Darzalex 1800 Mg Sc Enjeksiyonluk Çözelti Kısa Ürün BilgisiKISA URUN BILGISIBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBİ ÜRÜNÜN ADIDARZALEX 1800 mg SC Enjeksiyonluk Çözelti Steril, Sitotoksik 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her 15 ml'lik enjeksiyonluk çözelti flakonu 1800 mg daratumumab içerir (her ml'de 120 mg daratumumab). Daratumumab, rekombinant DNA teknolojisi kullanılarak memeli hücre dizisinde (Çin Hamsteri Överinden) elde edilen, CD38 antijenini hedef alan bir insan monoklonal IgG1Kantikorudur. Yardımcı maddeler:Her 15 ml'lik enjeksiyonluk çözelti flakonu 735,1 mg sorbitol (E420) içerir. Yardımcı maddelerin tam listesi için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti. Çözelti berrak ila opalesan ve renksiz ila sarı renklidir. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarMultipl Miyelom DARZALEX; Otolog kök hücre nakli için uygun olmayan yeni teşhis edilmiş multipl miyelomlu yetişkinhastaların tedavisinde lenalidomid ve deksametazon veya bortezomib, melfalan veprednizon ile kombine kullanımda, Otolog kök hücre nakli için uygun olan yeni teşhis edilmiş multipl miyelomlu yetişkinhastaların tedavisinde bortezomib, talidomid ve deksametazon ile kombine kullanımda, Daha önce bir proteazom inhibitörü ve lenalidomid içeren ve lenalidomide dirençgöstermiş veya daha önce lenalidomid ve bir proteazom inhibitörü içeren en az 2 seri tedavialmış ve sonrasında veya son tedavide hastalık progresyonu gelişen multipl miyelomluyetişkin hastaların tedavisinde pomalidomid ve deksametazon ile kombine kullanımda(bkz. bölüm 5.1), Daha önce en az 1 seri tedavi almış yanıt alınamayan veya nüks gelişmiş olan yetişkinmultipl miyelom hastalarında lenalidomid ve deksametazon veya bortezomib vedeksametazon ile kombine kullanımda, Monoterapi olarak, önceki tedavileri bir proteazom inhibitörü ve bir immünomodülatörajan içeren ve son tedavide hastalık progresyonu sergilemiş olan, relaps veya refraktermultiple miyelom hastalarının tedavisinde endikedir. AL Amiloidoz DARZALEX, yeni teşhis edilmiş sistemik hafif zincir (AL) amiloidozlu yetişkin hastalarıntedavisi için siklofosfamid, bortezomib ve deksametazon ile kombinasyon halindeendikedir. Kullanım SınırlamalarıDARZALEX, kontrollü klinik çalışmaların dışında kalan NYHA Sınıf TT TB4.2 Pozoloji ve uygulama şekliDARZALEX subkutan formülasyonu intravenöz kullanım için değildir ve belirtilen dozlar kullanılarak yalnızca subkutan enjeksiyon yoluyla verilmelidir. DARZALEX, bir sağlık çalışanı tarafından uygulanmalıdır. İlk doz resüsitasyon imkanının bulunduğu bir ortamda uygulanmalıdır. Hastaya, reçete edilen doğru formülasyon (intravenöz veya subkutan formülasyon) ve dozun verildiğinden emin olmak için flakon etiketlerini kontrol etmek önemlidir. Daratumumab intravenöz formülasyon almakta olan hastalar için, bir sonraki planlanmış dozda başlayacak şekilde intravenöz daratumumab formülasyonuna alternatif olarak DARZALEXsubkutan enjeksiyonluk çözelti kullanılabilir. Pozoloji/uygulama sıklığı ve süresi:Daratumumab kullanımında, infüzyonla ilgili reaksiyon (İİR) riskini azaltmak için, enjeksiyon öncesi ve sonrası ilaçlar uygulanmalıdır. Aşağıda Tavsiye edilen eşzamanlı ilaçlar ve Bölüm4.4'e bakınız. Doz:Multipl Miyelom Monoterapi için ve lenalidomid veya pomalidomid ile kombinasyon tedavisi için dozlama planı (4 haftalık kür rejimi)Tavsiye edilen DARZALEX subkutan enjeksiyonluk çözelti dozu 1800 mg olup, aşağıda Tablo 1'de verilen dozlama planına göre yaklaşık 3-5 dakika içinde uygulanır. Tablo 1: Monoterapi için ve lenalidomid ve deksametazon (Rd), pomalidomid vedeksametazon ile kombinasyon (Pd) tedavisi için DARZALEX dozlama planı (4
Deksametazon haftada 40 mg (veya >75 yaş hastalarda 20 mg/hafta azaltılmış doz) uygulanmalıdır. DARZALEX subkutan enjeksiyonluk çözelti ile birlikte uygulanan ilaçların dozu ve dozlama planı için Bölüm 5.1'e ve ilgili Kısa Ürün Bilgisine bakınız. Bortezomib, melfalan ve prednizon ile kombinasyon tedavisi için dozlama planı (6 haftalık kür reiimleri)Tavsiye edilen DARZALEX subkutan enjeksiyonluk çözelti dozu 1800 mg olup, aşağıda Tablo 2'de verilen dozlama planına göre yaklaşık 3-5 dakika içinde uygulanır.
Bortezomib, ilk 6 haftalık kür için haftada iki kez 1, 2, 4 ve 5. haftalarda, ardından 6 haftalık 8 kür boyunca haftada bir kez1, 2, 4 ve 5. haftalarda verilir. DARZALEX subkutanenjeksiyonluk çözelti ile uygulandığında VMP dozu ve doz çizelgesi hakkında bilgi için Bölüm5.1'e bakınız.Otolog kök hücre nakli (OKHT) için uygun olan yeni tanı alan hastaların tedavisi için bortezomib, talidomid ve deksametazon (4 haftalık kür reiimleri) ile kombinasyon halindedozlama ^ planıTavsiye edilen DARZALEX subkutan enjeksiyonluk çözelti dozu 1800 mg olup, aşağıda Tablo 3'te verilen dozlama planına göre yaklaşık 3-5 dakika içinde uygulanır.
a2 haftada bir olarak uygulanan dozlama planının ilk dozu 9. haftada verilir. b2 haftada bir olarak uygulanan dozlama planının ilk dozu OKHT'yi takiben tedavinin yenidenbaşlatılması üzerine 1. haftada verilir. Deksametazon, kür 1 ve 2'nin 1, 2, 8, 9, 15, 16, 22 ve 23. günlerinde 40 mg ve 1-2. günlerde 40 mg ve kür 3-4'ün sonraki dozlama günlerinde (8, 9, 15, 16. günler) 20 mg uygulanmalıdır.Deksametazon 20 mg, kür 5 ve 6'da 1, 2, 8, 9, 15, 16. günlerde uygulanmalıdır. DARZALEX subkutan enjeksiyonluk çözelti ile birlikte uygulanan ilaçların dozu ve dozlama planı için Bölüm 5.1'e ve ilgili Kısa Ürün Bilgisine bakınız. Bortezomib ile kombinasyon tedavisi için dozlama planı (3 haftalık kür rejimi)Tavsiye edilen DARZALEX subkutan enjeksiyonluk çözelti dozu 1800 mg olup, aşağıda Tablo
Deksametazon, ilk 8 bortezomib tedavi kürünün 1, 2, 4, 5, 8, 9, 11 ve 12. günlerinde 20 mg veya >75 yaş, düşük kilolu (BMI < 18.5), kötü kontrol edilen diabetes mellitus veya steroidtedavisine önceden toleranssızlıkta uygulanmalıdır. DARZALEX subkutan enjeksiyonluk çözelti ile birlikte uygulanan ilaçların dozu ve dozlama planı için Bölüm 5.1'e ve ilgili Kısa Ürün Bilgisine bakınız. AL Amiloidoz Bortezomib, siklofosfamid ve deksametazon ile kombinasyon tedavisi için dozlama planı (4 haftalık kür rejimleri)Tavsiye edilen DARZALEX subkutan enjeksiyonluk çözelti dozu 1800 mg olup, aşağıda Tablo 5'te verilen dozlama planına göre yaklaşık 3-5 dakika içinde uygulanır: Tablo 5: AL amiloidozda bortezomib, siklofosfamid ve deksametazon ilekombinasyon tedavisi için DARZALEX dozlama planı ([VCd]; 4 haftalık kür
DARZALEX subkutan enjeksiyonluk çözelti ile birlikte uygulanan ilaçların dozu ve dozlama planı için Bölüm 5.1'e ve ilgili Kısa Ürün Bilgisine bakınız. Unutulan doz Planlanmış bir DARZALEX dozunun unutulması halinde, doz mümkün olan en kısa zamanda uygulanmalı ve dozlama planı uygun şekilde ayarlanarak tedavi aralığı korunmalıdır. Doz modifikasyonları DARZALEX dozunun azaltılması önerilmez. Hematolojik toksisite durumunda, kan sayımlarının düzelmesine olanak vermek için dozun ertelenmesi gerekebilir (bkz. Bölüm 4.4).DARZALEX ile kombinasyon halinde verilen ilaçlar hakkında bilgi için ilgili Kısa ÜrünBilgisine bakınız. Klinik çalışmalarda, İİR'leri kontrol altına almak için DARZALEX subkutan enjeksiyonluk çözeltinin hızı ya da dozunun değiştirilmesi gerekli olmamıştır. Tavsiye edilen eşzamanlı ilaçlarEnjeksiyon öncesi ilaçlar İİR riskini azaltmak için tüm hastalara, her DARZALEX subkutan enjeksiyonluk çözelti uygulamasından 1 ila 3 saat önce enjeksiyon öncesi ilaçlar (oral ya da intravenöz) aşağıdakigibi uygulanmalıdır: Kortikosteroid (uzun etkili veya orta etkili) - Monoterapi: 100 mg metilprednizolon veya eşdeğeri. İkinci enjeksiyondan sonra, kortikosteroid dozu 60 mg metilprednizolon dozuna azaltılabilir. - Kombinasyon tedavisi: Her DARZALEX subkutan enjeksiyonluk çözeltiden önce 20 mg deksametazon (veya eşdeğeri) uygulanır. Deksametazon arka plan rejimine spesifik kortikosteroidolduğunda, bu deksametazon tedavi dozu DARZALEX uygulama günlerindekienjeksiyon öncesi uygulanan ilacın yerine geçecektir (bkz. Bölüm 5.1). Enjeksiyonöncesi ilaç olarak deksametazon (veya eşdeğeri) alan hastalar, DARZALEX uygulamagünlerinde ilave olarak arka plan rejimine spesifik kortikosteroidler (örn., prednizon)almamalıdır. Antipiretik (650 ila 1.000 mg oral parasetamol). Antihistaminik (25 ila 50 mg oral veya intravenöz yoldan uygulanan difenhidramin veyaeşdeğeri). Enjeksiyon sonrası ilaçlarGecikmiş infüzyonla ilgili reaksiyon riskini azaltmak için aşağıda belirtildiği şekilde enjeksiyon sonrası ilaçlar verilmelidir. - Monoterapi: Tüm enjeksiyonlardan sonraki ilk iki günde oral kortikosteroid (20 mg metilprednizolon veya yerel standartlara uygun eşdeğer dozda bir orta etkili veya uzun etkilikortikosteriod) uygulanmalıdır (enjeksiyondan sonraki gün başlanarak). - Kombinasyon tedavisi: DARZALEX enjeksiyonundan sonraki gün düşük dozda oral metilprednizolon (< 20 mg) veya eşdeğerinin verilmesi düşünülmelidir. Ancak, DARZALEX enjeksiyonundansonraki gün bir arka plan rejimine spesifik kortikosteroid (örn., deksametazon,prednizon) verilmişse, ilave olarak enjeksiyon sonrası ilaç verilmesine gerekolmayabilir (bkz. Bölüm 5.1). İlk üç enjeksiyondan sonra hastada majör İİR gelişmezse, enjeksiyon sonrası kortikosteroidlerin (arka plan rejimine spesifik kortikosteroidler haricinde) kullanımına son verilebilir. Ayrıca, kronik obstrüktif akciğer hastalığı öyküsü olan hastalar için kısa ve uzun etkili bronkodilatörler ve inhale kortikosteroidler gibi enjeksiyon sonrası ilaçların kullanımıdüşünülmelidir. İlk dört enjeksiyondan sonra hastada majör İİR gelişmezse, hekimin takdirinebağlı olarak bu inhalasyon yoluyla alınan enjeksiyon sonrası ilaçların kullanımına sonverilebilir. Herpes zoster virüs reaktivasyonu için profilaksiHerpes zoster virüs reaktivasyonunu önlemek için, anti-viral profilaksi düşünülmelidir. Özel popülasyonlara ilişkin ek bilgilerBöbrek yetmezliği:Böbrek yetmezliği olan hastalarda daratumumab ile ilgili çalışmalar yürütülmemiştir. Yapılan popülasyon farmakokinetiği (PK) analizlerine göre, böbrek yetmezliği bulunan hastalar için dozayarlaması gerekli değildir (bkz. Bölüm 5.2). Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda daratumumab ile ilgili çalışma yürütülmemiştir. Karaciğer yetmezliği olan hastalar için doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). Geriyatrik popülasyon:Doz ayarlamaları gerekli görülmemiştir (bkz. Bölüm 5.2). Pediyatrik popülasyon:DARZALEX tedavisinin 18 yaşından küçük çocuklarda güvenliliği ve etkililiği belirlenmemiştir. Bu konuda elde veri bulunmamaktadır (bkz. Bölüm 5.1). Vücut ağırlığı (>120 kg):Sabit dozlu (1800 mg) DARZALEX subkutan enjeksiyonluk çözelti kullanılarak, vücut ağırlığı >120 kg olan sınırlı sayıda hasta incelenmiş ve bu hastalarda etkililik belirlenmemiştir. Şu andavücut ağırlığına dayalı doz ayarlaması önerilememektedir (bkz. Bölüm 4.4 ve 5.2). Uygulama şekli:DARZALEX subkutan formülasyonu intravenöz kullanım için değildir ve belirtilen dozlar kullanılarak yalnızca subkutan enjeksiyon yoluyla verilmelidir. Uygulama öncesine yöneliközel tedbirler için Bölüm 6.6'ya bakınız. İğnenin tıkanmasını önlemek için, hipodermik enjeksiyon iğnesi veya subkutan infüzyon seti enjeksiyondan hemen önce enjektöre takılmalıdır. 15 mL DARZALEX subkutan enjeksiyonluk çözeltiyi göbek deliğinin yaklaşık 7,5 cm sağında veya solundakarnınsubkutan dokusunun içine yaklaşık 3-5 dakika süreyleenjekte edin.DARZALEX subkutan enjeksiyonluk çözeltiyi vücudun başka bölgelerineenjekte etmeyin çünkü bu konuda veri bulunmamaktadır.Enjeksiyon bölgeleri ardışık enjeksiyonlar için değiştirilmelidir. DARZALEX subkutan enjeksiyonluk çözelti cildin kızarık, morarmış, hassas, sert ya da skarlı bölgelerine kesinlikle enjekte edilmemelidir. Hasta acı duyarsa, uygulamayı duraklatın veya uygulama hızını yavaşlatın. Enjeksiyonun yavaşlatılmasıyla acının hafiflememesi durumunda, dozun geri kalanını uygulamak için karnındiğer tarafında ikinci bir enjeksiyon bölgesi seçilebilir. DARZALEX subkutan enjeksiyonluk çözelti tedavisi sırasında, subkutan kullanıma yönelik başka tıbbi ürünler DARZALEX ile aynı bölgeye uygulanmamalıdır. 4.3 KontrendikasyonlarEtkin maddeye veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşırı duyarlılık. 4.4 Özel kullanım uyarıları ve önlemleriİzlenebilirlikBiyolojik tıbbi ürünlerin takibini artırmak için, kullanılan ürünün marka ismi ve seri numarası hasta dosyasına açıkça işlenmelidir. İnfüzyona bağlı reaksiyonlarDARZALEX subkutan enjeksiyonluk çözelti, anafilaktik reaksiyonlar dahil olmak üzere şiddetli ve/veya ciddi infüzyonla ilgili reaksiyonlara (İİR) sebep olabilir. Klinik çalışmalardahastaların yaklaşık %9'unda (74/832) bir İİR meydana gelmiştir. İİR'lerin çoğunluğu derece 12 olup ilk enjeksiyondan sonra meydana gelmiştir. Daha sonraki enjeksiyonlarda meydanagelen İİR'ler hastaların %1'inde görülmüştür (bkz. Bölüm 4.8). DARZALEX enjeksiyonundan sonra İİR başlangıcına kadar geçen medyan süre 3,2 saattir (aralık: 0,15-83 saat). İİR'lerin çoğunluğu tedavi gününde meydana gelmiştir. Hastaların%1'inde gecikmiş İİR'ler meydana gelmiştir. İİR'nin bulgu ve belirtileri ateş, göğüs ağrısı, pruritus, üşüme, kusma, bulantı ve hipotansiyonun yanı sıra burun tıkanıklığı, öksürük, boğaz tahrişi, alerjik rinit ve hırıltılı solunum gibi solunumbelirtilerini içerebilir. Bronkospazm, hipoksi, dispne, hipertansiyon ve taşikardiyi içeren ciddireaksiyonlar oluşmuştur (bkz. Bölüm 4.8). Hastalara antihistaminik, antipiretik ve kortikosteroidler ile premedikasyon verilmeli ve hastalar özellikle birinci ve ikinci enjeksiyonlar sırasında ve sonrasında İİR'ler ile ilgili olarakizlenmeli ve bilgilendirilmelidir. Eğer bir anafilaktik reaksiyon ya da yaşamı tehdit eden (derece4) reaksiyon meydana gelirse, uygun acil bakım hemen başlatılmalıdır. DARZALEX tedavisiderhal ve kalıcı olarak kesilmelidir (bkz. Bölüm 4.2 ve 4.3). Gecikmiş İİR'lerin riskini düşürmek için, tüm hastalara DARZALEX enjeksiyonundan sonra oral kortikosteroid verilmelidir (bkz. Bölüm 4.2). Kronik obstrüktif akciğer hastalığı öyküsüolan hastalarda, ortaya çıkabilecek solunum komplikasyonlarını kontrol altına almak için ilaveenjeksiyon sonrası ilaçların kullanılması gerekli olabilir. Kronik obstrüktif akciğer hastalığıolan hastalarda enjeksiyon sonrası ilaçların (örn. kısa ve uzun etkili bronkodilatörler ve inhalekortikosteroidler) kullanılması düşünülmelidir (bkz. Bölüm 4.2). Nötropeni/trombositopeniDARZALEX, arka plan tedavisi ile indüklenen nötropeni ve trombositopeniyi artırabilir (bkz. Bölüm 4.8). Tedavi süresince, arka plan tedavilerinin üretici kısa ürün bilgilerine göre tam kan hücresi sayımları periyodik olarak izlenmelidir. Nötropeni hastaları enfeksiyon bulguları açısındanizlenmelidir. Kan hücre sayımlarının iyileşmesine izin vermek için, DARZALEX tedavisininertelenmesi gerekebilir. DARZALEX subkutan formülasyon alan düşük vücut ağırlığı olanhastalarda, yüksek nötropeni oranları gözlenmiş ancak yüksek ciddi enfeksiyon oranlarıylailişkilendirilmemiştir. DARZALEX'in doz azaltımı önerilmez. Transfüzyon veya büyümefaktörleri ile destekleyici bakım düşünülebilir. İndirekt Antigobulin Testi (İndirekt Coombs Testi) ile etkileşimDaratumumab, eritrositlerde düşük düzeylerde bulunan CD38'e bağlanır ve indirekt Coombs testinin pozitif çıkmasına neden olabilir. Daratumumaba bağlı indirekt Coombs testi pozitifliği,son daratumumab uygulamasından sonra 6 aya kadar devam edebilir. Eritrositlere bağlanandaratumumabın, hastanın serumundaki minör antijenlere karşı gelişen antikorların saptanmasınımaskeleyebileceği dikkate alınmalıdır. Hastanın ABO ve Rh kan grubu tayini bundanetkilenmez. Daratumumab tedavisine başlamadan önce hastalar taranmalı ve kan grupları belirlenmelidir. Fenotipleme, yerel uygulamaya göre, daratumumab tedavisine başlamadan önce düşünülebilir.Kırmızı kan hücresi genotiplendirmesi daratumumab'dan etkilenmez ve herhangi bir zamandayapılabilir. Bir transfüzyon planlanması durumunda, kan transfüzyonu merkezleri indirekt antiglobulin testleriyle olan bu etkileşimden haberdar edilmelidir (bkz. Bölüm 4.5). Acil bir transfüzyongerekli olduğunda, yerel kan bankası uygulamaları doğrultusunda çapraz eşleştirilmemiş,ABO/RhD uyumlu eritrositler verilebilir. Tam yanıtın belirlenmesi ile etkileşimDaratumumab, endojen M proteininin klinik izlemi için kullanılan serum protein elektroforezi (SPE) ve immünofiksasyon (IFE) analizlerinde tespit edilebilen bir insan IgG kappamonoklonal antikordur (bkz. Bölüm 4.5). Bu etkileşim, IgG kappa miyeloması proteini olanbazı hastalarda tam yanıtın ve hastalık ilerlemesinin belirlenmesini etkileyebilir. Hepatit B virüsü (HBV) reaktivasyonuDARZALEX ile tedavi edilen hastalarda bazı durumlarda ölümcül olan Hepatit B virüsü reaktivasyonu bildirilmiştir. DARZALEX ile tedaviye başlamadan önce tüm hastalarda HBVtaraması yapılmalıdır. Pozitif HBV serolojisi olan hastalar, DARZALEX tedavisi boyunca ve tedavi bitiminden sonraki en az altı ay boyunca HBV reaktivasyonunun klinik ve laboratuvar bulguları açısındanizlenmelidir. Hastalar mevcut klinik kılavuzlara göre yönetilmelidir. Klinik olarak belirtildiğigibi hepatit hastalığı uzmanına danışılabilir. DARZALEX ile tedavi sırasında HBV reaktivasyonu gelişen hastalarda, DARZALEX tedavisini kesin ve uygun tedaviyi uygulayın. HBV reaktivasyonu kontrol edilen hastalardaDARZALEX tedavisinin yeniden başlanması, HBV yönetiminde uzman doktorlar iletartışılmalıdır. Vücut ağırlığı (>120 kg)Vücut ağırlığı >120 kg olan hastalarda DARZALEX subkutan enjeksiyonluk çözeltinin etkililiğinin azalma potansiyeli bulunmaktadır (bkz. Bölüm 4.2 ve 5.2). Yardımcı maddelerBu ilaç sorbitol (E420) içerir. Kalıtımsal fruktoz intoleransı (HFI) olan hastalara bu ilac verilmemelidir. Ayrıca bu ilaç, her dozda 1 mmol'den (23 mg) daha az sodyum ihtiva eder, yani temelde sodyum içermez. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriEtkileşim çalışmaları yapılmamıştır. Bir IgGİK monoklonal antikoru olarak, bozulmamış daratumumabın renal atılımının ve karaciğer enziminin aracılık ettiği metabolizmasının temel eliminasyon yollarını temsil etmesimümkün değildir. Bu nedenle, ilaç metabolize edici enzimlerdeki değişikliklerin daratumumabeliminasyonunu etkilemesi beklenmemektedir. CD38 üzerindeki benzersiz bir epitopa yüksekafinite ve seçiciliği nedeniyle, daratumumabın, ilaç metabolize edici enzimleri değiştirmesi debeklenmemektedir. Daratumumab intravenöz veya subkutan formülasyonları ile lenalidomid, pomalidomid, talidomid, bortezomib, melfalan, prednizon, karfilzomib, siklofosfamid ve deksametazonkombinasyonları üzerinde gerçekleştirilen klinik farmakokinetik değerlendirmeler,daratumumab ile bu küçük moleküllü ilaçlar arasında klinik olarak anlamlı herhangi bir ilaç-ilaç etkileşimi göstermemiştir. İndirekt Antigobulin Testi (İndirekt Coombs Testi) ile etkileşimDaratumumab eritrositler üzerindeki CD38'e bağlanır ve antikor taraması ve çapraz eşleştirme gibi uyumluluk testlerini etkiler (bkz. Bölüm 4.4). Daratumumab etkileşimini azaltmayöntemleri, daratumumab bağlanmasını bozmak için reaktif eritrositlerin ditiyotretol (DTT) ileişleme tabi tutulmasını veya diğer lokal valide edilmiş metotları içermektedir. Kell kan grubusistemi DTT tedavisine de duyarlı olduğundan, DTT uygulanmış eritrositler kullanarakalloantikorların ekarte edilmesi veya tespit edilmesinin ardından Kell-negatif ünitelersağlanmalıdır. Alternatif olarak fenotipleme veya genotipleme de düşünülebilir (bkz. Bölüm4.4). Serum protein elektroforezi ve immünofiksasyon testleri ile etkileşimDaratumumab, hastalığa ait monoklonal immünoglobulinlerin (M proteini) görüntülenmesinde kullanılan serum protein elektroforezi (SPE) ve immünofiksasyon (IFE) analizlerindesaptanabilir. Bu da, IgG kappa miyelom proteini bulunan hastaların SPE ve IFE testsonuçlarının yanlış pozitif çıkmasına yol açarak, Uluslararası Miyelom Çalışma Grubu(IMWG) kriterlerine göre değerlendirilen tam yanıtlara ilişkin ilk değerlendirmeyi etkileyebilir.Daratumumab etkileşiminin şüphelenildiği kalıcı çok iyi kısmi yanıt sergileyen hastalarda tambir cevabın belirlenmesini kolaylaştırmak için, daratumumabı hastanın serumunda kalanendojen M proteininden ayırabilmek için valide bir daratumumab-spesifik IFE analizininkullanılması düşünülmelidir. Özel popülasyonlara ilişkin ek bilgilerHerhangi bir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Herhangi bir etkileşim çalışması yapılmamıştır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeline sahip kadınlar, daratumumab tedavisi sırasında ve tedavi sona erdikten sonra 3 ay süreyle etkili bir doğum kontrol yöntemi kullanmalıdır. Hayvanlar üzerinde yapılan çalışmalar, gebelik / ve-veya / embriyonal / fetal gelişim / ve-veya / doğum / ve-veya / doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz.Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. DARZALEX gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Gebelik dönemiDaratumumab'ın hamile kadınlarda kullanımına ilişkin veri mevcut değildir veya sınırlı miktardadır. Hayvanlar üzerinde yapılan çalışmalar üreme toksisitesi açısından yetersizdir (bkz.Bölüm 5.3). DARZALEX hamilelik sırasında ve doğum kontrolü kullanmayan çocuk doğurmapotansiyeli olan kadınlarda önerilmez. Laktasyon dönemiDaratumumabın insan sütüyle atılıp atılmadığı bilinmemektedir. Daratumumabın sütle atılımı hayvanlar üzerinde çalışılmamıştır. Emzirmenin durdurulup durdurulmayacağına ya daDARZALEX tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıpkaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası veDARZALEX tedavisinin emziren anne açısından faydası dikkate alınmalıdır. Üreme yeteneği/FertiliteDaratumumabın erkekler veya kadınlarda fertilite üzerindeki potansiyel etkilerini belirleyecek veri bulunmamaktadır (bkz. bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkilerDARZALEX, araç ve makine kullanımı üzerinde etkili değildir veya göz ardı edilebilir ölçüde etkilidir. Ancak, daratumumab kullanan hastalarda yorgunluk bildirilmiştir ve araç veya makinekullanırken bu durumun dikkate alınması gerekmektedir. 4.8 İstenmeyen etkilerGüvenlilik profili özetiMonoterapi veya kombinasyon tedavisi olarak uygulandığında daratumumab (intravenöz ya da subkutan formülasyon) ile en sık görülen herhangi bir dereceden advers reaksiyonlar (hastaların>%20'si) infüzyon reaksiyonları, yorgunluk, bulantı, diyare, konstipasyon, ateş, öksürük,nötropeni, trombositopeni, anemi, periferik ödem, periferik duyusal nöropati ve üst solunumyolu enfeksiyonu olmuştur. Ciddi advers reaksiyonlar pnömoni, bronşit, üst solunum yoluenfeksiyonu, sepsis, pulmoner ödem, influenza, ateş, dehidrasyon, diyare, atriyal fibrilasyon vesenkop olarak belirlenmiştir. DARZALEX subkutan formülasyonun güvenlilik profili, daha düşük İİR oranı hariç olmak üzere intravenöz formülasyonun güvenlilik profiline benzerlik göstermiştir. Faz 3 MMY3012çalışmasında, nötropeni, intravenöz daratumumaba kıyasla DARZALEX subkutanformülasyonu için > %5 daha yüksek sıklıkta bildirilen tek advers reaksiyon olmuştur (derece3 veya 4: %13 karşısında %8). Advers reaksiyonların tablo halinde listesi
intravenöz
Tablo 6 daratumumabın DARZALEX subkutan formülasyonu veya formülasyonunu alan hastalarda görülen advers reaksiyonları özetlemektedir. Veriler; 639 multipl miyelomlu (MM) hastada DARZALEX subkutan enjeksiyonluk çözeltiye (1800 mg) maruziyeti yansıtmaktadır. Veriler; monoterapi olarak DARZALEX subkutanenjeksiyonluk çözelti verilen faz 3 aktif kontrollü çalışmadan (MMY3012 çalışması) 260hastayı ve pomalidomid ve deksametazon ile kombine kullanımda DARZALEX subkutanenjeksiyonluk çözelti (D-Pd) verilen faz 3 aktif kontrollü çalışmadan (MMY3013) 149 hastayıiçermektedir. Ayrıca veriler, hastalara DARZALEX subkutan enjeksiyonluk çözeltininmonoterapi olarak (N=31, MMY1004 ve MMY1008) verildiği üç açık etiketli klinik çalışmayıve DARZALEX subkutan enjeksiyonluk çözeltinin bortezomib, melfalan ve prednizon (D- VMP, n=67), lenalidomid ve deksametazon (D-Rd, n=65) ya da bortezomib, lenalidomid ve deksametazon (D-VRd, n=67) ile kombine olarak verildiği MMY2040 çalışmasınıyansıtmaktadır. Ayrıca veriler, DARZALEX subkutan formülasyonun bortezomib,siklofosfamid ve deksametazon (D-VCd) ile kombine olarak uygulandığı faz 3 aktif kontrollüçalışmada (AMY3001) yer alan 193 yeni tanı AL amiloidoz hastasındaki maruziyetiyansıtmaktadır. Güvenlilik verileri, arka plan rejimleriyle kombine olarak intravenöz daratumumab uygulanan 1910 hasta ve monoterapi olarak intravenöz daratumumab uygulanan 414 hastayı kapsayan2324 hastada intravenöz daratumumab (16 mg/kg) maruziyetini de yansıtmaktadır. Pazarlamasonrası advers reaksiyonlar da dahil edilmiştir. Sıklıklar; çok yaygın (> 1/10), yaygın (> 1/100 ila < 1/10); yaygın olmayan (> 1/1.000 ila < 1/100); seyrek (> 1/10.000 ila < 1/1.000) ve çok seyrek (< 1/10.000) şeklinde tanımlanmıştır.Advers reaksiyonlar, her sıklık grubunda azalan ciddiyet sırasında sunulmaktadır.
#Derece 4 yok aTerim gruplandırmasını belirtir.bPazarlama sonrası advers reaksiyonlara göre. cİnfüzyonla ilişkili reaksiyonlar, araştırmacı tarafından daratumumab infüzyonu/enjeksiyonu ile ilişkili olduğu belirlenen terimleri içerir. ^Enjeksiyon bölgesi reaksiyonları, araştırmacı tarafından daratumumab enjeksiyonu ile ilişkili olduğu belirlenen terimleri içerir. Not: Daratumumab intravenöz veya daratumumab subkutan formülasyon ile tedavi edilen 3156 multipl miyelomlu ve AL amiloidoz hasta temel alınmıştır. Seçili advers reaksiyonların tanımıİnfüzyonla ilişkili reaksiyonlar (lİR 'ler)Klinik çalışmalarda (monoterapi ve kombinasyon tedavileri; N =832), DARZALEX subkutan formülasyonu ile herhangi bir dereceden İİR'lerin insidansı ilk DARZALEX enjeksiyonu (1800 mg, 1. hafta) ile %8,2, 2. hafta enjeksiyonu ile %0,4 ve sonraki enjeksiyonlar ile %1,1 olmuştur.Derece 3 İİR'ler, hastaların %0,8'inde görülmüştür. Hiçbir hastada derece 4 İİR oluşmamıştır. İİR'nin bulgu ve belirtileri ateş, göğüs ağrısı, kaşıntı, üşüme, kusma, bulantı ve hipotansiyonun yanı sıra burun tıkanıklığı, öksürük, boğaz tahrişi, alerjik rinit ve hırıltılı solunum gibi solunumbelirtilerini içerebilir. Bronkospazm, hipoksi, dispne, hipertansiyon ve taşikardiyi içeren ciddireaksiyonlar oluşmuştur (bkz. Bölüm 4.4). Enjeksiyon bölgesi reaksiyonlarıDARZALEX subkutan formülasyon ile yapılan klinik çalışmalarda (N=832), herhangi bir derece enjeksiyon bölgesi reaksiyonu insidansı %7,7 olmuştur. Derece 3 ya da 4 enjeksiyonbölgesi reaksiyonları görülmemiştir. En yaygın (>%1) enjeksiyon bölgesi reaksiyonu eritemolmuştur. Enfeksiyonlar Monoterapi olarak daratumumab uygulanan hastalarda, genel enfeksiyon insidansı DARZALEX subkutan formülasyon (%52,9) ile intravenöz daratumumab grupları (%50,0)arasında benzerlik göstermiştir. Derece 3 veya 4 enfeksiyonlar da DARZALEX subkutanformülasyon (%11,7) ile intravenöz daratumumab (%14,3) arasında benzer sıklıklarda meydanagelmiştir. Çoğu enfeksiyon kontrol altına alınabilmiş ve nadiren tedavinin sonlandırılmasınayol açmıştır. Çalışmalarda en yaygın olarak bildirilen derece 3 veya 4 enfeksiyon pnömoniolmuştur. Çalışmalarda en yaygın olarak bildirilen derece 3 veya 4 enfeksiyon pnömoniolmuştur. Aktif kontrollü çalışmalarda, hastaların %1 ila %4'ünün tedavisi enfeksiyonnedeniyle sonlandırılmıştır. Fatal enfeksiyonların primer nedeni pnömoni ve sepsisdir. İntravenöz daratumumab kombinasyon tedavisi uygulanan hastalarda, aşağıdaki enfeksiyonlar bildirilmiştir: Derece 3 veya 4 enfeksiyonlar: Derece 5 (fatal) enfeksiyonlar: Relaps/refrakter hasta çalışmalarında: DVd: %1; Vd: %2; DRd: %2; Rd: %1; DPd: %2 Yeni tanılı hasta çalışmalarında: D-VMP: %1, VMP: %1; DRd: %2, Rd: %2; DVTd: %0, VTd: %0. DARZALEX subkutan formülasyon ile kombinasyon tedavisi alan multipl miyelom hastalarda aşağıdakiler bildirilmiştir: Derece 3 veya 4 enfeksiyonlar: DPd: %28, Pd: %23 Derece 5 (fatal) enfeksiyonlar: DPd: %5, Pd: %3 Açıklama: D=daratumumab; Vd=bortezomib-deksametazon; Rd=lenalidomid-deksametazon; Pd=pomalidomid-deksametazon, VMP=bortezomib-melfalan-prednizon; VTd=bortezomib-talidomid-deksametazon. DARZALEX subkutan formülasyon kombinasyon tedavisi uygulanan AL amiloidoz hastalarında, enfeksiyon insidansı aşağıdaki gibi olmuştur: Derece 3 veya 4: D-VCd: %17, VCd: %10 Derece 5: D-VCd: %1, VCd: %1 Açıklama: D=daratumumab; VCd=bortezomib-siklofosfamid-deksametazon HemolizTeorik olarak hemoliz riski bulunmaktadır. Klinik çalışmalarda ve pazarlama sonrası güvenlilik verilerinde bu güvenlilik bulgusu sürekli olarak takip edilecektir. Kardiyak hastalıklar ve AL amiloidoz ilişkili kardiyomiyopatiAMY3001 çalışmasındaki hastaların çoğunluğunda başlangıçta AL amiloidoz ilişkili kardiyomiyopati mevcuttu (D-VCd %72'ye karşı VCd %71). Derece 3 veya 4 kardiyakhastalıklar, VCd alan hastaların %10'una kıyasla D-VCd alan hastaların %11'inde; ciddikardiyak hastalıklar ise D-VCd alan hastaların %16'sında ve VCd alan hastaların %13'ündemeydana gelmiştir. Hastaların >%2'sinde meydana gelen ciddi kalp hastalıkları kalp yetmezliği(D-VCd %6,2'ye karşı VCd %4,3), kardiyak arrest (D-VCd 3.6% vs. VCd 1.6%) ve atriyalfibrilasyonu (D-VCd %2,1'e karşı VCd %1,1) içermiştir. Ciddi ya da ölümcül kardiyak hastalıkdeneyimleyen tüm D-VCd kolu hastalarında başlangıçta AL amiloidoz ilişkili kardiyomiyopatimevcuttu. D-VCd kolunun VCd koluna kıyasla daha uzun medyan tedavi süresi (9,6 aya karşı5,3 ay), iki tedavi grubu arasında kardiyak hastalıkların sıklığı karşılaştırılırken dikkatealınmalıdır. Genel derece 3 veya 4 kardiyak hastalıklar (1,2 ve 2,3), kalp yetmezliği (0,5 ve0,6), kardiyak arrest (0,1 ve 0,0) ve atriyal fibrilasyonun (0,2 ve 0,1) maruziyete göredüzeltilmiş insidans oranları (risk altındaki 100 hasta ayı başına olay yaşayan hastaların sayısı),D-VCd kolu ile VCd arasında benzer olmuştur. Medyan 11,4 aylık takip süresiyle, AMY3001 çalışmasındaki genel ölüm olayları (D-VCd %14'e karşı VCd %15) her iki tedavi kolunda da primer olarak AL amiloidoz ilişkilikardiyomiyopati kaynaklı olmuştur. Diğer özel popülasyonlarOtolog kök hücre nakline uygun olmayan yeni tanı konmuş multipl miyelom hastalarında D-VMP tedavisinin VMP tedavisiyle karşılaştırıldığı faz 3 MMY3007 çalışmasında, ECOG performansskoru 2 olan alt grup hastaların güvenlilik analizi (D-VMP: n=89, VMP: n=84), genel popülasyonile tutarlıydı (bkz. bölüm 5.1). Yaşlı hastalar Önerilen dozda daratumumab (n=832 subkutan; n=2717 intravenöz) alan 3549 hastanın %38'i 65 yaş ila 75 yaş altı grupta ve %16'sı 75 yaş ve üzeri yaş grubunda idi. Yaşa göre etkililikaçısından genel farklılıklar gözlenmemiştir. Ciddi advers reaksiyonların insidansı, yaşlıhastalarda daha genç hastalara kıyasla daha yüksek olmuştur. Relaps ve refrakter multiplmiyelom hastaları (n=1976) arasında, yaşlılarda (>65 yaş) daha sık meydana gelen en yaygınciddi advers reaksiyonlar pnömoni ve sepsistir. Otolog kök hücre nakli için uygun olmayan yenitanı multipl miyelom hastaları (n=777) arasında, yaşlılarda (>75 yaş) daha sık meydana gelenen yaygın ciddi advers reaksiyon pnömonidir. Yeni tanı AL amiloidoz hastaları (n=193)arasında, yaşlılarda (>65 yaş) daha sık meydana gelen en yaygın ciddi advers reaksiyonpnömonidir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9 Doz aşımıSemptomlar ve bulgularKlinik çalışmalarda doz aşımı deneyimi yaşanmamıştır. TedaviDaratumumab doz aşımı için bilinen spesifik bir antidot mevcut değildir. Doz aşımı durumunda, hasta advers olayların bulgu ve belirtileri bakımından izlenmeli ve uygun semptomatik tedaviyehemen başlanmalıdır. 5.FARMAKOLOJIK ÖZELLIKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Monoklonal antikorlar ve antikor ilaç konjugatları ATC kodu: L01FC01 DARZALEX subkutan enjeksiyonluk çözelti, rekombinant insan hiyalüronidaz (rHuPH20) içermektedir. rHuPH20, etkisini geçici ve lokal olarak göstererek, subkutan alanın hücre dışımatriksinde doğal olarak oluşan bir glikoaminoglikan olan hiyalüronanı (HA), HA'yı oluşturaniki şeker (N-asetilglukozamin ve glukuronik asit) arasındaki bağı kesmek suretiyle parçalar.rHuPH20'nin derideki yarılanma ömrü 30 dakikadan azdır. Deri altı dokusundaki hiyalüronandüzeyleri, hiyalüronanın hızlı biyosentezi sebebiyle 24 ila 48 saat içinde normale döner. Etki mekanizmasıDaratumumab, multipl miyelom ve AL amiloidozdaki klonal plazma hücreleri dahil çeşitli hematolojik malignitelerde hücrelerin yüzeyinde ve ayrıca diğer hücre tipleri ve dokularınyüzeylerinde eksprese edilen CD38 proteinine bağlanan bir IgGİK insan monoklonalantikorudur (mAb). CD38 proteini, reseptör aracılı adezyon, sinyal iletimi ve enzim aktivitesigibi birden çok fonksiyona sahiptir. Daratumumabın, CD38 eksprese eden tümör hücrelerinin in vivoIn vitroçalışmalara göre, daratumumab birden fazla etki fonksiyonusayesinde, bağışıklık aracılı tümör hücrelerinin ölümüne neden olabilmektedir. Bu çalışmalar,daratumumabın CD38 eksprese eden malignitelerde komplemana bağlı sitotoksisite, antikorabağlı hücre aracılı sitotoksisite ve antikora bağlı hücresel fagositoz aracılığıyla tümör hücrelizisini başlatabileceğini ortaya koymaktadır. Daratumumabın aracılık ettiği hücre lizisi;miyeloid kökenli baskılayıcı hücrelerden oluşan bir alt kümeyi (CD38+MDSCs), düzenleyiciT hücrelerini (CD38+Tregs) ve B hücrelerini (CD38+Bregs) azaltmaktadır. T hücrelerinin(CD3+, CD4+ ve CD8+) de, gelişim aşaması ve aktivasyon düzeyine bağlı olarak CD38eksprese ettiği bilinmektedir. Daratumumab tedavisi ile periferik tam kan ve kemik iliğindeCD4+ ve CD8+ T hücre mutlak sayımlarında ve lenfosit yüzdelerinde anlamlı artışlargözlenmiştir. Ayrıca, T hücre reseptörü DNA sekanslamasında T hücre klonalitesinindaratumumab tedavisi ile arttığı doğrulanmış ve bağışıklık düzenleyici etkilerin klinik yanıtakatkı sağlayabileceği gösterilmiştir.Daratumumab, in vitroin vitroetkilerin klinik koşullarda anlamlılığı vetümör gelişimi üzerindeki yansımaları tam olarak anlaşılmamıştır.Farmakodinamik etkileriDoğal Öldürücü (Natural Killer - NK) hücre ve T hücre sayımı NK hücrelerinin yüksek düzeylerde CD38 eksprese ettiği bilinmektedir ve bu hücreler daratumumab aracılı hücre lizisine duyarlıdır. Daratumumab tedavisi ile periferik tam kan vekemik iliğinde toplam NK hücreler (CD16+CD56+) ve aktive (CD16+CD56d'm) NK hücrelerinmutlak sayımları ve yüzdelerinde azalma gözlenmiştir. Bununla birlikte, NK hücrelerinbaşlangıç düzeyleri klinik yanıt ile bir ilişki sergilememiştir. İmmünojenisiteKlinik çalışmalarda subkutan daratumumab monoterapisi ve kombinasyon tedavisi ile tedavi edilen multipl miyelom ve AL amiloidoz hastalarında, hastaların %1'inden azı tedaviyle ortayaçıkan anti-daratumumab antikorları geliştirmiştir. DARZALEX subkutan formülasyon monoterapisi ya da kombinasyon tedavisi alan multipl miyelom ve AL amiloidoz hastalarında tedaviyle ortaya çıkan non-nötralizan anti-rHuPH20antikorların insidansı %7,3 olmuştur (55/750). Anti-rHuPH20 antikorların daratumumabmaruziyetlerini etkilediği görülmemiştir. DARZALEX subkutan formülasyon tedavisindensonra anti-daratumumab veya anti-rHuPH20 antikor gelişiminin klinik ilgisi bilinmemektedir. DARZALEX subkutan enjeksiyonluk çözelti (subkutan formülasyon) ile klinik deneyimlerMonoterapi - relaps/refrakter multipl miyelomAçık etiketli, randomize, faz 3 eşit etkililik çalışması olan MMY3012 çalışmasında, bir proteazom inhibitörü ve bir immünomodülatör ajan da dahil daha önce en az üç basamak tedavialmış olan ya da bir proteazom inhibitörüne (PI) ve bir immünomodülatör ajana (IMiD) çiftrefrakter olan relaps veya refrakter multipl miyelomlu hastalarda DARZALEX subkutanenjeksiyonluk çözelti (1800 mg) ile intravenöz (16 mg/kg) daratumumab tedavilerinin etkililikve güvenliliği karşılaştırılmıştır. Tedavi kabul edilemez toksisite veya hastalık progresyonugörülünceye kadar devam etmiştir. Toplam 522 hasta randomize edilmiştir: 263'ü DARZALEX subkutan formülasyon koluna, 259'u ise intravenöz daratumumab koluna. Başlangıçtaki demografik ve hastalık özellikleri ikitedavi grubu arasında benzerdi. Medyan hasta yaşı 67'ydi (aralık: 33-92), hastaların %55'ierkek ve %78'si beyaz ırktandı. Medyan hasta kilosu 73'tü (aralık: 29 - 138 kg). Hastalara,daha önce medyan 4 basamak tedavi uygulanmıştı. Hastaların toplam %51'ine daha önce otologkök hücre nakli (OKHN) uygulanmış; hastaların %100'ü daha önce Pl(ler) ve IMiD(ler) iletedavi edilmiş ve hastaların çoğu PI ve IMiD içeren önceki sistemik tedaviye refrakterdi (%49). Çalışma, IMWG yanıt kriterlerine (tablo 7) göre genel yanıt oranı (ORR) ve 3. kür 1. günde doz öncesi maksimum Cdip değeri olan ortak birincil sonlanım noktalarını karşılamıştır (bkz.Bölüm 5.2).
bEşit etkililik hipotezi için Farrington-Manning testi ile hesaplanan p değeri <0,0001. cGüvenlilik popülasyonuna dayanır. Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanan pdeğeri <0,0001. Ortalama 29,3 aylık takipten sonra, medyan OS, DARZALEX subkutan formülasyon kolunda 28,2 ay (%95 GA: 22.8, NE) ve intravenöz daratumumab kolunda 25,6 aydı (%95 GA: 22.1,NE). Düşük vücut ağırlığı olan hastaları da kapsayan güvenlilik ve tolerabilite sonuçları, DARZALEX subkutan formülasyon ve intravenöz daratumumab için bilinen güvenlilik profiliile tutarlılık göstermiştir. Hastanın tedaviden memnuniyetini değerlendiren bir hasta tarafından bildirilen sonuç anketi olan değiştirilmiş CTSQ'nun sonuçları, DARZALEX subkutan formülasyon uygulananhastaların intravenöz daratumumab alan hastalara kıyasla tedavilerinden daha memnunolduğunu göstermiştir. Ancak, açık etiketli çalışmalar yanlılığa açıktır. Multipl miyelomda kombinasyon tedavileriMMY2040, DARZALEX 1800 mg subkutan formülasyonun etkililiğini ve güvenliliğini aşağıdaki kullanımlarda değerlendiren açık etiketli bir çalışmadır: - Yeni multipl miyelom (MM) tanısı konmuş olan ve nakil için uygun olmayan hastalardabortezomib, melfalan ve prednizon (D-VMP) ile kombine kullanımda. Bortezomib, ilk 6haftalık kür için haftada iki kez 1, 2, 4 ve 5. haftalarda (1. kür; 8 doz) ve sonrasında sekizadet daha 6 haftalık kür için haftada bir kez 1, 2, 4 ve 5. haftalarda (2-9. kürler; 4 doz/kür)1,3 mg/m2 vücut yüzey alanı dozunda subkutan enjeksiyon yoluyla uygulanmıştır. Melfalan9 mg/m2 ve prednizon 60 mg/m2, 9 adet 6 haftalık kürün (1-9. kürler) 1-4. günlerinde oralyoldan uygulanmıştır. DARZALEX subkutan formülasyonu ile tedaviye, hastalıkprogresyonu veya kabul edilemez toksisite görülünceye kadar devam edilmiştir. - Relaps ve refrakter MM hastalarında lenalidomid ve deksametazon (D-Rd) ile kombinekullanımda. Lenalidomid (tekrarlanan 28 günlük [4 hafta] kürlerin 1-21. günlerinde gündebir kez oral yoldan 25 mg), haftada 40 mg düşük doz deksametazon (veya >75 yaş hastalarya da BKİ <18,5 olan hastalar için haftada 20 mg'a azaltılmış doz) ile birlikte verilmiştir.DARZALEX subkutan formülasyonu ile tedaviye, hastalık progresyonu veya kabuledilemez toksisite görülünceye kadar devam edilmiştir. - Yeni MM tanısı konmuş ve nakil için uygun olan hastalarda bortezomib, lenalidomid vedeksametazon (D-VRd) ile kombine kullanımda. Bortezomib, haftada iki kez 1 ve 2.haftalarda 1,3 mg/m2 vücut yüzey alanı dozunda subkutan enjeksiyon yoluyla uygulanmıştır.Lenalidomid, 1-14. günlerde 25 mg dozda oral yoldan uygulanmıştır; düşük dozdeksametazon 3 haftalık kürlerde haftada 40 mg dozda uygulanmıştır. Toplam tedavi süresi4 kürdür. Toplam 199 hasta (D-VMP: 67; D-Rd: 65; D-VRd: 67) çalışmaya kaydedilmiştir. Etkililik sonuçları IMWG kriterleri kullanılarak bilgisayar algoritması ile belirlenmiştir. Çalışma, D-VMP ve D-Rd için ORR birincil sonlanım noktasını ve D-VRd için VGPR veya daha iyi yanıtbirincil sonlanım noktasını karşılamıştır (bkz. tablo 8).
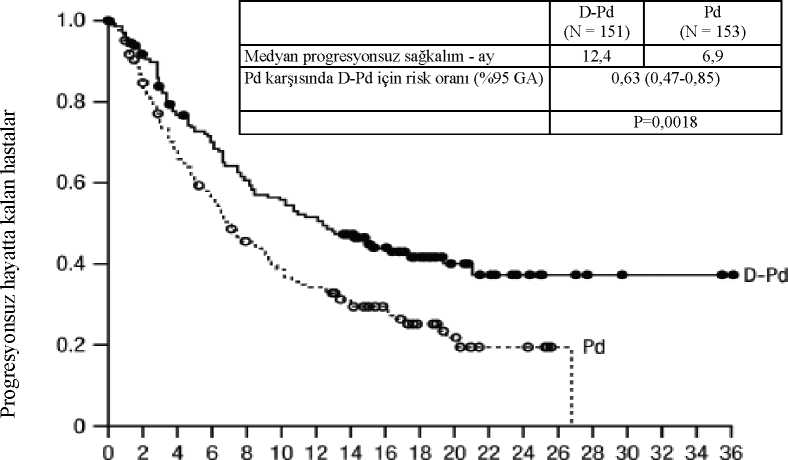
Pomalidomid ve deksametazon (Pd) ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü bir faz 3 çalışma olan MMY3013 çalışmasında, daha önce lenalidomid ve bir proteaz inhibitörü (PI) ile en az bir basamak tedavi alan multiplmiyelomlu hastalarda, pomalidomid ve düşük dozda deksametazon ile kombine edilenDARZALEX subkutan formülasyon ile tedavi (D-Pd), pomalidomid ve düşük dozdadeksametazon tedavisi (Pd) ile karşılaştırılmıştır. Pomalidomid (tekrarlanan 28 günlük [4 hafta]kürlerin 1-21. günlerinde günde bir kez oral yoldan 4 mg), haftada 40 mg düşük doz oral veyaintravenöz deksametazon (veya >75 yaş hastalar ya da BKİ <18,5 olan hastalar için haftada 20mg'a azaltılmış doz) ile birlikte verildi. DARZALEX subkutan formülasyonun uygulandığıgünlerde, deksametazon dozunun 20 mg'ı uygulama öncesi ilaç olarak, geri kalan kısmı iseuygulamadan sonraki gün verildi. Azaltılmış deksametazon dozu alan hastalar için, 20 mgdozun tamamı DARZALEX subkutan formülasyon uygulama öncesi ilacı olarak verildi.Pomalidomid ve deksametazon için doz ayarları üreticinin reçeteleme bilgilerine uygun olarakgerçekleştirildi. Tedavi her iki kolda hastalık progresyonu veya kabul edilemez toksisitegörülünceye kadar devam etti. Toplam 304 hasta randomize edildi: 151'i D-Pd koluna, 153'ü ise Pd koluna. Son rejimde veya sonrasında belgelenmiş hastalık progresyonu kanıtı olan hastalar çalışmaya dahil edilmiştir.Önceki tedavi sırasında > derece 3 döküntüsü olan hastalar, pomalidomid Kısa Ürün Bilgisinegöre hariç tutulmuştur. Başlangıçtaki demografik ve hastalık özellikleri iki tedavi grubuarasında benzerdi. Medyan hasta yaşı 67 olup (aralık 35 ila 90); hastaların %18'i > 75 yaşında,%53'ü erkek ve %89'u beyaz ırktan hastalardan oluşmuştur. Hastalara daha önce medyan 2basamak tedavi verilmişti. Tüm hastalar daha önce bir proteazom inhibitörü (PI) ve lenalidomidile tedavi almış ve hastaların %56'sına kök hücre nakli (OKHN) uygulanmıştır. Hastalarınyüzde doksan altısına (%96) daha önce bortezomib tedavisi uygulanmıştır. Hastalarınçoğunluğu lenalidomid (%80), bir PI (%48) veya hem immünomodülator hem PI'ne (%42)refrakterdi. Hastaların yüzde onbiri önceden 1 basamak tedavi almıştır; hepsi lenalidomide ve%32,4'ü hem lenalidomide hem de bir PI'ye dirençliydi. Etkililik, Uluslararası MiyelomÇalışma Grubu (IMWG) kriterlerine dayanarak progresyonsuz sağkalıma (PFS) göredeğerlendirildi. Medyan 16,9 aylık takip süresiyle, MMY3013 çalışmasının birincil PFS analizi, Pd koluna kıyasla D-Pd kolunda istatistiksel olarak anlamlı bir düzelme göstermiştir; medyan PFS D-Pd kolunda 12,4 ay iken, Pd kolunda medyan PFS 6,9 ay olmuştur (HR [% 95 GA]: 0,63 [0,47,0,85]; p-değeri = 0,0018), bu da Pd'ye kıyasla D-Pd ile tedavi edilen hastalarda hastalıkprogresyonu veya ölüm riskinde %37 oranında bir azalmayı yansıtmıştır. Grupların hiçbirindemedyan OS'ye ulaşılmadı.
Şekil 1:Risk taşıyan hasta Pd 153121 03 79 ei 523e27 17 12 55100000D-Pd 151 135111 100 B7 ÖD06 3Q 30 12a532221
Yanıt veren hastalarda yanıta kadar geçen medyan süre, D-Pd grubunda 1 ay (aralık: 0,9 ila 9,1 ay) ve Pd grubunda 1,9 ay (aralık: 0,9 ila 17,3 ay) olmuştur. Medyan yanıt süresine D-Pdgrubunda ulaşılmazken (aralık: 1 ila 34,9+ ay), Pd grubunda medyan yanıt süresi 15,9 ay(aralık: 1+ ila 24,8 ay) olmuştur. AL amiloidozlu hastalarda bortezomib, siklofosfamid ve deksametazon ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü faz 3 çalışma olan AMY3001 Çalışmasında, yeni tanı AL amiloidozu olan hastalarda bortezomib, siklofosfamid ve deksametazon ile kombine edilenDARZALEX 1800 mg subkutan formülasyonu (D-VCd), tek başına bortezomib, siklofosfamidve deksametazon (VCd) tedavisi ile karşılaştırılmıştır. Randomizasyon, AL amiloidoz KardiyakEvreleme Sistemi, AL amiloidoz hastaları için tipik olarak otolog kök hücre nakli (OKHN)öneren ülkeler ve böbrek fonksiyonuna göre tabakalandırılmıştır. Çalışma AMY3001'e kayıtlı tüm hastalarda, en az bir etkilenmiş organ, ölçülebilir hematolojik hastalık, kardiyak evre I-IIIA (Mayo 2004 kardiyak evresinin Avrupa Modifikasyonuna göre)ve NYHA sınıf I-IIIA ile yeni teşhis edilmiş AL amiloidozu vardı. NYHA sınıf II IBve IV olanhastalar çalışma dışı bırakılmıştır.Bortezomib (SC; 1,3 mg/m2 vücut yüzey alanı), siklofosfamid (oral veya IV; 300 mg/m2 vücut yüzey alanı; maksimum doz 500 mg) ve deksametazon (oral veya IV; 40 mg ya da >70 yaşındaolan veya vücut kitle indeksi [BMI] <18,5 olan veya hipervolemisi, yetersiz kontrollü diyabetiya da steroid tedavisine intolerans geçmişi olan hastalar için azaltılmış 20 mg doz) tekrarlanan28 günlük [4 hafta] kürlerin 1, 8, 15 ve 22. günlerinde haftalık olarak uygulanmıştır.DARZALEX dozlama günlerinde, deksametazon dozunun 20 mg'ı enjeksiyon öncesi ilaçolarak, geri kalan kısmı ise DARZALEX uygulamasından sonraki gün verilmiştir. Bortezomib,siklofosfamid ve deksametazon her iki tedavi kolunda altı adet 28 günlük [4 hafta] kürdeuygulanırken; DARZALEX tedavisine hastalık progresyonuna veya müteakip tedavibaşlangıcına kadar ya da ilk çalışma tedavisi dozundan itibaren maksimum 24 kür (~2 yıl)verilmiştir. Bortezomib, siklofosfamid ve deksametazon için doz ayarları üreticinin reçetelemebilgilerine uygun olarak gerçekleştirilmiştir. Toplam 388 hasta randomize edilmiştir: 195'i D-VCd koluna, 193'ü ise VCd koluna. Başlangıçtaki demografik ve hastalık özellikleri iki tedavi grubu arasında benzerdi. Hastalarınçoğunluğunda (%79) lambda serbest hafif zincir hastalığı mevcuttu. Medyan hasta yaşı 64'tü(aralık: 34 ila 87); %47'si >65 yaşında; %58'i erkek; %76'sı beyaz ırktan, %17'si Asyalı ve%3'ü Afrikalı Amerikalıydı; %23'ünde AL amiloidoz Klinik Kardiyak evre I, %40'ında evreII, %35'inde evre IIIA ve %2'sinde evre IIIB hastalık mevcuttu. Tutulan organların medyansayısı 2'ydi (aralık: 1-6) ve hastaların %66'ında 2 veya daha fazla tutulan organ vardı. Hayatiorgan tutulumu aşağıdaki gibiydi: %71 kalp, %59 böbrek ve %8 karaciğer. Derece 2 duyusalveya derece 1 ağrılı periferik nöropatisi olan hastalar çalışma dışı bırakıldı. Birincil etkililiksonlanım noktası, Uluslararası Konsensüs Kriterlerine göre Bağımsız İnceleme Komitesitarafından belirlenen hematolojik tam yanıt (HemCR) oranıydı. AMY3001 çalışmasında, VCdkoluna kıyasla D-VCd kolunda HemCR iyileşmesi gösterilmiştir. Etkililik sonuçları tablo 10'daözetlenmiştir.
D-VCd=daratumumab-bortezomib-siklofosfamid-deksametazon; VCd=bortezomib- siklofosfamid-deksametazon aTedaviye niyet popülasyonuna dayalı bP değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır. dNominal p değeri ters olasılık sansürleme ağırlıklı log-rank testi ile hesaplanmıştır. Yanıt veren hastalarda HemCR'ye kadar geçen medyan süre, D-VCd grubunda 60 gün (aralık: 8 ila 299 gün) ve VCd grubunda 85 gün (aralık: 14 ila 340 gün) olmuştur. VGPR veya dahaiyi yanıta kadar geçen medyan süre D-VCd grubunda 17 gün (aralık: 5 ila 336 gün) ve VCdgrubunda 25 gün (aralık: 8 ila 171 gün) olmuştur. İki tedavi kolunda da medyan HemCRsüresine ulaşılmamıştır. Çalışma için medyan takip süresi 11.4 aydır. Her iki koldaki hastalar için medyan majör organ bozulma progresyonsuz sağkalımına (MOD-PFS) ulaşılamamıştır. Genel sağkalım (OS) verileri olgun değildir. Toplam 56 ölüm gözlemlenmiştir [n=27 (%13,8) D-VCd ve n=29 (%15) VCd grubu]. Daratumumab infüzyonluk çözelti için konsantre (intravenöz formülasyon) ile klinik deneyimYeni tanı multipl miyelomOtolog kök hücre nakli için uygun olmayan hastalarda lenalidomid ve deksametazon ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü bir faz 3 çalışma olan MMY3008 çalışmasında, yeni tanı multipl miyelomu olan hastalarda lenalidomid ve düşük doz deksametazon ile kombineedilen intravenöz daratumumab 16 mg/kg (DRd), lenalidomid ve düşük doz deksametazontedavisi (Rd) ile karşılaştırılmıştır. Lenalidomid (tekrarlanan 28 günlük [4 hafta] kürlerin 1-21.günlerinde günde bir kez oral yoldan alınan 25 mg) ile birlikte haftada 40 mg düşük doz oralya da intravenöz deksametazon (veya >75 yaş hastalar ya da beden kitle indeksi [BKİ] <18,5olan hastalar için haftada 20 mg'a azaltılmış doz) verilmiştir. İntravenöz daratumumabinfüzyonunun uygulandığı günlerde, deksametazon dozu infüzyon öncesi ilaç olarakverilmiştir. Lenalidomid ve deksametazon için doz ayarları üreticinin reçeteleme bilgilerineuygun olarak gerçekleştirilmiştir. Tedavi her iki kolda hastalık progresyonu veya kabuledilemez toksisite görülünceye kadar devam etmiştir. Toplam 737 hasta randomize edilmiştir: 368'i DRd koluna, 369'u ise Rd koluna. Başlangıçtaki demografik ve hastalık özellikleri iki tedavi grubu arasında benzerdi. Medyan yaş 73'di (aralık:45-90) ve hastaların %44'ü >75 yaşındaydı. Hastaların çoğunluğu beyaz (%92); erkek (%52);%34'ünün Doğu Ortak Onkoloji Grubu (ECOG) performans skoru 0; %49,5'inin ECOGperformans skoru 1 ve %17'sinin ECOG performans skoru >2 idi. Hastaların %27'sindeUluslararası Evreleme Sistemi (ISS) evre I, %43'ünde ISS evre II ve %29'unda ISS evre IIIhastalık mevcuttu. Etkililik, Uluslararası Miyelom Çalışma Grubu (IMWG) kriterlerinedayanarak progresyonsuz sağkalıma (PFS) göre değerlendirilmiştir. MMY3008 Çalışması, Rd koluna kıyasla DRd kolunda progresyonsuz sağkalım (PFS) düzelmesi göstermiştir; medyan PFS'ye DRd kolunda ulaşılmazken, Rd kolunda medyan PFS 31,9 ay olmuştur (tehlike oranı [HR]=0,56; %95 GA: 0,43, 0,73; p<0,0001), bu da DRd iletedavi edilen hastalarda hastalık progresyonu veya ölüm riskinde %44 oranında bir azalmayıyansıtmıştır. Orijinal klinik kesme tarihinden yaklaşık 9 ay sonra güncellenmiş bir PFSanalizinin sonuçları, Rd koluna kıyasla DRd kolundaki hastalar için PFS düzelmesi göstermeyedevam etmiştir. Medyan PFS'ye DRd kolunda ulaşılmazken, Rd kolunda medyan PFS 33,8 ayolmuştur (HR=0,56; %95 GA: 0,44, 0,71; p<0,0001).
Şekil 2:Ifio
o (S031215182124273033363942454851Risk taşıyan hasta Rd 369 333 307 280 254 236 219 204194177 161 113 64 33 10 2 D-Rd 368 347 335 320 309 300 290 276 266 256 233 174131 70 24 7
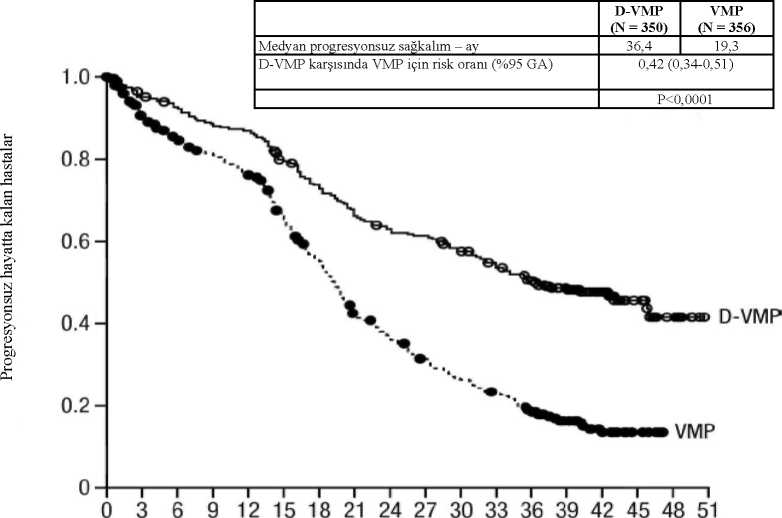
DRd=daratumumab-lenalidomid-deksametazon; Rd=lenalidomid-deksametazon; MRD=minimal rezidüel hastalık; GA=güven aralığıaTedaviye niyet popülasyonuna dayalı bp-değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır. c10-5 eşiğine dayalı dTabakalandmlmamış tablolar için Mantel-Haenszel olasılık oranı tahmini kullanılmıştır. Değeri > 1 olan bir olasılık oranı DRd lehine avantaja işaret eder.eFisher'in kesin testine göre p değeri. Yanıt veren hastalarda yanıta kadar geçen medyan süre, D-VMP grubunda 1,05 ay (aralık: 0,2 ila 12,1 ay) ve Rd grubunda 1,05 ay (aralık: 0,3 ila 15,3 ay) olmuştur. Medyan yanıt süresineDRd grubunda ulaşılmazken, Rd grubunda medyan yanıt süresi 34,7 ay (%95 GA: 30,8, tahminedilemez) olmuştur. Otolog kök hücre nakli için uygun olmayan hastalarda bortezomib, melfalan ve prednizon (VMP) ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü bir faz 3 çalışma olan MMY3007 çalışmasında, yeni tanı multipl miyelomu olan hastalarda bortezomib, melfalan ve prednizon ile kombine edilenintravenöz daratumumab 16 mg/kg tedavisi (D-VMP), VMP tedavisi ile karşılaştırılmıştır.Bortezomib, ilk 6 haftalık kür için haftada iki kez 1, 2, 4 ve 5. haftalarda (1. kür; 8 doz) vesonrasında sekiz adet daha 6 haftalık kür için haftada bir kez 1, 2, 4 ve 5. haftalarda (2-9. kürler;4 doz/kür) 1,3 mg/m2 vücut yüzey alanı dozunda subkutan enjeksiyon yoluyla uygulanmıştır.Melfalan 9 mg/m2 ve prednizon 60 mg/m2, 9 adet 6 haftalık kürün (1-9. kürler) 1-4. günlerindeoral yoldan uygulanmıştır. İntravenöz daratumumab tedavisine, hastalık progresyonu veyakabul edilemez toksisite görülünceye kadar devam edilmiştir. Toplam 706 hasta randomize edilmiştir: 350'Si D-VMP koluna, 356'sı ise VMP koluna. Başlangıçtaki demografik ve hastalık özellikleri iki tedavi grubu arasında benzerdi. Medyanyaş 71'di (aralık: 40-93) ve hastaların %30'u >75 yaşındaydı. Hastaların çoğunluğu beyaz(%85); kadın (%54); %25'inin ECOG performans skoru 0; %50'sinin ECOG performans skoru1 ve %25'inin ECOG performans skoru 2 idi. Hastaların sırasıyla %64, %22 ve %10'undaIgG/IgA/Hafif zincir miyelomu; %19'unda ISS evre I, %42'sinde ISS evre II, %38'inde ISSevre III hastalık ve %84'ünde standart risk sitogenetik mevcuttu. Etkililik, IMWG kriterlerinedayanarak PFS'ye ve genel sağkalıma (OS) göre değerlendirilmiştir. Medyan 16,5 aylık takip süresiyle, MMY3007 Çalışmasının birincil PFS analizi, VMP koluna kıyasla D-VMP kolunda bir iyileşme göstermiştir; medyan PFS'ye D-VMP kolundaulaşılmazken, VMP kolunda medyan PFS 18,1 ay olmuştur (HR=0,5; %95 GA: 0,38, 0,65;p<0,0001). Medyan 40 aylık takipten sonra güncellenmiş bir PFS analizinin sonuçları, VMPkoluna kıyasla D-VMP kolundaki hastalar için PFS düzelmesi göstermeye devam etmiştir. Medyan PFS, D-VMP kolunda 36,4 ay, VMP kolunda 19,3 ay olmuştur (HR=0,42; %95 GA: 0,34, 0,51; p<0,0001), bu da D-VMP ile tedavi edilen hastalarda hastalık progresyonu veyaölüm riskinde %58 oranında bir azalmayı yansıtmıştır.
VMP 356 304 278 263 246 207 171128 110 93 78 67 51 29 15 7 D-VMP 350 322 312 298 292 265 243 220 207 202 188 173 160 113 63 26Medyan 40 aylık takipten sonra, D-VMP kolu VMP koluna karşı OS avantajı göstermiş (HR=0,60; %95 GA: 0,46, 0,80; p=0,0003), bu da D-VMP kolunda tedavi edilen hastalardaölüm riskinde %40 oranında bir azalmayı yansıtmıştır. Medyan OS'ye hiçbir tedavi kolu içinulaşılmamıştır. I
VMP0.4-
0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 45 48 51 54Risk taşıyan hasta VMP 356331 325 322 312 302 292 278 269 257 242 226 198132 73 27 3 1 0 D-VMP 350330327 322 318309 301 292 288 283 275 270 248171 97 40 12 0 0
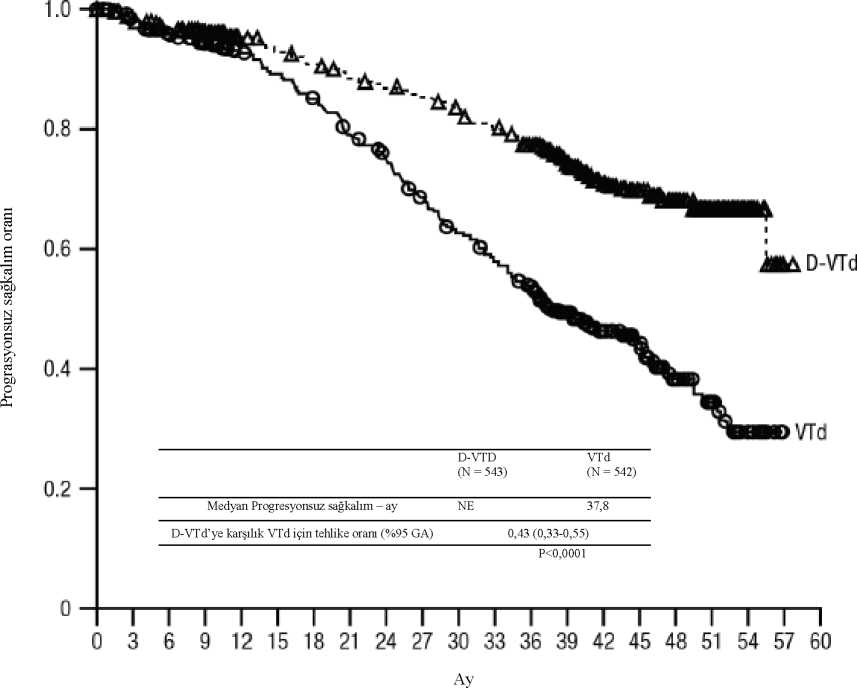
prednizon; MRD=minimal rezidüel hastalık; GA=güven aralığı aTedaviye niyet popülasyonuna dayalı bp-değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır. c10'5 eşiğine dayalı Yanıt veren hastalarda yanıta kadar geçen medyan süre, D-VMP grubunda 0,79 ay (aralık: 0,4 ila 15,5 ay) ve VMP grubunda 0,82 ay (aralık: 0,7 ila 12,6 ay) olmuştur. Medyan yanıt süresine D-VMP grubunda ulaşılmazken, VMP grubunda medyan yanıt süresi 21,3 ay (%95 GA: 18,4, tahmin edilemez) olmuştur. En az 70 yaşında olan veya 65-69 yaş aralığında olup ECOG performans skoru 2 olan ya da 65 yaşın altında olup anlamlı bir komorbiditesi veya ECOG performans skoru 2 olan hastalarda(D-VMP: n=273, VMP: n=270) bir alt grup analizi gerçekleştirilmiştir. Bu alt grupta elde edilenetkililik sonuçları genel popülasyon ile tutarlılık göstermiştir. Bu alt grupta, medyan PFS'ye D-VMP kolunda ulaşılmazken, VMP kolunda medyan PFS 17,9 ay olmuştur (HR=0,56; %95 GA: 0. 42, 0,75; p<0,0001). Genel yanıt oranı D-VMP grubunda %90 ve VMP grubunda %74olmuştur (VGPR oranı: D-VMP grubunda %29 ve VMP grubunda %26; CR: D-VMP grubunda%22 ve VMP grubunda %18; sCR oranı: D-VMP grubunda %20 ve VMP grubunda %7). Bualt grupta elde edilen güvenlilik sonuçları genel popülâsyon ile tutarlılık göstermiştir. Ayrıca,ECOG performans skoru 2 olan hasta alt grubunun (D-VMP: n=89, VMP: n=84) güvenlilikanalizi de genel popülasyon ile tutarlı olmuştur. Otolog kök hücre nakli (OKHT) için uygun hastalarda bortezomib, talidomid ve deksametazon (VTd) ile kombinasyon tedavisiMMY3006 çalışması 2 bölümlü, açık etiketli, randomize, aktif kontrollü bir faz 3 çalışmadır. Bölüm 1'de OKHT için uygun yeni tanı multipl miyelomu olan hastalarda bortezomib,talidomid ve deksametazon ile kombine edilen intravenöz daratumumab 16 mg/kg (D-VTd) ileindüksiyon ve konsolidasyon tedavisi, bortezomib, talidomid ve deksametazon (VTd) tedavisiile karşılaştırılmıştır. Tedavinin konsolidasyon fazı, OKHT'den minimum 30 gün sonra hastayeterli düzeyde iyileştiği ve engraftman tamamlandığı zaman başlamıştır. Bölüm 2'de, nakilsonrası 100. güne kadar en azından kısmi bir yanıta (PR) sahip olan gönüllüler, daratumumabidame veya sadece gözlem grubuna 1:1 oranında yeniden randomize edilmiştir. Bundan sonrasadece 1. bölümden elde edilen sonuçlar açıklanacaktır. Bortezomib, tekrarlanan 28 günlük (4 haftalık) indüksiyon tedavi kürlerinde (1-4. kürler) ve 4. kürün ardından OKHT sonrasında iki konsolidasyon küründe (5 ve 6. kürler) iki hafta süreylehaftada iki kere (1, 4, 8 ve 11. günler) 1,3 mg/m2 vücut yüzey alanı dozunda subkutanenjeksiyon veya intravenöz enjeksiyon yoluyla verilmiştir. Talidomid, altı bortezomib kürüboyunca günde 100 mg dozda oral yoldan uygulanmıştır. Deksametazon (oral veya intravenöz),1 ve 2. kürlerin 1, 2, 8, 9, 15, 16, 22 ve 23. günlerinde 40 mg ve 3-4. kürlerin 1-2. günlerinde40 mg ve daha sonraki doz günlerinde (8, 9, 15, 16. günler) 20 mg dozda verilmiştir. 5 ve 6.kürlerin 1, 2, 8, 9, 15, 16. günlerinde deksametazon 20 mg uygulanmıştır. İntravenözdaratumumab infüzyonunun uygulandığı günlerde, deksametazon dozu infüzyon öncesi ilaçolarak verilmiştir. Bortezomib, talidomid ve deksametazon için doz ayarları üreticininreçeteleme bilgilerine uygun olarak gerçekleştirilmiştir. Toplam 1085 hasta randomize edilmiştir: 543'ü D-VTd koluna, 542'si ise VTd koluna. Başlangıçtaki demografik ve hastalık özellikleri iki tedavi grubu arasında benzerdi. Medyanyaş 58'di (aralık: 22 ila 65). Tüm hastalar < 65 yaşındaydı: %43'ü > 60-65 yaş grubunda, %41'i> 50-60 yaş grubunda ve %16'sı 50 yaşın altındaydı. Hastaların çoğunluğu erkek (%59);%48'inin ECOG performans skoru 0; %42'sinin ECOG performans skoru 1 ve %10'ununECOG performans skoru 2 idi. Hastaların %40'ında Uluslararası Evreleme Sistemi (ISS) Evre 1, %45'inde ISS Evre 2 ve %15'inde ISS Evre 3 hastalık mevcuttu. Etkililik, transplantasyon sonrası 100. günde kesin tam yanıt (sCR) oranı ve PFS ile değerlendirilmiştir.
deksametazon; MRD=minimal rezidüel hastalık; GA=güven aralığı aTedaviye niyet popülasyonuna dayalı bp-değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır. c10'5 eşiğine dayalı dIMWG başına yanıttan bağımsız olarak eTabakalandmlmış tablolar için Mantel-Haenszel ortak olasılık oranı tahmini kullanılmıştır. 18,8 aylık bir medyan takip ile, ikinci randomizasyonda daratumumab idamesi randomize edilen hastaları sansürleyerek yapılan birincil PFS analizi, ikinci randomizasyon tarihindeHR=0,50; % 95 GA: 0,34, 0,75; p=0,0005 göstermiştir. İkinci randomizasyonda daratumumabidamesine randomize edilen hastaları sansürleyen, medyan takip süresi 44,5 aylık olangüncellenmiş bir PFS analizinin sonuçları, HR=0.43; %95 CI: 0.33, 0.55; p<0,0001göstermiştir. Medyan PFS'ye D-VTd kolunda ulaşılamadı ve VTd kolunda 37,8 aydır.
Relaps/refrakter multipl mi-yelomMonoterapi:Önceki tedavisi bir proteazom inhibitörü ve bir immünomodülatör ajan içeren ve son tedavide hastalığı ilerlemiş olan yetişkin relaps ve refrakter multipl miyelom hastalarının tedavisindekiintravenöz daratumumab monoterapisinin klinik etkililiği ve güvenliliği, iki açık etiketliçalışmada gösterilmiştir. MMY2002 çalışmasında, 106 relaps ve refrakter multipl miyelom hastasına hastalık progresyonuna kadar 16 mg/kg intravenöz daratumumab verilmiştir. Medyan hasta yaşı 63,5olup (aralık 31 ila 84); hastaların % 11'i > 75 yaşında, hastaların % 49'u erkek ve % 79'u beyazırktan hastalardan oluşmuştur. Hastalara, daha önce medyan 5 basamak tedavi uygulanmıştır.Hastaların % 80'ine daha önce otolog kök hücre nakli (OKHN) uygulanmıştır. Daha önceuygulanan tedaviler bortezomib (%99), lenalidomid (%99), pomalidomid (%63) vekarfilzomibi (%50) içermiştir. Başlangıçta, hastaların % 97'si son basamak tedaviye refrakterolup; %95'i hem proteazom inhibitörüne (PI) hem immünomodülatör ajana (IMiD); %77'sialkilleyici ajanlara; %63'ü pomalidomide ve % 48'i karfilzomibe refrakter idi. Bağımsız İnceleme Kurulu (BİK) değerlendirmesine dayalı önceden planlanmış ara analizin etkililik sonuçları, tablo 14'te sunulmaktadır.
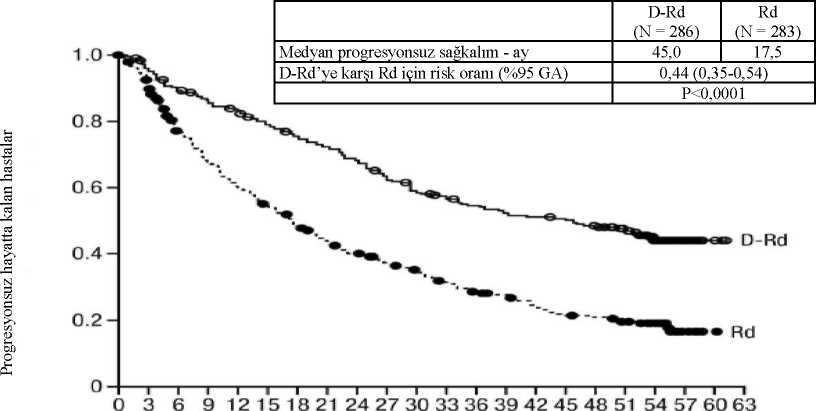
MMY2002 çalışmasında genel yanıt oranı (ORR), önceki anti-miyelom tedavisinin tipinden bağımsız olarak benzer bulunmuştur. Medyan 14,7 aylık takip süresi ile yapılan sağkalım güncellemesinde, medyan OS 17,5 ay olarak bulunmuştur (% 95 GA: 13,7, tahmin edilemez). GEN501 çalışmasında, 42 relaps ve refrakter multipl miyelom hastasına hastalık progresyonuna kadar 16 mg/kg intravenöz daratumumab verilmiştir. Medyan hasta yaşı 64 olup (aralık 44 ila76); hastaların % 64'ü erkek ve % 76'sı beyaz ırktan hastalardan oluşmuştur. Çalışmadakihastalara, daha önce medyan 4 basamak tedavi uygulanmıştır. Hastaların %74'üne daha önceOKHN uygulanmıştır. Daha önce uygulanan tedaviler bortezomib (%100), lenalidomid (%95),pomalidomid (%36) ve karfilzomibi (%19) içermiştir. Başlangıçta, hastaların %76'sı sonbasamak tedaviye refrakter olup; %64'ü hem PI hem IMiD'e; %60'ı alkilleyici ajanlara; %36'sıpomalidomide ve %17'si karfilzomibe refrakter idi. Önceden planlanmış ara analizde, 16 mg/kg dozda daratumumab tedavisinin %5 CR ve % 5 VGPR ile %36 ORR'ye yol açtığı görülmüştür. Yanıta kadar geçen medyan süre 1 ay olmuştur(aralık: 0,5 ila 3,2). Medyan yanıt süresine ulaşılmamıştır (% 95 GA: 5,6 ay, tahmin edilemez). Medyan 15,2 aylık takip süresi ile yapılan sağkalım güncellemesinde, gönüllülerin % 74'ünün halen hayatta olmasıyla medyan OS'ye ulaşılmamıştır (% 95 GA: 19,9, tahmin edilemez). Lenalidomid ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü bir faz 3 çalışma olan MMY3003 çalışmasında, daha önce en az bir tedavi alan relaps veya refrakter multipl miyelomlu hastalarda, lenalidomid vedüşük dozda deksametazon ile kombine edilen intravenöz daratumumab 16 mg/kg tedavisi(DRd), lenalidomid ve düşük dozda deksametazon tedavisi (Rd) ile karşılaştırılmıştır.Lenalidomid (tekrarlanan 28 günlük [4 hafta] siklusların 1. gününden 21. gününe kadar gündebir kez oral yoldan alınan 25 mg) ile birlikte haftada 40 mg düşük doz deksametazon (veya >75yaş hastalar veya BMI <18,5 olan hastalar için haftada 20 mg'a azaltılmış doz) verildi. İntravenözdaratumumab infüzyonunun verildiği günlerde, deksametazon dozunun 20 mg'ı infüzyon öncesiilaç olarak, geri kalan kısmı ise infüzyondan sonraki gün verildi. Tedavi her iki kolda hastalıkprogresyonu veya kabul edilemez toksisite görülünceye kadar devam etti. 286'sı DRd koluna, 283'ü ise Rd koluna olmak üzere toplam 569 hasta randomize edildi. Başlangıçtaki demografik ve hastalık özellikleri intravenöz daratumumab ve kontrol koluarasında benzer idi. Medyan hasta yaşı 65 yıl (aralık 34 ila 89) olup hastaların % 11'i >75 yaşidi. Daha önce lenalidomid alan hastaların %18'i de dahil, hastaların çoğu (%86) daha önce birPI ve %55'i daha önce bir IMiD kullanmıştı; hastaların %44'ü daha önce hem PI hem de IMiDkullanmıştı. Başlangıçta, hastaların % 27'si son tedavi basamağına refrakter idi. Hastaların%18'i yalnızca bir PI'ne, %21'i ise bortezomibe refrakter idi. Lenalidomide refrakter olanhastalar çalışmaya dahil edilmedi. Medyan 13,5 aylık takip süresiyle, MMY3003 Çalışmasının birincil PFS analizi, Rd koluna kıyasla D-Rd kolunda bir düzelme göstermiştir; medyan PFS'ye D-Rd kolunda ulaşılmazken,Rd kolunda medyan PFS 18,4 ay olmuştur (HR=0,37; %95 GA: 0,27, 0,52; p<0,0001). Medyan55 aylık takipten sonra güncellenmiş bir PFS analizinin sonuçları, Rd koluna kıyasla DRdkolundaki hastalar için PFS düzelmesi göstermeye devam etmiştir. Medyan PFS, DRd kolunda45,0 ay ve Rd kolunda 17,5 ay olmuştur (HR=0,44; %95 GA: 0,35, 0,54; p<0,0001), bu da DRdile tedavi edilen hastalarda hastalık progresyonu veya ölüm riskinde %56 oranında bir azalmayıyansıtmıştır (şekil 6).
Şekil 6:
17,4 (17,4, NE)
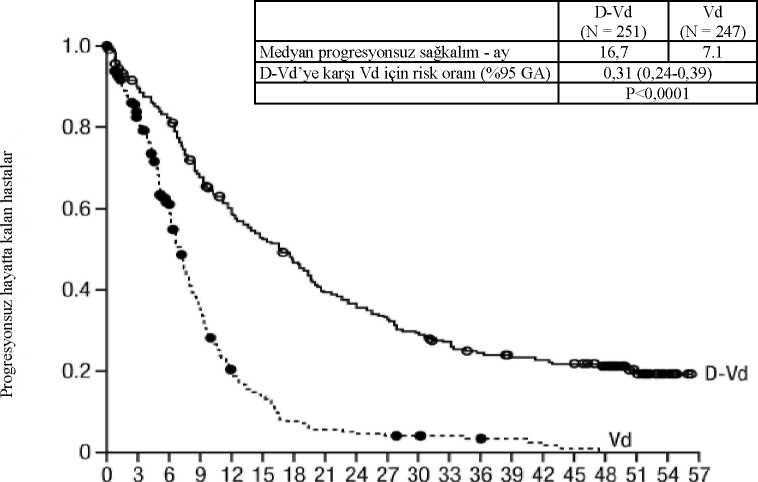
2,8 (1,2, 5,5) DRd=daratumumab-lenalidomid-deksametazon; Rd=lenalidomid-deksametazon; MRD=minimal rezidüel hastalık; GA=güven aralığı; NE=tahmin edilemez.ap-değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır.bTedaviye niyet popülasyonu ve 10-5 eşiğine dayalı cMantel-Haenszel ortak olasılık oranı tahmini kullanılmıştır. Değeri > 1 olan bir olasılık oranı DRd lehine avantaja işaret eder.dFisher'in kesin testine göre p değeri. Grupların hiçbirinde medyan OS'ye ulaşılmadı. Toplam 13,5 aylık bir medyan takip ile OS için risk oranı 0,64 idi (% 95 GA: 0,40, 1,01; p=0,0534). Bortezomib ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü bir faz 3 çalışma olan MMY3004 çalışmasında, daha önce en az bir tedavi alan relaps veya refrakter multipl miyelomlu hastalarda, bortezomib vedeksametazon ile kombine edilen intravenöz daratumumab 16 mg/kg tedavisi (DVd),bortezomib ve deksametazon tedavisi (Vd) ile karşılaştırılmıştır. Bortezomib, tekrarlanan 21günlük (3 hafta) tedavi sikluslarında iki hafta süreyle haftada iki kere (1, 4, 8 ve 11. günler) 1,3mg/m2 vücut yüzey alanı dozunda olmak üzere SC enjeksiyon veya IV infüzyon yoluyla toplam8 siklus boyunca verildi. Deksametazon, 8 bortezomib siklusunun her birinin 1, 2, 4, 5, 8, 9, 11ve 12. günlerinde oral yoldan 20 mg dozunda (3 haftalık her bir bortezomib siklusunun ikisiiçin haftada 80 mg) verilirken; >75 yaş hastalar, VKİ değeri <18,5 olan hastalar, diyabetiyeterince kontrol altına alınamayan hastalar veya daha önce steroid tedavisini tolere edemeyenhastalara haftada 20 mg'lık azaltılmış dozda verildi. İntravenöz daratumumab infüzyonununuygulandığı günlerde, deksametazon dozunun 20 mg'lık kısmı infüzyon öncesi ilaç olarakverildi. İntravenöz daratumumab tedavisine, hastalık progresyonu veya kabul edilemez toksisitegörülünceye kadar devam edildi. 251'i DVd koluna, 247'si ise Vd koluna olmak üzere toplam 498 hasta randomize edildi. Başlangıçtaki demografik ve hastalık özellikleri intravenöz daratumumab ve kontrol koluarasında benzer idi. Medyan hasta yaşı 64 yıl (aralık 30 ila 88) olup hastaların %12'si >75 yaşidi. Hastaların %69'u daha önce bir PI (%66'sı bortezomib), %76'sı ise IMiD (%42'silenalidomid) kullanmıştı. Başlangıçta, hastaların %32'si son tedavi basamağına refrakter idi.Hastaların %33'ü yalnızca bir IMiD'e, %28'i ise lenalidomide refrakter idi. Bortezomiberefrakter olan hastalar çalışmaya dahil edilmedi. 7,4 aylık takip süresiyle, MMY3004 çalışmasının birincil PFS analizi, Vd koluna kıyasla DVd kolunda bir düzelme göstermiştir; medyan PFS'ye DVd kolunda ulaşılmazken, Vd kolundamedyan PFS 7,2 ay olmuştur (HR [% 95 GA]: 0,39 [0,28, 0,53]; p değeri <0,0001). Medyan 50aylık takipten sonra güncellenmiş bir PFS analizinin sonuçları, Vd koluna kıyasla DVdkolundaki hastalar için PFS düzelmesi göstermeye devam etmiştir. Medyan PFS DVd kolunda16,7 ay, Vd kolunda 7,1 ay olmuştur (HR [%95 GA]: 0,31 [0,24, 0,39]; p değeri <0,0001), buda Vd karşısında DVd ile tedavi edilen hastalarda hastalık progresyonu veya ölüm riskinde %69oranında bir azalmayı yansıtmıştır (bkz. şekil 7).
5 4 2 1 0 0 0 0 54 50 48 46 38 20 7 0Vd 247182129 74 39 27 15 11 9 8 7 6 D-Vd 251 215198161 138123109 92 85 77 68 61
DVd=daratumumab-bortezomib-deksametazon; Vd=bortezomib-deksametazon; MRD=minimal rezidüel hastalık; GA=güven aralığı; NE=tahmin edilemez.ap-değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır.bTedaviye niyet popülasyonu ve 10-5 eşiğine dayalı cMantel-Haenszel ortak olasılık oranı tahmini kullanılmıştır. Değeri > 1 olan bir olasılık oranı DVd lehine avantaja işaret eder.dFisher'in kesin testine göre p değeri. Grupların hiçbirinde medyan OS'ye ulaşılmadı. Toplam 7,4 aylık bir medyan takip ile (%95 GA: 0, 14,9), OS için risk oranı 0,77 idi (%95 GA: 0,47, 1,26; p=0,2975). Kardiyak elektrofizyolojiBüyük bir protein olarak daratumumabın iyon kanallarıyla doğrudan etkileşime girme olasılığı düşüktür. Daratumumabın QTc aralığı üzerindeki etkisi relaps ve refrakter multipl miyelomlu83 hastayı kapsayan açık etiketli bir çalışmada (GEN501 Çalışması) daratumumabinfüzyonlarmdan (4 ila 24 mg/kg) sonra değerlendirilmiştir. Lineer karışık PK PDanalizleri,daratumumab Cmaks ortalama QTcF aralığında hiçbir büyük artış (yani, 20ms'den dahabüyük) göstermemiştir. Pediyatrik popülasyonAvrupa İlaç Kurumu, tüm multipl miyelomlu pediyatrik popülasyon alt kümelerinde DARZALEX ile yapılan çalışmaların bulgularını sunma yükümlülüğünü kaldırmıştır(pediyatrik kullanıma ilişkin bilgi için bkz. Bölüm 4.2). 5.2 Farmakokinetik özelliklerGenel özellikler Emilim:Multipl miyelomlu hastalarda önerilen 1800 mg dozda DARZALEX subkutan enjeksiyonluk çözeltinin biyoyararlanımı 0,012 saat-1 emilim hızı ile %69 olmuş ve pik konsantrasyonlar 70ila 72 saat sonunda görülmüştür (Tmaks). AL amiloidoz hastalarında önerilen 1800 mg dozdamutlak biyoyararlanım hesaplanmamış, emilim hızı sabiti 0,77 gün-1 (%8,31 CV) olmuş ve pikkonsantrasyonlar 3 günün sonunda görülmüştür. Önerilen 1800 mg DARZALEX subkutan enjeksiyonluk çözelti dozu uygulandıktan sonra, ilk dozdan son haftalık doza kadar (8. doz) pik konsantrasyonlar (Cmaks) 4,8 misli ve toplammaruziyet (EAA 0-7gün) 5,4 misli artmıştır. DARZALEX subkutan enjeksiyonluk çözeltinin enyüksek dip konsantrasyonları, monoterapi ve kombinasyon tedavisinin her ikisi için tipik olarakhaftalık dozlama rejimlerinin sonunda gözlenmiştir.Multipl miyelomlu hastalarda yapılan monoterapi çalışmasında, önerilen 1800 mg DARZALEX subkutan formülasyon uygulamasından (8 hafta için haftalık olarak, 16 hafta için2 haftada bir, sonrasında aylık) ve aynı dozlama planında uygulanan 16 mg/kg intravenözdaratumumab tedavisinden sonra oluşan daratumumab maruziyeti, intravenöz daratumumabiçin 522 ± 226 ^g/mL'ye kıyasla 593 ± 306 ^g/mL ortalama ± SD ve %107,93 (%90 GA: 95,74121,67) geometrik ortalama oranı ile maksimum Cdip (3. kür 1. gün doz öncesi) ortak birincilsonlanım noktası için eşit etkililik göstermiştir. Multipl miyelomlu hastalarda, kombinasyon tedavisinde kullanılan 1800 mg DARZALEX subkutan enjeksiyonluk çözeltinin 6 adet haftalık dozunu takiben temsili dip konsantrasyonlar,monoterapi olarak kullanılan 1800 mg DARZALEX subkutan enjeksiyonluk çözeltinindeğerlerine benzer olmuştur. Multipl miyelom hastalarında, pomalidomid ve deksametazon ile kombinasyon çalışmasında (MMY3013 çalışması) daratumumab maruziyeti monoterapideki maruziyete benzer olmuş,önerilen 1800 mg DARZALEX subkutan enjeksiyonluk çözelti uygulamasından (8 hafta içinhaftalık olarak, 16 hafta için iki haftada bir ve sonrasında aylık olarak) sonra maksimum Cdip(3. kür 1. gün doz öncesi) ortalama ± SD değeri 537±277 ^g/mL bulunmuştur. DARZALEX subkutan enjeksiyonluk çözelti monoterapisi ve kombinasyon tedavisi içeren multipl miyelom çalışmalarına ait veriler kullanılarak bir popülasyon PK analizigerçekleştirilmiş ve tahmin edilen PK maruziyet tablo 17'de özetlenmiştir. Tablo 17: Multipl miyelomlu hastalarda DARZALEX subkutan formülasyon(1800 mg) veya intravenöz daratumumab (16 mg/kg) monoterapisinden sonra
AL amiloidozlu hastalarda yapılan AMY3001 kombinasyon çalışmasında, önerilen 1800 mg DARZALEX subkutan formülasyon uygulamasından (8 hafta için haftalık olarak, 16 hafta için2 haftada bir, sonrasında aylık) sonra oluşan maksimum Cdip (3. kür 1. gün doz öncesi), 597 ±232 gg/mL ortalama ± SD ile multipl miyelomdaki değere benzer olmuştur. AL amiloidozlu hastalarda DARZALEX subkutan enjeksiyonluk çözelti kombinasyon tedavisinden elde edilen veriler kullanılarak, 211 hastaya ait verilerle bir popülasyon PK analizigerçekleştirilmiştir. Önerilen 1800 mg dozda, hesaplanan daratumumab konsantrasyonlarımultipl miyelomlu hastalara kıyasla biraz daha yüksek ancak genel olarak aynı aralıktaolmuştur (tablo 17 ve 18). Tablo 18: AL amiloidozlu hastalarda DARZALEX subkutan formülasyon (1800 mg)
Dağılım:Daratumumab monoterapisinde dağılım hacminin modelle öngörülen ortalama tahmini santral kompartıman için 5,25 L (%36,9 CV) ve periferik kompartıman (V2) için 3.78 L olarak vedaratumumab pomalidomid ve deksametazon ile kombinasyon halinde verildiğinde dağılımhacminin modelle öngörülen ortalama tahmini V1 için 4,36 L (%28,0 CV) ve V2 için 2,80 Lbulunmuştur. AL amiloidoz hastalarında, subkutan uygulamadan sonra modelle hesaplanangörünür dağılım hacmi 10.8 L'dir (%3,1 CV). Bu bulgular daratumumabın, sınırlı Biyotransformasyon:Bir IgGİK mAb olarak, daratumumabın diğer herhangi bir endojen IgG ile aynı şekilde biyotransforme olması beklenir (katabolik yollar yoluyla küçük peptidlere ve amino asitlereindirgenir). Eliminasyon:Daratumumab, hedef aracılı klirense özgü paralel doğrusal ve doğrusal olmayan (doyurulabilir) eliminasyon ile konsantrasyona ve zamana bağlı farmakokinetik sergiler. Popülasyon PKmodeliyle hesaplanan daratumumabın ortalama klirens değeri daratumumab monoterapisinde4,96 mL/s (%58,7 CV) ve daratumumab pomalidomid ve deksametazon ile kombinasyonhalinde uygulandığında 4,32 mL/s (%43,5 CV) olarak bulunmuştur. AL amiloidoz hastalarında,subkutan uygulamadan sonra görünür klirens 210 mL/gün (%4,1 CV) olmuştur. Doğrusaleliminasyon ile ilişkili yarılanma ömrü için modele dayalı geometik ortalama, daratumumabmonoterapisinde 20,4 gün (%22,4 CV), daratumumab pomalidomid ve deksametazon ilekombinasyon halinde uygulandığında 19,7 gün (%15,3 CV) ve AL amiloidozlu hastalarda 27,5gün (%74,0 CV) olmuştur. Monoterapi ve kombinasyon rejimleri için, kararlı duruma önerilendoz ve dozlama planı (1800 mg; 8 hafta için haftada bir, 16 hafta için 2 haftada bir ve sonrasında4 haftada bir) ile 4 haftada bir dozlama dönemine başlandıktan yaklaşık 5 ay sonra ulaşılmıştır. Hastalardaki karakteristik özelliklerÖzel popülasyonlarYaş ve cinsiyetMonoterapi veya çeşitli kombinasyon tedavileri alan hastalardaki (33-92 yaş) popülasyon PK analizlerine dayanarak, yaşın daratumumab farmakokinetiği üzerinde istatistiksel olarakanlamlı bir etkisi olmamıştır. Hastalar için yaşa dayalı bireyselleştirme gerekli değildir.Cinsiyetin multipl miyelomlu hastalarda PK parametresi üzerinde istatistiksel olarak anlamlıbir etkisi olmuş, fakat AL amiloidozlu hastalarda olmamıştır. Kadınlarda erkeklerden birazdaha yüksek maruziyet gözlenmiş ancak maruziyet farkı klinik olarak anlamlı kabuledilmemiştir. Hastalar için cinsiyete dayalı bireyselleştirme gerekli değildir. Böbrek yetmezliğiBöbrek yetmezliği olan hastalarda DARZALEX subkutan formülasyon ile resmi çalışmalar yürütülmemiştir. DARZALEX subkutan formülasyon monoterapisi ya da çeşitli kombinasyonterapileri alan hastalarda önceden var olan böbrek fonksiyonu verilerine dayanılarakpopülasyon PK analizleri gerçekleştirilmiş ve böbrek yetmezliği olan hastalar ile böbrekfonksiyonu normal olan hastalar arasında daratumumab maruziyeti yönünden klinik olarakönemli farklılıklar gözlenmemiştir. Karaciğer yetmezliğiKaraciğer yetmezliği olan hastalarda DARZALEX subkutan formülasyon ile resmi çalışmalar yürütülmemiştir. Daratumumab subkutan formülasyon monoterapisi veya çeşitli kombinasyon tedavileri alan hastalarda popülasyon PK analizleri gerçekleştirilmiştir. Normal hepatik fonksiyonları olanhastalar ile hafif karaciğer yetmezliği olan hastalar arasında daratumumab maruziyetinde klinikolarak anlamlı farklılıklar gözlenmemiştir. İlgili popülasyonlar için anlamlı sonuçlara varmakiçin orta dereceli ve şiddetli karaciğer yetmezliği olan çok az hasta mevcuttur. IrkDARZALEX subkutan formülasyon monoterapisi ya da çeşitli kombinasyon tedavileri alan hastalarda yürütülen popülasyon PK analizlerine dayanarak, daratumumaba maruziyet ırklararasında benzerdi. Vücut ağırlığıDARZALEX 1800 mg subkutan formülasyonun monoterapi olarak sabit dozlu uygulaması ile tüm vücut ağırlığı alt grupları için yeterli maruziyet elde edilmiştir. Multipl miyelomluhastalarda, düşük vücut ağırlığı alt grubunda (<65 kg) ortalama 3. kür 1. gün Cdip değeriintravenöz daratumumab alt grubuna kıyasla %60 daha yüksek ve daha yüksek vücut ağırlığı(>85 kg) alt grubunda ise %12 daha düşük olmuştur. Vücut ağırlığı >120 kg olan bazıhastalarda, azalmış etkililiğe neden olabilen daha düşük maruziyet gözlenmiştir. Ancak bugözlem, sınırlı sayıda hastaya dayanır. AL amiloidoz hastalarında, vücut ağırlıkları arasında Cdip için anlamlı farklılıklar gözlenmemiştir. 5.3 Klinik öncesi güvenlilik verileriŞempanzelerde daratumumab ile ve sinomolgus maymunlarda temsili anti-CD38 antikoru ile yapılan çalışmalardan toksikoloji verileri elde edilmiştir. Kronik toksisite testigerçekleştirilmemiştir. Daratumumabın karsinojenik potansiyelini belirlemek için hayvan çalışmaları yapılmamıştır. Daratumumabın üreme ve gelişim üzerindeki potansiyel etkilerini değerlendirmek ya da erkek veya kadınlarda fertilite üzerindeki potansiyel etkilerini belirlemek için hayvan çalışmalarıyapılmamıştır. Rekombinant insan hiyalüronidazı için karsinojenisite, genotoksisite ya da fertilite çalışmaları gerçekleştirilmemiştir. Maymunlara 39 hafta boyunca haftada 22,000 U/kg dozda subkutanyoldan (insan dozunun 12 katı) verilen hiyalüronidazın üreme dokuları ve fonksiyonu üzerindebir etkisi ve sistemik maruziyeti gözlenmemiştir. Hiyalüronidaz, endojen insanhiyalüronidazının rekombinant bir formu olduğundan, fertilite üzerinde etki, karsinojenisite yada mutagenez beklenmemektedir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiRekombinant insan hiyalüronidazı (rHuPH20) L-histidin L-histidin hidroklorür monohidrat L-metiyonin Polisorbat 20 Sorbitol (E420) Enjeksiyonluk su 6.2 GeçimsizliklerBu tıbbi ürün, bölüm 6.6'da belirtilenler dışındaki diğer maddelerle birlikte kullanılmamalıdır. 6.3 Raf ömrüAçılmamış flakon1 yılRaf ömrü süresince, delinmemiş flakonlar içindeki ürün 24 saate kadar süreyle tek bir periyot için ortam sıcaklığında (<30°C) saklanabilir. Ürün buzdolabından çıkarıldıktan sonra, tekrarbuzdolabına konulmamalıdır (bkz. Bölüm 6.6). Hazırlanmış enjektörKullanım sırasındaki kimyasal ve fiziksel stabilitesi, 30°C'ye (86°F) kadar ortam sıcaklığında ve ortam ışığında 4 saat süreyle gösterilmiştir. Mikrobiyolojik açıdan, açma yöntemi mikrobikkontaminasyon riskini önlemediği sürece, ürün hemen kullanılmalıdır. Hemen kullanılmadığıtakdirde, kullanım sırasında saklama süreleri ve koşulları kullanıcının sorumluluğundadır. 6.4 Saklamaya yönelik özel tedbirlerBuzdolabında saklayınız (2°C-8°C). Dondurulmaz. Işıktan korumak için, orijinal ambalajında saklayınız. Tıbbi ürünün açıldıktan sonraki saklama koşulları için Bölüm 6.3'e bakınız. 6.5 Ambalajın niteliği ve içeriği1800 mg daratumumab içeren elastomerik ve flip-off alüminyum kapaklı tip 1 cam flakon içerisinde 15 mL çözelti. Ambalaj büyüklüğü 1 flakondur. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerDARZALEX subkutan enjeksiyonluk çözelti tek kullanımlıktır ve kullanıma hazırdır. DARZALEX subkutan enjeksiyonluk çözelti, berrak ila opalesan ve renksiz ila sarı renkli bir çözelti olmalıdır. Opak partiküller, renk değişimi veya başka yabancı partiküller mevcut ise,çözelti kullanılmaz. DARZALEX subkutan enjeksiyonluk çözelti, polipropilen veya polietilen enjektör materyali; polipropilen, polietilen veya polivinil klorür (PVC) subkutan infüzyon setleri ve paslanmazçelik transfer ve enjeksiyon iğneleri ile geçimlidir. Açılmamış flakonDARZALEX subkutan enjeksiyonluk çözelti flakonu buzdolabından (2°C-8°C) çıkarılır ve ortam sıcaklığına (15°C-30°C) gelmesi beklenir. Delinmemiş flakon, ışıktan korunması içinorijinal ambalajı içerisinde maksimum 24 saat süreyle ortam sıcaklığı ve ortam ışığıkoşullarında saklanabilir. Doğrudan güneş ışığından uzak tutun. Çalkalanmaz. Hazırlanmış enjektörDozlama enjektörü kontrollü ve valide edilmiş aseptik koşullarda hazırlanır. Flakondan enjektöre aktarıldıktan sonra DARZALEX subkutan enjeksiyonluk çözelti ortam sıcaklığı veortam ışığında 4 saat süreyle saklanır (bkz. Bölüm 6.3). Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHIBIJohnson and Johnson Sıhhi Mal. San. ve Tic. Ltd. Şti. Kavacık/B eykoz/İSTANBUL 8. RUHSAT NUMARASI/NUMARALARI2022/798 9. İLK RUHSAT TARIHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 26.12.2022 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriDarzalex 1800 Mg Sc Enjeksiyonluk ÇözeltiEtken Maddesi: Daratumumab Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.