Vikisef 1 G Iv Enjeksiyonluk/infüzyonluk Çözelti Hazırlamak İçin Toz ve Çözücü Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERI TIBBİ ÜRÜNÜN ADIVİKİSEF 1 g IV enjeksiyonluk/infüzyonluk çözelti hazırlamak için toz ve çözücü 2. KALİTATİF VE KANTİTATİF BİLEŞİMİEtkin madde:Her flakon; 1000 mg seftriaksona eşdeğer miktarda 1192,89 mg seftriakson sodyum içerir. Yardımcı madde:Yardımcı maddeler için 6.1.'e bakınız. 3. FARMASÖTİK FORMUEnjeksiyonluk çözelti tozu ve çözücüsüEnjeksiyonluk çözelti tozu, beyaz ya da sarımsı renkte tozdur. Çözücü (enjeksiyonluk su); renksiz, kokusuz, berrak sıvıdır. Uygulama için hazırlandığında berrak renksiz çözelti halini alır. 4. KLİNİK ÖZELLİKLERİ4.1. Terapötik endikasyonlarVİKİSEF'e duyarlı patojenlerin neden olduğu enfeksiyonlar: - Sepsis, - Menenjit, - Dissemine Lyme borreliosis'i (hastalığın erken ve geç evreleri), - Abdominal enfeksiyonlar (peritonit, safra ve gastrointestinal sistem enfeksiyonları), - Kemik, eklem, yumuşak doku, cilt ve yara enfeksiyonları, - İmmün sistem bozukluğuna bağlı enfeksiyonlar, - Böbrek ve idrar yolları enfeksiyonları, - Solunum yolları enfeksiyonları, özellikle pnömoni, kulak-burun-boğaz enfeksiyonları, akutbakteriyel komplike olmayan otitis media, - Gonore dahil olmak üzereJşnigla|üenfpekıiyoSnlâr, ile imzalanmıştır.
- Preoperatif enfeksiyon profılaksisi. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Doktor tarafından başka şekilde tavsiye edilmediği takdirde; Standart doz Yetişkinler ve 12 yaşından büyük çocuklar: Normal olarak günde tek doz 1-2 g (24 saatte bir) VİKİSEF'dir. Ağır vakalarda veya orta derecede duyarlı organizmaların neden olduğu enfeksiyonlarda günde tek doz, 4 g'a çıkabilir. Tedavi süresi: Tedavi süresi hastalığın seyrine göre değişir. Genellikle bütün antibiyotik tedavilerinde olduğu gibi, hastanın ateşi düştükten veya bakteriyel eradikasyon sağlandıktan sonra en az 4872 saat VİKİSEF tedavisine devam edilmelidir. Kombine tedavi: Deneysel koşullar, birçok gram-negatif bakteriye karşı VİKİSEF ile aminoglikozitler arasında sinerji olduğunu göstermektedir. Bu tür kombinasyonlarda aktivite artışı her zaman kesinolmasa da, Pseudomonas aeruginosagibi patojenlerin neden olduğu ciddi ve hayatı tehditeden enfeksiyonlarda VİKİSEF ile aminoglikozitler kombine edilebilir.Ancak bu iki ilaç, aralarındaki fiziksel geçimsizlik nedeniyle önerilen dozlarda ayrı ayrı uygulanmalıdır. Menenjit: Bebek ve çocuklardaki bakteriyel menenjitte tedaviye günde tek doz 100 mg/kg (4 g aşılmamalıdır) ile başlanır. Etken organizmalar belirlenip duyarlılık testleri yapıldıktansonra, gerekirse doz azaltılabilir. En iyi tedavi sonuçları aşağıdaki tedavi sürelerinde eldeedilmiştir: Neisseria meningitidis:.Haemophilus influenzae:.Streptococcus pneumoniae:.7 günLyme horreliosis^Çocuk ve yetişkinlerde, 14 gün boyunca günde tek doz olarak 50 mg/kg ile en fazla 2 g arasında uygulanır.Gonore: Gonore (penisilinaz üreten ve üretmeyen suşlar) tedavisinde i.m. olarak 250 mg tek doz VİKİSEF önerilir. Bu belge
Preoperatif profilaksi: Enfeksiyon riskine bağlı olarak operasyondan 30-90 dakika önce 1-2 g'lık tek doz VİKİSEF uygulaması önerilir. Kolorektal cerrahide, VİKİSEF'in tek başına veyaornidazol gibi 5-nitroimidazol türevinin birlikte (ayrı ayrı verilerek) uygulanmasının etkiliolduğu kanıtlanmıştır. Uygulama şekli :VİKİSEF çözeltisi hazırlandıktan hemen sonra kullanılmalıdır. İntravenöz enjeksiyon: IV enjeksiyon için, VİKİSEF 0.5 g 5 ml, VİKİSEF 1 g ise 10 ml steril enjeksiyonluk suda çözünür. İntravenöz uygulama 2-4 dakika içinde gerçekleştirilmelidir. İntravenöz infüzyon: İnfüzyon en az 30 dakika süreyle verilmelidir. İntravenöz infüzyon için, 2 g VİKİSEF aşağıdaki kalsiyum içermeyen çözeltilerden birinde 40 ml'de çözülür: %0,9 NaCl %5 dekstroz%10 dekstroz%5 dekstroz + %0,9 NaCl%5 dekstroz + %0,45 NaCl%6 hidroksietil nişasta VİKİSEF çözeltileri muhtemel geçimsizliklerden dolayı diğer antimikrobiyal ilaçları içeren çözeltilerle veya yukarıda listenenlerden farklı çözücülerle karıştırılmamalıdır. Çökelti oluşabileceğinden; VİKİSEF flakonları sulandırmak veya sulandırılmış bir flakonu IV uygulama için seyreltmek üzere Ringer çözeltisi veya Hartmann çözeltisi gibi kalsiyum içerençözücüler kullanılmamalıdır. Ayrıca, VİKİSEF aynı IV uygulama hattında kalsiyum içerençözeltilerle karıştırıldığında da seftriakson-kalsiyum çökeltisi meydana gelebilir. VİKİSEF birY-bölgesinden parenteral beslenme gibi sürekli kalsiyum içeren infüzyonlar da dahil olmaküzere eş zamanlı olarak kalsiyum içeren IV çözeltilerle birlikte uygulanmamalıdır. Ancak,neonatlar dışındaki hastalarda, VİKİSEF ve kalsiyum içeren çözeltiler infüzyonlar arasındainfüzyon hatlarının uygun bir sıvıyla çok iyi yıkanması şartı ile, birbirinin ardından sıralıolarak uygulanabilir. Özel popülasyonlara ilişkin ek bilgiler :Böbrek/Karaciğer yetmezliği :Sadece böbrek fonksiyon bozukluğu olan, karaciğer fonksiyonları normal hastalarda VİKİSEF dozunu azaltmaya gerek yoktur. Ancak preterminal safhada böbrek yetmezliği Bu bej^eBelge Dcolaalarda(krealinjınzktereftsi <i05ml/dakika) ViKiSER¦£dozMrgüftde//2^g'kıaşmam»lıduf-tiSadecekaraciğer hasarı olan, böbrek fonksiyonları normal hastalarda VİKİSEF dozunu azaltmaya gerek yoktur. Ciddi böbrek ve karaciğer fonksiyon bozukluklarının bir arada görüldüğü vakalarda, seftriakson plazma konsantrasyonları düzenli olarak kontrol edilmeli ve gerektiğinde dozayarlaması yapılmalıdır. Diyalize alınan hastalara diyaliz sonrasında supleman olarak ilavedozlara gerek yoktur. Ancak bu hastalarda eliminasyon oranı değişmiş olabileceğinden, dozayarlamasının gerekli olup olmadığını belirlemek için serum konsantrasyonları kontroledilmelidir. Pediyatrik popülasyon :Yenidoğan, bebek ve 12 yaşından küçük çocuklarda: Aşağıda belirtilen doz şeması günde tek dozda uygulanır. Yenidoğanlar (14 günlüğe kadar): Günde tek doz 20-50 mg/kg vücut ağırlığı; günlük doz 50 mg/kg'ı aşmamalıdır. Prematüre ve matür bebekler için farklı uygulama gerekli değildir. Seftriakson ve intravenöz kalsiyum içeren ürünlerin eş zamanlı olarak yenidoğanlarda (<28 gün) kullanımı kontrendikedir. Kalsiyum içeren intravenöz ürünleri kullanan (veya buürünleri kullanması beklenen) yenidoğanlarda VİKİSEF kullanılmamalıdır (Bkz. Bölüm 4.3.Kontrendikasyonlar). Bebek ve çocuklar (15 günlükten 12 yaşına kadar): Günde tek doz 20-80 mg/kg. Vücut ağırlığı 50 kg veya üstünde olan normal çocuklarda normal yetişkin dozu kullanılmalıdır. Akut bakteriyel komplike olmayan otitis media tedavisi için 50 mg/kgdozunda (1g'ı aşmamak koşuluyla) tek uygulama önerilmektedir (single-shot therapy). Geriyatrik popülasyon :Geriyatrik hastalarda, yetişkinler için önerilen dozlar kullanılır. 4.3. KontrendikasyonlarVİKİSEF, sefalosporin sınıfı antibiyotiklere karşı aşırı hassasiyeti olan hastalarda kontrendikedir. Penisiline karşı aşırı hassas hastalarda çapraz alerjik reaksiyonların görülebileceği unutulmamalıdır. , ,ıı. ı ¦ı ¦.
Seftriakson veya ilacın içerdiği diğer yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda VİKİSEF kullanımı kontrendikedir. Hiperbilirubinemili yenidoğanlar ve prematüre yenidoğanlar seftriakson ile tedavi edilmemelidir. In-vitroçalışmalar seftriaksonun bilirubini serum albumininden ayırabildiğinive bu hastalarda bilirubin ensefalopatisi gelişebileceğini göstermiştir.Seftriakson ve intravenöz kalsiyum içeren ürünlerin eş zamanlı olarak yenidoğanlarda (<28 gün) kullanımı kontrendikedir. Kalsiyum içeren intravenöz ürünleri kullanan (veya buürünleri kullanması beklenen) yenidoğanlarda seftriakson kullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriDiğer sefalosporinlerde olduğu gibi, sefalosporinlere karşı alerjisi olduğu bilinmeyen ya da daha önceden alerjik reaksiyon geçirmeyen kişilerde dahi ölümcül olabilen anafilaktikreaksiyonlar bildirilmiştir. VİKİSEF gibi sefalosporin sınıfı antibakteriyel ilaç kullanan çocuk ve yetişkin hastalarda immün-sistem aracılı hemolitik anemi olguları gözlenmiştir. Seftriakson tedavisi sırasında anemi görülürse sefalosporine bağlı anemi tanısı göz önünde bulundurulmalıdır ve hastalığın etiyolojisi tespit edilene kadar tedavi durdurulmalıdır. Clostridium difficile-kaynaklıC. diffıcildninC. difficile,C. diffıcile'inC. dijfıcile'yeC. difficiletedavisi ve cerrahideğerlendirme yapılmalıdır.Antibiyotik ilişkili diyare, kolit veya psödomembranöz vakaları seftriakson kullanımında bildirilmiştir. Ciddi veya kanlı diyare görüldüğünde tedavi sonlandırılmalıdır. Gastrointestinalbir hastalığı olan veya daha önce kolit hikayesi olan hastalarda dikkatli olunmalıdır. Diğer
sefalosporinlerde gözlendiği gibi seftriaksonun uzun süre kullanılması duyarlı olmayan organizmaların (EnterococcusCandidatürleri gibi) gelişmesine yol açabilir.Mevcut bilimsel veriler, seftriakson veya kalsiyum içeren çözeltilerle veya diğer kalsiyum içeren ürünlerle tedavi edilen neonatlar haricindeki hastalarda herhangi bir intravaskülerçökelti bildirimi olmadığını göstermektedir. Ancak, seftriakson farklı infüzyon yollarındanolsa dahi hiçbir hastaya kalsiyum içeren çözeltilerle birlikte veya bunlarla karıştırılarakverilmemelidir (Bkz. 4.3. Kontrendikasyonlar). Diğer antibakteriyel ilaçlarda olduğu gibi, duyarlı olmayan mikroorganizmaların neden olduğu süper enfeksiyonlarla karşılaşılabilinir. Önerilenden daha yüksek doz uygulanan vakalarda, safra kesesi ultrasonografisinde safra taşını düşündüren gölgeler belirlenmiştir. Bu gölgeler seftriakson sodyum tedavisinintamamlanması veya ara verilmesi sonucu kaybolan kalsiyum seftriakson çökeltileridir. Bubulgulara, nadiren semptomlar da eşlik edebilir. Semptomatik vakalarda, cerrahi olmayan,konservatif tedavi önerilmektedir. Semptomatik vakalarda VİKİSEF tedavisinin sonlandırılmasına hekim karar verir. Seftriakson sodyum ile tedavi gören hastalarda safra tıkanmasına bağlı olması muhtemel pankreatit vakaları nadiren bildirilmiştir. Hastaların çoğunda, daha önceden uygulanmış majörbir tedavi, şiddetli hastalık ve tam parenteral beslenme gibi safra stazı ve safra tortusu gibidurumlar oluşturabilecek risk faktörleri bulunmakta idi. Safra çökmesiyle ilgili olarak,VİKİSEF'in başlangıç etkisi yaratıcı veya kofaktör rolü gözardı edilmemelidir. Yenidoğan, bebek ve çocuklarda VİKİSEF'in güvenilirliği ve etkinliği Kullanım Şekli ve Dozu bölümünde açıklanan dozlarla belirlenmiştir. Çalışmalar, diğer sefalosporinlerinolduğu gibi, seftriaksonun da bilirubini serum albümininden ayırabildiğini göstermiştir. Bunedenle hiperbilirubinemili yenidoğanların VİKİSEF ile tedavisi sırasında bu noktaya dikkatedilmelidir. Bilirubin ensefalopatisi gelişme riski bulunan yenidoğanlarda (özellikleprematürelerde) VİKİSEF kullanılmamalıdır. Uzun süreli tedavilerde kan tablosu düzenliolarak kontrol edilmelidir. Duyarlı kişilerde aşırı duyarlılık reaksiyonları gelişebilir. Tanı testleri üzerindeki etkisi: VİKİSEF tedavisi gören hastalarda Coombs testi nadiren de olsa yalancı pozitiflik verebilir. Diğer antibiyotiklerde olduğu gibi VİKİSEF de galaktozemi testinde yalancı pozitif sonucaneden olabilir. Benzer şekilde, idrarda glikoz tayini için kullanılan enzimatik olmayantestlerde de yalancı pozitif sonuç alınabilir. Bu nedenle, VİKİSEF tedavisi sırasında idrardaglikoz tayini enzimatik testlerle yapılmalıdır. Pediyatri: Term ve preterm bebeklerin akciğer ve böbreklerinde ölümcül olan seftriakson-kalsiyum çökeltileri bildirilmiştir. 28 günden büyük hastalarda seftriakson ve kalsiyum içeren ürünlerardışık olarak kullanılabilir. Bu durumda infüzyon yolu uygun sıvılar verilerek iyice yıkanmalıdır. Seftriakson hiçbir yaş grubunda intravenöz kalsiyum içeren solüsyonlarla aynı anda bir Y-seti kullanılarakverilmemelidir. Seftriakson Ringer ve Hartmann solusyonu gibi kalsiyum içeren solüsyonlarlaveya kalsiyum içeren parenteral beslenme solüsyonu ile sulandırılmamalı veyakarıştırılmamalıdır. İntravenöz seftriakson ve oral kalsiyum içeren ürünler arasında veyaintramüsküler seftriakson ile intravenöz veya oral kalsiyum içeren arasındaki etkileşimkonusunda henüz yeterli bilgi bulunmamaktadır. Bu tıbbi ürün her bir flakonda 82,95 mg sodyum ihtiva eder. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriŞimdiye kadar, yüksek doz seftriakson sodyum ile güçlü diüretiklerin (örneğin, furosemid) aynı anda uygulanması sonucu herhangi bir böbrek fonksiyon bozukluğuna rastlanmamıştır.seftriakson sodyumun, aminoglikozitlerin renal toksisitesini artırdığına ilişkin bir bulguyoktur. Seftriakson sodyum uygulamasının ardından alkol alındığında disülfiram benzeri etkiler gözlenmemiştir. Seftriaksonun kimyasal yapısında diğer bazı sefalosporinlerde bulunan, etanol intoleransı ve kanama sorunlarına neden olabilen N-metiltiotetrazol bulunmaz. VİKİSEF eliminasyonu probenesid ile etkilenmez. In-vitrobir çalışmada, kloramfenikol ve seftriakson kombinasyonunun antagonist etki gösterdiği saptanmıştır.Literatür raporlarına göre, seftriakson; amsakrin, vankomisin, flukonazol ve aminoglikozitlerle geçimsizdir. Çökelti oluşabileceğinden; VİKİSEF flakonları sulandırmak veya sulandırılmış bir flakonu IV uygulama için seyreltmek üzere Ringer çözeltisi veya Hartmann çözeltisi gibi kalsiyum içeren
çözücüler kullanılmamalıdır. Ayrıca, VİKİSEF aynı IV uygulama hattında kalsiyum içeren çözeltilerle karıştırıldığında da seftriakson-kalsiyum çökeltisi meydana gelebilir. VİKİSEF birY-bölgesinden parenteral beslenme gibi sürekli kalsiyum içeren infüzyonlar da dahil olmaküzere eş zamanlı olarak kalsiyum içeren IV çözeltilerle birlikte uygulanmamalıdır. Ancak,neonatlar dışındaki hastalarda, VİKİSEF ve kalsiyum içeren çözeltiler infüzyonlar arasındainfüzyon hatlarının uygun bir sıvıyla çok iyi yıkanması şartı ile, birbirinin ardından sıralıolarak uygulanabilir. VİKİSEF tedavisi gören hastalarda Coombs testi nadiren de olsa yalancı pozitiflik verebilir. Diğer antibiyotiklerde olduğu gibi VİKİSEF de galaktozemi testinde yalancı pozitif sonucaneden olabilir. Benzer şekilde, idrarda glikoz tayini için kullanılan enzimatik olmayantestlerde de yalancı pozitif sonuç alınabilir. Bu nedenle, VİKİSEF tedavisi sırasında idrardaglikoz tayini enzimatik testlerle yapılmalıdır. Seftriakson, hormonal kontraseptiflerin etkinliğini istenmeyen biçimde etkileyebilir. Sonuç olarak, tedavi sırasında veya tedaviyi takip eden ilk ay destekleyici ve hormonal olmayan ekkontraseptif yöntemlerin kullanılması önerilmelidir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi B'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda seftriakson sodyum kullanımına ilişkin klinik veri mevcut değildir. Ancak, seftriaksonun hormonal kontraseptif ilaçların etkinliği üzerinde ters etki gösterme olasılığı bulunmaktadır. Bu nedenle, hastalara seftriakson tedavisi sırasında veya tedaviyitakip eden ilk ay destekleyici ve hormonal olmayan kontraseptif yöntemlerin kullanılmasıönerilmelidir. Gebelik dönemiSeftriakson plasenta engelini aşar. İnsanda gebelikte kullanımının güvenliliği henüz kesinleşmemiştir. Hayvanlarda yürütülen üreme çalışmaları embriyotoksisite, fetotoksisite,teratojenisite veya doğumda, perinatal ve postnatal gelişimde erkek veya dişi fertilitesindeolumsuz etkiler göstermemiştir. Primatlarda embriyotoksisite veya teratojenisitegözlenmemiştir. Gebe kadınlara verilirken tedbirli olunmalıdır. Laktasyon dönemiSeftriakson anne sütüne küçük miktarlarda da olsa geçtiği için, emziren annelerde bu durumun göz önünde bulundurulması önerilmektedir. Üreme yeteneği / Fertiliteİntravenöz yolla uygulanan ve 586 mg/kg/gün'e kadar olan seftriakson dozu sıçanlarda üreme yeteneğini bozmamıştır. 4.7. Araç ve makine kullanımı üzerindeki etkilerKişinin motorlu taşıt ve makine kullanma yetisi üzerinde olumsuz etkisi olduğuna dair bir veri bulunmamaktadır. Seftriakson sodyum, bazen sersemlik veya baş dönmesine yol açabildiğiiçin motorlu taşıt kullanımını veya makine kullanımını etkileyebilir. 4.8. İstenmeyen etkilerÇok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Seftriakson sodyum kullanımı sırasında kendiliğinden veya ilacın kesilmesiyle ortadan kalktığı gözlenen yan etkiler aşağıda belirtilmiştir. Enfeksiyonlar ve enfestasyonlarSeyrek: Genital bölgede mikoz Değişik bölgelerde maya, mantar veya diğer dirençli organizmalarla görülen süperenfeksiyonlar. Kan ve lenf sistemi hastalıklarıSeyrek: Nötropeni, eozinofili, lökopeni, granülositopeni, hemolitik anemiyi de içeren anemi, trombositopeni, protrombin zamanında hafif uzama. Çok seyrek: Koagülasyon bozuklukları Çoğunluğu 10 günlük tedavi sonucunda ve toplam 20 g veya daha yüksek dozların uygulanmasından sonra bazı çok seyrek agranülositoz vakaları (< 500/mm3) bildirilmiştir. Bağışıklık sistemi hastalıklarıSeyrek: Baş ağrısı ve baş dönmesi Gastrointestinal hastalıklarıYaygın: Yumuşak dışkı ya da ishal, bulantı, kusma Seyrek: Stomatit ve glossit. Bu yan etkiler genellikle hafiftir ve tedavi sırasında veya tedavinin sonlanmasının ardından çoğunlukla kaybolurlar. Çok seyrek (izole vakalar): Psödomembranöz kolit (çoğunlukla Clostridium diffıcildninHepato-biliyer hastalıklarSeyrek: Karaciğer enzimlerinde artış (AST, ALT, alkalin fosfataz) Özellikle önerilen standart dozun üzerinde ilaç alan kişilerde seftriakson-kalsiyum tuzu çökelmesi gözlemlenmiştir. Prospektif çalışmalar, çocuklarda i.v. uygulama ile çökelmeinsidansında değişkenlik göstermiştir ve yavaş infüzyon yöntemi ile (20-30 dk.) çökelmeinsidansının azalması beklenmektedir. Genelde asemptomatik olan bu olaya nadiren ağrı,bulantı, kusma gibi klinik semptomlar da eşlik etmiştir. Seftriakson tedavisisonlandırıldığında çökelme ortadan kalkmaktadır. Deri ve deri altı doku hastalıklarıYaygın olmayan: Makülopapülar raş, ekzantem gibi alerjik deri reaksiyonları veya alerjik dermatit, kaşıntı, ürtiker, ödem. Çok seyrek: İzole vakalarda, eritema multiforme, Stevens Johnson sendromu veya Lyell's sendromu / toksik epidermal nekroliz Böbrek ve idrar hastalıklarıSeyrek: Serum kreatininde artış, oligüri, glikozüri, hematüri. Çok seyrek: İzole raporlarda, çoğunluğu 3 yaşından büyük, yüksek doz (örn. >80mg/kg/gün) veya toplam 10 g'ı aşan dozlarda tedavi gören ve diğer risk faktörlerini gösteren (örn. sıvıkısıtlamaları, yatağa bağımlılık, vs) çocuklarda renal presipitasyon bildirilmiştir. Ancak, ilaçkesildiği taktirde presipitasyon ortadan kalkar. Bu olaya böbrek yetmezliği ve anürinin eşlikettiği gözlenmiştir.
Seyrek: Ateş, rigor, flebit ve i.v. uygulamaya bağlı olarak enjeksiyon bölgesinde ağrı. Ağrı, en az 2-4 dk. sürede ve yavaş enjeksiyon uygulaması ile minimum düzeye indirilebilir. Lidokain çözeltisi olmadan intramüsküler enjeksiyon ağrılıdır. Araştırmalar:Kalsiyum ile etkileşim Şüpheli advers reaksiyonların raporlanması: Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiDoz aşımında, bulantı, kusma veya diyare görülebilir. İlaç konsantrasyonu hemodiyaliz veya periton diyaliziyle azaltılamaz. Spesifik bir antidot bulunmamaktadır. Doz aşımı tedavisisemptomatik olmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diğer beta-laktam antibakteriyal ilaçlar- Sefalosporinler (3. Kuşak) ATC kodu: J01DD04 Seftriakson, hücre duvarı sentezini inhibe ederek bakterisid etki gösterir. Seftriakson, gram-negatif ve gram-pozitif mikroorganizmaların büyük bir kısmında in-vitroin-vitrove klinik enfeksiyonlarda etkilidir (Bkz. Bölüm 4.1. Endikasyonlar).Gram-pozitif aeroblar: ¦ Metisiline duyarlı Staphylococcus aureus^¦ Metisiline duyarlı koagülaz-negatif stafilokoklar1 (S. epidermisgibi)¦ Streptococcuspyogenes(A grubu, P-hemolitik)¦ Streptococcus agalastiae(BvgrubuirP-hiiffloUıtik^anmıştır.Belge DoBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys¦ P-hemolitik streptokoklar (A ve B grubuna dahil olmayan) ¦ Streptococcus viridans^¦ Streptococcus bovis¦ Streptococcus pneumoniae^1: Hem in-vitroin-vivoolarak seftriaksona duyarlılık göstermiş olan türlerNot: Metisiline dirençli koagülaz negatif StaphylococcusEnterococcus faecalis, EnterococcusfaeciumListeria monocytogenesde dirençlidir.Metisiline dirençli koagülaz negatif Staphylococcusepidermidisgibi) doğal olarak dirençli organizmalardır.Gram-negatif aeroblar: +Acinetobacter(Acinetobacter lwofji, Acinetobacter anitratusA. baumanii]*, Acinetobacter calcoaceticus)'1Aeromonas hydrophilaAlcaligenes faecalisAlcaligenes odoransAlcaligenesbenzeri türleriBorrelia burgdorferiCapnocytophagatürleriCitrobacter(Citrobacter diversus [C. amalonaticusCitrobacter freundii**')Escherichia coli^+Enterobacter aerogenes^*+Enterobacter cloacae^*+Enterobactertürleri (diğer)1 *Haemophilus ducreyiHaemophilus influenzae (beta-laktamazpozitif izolatları1 dahil),Haemophilus parainfluenzae^Hafnia alveiKlebsiella(Klebsiella oxytoca, Klebsiellapneumoniae**)Moraxella catarrhalis^ (Branhamella catarrhalis)Moraxella osloensis Moraxellatürleri (diğer)Morganella morganii1Neisseria gonorrhoSa1ffen^s'lÇnidlrenöti4zolatla¥¥),'Şt'-
Neisseria meningitidis^Pasteurella multocida Plesiomonas shigelloidesProteus(Proteus mirabilis^, Proteuspenneri*, Proteus vulgaris1*) Pseudomonas fluorescens**) Pseudomonas fluorescens*Pseudomonastürleri (diğer)*Providentia rettgeri*Providentia türleri(diğer)Salmonella typhiSalmonellatürleri (tifoid olmayan)Serratia(Serratia marsescens*)Serratiatürleri (diğer)*ShigellaVibrioYersinia enterocoliticaYersiniatürleri (diğer)1: Hem in-vitroin-vivoolarak seftriaksona duyarlılık göstermiş olan türler* Bu türlerin izole edilen bazı suşları, özellikle kromozomal P-laktamaz üreterek seftriaksona direnç göstermektedir. ** Bu türlerin izole edilen bazı suşları, özellikle genişletilmiş spektrumlu ve plazmide bağlı P-laktamaz üreterek seftriaksona direnç göstermektedir. +: Bir veya birden fazla Avrupa Birliği bölgesinde yüksek direnç oranlarının gözlendiği türler, mikroorganizmaların duyarlı olup olmama olasılığı konusunda tahmini bir kılavuz niteliğitaşımaktadır. Not: Yukarıdaki organizmaların, amino- ve üreido- penisilinler, eski sefalosporinler ve aminoglikozitler gibi diğer antibiyotiklere karşı multipl direnç gösteren birçok suşu,seftriaksona duyarlıdır. Treponema pallidum, in-vitroP. aeruginosa+Listeriamonocytogenes,Mycoplasmatürleri,Stenotrophomanas maltophilia, Ureplasma urealyticum, Chlamydiatürleri de seftriaksona doğal olarak dirençli organizmalardır.Anaerob organizmalar: Bacteroidestürleri (safraya duyarlı)*,Clostridium(C. difficilegrubu hariç),Fusobacterium nucleatum,Fusobacteriumtürleri (diğer),Gaffkia anaerobica (peptococcus),Peptostreptococcusin-vitroin-vivoolarak seftriaksona duyarlılık göstermiş olan türler* Bu türlerin izole edilen bazı suşları, P-laktamaz üreterek seftriaksona direnç göstermektedir. Not: P-laktamaz üreten BacteroidesB. fragilis)Clostridium difficiledirençlidir.Sınır değerleri:Seftriaksona duyarlılık tayini, disk difüzyon testi, agar veya besiyeri dilüsyon testi gibi, National Committee for Clinical Laboratory Standards (NCCLS) (Klinik LaboratuvarStandartları Ulusal Komitesi) tarafından önerilen standart teknikler kullanılarak yapılabilir.Aşağıdaki seftriakson duyarlılık kriterleri NCCLS tarafından bildirilmiştir: 30 mg/l'lık ilaç konsantrasyonu kullanılarak bildirilen değerler mg/l (MIC testi) veya mm'dir (disk difüzyon testi). Klinik Laboratuvar Standartları Ulusal Komitesi (NCCLS)-(M100-S12)
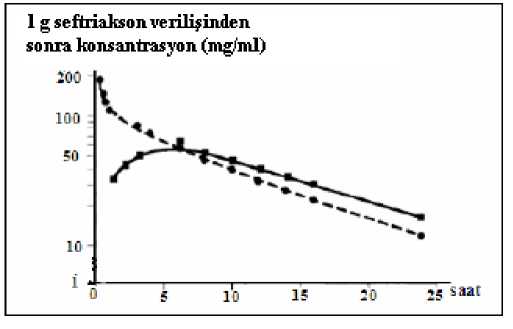
* 2002 S. pneumoniaesınır değerleri (NCCLS M100-S12), non-menenjit örnekler için <1 (Duyarlı), 2 (Orta derece) ve >4 (Dirençli) olarak ve menenjit örnekleri için >0.5 (Duyarlı), 1(Orta derece) ve > 2 (Dirençli) olarak belirlenmiştir.** 2002 Streptococcus viridansgrubu sınır değerleri (NCCLS M100-S12) <1 (Duyarlı), 2 (Orta derece) ve >4 (Dirençli) olarak belirlenmiştir.Duyarlılık testleri seftriakson diskleri ile yapılmalıdır, çünkü sefalosporin sınıfı disklerle yapılan in-vitro5.2. Farmakokinetik özelliklerGenel özelliklerEmilim: İntramüsküler, tek doz 1 g'lık uygulamadan sonraki 2-3 saat içinde ulaşılan maksimum plazma konsantrasyonu 81 mg/l'dir.Bolus intravenöz enjeksiyondan sonra ortalama pik konsantrasyonlar, 500 mg'lık dozu takiben yaklaşık olarak 120 mg/l ve 1 gramlık dozu takiben yaklaşık olarak 200 mg/l'dir; 30 dakikalık 2 gramlık infüzyondan sonra ortalama 250mg/l'lık düzeyler elde edilir. %1'lik lidokain hidroklorür çözeltisi ile hazırlanmış 500 mg VİKİSEF IM'nin intramüsküler enjeksiyonu, 1 saat içinde 40-70 mg/l'lık ortalama pik plazma konsantrasyonları oluşturur.İntramüsküler enjeksiyondan sonra biyoyararlanım %100'dür. Dağılım: Seftriaksonun dağılım hacmi 7-12 l'dir. Seftriakson 1-2 g'lık dozdan sonra akciğer, kalp, safra yolu/karaciğer, tonsillalar, orta kulak ve nazal mukoza, kemik, serebrospinal,plevra, prostat ve sinovyal sıvıların da dahil olduğu 60'ın üzerinde doku ve vücut sıvısında,etken patojenlerin çoğunun minimum inhibisyon konsantrasyonunun üzerinde ve 24 saattenuzun sürelerle mükemmel penetrasyon sağlamaktadır.İntravenöz uygulamada, seftriakson interstisyel sıvıya süratle difüze olur ve duyarlı organizmalara karşı 24 saat süren bakterisid konsantrasyonlar sağlanır (şekle bakınız). VİKİSEF'in farmakokinetiği, büyük ölçüde konsantrasyona bağlı olarak serum albüminine bağlanması ile belirlenir. İnsanda ilacın plazmada serbest (bağlı olmayan) fraksiyonu,terapötik konsantrasyon aralığının çoğu için yaklaşık olarak %5'tir ve 300 mg/l'likkonsantrasyonlarda %15'e yükselir. Seftriakson albümine geri dönüşümlü olarak bağlanır ve bağlanma oranı ilacın kandaki konsantrasyonu yükseldikçe azalır; örneğin, 100 mg/l'den düşük plazma konsantrasyonlarında%95, 300 mg/l'lik plazma konsantrasyonlarında ise %85 bağlanma görülür. Düşük albüminmiktarına bağlı olarak interstisyel sıvıdaki serbest seftriakson oranı plazmadakine göre dahayüksektir. Seftriakson, yenidoğan, bebek ve çocuklarda enflamasyonlu meninkslere penetre olur. Bebek ve çocuklarda 50-100 mg/kg i.v. VİKİSEF enjeksiyonunu izleyen 24 saat içinde,serebrospinal sıvıda seftriakson konsantrasyonu 1.4 mg/l'nin üstündedir. Serebrospinal sıvıdaortalama 18 mg/l olan doruk konsantrasyona i.v. enjeksiyondan yaklaşık 4 saat sonra ulaşılır.Ortalama serebrospinal sıvı düzeyleri, bakteriyel menenjitte plazma konsantrasyonunun%17'si, aseptik menenjitte ise %4'ü kadardır. Menenjitli erişkinlerde 50 mg/kg'lıkuygulamayla 2-24 saat süreyle elde edilen serebrospinal sıvı konsantrasyonları, menenjitte ensık rastlanan etken patojenlerin MİK değerlerinin birkaç kat üzerindedir. Seftriakson plasentadan geçer ve anne sütünde düşük konsantrasyonlarda bulunur. Biyotransformasyon: Seftriakson sistematik olarak metabolize edilmez, fakat bağırsak florasıtarafından inaktif metabolitlere dönüştürülür.Eliminasyon: VİKİSEF esas olarak değişmeden atılır. Seftriaksonun %50-60'ı değişmemiş olarak idrarla (tamamına yakını glomerüler filtrasyon ile), %40-50'si ise değişmemiş olaraksafrayla ve bağırsaklarla atılır.Seftriaksonun total plazma klerensi 10-22 ml/dakika'dır. Renal klerens 5-12 ml/dakikadır. Yetişkinlerde eliminasyon yarı-ömrü yaklaşık 8 saattir ve yarı ömür, doz, uygulama yolu veya tekrarlanan uygulamalardan büyük ölçüde etkilenmez. Doğrusallık/doğrusal olmayan durum: Seftriaksonun farmakokinetiği lineer değildir. Toplam ilaç konsantrasyonu bazında eliminasyon yarı-ömrü hariç, tüm temel farmakokinetikBelge Dc^gıJ.gijij^gç^gj^\^^^^^^l^^^^^k0ZW56RG83ZW56 Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysHastalardaki karakteristik özellikler:Yaşlı hastalar: 75 yaşın üstündeki yaşlı hastalarda ortalama eliminasyon yarı ömrü genç yetişkinlerle karşılaştırıldığında genellikle 2-3 kez daha uzundur. Tüm sefalosporinlerdeolduğu gibi, yaşlı hastalarda böbrek fonksiyonundaki azalma, yarı ömürde uzamaya yolaçabilir. Ancak, seftriaksonla ilgili bugüne kadar toplanan bulgular, doz rejiminde değişiklikyapılmasının gerekli olmadığını göstermektedir.Yenidoğanlar: Yenidoğanlarda ilk hafta dozun % 80'i idrarla atılır. Sekiz günlükten küçük bebeklerde ortalama eliminasyon yarı-ömrü genç erişkinlerle karşılaştırıldığında 2-3 kez dahauzundur.Böbrek ve karaciğer yetmezliği olan hastalar: Böbrek veya karaciğer yetmezliği olan hastalarda, seftriaksonun farmakokinetik özelliklerinde çok az değişiklik gözlenir veeliminasyon yarı ömrü hafif düzeyde uzar. Tek başına böbrek fonksiyonlarında bozuklukvarsa seftriaksonun safra yoluyla atılımı ve tek başına karaciğer fonksiyonlarında bozuklukvarsa böbrek yoluyla atılımı artar.Beyin omurilik sıvısı: VİKİSEF enflamasyonlu ve enflamasyonsuz meninkslerden geçer (eş zamanlı plazma konsantrasyonunun %4-17'si düzeyinde bir konsantrasyona ulaşır). 5.3. Klinik öncesi güvenlilik verileriİnsanlarda üreme çalışmaları embriyotoksisite, fetotoksisite, teratojenisite veya doğumda, perinatal ve postnatal gelişimde erkek veya dişi fertilitesinde olumsuz etkiler göstermemiştir.Primatlarda embriyotoksisite veya teratojenisite gözlenmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiÇözücü ampul: Enjeksiyonluk su 6.2. GeçimsizliklerSeftriakson içeren çözeltiler, diğer ilaçları içeren çözeltilerle veya bölüm 6.6'da Üstelenenlerden farklı çözücülerle karıştırılmamalıdır. Özellikle, kalsiyum içeren seyrelticiler (örneğin Ringer çözeltisi veya Hartman çözeltisi) seftriakson flakonlarını rekonstitüe etmek için veya rekonstitüe edilmiş bir flakonu IVuygulama için daha fazla seyreltmek için kullanılmamalıdır, çünkü çökelti oluşabilir. Seftriakson ve kalsiyum içe5eftıçözeliileSefea5tşt^ılmaffialıveyra aynı anda uygulanmamalıdır.
Literatür verilerine göre seftriakson; amsakrin, vankomisin, flukonazol, aminogliklozidler ve labetolol ile geçimsizdir. 6.3. Raf ömrüAçılmamış flakon: 36 ay Rekonstitüsyondan veya rekonstitüsyon ve dilüsyondan sonra, 25°C'nin altındaki oda sıcaklığında 24 saat, buzdolabında (2 - 8°C) 72 saat süreyle fiziksel ve kimyasal stabilitesinikorur. Mikrobiyolojik açıdan hazırlanan çözeltilerin bekletilmeden kullanılması önerilir. Eğer kullanılmayacaksa saklama koşulları ve süresi kullanıcının sorumluluğundadır. 6.4. Saklamaya yönelik özel tedbirlerAçılmamış flakon: 25°C'nin altında ışıktan koruyarak ambalajında saklanmalıdır. 6.5. Ambalajın niteliği ve içeriğiHer bir karton kutu; enjeksiyonluk çözelti tozu içeren 1 adet flakon ve 1 adet çözücü ampul içermektedir. Flakon: Aluminyum flip-off kapak ve bromobutil kauçuk tıpa ile kapatılmış renksiz, 15 ml hacminde, cam flakonlar (Tip III) Çözücü ampul: 10 ml enjeksiyonluk su içeren renksiz, halkalı, cam ampul (Tip I). 6.6. Beşeri tıbbi ürünlerden arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da artık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. Parenteral solüsyonun hazırlanması:Parenteral yoldan kullanılacak ilaçlar, rekonstitüsyondan sonra iyice çalkalanmalı ve uygulanmadan önce gözle incelenerek partiküler madde içermediğinden emin olunmalıdır.Hazırlanan çözeltide partikül bulunuyorsa kullanılmamalıdır. Hazırlanan çözeltilerin renkleri konsantrasyon ve saklama sürelerine bağlı olarak açık sarı ile bal rengi arasında değişir. Renkteki değişiklikler ilacın aktivitesini ve güvenliliğini etkilemez. İntravenöz uygulama-İntravenöz enjeksiyon : VİKİSEF 1 g IV, 10 ml steril enjeksiyonluk suda çözündürüldükten sonra 2-4 dakika içinde yavaş olarak damara (ya da parenteral sıvı tedavisi gören hastalardadamar yakınında lateks tübe) enjekte edilir. -İntravenöz infüzyon : İntravenöz infüzyonun süresi en az 30 dakika olmalıdır. VİKİSEF 1 g IV, infüzyon olarak kullanılacağı zaman; önce 10 ml enjeksiyonluk suyla çözülür, daha sonra,aşağıda belirtilen infüzyon çözeltileri ile 10 mg/ml - 40 mg/ml arasındaki konsantrasyonakadar seyreltilmesi önerilir. %0,9 NaCl %5 dekstroz%10 dekstroz%5 dekstroz + %0,9 NaCl%5 dekstroz + %0,45 NaCl%6 hidroksietil nişasta Yukarıda belirtilen infüzyon çözeltileri ile seyreltilerek hazırlanan çözeltiler, 25°C'nin altındaki oda sıcaklığında 24 saat, buzdolabında (2 - 8°C) 72 saat süreyle fiziksel ve kimyasalstabilitesini korur. Mikrobiyolojik açıdan hazırlanan çözeltilerin bekletilmeden kullanılması önerilir. Eğer kullanılmayacaksa saklama koşulları ve süresi kullanıcının sorumluluğundadır. 7. RUHSAT SAHİBİTürkem İlaç Sanayi ve Ticaret Anonim Şirketi Yenimahalle/Ankara Telefon: 0312 211 02 12 Faks: 0312 215 26 25 8. RUHSAT NUMARASI2022 / 8249.İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 28.12.2022 Ruhsat yenileme tarihi: |
İlaç BilgileriVikisef 1 G Iv Enjeksiyonluk/infüzyonluk Çözelti Hazırlamak İçin Toz ve ÇözücüEtken Maddesi: Seftriakson Sodyum Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.