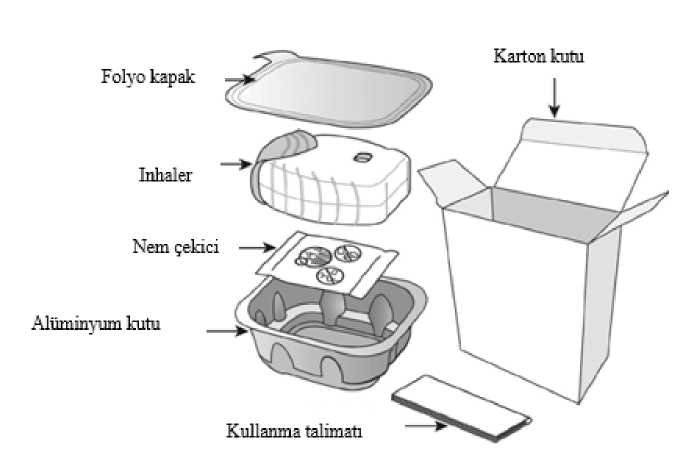
Anoro Ellipta 62,5 Mcg + 25 Mcg Kullanıma Hazır İnhalasyon Tozu Kısa Ürün BilgisiKISA URUN BILGISI^Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBİ ÜRÜNÜN ADIANORO ELLIPTA 62,5 mcg + 25 mcg kullanıma hazır inhalasyon tozu 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Uygulanan her bir doz (Ellipta İnhaler'in ağızlığından çıkan doz) 55 mikrogram umeklidinyuma eşdeğer 65 mikrogram umeklidinyum bromür ve 22 mikrogram vilanterol(trifenatat olarak) içermektedir. Bu, kullanıma hazır 62,5 mikrogram umeklidinyuma eşdeğer74,2 mikrogram umeklidinyum bromür ve 25 mikrogram vilanterole eşdeğer 40 mikrogramvilanterol trifenatat dozuna karşılık gelmektedir. Yardımcı madde:Her bir doz yaklaşık olarak 25 mg laktoz (monohidrat olarak) içerir (inek sütünden elde edilir). Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMKullanıma hazır inhalasyon tozu. Kırmızı inhaler kapağı ve dahili bir doz sayacı olan açık gri inhaler. ANORO ELLIPTA, her biri beyaz bir toz içeren 30 dozluk iki adet blister şerit içermektedir. Blister şeritlerden biri herdozda 62,5 mikrogram umeklidinyum, diğeri her dozda 25 mikrogram vilanterol içerir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarANORO ELLIPTA, erişkin kronik obstrüktif akciğer hastalarında (KOAH) görülen semptomların giderilmesine yönelik kontrol edici bir bronkodilatör tedavidir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Yetişkinler:Önerilen doz günde bir defa ANORO ELLIPTA 62,5/25 mikrogram inhalasyondur. ANORO ELLIPTA, bronkodilatasyonu muhafaza etmek için her gün, günde bir kez, günün aynı saatinde uygulanmalıdır. Maksimum doz, günde bir defa ANORO ELLIPTA 62,5/25mikrogram inhalasyondur. Uygulama şekli:ANORO ELLIPTA sadece inhalasyon yoluyla kullanılır. ANORO ELLIPTA her gün, günde bir kez, günün aynı saatinde uygulanmalıdır. ANORO ELLIPTA tek dozluk kullanıma hazır inhalasyondur. Kullanma TalimatıANORO ELLIPTA ilk kez kullanılmaya başlanıldığında düzgün çalıştığının kontrol edilmesi ve özel bir yöntemle kullanıma hazırlanması gerekmemektedir. Sadece aşağıdaki talimatlarauyulmalıdır.
İnhaler, nemi azaltmak için nem çekici bir paket içeren alüminyum kutuda paketlenmiştir. Alüminyum kutunun kapağı açıldıktan sonra nem çekici paket atılmalıdır. Nem çekici paketaçılmamalı, yutulmamalı veya teneffüs edilmemelidir. Dozu almaya hazır olana kadaralüminyum kutunun kapağı açılmamalıdır. İnhaler alüminyum kutudan çıkarıldığında, kapalı pozisyonda olacaktır. İnhalerin son kullanma tarihi etiketindeki boşluğa yazılmalıdır. İnhalerin son kullanma tarihi alüminyumkutunun açılmasından sonra 6 haftadır. Son kullanma tarihinden sonra inhalerkullanılmamalıdır. Folyo kapak açıldıktan sonra atılabilir. 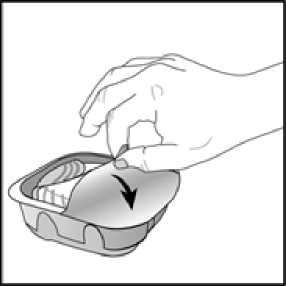  İnhaler kullanılmaya başlamadan önce aşağıdaki talimatlar okunmalıdır. Eğer ilaç inhale edilmeden, inhaler kapağı açılıp kapatılırsa, bir doz harcanmış olur.Harcanan doz inhalerin içerisinde güvenle tutulur fakat artık kullanılamaz. Bir inhalasyonda ^ belge, gtwenlLelektrpnik| İmza İle iıpzalanmıştır.yanlışlıkla ilave ilaç veya çift doz almak mümkün değildir. Doz sayacıİnhaler kapağıInhaler kapağı her açıldığında, ilaçtanbir doz hazırlanır 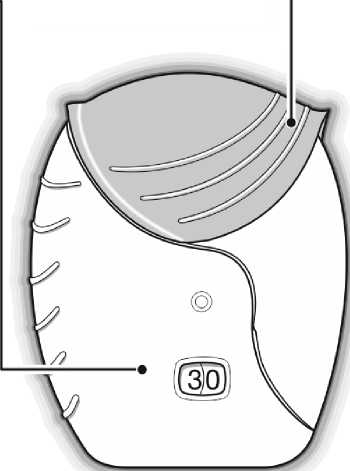 Bu sayaç, inhaler içinde kaç doz ilaç kaldığını gösterir. İnhaler kullanılmaya başlanmadan önce, tam olarak 30 dozu gösterir.İnhaler kapağı her açıldığında 1doz eksilir.10 dozdan az kaldığında,doz sayacının yarısı kırmızı olarak görünür.Son dozu kullandıktan sonra, doz sayacının yarısı kırmızı olarak görünürve 0 sayısını gösterir.Kullanım basamakları1) Dozun hazırlanması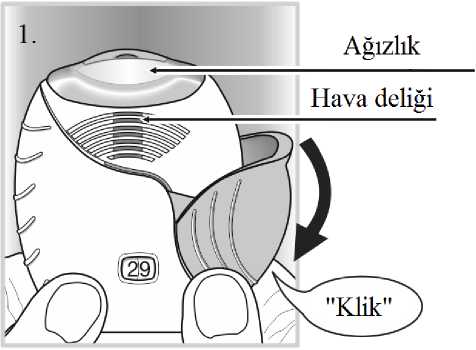 Doz alınmaya hazır olana kadarinhaler kapağı açılmamalıdır.İnhaler sallanmamalıdır. Klik sesi duyulana kadar inhalerkapağı tamamen aşağı doğrukaydırılır. Artık ilaç inhale edilmeyehazırdır. Bunu teyit etmek için dozsayacından 1doz azalır.Eğer klik sesi duyulduğundadoz sayacı bir birim eksilmezse,inhaler dozu vermeyecektir.İnhaler hiçbir zamansallanmamalıdır.2) İlacın inhale edilmesi İnhaler ağızdan uzakta tutulurkenmümkün olduğunca derin bir nefes verilir.İnhalerin içine doğru nefesverilmemelidir. Ağızlık dudakların arasına yerleştirilerekdudaklar ağızlığın çevresine sıkıcakapatılır. Hava çıkış deliği parmaklarlaengellenmemelidir. Uzun, devamlı ve derin bir nefes alınır.Bu nefes tutulabildiği kadar tutulmalıdır(en az 3-4 saniye). İnhaler ağızdan uzaklaştırılır. Yavaş ve hafif bir nefes verilir. İnhaler doğru kullanılıyor olunsa dahiilacın tadı alınmayabilir veyahissedilmeyebilir. 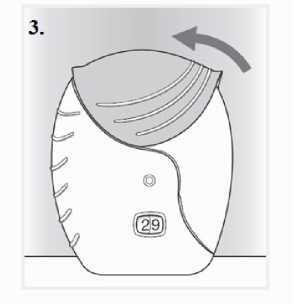 3) İnhalerin kapatılması Ağızlık temizlenmek istenirse, inhaler kapağınıkapatmadan önce kuru bir kağıt mendil kullanılır. İnhaler kapağı gidebildiği kadar yukarı doğru, ağızlığıkapayacak şekilde, kaydırılır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda dozun ayarlanması gerekli değildir (bkz. Bölüm 5.2). Karaciğer yetmezliği:Hafif ila orta şiddette karaciğer yetmezliği olan hastalar için dozun ayarlanması gerekli değildir. Şiddetli karaciğer yetmezliği olan hastalarda ANORO ELLIPTA ile herhangi bir çalışmagerçekleştirilmemiştir ve dikkatle kullanılmalıdır (bkz. Bölüm 5.2). Pediyatrik popülasyon:ANORO ELLIPTA'nın, endikasyonundan dolayı 18 yaşından küçük hastalarda kullanımı uygun değildir. Geriyatrik popülasyon:65 yaş üzeri hastalarda dozun ayarlanması gerekli değildir (bkz. Bölüm 5.2). 4.3. KontrendikasyonlarANORO ELLIPTA, Şiddetli süt proteini alerjisi bulunan hastalarda, İçeriğinde bulunan etkin madde veya bölüm 6.1'de listelenen yardımcı maddelerden 1 1 1 1Bu belse, aüvenii elektronik İmza İle İmzalanmıştır.
Belge Do lhnahangiZbirine I^rşıZmşırı(duyârİaiıiğıoüan hasta^rgdaakip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys 4.4. Özel kullanım uyarıları ve önlemleriAstımUmeklidinyum/vilanterolün astımlı hastalarda kullanımına ait çalışma bulunmadığından bu hasta popülasyonunda kullanılmamalıdır. Paradoksal bronkospazmUmeklidinyum/vilanterolün uygulanması, yaşamı tehdit edebilecek paradoksal bronkospazma yol açabilir. Paradoksal bronkospazm oluşması halinde umeklidinyum/vilanterol ile tedaviderhal kesilmelidir ve gerekirse alternatif tedavi başlatılmalıdır. Akut kullanım için değildir.Umeklidinyum/vilanterol bronkospazmın akut ataklarının tedavisi için endike değildir. Hastalığın kötüleşmesiSemptomları rahatlatmak için artan kısa etkili bronkodilatör kullanımı, kontrolün bozulduğunu göstermektedir. Umeklidinyum/vilanterol ile tedavi sırasında KOAH'ın kötüleşmesidurumunda, hastanın ve KOAH tedavi rejiminin yeniden değerlendirmesi yapılmalıdır. Kardiyovasküler etkilerUmeklidinyum/vilanterol dahil muskarinik reseptör antagonistleri ve sempatomimetik ajanların uygulanmasından sonra kardiyak aritmiler (ör. atriyal fibrilasyon ve taşikardi) gibikardiyovasküler etkiler görülebilir. Klinik olarak anlamlı kontrolsüz kardiyovasküler hastalığıolan hastalar klinik çalışmalardan çıkarılmıştır. Dolayısıyla, umeklidinyum/vilanterol şiddetlikardiyovasküler hastalığı olan hastalarda dikkatle kullanılmalıdır. Antimuskarinik aktiviteAntimuskarinik aktivitesine bağlı olarak umeklidinyum/vilanterol, üriner retansiyonu veya dar açılı glokomu olan hastalarda dikkatli kullanılmalıdır. HipokalemiBeta2 adrenerjik agonistler, bazı hastalarda istenmeyen kardiyovasküler etkiler oluşturma potansiyeli olan anlamlı hipokalemi oluşturabilir. Serum potasyumundaki azalma genelliklegeçicidir, takviye gerektirmez. Umeklidinyum/vilanterol ile önerilen terapötik dozlarda yapılan klinik çalışmalarda hipokaleminin klinik olarak anlamlı etkisi görülmemiştir. Umeklidinyum/vilanterol,hipokalemiye neden olma potansiyeli olan diğer ilaçlarla birlikte kullanıldığında dikkatliolunmalıdır (bkz. Bölüm 4.5). HiperglisemiBeta2 adrenerjik agonistler bazı hastalarda geçici hiperglisemiye neden olabilir. Umeklidinyum/vilanterol ile önerilen terapötik dozlarda yapılan klinik çalışmalarda plazma glukozu üzerinde klinik olarak anlamlı etki görülmemiştir. Umeklidinyum/vilanterol iletedaviye başlandığında plazma glukozu diyabetik hastalarda daha yakından takip edilmelidir. Eşlik eden koşullarUmeklidinyum/vilanterol, konvülsif bozuklukları veya tirotoksikozu olan hastalarda ve beta2 adrenerjik agonistlere karşı alışılmadık duyarlılığı olan hastalarda dikkatli kullanılmalıdır. Yardımcı maddelerBu tıbbi ürün laktoz içermektedir. Galaktoz intoleransı, Lapp laktaz eksikliği ve glukoz-galaktoz malabsorpsiyonu gibi nadir kalıtımsal sorunları olan hastalar bu ilacı kullanmamalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBeta blokörler ile etkileşim:Beta adrenerjik blokörler, vilanterol gibi beta2 adrenerjik agonistlerin etkisini zayıflatabilir veya antagonize edebilirler. Kullanılmasını zorunlu kılan sebepler olmadıkça selektif veya selektifolmayan beta adrenerjik blokörlerin eşzamanlı kullanımından kaçınılmalıdır. Metabolik ve taşıyıcı bazlı etkileşimlerVilanterol, sitokrom P450 3A4'ün (CYP3A4) bir substratıdır. Güçlü CYP3A4 inhibitörlerinin (ör. ketokonazol, klaritromisin, itrakonazol, ritonavir, telitromisin) eş zamanlı uygulaması,vilanterolün metabolizmasını inhibe edebilir ve vilanterole sistemik maruziyeti arttırabilir.Ketokonazol (400 mg) ile birlikte uygulanması, ortalama vilanterol EAA(0-t) ve Cmaks'ı sırasıyla%65 ve %22 oranında arttırmıştır. Vilanterol maruziyetindeki artış; kalp hızı, kan potasyumuveya QT aralığı (Fridericia yöntemi kullanılarak düzeltilmiş olan) üzerindeki beta adrenerjikagonist ile ilgili sistemik etkiler ile ilişkilendirilmemiştir. Umeklidinyum/vilanterolü,ketokonazol ve bilinen diğer güçlü CYP3A4 inhibitörleri ile birlikte uygularken dikkatliolunması tavsiye edilmektedir, çünkü vilanterole sistemik maruziyetin artma potansiyelibulunmaktadır, bu da istenmeyen etkilerin artışına sebep olabilir. Orta güçte bir CYP3A4inhibitörü olan verapamil, vilanterolün farmakokinetiğini anlamlı bir şekilde etkilememiştir. Umeklidinyum, sitokrom P450 2D6'nın (CYP2D6) bir substratıdır. Umeklidinyumun kararlı durum farmakokinetiği, CYP2D6 eksikliği olan (zayıf metabolize edenler) sağlıklı gönüllülerdedeğerlendirilmiştir. 8 kat yüksek dozda, umeklidinyum EAA veya Cmaks üzerinde herhangi biretki gözlenmemiştir. 16 kat yüksek dozda, umeklidinyum EAA'da 1,3 kat artış gözlenmiştir veumeklidinyum Cmaks'ı üzerinde herhangi bir etki gözlenmemiştir. Bu değişikliklerinbüyüklüğüne bağlı olarak, umeklidinyum/vilanterol CYP2D6 inhibitörleri ile birlikte veyaCYP2D6 eksikliği bulunan hastalara (zayıf metabolize edenler) uygulandığında klinik olarakanlamlı bir ilaç etkileşimi beklenmemektedir. Hem umeklidinyum hem de vilanterol, P-glikoprotein taşıyıcısının (P-gp) substratlarıdır. Orta güçte P-gp inhibitörü verapamilin (günde bir kez 240 mg), umeklidinyum ve vilanterolünkararlı durum farmakokinetiği üzerindeki etkisi sağlıklı gönüllülerde değerlendirilmiştir.Verapamilin, umeklidinyum veya vilanterol Cmaks'ları üzerinde herhangi bir etkisigözlenmemiştir. Umeklidinyum EAA'da yaklaşık 1,4 kat artış gözlenmiş olup vilanterol EAAdeğeri üzerinde herhangi bir etki gözlenmemiştir. Bu değişikliklerin büyüklüğüne bağlı olarak,umeklidinyum/vilanterol, P-gp inhibitörleri ile birlikte uygulandığında klinik olarak anlamlı birilaç etkileşimi beklenmemektedir. Diğer antimuskarinikler ve sempatomimetiklerUmeklidinyum/vilanterolün diğer uzun etkili muskarinik agonistler, uzun etkili beta2 adrenerjik agonistler veya bu iki ajandan herhangi birini içeren tıbbi ürünler ile eşzamanlı uygulanması Belge Doalışılmamnttİ6SS IbuAui§ullmal'biİJBeni8Fale'muskiri.niFISt.?6opSiâtisr»Ygy4ob.5ti28ad,Bsasijikagonistlerin istenmeyen etkilerini artırabileceğinden tavsiye edilmemektedir (bkz. Bölüm 4.4 ve 4.9). HipokalemiMetilksantin türevleri, steroidler veya potasyum tutucu olmayan diüretikler ile eş zamanlı hipokalemik tedavi beta2 adrenerjik agonistlerin olası hipokalemik etkilerini artırabileceğindendikkatle kullanılmalıdır (bkz. Bölüm 4.4). KOAH için kullanılan diğer tıbbi ürünlerResmi in vivoÖzel popülasyonlara ilişkin ek bilgiler:Özel popülasyonlarda herhangi bir etkileşim çalışması yürütülmemi ştir. Pediyatrik popülasyon:Pediyatrik popülasyonda herhangi bir etkileşim çalışması yürütülmemi ştir. 4.6. Gebelik ve LaktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon) uygulayanlarda kullanımına ilişkin herhangi bir veri yoktur. Gebelik dönemiUmeklidinyum/vilanterolün gebe kadınlarda kullanımına ilişkin veri bulunmamaktadır. Hayvanlarda yapılan çalışmalar, vilanterolün uygulanmasından sonra üreme toksisitesigöstermiştir (bkz. Bölüm 5.3). Umeklidinyum/vilanterol gebelik döneminde, sadece anne içinbeklenen yararları fetüs için olası risklerden fazla olduğunda kullanılmalıdır. Laktasyon dönemiUmeklidinyum veya vilanterolün anne sütüne geçip geçmediği bilinmemektedir. Ancak, anne sütünde diğer beta2 adrenerjik agonistler tespit edilmiştir. Yeni doğana/bebeklere yönelik riskdışlanamaz. Emzirmenin bebeğe ve tedavinin anneye yararı dikkate alınarak, emzirmeninkesilmesi veya ANORO ELLIPTA tedavisinin kesilmesinden hangisinin yapılması gerektiğikonusunda bir karara varılmalıdır. Üreme yeteneği/FertiliteUmeklidinyum/vilanterolün insanlarda fertilite üzerindeki etkilerine ilişkin herhangi bir veri yoktur. Hayvan çalışmaları umeklidinyum veya vilanterolün fertilite üzerinde hiçbir etkisiolmadığını göstermektedir (bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerUmeklidinyum/vilanterol'ün araç ve makine kullanımı üzerine herhangi bir etkisi yoktur veya ihmal edilebilir düzeydedir. 4.8. İstenmeyen etkilerGüvenlilik profilinin özetiUmeklidinyum/vilanterol ile en sık rapor edilen istenmeyen etki nazofarenjit olmuştur (%9). İstenmeyen etkilerin özetiANORO ELLIPTA'nın güvenlilik profili, KOAH'lı 6855 hastanın dahil olduğu klinik geliştirme programında, umeklidinyum/vilanterol ve bileşenlerin her biriyle elde edilmişgüvenlilik deneyimine ve spontan raporlamaya dayanmaktadır. Klinik geliştirme programı 24 hafta veya daha uzun süren Faz III klinik çalışmada günde bir kez umeklidinyum/vilanterol almış olan 2354 hasta; 24 haftalık çalışmada 55/22 mcg'lıkönerilen dozu almış olan 1296 hasta, 24 haftalık bir çalışmada 113/22 mcg'lık yüksek dozualmış olan 832 hasta ve 12 aylık bir çalışmada 113/22 mcg dozunu almış 226 hastayıiçermektedir. Aşağıda verilen yan etkilere atanan frekanslar 24-haftalık beş çalışmanın entegrasyonundan ve 12 aylık güvenlilik çalışmasından gözlemlenen ham sıklık oranlarını içermektedir. Aşağıda istenmeyen etkiler MedDRA vücut organ sistem sınıflandırması ve sıklığa göre liste halinde sunulmaktadır. İstenmeyen etkilerin sınıflandırılması için aşağıdaki sınıflandırmaölçeği kullanılmıştır: Çok yayn (>1/10); yayn (>1/100 ila <1/10); yayn olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarYayn: İdrar yolu enfeksiyonu, sinüzit, nazofarenjit, farenjit, üst solunum yolu enfeksiyonu Bağışıklık sistemi hastalıklarıYayn olmayan: Döküntüyü içeren hipersensitivite reaksiyonları Seyrek: Anaflaksi, anjiyoödem ve ürtikeri içeren hipersensitivite reaksiyonları Sinir sistemi hastalıklarıYayn: Yayn olmayan: Bilinmiyor:
Baş ağrısı Tremor, disguziBaş dönmesi Göz hastalıklarıSeyrek: Glokom, bulanık görme, intraoküler basınç artışı, göz ağrısı Kardiyak hastalıklarYayn olmayan: Atriyal fibrilasyon, supraventriküler taşikardi, idioventriküler ritim, taşikardi, supraventriküler ekstrasistoller, çarpıntı Solunum, göğüs bozuklukları ve mediastinal hastalıklarYayn: Öksürük, orofarenj iyal ağrı Yayn olmayan: Disfoni Seyrek: Paradoksa Gastrointestinal hastalıklarYayn: Kabızlık, ağız kuruluğu Deri ve deri altı doku hastalıklarıYayn olmayan: Döküntü Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYayn olmayan: Kas spazmları Böbrek ve idrar yolu hastalıklarıSeyrek: Üriner retansiyon, disüri, mesane çıkışı obstrüksiyonu Şüpheli advers reaksiyonların raporlanması:Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr[email protected]. Doz aşımı ve tedavisiSemptom ve belirtilerUmeklidinyum/vilanterolün doz aşımında muhtemelen bireysel bileşenlerin etkilerinden kaynaklanan, bilinen inhale muskarinik antagonist istenmeyen etkiler (ör: ağız kuruluğu, görmebozuklukları ve taşikardi) ve diğer beta2 adrenerjik agonistlerde doz aşımında görülenistenmeyen etkiler (ör. aritmiler, tremor, baş ağrısı, palpitasyonlar, bulantı, hiperglisemi vehipokalemi) ile tutarlı belirti ve semptomlar görülecektir. TedaviEğer doz aşımı meydana gelirse, hastaya gerektiği şekilde uygun takip ile destekleyici tedavi uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Obstrüktif hava yolu hastalıkları için ilaçlar, kortikosteroidlerle birlikte üçlü kombinasyon dahil antikolinerjikler ile kombinasyon halinde adrenerjiklerATC kodu: R03AL03 Etki mekanizması:Umeklidinyum/vilanterol uzun etkili bir muskarinik reseptör antagonisti/uzun etkili beta2 adrenerjik agonistinin (LAMA/LABA) inhalasyona yönelik bir kombinasyonudur. İnhalasyonutakiben, her iki bileşen, solunum yollarına lokal olarak etki eder ve farklı mekanizmalarlabronkodilatasyon yaratır. UmeklidinyumUmeklidinyum uzun etkili bir muskarinik reseptör antagonistidir (ayrıca antikolinerjik olarak da anılır). Muskarinik reseptör antagonisti olan, çoklu muskarinik kolinerjik reseptöralttürlerinde aktivite gösteren bir kuinüklidin türevidir. Umeklidinyum, bronkodilatöraktivitesini, asetilkolinin solunum yolu düz kasındaki muskarinik asetilkolin reseptörlerine Belge Do.bâil.aflffi,ası5wksffli!fititif',,o®al3!İiBf.:^r*k 'söst^^SlISik,ânc?ıLm£deli5vrd,s.ıfeciif-rlıre doğrudan uygulandığında, in vitroin vivouzun etki süresi gösterir.VilanterolVilanterol, selektif, uzun etkili bir beta2 adrenerjik reseptör agonistidir (beta2 adrenerjik agonisti). Vilanterol de dahil olmak üzere beta2 adrenerjik agonist ilaçların farmakolojiketkileri, en azından kısmen de olsa adenozin trifosfatın (ATP) siklik 3',5'-adonezin monofosfata(siklik AMP) dönüşmesinde katalizör görevi gören enzim olan intrasellüler adenilat siklazınstimülasyonu ile ilişkilendirilebilir. Artan siklik AMP düzeyleri bronşiyal düz kasıngevşemesine ve özellikle mast hücreler olmak üzere hücrelerden ani aşırı duyarlılık aracılarınınsalınmasının inhibe edilmesine neden olmaktadır. Farmakodinamik etkilerFaz III, 6 aylık çalışmalarda plaseboya kıyasla umeklidinyum/vilanterol, günde bir kez uygulamayı takiben 24 saatte akciğer fonksiyonunda (1 saniyedeki zorlu ekspiratuar hacim[FEVı] ile ölçüldüğü üzere), ilk dozun uygulanmasından sonra 15. dakikada belirginleşen(plaseboya kıyasla 112 ml iyileşme (p<0,001 1)) klinik anlamlı iyileşmeler sağlamıştır.Plaseboya kıyasla doz uygulamasını takip eden ilk 6 saat içinde FEVı'deki ortalama pikiyileşmeleri 24. haftada 224 ml'dir (p<0,0011). ANORO ELLIPTA etkisinde zaman içerisindetaşifilaksi kanıtına rastlanmamıştır. Kardiyak elektrofızyolojiUmeklidinyum/vilanterolün QT aralığı üzerindeki etkisi 103 sağlıklı gönüllüde 10 gün boyunca günde bir kez 113/22 mikrogram veya 500/100 mikrogram (önerilen dozun sekiz katıumeklidinyum ve önerilen dozun dört katı vilanterol ile tek doz) umeklidinyum/vilanteroluygulamasını içeren plasebo ve aktif (moksifloksasin) kontrollü QT çalışmasındadeğerlendirilmiştir. QT aralığı uzamalarında başlanca göre düzeltme sonrasında plaseboyagöre maksimum ortalama fark (Fridericia yöntemi kullanılarak düzeltilmiş, QTcF)umeklidinyum/vilanterol 113/22 mikrogram ile uygulamadan 10 dakika sonra 4,3 (%90GA=2,2 ila 6,4) milisaniye ve umeklidinyum/vilanterol 500/100 mikrogram ile uygulamadan30 dakika sonra 8,2 (%90 GA=6,2 ila 10,2) milisaniyedir. Bu nedenle umeklidinyum/vilanterol113/22 mikrogram ile QT aralığı uzamaları ile ilişkili klinik ilgiye sahip pro-aritmik potansiyelgözlenmemiştir. Kalp hızında doza bağımlı bir artış da gözlenmiştir. Kalp hızında başlanca göre düzeltme sonrasında plaseboya kıyasla maksimum ortalama fark umeklidinyum/vilanterol 113/22mikrogram ve 500/1000 mikrogram uygulamasından 10 dakika sonra sırasıyla 8,4 (%90 GA =7 ila 9,8) atım/dakika ve 20,3 (%90 GA = 18,9 ila 21,7) atım/dakikadır. Ayrıca, 6 aylık bir çalışmada günde bir kez umeklidinyum/vilanterol 55/22 mikrogram ile tedavi edilen KOAH'lı 53 hastada veya 6 aylık bir başka çalışmada günde bir kezumeklidinyum/vilanterol 113/22 mikrogram alan ilave 55 hastada ve 12 aylık bir çalışmadagünde bir kez 113/22 mikrogram alan 226 hastada 24 saatlik Holter takibinde kardiyak ritimüzerinde klinik olarak anlamlı etkiler gözlenmemiştir. Klinik etkililik ve güvenlilikGünde bir kez uygulanan umeklidinyum/vilanterolün klinik etkililiği klinik KOAH tanısı almış 6.835 yetişkin hastada yürütülen sekiz Faz III klinik çalışmada değerlendirilmiştir; 6 aylıkçalışmalardan 5.618 hasta (iki plasebo kontrollü ve üç aktif [tiotropium]-komparatör kontrollü),iki 3 aylık egzersiz dayanımı/akciğer fonksiyonu çalışmalarından 655 hasta ve 12 aylıkdestekleyici bir çalışmadan 562 hasta. Akciğer fonksiyonu üzerindeki etkilerANORO ELLIPTA çeşitli çalışmalarda akciğer fonksiyonunda iyileşmeler (dip FEVı'de başlanca göre değişiklik olarak tanımlanan) göstermiştir. 6 aylık bir Faz III çalışmasında,ANORO ELLIPTA 24. haftada plaseboya ve her bir monoterapi bileşeni tedavi koluna kıyasladip FEV1'de istatistiksel olarak anlamlı iyileşmeler göstermiştir. Ayrıca, ANORO ELLIPTA üç adet 6 aylık aktif kontrollü çalışmanın ikisinde dip FEV1'de tiotropiyuma kıyasla klinik olarak önemli ve istatistiksel olarak anlamlı iyileşmeler ve üçüncüaktif komparatörlü çalışmada tiotropiuma kıyasla sayısal olarak daha fazla iyileşmelergöstermiştir (bkz. Tablo 1). Bronkodilatör etkisinde zaman içerisinde bir azalma görülmemiştir. Semptomatik sonuçlarNefes darlığı:ANORO ELLIPTA plaseboya kıyasla 24. haftada TDI fokal skorunda (kritik ikincil sonlanım noktası) artış ile değerlendirilen nefes darlığında istatistiksel olarak ve klinik olarak anlamlıazalma göstermiştir (bkz. Tablo 1). Her bir monoterapi bileşeni ve tiotropiuma kıyasla TDIfokal skorundaki iyileşmeler istatistiksel olarak anlamlı değildir (bkz. Tablo 1). 24. haftada TDI fokal skorunda en az 1 ünitelik minimum klinik önemli fark (MCID) ile yanıt veren hasta oranı plaseboya (%41) ve her bir monoterapi bileşenine (umeklidinyum için %53ve vilanterol için %51) kıyasla ANORO ELLIPTA için daha yüksektir (%58). Sağlıkla bağlantılı yaşam kalitesi: ANORO ELLIPTA aynı zamanda St. George Solunum Anketi (SGRQ) kullanılarak ölçülen sağlıkla bağlantılı yaşam kalitesinde plasebo ve her bir monoterapi bileşenine kıyasla 24.haftada SGRQ toplam skorundaki azalma ile kanıtlanan bir iyileşme göstermiştir (bkz., Tablo1). ANORO ELLIPTA üç aktif kontrollü çalışmanın birinde tiotropiuma kıyasla SGRQ toplamskorunda istatistiksel olarak anlamlı bir azalma göstermiştir (bkz. Tablo 1). 24. haftada SGRQ skorunda en az MCID (başlanca göre 4 birimlik bir azalma olarak tanımlanan) ile yanıt veren hasta oranı plasebo (%34) ve her bir monoterapi bileşenine(umeklidinyum için %44 ve vilanterol için %48) kıyasla ANORO ELLIPTA için daha yüksektir(%49). Bir aktif komparatör çalışmasında, ANORO ELLIPTA kullanan daha yüksek bir hastayüzdesi tiotropiuma (%46) kıyasla 24. haftada SGRQ skorunda klinik olarak anlamlı biriyileşme (%53) ile yanıt vermiştir. Diğer iki aktif komparatörlü çalışmada, benzer bir hastaoranı ANORO ELLIPTA ve tiotropium ile en az MCID elde edilmiştir; ANORO ELLIPTA62,5/25 mikrogram için %49 ve %54 ve tiotropium için %52 ve %55. Kurtarıcı ilaç kullanımıANORO ELLIPTA, plasebo ve umeklidinyuma kıyasla salbutamol ile kurtarıcı ilaç kullanımını 1-24 hafta boyunca azaltmıştır (bkz. Tablo 1) ve başlanca göre kurtarıcı ilaç kullanımınıngerekmediği gün oranında artış sağlamıştır (ortalama %11,1); plaseboda ise bu orandabaşlanca göre azalma gözlenmiştir^öftalama i%0ü9)qızaianmıştır.
Üç adet 6 aylık aktif komparatör kontrollü çalışmada, ANORO ELLIPTA tiotropiuma kıyasla salbutamol ile kurtarıcı ilaç kullanımım azaltmıştır ve çalışmaların ikisinde bu azalmalaristatistiksel olarak anlamlıdır (bkz. Tablo 1). ANORO ELLIPTA aynı zamanda üç çalışmanıntümünde kurtarıcı ilaç kullanımının gerekmediği gün oranında tiotropiuma kıyasla (ortalama%11,7 ila %13,4 aralığı içinde) başlanca göre yüksek bir artış göstermiştir (ortalama %17,6ila %21,5 aralığı içinde). Tablo 1. 24. haftada akciğer fonksiyonu, semptomatik ve sağlıkla bağlantılı yaşam kalitesi
mcg = mikrogram n/e = değerlendirilmemiştir 1. En küçük kareler ortalaması 2. Çalışma DB2113360 ve Çalışma DB2113374'ten birleştirilmiş veriler 3. 1-24. haftada günde ortalama püskürtme sayısındaki fark 24 haftalık plasebo kontrollü klinik çalışmada ve üç 24 haftalık aktif kontrollü çalışmanın ikisinde daha yüksek bir umeklidinyum/vilanterol (113/22 mikrogram) dozu ayrıcaaraştırılmıştır. Bulgular ANORO ELLIPTA dozu için olana benzerdir ve ANORO ELLIPTAetkililiği için ilave destekleyici kanıt sağlamıştır. KOAH alevlenmeleriSemptomatik KOAH hastalarında yapılan bir 24 haftalık plasebo kontrollü çalışmada ANORO ELLIPTA, orta/şiddetli KOAH alevlenme riskini plaseboya kıyasla %50 (ilk alevlenmeyekadar geçen süre analizine dayalı olarak: Tehlike Oranı (HR) 0,5; 95% GA: 0,3, 0,8; p=0,0042);umeklidinyuma kıyasla %20 (HR 0,8; 95% GA: 0,5, 1,3; p=0,391) ve vilanterole kıyasla %30(HR 0,7; 95% GA: 0,4, 1,1; p=0,121) azaltmıştır. Semptomatik KOAH hastalarında yapılan üçaktif komparatörlü çalışmadan, tiotropiuma kıyasla orta/şiddetli KOAH alevlenmesi riski birçalışmada %50 azalmıştır (HR 0,5; 95% GA: 0,3, 1,0; p=0,044). Diğer iki çalışmada, birorta/şiddetli KOAH alevlenmesinin riski %20 ve %90 artmıştır (HR 1,2; 95% GA: 0,5, 2,6;p=0,709 ve HR 1,9; 95% GA: 1,0, 3,6; p=0,062). Bu çalışmalar özellikle tedavilerin KOAHalevlenmeleri üzerindeki etkisini değerlendirmek için tasarlanmamış olup, hastalar biralevlenme görülürse çalışmadan çekilmiştir. Destekleyici etkililik çalışmaları52 haftalık bir randomize, çift kör çalışmada (CTT116855, IMPACT), semptomatik KOAH bulunan ve önceki 12 ayda 1 veya daha fazla orta/şiddetli alevlenme öyküsü olan 10.355 hasta;tek bir inhaler olarak günde bir kez uygulanan umeklidinyum/vilanterol (UMEC/VI 55/22mikrogram), flutikazon furoat/umeklidinyum /vilanterol (FF/U^EC/VI 92/55/22 mikrogram)veya flutikazon furoat/vilanterol (FF/VI 92/22 mikrogram) alacak şekilde randomize edilmiştir(1:2:2). Primer sonlanım noktası, FF/VI ve U^EC/VI ile karşılaştırıldığında, FF/U^EC/VI iletedavi edilen bireylerde tedavi sırasında görülen orta ve şiddetli alevlenmelerin yıllık oranıolmuştur. Alevlenmelerin yıllık ortalama oranı FF/U^IEC/VI, FF/VI ve ^MEC/VI içinsırasıyla 0,91, 1,07 ve 1,21 olarak görülmüştür. FF/U^EC/VI'nin FF/VI ve UMEC/VI ile karşılaştırılması, sırasıyla bir orta/şiddetli alevlenme riskinde istatiksel olarak anlamlı %14,8'lik düşüşle (ilk alevlenmeye kadar geçen süre analizinedayalı olarak: HR 0,85; 95% GA: 0,80, 0,91; p<0,001) ve bir orta/şiddetli alevlenme riskinde%16,0'lık düşüşle (ilk alevlenmeye kadar geçen süre analizine dayalı olarak: HR 0,84; 95%GA: 0,78, 0,91; p<0,001) sonuçlanmıştır. Egzersiz dayanıklılığı ve akciğer hacimleriANORO ELLIPTA 62,5/25 mikrogram, hiperenflasyon (fonksiyonel rezidüel kapasite [FRC] >%120) görülen yetişkin KOAH hastalarında yürütülen bir çalışmada (ikincisinde değil)dayanıklılık mekik yürüme testi (ESWT) ile değerlendirildiği üzere plaseboya kıyasla egzersizdayanıklılık süresini iyileştirmiş ve her iki çalışmada plaseboya kıyasla akciğer hacmiölçümlerini iyileştirmiştir. İlk çalışmada, ANORO ELLIPTA 62,5/25 mikrogram 12. haftadadozun uygulamasından 3 saat sonra elde edilen egzersiz dayanıklılık süresinde (EET) plaseboyakıyasla istatistiksel olarak anlamlı ve klinik ile ilişkili iyileşme (45 ila 85 saniye arasındaminimum klinik olarak önemli farka (MCID) dayalı olarak) göstermiştir (69,4 saniye[p=0,003]). Plaseboya kıyasla EET'deki iyileşme 2. günde görülmüş ve 6. hafta ve 12. haftadadevam etmiştir. İkinci çalışmada, ANORO ELLIPTA 62,5/25 mikrogram ve plasebo arasındaEET açısından tedavi farkı 12. haftada 21,9 saniyedir (p=0,234). ANORO ELLIPTA 62,5/25 mikrogram aynı zamanda ilk çalışmada 12. haftada dip değerde ve doz sonrası 3. saatte akciğer hacmi ölçümlerinde başlanca göre değişiklik açısından plaseboyakıyasla istatistiksel olarak anlamlı iyileşmeler göstermiştir (inspiratuar kapasite: sırasıyla 237ml ve 316 ml, rezidüel hacim: -466 ml ve -643 ml ve fonksiyonel rezidüel kapasite: -351 ml ve-522 ml; tümü p<0,001). İkinci çalışmada, ANORO ELLIPTA 62,5/25 mikrogram 12. haftada dip değerde ve doz sonrası 3. saatte akciğer hacmi ölçümlerinde başlanca göre değişiklik açısından plaseboya kıyaslaiyileşmeler göstermiştir (inspiratuar kapasite: sırasıyla 198 ml ve 238 ml, rezidüel hacim: -295ml ve -351 ml ve fonksiyonel rezidüel kapasite: -238 ml ve -302 ml; tümü p<0,001*). *Bu çalışmada geriye doğru adımlama testi kullanılmıştır ve bu karşılaştırma, istatistiksel anlamlılığa ulaşmayan bir karşılaştırmanın altındadır. Bu nedenle, bu karşılaştırmadanistatistiksel bir anlama varmak olası değildir. Pediyatrik popülasyon:Avrupa İlaç Ajansı, KOAH'de pediyatrik popülasyonun tüm alt gruplarında ANORO ELLIPTA ile yapılan çalışmaların sonuçlarını sunma zorunluluğunu kaldırmıştır (pediyatrikkullanıma ilişkin bilgiler için Bölüm 4.2'ye bakınız). 5.2. Farmakokinetik özelliklerGenel özelliklerUmeklidinyum ve vilanterol inhalasyon yoluyla birlikte uygulandığında, her bir bileşenin farmakokinetiği her bir etkin madde ayrı ayrı uygulandığında gözlenene benzerdi. Dolayısıyla,farmakokinetik amaçlar için her bir bileşen bağımsız olarak düşünülebilir. EmilimUmeklidinyumUmeklidinyumun sağlıklı gönüllülere inhale edilerek uygulanmasını takiben, Cmaks 5-15 dakikada oluşmuştur. İnhale umeklidinyumun mutlak biyoyararlanımı, oral emilimden gelenönemsiz düzeyde katkı ile dozun ortalama %13'üdür. İnhale umeklidinyumun yinelenendozlamını takiben, kararlı durum, 1,5-1,8 katı birikim ile 7-10 gün arasında elde edilmiştir. VilanterolVilanterolün sağlıklı gönüllülere inhale edilerek uygulanmasını takiben, Cmaks 5-15 dakikada oluşmuştur. İnhale vilanterolün mutlak biyoyararlanımı oral emilimden gelen önemsiz düzeydekatkı ile %27'dir. İnhale vilanterolün yinelenen dozlarını takiben, kararlı durum, 2,4 katıbirikim ile 6 gün içinde elde edilmiştir. DağılımUmeklidinyumSağlıklı gönüllülere intravenöz uygulamayı takiben, ortalama dağılım hacmi 86 litredir. İnsan plazmasındaki in vitroplazma proteinine bağlanma oranı ortalama %89'dur.
VilanterolSağlıklı gönüllülere yapılan intravenöz uygulamayı takiben, kararlı durumda ortalama dağılım hacmi 165 litredir. İnsan plazmasındaki in vitroplazma proteinine bağlanma oranı ortalama%94'tür.BiyotranformasyonUmeklidinyumİn vitroçalışmalar, umeklidinyumun daha çok sitokrom P450 2D6 (CYP2D6) tarafından metabolize edildiğini ve P-glikoprotein (P-gp) transporteri için bir substrat olduğunugöstermiştir. Umeklidinyum için primer metabolik yollar, oksidatif (hidroksilasyon, O-dealkilasyon) ve bunu takiben konjugasyonu (glukuronidasyon vb.) olup, düşük farmakolojikaktivite içeren ya da farmakolojik aktivitesi olmayan bir dizi metabolitle sonuçlanmıştır.Sistemik metabolit maruziyeti düşüktür.VilanterolIn vitroçalışmalar, vilanterolün daha çok sitokrom P450 3A4 (CY^3A4) tarafından metabolize edildiğini ve P-gp transporteri için bir substrat olduğunu göstermiştir. Primer metabolik yollar,anlamlı olarak düşük betaı ve beta2 adrenerjik agonist aktivitesi olan bir dizi metabolite O-dealkilasyondur. İnsanlarda radyoaktif işaretli madde ile yapılan oral vilanterol uygulamasınıtakiben plazma metabolik profilleri, yüksek ilk geçiş metabolizması ile tutarlıdır. Sistemikmetabolit maruziyeti düşüktür.EliminasyonUmeklidinyumİntravenöz uygulamayı takiben plazma klirensi 151 litre/saattir. İntravenöz uygulamayı takiben, uygulanan radyoaktif işaretli dozun yaklaşık %58'i (ya da geri kazanılan radyoaktivitenin%73'ü) doz sonrası 192 saatte dışkı ile atılmıştır. Üriner eliminasyon, 168. saatte uygulananradyoaktif işaretli dozun %22'sine (geri kazanılan radyoaktivitenin %27'si) karşılıkgelmektedir. İntravenöz dozlamı takiben ilaçla ilgili maddelerin dışkı ile atılması, safraya salımıgöstermiştir. Sağlıklı erkek gönüllülerde oral uygulamayı takiben, toplam radyoaktivite, dozsonrası 168 saatte daha çok dışkı ile atılmıştır (uygulanan radyoaktif işaretli dozun yaklaşık%92'si ya da geri kazanılan radyoaktivitenin %99'u). Oral olarak uygulanan dozun %1'indenazı (geri kazanılan radyoaktivitenin %1'i) idrarla atılmıştır ve bu da oral uygulamayı takibenönemsiz düzeyde emilim olduğunu göstermiştir. 10 gün boyunca uygulanan inhale dozlamıtakiben umeklidinyum plazma eliminasyon yarı ömrü ortalama 19 saat olup ilacın %3'ü ila%4'ü kararlı durumda idrarda değişmeden atılmıştır. Vilanterolİntravenöz uygulamayı takiben vilanterolün plazma klirensi 108 litre/saattir. Radyoaktif işaretli vilanterolün oral uygulamasını takiben, kütle dengesi, radyoaktif işaretin %70'inin idrarda ve%30'unun dışkıda olduğunu göstermiştir. Vilanterolün primer eliminasyonu, metabolizmayıtakiben idrar ve dışkıda metabolitelerin atılımı ile gerçekleştirilmiştir. 10 gün boyunca inhaledozlamı takiben vilanterol plazma eliminasyon yarı ömrü ortalama 11 saattir. Doğrusallık/Doğrusal olmayan durum:Veri bulunmamaktadır. Hastalardaki karakteristik özelliklerGeriyatrik popülasyon:Yapılan bir popülasyon farmakokinetik analizi, umeklidinyum ve vilanterol farmakokinetiğinin 65 yaş ve üzeri ve 65 yaşın altındaki KOAH hastaları arasında benzer olduğunu göstermiştir. Böbrek yetmezliği:Şiddetli böbrek yetmezliği bulunan hastalarda, önerilen dozun iki katı umeklidinyum ve önerilen dozda vilanterol içeren umeklidinyum/vilanterol uygulamasından sonra sistemikumeklidinyum ya da vilanterol maruziyetinde herhangi bir artış olduğuna (Cmaks ve EAA) veşiddetli böbrek yetmezliği bulunan hastalar ve sağlıklı gönüllüler arasında değişen proteinbağlanma profili görüldüğüne dair herhangi bir kanıt mevcut değildir. Karaciğer yetmezliği:Orta düzeyde karaciğer yetmezliği (Child-Pugh Class B) bulunan hastalarda, önerilen dozun iki katı umeklidinyum ve önerilen dozda vilanterol içeren umeklidinyum/vilanteroluygulamasından sonra sistemik umeklidinyum ya da vilanterol maruziyetinde herhangi bir artışolduğuna (Cmaks ve EAA) ve orta düzeyde karaciğer yetmezliği bulunan hastalar ve sağlıklıgönüllüler arasında değişen protein bağlanma profili görüldüğüne dair herhangi bir kanıtmevcut değildir. Umeklidinyum/vilanterol, şiddetli karaciğer yetmezliği bulunan hastalardadeğerlendirilmemiştir. Diğer özel popülasyonlar:Yapılan bir popülasyon farmakokinetik analizi, yaş, ırk, cinsiyet, inhale kortikosteroid kullanımı ya da vücut ağırlığının etkisi dikkate alınarak umeklidinyum ya da vilanterol içinherhangi bir doz ayarlaması gerekmediğini göstermiştir. Zayıf CYP2D6 metabolize edicilereilişkin bir çalışma, sistemik umeklidinyum maruziyeti üzerinde CYP2D6 genetikpolimorfizminin klinik olarak anlamlı herhangi bir etki oluşturmadığını göstermiştir. 5.3. Klinik öncesi güvenlilik verileriTek başlarına ve kombinasyon halinde umeklidinyum ve vilanterol ile yapılan klinik dışı çalışmalarda, bulgular tipik olarak, sırasıyla muskarinik reseptör antagonisti ya da beta2adrenerjik agonistlerin primer farmakolojisi ve/veya lokal tahriş ile ilişkilendirilmiştir.Aşağıdaki ifadeler her bir bileşene ilişkin gerçekleştirilmiş olan çalışmaları yansıtmaktadır. Genotoksisite ve karsinojenisite:Umeklidinyum standart çalışmalarda genotoksik değilken EAA'ya göre, umeklidinyum 55 mikrogramın insan klinik maruziyetinin sırasıyla > 26 ya da > 22 katı maruziyet düzeylerindefarelerde ya da sıçanlarda gerçekleştirilen yaşam boyu inhalasyon çalışmalarında dakarsinojenik olmadığı görülmüştür. Genetik toksisite çalışmalarında vilanterol (alfa-fenilsinnamat olarak) ve trifenilasetik asit genotoksik değildi ve bu da vilanterolün insanlar için genotoksik bir risk oluşturmadığınıgöstermektedir. Diğer beta2 adrenerjik agonistlere yönelik bulgularla tutarlı olarak, yaşam boyuinhalasyon çalışmalarında vilanterol, dişi sıçan ve fare üreme yolunda ve sıçan hipofiz bezindeproliferatif etkilere yol açmıştır. EAA'ya dayanarak, vilanterol 22 mikrogramın insan klinikmaruziyetinin sırasıyla 0,5 ya da 13 katı maruziyet düzeylerinde sıçanlarda ya da farelerdegörülen tümör insidansında herhangi bir artış olmamıştır. Üreme toksisitesi:Umeklidinyum sıçanlar veya tavşanlarda teratojenik olmamıştır. 180 mikrogram/kg/gün (EAA'ya göre insanın 55 mikrogram umeklidinyuma klinik maruziyetinin yaklaşık 80 katı)dozu verilen annelerde yapılan bir pre ve post natal çalışmada, sıçanlara yapılan subkütanumeklidinyum uygulaması, annede daha düşük vücut ağırlığı artışı ve besin tüketimi ilesonuçlanmıştır ve yavrunun vücut ağırlığını sütten kesmeden önce hafifçe azaltmıştır. Vilanterol, sıçanlarda teratojenik özellik göstermemiştir. Tavşanlarda yapılan inhalasyon çalışmalarında, vilanterol, EAA'ya göre klinik insan maruziyetinin 6 katında diğer beta2adrenerjik agonistler ile görülenlere benzer etkiler yaratmıştır (yarık damak, göz kapağındaaçılma, sternebral füzyon ve ekstremite fleksürü/malrotasyon). Vilanterol 22 mikrogramsubkütan olarak verildiğinde, EAA'ya dayalı klinik insan maruziyetinin 36 katında hiçbir etkigörülmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLaktoz monohidrat (inek sütünden elde edilir.) Magnezyum stearat 6.2. GeçimsizliklerBilinen bir geçimsizliği bulunmamaktadır. 6.3. Raf ömrü24 ay Alüminyum kutu açıldıktan sonraki raf ömrü: İçinde bulunduğu alüminyum kutudan çıkarıldıktan sonra 30°C'nin altındaki oda sıcaklığında 6 hafta. İnhaler alüminyum kutudan çıkarılır çıkarılmaz etiketi üzerinde bulunan boşluğa inhalerin son kullanma tarihi yazılır. 6.4. Saklamaya yönelik özel tedbirler30°C altındaki oda sıcaklığında ve kuru bir yerde muhafaza ediniz. İnhaleri nemden korumak için kapalı alüminyum kutu içinde muhafaza ediniz ve ancak ilk kez kullanmaya başlayacağınız zaman alüminyum kutuyu açıp inhalerinizi içinden çıkarınız. Alüminyum kutu açıldıktan sonra inhaler en fazla 6 hafta kullanılabilir. İnhaler alüminyum kutudan çıkarılır çıkarılmaz etiketi üzerinde bulunan boşluğa inhalerin son kullanma tarihiyazılır. İnhalerin son kullanma tarihi alüminyum kutunun açılmasından sonra 6 haftadır. Etiketüzerine yazılan son kullanma tarihinden sonra inhaler kullanılmamalıdır. Folyo, alüminyumkutu açıldıktan sonra atılabilir. 6.5. Ambalajın niteliği ve içeriğiPlastik inhaler, nem çekici paket içeren bir alüminyum kutu içerisinde paketlenmiş olan açık gri renkli bir gövde, kırmızı renkli inhaler kapağı ve bir doz sayacından oluşmaktadır.Alüminyum kutu, sıyrılabilen bir folyo kapak ile kapatılmıştır. İnhalerde 30 dozluk kullanımahazır blisterden oluşan, her biri beyaz bir toz içeren iki alüminyum folyo şerit bulunmaktadır.
6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
ve
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği" Ambalaj Atıklarının Kontrolü Yönetmeğine uygun olarak imha edilmelidir. 7. RUHSAT SAHIBIGlaxoSmithKline İlaçları San. ve Tic.A.Ş. Büyükdere Cad. No.173, 1. Levent Plaza B Blok 34394 1. Levent/İstanbulTelefon: 0212 339 44 00Faks: 0212 339 45 00 8. RUHSAT NUMARASI2014/722 9. İLK RUHSAT TARIHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 23.09.2014 Ruhsat yenileme tarihi: 06.08.2020 10. KÜB'ÜN YENİLENME TARİHİ1Bu çalışmada geriye doğru adımlatetetestivküüdriıiimıştinve ibukaişılaşCırma, istatistiksel anlamlılığa ulaşmayan2Bu çalışmada geriye doğru adımlatetetestivküiMriıiimıştinve ibüıkaişılaştırma, istatistiksel anlamlılığa ulaşmayanBelge Doma Kodu: lZW56aklTJZl,AxZm^RG83RG|83ar llIYnU3j . Belge Tafcin .Âdrefi:https:/iwww.turkiye.govlr/saglikotit^-ebysuir Karşılaştırmamn altındadır. Bu nedenle, DüKarşllaştırmadan^statistikseT bir anlama varmaK olası "değildir. |
İlaç BilgileriAnoro Ellipta 62,5 Mcg + 25 Mcg Kullanıma Hazır İnhalasyon TozuEtken Maddesi: Umeklidinyum Bromür + Vilanterol Kullanma talimatı ve kısa ürün bilgileri |
||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.