Darzalex 100 Mg/5 Ml İnfüzyonluk Çözelti Hazırlamak İçin Konsantre Kısa Ürün BilgisiKISA URUN BILGISI¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'a bildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERİ TIBBİ ÜRÜNÜN ADI DARZALEX 100 mg/5 mL infüzyonluk çözelti hazırlamak için konsantre Steril - Sitotoksik 2. KALİTATİF VE KANTİTATİF BİLEŞİM Her 5 mL'lik flakon 100 mg daratumumab içerir (her mL'de 20 mg daratumumab). Daratumumab, rekombinant DNA teknolojisi kullanılarak memeli hücre dizisinde (Çin Hamsteri Overinden) elde edilen, CD38 antijenini hedef alan bir insan monoklonal IgGİKantikorudur. Yardımcı maddeler: Her 5 mL'lik DARZALEX flakonu, 0,4 mmol (9,3 mg) sodyum içerir. Yardımcı maddelerin tam listesi için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORM İnfüzyon çözeltisi için konsantrat. Çözelti renksiz ila sarı renklidir. 4. KLİNİK ÖZELLİKLER DARZALEX; Otolog kök hücre nakli için uygun olmayan yeni teşhis edilmiş multipl miyelomluyetişkin hastaların tedavisinde lenalidomid ve deksametazon veya bortezomib, melfalanve prednizon ile kombine kullanımda, Otolog kök hücre nakli için uygun olan yeni teşhis edilmiş multipl miyelomlu yetişkinhastaların tedavisinde bortezomib, talidomid ve deksametazon ile kombine kullanımda, Daha önce en az 1 seri tedavi almış yanıt alınamayan veya nüks gelişmiş olan yetişkinmultipl miyelom hastalarında lenalidomid ve deksametazon veya bortezomib vedeksametazon ile kombine kullanımda, Monoterapi olarak, önceki tedavileri bir proteazom inhibitörü ve bir immünomodülatörajan içeren ve son tedavide hastalık progresyonu sergilemiş olan, relaps veya refraktermultiple miyelom hastalarının tedavisinde endikedir. 4.2 Pozoloji ve uygulama şekli DARZALEX, resüsitasyon imkanının bulunduğu bir ortamda, bir sağlık çalışanı tarafından uygulanmalıdır. Daratumumab ile infüzyonla ilişkili reaksiyon (İİR) riskini azaltmak için infüzyon öncesi ve sonrası tıbbi ürünler uygulanmalıdır. Aşağıda "Tavsiye edilen eş zamanlı ilaçlar", "İnfüzyonabağlı reaksiyonların yönetimi" ve Bölüm 4.4'e bakınız. Pozoloji/uygulama sıklığı ve süresi:Doz: Lenalidomid ve deksametazon ile kombinasyon tedavisi ve monoterapi için standart dozlama (4 haftalık kür rejimi):Tavsiye edilen DARZALEX dozu 16 mg/kg vücut ağırlığı olup, aşağıda Tablo 1'de verilen dozlama planına göre intravenöz infüzyon olarak uygulanır: Tablo 1: Monoterapi için ve lenalidomid ile kombinasyon tedavisi için standartDARZALEX dozlama planı (4 haftalık kür dozlama rejimi):
Deksametazon haftada 40 mg (veya >75 yaş hastalarda 20 mg/hafta olacak şekilde azaltılmış doz) uygulanmalıdır. DARZALEX ile birlikte uygulanan ilaçların dozu ve dozlama planı için Bölüm 5.1'e ve ilgili Kısa Ürün Bilgisi'ne bakınız. Bortezomib, melfalan ve prednizon ile kombinasyon tedavisi için dozlama planı (6 haftalık kür rejimi):Tavsiye edilen DARZALEX dozu 16 mg/kg vücut ağırlığı olup, aşağıda Tablo 2'deki dozlama planına göre intravenöz infüzyon olarak uygulanır. Tablo 2: Bortezomib, melfalan ve prednizon ile kombinasyon tedavisi içinDARZA LEX dozlama planı ((VMP; bortezomib, melfalan ve prednizon); 6 haftalık kür dozlama rejimi):
Bortezomib, ilk 6 haftalık kür için haftada 2 kez 1, 2, 4 ve 5. haftalarda, ardından 6 haftalık 8 kür boyunca haftada 1 kez 1, 2, 4 ve 5. haftalarda verilir. DARZALEX ile uygulandığında VMPdozu ve doz çizelgesi hakkında bilgi için Bölüm 5.1'e bakınız. Otolog kök hücre nakli (OKHT) için uygun olan yeni tanı alan hastaların tedavisi için bortezomib, talidomid ve deksametazon (4 haftalık kür rejimleri) ile kombinasyon halindedazlama rejimi:Tavsiye edilen DARZALEX dozu 16 mg/kg vücut ağırlığı olup, aşağıda Tablo 3'teki dozlama planına göre intravenöz infüzyon olarak uygulanır. Tablo 3: Bortezomib, talidomid ve deksametazon ile kombinasyon tedavisi içinDARZALEX dozlama planı ((VTd); 4 haftalık kür dozlama rejimi):
a 2 haftada bir olarak uygulanan dozlama planının ilk dozu 9. haftada verilir. b 2 haftada bir olarak uygulanan dozlama planının ilk dozu OKHT'yi takiben tedavinin yeniden başlatılması üzerine 1. haftada verilir. Deksametazon, kür 1 ve 2'nin 1, 2, 8, 9, 15, 16, 22 ve 23. günlerinde 40 mg ve 1-2. günlerde 40 mg ve kür 3-4'ün sonraki dozlama günlerinde (8, 9, 15, 16. günler) 20 mg uygulanmalıdır.Deksametazon 20 mg, kür 5 ve 6'da 1, 2, 8, 9, 15, 16. günlerde uygulanmalıdır. DARZALEX ile birlikte uygulanan ilaçların dozu ve dozlama planı için Bölüm 5.1'e ve ilgili Kısa Ürün Bilgisi'ne bakınız. Bartezamib ve deksametazon ile kombinasyon tedavisi için dozlama planı (3-haftalık kür rejimi):Tavsiye edilen DARZALEX dozu 16 mg/kg vücut ağırlığı olup, aşağıda Tablo 4'teki dozlama planına göre intravenöz infüzyon olarak uygulanır. Tablo 4: Bortezomib ve deksametazon ile kombinasyon tedavisi için DARZALEXdozlama planı (3 haftalık kür dozlama rejimi):
Deksametazon, ilk 8 bortezomib tedavi kürünün 1, 2, 4, 5, 8, 9, 11 ve 12. günlerinde 20 mg veya >75 yaş, düşük kilolu (BMI <18,5), kötü kontrol edilen diabetes mellitus veya steroidtedavisine önceden toleranssız olan hastalar için azaltılmış 20 mg/hafta dozu uygulanmalıdır. DARZALEX ile birlikte uygulanan ilaçların dozu ve dozlama planı için Bölüm 5.1'e ve ilgili Kısa Ürün Bilgisi'ne bakınız. Uygulama şekli:DARZALEX intravenöz kullanım içindir. DARZALEX, %0,9 serum fizyolojik (9 mg/mL enjeksiyonluk sodyum klorür) çözeltisi ile seyreltildikten sonra intravenöz infüzyon olarakuygulanır. Tıbbi ürünün uygulanmadan önce seyreltilmesine ilişkin talimatlar için Bölüm 6.6'ebakınız. İnfüzyon hızları Seyreltme işleminden sonra DARZALEX infüzyonu, aşağıda Tablo 5'te belirtilen başlangıç infüzyon hızında intravenöz yoldan uygulanmalıdır. İnfüzyon hızının artırılması, infüzyonreaksiyonları söz konusu değilse düşünülmelidir. Uygulamayı kolaylaştırmak için, 1. haftada ilk reçete edilen 16 mg/kg doz, iki ardışık güne bölünebilir. Yani sırasıyla 1. gün ve 2. günde 8 mg/kg, aşağıdaki Tablo 5'e bakınız. Tablo 5: DARZALEX (16 mg/kg) uygulaması için infüzyon hızları
a İnfüzyon hızının artırılması, yalnızca infüzyon reaksiyonları söz konusu değilse düşünülmelidir. b 500 mL'lik bir seyreltme hacmi 16 mg/kg doz için, yalnızca önceki hafta İİR olmaması durumunda kullanılmalıdır. Aksi takdirde 1.000 mL seyreltme hacmi kullanın.c Sonraki infüzyonlarda (yani 3. infüzyondan itibaren) başlangıç hızında değişiklikyapılacaksa, ilk 2 infüzyondaki >100 mL/saatlik nihai infüzyon hızında hiçbir İİR'ninmeydana gelmemiş olması gerekmektedir. Aksi takdirde, 2. infüzyon için geçerli olantalimatlara uyulmalıdır. Unutulan doz Planlanmış bir DARZALEX dozunun unutulması halinde, doz mümkün olan en kısa zamanda uygulanmalı ve dozlama planı uygun şekilde ayarlanarak tedavi aralığı korunmalıdır. Doz Modifikasyonları DARZALEX dozunun azaltılması önerilmez. Hematolojik toksisite durumunda, kan sayımlarının düzelmesine olanak vermek için dozun ertelenmesi gerekebilir (bkz. Bölüm 4.4). DARZALEX ile kombinasyon halinde verilen ilaçlar hakkında bilgi için ilgili Kısa Ürün Bilgisi'lerine bakınız. Tavsiye edilen eş zamanlı ilaçlarİnfüzyon öncesi ilaçlarİİR riskini azaltmak için tüm hastalara, her DARZALEX infüzyonundan 1 ila 3 saat önce infüzyon öncesi ilaçlar aşağıdaki gibi uygulanmalıdır: Kortikosteroid (uzun etkili veya orta etkili) - Monoterapi:İntravenöz yoldan uygulanan 100 mg metilprednizolon veya eşdeğeri. 2. infüzyondan sonra, kortikosteroid dozu azaltılabilir (oral veya intravenöz 60 mg metilprednizolon). - Kombinasyon tedavisi:Her DARZALEX infüzyonundan önce 20 mg deksametazon (veya eşdeğeri) uygulanır. Deksametazon tedavi rejimine ait spesifik kortikosteroid olduğunda, budeksametazon DARZALEX tedavi günlerindeki premedikasyon olarak uygulanandeksametazonun yerine geçecektir. (bkz. Bölüm 5.1). Deksametazon ilk DARZALEX infüzyonundan önce intravenöz yoldan uygulanır, sonraki infüzyonlardan önce oral yoldan verilmesi düşünülebilir. Ön tedavi olarakdeksametazon alan hastalar, DARZALEX infüzyon günlerinde arka plan rejiminespesifik kortikosteroid (örn., prednizon) almamalıdır. Antipiretik (650 ila 1.000 mg oral parasetamol) Antihistaminik (25 ila 50 mg oral veya intravenöz yoldan uygulanan difenhidramin veya eşdeğeri). İnfü^^on sonrası ilaçlarGecikmiş İİR riskini azaltmak için aşağıda belirtildiği şekilde infüzyon sonrası ilaçlar verilmelidir. - Monoterapi:Tüm infüzyonlardan sonraki ilk 2 günde oral kortikosteroid (20 mg metilprednizolon veya yerel standartlara uygun eşdeğer dozda bir orta etkili veya uzun etkilikortikosteriod) uygulanmalıdır (infüzyondan sonraki gün başlanarak). - Kombinasyon tedavisi:DARZALEX infüzyonundan sonraki gün düşük dozda oral metilprednizolon (< 20 mg) veya eşdeğerinin verilmesi düşünülmelidir. Ancak, DARZALEX infüzyonundansonraki gün bir arkaplan rejimine spesifik kortikosteroid (örn., deksametazon,prednizon) verilmişse, ilave olarak infüzyon sonrası ilaç verilmesine gerekolmayabilir (bkz. Bölüm 5.1). Ayrıca, kronik obstrüktif akciğer hastalığı (KOAH) öyküsü olan hastalar için kısa ve uzun etkili bronkodilatörler ve inhale kortikosteroidler gibi infüzyon sonrası ilaçların kullanımıdüşünülmelidir. İlk 4 infüzyondan sonra hastada majör İİR gelişmezse, hekimin kararına bağlıolarak bu inhalasyon yoluyla alınan infüzyon sonrası ilaçların kullanımına son verilebilir. Herpes zoster virüs reaktivasyonu için profilaksiHerpes zoster virüs reaktivasyonunu önlemek için, anti-viral profilaksi düşünülmelidir. İnfüzyona bağlı reaksiyonların yönetimiDARZALEX tedavisinden önce İİR riskini azaltmak için infüzyon öncesi ilaçlar uygulanmalıdır. Herhangi bir derece veya şiddetteki İİR'ler için, DARZALEX infüzyonu derhal kesilmeli ve semptomlar kontrol altına alınmalıdır. İİR'lerin yönetimi, infüzyon hızının azaltılmasını veya DARZALEX tedavisinin aşağıda açıklandığı gibi sonlandmlmasını gerektirebilir (bkz. Bölüm 4.4). Derece 1-2 (hafif ila orta şiddetli):Reaksiyon semptomları ortadan kalktığında, infüzyonaİİR'nin ortaya çıktığı hızın en fazla yarısı olan bir hızda yeniden başlanmalıdır. Hastadadaha fazla İİR semptomu gelişmezse, infüzyon hızı maksimum 200 mL/saat olacakşekilde klinik açıdan uygun görülen artışlar ve aralıklar ile tekrar artırılabilir (Tablo 5). Derece 3 (şiddetli):Reaksiyon semptomları ortadan kalktığında, infüzyona reaksiyonunortaya çıktığı hızın en fazla yarısı olan bir hızda yeniden başlanması düşünülebilir.Hastada daha fazla semptom gelişmezse, infüzyon hızı uygun görülen artışlar ve aralıklarile tekrar artırılabilir (Tablo 5). Derece 3 semptomların yeniden ortaya çıkmasıdurumunda yukarıdaki prosedür tekrarlanmalıdır. Derece 3 veya üzeri bir infüzyonreaksiyonunun 3. kez ortaya çıkması durumunda, DARZALEX tedavisi kalıcı olarakkesilmelidir. Derece 4 (yaşamı tehdit eden):Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği: Böbrek yetmezliği olan hastalarda daratumumab ile resmi çalışmalar yürütülmemiştir. Yapılan popülasyon farmakokinetiği (PK) analizlerine göre, böbrek yetmezliği bulunan hastalar içindoz ayarlaması gerekli değildir (bkz. Bölüm 5.2). Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda daratumumab ile resmi çalışma yürütülmemiştir. Yapılan popülasyon PK analizlerine göre, karaciğer yetmezliği olan hastalar için doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). Pediyatrik popülasyon:DARZALEX tedavisinin 18 yaşından küçük çocuklarda güvenliliği ve etkililiği belirlenmemiştir. Bu konuda elde veri bulunmamaktadır. Geriyatrik popülasyon:Geriyatrik popülasyon için doz ayarlaması gerekli görülmemiştir (bkz. Bölüm 5.2). 4.3 KontrendikasyonlarDaratumumaba veya DARZALEX'in içeriğindeki Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşırı duyarlılık. 4.4 Özel kullanım uyarıları ve önlemleriİzlenebilirlikBiyoteknolojik tıbbi ürünlerin takibini artırmak için, kullanılan ürünün marka ismi ve seri numarası hasta dosyasına açıkça işlenmelidir. İnfüzyonla ilişkili reaksiyonlar (İİR)DARZALEX anafilaktik reaksiyonlar dahil olmak üzere ciddi İİR'lere sebep olabilir (bkz. Bölüm 4.8). Bu reaksiyonlar yaşamı tehdit edici olabilir ve ölümcül sonuçlar bildirilmiştir. İnfüzyon süresince tüm hastalar İİR için izlenmelidir. Herhangi bir derece İİR deneyimleyen hastalar, infüzyon sonrası semptomlar düzelene kadar izlenilmeye devam edilmelidir. Klinik çalışmalarda İİR'ler, DARZALEX tedavisi alan tüm hastaların yaklaşık olarak yarısında bildirilmiştir. İİR'lerin çoğunluğu derece 1-2 olup ilk infüzyonda meydana gelmiştir (bkz. Bölüm 4.8). Tüm hastaların %4'ünde, birden fazla infüzyonda bir İİR gelişmiştir. Bronkospazm, hipoksi, dispne,hipertansiyon, laringeal ödem, pulmoner ödem ve oküler advers reaksiyonlar (koroidal efüzyon,akut miyopi ve akut açı kapanması glokomu dahil) dahil olmak üzere ciddi reaksiyonlaroluşmuştur. Semptomlar ağırlıklı olarak; burun tıkanıklığı, öksürük, boğaz iritasyonu, üşüme,kusma ve bulantı olmuştur. Daha az sıklıkta görülen semptomlar ise hırıltılı solunum, alerjikrinit, yüksek ateş, göğüs rahatsızlığı, kaşıntı, hipotansiyon ve bulanık görmedir (bkz. Bölüm4.8). DARZALEX tedavisinden önce İİR riskini azaltmak için, hastalara antihistaminik, antipiretik ve kortikosteroid premedikasyon verilmelidir. Herhangi bir şiddetteki İİR'ler için DARZALEXinfüzyonuna ara verilmelidir ve İİR'ler için gerektiği şekilde tıbbi yönetim/destekleyici tedaviuygulanmalıdır. Derece 1, 2 veya 3 İİR gelişen hastalar için, infüzyona yeniden başlanırken,infüzyon hızı azaltılmalıdır. Eğer bir anafilaktik reaksiyon ya da yaşamı tehdit eden (derece 4)İİR meydana gelirse, uygun acil resüsitasyon hemen başlatılmalıdır. DARZALEX tedavisiderhal ve kalıcı olarak kesilmelidir (bkz. Bölüm 4.2 ve 4.3). Gecikmiş İİR'lerin riskini düşürmek için, tüm hastalara DARZALEX infüzyonlarından sonra oral kortikosteroid verilmelidir. Ayrıca, KOAH öyküsü olan hastalarda ortaya çıkabileceksolunum komplikasyonlarını kontrol altına almak için infüzyon sonrası ilaçların (örn. inhalekortikosteroidler ile kısa ve uzun etkili bronkodilatörler) kullanılması düşünülmelidir. Okülersemptomlar ortaya çıkarsa, DARZALEX infüzyonunu kesilmeli ve DARZALEX'i yenidenbaşlatmadan önce derhal oftalmolojik değerlendirme istenmelidir (bkz. Bölüm 4.2). Nötropeni/trombositopeniDARZALEX, arkaplan tedavisi ile indüklenen nötropeni ve trombositopeniyi artırabilir (bkz. Bölüm 4.8). Tedavi süresince, arkaplan tedavilerinin kısa ürün bilgilerine göre tam kan sayımları periyodik olarak izlenmelidir. Nötropeni hastaları enfeksiyon bulguları açısından izlenmelidir. Kansayımlarının iyileşmesine izin vermek için DARZALEX tedavisinin ertelenmesi gerekebilir.DARZALEX'in doz azaltımı önerilmez. Transfüzyon veya büyüme faktörleri ile destekleyicibakım düşünülebilir. İndirekt antigobulin testi (indirekt Coombs testi) ile etkileşimDaratumumab, eritrositlerde düşük düzeylerde bulunan CD38'e bağlanır ve indirekt Coombs testinin pozitif çıkmasına neden olabilir. Daratumumaba bağlı indirekt Coombs testi pozitifliği,son daratumumab infüzyonundan sonra 6 aya kadar devam edebilir. Eritrositlere bağlanandaratumumabın, hastanın serumundaki minör antijenlere karşı gelişen antikorların saptanmasınımaskeleyebileceği dikkate alınmalıdır. Hastanın ABO ve Rh kan grubu tayini bundanetkilenmez. Daratumumab tedavisine başlamadan önce hastalar taranmalı ve kan grupları belirlenmelidir. Fenotipleme, yerel uygulamaya göre, daratumumab tedavisine başlamadan önce düşünülebilir.Kırmızı kan hücresi genotiplendirmesi daratumumab'dan etkilenmez ve herhangi bir zamandayapılabilir. Bir transfüzyon planlanması durumunda, kan transfüzyonu merkezleri indirekt antiglobulin testleriyle olan bu etkileşimden haberdar edilmelidir (bkz. Bölüm 4.5). Acil bir transfüzyongerekli olduğunda, yerel kan bankası uygulamaları doğrultusunda çapraz eşleştirilmemiş,ABO/RhD uyumlu eritrositler verilebilir. Tam yanıtın belirlenmesi ile etkileşimDaratumumab, endojen M proteininin klinik izleminde kullanılan serum protein elektroforezi (SPE) ve immünofiksasyon (IFE) analizlerinde tespit edilebilen bir insan IgG kappamonoklonal antikordur (bkz. Bölüm 4.5). Bu etkileşim, IgG kappa miyelom proteini olan bazıhastalarda tam yanıtın ve hastalık ilerlemesinin belirlenmesini etkileyebilir. Hepatit B virüs (HBV) reaktivasyonuDARZALEX ile tedavi edilen hastalarda bazı durumlarda ölümcül olan Hepatit B virüsü reaktivasyonu bildirilmiştir. DARZALEX ile tedaviye başlamadan önce tüm hastalarda HBVtaraması yapılmalıdır. Pozitif HBV serolojisi olan hastalar, DARZALEX tedavisi boyunca ve tedavi bitiminden sonraki en az 6 ay boyunca HBV reaktivasyonunun klinik ve laboratuvar bulguları açısındanizlenmelidir. Hastalar mevcut klinik kılavuzlara göre yönetilmelidir. Klinik olarak belirtildiğigibi hepatit hastalığı alanında uzman bir hekime danışılabilir. DARZALEX ile tedavi sırasında HBV reaktivasyonu gelişen hastalarda, DARZALEX tedavisini kesin ve uygun tedaviyi uygulayın. HBV reaktivasyonu kontrol edilen hastalardaDARZALEX tedavisinin yeniden başlanması, HBV yönetiminde uzman doktorlar iletartışılmalıdır. Yardımcı maddelerHer 5 mL'lik DARZALEX flakonu, 0,4 mmol (9,3 mg) sodyum içerir. Kontrollü sodyum diyeti alan hastalar bunu göz önünde bulundurmalıdır. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriDARZALEX ile herhangi bir etkileşim çalışması yapılmamıştır. Bir IgGİK monoklonal antikoru olarak, bozulmamış daratumumabın renal atılımının ve karaciğer enziminin aracılık ettiği metabolizmasının temel eliminasyon yollarını temsil etmesimümkün değildir. Bu nedenle, ilaç metabolize edici enzimlerdeki değişikliklerin daratumumabeliminasyonunu etkilemesi beklenmemektedir. CD38 üzerindeki benzersiz bir epitopa yüksekafinitesi nedeniyle, daratumumabın, ilaç metabolize edici enzimlerin aktivitelerini değiştirmeside beklenmemektedir. Daratumumab ile lenalidomid, pomalidomid, talidomid, bortezomib ve deksametazon kombinasyonları üzerinde gerçekleştirilen klinik farmakokinetik değerlendirmeler,DARZALEX ile bu küçük moleküllü ilaçlar arasında klinik olarak anlamlı hiçbir ilaç-ilaçetkileşimi göstermemiştir. İndirekt antigobulin testi (indirekt Coombs testi) ile etkileşimDaratumumab eritrositler üzerindeki CD38'e bağlanır ve antikor taraması ve çapraz eşleştirme gibi uyumluluk testlerini etkiler (bkz. Bölüm 4.4). Daratumumab etkileşimini azaltmayöntemleri, daratumumab bağlanmasını bozmak için reaktif alyuvarların ditiyotretol (DTT) ileişleme tabi tutulmasını veya diğer lokal valide edilmiş metodları içermektedir. Kell kan grubusistemi DTT tedavisine de duyarlı olduğundan, DTT uygulanmış eritrositler kullanarakalloantikorların ekarte edilmesi veya tespit edilmesinin ardından Kell-negatif ünitelersağlanmalıdır. Alternatif olarak fenotipleme ve genotipleme de düşünülebilir (bkz. Bölüm 4.4). Serum protein elektroforezi (SPE) ve immünofiksasyon (IFE) testleri ile etkileşim4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeline sahip kadınlar, olası DARZALEX tedavisi sırasında ve sonrasında 3 ay süreyle etkili bir doğum kontrol yöntemi kullanmalıdır. Gebelik dönemiDaratumumabın gebe kadınlarda kullanımına ilişkin veri mevcut değildir veya sınırlıdır. Hayvanlar üzerinde yapılan çalışmalar üreme toksisitesi açısından yetersizdir (bkz. Bölüm 5.3).DARZALEX gebelik sırasında ve doğum kontrolü kullanmayan çocuk doğurma potansiyeliolan kadınlarda önerilmez. Hayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya/embriyonal/fetal gelişim/ve-veya/doğum/ve-veya/doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. DARZALEX gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiDaratumumabın anne sütüne geçip geçmediği bilinmemektedir. Yenidoğanlar/bebekler için bir risk göz ardı edilemez. Emzirmeyi bırakma veya DARZALEX tedavisini bırakma/tedaviden kaçınma kararı, çocuk için emzirmenin yararı ve anne içintedavinin yararı göz önüne alınarak alınmalıdır. FertiliteDaratumumabın erkekler veya kadınlarda fertilite üzerindeki potansiyel etkilerini belirleyecek veri bulunmamaktadır (bkz. bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkilerDARZALEX, araç ve makine kullanımı üzerinde etkili değildir veya etkisi göz ardı edilebilir ölçüdedir. Ancak, daratumumab kullanan hastalarda yorgunluk bildirilmiştir ve araç veyamakine kullanırken bu durumun dikkate alınması gerekmektedir. 4.8 İstenmeyen etkilerGüvenlilik profili özetiEn sık görülen advers reaksiyonlar; (>%20 hastalar) İİR'ler, yorgunluk, bulantı, diyare, konstipasyon, ateş, dispne, öksürük, nötropeni, trombositopeni, anemi, periferik ödem, asteni,periferik duyusal nöropati ve üst solunum yolu enfeksiyonu olmuştur. Ciddi adversreaksiyonlar; sepsis, pnömoni, bronşit, üst solunum yolu enfeksiyonu, pulmoner ödem,influenza, ateş, dehidrasyon, diyare ve atriyal fibrilasyon olarak belirlenmiştir. Advers reaksiyonların tablo halinde listesiTablo 6 DARZALEX alan hastalarda görülen advers ilaç reaksiyonlarını özetlemektedir. Veriler DARZALEX (16 mg/kg) alan 2066 multiple miyelom hastasını (geçmiş rejimler ilekombine olarak DARZALEX alan 1910 hasta ve monoterapi alan 156 hasta) yansıtmaktadır. MMY3006 çalışmasında, CD34 + hücre sayısı D-VTd kolunda VTd koluna göre daha düşüktü (medyan: D-VTd: 6,3 x 106/kg; VTd 8,9 x 106/kg) ve mobilizasyonu tamamlayanlar arasındaVTd kolundakilere göre D-VTd grubundaki daha fazla hasta plerixafor aldı (D-VTd:%21,7;VTd:%7,9). Engraftrasyon ve hematopoetik yeniden yapılanma oranları, D-VTd ve VTdkollarında transplantasyon yapılan kişiler arasında benzerdi (D-VTd:%99,8; VTd:%99,6;transfüzyon olmaksızın geri kazanım ile ölçülen nötrofiller >0,5 x 109/L, lökositler >1 x 109/Lve trombositler >50 x 109/L). Pazarlama sonrası advers reaksiyonlar da dahil edilmiştir. İstenmeyen etkiler aşağıda sistem organ sınıfına (MedDRA) göre listelenmiştir. Sıklıklar; çok yaygın (>1/10), yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000) ve çok seyrek (<1/10.000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor) şeklinde tanımlanmıştır. Advers reaksiyonlar, her sıklık grubundailgili olduğu yerde azalan ciddiyet sırasında sunulmaktadır. Tablo 6: DARZALEX 16 mg/kg ile tedavi edilen multipl miyelom hastalarında görülen advers reaksiyonlar
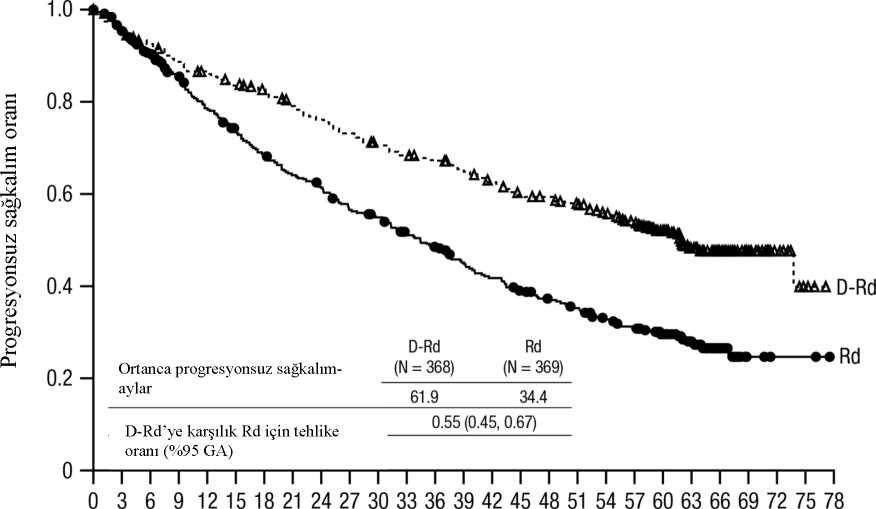
*Derece 4 yok. aTerim gruplandırmasını belirtir. bPazarlama sonrası advers reaksiyon. cİnfüzyonla ilişkili reaksiyonlar, araştırmacı tarafından infüzyon ile ilişkili olduğu belirlenen terimleri içerir (aşağıya bakınız). dİnsidans, MMY3003, MMY3006, MMY3008 ve MMY3013 çalışmalarından (COVID-19 pandemisinin başlangıcı) 01 Şubat 2020'de veya sonrasında en az bir doz çalışma tedavisi alanhastaların bir alt grubuna dayanmaktadır. Seçilmiş advers reaksiyonların listesiİnfüzyonla ilişkili reaksiyonlar (İİR)Klinik çalışmalarda (monoterapi ve kombinasyon tedavileri; N=2066), herhangi bir dereceden İİR insidansı ilk DARZALEX infüzyonu (16 mg/kg) ile %37, 2. infüzyon ile %2 ve sonrakiinfüzyonlar ile kümülatif olarak %6 olmuştur. 2. veya daha sonraki infüzyonlar ile, hastaların%1'inden daha azında infüzyonla ilişkili derece 3/4 reaksiyon görülmüştür. Reaksiyon başlangıcına kadar geçen medyan süre 1,5 saattir (aralık: 0 ila 72,8 saat). Reaksiyonlar nedeniyle infüzyonlara ara verme insidansı %36 olarak bulunmuştur. 16mg/kg'lık infüzyonlarm medyan infüzyon süreleri yaklaşık olarak 1. infüzyon, 2. infüzyon vesonraki infüzyonlar için sırasıyla; 7, 4 ve 3 saat olmuştur. İnfüzyonla ilişkili ciddi reaksiyonlar bronkospazm, dispne, laringeal ödem, pulmoner ödem, oküler advers reaksiyonlar (koroidal efüzyon, akut miyopi ve akut açı kapanması glokomudahil), hipoksi ve hipertansiyon olarak saptanmıştır. İnfüzyonla ilişkili diğer reaksiyonlar buruntıkanıklığı, öksürük, üşüme, boğaz iritasyonu, bulanık görme, kusma ve bulantı olmuştur (bkz.Bölüm 4.4). OKHT (çalışma MMY3006) esnasında medyan 3,75 (aralık: 2,4 ila 6,9) ayda DARZALEX dozu kesildiğinde, DARZALEX'in yeniden başlatılması üzerine, OKHT'yi takiben ilkinfüzyonda İİR insidansı %11 idi. Yeniden başlatma sonrasında kullanılan infüzyonhızı/seyreltme hacmi, OKHT'ye bağlı kesintiden önce son DARZALEX infüzyonu içinkullanıldı. OKHT'yi takiben DARZALEX'in yeniden başlatılmasında ortaya çıkan İİR'ler, 2.haftada veya daha sonraki infüzyonlarda önceki çalışmalarda bildirilenlerle semptomlar veciddiyet açısından (derece 3/4: <%1) tutarlıydı. Çalışma MMY1001'de, daratumumab kombinasyon tedavisi alan hastalara (n = 97), 1. günde ilk 16 mg/kg daratumumab dozu, 2 güne bölünmüş şekilde yayılarak, yani 1. gün ve 2. gündesırasıyla 8'er mg/kg daratumumab olarak uygulanmıştır. İnfüzyonla ilişkili herhangi birderecedeki reaksiyon insidansı %42 olmuştur. Hastaların %36'sı İİR'leri 1. haftanın 1.gününde, %4'ü 1. haftanın 2. gününde ve %8'i de devam eden diğer infüzyonlarda yaşamıştır.Bir reaksiyonun başlangıcına kadar geçen medyan süre 1,8 saattir (aralık: 0,1 ila 5,4 saat).Reaksiyonlara bağlı infüzyon kesintilerinin görülme sıklığı %30'dur. Medyan infüzyonsüreleri, 1. haftanın 1. gününde 4,2 saat, 1. haftanın 2. gününde 4,2 saat ve sonraki infüzyonlariçin 3,4 saat olmuştur. EnfeksiyonlarDARZALEX kombinasyon tedavisi alan hastalarda derece 3 ve 4 enfeksiyonlar bildirilmiştir. Relaps/refrakter hasta çalışmalarında; DVd: %21, Vd: %19; DRd: %28, Rd: %23; DPd: %28.Yeni tanılı hastalardaki çalışmalarda; D-VMP: %23, VMP: %15, DRd: %32, Rd: %23 D-VTd:%22, VTd: %20. Çalışmalarda en yaygın olarak bildirilen ciddi (derece 3 veya 4) enfeksiyon pnömoni olmuştur. Aktif kontrollü çalışmalarda, hastaların %1 ila %4'ünün tedavisi enfeksiyon nedeniylesonlandırılmıştır. Fatal enfeksiyonların primer olarak sepsis ve pnömonidenkaynaklanmaktadır. DARZALEX kombinasyon tedavisi alan hastalarda, fatal enfeksiyonlar (derece 5) aşağıdaki gibi bildirilmiştir: Relaps/refrakter hastaların yer aldığı çalışmalarda; DVd: %1, Vd: %2; DRd: %2, Rd: %1; DPd: %2 Yeni tanılı hastaların yer aldığı çalışmalarda; D-VMP: %1, VMP: %1; DRd: %2, Rd: %2; DVTd: %0, VTd: %0. Anahtar kelimeler: D=Daratumumab, Vd:Bortezomib-Deksametazon, Rd=Lenalidomid-Deksametazon, Pd=Pomalidomid-Deksametazon, VMP=Bortezomib-Melfalan-Prednizon, VTd=Bortezomib-Talidomid-Deksametazon. HemolizDARZALEX kullanımı ile teorik olarak hemoliz riski bulunmaktadır. Klinik çalışmalarda ve pazarlama sonrası güvenlilik verilerinde bu güvenlilik bulgusu sürekli olarak takip edilecektir. Diğer özel popülasyonlarOKHT'ye uygun olmayan yeni tanı konmuş multipl miyelom hastalarında D-VMP tedavisinin VMP tedavisiyle karşılaştırıldığı Faz 3 MMY3007 çalışmasında, Doğu Ortak Onkoloji Grubu(ECOG) performans skoru 2 olan alt grup hastaların güvenlilik analizi (D-VMP: n=89, VMP:n=84), genel popülasyon ile tutarlıydı (bkz. Bölüm 5.1). Yaşlı hastalarÖnerilen dozda DARZALEX alan 2459 hastanın %38'i 65 ila 75 yaş ve %15'i 75 yaş ve üzeri idi. Yaşa göre etkililik açısından genel farklılıklar gözlenmemiştir. Ciddi advers reaksiyonlarıninsidansı, yaşlı hastalarda daha genç hastalara kıyasla daha yüksek olmuştur. Relaps ve refraktermultipl miyelom hastaları (n=1213) arasında, yaşlılarda (>65 yaş) daha sık meydana gelen enyaygın ciddi advers reaksiyonlar pnömoni ve sepsistir. OKHT için uygun olmayan yeni tanımultipl miyelom hastaları (n=710) arasında, yaşlılarda (>75 yaş) daha sık meydana gelen enyaygın ciddi advers reaksiyon pnömonidir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9 Doz aşımı ve tedavisiSemptom ve bulgularKlinik çalışmalarda doz aşımı deneyimi yaşanmamıştır. Bir klinik çalışmada, 24 mg/kg'a kadar dozlar intravenöz olarak uygulanmıştır. TedaviDARZALEX doz aşımı için bilinen spesifik bir antidot mevcut değildir. Doz aşımı durumunda, hasta advers olayların bulgu ve belirtileri bakımından izlenmeli ve uygun semptomatik tedaviyehemen başlanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar ve antikor ilaç konjugatları, CD38 (Clusters of Differentiation 38) inhibitörleriATC kodu: L01FC01 Etki mekanizmasıDaratumumab, multipl miyelom tümör hücrelerinin yüzeylerinde yüksek düzeyde ve ayrıca diğer hücre tipleri ve dokuların yüzeylerinde çeşitli düzeylerde eksprese edilen CD38 proteininebağlanan bir IgGİK insan monoklonal antikorudur (mAb). CD38 proteini, reseptör aracılıadezyon, sinyal iletimi ve enzim aktivitesi gibi birden çok fonksiyona sahiptir. Daratumumabın, CD38 eksprese eden tümör hücrelerinin in vivoIn vitroçalışmalara göre, daratumumab birden fazla fonksiyonusayesinde, immün aracılı tümör hücresi ölümüne neden olabilmektedir. Bu çalışmalar,daratumumabın CD38 eksprese eden malignitelerde komplemana bağlı sitotoksisite, antikorabağlı hücre aracılı sitotoksisite ve antikora bağlı hücresel fagositoz aracılığıyla tümör hücrelizisini başlatabileceğini ortaya koymaktadır. Daratumumabın aracılık ettiği hücre lizisi;miyeloid kökenli supresör hücrelerden oluşan bir alt kümeyi (CD38+MDSCs), regülatör T(CD38+Tregs) ve B (CD38+Bregs) hücrelerini azaltmaktadır. T hücrelerinin (CD3+, CD4+ veCD8+) de, gelişim aşaması ve aktivasyon düzeyine bağlı olarak CD38 eksprese ettiğibilinmektedir. DARZALEX tedavisi ile periferik tam kan ve kemik iliğinde CD4+ ve CD8+ Thücre mutlak sayılarında ve lenfosit yüzdelerinde anlamlı artışlar gözlenmiştir. Ayrıca, T hücrereseptörü DNA sekanslamasında T hücre klonalitesinin daratumumab tedavisi ile arttığıdoğrulanmış ve immün modülatör etkilerin klinik yanıta katkı sağlayabileceği gösterilmiştir.Daratumumab, in vitroin vitroetkilerin klinik koşullarda anlamlılığı vetümör gelişimi üzerindeki yansımaları tam olarak anlaşılmamıştır.Farmakodinamik etkileriDoğal öldürücü (Natu^al Killer - NK) hücre ve T-hücre sayımıNK hücrelerinin yüksek düzeylerde CD38 eksprese ettiği bilinmektedir ve bu hücreler daratumumab aracılı hücre lizisine duyarlıdır. DARZALEX tedavisi ile periferik tam kan vekemik iliğinde toplam NK hücrelerin (CD16+CD56+) ve aktive NK hücrelerin(CD16+CD56dim) mutlak sayımları ve yüzdelerinde azalma gözlenmiştir. Bununla birlikte, NKhücrelerin başlangıç düzeyleri klinik yanıt ile bir ilişki sergilememiştir. İmmünojenisiteKlinik çalışmalarda intravenöz daratumumab ile tedavi edilen hastalarda, hastaların %1'inden azı tedaviyle ortaya çıkan anti-daratumumab antikorları geliştirmiştir. Klinik etkililik ve güvenlilikYeni tanı konulmuş multipl miyelomOKHT için uygun olmayan hastalarda lenalidomid ve deksametazon ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü bir Faz 3 çalışma olan MMY3008 çalışmasında, yenitanı multipl miyelomu olan hastalarda lenalidomid ve düşük doz deksametazon ile kombineedilen DARZALEX 16 mg/kg tedavisi (DRd), lenalidomid ve düşük doz deksametazon tedavisi(Rd) ile karşılaştırılmıştır. Lenalidomid (tekrarlanan 28 günlük [4 hafta] kürlerin 1-21.günlerinde günde bir kez oral yoldan alınan 25 mg) ile birlikte haftada 40 mg düşük doz oralya da intravenöz deksametazon (veya >75 yaş hastalar ya da beden kitle indeksi [BKİ] <18,5olan hastalar için haftada 20 mg'a azaltılmış doz) verilmiştir. DARZALEX infüzyonununuygulandığı günlerde, deksametazon dozu infüzyon öncesi ilaç olarak verilmiştir. Lenalidomidve deksametazon için doz ayarları üreticinin reçeteleme bilgilerine uygun olarakgerçekleştirilmiştir. Tedavi, her iki kolda hastalık progresyonu veya kabul edilemez toksisitegörülünceye kadar devam etmiştir.Toplam 737 hasta randomize edilmiştir: 368'i DRd koluna, 369'u ise Rd koluna. Başlangıçtaki demografik özellikler ve hastalık özellikleri iki tedavi grubu arasında benzer olmuştur. Medyanyaş 73 (aralık:45-90) ve hastaların %44'ü >75 yaşındaydı. Hastaların çoğunluğu beyaz (%92)ve erkek (%52) idi. %34'ünün ECOG performans skoru 0, %49,5'inin ECOG performans skoru1 ve %17'sinin ECOG performans skoru >2'ydi. Hastaların %27'sinde Uluslararası Evreleme Sistemi (ISS) evre I, %43'ünde ISS evre 2 ve %29'unda ISS evre 3 hastalık mevcuttu. Etkililik, Uluslararası Miyelom Çalışma Grubu(IMWG) kriterlerine dayanarak progresyonsuz sağkalıma (PFS) ve genel sağkalıma (OS) göredeğerlendirilmiştir. Ortalama 28 aylık takip süresiyle, MMY3008 çalışmasının birincil PFS analizi, Rd koluna kıyasla DRd kolunda artış göstermiştir; medyan PFS'ye DRd kolunda ulaşılmazken, Rdkolunda medyan PFS 31,9 ay olmuştur (risk oranı [HR]=0,56; %95 güven aralığı [CI]:0,43,0,73; p<0,0001), bu da DRd ile tedavi edilen hastalarda hastalık progresyonu veya ölümriskinde %44 oranında bir azalmayı yansıtmıştır. 64 aylık medyan takipten sonra güncellenmişbir PFS analizinin sonuçları, Rd koluna kıyasla DRd kolundaki hastalar için PFS'de bir iyileşmegöstermeye devam etmiştir. Medyan PFS, DRd kolunda 61,9 ay ve Rd kolunda 34,4 aydı(HR=0,55; %95 CI: 0,45, 0,67). Şekil 1: MMY3008 çalışmasında Kaplan-Meier PFS eğrisi
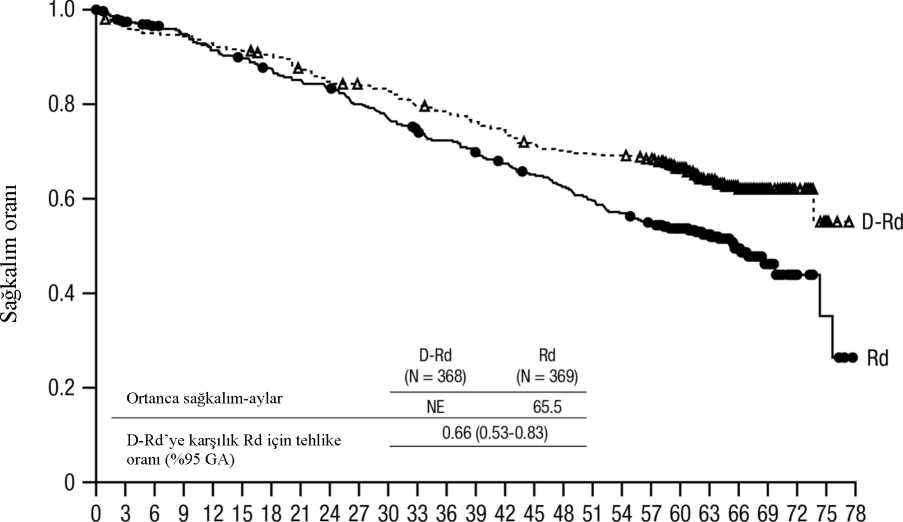
56 aylık medyan takip ile DRd, Rd koluna göre bir OS avantajı göstermiştir (HR=0,68; %95 CI: 0,53, 0.86; p=0,0013). Ortalama 64 aylık bir sürenin ardından güncellenmiş bir OSanalizinin sonuçları, Rd koluna kıyasla DRd kolundaki hastalar için OS'de bir iyileşmegöstermeye devam etmiştir. Medyan OS'ye DRd kolunda ulaşılmamıştır ve Rd kolunda 65,5aydır (HR=0,66; %95 CI: 0,53, 0,83).
MMY3008 çalışmasına ait ilave etkililik sonuçları aşağıda Tablo 7'de sunulmuştur. Tablo 7:MMY3008 çalışmasına ait ilave etkililik sonuçlarıa
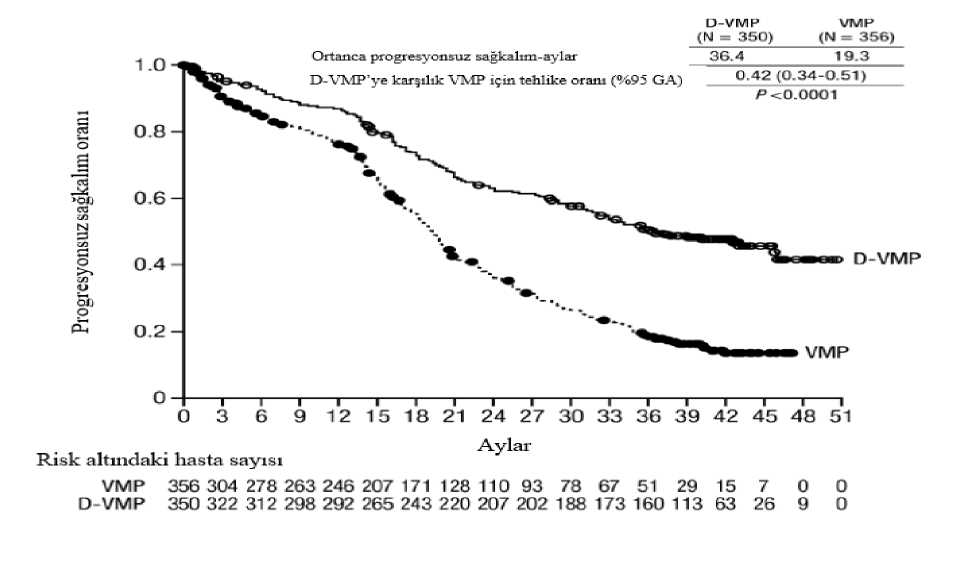
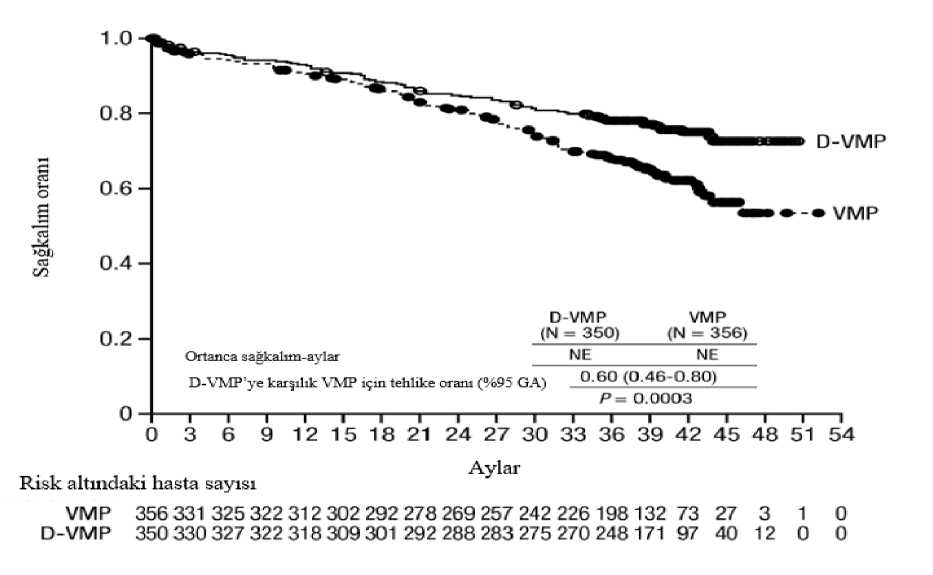
a Tedaviye niyet popülasyonuna dayalı. b p-değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır. c10-5 eşiğine dayalı. d Tabakalandırılmamış tablolar için Mantel-Haenszel olasılık oranı tahmini kullanılmıştır. Değeri >1 olan bir olasılık oranı DRd lehine avantaja işaret eder. e Fisher'in kesin testine göre p-değeri. Yanıt veren hastalarda yanıta kadar geçen medyan süre, DRd grubunda 1,05 ay (aralık:0,2 ila 12,1 ay) ve Rd grubunda 1,05 ay (aralık:0,3 ila 15,3 ay) olmuştur. Medyan yanıt süresine DRdgrubunda ulaşılmazken, Rd grubunda medyan yanıt süresi 34,7 ay (%95 CI:30,8, tahminedilemez) olmuştur. OKHT için uygun olmayan hastalarda bortezomib, melfalan ve prednizon (VMP) ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü bir Faz 3 çalışma olan MMY3007 çalışmasında, yeni tanı multipl miyelomu olan hastalarda bortezomib, melfalan ve prednizon ile kombine edilenDARZALEX 16 mg/kg tedavisi (D-VMP), VMP tedavisi ile karşılaştırılmıştır. Bortezomib, ilk6 haftalık kür için 1, 2, 4 ve 5. haftalarda olmak üzere haftada 2 kez (1. kür; 8 doz) ve sonrasında8 adet daha 6 haftalık kür için 1, 2, 4 ve 5. haftalarda olmak üzere haftada 1 kez (2-9. kürler; 4doz/kür) 1,3 mg/m2 vücut yüzey alanı dozunda subkutan enjeksiyon yoluyla uygulanmıştır.Melfalan 9 mg/m2 ve prednizon 60 mg/m2, 9 adet 6 haftalık kürün (1-9. kürler) 1-4. günlerindeoral yoldan uygulanmıştır. DARZALEX tedavisine, hastalık progresyonu veya kabul edilemeztoksisite görülünceye kadar devam edilmiştir. Toplam 706 hasta randomize edilmiştir: 350'si D-VMP koluna, 356'sı ise VMP koluna. Başlangıçtaki demografik özellikler ve hastalık özellikleri iki tedavi grubu arasında benzerolmuştur. Medyan yaş 71 (aralık: 40-93) ve hastaların %30'u >75 yaşındaydı. Hastalarınçoğunluğu beyaz (%85) ve kadın (%54) idi. %25'inin ECOG performans skoru 0, %50'sininECOG performans skoru 1 ve %25'inin ECOG performans skoru 2'ydi. Hastaların sırasıyla%64, %22 ve %10'unda IgG/Ig^haflf zincir miyelomu, %19'unda ISS evre 1, %42'sinde ISSevre 2, %38'inde ISS evre 3 hastalık ve %84'ünde standart risk sitogenetiği mevcuttu. Etkililik,IMWG kriterlerine dayanarak PFS'ye göre değerlendirilmiştir. Medyan 16,5 aylık takip süresiyle, MMY3007 çalışmasının birincil PFS analizi, VMP koluna kıyasla D-VMP kolunda bir iyileşme göstermiştir; medyan PFS'ye D-VMP kolundaulaşılmazken, VMP kolunda medyan PFS 18,1 ay olmuştur (HR=0,5; %95 CI:0,38, 0,65;p<0,0001). Medyan 40 aylık takip sonrası güncellenen PFS analizi sonuçlarında, VMP kolunakıyasla D-VMP kolundaki hastalar için PFS iyileşmesi göstermeye devam etmiştir. MedyanPFS D-VMP kolunda 36,4 ay, VMP kolunda medyan PFS 19,3 ay olmuştur (HR=0,42; %95CI:0,34, 0,51; p<0,0001), bu da D-VMP ile tedavi edilen hastalarda hastalık progresyonu veyaölüm riskinde %58 oranında bir azalmayı yansıtmıştır.
prednizon, MRD=minimal rezidüel hastalık, CI=güven aralığı aTedaviye niyet popülasyonuna dayalı.
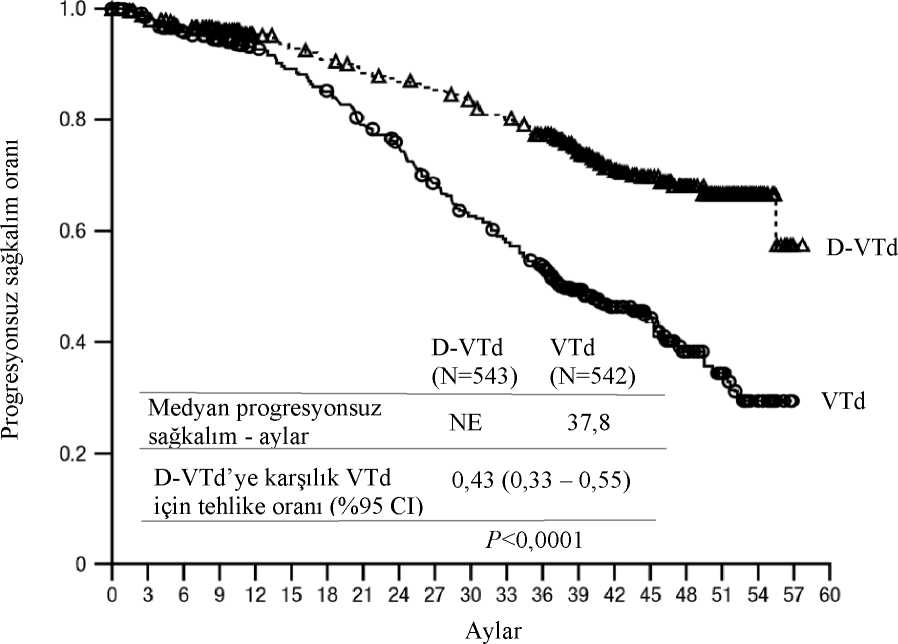
b p-değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır. c10-5 eşiğine dayalı. d Tabakalandırılmış tablolar için Mantel-Haenszel ortak olasılık oranı tahmini kullanılmıştır. Değeri > 1 olan bir olasılık oranı D-VMP lehine avantaja işaret eder.eFisher'in kesin testine göre p-değeri. Yanıt veren hastalarda yanıta kadar geçen medyan süre, D-VMP grubunda 0,79 ay (aralık:0,4 ila 15,5 ay) ve VMP grubunda 0,82 ay (aralık:0,7 ila 12,6 ay) olmuştur. Medyan yanıt süresineD-VMP grubunda ulaşılmazken, VMP grubunda medyan yanıt süresi 21,3 ay (aralık: 18,4,tahmin edilemez) olmuştur. En az 70 yaşında olan veya 65-69 yaş aralığında olup ECOG performans skoru 2 olan ya da 65 yaşın altında olup anlamlı bir komorbiditesi veya ECOG performans skoru 2 olan hastalarda(D-VMP: n=273, VMP: n=270) bir alt grup analizi gerçekleştirilmiştir. Bu alt grupta elde edilenetkililik sonuçları genel popülasyon ile tutarlılık göstermiştir. Bu alt grupta, medyan PFS'ye D-VMP kolunda ulaşılmazken, VMP kolunda medyan PFS 17,9 ay olmuştur (HR=0,56; %95CI:0,42, 0,75; p<0,0001). Genel yanıt oranı D-VMP grubunda %90 ve VMP grubunda %74olmuştur (VGPR oranı: D-VMP grubunda %29 ve VMP grubunda %26; CR:D-VMP grubunda%22 ve VMP grubunda %18; sCR oranı:D-VMP grubunda %20 ve VMP grubunda %7). Bu altgrupta elde edilen güvenlilik sonuçları genel popülasyon ile tutarlılık göstermiştir. Ayrıca,ECOG performans skoru 2 olan hasta alt grubunun (D-VMP: n=89, VMP: n=84) güvenlilikanalizi de genel popülasyon ile tutarlı olmuştur. OKHT için uygun hastalarda bortezomib, talidomid ve deksametazon (VTd) ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü bir Faz 3 çalışma olan 2 bölümlü MMY3006 çalışmasında, bölüm 1'de OKHT için uygun yeni tanı multipl miyelomu olan hastalardabortezomib, talidomid ve deksametazon ile kombine edilen DARZALEX 16 mg/kg tedavisi(D-VTd), bortezomib, talidomid ve deksametazon (VTd) tedavisi ile karşılaştırılmıştır.Tedavinin konsolidasyon fazı, OKHT'den minimum 30 gün sonra hasta yeterli düzeydeiyileştiği ve engraftman tamamlandığı zaman başlamıştır. Bölüm 2'de, nakil sonrası 100. günekadar en azından kısmi bir yanıta (PR) sahip olan hastalar 1:1 oranında daratumumab idameveya sadece gözlemek üzere yeniden randomize edilmiştir. Bundan sonra sadece 1. bölümdenelde edilen sonuçlar açıklanacaktır. Bortezomib, tekrarlanan 28 günlük (4 hafta) indüksiyon tedavi kürlerinde (1-4. kürler) ve 4. kürün ardından OKHT sonrasında 2 konsolidasyon küründe (5 ve 6. kürler) 2 hafta süreyle haftada 2 kere (1, 4, 8 ve 11. günler) 1,3 mg/m2 vücut yüzey alanı dozunda subkutan enjeksiyon veya intravenöz infüzyon yoluyla verilmiştir. Talidomid, 6 bortezomib kürü boyunca günde100 mg dozda oral yoldan uygulanmıştır. Deksametazon (oral veya intravenöz), 1 ve 2. kürlerin1, 2, 8, 9, 15, 16, 22 ve 23. günlerinde 40 mg ve 3-4. kürlerin 1-2. günlerinde 40 mg ve dahasonraki doz günlerinde (8, 9, 15, 16. günler) 20 mg dozda verilmiştir. 5 ve 6. kürlerin 1, 2, 8, 9,15, 16. günlerinde deksametazon 20 mg uygulanmıştır. DARZALEX infüzyonununuygulandığı günlerde, deksametazon dozu infüzyon öncesi ilaç olarak verilmiştir. Bortezomib,talidomid ve deksametazon için doz ayarları üreticinin reçeteleme bilgilerine uygun olarakgerçekleştirilmiştir. Toplam 1085 hastanın 543'ü D-VTd, 542'si ise VTd koluna randomize edilmiştir. Başlangıçtaki demografik özellikler ve hastalık özellikleri iki tedavi grubu arasında benzerolmuştur. Medyan yaş 58'di (aralık: 22 ila 65). Tüm hastalar < 65 yaşındaydı. %43'ü > 60-65yaş grubunda, %41'i > 50-60 yaş grubunda ve %16'sı 50 yaş altındaydı. Hastaların çoğunluğuerkek (%59) idi. %48'inin ECOG performans skoru 0, %42'sinin ECOG performans skoru 1ve %10'unun ECOG performans skoru 2'ydi. Hastaların %40'ında ISS evre 1, %45'inde ISSevre 2 ve %15'inde ISS evre 3 hastalık mevcuttu. Etkinlik, transplantasyon sonrası 100. günde kesin tam yanıt (sCR) oranı ve PFS ile değerlendirilmiştir. Tablo 9: MMY3006 çalışmasına ait etkililik sonuçları®
D-VTd=daratumumab-bortezomib-talidomid-deksametazon, VTd=bortezomib-talidomid-deksametazon, MRD=minimal rezidüel hastalık, CI=güven aralığı, HR=Tehlike Oranı. aTedaviye niyet popülasyonuna dayalı. b p-değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır. c10"5 eşiğine dayalı. d IMWG başına yanıttan bağımsız olarak. e Tabakalandırılmış tablolar için Mantel-Haenszel ortak olasılık oranı tahmini kullanılmıştır. 18.8 aylık bir medyan takip ile, ikinci randomizasyonda daratumumab idamesine randomizeedilen hastaların sansürlenmesiyle yapılan birincil PFS analizi, ikinci randomizasyon tarihindeHR=0,5; %95 CI: 0,34, 0,75; p=0,0005 olarak göstermiştir. İkinci randomizasyondadaratumumab idamesine randomize edilen hastaları sansürleyen, medyan takip süresi 44,5 aylıkolan güncellenmiş bir PFS analizinin sonuçları, HR=0,43; %95 CI: 0,33, 0,55; p<0,0001göstermiştir. Medyan PFS'ye D-VTd kolunda ulaşılamamıştır ve VTd kolunda meydan PFS 37.8 aydır.
Şekil 5: MMY3006 çalışmasında Kaplan-Meier PFS eğrisi
Relaps/refrakter multipl mi-yelom MonoterapiÖnceki tedavisi bir proteazom inhibitörü ve bir immünomodülatör ajan içeren ve son tedavide hastalığı ilerlemiş olan yetişkin relaps ve refrakter multipl miyelom hastalarının tedavisindekiDARZALEX monoterapisinin klinik etkililiği ve güvenliliği, iki açık etiketli çalışmadagösterilmiştir. MMY2002 çalışmasında, 106 relaps ve refrakter multipl miyelom hastasına hastalık progresyonuna kadar 16 mg/kg DARZALEX verilmiştir. Medyan hasta yaşı 63,5 olup (aralık31 ila 84); hastaların %11'i > 75 yaşında, hastaların %49'u erkek ve %79'u beyaz ırktanhastalardan oluşmuştur. Hastalara, daha önce medyan 5 basamak tedavi uygulanmıştır.Hastaların %80'ine daha önce OKHT uygulanmıştır. Daha önce uygulanan tedavilerbortezomib (%99), lenalidomid (%99), pomalidomid (%63) ve karfilzomibi (%50) içermiştir. Başlangıçta, hastaların %97'si son basamak tedaviye refrakter olup, %95'i proteazom inhibitörü (PI) ve immünomodülatör ajana (IMiD), %77'si alkilleyici ajanlara, %63'üpomalidomide ve %48'i karfilzomibe refrakterdi. Bağımsız İnceleme Kurulu (BİK) değerlendirmesine dayalı önceden planlanmış ara analizin etkinlik sonuçları, Tablo 10'da sunulmaktadır. Tablo 10: MMY2002 çalışmasının BİK tarafından değerlendirilen etkililik sonuçları
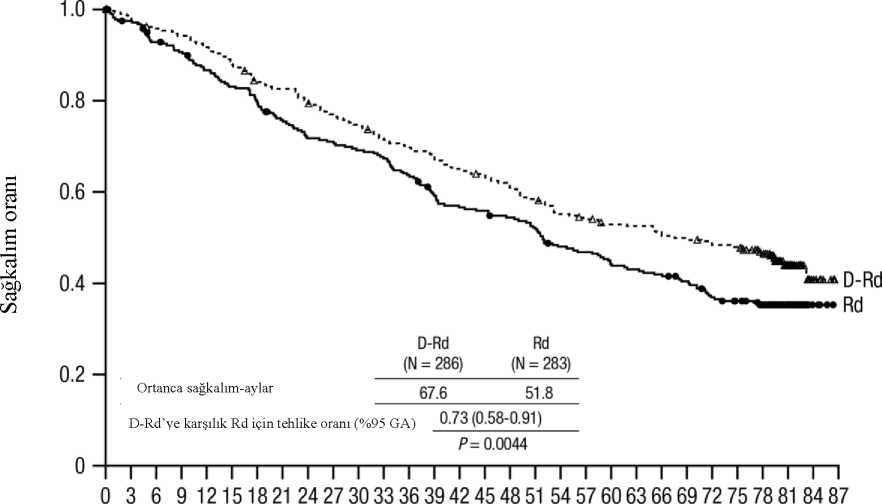
MMY2002 çalışmasında ORR, önceki anti-miyelom tedavisinin tipinden bağımsız olarak benzer bulunmuştur. Medyan 14,7 aylık takip süresi ile yapılan sağkalım güncellemesinde, medyan OS 17,5 ay olarak bulunmuştur (%95 CI: 13,7, tahmin edilemez). GEN501 çalışmasında, 42 relaps ve refrakter multipl miyelom hastasına hastalık progresyonuna kadar 16 mg/kg DARZALEX verilmiştir. Medyan hasta yaşı 64 olup (aralık: 44 ila 76),hastaların %64'ü erkek ve %76'sı beyaz ırktan hastalardan oluşmuştur. Çalışmadaki hastalara,daha önce medyan 4 basamak tedavi uygulanmıştır. Hastaların %74'üne daha önce OKHTuygulanmıştır. Daha önce uygulanan tedaviler bortezomib (%100), lenalidomid (%95),pomalidomid (%36) ve karfilzomibi (%19) içermiştir. Başlangıçta, hastaların %76'sı sonbasamak tedaviye refrakter olup, %64'ü hem PI hem IMiD'e, %60'ı alkilleyici ajanlara, %36'sıpomalidomide ve %17'si karfilzomibe refrakterdi. Önceden planlanmış ara analizde, 16 mg/kg dozda daratumumab tedavisinin %5 CR ve %5 VGPR ile %36 ORR'ye yol açtığı görülmüştür. Yanıta kadar geçen medyan süre 1 ay olmuştur(aralık: 0,5 ila 3,2). Medyan yanıt süresine ulaşılmamıştır (%95 CI: 5,6 ay, tahmin edilemez). Medyan 15,2 aylık takip süresi ile yapılan sağkalım güncellemesinde, gönüllülerin %74'ünün halen hayatta olmasıyla medyan OS'ye ulaşılmamıştır (%95 CI: 19,9, tahmin edilemez). Lenalidomid ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü bir Faz III çalışma olan MMY3003 çalışmasında, daha önce en az bir tedavi alan multipl miyelomlu hastalarda, lenalidomid ve düşük dozdadeksametazon ile kombine edilen DARZALEX 16 mg/kg tedavisi (DRd), lenalidomid ve düşükdozda deksametazon tedavisi (Rd) ile karşılaştırılmıştır. Lenalidomid (tekrarlanan 28 günlük[4 hafta] siklusların 1. gününden 21. gününe kadar günde bir kez oral yoldan alınan 25 mg) ilebirlikte haftada 40 mg düşük doz deksametazon (veya > 75 yaş hastalar veya BMI < 18,5 olanhastalar için haftada 20 mg'a azaltılmış doz) verilmiştir. DARZALEX infüzyonunun verildiği günlerde, deksametazon dozunun 20 mg'ı infüzyon öncesi ilaç olarak, geri kalan kısmı ise infüzyondan sonraki gün verilmiştir. Tedavi her iki kolda hastalık progresyonu veya kabuledilemez toksisite görülünceye kadar devam etmiştir. 286'sı DRd koluna, 283'ü ise Rd koluna olmak üzere toplam 569 hasta randomize edilmiştir. Başlangıçtaki demografik özellikler ve hastalık özellikleri DARZALEX ve kontrol koluarasında benzer olmuştur. Medyan hasta yaşı 65 yıl (aralık: 34 ila 89) olup hastaların %11'i >75 yaşındaydı. Daha önce lenalidomid alan hastaların %18'i de dahil, hastaların çoğu (%86)daha önce bir PI ve %55'i daha önce bir IMiD kullanmıştır ve hastaların %44'ü daha önce hemPI hem de IMiD kullanmıştır. Başlangıçta, hastaların %27'si son tedavi basamağına refrakterdi.Hastaların %18'i yalnızca bir PI'ne, %21'i ise bortezomibe refrakterdi. Lenalidomide refrakterolan hastalar çalışmaya dahil edilmemiştir. Medyan 13,5 aylık takip süresiyle, MMY3003 çalışmasının ilk PFS analizi, Rd koluna kıyasla DRd kolunda bir iyileşme göstermiştir; medyan PFS'ye DRd kolunda ulaşılmazken, Rdkolunda medyan PFS 18,4 ay olmuştur (HR=0,37; %95 CI:0,27, 0,52; p<0,0001). Medyan 55aylık takip sonrası güncellenmiş bir PFS analizinin sonuçları, Rd koluna kıyasla DRd kolundakihastalar için PFS iyileşmesi göstermeye devam etmiştir. Medyan PFS DRd kolunda 45 ay, Rdkolunda medyan PFS 17,5 ay olmuş (HR=0,44; %95 CI:0,35, 0,54; p<0,0001), bu da DRd iletedavi edilen hastalarda hastalık progresyonu veya ölüm riskinde %56 oranında bir azalmayıyansıtmıştır (bkz. şekil 6). Şekil 6: MMY3003 çalışmasında PFS'nin Kaplan-Meier eğrisi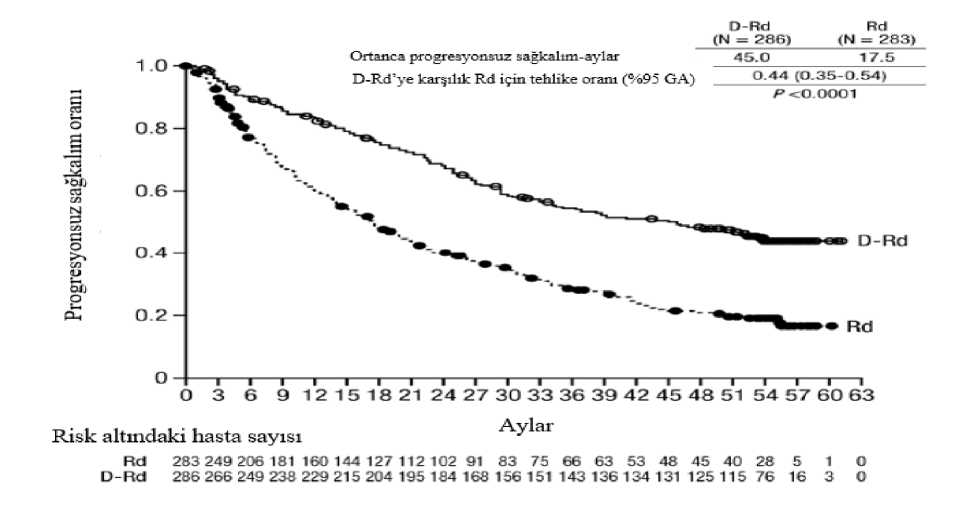
80 aylık medyan takip sonrasında DRd, Rd koluna göre OS avantajı göstermiştir (HR=0,73; %95 CI: 0,58, 0,91; p=0,0044). Medyan OS, DRd kolunda 67,6 ay ve Rd kolunda 51,8 aydır.
MMY3003 çalışmasına ait ilave etkililik sonuçları aşağıda, Tablo 11'de sunulmuştur. Tablo 11: MMY3003 çalışmasına ait ilave etkililik sonuçları
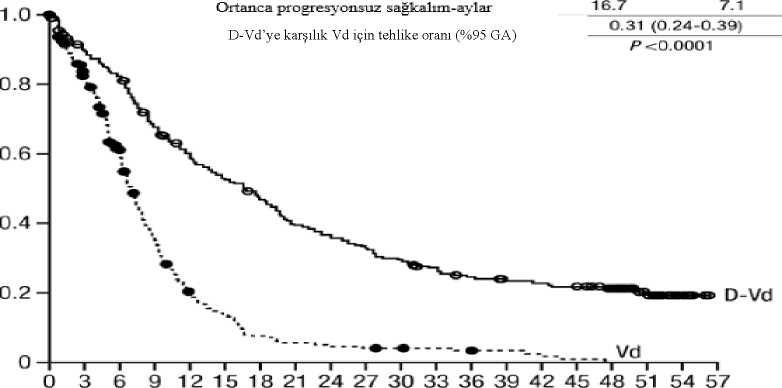
DRd = daratumumab-lenalidomid-deksametazon, Rd = lenalidomid-deksametazon, MRD = minimal rezidüel hastalık, CI = güven aralığı, NE = tahmin edilemez. a p-değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır.b Intent-to-treat popülasyonu ve 10-5 eşiği esas alınmıştır. c Mantel-Haenszel ortak olasılık oranı tahmini kullanılmıştır. Değeri > 1 olan bir olasılık oranı DRd lehine avantaja işaret eder.d Fisher'in kesin testine göre p-değeri. Bortezomib ile kombinasyon tedavisiAçık etiketli, randomize, aktif kontrollü bir Faz III çalışma olan MMY3004 çalışmasında, daha önce en az bir tedavi alan multipl miyelomlu hastalarda, bortezomib ve deksametazon ilekombine edilen DARZALEX 16 mg/kg tedavisi (DVd), bortezomib ve deksametazon tedavisi(Vd) ile karşılaştırılmıştır. Bortezomib, tekrarlanan 21 günlük (3 hafta) tedavi sikluslarında 2hafta süreyle haftada iki kere (1, 4, 8 ve 11. günler) 1,3 mg/m2 vücut yüzey alanı dozunda olmaküzere subkutan enjeksiyon veya intravenöz enjeksiyon yoluyla toplam 8 siklus boyuncaverilmiştir. Deksametazon, 8 bortezomib siklusunun her birinin 1, 2, 4, 5, 8, 9, 11 ve 12.günlerinde oral yoldan 20 mg dozunda (3 haftalık her bir bortezomib siklusunun ikisi içinhaftada 80 mg) verilirken > 75 yaş hastalar, VKİ değeri < 18,5 olan hastalar, diyabeti yeterincekontrol altına alınamayan hastalar veya daha önce steroid tedavisini tolere edemeyen hastalarahaftada 20 mg'lık azaltılmış dozda verilmiştir. DARZALEX infüzyonunun uygulandığıgünlerde, deksametazon dozunun 20 mg'lık kısmı infüzyon öncesi ilaç olarak verilmiştir.DARZALEX tedavisine, hastalık progresyonu veya kabul edilemez toksisite görülünceye kadardevam edilmiştir. 251'i DVd koluna, 247'si ise Vd koluna olmak üzere toplam 498 hasta randomize edilmiştir. Başlangıçtaki demografik ve hastalık özellikleri DARZALEX ve kontrol kolu arasında benzerolmuştur. Medyan hasta yaşı 64 yıl (aralık: 30 ila 88) olup hastaların %12'si > 75 yaşındaydı.Hastaların %69'u daha önce bir PI (%66'sı bortezomib), %76'sı ise IMiD (%42'si lenalidomid)kullanmıştır. Başlangıçta, hastaların %32'si son tedavi basamağına refrakterdi. Hastaların%33'ü yalnızca bir IMiD'e, %28'i ise lenalidomide refrakterdi. Bortezomibe refrakter olanhastalar çalışmaya dahil edilmemiştir. Medyan 7,4 aylık takip süresiyle, MMY3004 çalışmasının ilk PFS analizi, Vd koluna kıyasla DVd kolunda bir iyileşme göstermiştir; medyan PFS'ye DVd kolunda ulaşılmazken, Vdkolunda medyan PFS 7,2 ay olmuştur (HR [%95 CI]: 0,39 [0,28, 0,53]; p<0,0001). Medyan 50aylık takip sonrası güncellenmiş bir PFS analizinin sonuçları, Vd koluna kıyasla DVd kolundakihastalar PFS iyileşmesi göstermeye devam etmiştir. Medyan PFS'ye DVd kolunda 16,7 ay, Rdkolunda medyan PFS 7,1 ay olmuştur (HR [%95 CI]: 0,31 [0,24, 0,39]; p<0,0001), bu da DVdkarşı Vd ile tedavi edilen hastalarda hastalık progresyonu veya ölüm riskinde %69 oranında birazalmayı yansıtmıştır (bkz. Şekil 8).
Vd 247182129 74 39 27 15 11 9876542 1 0000 D-Vd 251 215198161138 1 23109 9 2 85 77 68 61 54 50 48 4638 20 7 073 aylık medyan takip sonrasında DVd, Vd koluna göre OS avantajı göstermiştir (HR=0,74; %95 GA: 0,59, 0,92; p=0,0075). Medyan OS, DVd kolunda 49,6 ay ve Vd kolunda 38,5 aydır. Şekil 9: MMY3004 çalışmasında OS'nin Kaplan-Meier eğrisi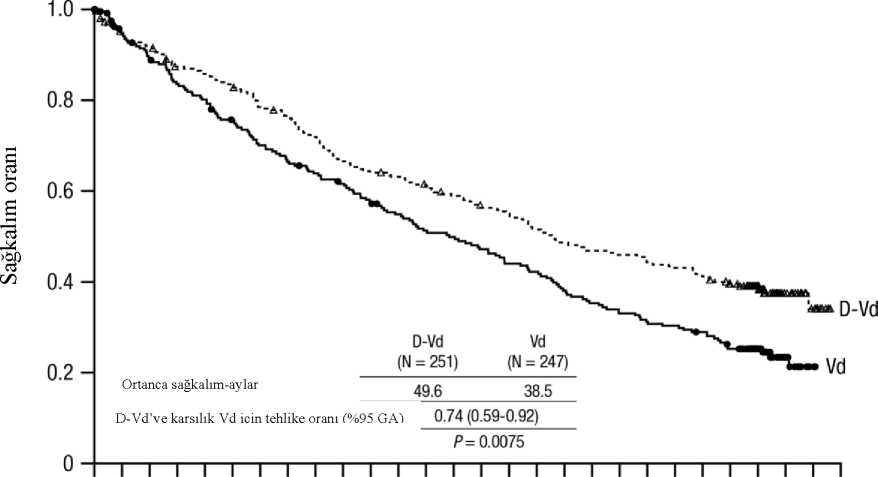 0369121518212427303336394245485154576063666972757881
MMY3004 çalışmasına ait ilave etkililik sonuçları aşağıda, Tablo 12'de sunulmuştur. Tablo 12: MMY3004 çalışmasına ait ilave etkililik sonuçları
DVd = daratumumab-bortezomib-deksametazon, Vd = bortezomib-deksametazon, MRD = minimal rezidüel hastalık, CI = güven aralığı, NE = tahmin edilemez. a p-değeri Cochran Mantel-Haenszel Ki-Kare testi ile hesaplanmıştır.b Intent-to-treat popülasyonu ve 10-5 eşiği esas alınmıştır. c Mantel-Haenszel ortak olasılık oranı tahmini kullanılmıştır. Değeri >1 olan bir olasılık oranı DVd lehine avantaja işaret eder.d Fisher'in kesin testine göre p-değeri. Kardiyak elektrofizyolojiBüyük bir protein olarak DARZALEX'in iyon kanallarıyla doğrudan etkileşime girme olasılığı düşüktür. Daratumumabın QTc aralığı üzerindeki etkisi relaps ve refrakter multipl miyelomlu83 hastayı kapsayan açık etiketli bir çalışmada (GEN501 çalışması) daratumumabinfüzyonlarından (4 ila 24 mg/kg) sonra değerlendirilmiştir. Lineer karışık PK-PD analizleri,daratumumabın maksimum konsantrasyonlarında (Cmax), ortalama QTcF aralığında hiçbirbüyük artış (20ms'den daha büyük) göstermemiştir. 5.2 Farmakokinetik özelliklerDaratumumabın farmakokinetiği (PK), relaps ve refrakter multipl miyelom hastalarına 0,1 mg/kg ila 24 mg/kg doz aralığında intravenöz yoldan uygulanan daratumumabmonoterapisini takiben değerlendirilmiştir. Daratumumabın PK özelliklerini tanımlamak ve multipl miyelomu olan hastalarda kovaryatların daratumumab dağılımına etkisini değerlendirmek için 4 popülasyonfarmakokinetiği analizi yapılmıştır; Analiz 1 (n=223) DARZALEX monotreapisi ile tedaviedilen multipl miyelom hastalarını değerlendirirken, Analiz 2 (n=694), Analiz 3 (n=352) veAnaliz 4 (n=355) daratumumab kombinasyon tedavileri ile tedavi edilen hastalarıdeğerlendirmiştir. Analiz 2'ye 694 hasta (n=326; lenalidomid-deksametazon, n=246;bortezomib-deksametazon, n=99; pomalidomid-deksametazon, n=11; bortezomib-melfalan-prednizolon, n=12; bortezomib-talidomid-deksametazon) Analiz 3'e 352 hasta (bortezomib-melfalan-prednizolon) ve Analiz 4'e 355 hasta (lenalidomid-deksametazon) dahil edilmiştir. Daratumumab kombinasyon tedavileri alan multipl miyelom hastaları ile ek 3 popülasyon PK analizleri (Analiz 2, Analiz 3 ve Analiz 4) yürütülmüştür. Daratumumab konsantrasyon-zamanprofilleri, monoterapi ve kombinasyon tedavilerinden sonra benzerlik göstermiştir. 4 adet popülasyon PK analizine göre (Analiz 1-4), vücut ağırlığı daratumumab için istatistiksel olarak anlamlı bir eşdeğişken olarak belirlenmiştir. Dolayısıyla, multipl miyelom hastaları içinvücut ağırlığına dayalı dozlama uygun bir dozlama stratejisidir. Multipl miyelomlu 1309 hastada önerilen tüm dozlama planı için daratumumab farmakokinetiğinin simülasyonu yapılmıştır. Simülasyon sonuçları, ilk doz için bölünmüş vetek dozlamanın tedavinin ilk günü PK profili hariç benzer PK sağladığını doğrulamıştır. Emilim:Tavsiye edilen monoterapi planı ve 16 mg/kg dozun haftalık dozlamasının sonunda, ortalama ± SD (standart sapma) serum Cmax değeri 915 (410,3) mcg/mL ile ilk infüzyondan sonragörülenin yaklaşık 2,9 katı olmuştur. Haftalık dozlamanın sonunda ortalama ± SD doz öncesi(dip) serum konsantrasyonu 573 (331,5) mcg/mL olmuştur. PK analizi temel alınarak DARZALEX monoterapi olarak uygulandığında, daratumumab kararlı durumuna 4 haftalık dozlama periyodunun yaklaşık 5. ayında (21. infüzyonla)ulaşılmıştır. Daratumumab için kararlı durumda ortalama ± SD Cmax'ın ilk dozdan sonra erişilenCmax a oranı 1,6 ± 0,5 idi. Dağılım:Daratumumabın ortalama ± SD merkezi dağılım hacmi 56,98 (18,07) mL/kg'dır. Dağılım hacmi, plazma kompartımanına ilk dağılım ile tutarlı olmuştur. Biyotransformasyon:Bir IgG1^ mAb olarak, daratumumab'ın diğer herhangi bir endojen IgG ile aynı şekilde biyotransforme olması beklenir (katabolik yolaklar aracılığıyla küçük peptidlere ve aminoasitlere indirgenir). Eliminasyon:Daratumumabın konsantrasyon-zaman eğrisi (EAA eğrisi) altındaki alanda artışlar dozla orantılıdan daha fazlası olmuş ve klirens artan doz ile azalma göstermiştir. Bu gözlemler,CD38'in daha yüksek dozlarla doyurulabileceğini, ardından hedef bağlanma klirensininetkisinin en aza indirildiğini ve daratumumab klirensinin endojen IgG1'in lineer klirensineyaklaştığını göstermektedir. Ayrıca klirens çoklu dozlarla azalmaktadır ki bu da tümör yükününazalmasına bağlı olabilir. Daratumumabın kombinasyon tedavisindeki doğrusal klirens ile ilişkili ortalama tahmini terminal yarı ömrü yaklaşık 15-23 gündür. Artan doz ve tekrarlanan dozlama ile terminal yarı ömrü artar. İlk 16 mg/kg dozundan sonra daratumumab'ın ortalama ± SD tahmini terminal yarı ömrü 9 ± 4,3 gündür. Daratumumab'ınson 16 mg/kg dozundan sonra tahmini terminal yarı ömrü artmıştır, ancak güvenilir bir tahminiçin yeterli veri bulunmamaktadır. Popülasyon PK analizine dayalı olarak, lineer klirens ileilişkili ortalama ± SD tahmini terminal yarı ömrü, monoterapi olarak onaylanmış DARZALEXdozunun uygulanmasından sonra 18 ± 9 gündür; bu, hedef aracılı klirensin tam doygunluğu vedaratumumab dozunun tekrarlanması üzerine beklenebilecek terminal yarılanma ömrüdür.DARZALEX kombinasyon tedavisi olarak uygulandığında terminal yarı ömrü benzer olmuştur. Doğrusallık/doğrusal olmayan durum:Daratumumabın konsantrasyon-zaman eğrisi (EAA) altındaki alanı monoterapi olarak 1 ila 24 mg/kg veya kombinasyon tedavisi olarak 1 ila 16 mg/kg bir dozaj aralığında orantılı olarakdaha fazla artar. 1 ila 24 mg/kg kohortlarında, ilk dozdan sonra pik serum konsantrasyonları (Cmax) doza yakın oranla artmıştır. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Böbrek yetmezliği olan hastalarda DARZALEX ile resmi çalışmalar yürütülmemiştir. DARZALEX monoterapisi ya da çeşitli kombinasyon tedavileri (Analiz 1-4) alan hastalardaönceden var olan böbrek fonksiyonu verilerine dayanılarak, böbrek fonksiyonu normal(kreatinin klirensi [CrCL] >90 mL/dk) olan toplam 441 hasta, hafif böbrek yetmezliği (CrCL<90 ve >60 mL/dk) olan 621 hasta, orta derecede böbrek yetmezliği (CrCL <60 ve >30 mL/dk)olan 523 hasta ve ağır böbrek yetmezliği veya son evre böbrek yetmezliği (CrCL <30 mL/dk)olan 27 hastanın yer aldığı 3 bireysel popülasyon PK analizleri gerçekleştirilmiştir. Böbrekyetmezliği olan hastalar ile böbrek fonksiyonu normal olan hastalar arasında daratumumabmaruziyeti yönünden klinik olarak önemli farklılıklar gözlenmemiştir. Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda DARZALEX ile resmi çalışmalar yürütülmemiştir. Daratumumab gibi IgG1 molekülleri hepatik yollardan metabolize edilmediğinden, karaciğerfonksiyonundaki değişikliklerin daratumumab eliminasyonunu etkileme olasılığıbulunmamaktadır. Daratumumab monoterapisi veya çeşitli kombinasyon tedavileri alan hastalarda yürütülen 4 bireysel popülasyon PK analizi (Analiz 1-4), normal hepatik fonksiyonu olan 1404 hastayı(toplam bilirubin [TB] ve aspartat aminotransferaz [AST] < normalin üst sınırı [ULN]), hafifkaraciğer yetmezliği olan 189 hastayı (TB 1 x ila 1,5 x ULN veya AST> ULN) ve orta şiddetli(TB> 1,5 x ila 3 x ULN; n=7) ya da ciddi (TB> 3 x ULN; n=1) karaciğer yetmezliği olan 8hastayı içeriyordu. Karaciğer yetmezliği olan hastalar ile normal hepatik fonksiyonları olanhastalar arasında daratumumab maruziyetinde klinik olarak anlamlı farklılıklar gözlenmedi. Yaş ve cinsiyet:Daratumumab monoterapisi ya da çeşitli kombinasyon terapileri alan hastalarda yürütülen 4 bireysel popülasyon PK analizlerine (1-4) göre, yaşın (aralık: 31 - 93 yaş) daratumumabınfarmakokinetiği üzerinde klinik olarak anlamlı bir etkisi yoktur ve daratumumab maruziyetinindaha genç (<65 yaş, n=518) ve yaşlı hastalar (yaş > 65 ila <75; n=761, yaş >75; n=334) arasındabenzer olduğu görülmüştür. PK analizlerinde cinsiyet daratumumab maruziyetini klinik olarak ilgili bir derecede etkilememiştir. Irk:Daratumumabı monoterapi veya çeşitli kombinasyon tedavileri olarak (Analiz 1-4) alan hastalarda yürütülen 4 bireysel popülasyon PK analizlerine dayanarak, daratumumabamaruziyet beyaz (n=1371) ve beyaz olmayan (n=242) gönüllüler arasında benzer olmuştur. 5.3 Klinik öncesi güvenlilik verileriŞempanzelerde daratumumab ile ve sinomolgus maymunlarda temsili anti-CD38 antikoru ile yapılan çalışmalardan toksikoloji verileri elde edilmiştir. Kronik toksisite testigerçekleştirilmemiştir. Karsinojenisite ve m-atajenisiteDaratumumabın karsinojenik potansiyelini belirlemek için hayvan çalışmaları gerçekleştirilmemiştir. Üreme toksikolojisiDaratumumabın üreme ve gelişim üzerindeki potansiyel etkilerini değerlendirmek için hayvan çalışmaları gerçekleştirilmemiştir. FertiliteErkek ve kadınlarda fertilite üzerindeki potansiyel etkilerini belirlemek için hayvan çalışmaları gerçekleştirilmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiGlasiyel asetik asit Mannitol (E 421) Polisorbat 20 Sodyum asetat trihidratSodyum klorürEnjeksiyonluk su 6.2 GeçimsizliklerBu tıbbi ürün, Bölüm 6.6'da belirtilenler dışında diğer tıbbi ürünlerle karıştmlmamalıdır. 6.3 Raf ÖmrüAçılmamış flakonlar24 ayDilüsyon sonrasıMikrobiyolojik açıdan, açma/seyreltme yöntemi mikrobiyolojik kontaminasyon riskini önlemediği sürece, ürün hemen kullanılmalıdır. Hemen kullanılmadığı takdirde, kullanımsırasında saklama süreleri ve koşulları kullanıcının sorumluluğundadır ve ışıktan korunaraksoğutucu koşullarında (2°C - 8°C) en fazla 24 saat ve ardından oda sıcaklığında (15°C - 25°C)ve oda ışığında 15 saat (infüzyon süresi dahil) olmalıdır. Buzdolabında saklanıyorsa,uygulamadan önce çözeltinin ortam sıcaklığına ulaşması beklenmelidir. 6.4 Saklamaya yönelik özel tedbirlerBuzdolabında saklayınız (2 °C-8 °C). Dondurulmaz. Işıktan korumak için, orijinal ambalajında saklayınız. Tıbbi ürünün seyreltildikten sonraki saklama koşulları için Bölüm 6.3'e bakınız. 6.5 Ambalajın niteliği ve içeriği100 mg daratumumab içeren elastomerik ve alüminyum kapaklı tip 1 cam flakon içerisinde 5 mL konsantre. Ambalaj büyüklüğü 1 flakondur. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. Bu tıbbi ürün, yalnızca tek kullanımlıktır. İnfüzyonluk çözelti, aseptik teknik kullanarak aşağıdaki gibi hazırlanır: Gerekli DARZALEX çözeltisinin dozu (mg), toplam hacmi (mL) ve gerekli DARZALEXflakonu sayısı hastanın vücut ağırlığına göre hesaplanır. DARZALEX çözeltisinin renksiz ila sarı renkli olduğu kontrol edilir. Opak partiküller,renk değişimi veya başka yabancı partiküller varsa, çözelti kullanılmaz. Aseptik teknik kullanılarak, gerekli DARZALEX çözeltisi hacmine eşit miktarda 9mg/mL (%0,9) sodyum klorür enjeksiyonluk çözelti hacmi infüzyontorbasından/kabından atılır. Gereken miktarda DARZALEX çözeltisi çekilir ve 9 mg/mL (%0,9) sodyum klorürenjeksiyonluk çözelti içeren infüzyon torbasına/kabına eklenerek uygun hacme seyreltilir(bkz. Bölüm 4.2). İnfüzyon torbaları/kapları, polivinilklorür (PVC), polipropilen (PP),polietilen (PE) veya poliolefin karışımından (PP+PE) yapılmış olmalıdır. Uygun aseptikkoşullar altında seyreltilir. Flakon içerisinde kalan kullanılmamış ürün atılır. Çözeltiyi karıştırmak için torba/kap nazikçe ters çevrilir. Çalkalanmaz. Parenteral tıbbi ürünler, uygulanmadan önce partikül madde ve renk değişimi yönündengörsel olarak incelenir. Daratumumab bir protein olduğundan, seyreltilen çözeltide çokküçük, yarı saydam ila beyaz proteinöz partiküller ortaya çıkabilir. Gözle görülür birşekilde opak partiküller, renk değişimi veya başka yabancı partiküller mevcut ise, çözeltikullanılmaz. DARZALEX koruyucu madde içermediğinden, seyreltilmiş çözeltiler oda sıcaklığında(15°C - 25°C) ve oda ışığında 15 saat içerisinde (infüzyon süresi dahil) uygulanmalıdır. Hemen kullanılmayan seyreltilmiş çözeltiler, uygulamadan önce buzdolabında(2°C - 8°C) ve ışıktan korunarak 24 saat süreyle saklanabilir. Dondurulmaz.Buzdolabında saklanıyorsa, uygulamadan önce çözeltinin ortam sıcaklığına ulaşmasıbeklenmelidir. Seyreltilen çözelti, akış regülatörü ve in-line, steril, pirojenik olmayan, proteinlerebağlanma oranı düşük polietersülfon (PES) filtre (por boyutu 0,22 veya 0,2 mikrometre)donanımlı bir infüzyon seti kullanarak intravenöz infüzyon yoluyla uygulanır. Poliüretan(PU), polibutadien (PBD), PVC, PP veya PE uygulama setleri kullanılmalıdır. DARZALEX infüzyonu, diğer ajanlar ile aynı intravenöz hattan uygulanmaz. İnfüzyon çözeltisinin kullanılmamış kısmını yeniden kullanmak için saklamayın.Kullanılmamış bir ürün veya atık materyali, bölgesel gereklilikler uyarınca bertarafedilmelidir. 7. RUHSATI SAHİBİJohnson and Johnson Sıhhi Mal. San. ve Tic. Ltd. Şti. Kavacık/Beykoz/İstanbul 8. RUHSATI NUMARASI/NUMARALARI2017/957 9. ILK RUHSAT TARTHT/RUHSAT YENILEME TARIHIİlk ruhsat tarihi: 29.12.2017 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENILENME TARIHI |
İlaç BilgileriDarzalex 100 Mg/5 Ml İnfüzyonluk Çözelti Hazırlamak İçin KonsantreEtken Maddesi: Daratumumab Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.