Nuvaring 11,7 Mg/2,7 Mg Vajinal Salım Sistemi Kısa Ürün BilgisiKISA ÜRÜN BILGISI1. BEŞERI TIBBİ ÜRÜNÜN ADINUVARING 11,7 mg/2,7 mg vajinal ilaç taşıyıcı sistem 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:NUVARING 11,7 mg etonogestrel ve 2,7 mg etinilestradiol içerir. Halka 3 haftalık bir dönemde, günde ortalama sırasıyla 120 mikrogram ve 15 mikrogram etonogestrel ve etinilestradiol salınımı yapar. Yardımcı madde(ler):Yardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMVajinal halka. NUVARING; Dış çapı 54 mm ve kalınlığının çapı 4 mm olan, esnek, saydam, renksiz ya da neredeyse renksiz bir halkadır. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarKontrasepsiyon. NUVARING doğurganlık çağındaki kadınlara yöneliktir. Güvenlilik ve etkililiği 18 - 40 yaş arası kadınlarda belirlenmiştir. NUVARING reçetelenme kararında kadının mevcut risk faktörleri, özellikle venöz tromboembolizm (VTE) için risk faktörleri ve NUVARING kullanımıyla VTE riskinin diğerkombine hormonal kontraseptiflerle (KHK) karşılaştırması göz önünde bulundurulmalıdır (bkz.bölüm 4.3 ve 4.4). 4.2. Pozoloji ve uygulama şekliPozoloji:Başarılı bir kontraseptif etkinlik için NUVARING, tarif edildiği şekilde kullanılmalıdır (bkz. 'NUVARING nasıl kullanılır' ve 'NUVARING kullanmaya nasıl başlamalı'). Uygulama sıklığı ve süresi:NUVARING kullanmaya nasıl başlamalıÖnceki siklusta hormonal kontraseptif kullanılmadığında:NUVARING menstrüasyonun ilk gününde yerleştirilmelidir (örn. menstrüel kanamanın ilk gününde). Etki 2-5. günlerde başlar, ancak NUVARING kullanımının ilk 7 günü sırasında ekolarak prezervatif gibi bir bariyer yöntemi kullanımı önerilmektedir. Bir kombine hormonal kontraseptiften geçiş yapmak:Kadın NUVARING'i en geç daha önce kullandığı kombine hormonal kontraseptifin, olağan tabletsiz, flastersiz ya da plasebo tabletli dönemi sonrasındaki gün yerleştirmelidir. Eğer kadın önceki metodunu sürekli ve doğru olarak kullanıyorsa ve gebe olmadığı kesin ise, döngünün herhangi bir gününde önceki kombine hormonal kontraseptiften geçiş yapabilir. iterğe'TaRiİJ ActiAl^^.tariflyedt^'^ tr/saglik-titck-ebys
Sadece progestogen yönteminden (minipil, implant veya enjeksiyon) veya bir progestogen-salgılayan intrauterin sisteminden (IUS) geçiş yapmak:Kadın minipil'den herhangi bir günde (implanttan veya hormon içeren rahim içi araç çıkarıldığı gün, enjeksiyon yönteminde bir sonraki enjeksiyonun uygulanma tarihinde) geçiş yapabilirfakat bu olguların tamamında NUVARING kullanımmın ilk 7 günü boyunca ek bir bariyeryöntemi kullanmalıdır. hk trimester düşüğü sonrasında:Kadın derhal kullanmaya başlayabilir. Böylece, ek kontraseptif önlem alma gereği ortadan kalkar. Eğer hemen ardından bir uygulama istenmiyorsa, 'önceki siklusta hormonal kontraseptifkullanılmadığında' başlığı altında bildirilmiş tavsiyeler dikkate alınmalıdır (ya da izlenmelidir).Bu sırada, alternatif bir kontrasepsiyon yöntemi kullanılması önerilir. Doğum ya da ikinci trimester düşüğü sonrasında:Emziren kadın için bölüm 4.6.'ya bakınız. Kadınlara doğum ya da ikinci trimester düşüğünü izleyen dördüncü hafta sırasında kullanıma başlamaları önerilmelidir. Daha geç başlangıç yapan kadınlara NUVARING kullanımının ilk 7gününde ek bir bariyer yöntemi kullanmaları önerilmelidir. Bununla birlikte, öncesinde cinselilişki gerçekleşmişse, NUVARING kullanmaya başlamadan önce hamilelik dışlanmalı ya dakadın ilk adet dönemine kadar beklemelidir. Önerilen rejimden sapmalarKadın önerilen rejime uymaz ise, kontraseptif etkinlik ve siklus kontrolü bozulabilir. Bir sapma durumunda kontraseptif etkililik kaybını önlemek amacıyla şunlar önerilebilir: Halkasız dönemin uzamış olması durumunda ne yapılmalıKadın anımsadıktan sonra derhal yeni bir halka yerleştirmelidir. Yerleştirmeyi izleyen 7 gün boyunca prezervatif gibi ek bir bariyer yöntemi kullanılmalıdır. Halkasız dönemde bir cinselilişki gerçekleşmiş ise, hamilelik olasılığı düşünülmelidir. Halkasız dönemin uzunluğuarttıkça hamilelik riski artacaktır. Halka geçici olarak vajina dışına çıkmış ise ne yapılmalıNUVARING 3 haftalık bir kesintisiz dönem boyunca vajina içinde bırakılmalıdır. Eğer halka yanlışlıkla çıkarılmış ise soğuk ya da ılık (sıcak değil) sıcaklıktaki su ile çalkalanarakderhal yeniden yerleştirilmelidir. Eğer NUVARING vajinanın dışında 3 saatten kısa bir süreboyunca kalmış ise kontraseptif etkililikte bir azalma olmaz. Kadın mümkün olan en kısa sürede, ancak en geç 3 saat içindehalkayı yeniden yerleştirmelidir.Eğer kullanımın 1. ya da 2. haftalarında NUVARING 3 saati aşan bir sürevajina dışında kaldıysa ya da bundan şüpheleniliyorsa kontraseptif etkililikte azalma olabilir. Kadınanımsamasını takiben halkayı derhal geri yerleştirmelidir. NUVARING vajina içindekesintisiz 7 gün bulunma süresini tamamlayana kadar, ek olarak prezervatif gibi bir bariyeryöntemi kullanılmalıdır. NUVARING'in vajina dışında kalma süresi ne kadar uzunsa ve budurum halkasız döneme ne kadar yakınsa, gebelik riski o kadar yüksektir.
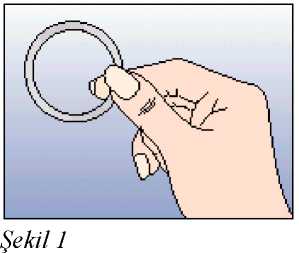
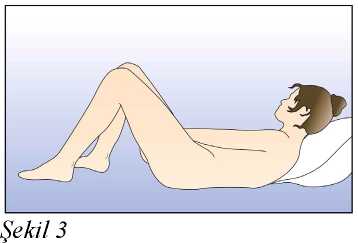
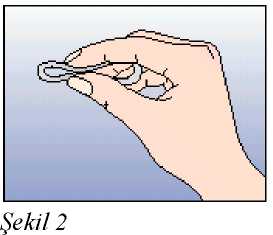
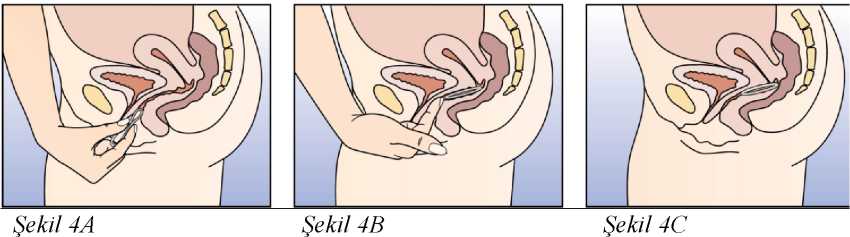
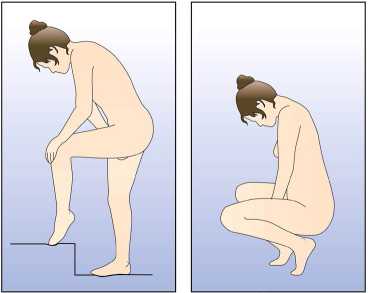
Eğer 3 haftalık kullanım periyodunun 3. haftasında NUVARING 3 saati aşan bir sürevajina dışında kaldıysa ya da bundan şüpheleniliyorsa kontraseptif etkinlikte azalma olabilir.Kadın halkayı çıkarmalı ve aşağıdaki iki seçenekten birini seçmelidir:1. Hemen yeni bir halka yerleştirilmelidir. Not: Yerleştirilen yeni halka ile sonraki üç haftalık kullanım periyodu başlayacaktır. Kadın önceki siklusundan geri çekilme kanaması yaşamayabilir. Ancak ani kanama velekelenme meydana gelebilir. 2. Çekilme kanaması gerçekleştikten sonra ve önceki halkanın çıkarılmasından veyaatılmasından sonra 7 gün geçmeden (7x24 saat) bir yeni halka yerleştirilmelidir. Not: Bu seçenek sadece, eğer halka önceki 7 günde devamlı kullanıldıysa seçilmelidir. NUVARING, bilinmeyen bir süre boyunca vajina dışına çıkmışsa, hamilelik olasılığı göz önünde bulundurulmalıdır. Yeni bir halka takılmadan önce bir gebelik testi yapılmalıdır. Halka kullanım süresi aşılmış ise ne yapılmalıHer ne kadar bu önerilen bir rejim olmasa da, NUVARING maksimum 4 hafta4 haftadan uzunbir süre bırakılmışsa, kontraseptif etkililik azalabilir ve yeni bir NUVARING halkasıyerleştirilmeden önce hamilelik dışlanmalıdır.Kadın önerilen rejime bağlı kalmamış ve sonrasında izleyen halkasız dönemde herhangi bir çekilme kanaması olmamış ise yeni bir NUVARING yerleştirme öncesinde hamilelikdışlanmalıdır. Adet dönemi nasıl kaydırılır ya da geciktirilirBir dönemi geciktirmekisteyen bir kadın halkasız dönem geçirmeden yeni bir halka yerleştirebilir. Bir sonraki halka yine 3 hafta süreyle kullanılabilir. Kadın kanama ya dalekelenme yaşayabilir. Düzenli NUVARING kullanımına daha sonra bir haftalık olağanhalkasız dönemden sonra yeniden başlanır.Dönemi olağan mevcut programında yer alandan başka bir hafta gününe kaydırmakUygulama şekli:NUVARING nasıl kullanılırNUVARING vajinaya kadının kendisi tarafından yerleştirilebilir. Hekim, kadına NUVARING'in nasıl yerleştirileceği ve çıkartılacağı konusunda önerilerde bulunmalıdır.Yerleştirme sırasında kadın, örn. bir bacağını kaldırma, çömelme ya da uzanma gibi kendisiiçin en uygun pozisyonu seçecektir. NUVARING iki yandan sıkıştırılmalı ve rahat hissedilenekadar vajina içine sokulmalıdır. NUVARING'in vajina içindeki kesin konumu halkanınkontraseptif etkisi açısından kritik değildir (bkz. Şekil 1-4). NUVARING bir kez yerleştirildikten sonra (bkz. 'NUVARING kullanmaya nasıl başlamalı') 3 hafta boyunca sürekli olarak vajina içinde bırakılmalıdır. KadınlaraNUVARING'in vajinadaki varlığını düzenli^ kontrol etmeleri tavsiye edilmelidir (örn. Cinsel Belge DolISG yanİlşiıkaapdlşlrl:htÇıskarsa,
geçici olarak vajina dışına çıkmış ise ne yapılmalı' başlığı altında (daha fazla bilgi için, bkz bölüm 4.4 'Çıkarma') verilen talimatlar izlenmelidir. NUVARING, yerleştirme sonrasında 3 hafta kullanıldıktan sonra yine haftanın aynı günü çıkartılmalıdır. Yeni halka, bir haftalık halkasız dönem sonrası yerleştirilir (örn. NUVARINGÇarşamba günü saat 22:00 dolayında yerleştirilmiş ise 3 hafta sonra yine Çarşamba günü saat22:00 dolayında çıkartılacaktır. Onu izleyen Çarşamba günü yeni halka yerleştirilecektir).(Şekil5).Kullanılmış halka poşete yerleştirilmeli (çocuk ve ev hayvanlarından uzak tutunuz) ve bölüm6.6' da tanımlandığı üzere çöpe atılmalıdır. NUVARING'in çıkartılmasından genellikle 2-3gün sonra çekilme kanaması başlar ve yeni halka yerleştirene dek tamamen kesilmeyebilir.Diğer vajinal korunma yöntemleri ile kullanım NUVARING, diyafram, servikal başlık veya kadın kondomu gibi belirli kadın korunma yöntemlerinin doğru yerleşimini ve pozisyonunu etkileyebilir. Bu kontraseptif yöntemler,destek yöntemler olarak NUVARING ile birlikte kullanılmamalıdır. NUVARING parmaklarla nasıl yerleştirilir?
 Şekil 5
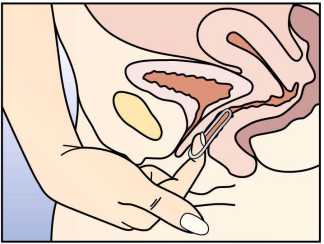 NUVARING işaret parmağının kanca şeklinde kıvrılması ve halkanın işaretparmağı ve orta parmak arasındakavranması ve dışarı doğru çekilmesiyoluyla çıkartılabilir.Özel popülasyonlara ilişkin ek bilgiler:Geriyatrik popülasyon:Geriyatrik popülasyonda kullanımı uygun değildir. Pediyatrik popülasyon:NUVARING'in etkililiği ve güvenliliği 18 yaş altındaki adolesanlarda çalışılmamıştır. Böbrek yetmezliği:Böbrek hastalığının NUVARING'in farmakokinetik özellikleri üzerindeki etkisini değerlendiren bir çalışma yapılmamıştır. Karaciğer yetmezliği:Karaciğer hastalığının NUVARING'in farmakokinetik özellikleri üzerindeki etkisini değerlendiren hiçbir çalışma yapılmamıştır. Ancak karaciğer fonksiyon bozukluğu olankadınlarda, steroid hormonlarının metabolizması azalmış olabilir. 4.3. KontrendikasyonlarKHK aşağıda belirtilen koşullarda kullanılmamalıdır. NUVARING kullanımı sırasında bu koşulların herhangi biri ilk kez ortaya çıktığında halka derhal çıkartılmalıdır. NUVARING aktif bileşenlerine ya da 6.1 bölümünde listelenen herhangi bir yardımcımaddeye aşırı duyarlılık, Venöz tromboembolizm (VTE) varlığı ya da riski, - Venöz tromboembolizm - mevcut VTE (antikoagülan kullanırken) veya VTE öyküsü(örn. derin ven trombozu [DVT] veya pulmoner embolizm [PE]) - Aktive protein C (APC) direnci, antitrombin III eksikliği, protein C eksikliği, protein Seksikliği, gibi venöz tromboembolizm için bilinen kalıtsal veya edinilmiş predispozisyon - Uzun süre hareketsiz kalınan majör cerrahi (bkz. bölüm 4.4)  - Çoklu risk faktörlerinin varlığı nedeniyle yüksek venöz tromboembolizm riski (bkz.bölüm 4.4) Arteriyel tromboembolizm (ATE) varlığı ya da riski, - Arteriyel tromboembolizm - mevcut arteriyel tromboembolizm, arteriyeltromboembolizm öyküsü (örn. miyokard infarktüsü) veya prodromal durum (örn. anginapektoris) - Serebrovasküler hastalık - mevcut inme, inme öyküsü veya prodromal durum öyküsü(örn. geçici iskemik atak, GİA) - Hiperhomosisteinemi ve antifosfolipid antikorları (antikardiolipin antikorları, lupusantikoagulan) gibi arteriyel tromboembolizm için bilinen kalıtsal veya edinilmişpredispozisyon - Fokal nörolojik semptomların eşlik ettiği migren öyküsü - Çoklu risk faktörlerinin (bkz. bölüm 4.4) veya aşağıdaki ciddi risk faktörlerinin herhangibirinin varlığı nedeniyle yüksek arteriyel tromboembolizm riski: ¦ Vasküler tutulumun eşlik ettiği diabetes mellitus ¦ Ciddi hipertansiyon ¦ Ciddi dislipoproteinemi Pankreatit veya ciddi hipertrigliseridemi ile birlikte pankreatit öyküsü, Karaciğer fonksiyonu ile ilgili değerlerin normale dönmediği ciddi karaciğer hastalığı varlığı veya öyküsü, Karaciğer tümörlerinin (benign ya da malign) varlığı ya da öyküsü, Bilinen veya kuşkulanılan, seks-stseroidlerinin etkili olduğu genital organların veya memelerin habis durumları, Tanısı konmamış vajinal kanama, Gebelik ya da gebelik şüphesi. NUVARING'in ombitasvir / paritaprevir / ritonavir ve dasabuvir veya glekaprevir / pibrentasvir içeren tıbbi ürünlerle eş zamanlı kullanımı kontrendikedir (bkz. bölüm 4.4 ve bölüm 4.5). 4.4. Özel kullanım uyarıları ve önlemleriAşağıda belirtilen durumlar ya da risk faktörlerinden herhangi birinin varlığında, NUVARING'in uygunluğu kadın ile tartışılmalıdır. Bu durumlar ya da risk faktörlerininherhangi birinde ağırlaşma ya da ilk kez ortaya çıkma söz konusu olduğunda kadınınNUVARING kullanımının durdurulup durdurulmayacağına karar vermek için hekimi iletemasa geçmesi tavsiye edilmelidir. 1. Dolaşım bozukluklarıVenöz tromboembolizm (VTE) riski Herhangi bir kombine hormonal kontraseptifin (KHK) kullanımı hiç kullanım olmamasına kıyasla venöz tromboembolizm (derin ven trombozu ve pulmoner embolizm) riskini artırır. Levonorgestrel,norgestimat veya noretisteron en düşük VTE riskiyleilişkilendirilmiştir. NUVARING gibi diğer ürünlerde risk seviyesi bunun iki katına kadar olabilir. En düşük VTE riski olan ürün dışında herhangi bir ürününkullanılmasına, NUVARING'le VTE riski, mevcut risk faktörlerinin riski nasıletkilediği ve kullanımın ilk yılında VTE riskinin en fazla olduğu kadınlakonuşulduktan sonra karar verilmelidir. Buna ek olarak, 4 hafta veya daha uzun süreKHK kullanımından sonra ara verilip tekrar başlandığında, riskin arttığına dairbulgular vardır.
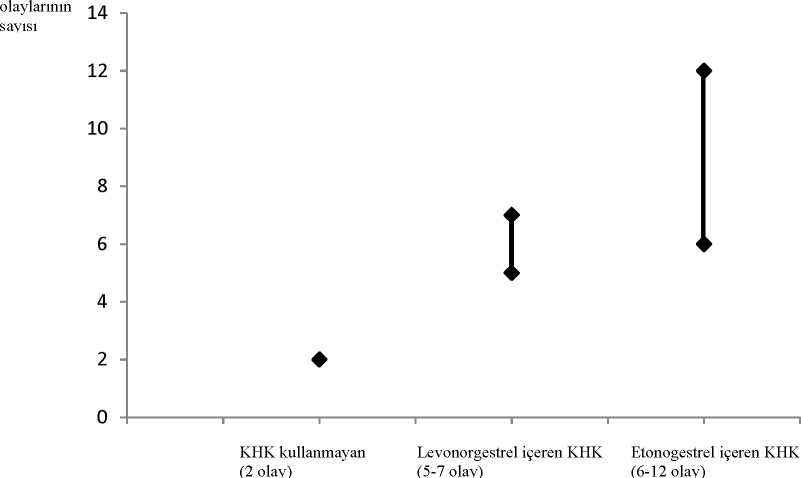
KHK kullanmayan veya hamile olmayan kadınlarda, bir yıl içinde 10.000 kadından 2'sindeVTE gerçekleşir. Ancak, bir kadındaki kişisel risk, altta yatan risk faktörlerine (bkz.aşağıdaki bölüm) bağlı olarak, çok daha yüksek olabilir. Levonorgestrel içeren düşük doz KHK kullanan 10.000 kadından yaklaşık 6'sında bir yıliçerisinde VTE gelişeceği tahmin edilmektedir1. NUVARING'le levonorgestrel içerenKHK'lerin karşılaştırılmasında VTE riskiyle ilgili tutarsız sonuçlar elde edilmiştir (görecerisk tahminleri hiç artış olmamasından [risk oranı, RO=0,96], neredeyse iki katı risk artışına[RO=1,90] kadar değişkendir). Bu, bir yılda NUVARING kullanan 10.000 kadından 6 ila12'sinde VTE'ye karşılık gelmektedir. Her iki durumda da bir yıldaki VTE sayısı, hamile olan veya postpartum dönemdekikadınlarda beklenen sayıdan daha düşüktür. Vakaların %1 ila 2'sinde VTE ölümcül olabilir.
KHK kullanıcılarında hepatik, mezenterik, renal ya da retinal venler ve arterler gibi diğer kan damarlarında son derece seyrek olarak tromboz bildirilmiştir. VTE için risk faktörleriKHK kullanan, ilave risk faktörleri olan bir kadında, özellikle birden fazla risk faktörü varsa (bkz. aşağıdaki tablo) venöz tromboembolik komplikasyon riski büyük oranda artabilir. Birden fazla risk faktörü nedeniyle yüksek venöz tromboz riski olan kadınlarda NUVARING kontrendikedir (bkz. bölüm 4.3). Bir kadında birden fazla risk faktörü varsa, risk artışı,faktörlerin teker teker risk toplamından daha yüksek olabilir - bu durumda kadının toplam VTEriski değerlendirilmelidir. Risk yarar dengesi negatif olarak değerlendiriliyorsa, KHKreçetelenmemelidir (bkz. bölüm 4.3). Bu belge Belge Do
Venöz trombozun başlangıcı veya progresyonunda varikoz venlerin veya süperfisyaltromboflebitin olası rolü hakkında fikir birliği yoktur. Hamilelik sırasında, özellikle doğum sonrası 6 haftalık dönemde, artmış tromboembolizmriski göz önünde bulundurulmalıdır (gebelik ve laktasyon bilgileri için bkz. bölüm 4.6). VTE'nin semptomları (derin ven trombozu ve pulmoner emboli)Kadınlara semptomlar görüldüğü takdirde acil tıbbi yardıma başvurmaları ve ilgili sağlık çalışanına KHK kullandıklarını belirtmeleri gerektiği söylenmelidir. Derin ven trombozunun (DVT) semptomları aşağıdakileri içerir; - her iki bacak ve/veya ayakta ya da bacakta bir vende şişme; - bacakta, yalnızca ayağa kalkarken veya yürürken hissedilebilen a veya hassasiyet; - bacakta sıcaklık artışı; bacak derisinin kızarması veya soluklaşması Pulmoner emboli (PE) semptomları aşağıdakileri içerir: - sebebi belli olmayan ani nefes darlığı veya hızlı nefes alıp verme; - hemoptiziyle birlikte olabilen ani öksürme; - keskin göğüs ası; - ciddi sersemlik veya baş dönmesi; - hızlı veya düzensiz kalp atımı Bu semptomların bazıları (örn. nefes darlığı, öksürme) spesifik değildir ve daha yaygın veya ciddiyeti daha düşük olaylar şeklinde yanlış yorumlanabilir (örn. solunum yoluenfeksiyonu). Vasküler oklüzyonun diğer ^^ilirtileTi, '®bii"'tefestrfeffliiede'§ani a, şişme veya hafif mavi
soluklaşmayı içerir. Oklüzyon gözde gerçekleşirse göz semptomları görme kaybına kadar ilerleyebilen asız görme bulanıklığı kadar çeşitli olabilir. Bazen görme kaybı aniden gerçekleşebilir. Arteriyel embolizm (ATE) riskiEpidemiyolojik çalışmalar KHK kullanımını artmış arteriyel tromboembolizm (miyokard infarktüsü) veya serebrovasküler olay (geçici iskemik atak, inme) riski ile ilişkilendirmiştir.Arteriyel tromboembolik olaylar ölümcül olabilir. ATE için risk faktörleriKHK kullananlarda arteriyel tromboembolik komplikasyon veya serebrovasküler olay riski, risk faktörü olan kadınlarda artar (bkz. aşağıdaki tablo). Yüksek arteriyel tromboz riskine nedenolacak ciddi bir risk faktörü veya birden fazla risk faktörü olan bir kadında NUVARINGkontrendikedir (bkz. bölüm 4.3). Bir kadında birden fazla risk faktörü varsa, risk artışı,faktörlerin teker teker risk toplamından daha yüksek olabilir - bu durumda kadının toplam riskideğerlendirilmelidir. Risk yarar dengesi negatif olarak değerlendiriliyorsa, KHKreçetelenmemelidir (bkz. bölüm 4.3).
ATE semptomlarıKadınlara, semptomlar görüldüğü takdirde acil tıbbi yardıma başvurmaları ve ilgili sağlık çalışanına KHK kullandıklarını belirtmeleri gerektiği söylenmelidir. Serebrovasküler olay semptomları aşağıdakileri içerir: - özellikle vücudun bir tarafında yüz, kol veya bacakta ani uyuşukluk veya zayıflık; - ani yürüme güçlüğü, baş dönmesi, denge veya koordinasyon kaybı; - ani konfüzyon, konuşma veya anlama güçlüğü; - bir gözde veya her ikisinde ani göTımâegüçlıüğüi ile imzalanmıştır. - nedeni bilinmeyen ani, ciddi ve uzun süreli baş ası;  - nöbetle birlikte veya nöbet olmadan bilinç kaybı veya bayılma. Semptomların geçici olması olayın geçici iskemik atak (GİA) olduğuna işaret eder. Miyokard infarktüsü (Mİ) semptomları aşağıdakileri içerir: - göğüs, kol veya göğüs kemiğinin altında a, rahatsızlık, basınç, ağırlık, sıkışma veyadoluluk hissi; - sırt, çene, boğaz, kol ve karna uzanan a; - tokluk, hazımsızlık veya tıkanıklık hissi; - terleme, bulantı, kusma veya sersemlik; - aşırı halsizlik, anksiyete veya nefes darlığı; - hızlı veya düzensiz kalp atımı. Şüphelenilen veya doanmış VTE veya ATE durumunda, KHK kullanımı kesilmelidir.Antikoagülan tedavinin (kumarinler) teratojenisitesi nedeniyle uygun kontrasepsiyonbaşlatılmalıdır. 2. TümörlerEpidemiyolojik çalışmalar oral kontraseptiflerin uzun süre kullanımının, humanpapillomavirus (HPV) ile enfekte kadınlarda serviks kanseri gelişimi için bir risk faktörüolduğunu göstermektedir. Bununla birlikte, bu bulgunun karışıklığa neden olan etkilerdenne derece etkilendiği konusunda halen belirsizlik vardır (örn., seks partnerlerinin sayısındaveya bariyer yöntemlerin kullanımında farklar). NUVARING kullanıcılarında servikskanseri riskine dair hiçbir epidemiyolojik veri mevcut değildir (bkz. 'Tıbbimuayene/konsültasyon'). 54 epidemiyolojik çalışmanın meta-analizi, halen kombine oral kontraseptif (KOK)kullanmakta olan kadınlarda meme kanseri tanısı görece riskinin (NR=1.24) bir miktar dahayüksek olduğunu bildirmektedir. Bu yüksek risk, KOK kullanımının bırakılmasını izleyen10 yıl boyunca kademeli olarak azalır. Meme kanserinin 40 yaş altı kadınlarda seyrekgörülmesinden ötürü, halen ya da yakın tarihlerde KOK kullananlarda yüksek meme kanseritanı sayısı meme kanseri genel riskine kıyasla düşük olmaktadır. Herhangi bir zamanda KOKkullanmış olan kadınlarda konulan meme kanseri tanısı, hiç KOK kullanmamış olankadınlardakiyle karşılaştırıldığında daha az ilerlemiş olma eğilimini taşır. Gözlemlenenyüksek risk patterni, KOK kullanıcılarında meme kanserine daha erken tanı konulmasına,KOK'ların biyolojik etkilerine ya da her ikisine birden bağlı olabilir. Seyrek vakalarda, KOK kullanıcılarında, benign karaciğer tümörleri ve daha seyrek olarak malign karaciğer tümörleri bildirilmiştir. İzole vakalarda bu tümörler yaşamı tehdit edenintra-abdominal hemorajilere yol açmıştır. Bu nedenle, NUVARING kullanan kadınlardaciddi üst abdomen ası, karaciğer büyümesi ya da intra-abdominal hemoraji belirtilerininoluşması durumunda, ayırıcı tanıda karaciğer tümörü düşünülmelidir. 3. ALT yükselmeleriHepatit C virüsü enfeksiyonları (HCV) için ribavirin içeren veya içermeyen ombitasvir / paritaprevir / ritonavir ve dasabuvir içeren tıbbi ürünlerle tedavi edilen hastalarda yapılan klinikçalışmalar sırasında, normal üst sınırının (ULN) 5 katından daha fazla transaminaz (ALT)yükselmeleri, kombine hormonal kontraseptifler (KHK'ler) gibi etinilestradiol içeren ilaçlarkullanmakta olan kadınlarda anlamlı olarak daha sıklıkla oluşmuştur. Ayrıca glekaprevir /pibrentasvir ile tedavi edilenbhastalarıdaeidapiKıHKiegi^affitinilestradiol içeren ilaçlar kullanan 4. Diğer durumlarHipertrigliseridemisi ya da bu hastalıkla ilgili aile öyküsü bulunan kadınlar, hormonalkontraseptif kullandıklarında yüksek pankreatit riski altında olabilir. Hormonal kontraseptif kullanan kadınların kan basınçlarında küçük artışlar bildirilmişolmasına karşın, klinik olarak önemli artışlar seyrektir. Hormonal kontraseptif kullanımı veklinik hipertansiyon arasında kesin bir ilişki kanıtlanmış değildir. Bununla birlikte,NUVARING kullanımı sırasında sürekli ve klinik olarak anlamlı bir hipertansiyon gelişirse,hekimin halka kullanımını bir süre durdurması ve hipertansiyonu tedavi etmesi doğruolacaktır. Antihipertansif tedavi ile normotansif değerler elde edilirse, uygun görülendurumlarda NUVARING kullanımına yeniden başlanabilir. Gerek hamilelik gerekse hormonal kontraseptif kullanımı sırasında aşağıdaki durumlarailişkin belirti ya da kötüleşme bildirilmiş olmakla birlikte kullanımı ile ilişkinin kanıtı kesindeğildir: kolestaza bağlı sarılık ve/veya pruritus, safra taşı oluşumu, porfiri, sistemik lupuseritematozus, hemolitik üremik sendrom, Sydenham koresi, herpes gestasyonis, otosklerozlailişkili işitme kaybı.
indükleyebilir ya da
Eksojen östrojenler, kalıtsal ve edinilmiş anjiyoödem belirtilerini şiddetlendirebilir. Akut ya da kronik karaciğer bozukluklarında karaciğer fonksiyonları belirteçleri normaledönene kadar NUVARING kullanımına ara verilmesi gerekebilir. İlk olarak hamilelik ya dadaha önceki seks steroidi kullanımları sırasında ortaya çıkmış olan kolestatik sarılık ve/veyakolestaz ile ilişkili pruritin tekrarlaması halka kullanımının bırakılmasını gerektirir. Östrojen ve progesteronların periferik insülin direnci ve glukoz toleransı üzerine bir etkisiolabilse de, hormonal kontraseptif kullanan diabetiklerde terapötik rejim değişikliği gereğineişaret eden bir kanıt bulunmamaktadır. Bununla birlikte, NUVARING kullanan diabetikkadınlar özellikle ilk kullanım aylarında dikkatle izlenmelidir. Crohn hastalığında ve ülseratif kolitte, hormonal kontraseptif kullanımı ile ilişkili yenidenortaya çıkma veya kötüleşme bildirilmiştir. Ancak hormonal kontraseptif kullanımı ileilişkisine dair kanıt yetersizdir. Özellikle kloazma gravidarum öyküsü bulunan kadınlarda nadir olarak kloazma oluşabilir.Kloazmaya eğilimli kadınlar NUVARING kullanımı sırasında güneş ya da ultraviyoleışınlarına maruz kalmaktan kaçınmalıdır. Aşağıdaki durumlardan herhangi biri bulunan kadınlar NUVARING'i doğru olarakyerleştirmede başarılı olmayabilir ya da halkayı kaybedebilirler: uterus boynu prolapsusu,sistosel ve/veya rektosel, ciddi ya da kronik konstipasyon. Çok nadir olarak, NUVARING'in üretraya ve mesane çıkışına yanlışlıkla yerleştirildiği bildirilmiştir. Sistit semptomları karşısında ayırıcı tanıya gidilirken, bu nedenle halkanınyanlış yere yerleştirilmiş olma olasılığı üzerinde durulmalıdır. NUVARING kullanımı sırasında kadınlar, çok seyrek olarak vajinit yaşayabilirler. Ne NUVARING etkinliğiniBuvaiiüiitvtffldavi&iındfiBaefkilfindi^ııne de NUVARING kullanımınınBelge Do Çok nadir olarak halkanın vajina dokusuna yapıştığı ve sağlık görevlisi tarafından çıkarılmasının gerektiği bildirilmiştir. Dokunun halkanın üzerinde büyüdüğü bazıdurumlarda, üstteki vajinal dokuyu kesmeden halkayı keserek çıkarma gerçekleştirilmiştir. Depresif ruh hali ve depresyon, hormonal kontraseptif kullanımın iyi bilinen istenmeyen yan etkilerindendir (bkz. bölüm 4.8). Depresyon ciddi olabilir ve intihar girişimi ve intihar içiniyi bilinen bir risk faktörüdür. Kadınların, tedaviye başladıktan kısa bir süre sonra da dahilolmak üzere, duygudurum değişiklikleri ve depresif belirtiler olması durumundadoktorlarına başvurmaları önerilir. Tıbbi muayene/Konsültasyon: NUVARING kullanmaya ilk kez veya yeniden başlamadan önce eksiksiz bir tıbbi öykü (ailenin tıbbi öyküsü dahil) alınmalı ve gebelik dışlanmalıdır. Kontrendikasyonlar (bkz. bölüm 4.3) veuyarılar (bkz. bölüm 4.4) kılavuzluğunda kan basıncı ölçülmeli ve fiziki muayene yapılmalıdır.Diğer KHK'lerle karşılaştırıldığında NUVARING'in taşıdığı risk de dahil olmak üzere venözve arteriyel trombozla ilgili bilgilere, VTE ve ATE semptomlarına, bilinen risk faktörlerine veşüphelenilen tromboz durumunda yapılması gerekenlere kadının dikkati çekilmelidir. Kadına ayrıca, kullanma talimatını dikkatlice okunması ve verilen talimatlara uyması söylenmelidir. Bu kontrollerin sıklığı ve yapısı belirlenirken, yerleşik uygulama önerileri esasalınmalı ve her bir kadına göre özel olarak uyarlanmalıdır. Kadınlara hormonal kontraseptiflerin HIV infeksiyonlarına (AIDS) ve cinsel yoldan geçen diğer hastalıklara karşı koruma sağlamadığı belirtilmelidir. Azalmış etkililik: Uyumsuzluk (non-kompliyans) durumlarında (bölüm 4.2) ya da etinilestradiol ve/veya etonogestrelin plazma konsantrasyonunu azaltan ilaçlarla eşzamanlı uygulamaları (bölüm 4.5)NUVARING'in etkinliğini azaltabilir. Azalmış siklus kontrolü: NUVARING kullanımı sırasında düzensiz kanamalar (lekelenme ya da ani kanamalar) oluşabilir. Daha önce düzenli olan sükluslar, NUVARING'in önerildiği şekilde kullanılmasısırasında düzensiz hale gelmişse, hormon dışı nedenler düşünülmeli ve malignite ya dahamileliği dışlamak için uygun tanı önlemleri alınmalıdır. Bunlara kürtaj da dahil olabilir. Bazı kadınlarda halkasız dönem sırasında bir çekilme kanaması oluşmayabilir. NUVARING bölüm 4.2'deki talimatlar uyarınca kullanılırsa, kadının gebe kalması olası değildir. Bununlabirlikte, olmadığı fark edilen ilk çekilme kanaması öncesinde NUVARING ilgili talimatlaragöre kullanılmamışsa ya da iki çekilme kanaması gerçekleşmemişse, NUVARING kullanmayısürdürmeden önce hamilelik dışlanmalıdır. Erkeklerin etinilestradiol ve etonogestrel maruziyeti: Cinsel partner olan erkeklerin, etinilestradiol ve etonogestrelin penis vasıtasıyla emilmesi yoluyla maruz kaldıkları etkinin kapsamı ve muhtemel farmakolojik rolü incelenmemiştir. Kopan halkalar: Çok nadir durumlarda kullanımı sırasında NUVARING'in koptuğu bildirilmiştir (bkz. bölüm 4.5). Halka kopmasına bağlı vajinal yara rapor edilmiştir. Kadına kopan halkayı çıkarması,mümkün olan en kısa sürede yeni bir halka yerleştirmesi ve sonraki 7 gün boyunca prezervatif Buoelge
gibi bariyerli bir yöntemi kullanması önerilir. Gebelik olasılığı düşünülmeli ve kadın kendi doktoruna başvurmalıdır. Halkanın Dışarı Çıkması: NUVARING'in, eğer doğru yerleştirilmediyse, bir tampon çıkarılırken, cinsel ilişki esnasında veya şiddetli veya kronik kabızlıkta çıktığı bildirilmiştir. Uzun süre dışarıda kalma kontraseptifbaşarısızlığına ve/veya ara kanamaya neden olabilir. Dolayısıyla, etkinliği garantilemek içinkadına NUVARING'in yerinde olup olmadığını düzenli olarak kontrol etmesi tavsiyeedilmelidir (örneğin ilişkiden önce ve sonra). Eğer NUVARING kazayla dışarı çıkar ve vajina dışında 3 saatten daha kısa sürekalırsa, kontraseptif etkinlik azalmaz. Kadın halkayı soğuk veya ılık (sıcak değil) su ile durulamalı vemümkün olan en kısa zamanda fakat en geç 3 saat içerisinde tekrar yerleştirmelidir.Eğer NUVARING 3 saatten daha uzun sürevajina dışında kalırsa veya vajina dışında kaldığından kuşkulanılırsa kontraseptif etkililik azalabilir. Bu durumda, bölüm 4.2'de ('Halkageçici olarak vajina dışına çıktığında ne yapılmalı') verilen uygun tavsiye izlenmelidir.1 Bir yılda 10.000 kadında levonorgestrel içeren KHK'lerde görece risk orta nokta aralığı 5 ila 7'yken kullanmayanlarda yaklaşık 2,3 ile 3,6'dır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriNot: Potansiyel etkileşimleri tanımlamak için eş zamanlı ilaçların reçetelenme bilgisine başvurulmalıdır. Diğer tıbbi ürünlerin NUVARING üzerindeki etkileriMikrozomal enzimleri uyararak seks hormonlarının klerensinde artışa ve kanama ve/veya kontraseptif başarısızlığa yol açabilen ilaçlar veya bitkisel ürünler ile etkileşimler ortayaçıkabilir. İdame Enzim indüksiyonu birkaç gün tedaviden sonra gözlemlenebilir. Maksimum enzim indüksiyonu genellikle birkaç hafta içinde görülür. İlaç tedavisinin kesilmesinden sonra, yaklaşık 4 haftaboyunca enzim indüksiyonu devam edebilir. Kısa süreli tedavi Enzim uyaran ilaçlar veya bitkisel ürünlerle tedavi gören kadınlar, NUVARING'in yanı sıra bir bariyer yöntemini veya başka bir kontrasepsiyon yöntemini geçici olarak kullanmalıdır. Not:NUVARING bir diyafram, servikal başlık veya kadın kondomu ile kullanılmamalıdır. Bariyeryöntemi, eşzamanlı ilaç tedavisi boyunca ve ilacın kesilmesinde 28 gün sonrasına kadarkullanılmalıdır. Eş zamanlı ilaç uygulamasının 3 haftalık bir halka siklusunu aşmasıdurumunda, olağan halkasız dönem atlanarak derhal bir sonraki halka yerleştirilmelidir. Uzun süreli tedavi Kadınlarda karaciğer enzim indükleyici aktif maddeler ile uzun süreli tedavide, başka bir güvenilir, hormonal olmayan doğum kontrol yöntemi önerilmektedir. Literatürde aşağıdaki etkileşimler bildirilmiştir.
Kombine hormonal kontraseptiflerin klirensini arttıran maddeler Seks hormonlarının plazma konsantrasyonlarını azaltarak klirens artışına sebep olan mikrozomal enzimleri, özellikle sitokrom P450 enzimini (CYP), indükleyen ilaçlarla veyabitkisel ürünlerle etkileşimler ortaya çıkabilir ve NUVARING dahil olmak üzere kombinehormonal kontraseptiflerin etkinliğini azaltabilir. Bu ürünler fenitoin, fenobarbital, pirimidon,bosentan, karbamazepin, rifampisin ve muhtemelen okskarbazepin, topiramat, felbamat,griseofulvin, bazı HIV proteaz inhibitörleri (ritonavir gibi) ve non-nükleosit revers transkriptazinhibitörleri (örn., efavirenz), ve bitkisel St. John's wort içeren ürünlerdir. Kombine hormonal kontraseptiflerin klirensinde değişken etkileri olan maddeler Hormonal kontraseptifler, HIV proteaz inhibitörleri (örn., Nelfinavir) ve non-nükleosit reverstranskriptaz inhibitörlerinin (örn., Nevirapin) birçok kombinasyonu ve / veya Hepatit C virüsü(HCV) tıbbi ürünleri ile kombinasyonları (örn., Boceprevir, telaprevir) birlikte uygulandığında,etonogestrel veya östrojen dahil olmak üzere progestojenlerin plazma konsantrasyonlarınıartırabilir veya azaltabilir. Bu değişikliklerin net etkisi, bazı vakalarda klinik olarak ilişkiliolabilir. Kombine hormonal kontraseptiflerin klirensini azaltan durumlar Enzim inhibitörleri ile potansiyel etkileşimlerin klinik ilişkisi bilinmemektedir. Eş zamanlı olarak güçlü (ör. ketokonazol, itrakonazol, klaritromisin) veya orta (örn.,flukonazol, diltiazem, eritromisin) CYP3A4 inhibitörleri, etonogestrel dahil olmak üzere,östrojenler veya progestojenlerin serum konsantrasyonlarını arttırabilir. Antimikotik, antibiyotik ve kayganlaştırıcı ürünler de dahil olmak üzere intravajinal preparatların eş zamanlı kullanımı sırasında halka kopması bildirilmiştir (bkz. Bbölüm 4.4.'Kopan Halkalar'). Farmakokinetik verileri esas aldığımızda, vajinal yoldan uygulananantimikotikler ve spermisidlerin NUVARING'in kontraseptif etkililiği ve güvenliliği etkilemeolasılığı bulunmamaktadır. Hormonal kontraseptifler diğer ilaçların metabolizması ile etkileşebilir. Buna göre, plazma ve doku konsantrasyonları hem artabilir (örn. siklosporin) hem de azalabilir (örn. lamotrigin). Farmakodinamik etkileşimlerRibavirin veya glekaprevir / pibrentasvir içeren veya içermeyen ombitasvir / paritaprevir / ritonavir ve dasabuvir içeren tıbbi ürünlerle eş zamanlı kullanım, ALT yükselme riskiniartırabilir (bkz. bölüm 4.3 ve 4.4). Bu nedenle, NUVARING kullanıcıları, bu kombinasyon ilaçrejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örn., sadeceprogestojen kontrasepsiyon veya hormonal olmayan yöntemler) geçmelidir. NUVARING, bukombinasyon ilaç tedavisi ile tedavinin tamamlanmasından 2 hafta sonra yeniden başlatılabilir. Laboratuvar testleri: Kontraseptif steroidlerin kullanımı; karaciğer, tiroid, adrenal ve böbrek fonksiyonunun biyokimyasal parametreleri, taşıyıcı proteinlerin (örn. kortikosteroid bağlayan globulin ve sekshormonu bağlayan globulin) plazma düzeyleri, lipid/lipoprotein fraksiyonları, karbonhidratmetabolizması parametreleri ve koagülasyon ve fibrinoliz parametreleri dahil belirli laboratuvarsonuçlarını etkileyebilmektedir. Değişimler genellikle normal laboratuvar aralıkları içindekalmaktadır.
Tamponlarla etkileşim: Farmakokinetik verilere göre, tamponların kullammınm, NUVARING tarafından salınan hormonların sistemik emilimi üzerinde hiçbir etkisi yoktur. Nadir durumlarda NUVARINGtampon çıkarılırken çıkarılabilir (bkz. öneri için 'Halka geçici olarak vajina dışına çıkmış isene yapılmalı'). Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:Pediyatrik popülasyon ve özel popülasyonlarla ilgili herhangi bir etkileşim çalışması yoktur. Geriyatrik popülasyon:NUVARING, fertil kadınların kullanımında endikedir. Geriyatrik popülasyonda herhangi bir güvenlilik veya etkililik çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi X'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Bu tıbbi ürünün endikasyonu kontrasepsiyon olduğu için, bu başlık geçerli değildir. Gebelik dönemiNUVARING hamilelik sırasında kontrendikedir. Eğer hamilelik NUVARING doğal yerindeyken gerçekleşirse, halka yerinden çıkartılmalıdır. Yaygın epidemiyolojik çalışmalar, hamilelik öncesinde KOK kullanmış kadınların doğurduğuçocuklarda doğum kusuru riski artışı ve KOK'lar erken hamilelik sırasında yanlışlıklakullanıldığında bir teratojenik etki ortaya koymamıştır. Az sayıda kadının dahil olduğu bir klinik çalışma sonucuna göre, intravajinal uygulama dolayısıyla, NUVARING'deki kontraseptif steroidlerin intrauterin konsantrasyonları KOKkullanıcılarında gözlenen seviyeler ile benzerdir (bkz. bölüm 5.2). NUVARING'e maruzkalmış hamileliklerin klinik sonuçları bildirilmemiştir. Doğum sonrası dönemde NUVARING kullanımına tekrar başlanırken VTE riskinin artışı göz önünde bulundurulmalıdır (bkz. bölüm 4.2 ve 4.4). Laktasyon dönemiEmzirme, anne sütünün miktarını azaltabilen ve bileşimini değiştirebilen östrojenlerden etkilenebilmektedir. Bu nedenle, çocuk sütten tamamen kesilene kadar geçen süredeNUVARING kullanımı genellikle önerilmemelidir. Küçük miktarlarda kontraseptif steroidlerve/veya metabolitleri süt ile atılabilmektedir ancak bunun bebeğin sağlığını olumsuzetkilediğine ilişkin bir kanıt bulunmamaktadır. Üreme yeteneği/FertiliteNUVARING gebelikten korunmak için endikedir. Kadın, gebe kalmak istediği için NUVARING'i kullanmayı bırakırsa, gebe kalmaya çalışmadan önce doğal adet dönemine kadarbeklemesi tavsiye edilmelidir; bu durum, bebeğin ne zaman doğacağının hesaplanmasınayardımcı olacaktır.
4.7. Araç ve makine kullanımı üzerindeki etkilerFarmakodinamik profilin temelinde, NUVARING'in araç ve makine kullanımı üzerinde beklenen herhangi bir etkisi yoktur veya etkisi göz ardı edilebilir derecede önemsizdir. 4.8. İstenmeyen etkilerNUVARING'le yapılan klinik çalışmalarda en sık rapor edilen istenmeyen etkiler baş ası, vajinal enfeksiyon ve vajinal akıntı olmuştur; bunların hepsi kadınların %5 ila 6'sında raporedilmiştir. Seçilmiş advers reaksyionların tanımıKHK kullanan kadınlarda, miyokard infarktüsü, inme, geçici iskemik atak, venöz tromboz ve pulmoner emboli dahil, arteriyel ve venöz trombotik ve tromboembolik olay riskinde artışgözlenmiştir; bölüm 4.4'te daha detaylı olarak bunlardan bahsedilmektedir. KHK kullanan kadınlarda diğer yan etkiler de rapor edilmiştir; bölüm 4.4'te daha detaylı olarak bunlardan bahsedilmektedir. NUVARING kullanıcılarında bildirilmiş olan advers ilaç reaksiyonlarının listesi, aşağıda verilmektedir. Sıklıklar şu şekilde tanımlanmıştır: Çok yaygın (> 1/10), yaygın (> 1/100 ila < 1/10), yaygın olmayan (> 1/1,000 ila <1/100), seyrek (> 1/10.000 ila < 1/1.000), çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarYaygın: Vajinal enfeksiyon Yaygın olmayan: Servisit, sistit, üriner sistem enfeksiyonu Bağışıklık sistemi hastalıklarıBilinmiyor: Kalıtsal ve edinilmiş anjiyoödem semptomlarının şiddetlenmesini ve anafilaksiyi içeren hipersensitivite reaksiyonları1 Metabolizma ve beslenme hastalıklarıYaygın olmayan: Artan iştah Psikiyatrik hastalıklarYaygın: Depresyon, azalan libido Yaygın olmayan: Tepkide değişiklik, ruh hali değişimi, ruh hali dalgalanması Sinir sistemi hastalıklarıYaygın: Baş ası, migren Yaygın olmayan: Baş dönmesi, hipoestezi Göz hastalıklarıYaygın olmayan: Görme bozukluğu Vasküler hastalıklarYaygın olmayan: Sıcak basması izm Seyrek: : lZW56Q3NRtVenöV5^ZmmbOemLbI0ZiZm, arterlyelItrombrose:mbso)\i  Gastrointestinal hastalıklarYaygın: Karın ası, bulantı Yaygın olmayan: Abdominal distansiyon, diyare, kusma, konstipasyon Deri ve deri altı doku hastalıklarıYaygın: Akne Yaygın olmayan: Saç dökülmesi, egzema, kaşıntı, döküntü, ürtiker Bilinmiyor: Kloazma1 Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın olmayan: Sırt ası, kas spazmları, ekstremitelerde a Böbrek ve idrar hastalıklarıYaygın olmayan: Disüri, acil idrara çıkma hissi, pollaküri Üreme sistemi ve meme hastalıklarıYaygın: Memede hassasiyet, genitalkaşıntı,dismenore, pelvik a, vajinal akıntı Yaygın olmayan: Amenore, meme ası, meme büyümesi, memede kitle, servikal polip, koital kanama, disparoni, serviksin ektropiyonu, fibrokistik meme hastalığı, menoraji, metroraji, pelvik a, premenstrüel sendrom, uterinspazm, vajinal yanma hissi, vajinal koku, vajinal a, vulvovajinal a,vulvovajinal kurulukSeyrek:Galaktore Bilinmiyor: Penis rahatsızlıkları1 Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıYaygın olmayan: Yorgunluk, irritabilite, halsizlik, ödem, yabancı cisim hissetme Bilinmiyor: Vajinal halka bölgesi dokusunda aşırıbüyüme1 AraştırmalarYaygın: Kilo artışı Yaygın olmayan: Kan basıncı artışı Yaralanma ve zehirlenmeYaygın: Vajinal halka rahatsızlığı, vajinalhalkanın çıkması Yaygın olmayan: Vajinal halka komplikasyonu Bilinmiyor: Halka kopmasına bağlı vajinalyara1 1) Advers olayların listelenmesi spontan raporlamaya dayanır. KHK kullanımıyla ilişkili hormon-bağımlı tümörler (örneğin karaciğer tümörleri, meme kanseri) rapor edilmiştir. Daha fazla bilgi için bkz. bölüm 4.4. Çok seyrek olarak, NUVARING'in kullanım sırasında koptuğu rapor edilmiştir (bkz. bölüm 4.4 ve 4.5). Etkileşimler Hormonal kontraseptiflerle diğer ilaçların (enzim indükleyicileri) etkileşimlerinden ani kanama ve/veya kontraseptif başarısızlık ortaya çıkabilir (bakınız bölüm 4.5).
Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr:[email protected]:4.9. Doz aşımı ve tedavisiHormonal kontraseptiflerin doz aşımının bildirilen herhangi bir ciddi olumsuz etkisi yoktur. Bu olguda oluşabilecek semptomlar şunlardır: Bulantı, kusma ve genç kadınlarda hafif vajinalkanama. Antidotu yoktur ve tedavi semptomatiktir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diğer jinekolojik ürünler, intravajinal kontraseptifler, progestojen ve östrojen içeren vajinal halkaATC kodu: G02BB01 Etki mekanizması: NUVARING etonogestrel ve etinilestradiol içerir. Etonogestrel 19-nortestosteron türevi bir progestojendir ve hedef organlarda progesteron reseptörlerine yüksek afinite ile bağlanır.Etinilestradiol kontraseptif ürünlerde yaygın olarak kullanılan bir östrojendir. NUVARING' inkontraseptif etkisi, en önemlisi ovulasyon inhibisyonu olan çeşitli mekanizmalaradayanmaktadır. Klinik etkililik ve güvenlilik: A.B.D.) 18 ve 40 yaş arası kadınlarda Klinik çalışmalar dünya çapında (AB, Brezilya, yürütülmüştür. Kontraseptif etkinlik kombine oral kontraseptiflerin bilinen etkinliğine en azından benzer gibi görünmektedir. Aşağıdaki tablo NUVARING klinik çalışmalarında saptanan Pearl İndekslerini(100 kadında kullanım yılı başına gebeliklerin sayısı) göstermektedir.
Daha yüksek dozda KOK'ların kullanımıyla (0T,05 mg etinilestradiol) endometriyum ve over kanseri riski azalmaktadır. Bu durumun NUVARING gibi daha düşük dozlu bir kontraseptifiçin de geçerli olup olmadığı henüz belirlenmemiştir.Kanama paterni: 150/30 mikrogram levonorgestrel/etinilestradiol KOK ile yapılan karşılaştırmalı geniş ölçekli bir çalışmada (n=512 ve n=518) 13'ten fazla menstrüel siklusta kanama değerlendirilmiş velekelenme ve ara kanama insidansı KOK kullanıcılarına kıyasla NUVARING kullananlarda  daha düşük bulunmuştur (%2,0-6,4). Birçok bireyde kanama sadece halkasız ara dönemlerle sınırlı kalmıştır (%58,8-72,8). Kemik mineral yoğunluğu üzerine etkileri: NUVARING'in (n=76) kemik mineral dansitesi (BMD) üzerindeki etkileri, 2 yılı aşkın bir dönem boyunca, non-hormonal bir spiral (IUD) (n=31) ile karşılaştırılmıştır. Kemik kütlesiüzerinde herhangi bir advers etki gözlenmemiştir. Pediyatik popülasyon: NUVARING'in 18 yaş altı adolesanlarda etkililiği ve güvenliliği çalışılmamıştır. Geriyatrik popülasyon: NUVARING, fertil kadınların kullanımında endikedir. Geriyatrik popülasyonda herhangi bir güvenlilik veya etkililik çalışması yapılmamıştır. 5.2. Farmakokinetik özelliklerGenel özelliklerEtonogestrel:Emilim:NUVARING'den salınan etonogestrel vajinal mukozadan hızla absorbe edilmektedir. Yaklaşık 1700 pg/mL olan maksimum etonogestrel serum konsantrasyonlarına yerleştirmeyi izleyenyaklaşık 1 hafta içinde ulaşılır. Serum konsantrasyonları küçük dalgalanmalar gösterir ve 1hafta kullanımdan sonra yaklaşık 1600 pg/mL'ye, 2 hafta kullanımdan sonra yaklaşık 1500pg/mL'ye ve 3 hafta kullanımdan sonra yaklaşık 1400 pg/mL'ye yavaş yavaş düşer. Mutlak biyoyararlanım, oral uygulama sonrasına göre daha yüksek olarak % 100' dür. Servikal ve intrauterin etonogestrel seviyeleri, 0,150 mg desogestrel ve 0,020 mg etinilestradiol içerenbir oral kontraseptif veya NUVARING kullanan az sayıda kadında ölçülmüştür. Gözlenenseviyeler benzer bulunmuştur. Dağılım:Etonogestrel, serum albüminine ve seks hormonu bağlayan globuline (SHBG) bağlanmaktadır. Etonogestrel sanal dağılım hacmi 2,3 L/kg' dır. Biyotransformasyon:Etonogestrel, bilinen steroid metabolizması yollarından metabolize edilmektedir. Sanal serum klerensi 3,5 L/h dolayındadır. Birlikte uygulanan etinilestradiol ile herhangi bir doğrudanetkileşimi bulunmamıştır. Eliminasyon:Etonogestrel serum düzeyleri iki evrede düşmektedir. Terminal eliminasyon evresi yaklaşık 29 saatlik bir yarı ömür ile karakterizedir. Etonogestrel ve metabolitleri 1,7:1 dolayındaki birüriner-bilyer oranı ile atılmaktadır. Metabolit atılım yarılanma ömrü yaklaşık 6 gündür. Etinilestradiol:Emilim:NUVARING tarafından salınan etinilestradiol, vajinal mukozadan hızla absorbe edilmektedir. Maksimum serum konsantrasyonları yerleştirmeden 3 gün sonra 35 pg/mL dolayında elde edilirve 1 hafta kullanımdan sonra 19 pg/mL'ye, 2 hafta kullanımdan sonra 18 pg/mL'ye ve 3 haftakullanımdan sonra 18 pg/mL'ye düşer. NUVARING ile aylık sistemik etinilestradiol
,(AeUC0İM))FyZ'Wİ9mln .hy^^'di?Mötl|'k^iyöyirarlanım etinilestradiolün, oral »3kOYnUyZlAx Belge Taldp Adresı:https://www.turkiye.gov.tr/saglik-titck-ebys
maruziyeti )ama Kodu:Belge DoİZ' uygulamasına benzer olarak yaklaşık %56' dır. Servikal ve intrauterin etinilestradiol seviyeleri 0,150 mg desogestrel ve 0,020 mg etinilestradiol içeren bir oral kontraseptif veya NUVARINGkullanan az sayıda kadında ölçülmüştür. Gözlenen seviyeler benzer bulunmuştur. Dağılım:Etinilestradiol serum albumine yüksek ölçüde ancak spesifik olmayarak bağlanmaktadır. 15 L/kg dolayında bir sanal dağılım hacmi belirlenmiştir. Biyotransformasyon:Etinilestradiol başlıca aromatik hidroksilasyon yoluyla metabolize olmakla birlikte geniş bir yelpazede yer alan hidroksilli ve metilli metabolitler oluşmaktadır. Bunlar sulfat ve glukuronatkonjugatları ve serbest metabolitler olarak bulunmaktadır. Sanal klerens 35 L/h dolayındadır. Eliminasyon:Etinilestradiol serum düzeyleri iki evrede azalmaktadır. Terminal eliminasyon evresi yarı ömründe büyük bir varyasyon görülmekte, ortalama yarı ömür değeri (medyan) yaklaşık 34saat sonucunu vermektedir. Değişime uğramamış etinilestradiol atılmamakta; etinilestradiolmetabolitleri üriner ve safradan 1,3:1 oranında atılmaktadır. Metabolit atılımı yarılanma ömrü1,5 gün dolayındadır. Hastalardaki karakteristik özelliklerPediyatrik popülasyon:Sağlıklı postmenarş 18 yaş altı kız çocuklarında NUVARING farmakokinetikleri çalışılmamıştır. Geriyatrik popülasyon:NUVARING, fertil kadınların kullanımında endikedir. Geriyatrik popülasyonda herhangi bir güvenlilik veya etkililik çalışması yapılmamıştır. Böbrek yetmezliğinin etkileri:Böbrek yetmezliğinin NUVARING farmakokinetikleri üzerindeki etkilerini değerlendirmek için çalışma yapılmamıştır. Karaciğer yetmezliğinin etkileri:Karaciğer yetmezliğinin NUVARING farmakokinetikleri üzerindeki etkilerini değerlendirmek için çalışma yapılmamıştır. Ancak, karaciğer fonksiyon bozukluğu olan kadınlarda steroidhormonlarının metabolizması azalmış olabilir. Etnik gruplar:Etnik gruplardaki farmakokinetiklerini değerlendirmek için resmi çalışma yapılmamıştır. 5.3. Klinik öncesi güvenlilik verileriEtonogestrel ve etinilestradiol ile klinik olmayan veriler klasik güvenlilik çalışmaları temelinde, farmakoloji, tekrarlanan doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üremetoksisitesi açısından, insanlar için her zaman bilinenlerin dışında herhangi bir tehlike ortayakoymamaktadır. Çevresel Risk DeğerlendirmesiÇevresel risk değerlendirme çalışmaları, 17a-etinilestradiol ve etonogestrelin yüzey suyu
8^gâsiz.m.a\ır^lS55.^isfeoluş^Sra^lilıeğinigÖ*termil!^S(bS^?:S2!üı Belge Dom  6. FARMASOTIK ÖZELLİKLER6.1. Yardımcı maddelerin listesiEtilen vinilasetat kopolimer, % 28 vinilasetat Etilen vinilasetat kopolimer, % 9 vinilasetatMagnezyum stearat 6.2. GeçimsizliklerMevcut değildir. 6.3. Raf ömrü40 ay 6.4. Saklamaya yönelik özel tedbirlerHastaya satış öncesi 40 ay (2-8°C'de), hastaya satıştan sonra 4 ay (30°C'nin altında oda sıcaklığında) saklanmalıdır. Hastaya satış sırasında, ambalaj üzerine satış tarihinin yazılması gerekmektedir. Hastaya satış tarihinden 4 ay sonrasında ya da son kullanma tarihinden sonra (hangi tarih önce gelirse)uygulanmamalıdır. Nem ve ışıktan korumak için orijinal ambalajında saklanmalıdır. 6.5. Ambalajın niteliği ve içeriğiBir adet NUVARING içeren saşe. Saşe, iç kısmi düşük yoğunlukta polietilen ve dış kısmı polyester kaplı aluminyumdan yapılmıştır. Açılıp kapanabilir ve su geçirmezdir. Saşe, baskılıkarton kutuya kullanma talimatı ile birlikte konmuştur. Her kutu 1 halka içerir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerNUVARING, son kullanma tarihinden önce veya satın alınan tarihten sonra 4 ay içerisinde (hangisi önce gelirse) yerleştirilmelidir. Çıkarıldıktan sonra NUVARING ağzı yeniden kapatılabilen poşet içinde saklanmalıdır ve normal ev atıkları ile birlikte başkalarının yanlışlıkla temasını önleyecek şekilde atılmalıdır.NUVARING klozete/tuvalete çekilmesi yoluyla atılmamalıdır. Kullanılmamış (son kullanmatarihi geçmiş) halkalar yerel yönetmeliklere uygun şekilde atılmalıdır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİOrganon Turkey İlaçları Ltd. Şti. Esentepe Mah. Büyükdere Cad. Kanyon Blok No: 185 İç Kapı No:271 Şişli - İstanbulTelefon : (212) 268 20 68Faks : (212) 319 76 00 Belge Do8. RUHSAT NUMARASI(LARI)9099/3 06 belge)ğru&na Kodu:lZW56Q3NRM0FyZW56ZmxXS3k0YnUyZlAxBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys9. ILK RUHSAT TARIHI / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 02.06.2022 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriNuvaring 11,7 Mg/2,7 Mg Vajinal Salım SistemiEtken Maddesi: Etonogestrel-etinilestradiol Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.