Spravato 28 Mg Burun Spreyi, Çözelti Kısa Ürün BilgisiKISA URUN BILGISI¡ Bu ilaç ek izlemeye tabidir. Bu üçgen, yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM' a bildirmeleribeklenmektedir. Bakınız Bölüm 4.8. Şüpheli advers reaksiyonların raporlanması. 1. BEŞERI TIBBİ ÜRÜNÜN ADISPRAVATO 28 mg burun spreyi, çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir burun sprey cihazı, 28 mg esketamine karşılık gelen esketamin hidroklorür (32,3 mg) içerir.Yardımcı madde(ler):Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMBurun spreyi çözelti. Berrak, renksiz, sulu çözelti. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarSPRAVATO, tedaviye dirençli Majör Depresif Bozuklukta (uygun doz ve sürede kullanılan en az iki farklı antidepresan tedaviye yanıt vermeyen yetişkinlerde mevcut orta ila şiddetli depresifatakta), SSRI ya da SNRI ile beraber kullanımda endikedir. Oral antidepresan tedavisi ile birlikte uygulanan SPRAVATO, klinik değerlendirmeye göre bir psikiyatrik acil durum oluşturan depresif semptomların hızlı bir şekilde azaltılması için akut kısasüreli tedavi olarak orta ila şiddetli Majör Depresif Bozukluk atağı geçiren yetişkinlerde endikedir. Çalışılan popülasyonların açıklaması için Bölüm 5.1'e bakınız. 4.2 Pozoloji ve uygulama şekliSPRAVATO'yu reçete etme kararı, bir psikiyatri uzmanı tarafından verilmelidir. SPRAVATO, bir sağlık çalışanının doğrudan gözetimi altında hastanın kendisi tarafından uygulanır. Bir tedavi seansı, nazal SPRAVATO uygulaması ve her uygulama sonrası gözetim döneminden oluşmaktadır. SPRAVATO'nun uygulanması ve uygulama sonrası gözetimi, uygun klinikkoşullarda gerçekleştirilmelidir. Tedavi öncesi değerlendirme SPRAVATO dozu uygulanmadan önce kan basıncı ölçülmelidir. Başlangıçtaki kan basıncı yüksek ise, kısa süreli kan basıncı artışları riski ve SPRAVATO tedavisinin yararı değerlendirilmelidir (bkz. Bölüm 4.4). Kan basıncı veya kafa içi basıncındakiartışın ciddi risk teşkil ettiği durumlarda SPRAVATO uygulanmamalıdır (bkz. Bölüm 4.3). Klinik açıdan stabil olmayan veya belirgin derece kardiyovasküler ya da solunum sistemi hastalıkları olan kişiler için ek önlemler gereklidir. Bu hastalarda SPRAVATO, uygunresüsitasyon ekipmanı ve kardiyopulmoner resüsitasyon (kalp masajı) eğitimi almış sağlıkçalışanlarının bulunduğu bir ortamda uygulanmalıdır (bkz. Bölüm 4.4). Uygulama sonrası gözlem SPRAVATO dozu uygulandıktan yaklaşık 40 dakika sonra ve sonrasında klinik açıdan gerekli oldukça kan basıncı yeniden ölçülmelidir (bkz. Bölüm 4.4). Sedasyon, dissosiyasyon ve kan basıncı yüksekliği ihtimali sebebiyle hastalar, 2 saat boyunca ve klinik açıdan stabil ve sağlık merkezinden ayrılmaya hazır oluncaya kadar bir sağlık çalışanıtarafından izlem altında tutulmalıdır (bkz. Bölüm 4.4). Pozoloji/uygulama sıklığı ve süresi:PozolojiTedaviye Dirençli Majör Depresif BozuklukSPRAVATO'nun tedaviye dirençli Majör Depresif Bozukluk için kullanımına ilişkin doz tavsiyeleri Tablo 1 ve Tablo 2'de (65 yaş ve üzeri yetişkinler) gösterilmektedir. Sürdürüm fazında,hastanın indüksiyon fazının sonunda aldığı doza devam edilmesi önerilmektedir. Dozdüzenlemesi, bir önceki kullanılan dozun etkililiği ve tolere edilebilirliğine göre yapılmalıdır.Sürdürüm fazında, SPRAVATO dozu remisyonu/yanıtı devam ettirmek amacıyla hastaya özgüolarak en düşük frekansa indirilmelidir. 28 mg doz için 1 cihaz, 56 mg doz için 2 cihaz ve 84 mg için 3 cihaz olarak düşünülmelidir (bkz. kullanım kılavuzu).
1-4. hafta indüksiyon fazında haftalık uygulanan iki doz arasında en az bir günbırakılması önerilir. doz ve en düşük doz sıklığı hastaya özgü belirlenir. İlk 56 mg dozdan sonra, etkililik ve tolere edebilirliğe bağlı olarak ikinci doz 84 mg'ayükseltilebilir veya 56 mg'da kalabilir. Takiben indüksiyon aşamasının sonuna kadar, her klinik değerlendirmede etkililik ve tolereedilebilirliğe bağlı olarak sonraki dozlar 84 mg'ayükseltilebilir (önceki doz 56 mg ise), aynıkalabilir veya 56 mg'a (önceki doz 84 mg ise)düşürülebilir. Sürdürüm fazında tedaviye devam edilip edilmeyeceği kararı indüksiyon fazının sonunda tedavi yanıtı değerlendirilerek verilmelidir.Tedaviye devam etme gerekliliği düzenli olarak yeniden incelenmelidir. Tablo 2: Tedaviye dirençli Majör Depresif Bozukluğu olan 65 yaş ve üzeri yetişkinlerde _ SPRAVATO için önerilen dozİndüksiyon fazı1-4. haftalar:
1. hafta: Birinci doz: 28 mg İkinci doz: 28 mg veya 56 mg (tüm doz değişiklikleri 28 mg'lık artışlar halindeyapılmalıdır.) 2. haftadan 4. haftaya:Haftada iki kez 28 mg, 56 mg veya 84 mg (tüm doz değişiklikleri 28 mg'lık artışlar halindeyapılmalıdır.) 1-4. hafta indüksiyon fazında haftalık uygulanan iki doz arasında en az bir gün bırakılmasıönerilir. İlk 28 mg dozdan sonra, etkililik ve tolere edebilirliğe bağlı olarak ikinci doz 56 mg'ayükseltilebilir veya 28 mg'da kalabilir. Takiben indüksiyon aşamasının sonuna kadar, sonraki dozlar aynı kalabilir veya klinik yargıyagöre etkililik ve tolere edilebilirliğe bağlı olarak28 mg'lık artışlarla artırılabilir veya azaltılabilir.
Sürdürüm fazı 5-8. haftalar:Haftada bir 28 mg, 56 mg veya 84 mg; tüm doz değişiklikleri 28 mg'lık artışlar halindeyapılmalıdır (Sürdürüm fazında, hastanınindüksiyon fazının sonunda aldığı doza devamedilmesi önerilmektedir). 9. haftadan itibaren:Hekim tarafından belirlendiği şekilde iki haftada bir ya da haftada bir 28 mg, 56 mg veya84 mg; tüm doz değişiklikleri 28 mg'lık artışlarhalinde yapılmalıdır. Remisyonu/yanıtı devamettirmek için en düşük doz ve en düşük dozsıklığı hastaya özgü belirlenir. Tedaviye devam etme gerekliliği düzenli olarak yeniden incelenmelidir. 
Depresyon belirtilerinde düzelme sağlandıktan sonra, tedaviye en az 6 ay süreyle devam edilmesi önerilir. Majör Depresif Bozukluğa bağlı psikiyatrik acil durumun akut kısa süreli tedavisiYetişkin hastalar (<65 yaş) için önerilen SPRAVATO dozu 4 hafta boyunca haftada iki kez 84mg'dır. Tolere edilebilirliğe göre 56 mg'a kadar doz azaltımı yapılmalıdır. SPRAVATO ile 4haftalık tedaviden sonra, klinik karara göre oral antidepresan (AD) tedavisine devam edilmelidir.Bu hastalarda SPRAVATO ile tedavi, kapsamlı klinik bakım planının bir parçası olmalıdır. Uygulama öncesi yiyecek ve sıvı alımı ile ilgili tavsiyelerSPRAVATO uygulamasından sonra bazı hastalar bulantı ve kusma yaşayabileceğinden, hastalara uygulama öncesi en az 2 saat boyunca bir şey yememeleri ve uygulama öncesi en az 30 dakikaboyunca bir şey içmemeleri söylenmelidir (bkz. Bölüm 4.8). Nazal kortisosteroid veya nazal dekonjestanDozlama gününde nazal kortikosteroid veya nazal dekonjestan uygulamasına ihtiyaç duyan hastalara, bu tıbbi ürünleri SPRAVATO uygulamasından önceki 1 saat içinde uygulamamalarısöylenmelidir. Unutulan tedavi seansı/seanslarıTedavinin ilk 4 haftasında tedavi seans(lar)ını kaçıran hastalar mevcut doz programlarına devam etmelidir. Tedaviye dirençli Majör Depresif Bozukluğu olan, idame fazı sırasında tedavi seans(lar)ını kaçıran ve depresyon semptomlarında kötüleşme olan hastalar için, klinik karara göre, önceki dozprogramına geri dönülmesi değerlendirilebilir (bkz. Tablo 1 ve 2). Uygulama şekli:SPRAVATO yalnızca nazal yoldan kullanıma yöneliktir. Burun sprey cihazı, iki sprey halinde (her burun deliği için bir) toplam 28 mg esketamin uygulayan bir cihazdır. Tıbbi ürün kaybını önlemekiçin, cihaz kullanım öncesi hazırlanmamalıdır. Bir sağlık çalışanının gözetimi altında, l cihaz (28mg doz için) veya her cihazın kullanımı arasında 5 dakika olacak şekilde 2 cihaz (56 mg doz için)ya da 3 cihaz (84 mg doz için) kullanılarak hasta tarafından uygulamaya yöneliktir. Uygulama sonrası hapşırma Uygulamadan hemen sonra hapşırma meydana gelirse, yeni bir cihaz kullanılmamalıdır.Ardışık 2 sprey için aynı burun deliğinin kullanılması Uygulama aynı burun deliğinde gerçekleştirilirse, yeni bir cihaz kullanılmamalıdır. SPRAVATO tedavisinin yavaş yavaş azaltılarak sonlandırılması gerekli değildir; klinik çalışmalara ait veriler temel alındığında, yoksunluk belirtileri riski düşüktür. Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliğiHafif ila şiddetli böbrek yetmezliği olan hastalar için doz ayarı gerekli değildir. Diyaliz hastaları araştırılmamıştır. Karaciğer yetmezliğiHafif (Child Pugh sınıf A) veya orta şiddetli (Child Pugh sınıf B) karaciğer yetmezliği olan hastalarda doz ayarı gerekli değildir. Bununla birlikte, orta şiddetli karaciğer yetmezliği olanhastalarda 84 mg olan maksimum doz dikkatle kullanılmalıdır. SPRAVATO, şiddetli karaciğer yetmezliği (Child-Pugh sınıf C) olan hastalarda araştırılmamıştır. Bu popülasyonda kullanılması önerilmemektedir (bkz. Bölüm 4.4 ve 5.2). Pediyatrik popülasyonSPRAVATO'nun, 17 yaş ve altındaki pediyatrik hastalarda güvenlilik ve etkililiği gösterilmemiştir. Bu konuda veri bulunmamaktadır. SPRAVATO'nun, 7 yaş altındaki çocuklardailgili kullanımı bulunmamaktadır. Yaşlılar (65 yaş ve üzeri)Tedaviye dirençli Majör Depresif Bozukluğu olan yaşlı hastalarda, ilk SPRAVATO dozu 28 mg'dır (1. gün, başlangıç dozu, bkz. Tablo 2). Sonraki doz artışları, etkililik ve tolere edilebilirliğedayanarak 56 mg veya 84 mg'a kadar 28 mg'lık artışlar halinde yapılmalıdır. SPRAVATO, Majör Depresif Bozukluğa bağlı psikiyatrik acil durumun akut kısa süreli tedavisi olarak yaşlı hastalarda çalışılmamıştır. Tedaviye Dirençli Majör Depresif Bozukluğu olan Japon ve Çinli hastalarJapon ve Çinli hastalarda SPRAVATO'nun etkinliği araştırılmış, ancak kanıtlanmamıştır (bkz. Bölüm 5.1). 4.3 Kontrendikasyonlar Etkin maddeye, ketamine veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birinekarşı aşırı duyarlılık. Kan basıncı veya kafa içi basıncındaki bir artışın ciddi risk teşkil ettiği hastalar (bkz. Bölüm4.8): - Anevrizmal vasküler hastalığı (intrakraniyal, torasik veya abdominal aorta ya daperiferik arteriyel damarlar dahil) olan kişiler. - İntraserebral hemoraji öyküsü olan hastalar. - Miyokard enfarktüsü (MI) de dahil yakın tarihli (6 hafta içerisinde) kardiyovaskülerolay. 4.4 Özel kullanım uyarıları ve önlemleriUyarılar:Antidepresan ilaçların çocuklar ve 24 yaşına kadar olan gençlerdeki kullammlarmm, intihar düşünce ya da davranışlarını artırma olasılığı bulunmaktadır. Bu nedenle özellikle tedavininbaşlangıcı ve ilk aylarda ilaç dozunun artırılma/azaltılma ya da kesilme dönemlerinde hastanıngösterebileceği huzursuzluk, aşırı hareketlilik gibi beklenmedik davranış değişiklikleri ya daintihar olasılığı gibi nedenlerle hastanın gerek ailesi gerekse tedavi edicilerce yakinen izlenmesi gereklidir._İntihar/intihar düşünceleri veya klinik kötüleşme SPRAVATO'nun intiharı önlemedeki veya intihar düşüncesi veya davranışını azaltmadaki etkililiği gösterilmemiştir (bkz. Bölüm 5.1). SPRAVATO kullanımı, klinik olarak gerekliyse,hastalarda ilk SPRAVATO dozundan sonra iyileşme görülse bile hastaneye yatış ihtiyacını ortadankaldırmaz. Özellikle tedavinin erken evrelerinde ve doz değişikliklerinin ardından, tedaviye ek olarak yüksek risk taşıyanlar başta olmak üzere hastalar yakın gözetim altında tutulmalıdır. Hastalar (vehastaların bakım verenleri) klinik kötüleşme, intihar davranışı veya düşünceleri ve olağan dışıdavranış değişikliklerini izlemeleri ve belirtilerin mevcut olması durumunda derhal tıbbi yardımalmaları gerektiğine dair uyarılmalıdır. Depresyon, intihar düşünceleri, kendine zarar verme ve intihar (intihar ilişkili olaylar) riskinde bir artış ile ilişkilidir. Bu risk, anlamlı remisyon meydana gelinceye dek devam eder, bu nedenlehastalar yakından izlenmelidir. İntihar riskinin iyileşmenin erken evrelerinde artış göstermesi,genelde karşılaşılan bir klinik deneyimdir. İntihar ilişkili olaylar geçmişine sahip veya tedaviye başlanmadan önce anlamlı derecede intihar düşünceleri sergileyen hastaların daha büyük bir intihar düşüncesi veya intihar girişimi riskitaşıdığı bilindiğinden, bu hastalar tedavi boyunca dikkatle izlenmelidir. Nöropsikiyatrik ve motor bozukluklar Klinik araştırmalarda, SPRAVATO'nun somnolans, sedasyon, dissosiyatif belirtiler, algı bozuklukları, baş dönmesi, vertigo ve anksiyeteye sebep olduğu rapor edilmiştir (bkz. Bölüm 4.8).Bu etkiler dikkat, yargı, düşünme, tepki hızı ve motor becerileri bozabilir. Her bir tedavi seansında,hastalar klinik karara göre ne zaman stabil kabul edileceklerini değerlendirmek üzere bir sağlıkçalışanının gözetimi altında takip edilmelidir (bkz. Bölüm 4.7). Solunum depresyonu Anestezi olarak kullanılan esketamin veya ketaminin yüksek dozlarda hızlı intravenöz enjeksiyonundan sonra solunum depresyonu meydana gelebilir. Esketamin burun sprey(SPRAVATO) ile klinik çalışmalarda solunum depresyonu olgusu gözlenmemiştir; nadiren derinsedasyon vakaları bildirilmiştir. SPRAVATO'nun MSS depresanlarıyla birlikte kullanılmasısedasyon riskini artırabilir (bkz. Bölüm 4.5). Pazarlama sonrası kullanım sırasında,SPRAVATO'nun MSS depresanları ile kombinasyon halinde kullanımıyla veya obezite, anksiyete,kardiyovasküler ve solunum rahatsızlıkları gibi komorbiditeleri olan hastalarda nadiren solunumdepresyonu vakaları gözlenmiştir. Bu olaylar doğası gereği geçici olmuştur ve sözel/dokunsalstimülasyon veya ilave oksijen sonrasında düzelmiştir. Sedasyon ve solunum depresyonu içinyakın izlem gereklidir. Kan basıncı üzerindeki etki SPRAVATO, sistolik ve/veya diyastolik kan basıncında, tıbbi ürünün uygulanmasından yaklaşık 40 dakika sonra pik noktaya ulaşan ve yaklaşık 1-2 saat süren geçici artışlara neden olabilir (bkz.Bölüm 4.8). Tedavi seansından sonra önemli ölçüde kan basıncı artışı meydana gelebilir.SPRAVATO, kan basıncı veya kafa içi basıncındaki bir artışın ciddi risk teşkil ettiği hastalardakontrendikedir (bkz. Bölüm 4.3). SPRAVATO reçete edilmeden önce, kardiyovasküler veserebrovasküler rahatsızlıkları olan hastalar SPRAVATO'nun potansiyel yararlarının ilgilirisklerden ağır basıp basmadığının belirlenmesi için dikkatle değerlendirilmelidir. Doz uygulaması öncesi kan basıncının yükseldiği belirlenen hastalarda (genel kural olarak: <65 yaş hastalar için >140/90 mmHg ve >65 yaş hastalar için >150/90 mmHg), SPRAVATO iletedaviye başlanmadan önce kan basıncını azaltmak için yaşam tarzı ve/veya farmakolojiktedavilerin belirlenmesi uygun olacaktır. SPRAVATO uygulaması öncesi kan basıncınınyükselmesi durumunda SPRAVATO tedavisini erteleme kararı, bireysel olarak hastalardaki yararve risk dengesi göz önünde tutularak verilmelidir. Doz uygulamasından sonra kan basıncı izlenmelidir. Kan basıncı dozdan yaklaşık 40 dakika sonra ve sonrasında, değerler düşene kadar klinik olarak gerekli oldukça ölçülmelidir. Eğer kan basıncıuzun bir süre yüksek olmaya devam ederse, derhal kan basıncı yönetiminde deneyimlipratisyenlerden yardım alınmalıdır. Hipertansif kriz belirtileri sergileyen hastalar derhal acilbakıma sevk edilmelidir. Kardiyovasküler veya solunum bakımından durumu klinik açıdan anlamlı veya değişken olan hastalar Kardiyovasküler veya solunum bakımından durumu klinik açıdan anlamlı veya değişken olan hastalarda, ancak yarar riskten fazlaysa SPRAVATO ile tedaviye başlanmalıdır. Bu hastalardaSPRAVATO, uygun resüsitasyon ekipmanı ve kardiyopulmoner resüsitasyon (kalp masajı) eğitimialmış sağlık çalışanlarının bulunduğu bir ortamda uygulanmalıdır. Değerlendirilmesi gerekendurumlar aşağıdakileri içerebilir, fakat bunlarla sınırlı değildir: KOAH dahil anlamlı pulmoner yetmezlik; Morbid obezite ile birlikte uyku apnesi (BKİ>35); Hemodinamik instabiliteye yol açan kontrolsüz bradiaritmi ya da taşiaritmileri olanhastalar; MI öyküsüne sahip hastalar. Bu hastalar doz uygulamasından önce klinik açıdan stabilolmalı ve kardiyak belirti sergilememelidir. Hemodinamik açıdan anlamlı valvüler kalp hastalığı ya da kalp yetmezliği (NYHA SınıfIII-IV). İlaç suistimali, bağımlılığı, yoksunluğu İlaç suistimali veya bağımlılığı öyküsü olan kişiler, SPRAVATO'nun suistimali ve kötüye kullanımı için daha yüksek risk taşıyabilir. SPRAVATO'yu reçete etmeden önce, her bir hastanınsuistimal ve kötüye kullanım riski değerlendirilmeli ve esketamin kullanan hastalar tedavi aldıklarısüre boyunca ilaç arama davranışı da dahil olmak üzere suistimal ve kötüye kullanım davranışlarıya da durumlarının gelişimi yönünden izlenmelidir. Uzun süreli ketamin kullanımı ile bağımlılık ve tolerans rapor edilmiştir. Ketamine bağımlı kişilerde, ketamin tedavisinin sonlandırılmasıyla kriz, anksiyete, titreme, terleme ve palpitasyonile karakterize yoksunluk belirtileri bildirilmiştir. Arketamin ve esketaminin rasemik karışımı olan ketamin, suistimal edildiği rapor edilen bir tıbbi üründür. SPRAVATO'nun suistimal, kötüye kullanım ve başkasına verilme potansiyeli, bir sağlıkçalışanının doğrudan gözetimi altında uygulanmasıyla minimuma indirilmektedir. SPRAVATOesketamin içerir ve suistimal ve başkasına verme durumlarına maruz kalabilir. Diğer risk taşıyan popülasyonlar SPRAVATO, aşağıda belirtilen hastalıklara sahip hastalarda dikkatli kullanılmalıdır. Bu hastalar, SPRAVATO reçete edilmeden önce dikkatle değerlendirilmeli ve ancak yararın riskten ağırbasması durumunda tedaviye başlanmalıdır: Psikoz varlığı veya öyküsü Mani veya bipolar bozukluk varlığı ya da öyküsünün varlığı Yeterli şekilde tedavi edilmeyen hipertiroidizm Beyin yaralanması, hipertansif ensefalopati, ventriküler şantlar ile intratekal tedavi veyaintrakraniyal basınç artışı ile ilişkili başka bir hastalık öyküsü. Yaşlılar (65 yaş ve üzeri) SPRAVATO ile tedavi gören yaşlı hastalar harekete geçtiklerinde düşme riskleri daha fazla olabileceğinden, bu hastalar dikkatle izlenmelidir. Şiddetli karaciğer yetmezliği Beklenen maruziyet artışı ve klinik deneyimsizlik nedeniyle, Child Pugh sınıf C (şiddetli) karaciğer yetmezliği olan hastalarda SPRAVATO önerilmemektedir. Kronik ketamin kullanımı ile hepatotoksisite rapor edilmiş olduğundan, uzun dönemli SPRAVATO kullanımına bağlı bu tür bir etki potansiyeli dışlanamaz. İdrar yolu belirtileri SPRAVATO kullanımı ile idrar yolu ve mesane ile ilgili belirtiler rapor edilmiştir (bkz. Bölüm 4.8). Tedavi süresince idrar yolu ve mesane ile ilgili belirtilerin izlenmesi ve belirtiler kalıcıolmaya devam ederse uygun sağlık mesleği mensubuna danışılması önerilmektedir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriSPRAVATO'nun MSS depresanları (benzodiazepinler, opioidler, alkol gibi) ile eş zamanlı kullanımı sedasyonu artırabilir, bu nedenle yakından izlenmelidir. SPRAVATO ile psikostimülanlar (amfetaminler, metilfenidat, modafinil, armodafinil gibi) veya kan basıncını artırabilecek diğer tıbbi ürünler (örn. ksantin türevleri, ergometrin, tiroit hormonları,vazopressin ya da tranilkipromin, selegilin, fenelzin gibi MAO inhibitörleri) birlikte kullanılırken,kan basıncı yakından izlenmelidir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlarda ilaç-ilaç etkileşimleri için herhangi bir çalışma yapılmamıştır. Pediyatrik popülasyon:Pediyatrik popülasyonlarda ilaç-ilaç etkileşimleri için herhangi bir çalışma yapılmamıştır. 4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Gebelik sırasında ve doğum kontrolü kullanmayan çocuk doğurma potansiyeline sahip kadınlarda SPRAVATO'nun kullanılması önerilmemektedir. Gebelik dönemiSPRAVATO'nun gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvan çalışmaları, arketamin ve esketamin'in rasemik karışımı olan ketaminin, fetüs gelişimindenörotoksisiteyi indüklediğini göstermiştir (bkz. Bölüm 5.3). Esketamin ile benzer bir risk göz ardıedilemez. İnsanlara yönelik potansiyel risk bilinmemektedir. Kadın hastanın SPRAVATO ile tedavi sırasında gebe kalması durumunda, tedavi sonlandırılmalı ve hasta fetüse yönelik potansiyel risk ve klinik/terapötik seçenekler hakkında mümkün olan enkısa sürede bilgilendirilmelidir. SPRAVATO, gerekli olmadıkça gebelik dönemindekullanılmamalıdır. Laktasyon dönemiEsketaminin anne sütüne geçip geçmediği bilinmemektedir. Hayvanlardaki veriler, esketaminin süte geçtiğini göstermiştir. Anne sütüyle beslenen bebeklere yönelik bir risk dışlanamaz.Emzirmenin çocuk için yararı ve tedavinin kadın için yararı dikkate alınarak, emzirmeninbırakılması ya da SPRAVATO tedavisinin sonlandırılması/tedaviden kaçınılması yönünde birkarar verilmelidir. Üreme yeteneği/FertiliteHayvan çalışmaları, fertilite ve üreme yeteneğinin esketamin tarafından olumsuz yönde etkilenmediğini göstermiştir. 4.7 Araç ve makine kullanımı üzerindeki etkilerSPRAVATO, araç ve makine kullanımı üzerinde büyük bir etkiye sahiptir. Klinik çalışmalarda, SPRAVATO'nun somnolans, sedasyon, dissosiyatif belirtiler, algı bozuklukları, baş dönmesi,vertigo ve anksiyeteye sebep olduğu rapor edilmiştir (bkz. Bölüm 4.8). SPRAVATOuygulamasından önce, hastalara tedavinin ertesi günü dinlendirici bir uykudan sonrasına kadar araç veya makine kullanımı gibi tam mental uyanıklık ve motor koordinasyonu gerektiren potansiyel olarak tehlikeli olabilecek aktivitelerden kaçınması söylenmelidir (bkz. Bölüm 4.4). 4.8 İstenmeyen etkilerGüvenlilik profili özeti SPRAVATO ile tedavi edilen hastalarda en yaygın olarak gözlenen advers reaksiyonlar baş dönmesi (%31), dissosiyasyon (%27), bulantı (%27), baş ağrısı (%23), somnolans (%18), disguzi(%18), vertigo (%16), hipoestezi (%11), kusma (%11) ve kan basıncı artışı (%10) olmuştur. Advers reaksiyonların tablo halinde listesi Esketamin ile rapor edilen advers reaksiyonlar, Tablo 3'te listelenmektedir. Belirlenmiş sistem organ sınıfları içerisinde, advers reaksiyonlar sıklık başlıkları altında aşağıdaki düzene göretanımlanmıştır: çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10); yaygın değil (> 1/1.000 ila <1/100); seyrek (> 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor). Tablo 3: Advers reaksiyonların listesi
Seçilen advers reaksiyonların tanımı Dissosiyasyon Esketaminin en yaygın psikolojik etkilerinden biri dissosiyasyon (%27) olmuştur. Diğer ilişkili terimler derealizasyon (%2,2), depersonalizasyon (%2,2), illüzyonlar (%1,3) ve zaman algısındabozukluğu (%1,2) içermiştir. Bu advers reaksiyonlar, geçici ve kendi kendiyle sınırlı olarakbildirilmiş ve dozlama gününde meydana gelmiştir. Dissosiyasyon, çalışmalar genelinde %4'tendüşük insidansla şiddetli olarak bildirilmiştir. Dissosiyasyon belirtileri, tipik olarak dozdan 1,5saat sonra düzelmiş ve belirtilerin şiddeti tekrarlı tedavilerle zaman içinde azalma eğilimigöstermiştir. Sedasyon/somnolans/solunum depresyonu Klinik çalışmalarda, sedasyon (%9,3) ve somnolans (%18,2) advers reaksiyonları, ağırlıklı olarak hafif veya orta şiddetli olmuş, dozlama gününde meydana gelmiş ve aynı gün kendiliğindendüzelmiştir. Sedatif etkiler tipik olarak dozdan 1,5 saat sonra ortadan kaybolmuştur. Somnolansoranları, uzun süreli tedavi boyunca zaman içinde nispeten stabil olmuştur. Sedasyon durumunda,solunum sıkıntısı belirtileri gözlenmemiş ve hemodinamik parametreler (yaşamsal bulgular veoksijen satürasyonu dahil) normal aralıklar dahilinde kalmıştır. Pazarlama sonrası kullanımsırasında, nadiren solunum depresyonu vakaları gözlenmiştir (bkz. Bölüm 4.4). Kan basıncındaki değişiklikler Tedaviye dirençli Majör Depresif Bozukluk için yapılan klinik çalışmalarda, SPRAVATO + oral antidepresanlar alan hastalarda zaman içinde sistolik ve diyastolik kan basıncında (SKB ve DKB)meydana gelen artışlar, dozdan 40 dakika sonra SKB'de yaklaşık 7 ila 9 mmHg ve DKB'de 4 ila6 mmHg; dozdan 1,5 saat sonra ise SKB'de 2 ila 5 mmHg ve DKB'de 1 ila 3 mmHg olmuştur(bkz. Bölüm 4.4). Esketamin + oral antidepresan alan hastalarda, belirgin derecede anormal kanbasıncı yüksekliklerinin sıklığı SBP (>40 mmHg artış) için %8 (<65 yaş) ila %17 (>65 yaş) veDBP (>25 mmHg artış ) için %13 (<65 yaş) ila %14 (>65 yaş) arasında değişmiştir. SBP artışı (>180 mmHg) insidansı %3 ve DBP artışı (> 110 mmHg) insidansı %4 olmuştur. Bilişsel ve hafıza bozukluğu Uzun süreli ketamin kullanımı veya ilaç suistimali ile bilişsel ve hafıza bozukluğu bildirilmiştir. Bu etkiler, zaman içinde artış göstermemiş ve ketamin tedavisinin sonlandırılmasıyla eskiyedönmüştür. Uzun dönemli klinik çalışmalarda, esketamin burun spreyin bilişsel fonksiyonüzerindeki etkisi zaman içinde değerlendirilmiş ve performans stabil kalmıştır. İdrar yolu belirtileri Yüksek dozlarda günlük ve uzun dönemli ketamin kullanımı ile interstisyel sistit vakaları bildirilmiştir. Esketamin klinik çalışmalarında interstisyel sistit olgularına rastlanmamış; fakatplasebo ile tedavi gören hastalara kıyasla esketamin ile tedavi gören hastalarda alt idrar yolubelirtileri (pollakiüri, dizüri, idrar aciliyeti, noktüri ve sistit) daha yüksek bir oranda gözlenmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr. e-posta:[email protected]: tel: 0 800 314 00 08; faks: 0 312 218 35 99).4.9 Doz aşımı ve tedavisiSPRAVATO'nun hasta tarafından aşırı dozda alınma potansiyeli, ürünün tasarımı ve uygulamanın bir sağlık çalışanının gözetimi altında gerçekleştirilmesiyle minimuma indirilmektedir (bkz.Bölüm 4.2). BelirtilerSağlıklı gönüllülerde test edilen maksimum tek esketamin burun sprey dozu 112 mg olup toksisite bulgusu ve/veya advers klinik sonuçlarla ilişkili olmamıştır. Ancak, önerilen doz aralığına kıyasla112 mg esketamin burun sprey dozu, baş dönmesi, hiperhidroz, somnolans, hipoestezi, anormalhissetme, bulantı ve kusma gibi advers reaksiyonların daha yüksek oranlarıyla ilişkili olmuştur. Normal anestetik dozun 25 misli dozda verilen ketamin ile sahip olunan deneyimlere dayanılarak bu dozda yaşamı tehdit edici belirtiler beklenmektedir. Klinik belirtiler konvülsiyonlar, kardiyakaritmiler ve solunum arresti olarak tanımlanmıştır. Esketaminin benzer bir supraterapötik dozununintranazal yoldan uygulanması olanaklı görünmemektedir.YönetimEsketamin doz aşımı için spesifik bir antidot yoktur. Doz aşımı durumunda, çoklu tıbbi ürün katılım olasılığı düşünülmelidir. SPRAVATO doz aşımı, klinik belirtilerin tedavisi ve gerekliizlem ile kontrol altına alınmalıdır. Yakın gözetim ve izlem, hasta iyileşinceye kadar devametmelidir. 5. FARMAKOLOJIK ÖZELLIKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Sinir sistemi; Psikoanaleptikler; Antidepresanlar; Diğer antidepresanlar ATC kodu: N06AX27 Etki mekanizmasıEsketamin, rasemik ketaminin S-enantiomeridir. Bir iyonotropik glutamat reseptörü olan A-metil-D-aspartat (NMDA) reseptörünün nonselektif, nonkompetitif bir antagonistidir. NMDA reseptör antagonizmi aracılığıyla esketaminin glutamatsalımında geçici bir artışa neden olarak, a-amino-3-hidroksi-5-metil-4-isoksazolpropionik asitreseptörü (AMPAR) stimülasyonunda artışlara ve daha sonra sinaptik fonksiyonun duygudurumve duygusal davranışın düzenlenmesinde rol oynayan bu beyin bölgelerinde onarılmasına katkıdabulunabilecek nörotrofik sinyal iletiminde artışlara yol açtığını ileri sürmektedir. Ödül vemotivasyonla ilgili beyin bölgelerinde dopaminerjik nörotransmisyonun onarılması ve anhedoniile ilgili beyin bölgelerinde stimülasyonun azaltılması hızlı yanıta yol açabilir. Farmakodinamik etkiler Suistimal potansiyeli Keyif amaçlı çoklu uyuşturucu kullanıcılarında (n=41) yürütülen bir suistimal potansiyeli çalışmasında, esketamin burun spreyin (84 mg ve 112 mg) ve pozitif kontrol ilacı intravenözketaminin (40 dakika boyunca infüzyon yoluyla verilen 0,5 mg/kg) tek dozları, öznel ilacı sevmedeğerlendirmeleri ve diğer öznel ilaç etkisi ölçümlerinde plaseboya kıyasla anlamlı derecede dahayüksek puanlara neden olmuştur. Klinik etkililik ve güvenlilikSPRAVATO burun spreyin etkililik ve güvenliliği, majör depresif bozukluk için DSM-5 kriterlerini karşılayan ve mevcut majör depresyon atağında yeterli dozaj ve sürede uygulanan enaz iki oral antidepresan (AD) tedavisine yanıt vermeyen tedaviye dirençli depresyonlu (TDD)yetişkin hastalarda (18-86 yaş) yürütülen beş Faz 3 klinik çalışmada araştırılmıştır. 1.833 yetişkinhasta çalışmaya kaydedilmiş ve bunların 1.601'i SPRAVATO'ya maruz kalmıştır. SPRAVATO burun spreyinin etkililiği ve güvenliği, Mini Uluslararası Nöropsikiyatrik Görüşme (MINI) sorularına olumlu yanıt veren orta ila şiddetli MDB'li (majör depresif bozukluk) (MADRStoplam puanı >28) yetişkin hastalarda (18 ila 64 yaş) yapılan iki Faz 3 klinik çalışmadaaraştırılmıştır: B3 ([Bir anlığına bile olsa] kendinize zarar vermeyi, incitmeyi ya da yaralamayıdüşünüyor musunuz: en azından bunun sonucunda ölebileceğinize dair bir niyet ya dafarkındalıkla; ya da intiharı [yani, kendinizi öldürmeyi] düşünüyor musunuz?) ve B10 (Son 24saat içinde kendinizi öldürme düşüncelerine göre hareket etmeye niyetli misiniz?). 227'siSPRAVATO'ya maruz kalan 456 yetişkin hasta kaydedilmiştir. Tedaviye dirençli depresyon - Kısa dönemli çalışmalarSPRAVATO, TDD'li hastalarda yapılan üç kısa dönemli (4 haftalık) randomize, çift kör, aktif kontrollü Faz 3 çalışmada değerlendirilmiştir. TRANSFORM-1 (TRD3001) ve TRANSFORM-2(TRD3002) çalışmaları yetişkinlerde (18 ila < 65 yaş) ve TRANSFORM-3 (TRD3005) çalışması65 yaş ve üzeri hastalarda gerçekleştirilmiştir. TRD3001 ve TRD3002 çalışmalarındaki hastalarda1. gün tedaviye SPRAVATO 56 mg + yeni başlanan günlük oral AD kombinasyonu ya da yenibaşlanan günlük oral AD + plasebo burun sprey kombinasyonu ile başlanmıştır. Daha sonraSPRAVATO dozajları, 4 haftalık çift kör indüksiyon fazı boyunca haftada iki kez uygulanan 56mg dozunda devam ettirilmiş ya da 84 mg'a ya da eşdeğer plasebo burun spreye titre edilmiştir.56 mg veya 84 mg SPRAVATO dozları, TRD3001 çalışmasında sabit ve TRD3002 çalışmasındaesnektir. TRD3005 çalışmasında, hastaların (65 yaş ve üzeri) tedavisine SPRAVATO 28 mg +yeni başlanan günlük oral AD kombinasyonu ya da yeni başlanan günlük oral AD + plasebo burunsprey kombinasyonu ile başlanmıştır (1. gün). SPRAVATO dozları, 4 haftalık çift kör indüksiyonfazı boyunca haftada iki kez uygulanan 56 mg ya da 84 mg'a veya eşdeğer plasebo burun spreyetitre edilmiştir. TRD3002 ve TRD3005 esnek doz çalışmalarında, SPRAVATO dozunun artışıklinik karara göre yapılmış ve tolere edilebilirliğe göre azaltılabilmiştir. Yeni başlanan açık etiketlioral AD (SNRI: duloksetin, uzatılmış salımlı venlafaksin; SSRI: essitalopram, sertralin)tedavisine tüm çalışmalarda 1. gün başlanmıştır. Yeni başlanan oral AD seçimi, hastanın öncekitedavi geçmişine dayanılarak araştırmacı tarafından belirlenmiştir. Tüm kısa dönemliçalışmalarda, birincil etkililik sonlanım noktası MADRS toplam skorunda başlangıçtan 28. günekadar meydana gelen değişimdir. TRD3002, TRD3001 ve TRD3005 çalışmalarındaki hastaların başlangıçtaki demografik ve hastalık özellikleri Tablo 4'te sunulmaktadır.
TRD3002 esnek doz çalışmasında, 28. günde, SPRAVATO'ya randomize hastaların %67'si 84 mg almıştır. TRD3002 çalışmasında esketamin + yeni başlanan oral AD kombinasyonu, yenibaşlanan bir oral AD (SNRI: duloksetin, uzatılmış salımlı venlafaksin; SSRI: essitalopram,sertralin) + plasebo burun sprey kombinasyonuna kıyasla klinik olarak anlamlı ve istatistikselüstünlük sergilemiş (Tablo 5) ve dozdan 24 saat sonra gibi erken bir sürede belirtilerde azalmagözlenmiştir. TRD3001 çalışmasında, yeni başlanan bir oral AD (SNRI: duloksetin, uzatılmış salımlı venlafaksin; SSRI: essitalopram, sertralin) + plasebo burun sprey kombinasyonuna kıyaslaSPRAVATO + yeni başlanan oral AD kombinasyonu lehine, 4 haftalık indüksiyon fazınınsonunda MADRS toplam puanlarında başlangıca göre meydana gelen değişimde klinik olarakanlamlı tedavi etkisi gözlenmiştir (Tablo 5). TRD3001 çalışmasında, SPRAVATO 84 mg + oralAD grubu için tedavi etkisi oral AD + plasebo grubuna kıyasla istatistiksel açıdan anlamlıolmamıştır. TRD3005 çalışmasında, 28. günde, SPRAVATO'ya randomize hastaların %64'ü 84 mg, %25'i 56 mg ve %10'u 28 mg alıyordur. TRD3005 çalışmasında, yeni başlanan bir oral AD (SNRI:duloksetin, uzatılmış salımlı venlafaksin; SSRI: essitalopram, sertralin) + plasebo burun spreykombinasyonuna kıyasla SPRAVATO + yeni başlanan oral AD için 4 haftalık indüksiyon fazınınsonunda MADRS toplam puanlarında başlangıca göre meydana gelen değişimde klinik açıdananlamlı, fakat istatistiksel olarak önemli olmayan bir tedavi etkisi gözlenmiştir (Tablo 5). Alt grupanalizleri, 75 yaş üzeri popülasyonda sınırlı etkililiği ileri sürmektedir.
SD = standart sapma; SE = standart hata; LS Ortalaması = en küçük kareler ortalaması; GA = güven aralığı; AD = antidepresan* İleriye Taşınan Temel Gözlem kullanılarak ANCOVA analizi: tedaviyi bırakan bir hasta için, depresyon seviyesinin başlangıç seviyesine döndüğü varsayılır (yani depresyon seviyesi, tedaviye başlamadan önceki ileaynıdır).§Nazal yoldan uygulanan esketamin veya plasebo; oral AD = yeni başlanan bir AD (SNRI: duloksetin, uzatılmış salımlı venlafaksin; SSRI: essitalopram, sertralin)iEn küçük kareler ortalama değişiminde başlangıca göre meydana gelen fark (SPRAVATO + oral AD eksi Oral AD + plasebo burun sprey)iOral AD + plasebo burun spreyden istatistiksel olarak anlamlı derecede üstün olan tedavi grubu #Medyan yansız tahmin (Oral AD + plasebo burun spreye olan farkın ağırlıklı LS ortalamalar kombinasyonu) ve%95 esnek güven aralığıYanıt ve remisyon oranlarıYanıt, MADRS toplam puanında indüksiyon fazının başlangıcına göre meydana gelen > %50 azalma olarak tanımlanmıştır. MADRS toplam puanında başlangıca göre meydana gelen azalmayadayanarak, TRD3001, TRD3002 ve TRD3005 çalışmalarında SPRAVATO + oral AD tedavisineyanıt sergileyen hastaların oranı, 4 haftalık çift kör indüksiyon fazı boyunca oral AD + plaseboburun spreye göre daha yüksek olmuştur (Tablo 6). Remisyon, MADRS toplam puanının < 12 olması olarak tanımlanmıştır. Üç çalışmanın tümünde, oral AD + plasebo burun spreyi kombinasyonuna kıyasla SPRAVATO + oral AD kombinasyonuile tedavi edilen hastaların daha büyük bir bölümü 4 haftalık çift kör indüksiyon fazının sonundaremisyondaydı (Tablo 6).
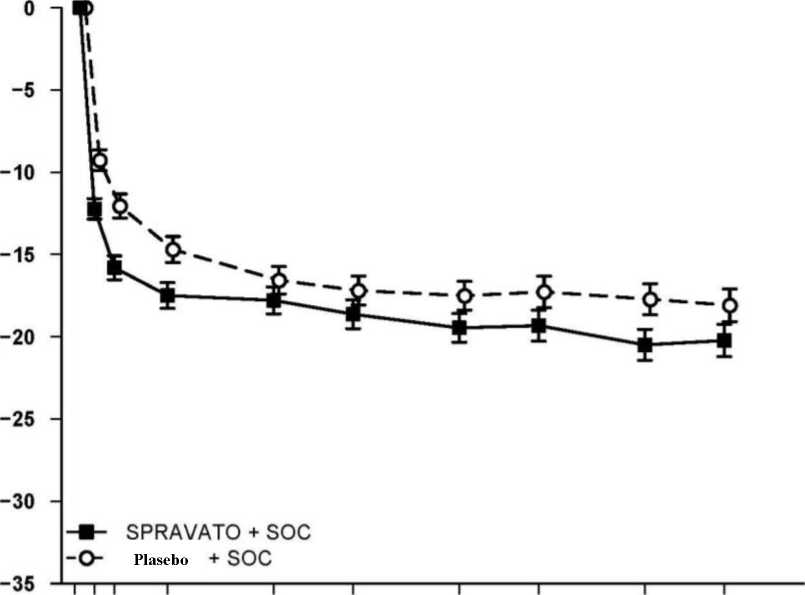
Tedaviye dirençli depresyon - Uzun dönemli çalışmalar Relaps önleme çalışması Bir relaps önleme çalışmasında, antidepresan etkililiğin devam ettiği gösterilmiştir. SUSTAIN-1 (TRD3003) çalışması, uzun dönemli randomize, çift kör, paralel gruplu, aktif kontrollü, çokmerkezli relaps önleme çalışmasıdır. Depresyon nüksünün önlenmesini değerlendiren primersonuç ölçümü, nükse kadar geçen süre olarak ölçülmüştür. Toplam 705 hasta kaydedilmiştir; 437hasta doğrudan kaydedilmiş, 150'si TRD3001'den ve 118'i TRD3002'den geçiş yapmıştır.Doğrudan kaydedilen hastalara, 4 haftalık açık etiketli indüksiyon fazında SPRAVATO (haftadaiki kez 56 mg veya 84 mg) + oral AD kombinasyonu uygulanmıştır. Açık etiketli indüksiyonfazının sonunda, hastaların %52'si remisyona girmiş (MADRS toplam puanı <12) ve %66'sı yanıtvermiştir (MADRS toplam puanında >%50 düzelme). Yanıt veren hastalar (455), 12 haftalıkoptimizasyon fazında, SPRAVATO + oral AD kombinasyonu ile tedavi almaya devam etmiştir. İndüksiyon fazından sonra, hastalar 4 hafta boyunca haftalık olarak SPRAVATO almış ve 8. haftadan itibaren, doz sıklığını belirlemek için bir algoritma (MADRS'ye dayalı) kullanılmıştır;remisyondaki hastalara (MADRS toplam puanı <12 olan hastalar) iki haftada bir doz uygulanmış,ancak MADRS toplam puanı >12'ye yükselmişse, hastanın yanıt/remisyonu devam ettirecek endüşük doz sıklığında tedaviye devam etmesini sağlamak amacıyla doz sıklığı gelecek 4 hafta içinhaftalık doz uygulamasına artırılmıştır. On altı haftalık tedavi döneminin sonunda stabil remisyon(n=176) veya stabil yanıt (n=121) sergileyen hastalar SPRAVATO'ya devam etmek ya daSPRAVATO'yu bırakıp plasebo burun spreye geçiş yapmak üzere randomize edilmiştir. Stabilremisyon, optimizasyon fazının son 4 haftasının en az 3'ünde MADRS toplam puanının <12olması ve stabil yanıt, stabil remisyon olmaksızın optimizasyon fazının son 2 haftası için MADRStoplam puanında başlangıca göre meydana gelen > %50 azalma olarak tanımlanmıştır. Stabil remisyon SPRAVATO + oral AD kombinasyonu ile tedaviye devam eden stabil remisyonda olan hastalarda depresyon belirtilerinin relapsına kadar geçen süre, yeni başlanan bir oral AD (SNRI: duloksetin,uzatılmış salımlı venlafaksin; SSRI: essitalopram, sertralin) + plasebo burun sprey grubundakihastalara kıyasla istatistiksel olarak anlamlı derecede daha uzun olmuştur (Şekil 1). Relaps, ardışık2 hafta boyunca MADRS toplam puanının > 22 olması ya da kötüleşen depresyon veya relapsaişaret eden diğer klinik olarak ilgili olaylar için hastaneye yatış olarak tanımlanmıştır. Yenibaşlanan bir oral AD (SNRI: duloksetin, uzatılmış salımlı venlafaksin; SSRI: essitalopram,sertralin) + plasebo burun sprey grubu için relapsa kadar geçen medyan süre 273 gün iken,SPRAVATO + oral AD grubu %50 relaps oranına hiç ulaşmadığından, bu grup için medyan değertahmin edilememiştir.
Stabil remisyonda olan hastalar için, 12 ve 24 haftalık çift kör takip döneminde Kaplan-Meier tahminlerine dayalı relaps oranı SPRAVATO için sırasıyla %13 ve %32; plasebo burun sprey içinsırasıyla %37 ve %46 olmuştur. Stabil yanıtSPRAVATO + oral AD kombinasyonu ile tedaviye devam eden stabil yanıt durumunda olan hastalar için de etkililik sonuçları tutarlı olmuştur: hastaların depresyon belirtilerinin relapsınakadar geçen süre, yeni başlanan bir oral AD (SNRI: duloksetin, uzatılmış salımlı venlafaksin;SSRI: essitalopram, sertralin) + plasebo burun sprey grubundaki hastalara kıyasla istatistikselolarak anlamlı derecede daha uzun olmuştur (Şekil 2). Yeni başlanan bir oral AD (SNRI:duloksetin, uzatılmış salımlı venlafaksin; SSRI: essitalopram, sertralin) + plasebo burun spreygrubu için relapsa kadar geçen medyan süre (88 gün), SPRAVATO + oral AD grubuna (635 gün)kıyasla daha kısa olmuştur. Stabil yanıt durumunda olan hastalar için, 12 ve 24 haftalık çift kör takip döneminde Kaplan-Meier tahminlerine dayalı relaps oranı SPRAVATO için sırasıyla %21 ve %21; plasebo burun sprey içinsırasıyla %47 ve %56 olmuştur. TRD3003 çalışmasına kayıtlar yaklaşık 2 yıla yayılmıştır. Sürdürüm fazı değişken süreli olmuş ve bir hasta depresyon belirtilerinde relaps yaşayana veya başka sebeple tedaviyi bırakana ya dagerekli sayıda relaps olayı meydana geldiği için çalışma sonlandırılana dek devam etmiştir.Maruziyet sayıları, çalışmanın ara analize göre önceden belirlenmiş sayıda relaps olayı meydanageldiğinde durdurulmasından etkilenmiştir. SPRAVATO + oral AD ile tedavinin ilk 16haftasından sonra, sürdürüm fazında SPRAVATO'ya medyan maruziyet süresi SPRAVATO iletedavi edilen hastalarda (stabil remisyon ve stabil yanıt) 4,2 aydır (aralık: 1 gün ila 21,2 ay). Buçalışmada, SPRAVATO sürdürüm fazında hastaların %31,6'sına 6 aydan fazla süreyle ve%7,9'una 1 yıldan fazla süreyle verilmiştir. Dozlama sıklığıSürdürüm fazında çoğunlukla kullanılan dozlama sıklığı Tablo 7'de gösterilmektedir. SPRAVATO'ya randomize edilen hastaların %60'ına 84 mg ve %40'ına 56 mg doz verilmiştir.
Tedaviye dirençli depresyon - Japon hastalarda kısa süreli çalışmaSPRAVATO'nun etkililiği, TDD'li (tedaviye dirençli depresyon) 202 yetişkin Japon hastada yapılan kısa süreli (4 haftalık) randomize, çift kör, aktif kontrollü bir çalışmada (TRD2005)değerlendirilmiştir. Hastalar, mevcut oral AD'ye (antidepresan) ek olarak SPRAVATO sabit doz28 mg, 56 mg, 84 mg veya plasebo burun spreyi ile 4 haftalık indüksiyon tedavisi almıştır. Birinciletkililik sonlanım noktası, MADRS toplam skorundaki başlangıçtan 28. güne kadar olandeğişiklikti. Hastaların temel demografik ve hastalık özellikleri, SPRAVATO artı AD ve plaseboburun spreyi artı AD grupları arasında benzerdir. TRD2005 çalışmasında, oral AD artı plasebo burun spreyi ile karşılaştırıldığında SPRAVATO artı oral AD dozlarının herhangi biri için 4 haftalık indüksiyon aşamasının sonunda başlangıca göreMADRS toplam puanlarında istatistiksel olarak anlamlı bir değişiklik gözlemlenmemiştir (Tablo8).
Tedaviye dirençli depresyon - Çinli hastalarda kısa süreli çalışmaSPRAVATO'nun etkililiği, TDD'li 252 yetişkin hastada (224 Çinli hasta, 28 Çinli olmayan hasta) yapılan kısa süreli (4 hafta) randomize, çift kör, aktif kontrollü bir çalışmada da (TRD3006)değerlendirilmiştir. Hastalar, yeni başlatılan bir oral AD'ye ek olarak, esnek dozlu SPRAVATO (56 mg veya 84 mg) veya plasebo burun spreyi ile 4 haftalık indüksiyon tedavisi almıştır. Primer etkinlik sonlanımnoktası, MADRS toplam skorunda başlangıçtan 28. güne kadar olan değişiklikti. Hastaların temeldemografik ve hastalık özellikleri, SPRAVATO artı AD grubu ile plasebo burun spreyi artı ADgrupları arasında benzerdir. TRD3006 çalışmasında, oral AD artı plasebo burun spreyi alan grup ile karşılaştırıldığında SPRAVATO artı oral AD alan grup için 4 haftalık indüksiyon aşamasının sonunda başlangıca göreMADRS toplam puanlarındaki değişiklikte istatistiksel olarak anlamlı bir fark gözlenmemiştir(Tablo 9).
Majör Depresif Bozukluğa bağlı psikiyatrik acil durumun akut kısa süreli tedavisiSPRAVATO, Mini Uluslararası Nöropsikiyatrik Görüşme (MINI) sorularına olumlu yanıt veren orta ila şiddetli MDB'si olan yetişkin hastalarda (MADRS toplam puanı >28) iki özdeş Faz 3 kısasüreli (4 hafta) randomize, çift kör, çok merkezli, plasebo kontrollü çalışmada, Aspire I (SUI3001)ve Aspire II (SUI3002) araştırılmıştır: B3 ([Bir anlığına bile olsa] kendinize zarar vermeyi,incitmeyi ya da yaralamayı düşünüyor musunuz: en azından bunun sonucunda ölebileceğinize dairbir niyet ya da farkındalıkla; ya da intiharı [yani, kendinizi öldürmeyi] düşünüyor musunuz?) veB10 (Son 24 saat içinde kendinizi öldürme düşüncelerine göre hareket etmeye niyetli misiniz?).Bu çalışmalarda, hastalar 4 hafta boyunca haftada iki kez SPRAVATO 84 mg veya plasebo burunspreyi ile tedavi görmüştür. Tüm hastalara, araştırmacı tarafından belirlendiği şekilde, ilk yatarakhastaneye yatış ve yeni başlatılan veya optimize edilmiş bir oral antidepresan (AD) tedavisi (ADmonoterapisi veya AD artı güçlendirme) dahil olmak üzere kapsamlı standart bakım (SOC)tedavisi uygulanmıştır. Hekimin görüşüne göre, hastanın ani intihar riski nedeniyle akut psikiyatrik hastaneye yatış klinik olarak gerekliydi. İlk dozdan sonra, 84 mg'lık dozu tolere edemeyen hastalarda SPRAVATO 56mg'a tek seferlik bir doz azaltılmasına izin verilmiştir. SUI3001 ve SUI3002'deki hastaların temel demografik ve hastalık özellikleri, SPRAVATO artı SOC veya plasebo burun spreyi artı SOC grupları arasında benzerdir. Ortanca hasta yaşı 40 (aralık18 ila 64), %61'i kadın; %73 Kafkas ve %6 Siyah; ve hastaların %63'ü daha önce en az bir intihar 23 girişiminde bulunmuştur. Çalışmaya girmeden önce hastaların %92'si antidepresan tedavi almaktaydı. Çalışma sırasında, standart bakım tedavisinin bir parçası olarak hastaların %40'ı ADmonoterapisi, hastaların %54'ü AD artı güçlendirme rejimi ve %6'sı hem AD monoterapisi/ADartı güçlendirme rejimi almıştır. Birincil etkililik ölçüsü, ilk dozdan 24 saat sonra (2. gün) başlangıç MADRS toplam skorundan değişiklikle ölçüldüğü üzere MDB semptomlarının azalmasıydı. SUI3001 ve SUI3002'de, SPRAVATO artı SOC, plasebo burun spreyi artı SOC'ye kıyasla birincil etkililik ölçüsünde istatistiksel üstünlük göstermiştir (bkz. Tablo 10). Tablo 10: İlk Dozdan 24 Saat SonraDeğişim için Birincil Etkililik Sonuçları BOCF*)MADRS Toplam Skorunda Başlangıca Göre (Çalışmalar SUI3001 ve SUI3002 (ANCOVA
Havuzlanmış Çalışmalar 1ve 2 SD = standart sapma; SE = standart hata; LS Ortalaması = en küçük kareler ortalaması; GA = güven aralığı; SOC=standart bakım*İleriye Taşınan Temel Gözlem kullanılarak ANCOVA analizi: SUI3001'de 2 hasta (her grupta 1 hasta) 2. gün (ilk dozdan 24 saat sonra) MADRS toplam puanına sahip değildi ve SUI3002'de 6 hasta (Esketamine'de 4 hasta vePlasebo'da 2 hasta) 2. gün (ilk dozdan 24 saat sonra) MADRS toplam puanına sahip değildi. Bu hastalar için,depresyon düzeyinin başlangıç düzeyine döndüğü (yani depresyon düzeyinin tedavinin başlangıcıyla aynı olduğu)varsayılır ve başlangıçtan itibaren MADRS toplam puanları analiz için ileriye taşınır.iNazal yoldan uygulanan esketamin veya plasebo§En küçük kareler ortalama değişiminde başlangıca göre meydana gelen fark (SPRAVATO + SOC eksi plasebo burun sprey + SOC)^Plasebo burun spreyi + SOC'den istatistiksel olarak anlamlı derecede üstün olan tedavi grupları.SPRAVATO + SOC ve plasebo + SOC arasındaki 2. günde (ilk dozdan 24 saat sonra) MADRS toplam skorunda başlangıca göre değişiklikteki tedavi farklılıkları (%95 GA), önceden intihargirişimi olduğu bildirilen alt popülasyon için (N=284) - 4,7 (-7,16; - 2,24) ve önceden intihargirişimi bildirmeyen alt popülasyon için (N=166) -2,34 (-5,59; 0,91) olmuştur. Tedavi yamtınm zaman süreciHem SUI3001 hem de SUI3002'de SPRAVATO'nun plaseboya kıyasla tedavi farkı 4 saatten başlayarak gözlenmiştir. 4 saat ile tedavi aşamasının sonu olan 25. gün arasında, hem SPRAVATOhem de plasebo grupları iyileşmeye devam etmiştir; gruplar arasındaki fark genel olarak kalmıştır,ancak 25. gün boyunca zamanla artmadığı görülmüştür. Şekil 3, havuzlanmış çalışmalar SUI3001ve SUI3002 kullanılarak MADRS toplam puanındaki değişimin birincil etkililik ölçüsünün zamansürecini göstermektedir. En Küçük Kareler SUI3001 ve SUI3002*'de Zaman İçinde MADRS Toplam Puanında Taban Çizgisinden Ortalama Değişim (Havuzlanmış Veri, GüvenlikAnalizi Seti) - ANCOVA BOCFŞekil 3:
IRemisyon oranlarıFaz 3 çalışmalarda, 4 haftalık çift kör tedavi çalışmaları boyunca tüm zaman noktalarında, remisyona ulaşan hastaların yüzdesi (çalışma sırasında herhangi bir zamanda MADRS toplampuanı <12), SPRAVATO + SOC grubunda plasebo + SOC grubuna göre daha yüksekti (Tablo 11).
İntihar üzerindeki etkilerHer iki tedavi grubundaki genel hastalar arasında istatistiksel olarak anlamlı bir fark olmamasına rağmen, Klinik Küresel İzlenim - İntihar Şiddeti - revize edilmiş (CGI-SS-r) ölçeği ile 24 saatliksonlanım noktasında ölçülen intihar eğilimlerinin şiddetinde iyileşme yaşanmıştır. SPRAVATO'nun intiharı önlemedeki uzun vadeli etkililiği belirlenmemiştir. Pediatrik popülasyonAvrupa İlaç Ajansı, pediatrik popülasyonun bir veya daha fazla alt grubunda majör depresif bozukluğun tedavisinde SPRAVATO ile yapılan çalışmaların sonuçlarını sunma yükümlülüğünüertelemiştir (pediyatrik kullanım hakkında bilgi için bkz. Bölüm 4.2). 5.2 Farmakokinetik özelliklerGenel özelliklerEmilimBurun sprey olarak uygulanan 84 mg esketaminin ortalama mutlak biyoyararlanımı yaklaşık %48'dir. Esketamin, nazal uygulamanın ardından burun mukozası tarafından hızlıca emilir ve 28 mg doz uygulamasını takiben 7 dakika içinde plazmada ölçülebilir. Maksimum plazma konsantrasyonunakadar geçen süreye (tmaks), tipik olarak tedavi seansının son nazal sprey uygulamasından 20 ila 40dakika sonra ulaşılır (bkz. Bölüm 4.2). Esketamin burun spreyin maksimum plazma konsantrasyonunda (Cmaks) ve plazma konsantrasyon-zaman eğrisi altındaki alan (EAA«) değerinde, 28 mg, 56 mg ve 84 mg dozlar iledoza bağlı artışlar meydana gelmiştir. Esketaminin farmakokinetik profili, tek ve tekrarlı doz uygulamasından sonra benzer olmuş, esketamin haftada iki kez uygulandığında plazmada birikim gözlenmemiştir. Dağılımİntravenöz yoldan uygulanan esketaminin ortalama kararlı durum dağılım hacmi 709 L'dir. İnsan plazma proteinlerine bağlanan toplam esketamin konsantrasyonu oranı ortalama %43 ila %45'tir. Esketaminin plazma proteinlerine bağlanma derecesi, hepatik veya renal fonksiyona bağlıdeğildir. Esketamin, P-glikoproteinin (P-gp; çoklu ilaç direnci ilişkili protein 1), meme kanseri direnç proteininin (BCRP) ya da organik anyon taşıyıcısı (OATP) 1B1 veya OATP1B3'ün substratıdeğildir. Esketamin, bu taşıyıcıları veya çoklu ilaç ve toksik bileşen ekstrüzyon 1 (MATE1) veMATE2-K taşıyıcılarını ya da organik katyon taşıyıcısı 2 (OCT2), OAT1 veya OAT3'ü inhibeetmemektedir. BiyotransformasyonEsketamin büyük ölçüde karaciğerde metabolize olur. Esketaminin insan karaciğer mikrozomlarındaki primer metabolik yolağı, noresketaminin oluşturulduğu N-demetilasyondur.Esketaminin N-demetilasyonundan sorumlu başlıca sitokrom P450 (CYP) enzimleri CYP2B6 veCYP3A4'tür. CYP2C19 ve CYP2C9 gibi diğer CYP enzimleri, çok daha az ölçüde katkısağlamaktadır. Daha sonra noresketamin, CYP'ye bağlı yolaklar aracılığıyla diğer metabolitleremetabolize olur ve bunların bazıları glukuronidasyondan geçer. Eliminasyonİntravenöz yoldan uygulanan esketaminin ortalama klirensi saatte yaklaşık 89 L'dir. Nazal uygulama sonrası Cmaks'a ulaşıldıktan sonra, plazmadaki esketamin konsantrasyonlarında ilkbirkaç saat hızlı ve sonrasında daha kademeli bir azalma meydana gelmiştir. Burun sprey olarakuygulama sonrası ortalama terminal yarılanma ömrü genel olarak 7 ile 12 saat arasında olmuştur. Radyoaktif işaretli esketaminin intravenöz yoldan alınmasından sonra, uygulanan radyoaktivitenin yaklaşık %78'i idrarda ve %2'si feçeste görülmüştür. Radyoaktif işaretli esketaminin oral yoldan 28 alınmasından sonra, uygulanan radyoaktivitenin yaklaşık %86'sı idrarda ve %2'si feçeste görülmüştür. Geri kazanılan radyoaktivite, ağırlıklı olarak esketamin metabolitlerindenoluşmuştur. İntravenöz ve oral uygulama yolları için, dozun %1'inden daha azı idrarla değişmemişilaç olarak atılmıştır. Doğrusallık/doğrusal olmayan durumEsketamin maruziyeti 28 mg'dan 84 mg'a kadar olan doz aralığında artmıştır. Cmaks ve EAA değerlerindeki artış, 28 mg ile 56 mg veya 84 mg arasında doz oransallığından düşük olmuş, fakat56 mg ve 84 mg arasında neredeyse dozla orantılı olmuştur. EtkileşimlerDiğer tıbbi ürünlerin esketamin üzerindeki etkisi Hepatik enzim inhibitörleri Sağlıklı gönüllülerin, hepatik CYP2B6 aktivitesi inhibitörü olan oral tiklopidin ile ön tedavisi (esketamin uygulamasından önceki 9 gün boyunca ve esketamin uygulaması gününde günde ikikez 250 mg), nazal sprey olarak uygulanan esketaminin Cmaks değeri üzerinde hiçbir etkiye yolaçmamıştır. Esketaminin EAA® değeri, yaklaşık %29 oranında artmıştır. Esketaminin terminalyarılanma ömrü, tiklopidin ön tedavisinden etkilenmemiştir. Hepatik CYP3A4 aktivitesi inhibitörü olan oral klaritromisin ile ön tedavi (esketamin uygulamasından önceki 3 gün boyunca ve esketamin uygulaması gününde günde iki kez 500 mg),nazal yoldan uygulanan esketaminin ortalama Cmaks değerini yaklaşık %11 ve EAA® değeriniyaklaşık %4 oranında artırmıştır. Esketaminin terminal yarılanma ömrü, klaritromisin öntedavisinden etkilenmemiştir. Hepatik enzim indükleyicileri CYP3A4 ve CYP2B6 gibi birden çok hepatik CYP enziminin güçlü bir indükleyicisi olan oral rifampisin ile ön tedavi (esketamin uygulamasından önceki 5 gün boyunca günde 600 mg), burunsprey olarak uygulanan esketaminin ortalama Cmaks değerini yaklaşık %17 ve EAA® değeriniyaklaşık %28 oranında azaltmıştır. Diğer burun sprey ürünleri Alerjik rinit öyküsüne sahip ve daha önce çim polenine maruz kalan hastaların burun sprey olarak uygulanan oksimetazolin ile ön tedavisi (nazal esketamin uygulamasından 1 saat önce uygulanan2 sprey %0,05 çözelti), esketaminin farmakokinetiği üzerinde minör düzeyde etkili olmuştur. Sağlıklı gönüllülerin nazal mometazon furoat uygulaması ile ön tedavisi (son mometazon furoat dozunun nazal esketamin uygulamasından 1 saat önce uygulandığı, 2 hafta boyunca günde 200mcg), esketaminin farmakokinetiği üzerinde minör düzeyde etkili olmuştur. Esketaminin diğer ilaçlar üzerindeki etkisi İki hafta boyunca haftada iki kez nazal yoldan uygulanan 84 mg esketamin, hepatik CYP3A4 substratı olan oral midazolamın (tek 6 mg doz) ortalama plazma EAA® değerini yaklaşık %16oranında azaltmıştır. İki hafta boyunca haftada iki kez nazal yoldan uygulanan 84 mg esketamin, hepatik CYP2B6 substratı olan oral bupropionun (tek 150 mg doz) ortalama plazma EAA değerini etkilememiştir. Hastalardaki karakteristik özelliklerÖzel popülasyonlarYaşlılar (65 yaş ve üzeri)Burun sprey olarak uygulanan esketaminin farmakokinetiği, yaşlı fakat bunun dışında sağlıklı olan kişilerle daha genç sağlıklı yetişkinler arasında karşılaştırılmıştır. 28 mg doz ile elde edilenortalama esketamin Cmaks ve EAA« değerleri, yaşlı kişilerde (65 ila 81 yaş) daha genç yetişkinlere(22 ila 50 yaş) kıyasla sırasıyla %21 ve %18 daha yüksek olmuştur. 84 mg doz ile elde edilenortalama esketamin Cmaks ve EAA« değerleri, yaşlı kişilerde (75 ila 85 yaş) daha genç yetişkinlere(24 ila 54 yaş) kıyasla sırasıyla %67 ve %38 daha yüksek olmuştur. Esketaminin terminalyarılanma ömrü, yaşlı ve daha genç yetişkin kişilerde benzer olmuştur (bkz. Bölüm 4.2). Böbrek yetmezliği 28 mg esketamin burun sprey dozu uygulandıktan sonra esketaminin Cmaks değeri, hafif (CLcr, 58 ila 77 mL/dk), orta şiddetli (CLcr, 30 ila 47 mL/dk) veya şiddetli (CLcr, 5 ila 28 mL/dk, diyalizdedeğil) böbrek yetmezliği olan hastalarda normal böbrek fonksiyonu (kreatinin klirensi [CLcr], 88ila 140 mL/dk) olan hastalara göre ortalama %20 ila %26 daha yüksek olmuştur. EAA« değeri,hafif ila şiddetli böbrek yetmezliği olan hastalarda %13 ila %36 daha yüksek bulunmuştur. Diyaliz hastalarına burun sprey olarak uygulanan esketamin ile klinik deneyim mevcut değildir. Karaciğer yetmezliği 28 mg esketamin dozları ile elde edilen Cmaks ve EAA« değerleri, Child-Pugh sınıf A (hafif) karaciğer yetmezliği olan kişilerle sağlıklı kişiler arasında benzer olmuştur. Esketaminin Cmaks veEAA« değerleri, sağlıklı kişilere göre Child-Pugh sınıf B (orta şiddetli) karaciğer yetmezliği olankişilerde sırasıyla %8 ve %103 oranında daha yüksek olmuştur. Child-Pugh sınıf C (şiddetli) karaciğer yetmezliği olan hastalarda, burun sprey olarak uygulanan esketamin ile klinik deneyim mevcut değildir (bkz. Bölüm 4.2 ve 4.4). Irk Esketamin burun spreyin farmakokinetiği, sağlıklı Asyalı ve beyaz ırktan kişiler arasında karşılaştırılmıştır. Tek bir 56 mg'lık esketamin dozu ile elde edilen ortalama plazma esketaminCmaks ve EAA« değerleri, Çinlilerde beyazlara göre sırasıyla %14 ve %33 daha yüksek olmuştur.Ortalama olarak, beyazlara kıyasla Korelilerde esketamin Cmaks değeri %10 daha düşük ve EAA«değeri %17 daha yüksek bulunmuştur. Sağlıklı Japon hastalara ek olarak tedaviye dirençlidepresyonu olan Japon hastaları içeren bir popülasyon farmakokinetik analizi yapılmıştır. Buanalize göre, belirli bir doz için, Japon hastalarda plazma esketamin Cmaks ve AUC 24s, Asyalıolmayan hastalara göre yaklaşık %20 daha yüksektir. Esketaminin plazmada ortalama terminalyarılanma ömrü, Asyalı kişilerde 7,1 ila 8,9 saat ve beyazlarda 6,8 saat olmuştur.Cinsiyet ve vücut ağırlığı Popülasyon PK analizine dayanarak, esketamin burun spreyin farmakokinetiğinde cinsiyet ve toplam vücut ağırlığı (>39 ila 170 kg) için anlamlı farklılıklar gözlenmemiştir. Alerjik rinit Burun sprey olarak uygulanan 56 mg'lık tek bir esketamin dozunun farmakokinetiği, sağlıklı kişilerle karşılaştırıldığında çim polenine maruz kalan alerjik rinitli kişilerde benzer olmuştur. 5.3 Klinik öncesi güvenlilik verileriGeleneksel tekrarlı doz toksisitesi, genotoksisite, nörotoksisite, üreme toksisitesi ve karsinojenik potansiyel çalışmalarından elde edilen klinik dışı veriler insanlar için özel bir tehlikeyigöstermemiştir. Ketamin ile yapılan hayvan çalışmaları, gelişimsel nörotoksisite bulgusugöstermiştir. Esketaminin gelişmekte olan fetüs üzerindeki nörotoksik etki potansiyeli göz ardıedilemez (bkz. Bölüm 4.6). GenotoksisiteEsketamin, Ames testinde metabolik aktivasyon ile veya metabolik aktivasyonsuz mutajenik etki sergilememiştir. Esketaminin genotoksik etkileri, tarama in vitroin vivoin vivoComet testinde, intravenöz yoldanuygulanan esketamin genotoksik özellikler göstermemiştir.Üreme toksisitesiKetaminin nazal yoldan sıçanlara uygulandığı embriyo-fetal gelişimsel toksisite çalışmasında, yavrular, EAA değerlerine göre insanlardaki maruziyetin 6 misline kadar maruziyete yol açandozlarda maternale toksisite varlığında advers olarak etkilenmemiştir. Ketaminin nazal yoldantavşanlara uygulandığı embriyo-fetal gelişimsel toksisite çalışmasında, maternal olarak toksikdozlarda iskelet malformasyonları gözlenmiş ve fetal vücut ağırlığı azalmıştır. EAA değerlerinegöre tavşanlardaki maruziyet insanlardaki maruziyet bölgesindeydi. Hafif ila orta dereceli anesteziye yol açan dozlarda yürütülen yayımlanmış hayvan çalışmaları (primatlar dâhil), hızlı beyin gelişimi ya da sinaps gelişim sürecinde anestetik ajan kullanımınıngelişmekte olan beyinde, uzun süreli biliş eksiklikleri ile ilişkili olabilecek hücre kaybına nedenolduğunu göstermiştir. Bu klinik dışı bulguların klinik anlamlılığı bilinmemektedir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSitrik asit monohidrat Disodyum edetat Sodyum hidroksit (pH ayarı için) Enjeksiyonluk su 6.2 GeçimsizliklerGeçerli değil. 6.3 Raf ömrü36 ay 6.4 Saklamaya yönelik özel tedbirler30°C altındaki oda sıcaklığında saklayınız. 6.5 Ambalajın niteliği ve içeriğiKlorobutil kauçuk tıpalı Tip-I cam flakon. Doldurulan ve tıpalanan flakon, manuel olarak aktive edilen burun sprey cihazı içine monte edilir. Cihaz, iki sprey uygular. Her bir paket içinde, her bir cihaz yalıtılarak kapatılmış blistere ayrı olarak ambalajlanmıştır. 1, 2 veya 3 burun sprey cihazı içeren ambalaj boyutları. Tüm ambalaj boyutları pazarlanmayabilir. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıkları Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. Aşağıdaki bilgiler yalnızca sağlık çalışanlarına yöneliktir: Kullanım KılavuzuSPRAVATO (esketamin)Burun Sprey Cihazı
Her bir burun sprey cihazı, iki sprey halinde toplam 28 mg esketamin uygular. ÖnemliBu cihaz, bir sağlık mesleği mensubunun gözetimi altında hasta tarafından uygulanmak için tasarlanmıştır. Hastayı eğitip denetlemeden önce, bu Kullanım Kılavuzunun tamamını okuyunuz. Yardıma mı ihtiyacınız var?İlave yardım almak veya geri bildiriminizi paylaşmak istiyorsanız, Ruhsat Sahibinin iletişim bilgileri için Kullanma Talimatına bakınız. Burun Sprey Cihazı
Her burun sprey cihazı, iki sprey halinde toplam 28 mg esketamin uygular.
Yalnızca ilk cihazdan önce:  Hastaya yalnızca ilk cihazdan önce burnunu silmesini söyleyin. Gerekli cihaz sayısını doğrulayın.
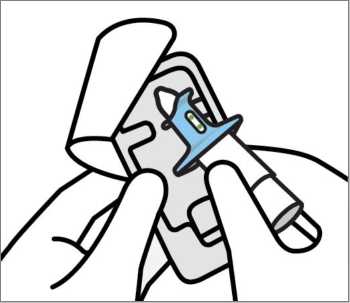
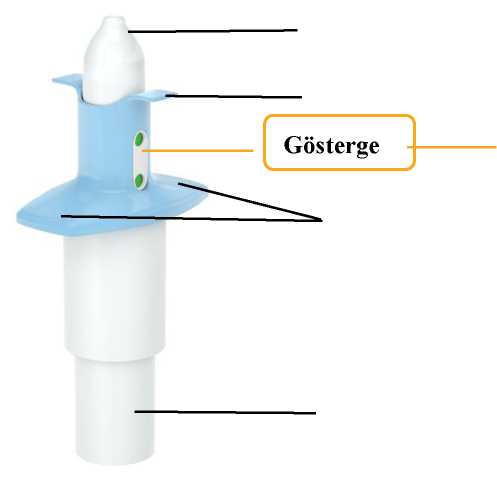
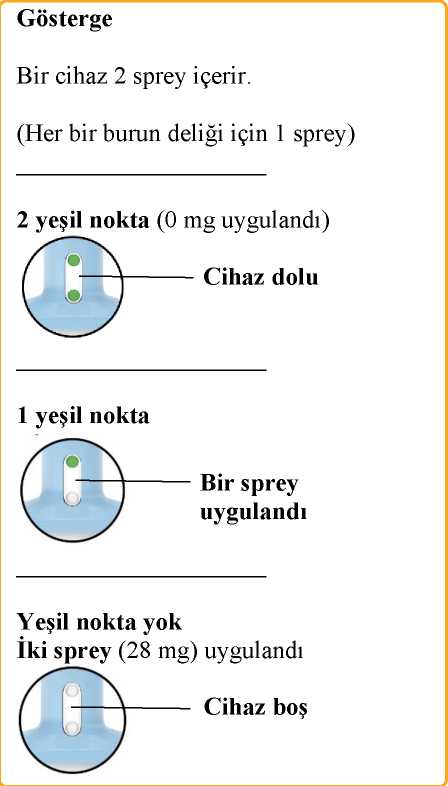
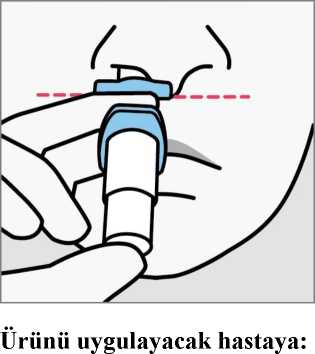
Son kullanma tarihini ('SKT') kontrol edin. Son kullanma tarihi geçmişse, yeni bir cihaz alın. Blister ambalajı soyun ve cihazı çıkartın. Sağlık mesleği mensubu:Cihazı çalıştırmaya hazırlamayın. Bu, ilaç kaybına neden olacaktır. Göstergenin 2 yeşil nokta gösterdiğini doğrulayın. Göstermiyorsa, cihazı atın ve yenisini alın. Cihazı hastaya verin. 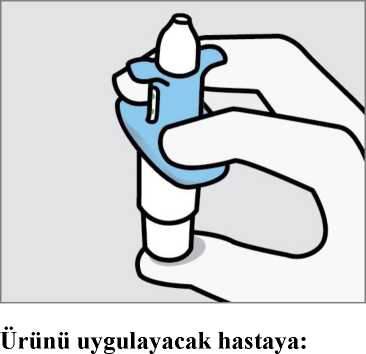 Cihazı, gösterildiği gibi başparmağı pistonu nazikçe destekleyecek şekilde tutmasını ve Pistona bastırmamasını söyleyin.
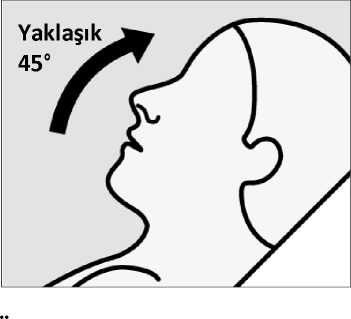
Uygulama sırasında ilacı burnunun içinde tutmak için başını yaklaşık 45 derece arkaya yatırmasını söyleyin. Cihazın ucunu ilk burun deliğine yerleştirmesini ve Burun yuvasının burun delikleri arasındaki deriye temas etmesi gerektiğini söyleyin. Diğer burun deliğini kapatmasını ve Pistonu, durduğu noktaya kadar tamamen iterken burnundan nefes almasını söyleyin. Ürünü uygulayacak hastaya: Spreyi uyguladıktan sonra ilacı burnunun içinde tutmak için burnunu hafifçe çekmesini söyleyin. Ürünü uygulayacak hastaya: Ucu ikinci burun deliğine yerleştirmek için el değiştirmesini ve İkinci spreyi uygulamak için 4. Adımı tekrarlamasını söyleyin.  Cihazı hastadan alın. Göstergenin hiç yeşil nokta göstermediğini doğrulayın. Yeşil nokta görürseniz, hastadan ikinci burun deliğine tekrar sprey sıkmasını isteyin. Cihazın boş olduğunu doğrulamak için göstergeyi tekrar kontrol edin.  Ürünü uygulayacak hastaya: Her cihaz uygulamasından sonra 5 dakika rahat bir pozisyonda (tercihen yarı yatık) dinlenmesini ASıvı dışarı akarsa, burnunu hafifçe kurulamasını söyleyin. Burnunuzu sümkürmeyin. 
Birden fazla cihaz gerekli olursa, 2-5. Adımları tekrarlayın. ÖNEMLİ: Hastanın, ilacın emilmesi için her cihaz uygulamasından sonra 5 dakika beklediğinden emin olun. İmhaKullanılan cihazı/cihazları yerel gerekliliklere uygun olarak bertaraf edin.
Revizyon tarihi: 7. RUHSAT SAHİBİJohnson and Johnson Sıhhi Mal. San. ve Tic. Ltd. Şti. Kavacık/Beykoz/İstanbul 8. RUHSAT NUMARASI2022/103 9. ILK RUHSAT TARTHT/RUHSAT YENILEME TARIHIİlk ruhsat tarihi: 07.03.2022 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENILENME TARIHI |
İlaç BilgileriSpravato 28 Mg Burun Spreyi, ÇözeltiEtken Maddesi: Esketamin Hidroklorür Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.