Sayfren 1 Mg/ml Oral Çözelti Kısa Ürün BilgisiKi^^ muN1. BEŞERİ TIB^^ ADI SAYFREN 1 mg/ml oral çözelti 2. KAUTATO VE KANTTATO BL^M Etkin madde: Aripiprazol Her mPde 1 mg aripiprazol ^rir. Yardma maddeler:Her m^de Propil parahidroksibenzoat (E216) 0,20 mg Metil parahidroksibenzoat (E218) 1,80 mg Ya^m^naddeler ^in 6. Te b^nız. 3. FARMA^^^^ TORMOral çözelti Şeffaf, renksiz homojen çözelti. 4. K^^râC ÖZELLKLER4.1 Terapitik endikasyonlarSAYFREN y^^cin ve ergenlerde (13-17 y^) şizofreni tedavisinde (akut şizofreni epizodlannın tedavisinde ve idame ted^^i sır^^da klin ik^gmda) endikedir.SAYFREN y^^^inlerde Bipolar I Bozuklukla ilişkili akut manik epizodlaraı tedavisinde ve son epizodu manik ya da karma olan bipolar I hastalarda stabilitenin s^lanm^ı ve r^üransmönlenmesinde endikedir. SAYFREN antidepresan tedaviye d^ıçli m^r depresyon hastala^mia antidepresan tedaviyi güçlendirmek ^in ekleme tedavisi olarak endikedir. SAYFREN pediyatrik hastalarda (6 -17 y^) b^ala^^ karçı agresyon, kendini k^;lı olarak yaralama, öfe nöbetleri ve ruh halinin hızla d^^mesi semptomlan da dahil olmak üzere, otistikbozukluk ile ilişkili irritabilitenin tedavisinde endikedir. 4.2 Pozoloji ve uygulama şekliPozoloji / uygulama sık^ ve ^resi:SAYFREN, tablet kul^ırken yutma zo^^ju y^ayan hastalarda alternatif tedavi olarak kull^lır (bkz; bölüm 5.2).^;u içerisinde kalibre 30 mFlik dereceli ölçek (2 mİ ve 5-30 mİ çizgisi olan) ve hacme (mİ) göre derecelendirilmiş 5 ml'lİk bir pipet i^rir. Uygun doz, dereceli ölçek veya hacme (mİ) göre derecelendirilmiş pipet kullanılarak ayarlanır. Y^^^inlerde Şizofrenide SAYFRENin öndoöğünl^ıgünde tek dozverilen 10 mg/günmg/gün'dürçö^^^^^n'dügünde^ıçalışmmg/günçö^^^^^ı) doz^^ıdaolduğu gösrmiştiGünlük'ı^nam^lır.Bipolar Manide SAYFRE^^ emlerin zam^^^İkkate ^inde tek doz olarak verilmelidir, b^langıç dozu genellikle günde 15 mg veya 30 m^ır ^rn: 10 ml - 30 ml çöz^^^^^n'dür). Eğer gerekliyse, doz ayarlam^ı 24 saatten daha kısa ^rede y^^dmam^lır. Antimanik ^^^liği (312 hafta) 15 mg/gün - 30 mg/gün doz ar^;ı ^in klinik çalışmalarla ispatlamıştır. 30mg/gün'ün üzerindeki dozlar^lik çalışmalar ile d^^erlendir^^ş d^^dir. Bipolar I Bozuklukta yeni mani epizodla ^^m önlenmesiAripiprazol kullanan hastalarda manik epizodlann tekrarlanm anı^11^Mm^m^egünlükrd^m göz önünde^lır.M^r depresif epizodlarda SAYFRENin antidepresanlara ilave tedavi olarak öndoöğünlnı^mm^sı^ı gündemg/gün'dü^^^mdamg/günmg/günçö^^^ün)rdaGünlük^ımk^^m^iıgünlükı^iı^^^^de dogözönüne Anabilir.Aripiprazol ilavesi ile devam eden tedavisinde hastanın düzenli olarak izlenmesi gerekmektedir.Pediyatrik p^ülasyonErgenlerde (13-17 y^) şizofreniÖn^^l^ı^mm^sı^ı gündemg/gün'dürçö^^^^^n'dügün,günögünlük doz^m^holduğund^şln, günlükı içş^mc^iır.SAYFREN 10 mg/günmg/günçöGünlükgörebilirler.Otistik Bozukluk ile ilişkilendirilen İrritabilite Pediyatrik Hastalar (6-17 y^)SAYFRENin öngünde5 ilâ 10 mg/gün olup mdoz günde birdoğ^^^^^^ kişiye gö^iır.Tedaviye 2 mg/gün^l^iımg/gün'çı^mm,cıdmnlmg/gün^ı'çıkılm^hmg/gün'k^^dmm,^d^iır.Uygulama şekli Ağız yoluyla ^ıır. Özel p^ülasyonlara il^kin ek bilgiler Bibrek yetme^ji: ^brek yetme^^ olan hastalarda doz ayarlama gerekmez. Karayer yetme^ji: Hafif-o^^iddette karayer bo^^hığu olan hastalar ^in doz ayarlam^ı önerilmemektedir. Şiddetli karayer bo^^hığu olan hastalarda mevcut veriler, tavsiyedebulunmak ^in yetersizdir. Bu hastalarda, dozlama dikkatli bir ş^^Me düzenlenmelidir. Buna ekolarak, 30 m^ık maksimum günlük do^^ddetli karayer bo^^^^ olan hastalarda dikkatlicekull^Mm^iır (bkz; böl^ 5.2).Pediyatrik popülasyon:SAYFRENin 6 yaşm altındaki çocuklarda güvenliliği ve etkililiği belirlenmediğinden kullanılması önerilmemektedir.Geriyatrik p^ülasyon: 65 ya> ve üzerindeki hastalarda SAYFRENin şizofreni, Bipolar I bozukluk veya m^^OT depresif epizodlamı tedavisindeki güv^^^iği ve etkililiğibelirlenm^rnştir.^püb^^^^mı yüksek hassasiyetinden dol^^^ Minik f^örler uygun olduğu zaman daha düşük b^b^ç do^^ ^şünülmelidir (bkz; bö^n 4.4).Cinsiyet: K^n hastalarda erkek hastalardan daha fa^ı bir doz ayan gerekmez (bkz; bö^n 5.2).CYP2D6 veya CYP3A^i inhibe eden veya CYP3A^i ^^iikleyen il^lan kullanan hastalarda (bkz; bölüm 4.5):Güçlü CYP3A4 veya CYP2D6 inhibitörleri ile e^ inanlı olarak aripiprazol alan hastalarda dozun ay^^^^nası:(bkz. böWm 4.5)Güçlü CYP3A4 indükleyicileri kullanan hastalarda dozun ay^^^ması:(bkz. bölüm 4.5)CYP3A4 ve CYP2D6 enzimlerini inhibe eden çok s^da iMçla ^ zamklı olarak ted^ gören hastalarda günlük dozun, normal dozun %25ine kadar az^ılm^ı göz önündebulundurulm^br. CYP2D^a iyi metabolize edem^ği bilinen hastalarda aripiprazol dozu b^b^ıçta normal dozun ya^na (%50) indirilmeli, daha sonra iyi bir klinik y^ü alabilecek şekildeayarlanm^iır. Bir CYP3A4 inhibitörii uygulanan, iyi metabolize edemeyen hastalardaaripiprazol dozu, normal dozun çeyr^ kadar (%25) olm^iır. 4.3 Kontrendikasyonlar Aripiprazole veya diğer bilecenlerine karçı alerjisi olanlarda kontrendikedir. 4.4 Özel kullamm uyanla^^e önlemleri Antipsikotik tedavi sıramda, hastan klinik durumunun düzelmesi birk^^jünden birkaç haftaya kadar riirebilir. ^^önem boyunca hastalar y^^d^^özlenmelidir. Aripipra^^ioğrudan antidepresan tedavi a^^lı kull^Mmam^iır. Önemli adve^^aç reaksiyonlan:İntihar:Psikotik hast^darda ve duygudurum bozuklukla^^^ intihar ^^mi gömmesi doğaldır ve baz durumlarda, aripipra^ü de ^eren antipsikotik tedaviye bulanmandan ya da tedavininkesilmesinden hemen sonra intihar ^^mi gö^^ğü bildi^^Mştir (bkz; böl^ 4.8).Yüksekrisk ^toıdaki hastalan y^nd^^özlenmesi antipsikotik tedaviye etmelidir. Aripiprazoliyi hasta uygulam^^^^^ uyumlu olacak şekilde, dozriskini azaltmak ^in, en düşükmiktarda r^ete edilmelidir. Kardiyovasküler bozukluklar:Aripiprazol, bilinen kardiyov^üler hast^jı (miyokard infa^^ttisü ya da iskemik kalp hastalığı hikayesi, kalp yetmezl^i ya da iletim anormallikleri), serebrov^üler hast^jı ya dahipotansiyona neden olabilecek durumlan (dehidratasyon, hipovolemi ve antihipertansifikçlarla tedavi) ya da akselere veya malign dahil olmak üzere hipertansiyonu olduğu bilinenhastalarda dikkatli kull^Mm^iır. Antipsikotik ikçlar ile tedavide tromboemboli (VTE) vakalan rapor ^^toiştir. Antipsikotikler ile tedavi edilen hastalarda VTE riski oluşabilec^^den, SAYFREN ile tedavi sır^^^^^ ve öncesinde VTE ^in tüm ol^ı risk f^örleri belirlenmeli ve koruyucu önlemler^^m^iır. QT u^^ması:Aripipra^^in klinik deneylerinde, QT uzam^^m gö^^^^ sıklığının plasebo ile karçık^ınlabilir olduğu gö^toiştür. Diğer antipsikotiklerle olduğu gibi, ailesinde QT uzamasıhikayesi olan hastalarda aripiprazol dikkatle kull^Mm^iır. Tardif diskinezi:1 yıllık ya da daha az ^reli olan klinik çalışmalarda, aripiprazol ile tedavi sır^^da aniden ortaya çıkan diskinezi ile ilgili seyrek raporlar yer ataştır. Antipsikotik tedavi süresi uz^^^ndatardif diskinezi riski a^ğı ^in, SAYFREN alan hastalarda tardif diskinezi belirti ve bulgulangörürse dozun az^Mm^ı ya da ila^ kesilmesi düşünülmelidir. Bu bulgular ^çici olarakkötükşebilir veya tedavi kesildikten sonra dahi ortaya çıkabilir (bkz; bö^n 4.8).Diğer ekstrapiramidal semptomlar:Pediyatrik klinik çalışmalarda aripiprazol ile tedavi sır^^^la akatizi ve parkinsonizm gözlemlemiştir. Aripiprazol ile tedavi edilen hast^^ diğer ekstrapiramidal belirti vesemptomla^^özlenirse, doz azaltma ve y^n klinik gözlem değerlendirilmelidir. Nöroleptik malign sendrom (NMS):lmbö^n 4.8).Nöbet:Klinik çalışmalarda, aripiprazol ile tedavi sıramda n^to nöbet vakalan raporl^rnıştır. Bu sebeple, nöbet bozukluğu hikayesi ya da nöb^^^^ üişkilendirilen durumlan olan hastalardadikkatli kull^^m^lır (bkz; bö^n 4.8).Yaşlı hastalarda demans^^ Uişkili psikoz:Konvansiyonel ve atipik antipsikotik i^çlar demansa b^lı psikozu olan y^ı hastalarııjı tedavisinde kull^^^^|ında ölüm riskinde a^a neden olmaktır. Mortalite^^ m'-tış:(bkz; bö^n 4.8).Serebrovasküler advers olaylar:(bkz; bölrnn 4.8).Hiperglisemi ve diabetes mellitus:Aripiprazol dahil atipik antipsikotikler ile tedavi edilen hastalarda hiperglisemi ve diyabet bildi^üş, baz vakalarda hipergliseminin ^ın derecede olduğu ve ketoasidoz, hiperosmolarkoma veya ölüm ile ilişkili olduğu bildüıiştir. Hastalamı şiddetli komplikasyonlara eğiliminesebep olabilen risk faktörleri obezite ve ailede diyabet öyküsü olmadır. Aripiprazol ile^çekl^ûüş klinik çalışmalarda, hiperglisemi b^liılı advers olaylamı (diabeti de ^ren)insidans oranla^^^^^ ya da anormal glisemi laboratuvar delerlerinde plasebo ilekarçık^ı^^^mda anl^lı fa^^idar gözlenm^mştir. SAYFREN ile ya da diğer atipikantipsikotik ajanlarla tedavi edilen hastalarda hiperglisemi b^iülı advers olaylar ^indoğrudan kanlanmalara izin verecek kesin risk tahminleri mevcut delildir. SAYFRENi de^ren diğer atipik antipsikotiklerle tedavi edilen hastalar hipergliseminin belirti ve bulgularınakarçı (polidipsi, poliüri, polifaj ve z^Mc) ve diabetes mellitus t^isi kodmuş ya da diabetesmellitus risk f^örleri olan hastalar glikoz kont^^iün kötütö^esi ihtimaline ka^ı düzenliolarak izlenmelidir (bkz; bölrnn 4.8).Hipersensitivite:Alerjik bulgularla karakterize edilen hipersensitivite reaksiyonlan d^er i^çlarla olduğu gibi aripiprazol ile de ortaya çıkabilir (bkz; böl^ 4.8).artışı:Kilo a^şı gen^^ie şizofrenik ve bipolar manik hastalarda, morbiditelere, kilo a^^ıa sebep olduğu bilinen antipsikotiklerin kull^^muna, düzensiz y^am şekline b^lı olarak gö^i ve şiddetli komplikasyonlara neden olabilir. SAYFREN r^etel^mıiş hastalarda, pazarlama sonr^ıkilo artşı bildi^üştir. Tespit edild^p zaman genellikle diyabet hikayesi, tiroid bo^^uğu yada pituiter adenom bulunanlar gibi yüksek risk f^örii tnyan hastalardır. Klinik çalışmalarda aripipra^^in klinik olarak anl^lı kilo a^^a sebep olduğu gösterilm^^ıtir (bkz; bö^n 5.1).Bipolar manisi olan adolesan hastalarla yüriidilen klinik çalışmalarda, 4 haft^k tedavi sonr^^da aripipra^^in kilo ânıyla ilişkilendi^Miği gö^toiştür. Bipolar manisi olanadolesan hastalarda kilo artşı izlemi y^^ümdıdr. Kilo a^şı klinik olarak belirgin ise dozazaltma dikkate ^^m^iır (bkz; böl^ 4.8).Disfaji:Antipsikotik il^^oılb^m özofagus dismotilitesi ve aspirasyon ile ilişkilendiri^ştir. Aspirasyon pnömonisi riski olan hastalarda aripiprazol ve diğer antipsikotik ikçlar dikkatlikull^^m^iır. Patolojik kumar oynamadiğer d^ü kontrol bozuklukları:Aripiprazol r^ete edilen hastalar ar^^da, daha önceden kumar oynama öykülerine sahip olup olm^kla^m b^Mmafeı^, pazarlama sonr^ı raporlarda patolojik kumar oynamabildi^ıiştir. D^M önceden patolojik kumar oyn^^^ ^^üsüne sahip hastalar a^ıış risk ^toıdaolabilirler ve daha dikkatli izlenmelidirler (bkz. böl^ 4.8).Pazarlama sonr^ vaka raporlamda hastalam kumar oynama ^ğpn arzu yaı^ıl^kları ve aripiprazol kull^ırken bu arzuyu kontrol edemedikleri öne sü^taıüşdir. Daha az bildirilendiğer kompulsif davra^lar; cinsel arzular, ^ve^, yemek yeme/ tıkınarak yeme ^^iğerdiMisel ya da kompulsif davr^şlaMır. Hastalar bu davr^şlan anormal olarakt^mnlam^klamdan aripiprazol r^ete eden hekimlerin hastalamia/hasta y^nla^a yenibulayan ya da yoğun olan, kumar oynama ist^, kompulsif cinsel diMiler, kompulsif ^veriş,tıkınarak ya da kompulsif yemek yeme vb. kompulsif arzularla ilgili sorular sormala^nemlidir.DiWü kontrol belirtilerinin altta yatan bozuklukla da ilişkili olabilec^i göz önündebulundurulm^lır. Hepsinde olmasa da baa vakalarda, doz azaltoıı ya da tedavi kesilmesisonr^ı dü^sellikte azalma bildirmiştir. Kompulsif davr^şlar e?er fark edilmezlerse hast ankendisine ya da b^kalaraıa zarar vermesi ile son^lanabilir. Hastada bu tara dükler fark^^^^jinde doz az^Mm^ ya da tedavinin kesilm^^^ ^lünülebilir.Ortostatik hipotansiyon:Potansiyel olarak aı-adrenerjik res^^r antagonist aktivitesi nedeniyle, aripiprazol ortostatik hipotansiyon ile b^bntı^^ Olunabilir. Y^^^^n hastalarda (n=2467) yollan plasebo-kontrollükısa süreli çımalarda ortostatik hipotansiyon ile ilişkilendirilen advers etkilerin insid^sışöyledir: ortostatik hipotansiyon (plasebo %0,3; aripiprazol, %1); ortostatik sersemlik (plasebo,%0,3; aripiprazol, %0,5) ve senkop (plasebo, %0,4; aripiprazol, %0,5). 6-17 y^lan ar^^dakipediyatrik hastalarda (n=611) ise ortostatik hipotansiyon ile ilişkilendirilen advers etkilerininsid^^ı; ortostatik hipotansiyon (plasebo, %0; aripiprazol, %0,5); ortostatik sersemlik(plasebo, %0; aripiprazol, %0,3) ve senkop (plasebo, %0; aripiprazol, %0,2) olarak gömmüştür. Klinik çalışmalarda oral aripiprazol ile tedavi edilen hastalamı %0,8inde (112/13.543) ortostatik hipotansiyon gi^toiştür. Vûcu sımağı ayrn-ı:Aripiprazol dahil antipsikotik ikçlamı vücudun iç vücut sıc^^;mı ^ürme yeteneğini bozduklan düşünülmektedir. Aripiprazol, iç vücut sıc^^^da bir a^^ neden olabilec^^ ^ğunegzersiz,sıc^^ maruz kalma, antikolinerjik aktivitesi olan ikçlarla birlikte alımı ya da dehidratasyona maruz kalma gibi durumlann söz konusu olabilec^i hastalarda gerek^ özen gösterilerek ^etelenmelidir. İlacm kötüye kullammıbağımlılık:Kötüye kulkrnn: Aripiprazol, ila^ kötüye kulb^nı, tolerans g^şimi veya fiziksel b^^mlılık potansiyeli b^^mmdan insanlar üzerinde sistematik olarak çalışılm^mştır. Bu nedenle, il^kötüye kullum hikayesi olan hastalar dikkatli değerlendirilmelidir ve bu hastalar SAYFRENkull^ırken herhangi bir y^ış kullum veya kötüye kullum belirtisi açısından y^^danizlenmelidir (toleransdoz a^^, ibç arama davr^^^ gibi). B^^ ^ık: Klinik çalışmalarda herhangi bir il^ arama davrmış ^^mi açığa çıkmamış olm^^a r^nen, bu gizlemler sistematik d^^dir ve bu simdi deneyimler esas Anarakherhangi bir aktif santral sinir sistemi ilacın piyasaya verildikten sonra, ne ölçüde yanlışkull^ılac^^ı, s^tınlac^^ı ve/veya kötüye kull^ılac^^ı tahmin etmek mümkün d^^dir.Uyku apmesi semdromu:SAYFREN kullanan hastalarda uyku apnesi sendromu rapor ^^taıiştir. Eş zammiı olarak santral sinir sistemi depres^ı kullanan hastalar ile uyku apnesi öyküsü olan ya da uyku apnesi riskit^yan ^rn; ^ın kilolu/obezler veya erkekler) hastalarda SAYFREN kull^lırken dikkatliolunm^iır. Dikkat E^^Miği Hiperaktivite Bozukluğu (ADHD) komorbiditesi olam hastalar:Bipolar I bozukluk ve ADH^'nin jdiksek şıklıklı komorbiditesine rağmen aripiprazol ile stimulanlaraı birlikte kull^Mm^^a ilişkin az givenlilik verisi bulunmakt^ır. Bu sebeple, buikçlam birlikte uygulanma sır^^da daha dikkatli olunm^iır. D^me:Aripiprazol, düşmeye neden olabilecek uyku hali, postüral hipotansiyon, motor ve duyusal dengesi^^e neden olabilir. Daha yüksek risk ^taıdaki hastalan tedavi ederken dikkatli olunmdıve daha düşük bir b^b^ç dozu düşünülmelidir ^rn., Y^ı veya ^çten düşmüş hastalar; bkz.Bölüm 4.2).Oral çözelti, metil parahidroksibenzoat (E216) ve propil parahidroksibenzoat (E218) ^rir. Alerjik reaksiyonlara (muhtemelen ge^toıiş) sebebiyet verebilir. 4.5 Diğer tibbi ü^nler ile etkil^imler ve ^er etkilim şekilleri Aripipra^^in santral sinir sistemi üzerindeki sedasyon gibi istenmeyen etkilere sebep olan (bkz; böl^ 4.8)birincil etkileri göz önüne ^^^^ğmda, SAYFREN santral etki gösteren diğer ikçlarlaveya alkolle birlikte ^^iığı zaman dikkatli olunm^İır. Aripiprazol, m-adrenerjik res^örantagonist aktivitesi nedeniyle baa antihipertansif bileklerin etkisini artırma potansiyelinesahiptir.Eğer aripiprazol QT uzamdı ya da elektrolit dengesinin bozulm^^a sebep olduğu bilinen ikçlarla birlikte kull^ırsa, dikkatli bir şekilde kullanm^iır. Başka ilaclann SAYFREN üzerindeki etkisi:Gastrik asit blokörti ve H2 antagonisti olan famotidin, aripiprazol emilim hı^^^^üşürmektedir fakat bu etkinin klinik b^lmtıh o^^^ğu kabul edilmemektedir. Aripiprazol, CYP1A enziminden b^^^ız ancak CYP2D6 ve CYP3A4 enzimleri so^^^ığunda birden fazla yol ile metabolize edilir. Bu sebeple, sigara kullananlar ^in dozajayarlam^ı gerekmemektedir. Kinidin ve diğer güçlü CY^^^^ıhibitörleri: S^^klı gönüllülerde ^çekl^irilen klinik çalışmada, kuvvetli CYP2D6 inhibitörii (kinidin), Cmaks d^^meden kdırken aripiprazol EA^^m %107 or^^mda a^ı^ıştır. Aktif metabolitolan dehidro-aripipra^^^^ EAA'sı ve Cmak^ı sır^^la %32 ve %47 or^^mda az^toştır.Kinidinle birlikte uygulanm^ı durumunda SAYFREN dozu, normal dozun yakl^k yansınaindirilmelidir. Fluoksetin ve paroksetin gibi diğer kuvvetli CYP2D6 (kinidin) inhibitörl erinin debenzer etkiler göstermesi beklenir ve bu yizden benzer doz azaltma uygulanmadır. Ketokonazol ve d^er CY^^^^ıbibitörleri: S^^klı göniüUilerde ^çekl^irilen klinik çalışmada, kuvvetli CYP3A4 (ketokonazol) inhibitöm, aripipra^^in EA^^nı ve Cmak^^ sır^^la %63 ve %37 or^^mda a^ı^ıştır.Dehidro-aripipra^^in EA^^ı ve Cmak^ı sır^^la %77 ve %43 or^^mda az^toştır. ZayıfCYP2D6 metabolizirleri, kuvvetli CYP3A4 inhibitörii ile birlikte uygul^^^ında, hızlıCYP2D6 metabolizirle^^ kıyasla, aripipra^^in yüksek plazma konsantrasyonlan ileson^il^ır. SAYFRENin ketakonazol ya da d^er kuvvetli CYP3A4 i^^itörleri birlikteuygul^^ğı göz önüne a^^^mda, hastaya olan potansiyel yaran potansiyel risklerinden dahafazla olm^hr. Ketokonazol ile birlikte uygulanm^ı durumunda SAYFREN dozu, normaldozun yakl^k ya^na indirilmelidir. İtrakonazol ve HIV proteaz in^^törleri gibi ^erkuvvetli CYP3A4 inhibitörlerinin de benzer etkil^^östermesi beklenir ve bu yüzden benzer dozazaltm^^^ ^gulanm^hr (bkz; bö^n 4.2).CYP2D6 ya da CYP3A4 inhibitörleri kombinasyon tedavisinden ç^^^ğinde, SAYFREN dozu zam^ı tedaviye b^lanmad^^ önceki seviyeye kadar a^mhn^iır. Z^f CYP3A4 ^r., diltiazem ya da essitalopram) ya da CYP2D6 inhibitörleri, SAYFREN ile birlikte uygul^^ğı zaman, aripiprazol konsantrasyonla^^^^^ Wr miktar a^ş gömmesibeklenebilir. Karbamazepin ve d^er CY^^^^ndükleyiciler: Kuvvetli bir CYP3A4 ^^ikleyicisi olan karbamazepin ile birlikte kull^üm^^ı takiben, aripipra^^in tek b^ıa (30 mg) uygulanm^^^ kıyasla aripipra^^in Cmaks ve EAA'smmgeometrik ort^ı sır^^la %68 ve %73 d^^^ ^şüktür. Benzeri şekilde dehidro-aripiprazolünCmaks ve EA^^ıın karbamazepin ile ^ kull^^mıından sonra geometrik ort^ı sır^^^a tekb^ıa aripiprazol tedavi^jörenlere gire %69 ve %71 daha düşüktür. SAYFREN karbamazepin ile birlikte kull^^Mığmda, SAYFREN dozu iki k^ıa çıka^m^dır. Diğer kuvvetli CY^^^ indükleyicilerinin (rifampisin, rifabutin, fenitoin, fenobarbital,primidon, efavirenz, nevirafin ve St. John's Wort gibi) de benzer etkiler göstermesi beklenir vebu yüzden benzer doz artmhn^ı uygulanmadır. Kuvvetli CYP3A4 indükleyicileri tedavidençekildiğinde, SAYFREN do^^nerilen doza indirilmelidir. Famotidin, valproat ve lityum: Aripiprazol valproat veya lityum ile birlikte kull^^^ğmda, klinik b^^ndan aripiprazol konsantrasyonunda anl^lı bir d^^iklik olma^^tır. Bu sebeple aripiprazol ile valproat veyalityumun birlikte kulla^^mda doz ayarlam^^a gerek yoktur. SAYFRENin başka ilaçlar üzerindeki etkisi:Klinik çalışmalarda, 10 ^^;ün-30 mg/gün dozlannda aripiprazol, CYP2D6 (dekstrometorfan), CYP2C9 (varfarin), CYP2C19 (omeprazol, varfarin), ve CYP3A4 (dekstrometorfan)substratla^ın metabolizm^ı üzerinde h^bir önemli etki gösterm^rnştir. Aynca, aripiprazol vedehidro-aripiprazol, CYP1A2nin ara^^mdaki metabolizma in vitroolarak düşürebilecekbir potansiyel gösterm^iştir. Bu nedenle, aripipra^^in klinik olar^ önemli bir tıbbi ü^le buenzimlerin ara^k bir etkiline girm^^^ ^^şük bir ihtimaldir.Aripiprazol valproat, lityum veya lamotirijin ile beraber kull^^^ğında, valproat, lityum veya lamotirijin konsantrasyonla^mia klinik olar^ önemli birmeydana gelm^rnştir. Serotonin sendromu: Aripiprazol kullanan hastalarda serotonin sendromu vakalan rapor ^^toiştir ve bu duruma dair belirti ve bulgula özellikle ^çici serotonin geri^n inhibitö^seçici serotonin noradrenalingeri^n inhibitörii (SSRI/SNRI) gibi diğer serotonerjik i^çlar veya aripiprazolkonsantrasyonunu yüks^Mği bilinen i^çlar ile birlikte kullrnılan vakala^ gözlenmektedir (bkz; bö^n 4.8).Alkol: Bkçok psikoaktif tedavilerde olduğu gibi hastalara SAYFREN kulla^mıı sır^^da alkol ^^ından ^^nmalan bildirilmelidir. Özel p^ülasyonlara il^kin ek bilgilerEtkil^^^^ çalışma y^ılm^rnştır. Pediyatrik p^ülasyon:Etkil^^^^ çalışma y^ılm^rnştır. 4.6 Gebelik ve laktasyonGenel tavsiye:Gebelik Kategorisi: C. Ço^ğ^)ğ^ü(Kontrasepsiyon):Hastalar aripiprazol tedavisi sır^^da hamile kdırlarsa ya da hamile kalm^ pl^^yorlarsa doktorlama haber vermelidirler. Gebelik dinemi:Aripipra^^in gebe kanlarda kull^^^^ ^mböWm 5.3).Hastalar aripiprazol tedavisi sırlında hamile kdırlarsa ya da hamile kalmayıpl^^yorlarsa doktorlanna haber vermelidirler. İnsanla^ simdi deneyim olduğu ^in,SAYFREN hamilelikte yalmzca e?er beklenen yarar fetusa olan potansiyel zarardan dahafazlaysa kull^^m^iır.Geb^^in üçünoi trimesterinde antipsikotik i^çlara maruz kalan yeni doğanlar, doğumu takiben şiddeti d^şebilen, anormal kas hareketleri (ekstrapiramidal işaretler/ ekstrapiramidalsemptomlar) ve/veya il^ kesilme semptomlan ^^^ndan risk ^toıd^ırlar. Bu semptomlar,ajitasyon, hipertoni, hipotoni, tremor, somnolans, respiratuar distres veya beslenmebozukluklar^ içermektedir. ^rauç olarak yenido^an bebekler dikkatle izlenmelidir. SAYFREN gerekli olmakça geb^^^iöneminde kull^Mmam^iır. Laktasyon dinemi:Aripiprazol ve metabolitleri insan sütüne içmektedir. Da^ anne ^in önemi veya emzirmenin bebek ^in önemi dikkate Anarak emzirmenin veya ila^ kesilmesi yönünde bir kararverilmelidir. Üreme yeten^ / Fertilite:Aripiprazol hayvanlardaki üreme toksisitesi çalışmalarda fertiliteyi azaltm^^;tır (bkz; bö^n9 / 245.3). 4.7 A^ç ve makine kullamm üzerindeki etkilerAripiprazol santral sinir sistemi ve görme y^i üzerine etkileri nedeniyle ar^ kullanma yetisi üzerinde minör ya da orta düzeyde bozulmalara neden olabilir. Bu etkiler sedasyon, sersemlik,s^^q3, görme bul^^^ğı ve çi^örmeyi ^erir (bkz; bö^n 4.8).4.8 İstenmeyen etkilerGüvenlilik profili özetiPlasebo-kont^^^^^ çalışmalarda y^^m olarak raporlanan advers reaksiyonlar; akatizi ve bul^^dır: her biri oral aripiprazol ile tedavi gören hastalamı %^^den daha fazl^^da ortayaçıkmıştır. Advers Reaksiyon TablosuAripiprazol tedavisi ile ilişkili advers il^ reaksiyonlan sddddan ^^daki tabloda verilmektedir. Tabloda verilen advers reaksiyonlan klinik çalışmalar ve/veya pazarlama sonrasıraporl^^ıştır. Çok y^^m Çi 1/10); ya^n Çi 1/100 ila <1/10); y^^m olmayan ^^^.000 ila <1/100); seyrek ^^^^.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Her s ıkıkgrubunda istenmeyen etkiler daha ciddi istenmeyen etkilerleb^k^ istenmeyen ola^ ciddiyeti azalac^ şekilde devam ^^toiştir.Pazarlama sonr^ı raporlanan istenmeyen etkilerin sıklığı spontan raporlama ile ^çekleştiği ^in mümkün olamamakt^ır. Bu nedenle pazarlama sonr^ı raporlanan istenmeyen etkilerinsıklığı bilinmiyor' olar^^ımflanmakt^r.
BilinmiyorYaygınYaygınOlmayanSeyrekA^şürmalarVücut azalma Kiloa^ı Alaninaminotransferazdüzeyinde artma(ALT) Aspartataminotransferazdüzeyinde artma(AST) yüks^^ğiQT uzamasıA^^ış km şekeridüzeyiA^^^ glikozile düzeyi ^çil^^ advers reaksiyonlamı tammlanY^^^inler: Ekstrapiramidal bulgular (EPS): Şizofreni:^kkont^lü bir çalmada, aripiprazol ile tedavi edilen hastalarda, Parkinson, akatizi, distoni ve diskinezi dahil olmak üzere, haloperidol ile tedaviedilenlere (%57,3) oranla daha düşük ortalama (%25,8) EPS gö^me sM^ı tespit ^^niştir.26 haft^k uzun süreli kont^lü bir çalışmada, aripiprazol ile tedavi gören hastalar ^in EPSningö^^^ sıklığı %19 ve plasebo ile tedavi gören hastalar ^in ise %13,1 olarak bulunmuştur.Diğer bir 26 haft^k uzun süreli kont^lü çalışmada, aripiprazol ile tedavi gören hastalar ^inEPSnin gö^ne sıklığı %14,8 ve olanzapin ile tedavi gören hastalar ^in ise %15,1 olarakbulunmuştur.Bipolar I Bozuklukta Manik Epizodlar -^k^kidame fa^mm plasebo kont^lü çalışm^mıda,aripiprazol ile tedavi gören hastalar ^in EPSnin gö^^^ sıklığı %18,2 ve plasebo ile tedavigören hastalar ^in %15,7 olar^^ ^^tomuştur.Otistik Bozukluk ile İlişkili İrritabilite-Plasebo kont^lü kısa dönem otistik bozukluk çalışmalarda pediyatrik hastalarda (6 ilâ 17 y^) akatizi ile b^k^ılı olmayan olaylar dahil,rapor edilen EPS-b^lan^ olay insid^^ı aripiprazol ile tedavi edilen hastalarda %18, plaseboile tedavi edilen hastalarda %2, akatizi ile b^l^ılı olay insid^sı ise aripiprazol tedavisi alanhastalarda %3, plasebo ile tedavi edilen hastalarda %9 olmuştur. Pediyatrik (6 ilâ 17 y^) kısadönem otistik bozukluk ç^imala^da Simpson Angus Derecelendirme Skal^ı aripiprazol ileplasebo ararda anl^lı fa^^ göste^^tir (aripiprazol 0,1; plasebo -0,4). Barnes AkatiziSkal^'ndaki d^^^dikler ve istem Dışı Hareketler Skal^ı Değerlendirmeleri aripiprazol veplasebo gruplan ararda birbirine benzer bulunmuştur.Akatizi: Plasebo kont^lü çalışmalarda, aripiprazol ile tedavi gören bipolar bozuk^ju olan hastalarda akatizinin gö^^^ıklığı %12,1 ve plasebo ile tedavi gören bipolar boz^^ğu olan hastalar ^in%3,2 olarak bulun^^tur. Şizofrenik hastalarda, akatizinin gi^^^^ıklığı aripiprazol ile tedavigörenler ^in %6,2 ve plasebo ile tedavi frenlerde %3,^ür. Distoni: Klas Etkisi: Tedavinin ilk günlerinde y^m bireylerde; distoni semptomlan, kas grubunun uz^^nış anormal k^ılm^ı ortaya çıkabilir. Distonik semptomlar: boyun kasla^^a spazm, bazenboğazda daralma, yutma güçlüğü, nefes almada güçlük ve/veya dilde şişkinlik. Bu semptomlardüşük dozlarda ortaya çıkabilirken, ilk jenerasyon antipsikotik ikçlaraı daha yüksek dozlardadaha ciddi ve yüksek potenste ve daha sıklıkla o^şabilir. Akut distoni riskinin erkeklerde ve dahag^ç y^ gruplarda a^^ gözlemlemiştir. Prolaktin: On^lı endikasyon(lar)^ yüzülen klinik çakmalarda ve pazarlama sonr^^^a tedavi b^l^jıa ile kıyasl^^^mda aripiprazol kullananlarda serum prolaktin düzeylerinde a^ş veazalmalar gözlemiştir (bkz; hölwn 5.1).Laboratuvar parametreleri: Rutin laboratuvar parametrelerinde ve lipid parametrelerinde (bk^ bölüm 5.1)potansiyel ve klinik olarak anl^lı d^^^dikler meydana gelen hastalar oranlanmamla gerçekl^irilen aripiprazolve plasebo arardaki ka^l^ırmalar medikal olarak anl^lı fa^^üddar olm^^^^ı gösteriştir.Genellikle ^çici ve asemptomatik olan CPK (Kreatin Fosfokinaz) seviyesindeki arşlar,aripiprazol ile tedavi görenler ^in plasebo alanlarla ka^l^m^^mda %3,5 ve plasebo alanlarda%2,0dir.Diğer bulgular: Antipsikotik tedaviyle i^^ili olduğu bilinen ve aripiprazol ile tedavi sırırda bildirilmiş istenmeyen etkiler, nöroleptik malign sendromu, tardif diskineziyi, nöbet vakalarmı,serebrov^üler advers olaylan ve y^ı dem^slı hastala^^^lüm oramdaki a^^ hiperglisemive diyabeti Emektedir (bkz; böl^ 4.4).Pediyat^^^ ^pülasyon: Ergenlerde (13-17 y^) Şizofreni: Şizofrenisi olan 302 ergenin (13-17 y^) dahil ^^ğu kısa dönem plasebo kont^lü klinik çalışmalarda yan etki sıklık ve tipleri y^^^inler ile benzerdir; ancak sadece ^^daki durumlararipiprazol alan ergenlerde, aripiprazol alan yet^kinlere göre (ve plaseboya göre) daha sıklıklarapor ^^taıiştir: Somnolans/sedasyon ve ekstrapiramidal bozukluklar çok sıklıkla ^^^10), ve ^ız kuruluğu, iştah a^^ ve ortostatiksıklıkla (> 1/100, < 1/10) rapor ^^^iştir. Otistik Bozukluk ile İlişkili İrritabilite - Pediyatrik Hastalar (6-17 y^): Otistik bozukluk ile ilişkili irritabilitesi olan 313 pediyatrik hastan (6-17 y^) k^^Mığı kısa süreli, plasebo kont^lü klinik çalışmalarda istenmeyen etkilerin sıklıklan ve türleriy^^rinlerdekilere benzer seyr^toiş, ancak ^^daki olaylar aripiprazol alan pediyatrikhastalarda y^^cinlerden d^^ sık (ve plasebodan d^^ sık) rapor ^^^liştir: sedasyon veyorgunluk çok sık ^/10); salya akm^ı, iştah a^ı, iştah azalm^ı, kas ve iskelet k^^ğı, a?zmkuruma ve at^^ık (>1/100, <1/10) bildirmiştir. Patolojik kumar oynama ve diğer dü^ kontrol bozukluklan: Aripiprazol ile tedavi edilen hastalarda patolojik kumar oynama, hipers^üalite, kompülsif ^%ve^ ve tık^ıırc^^a veya kompulsif yemek yeme gözlenebilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatl^lırma sonr^ı şüpheli il^ advers reaksiyonlamı raporlanm^ı büyük önem t^makt^ır. Raporlama y^^üm^ ila^ yarar/risk deng^^^ı sürekli olarak izlenmesineolanak s^lar. S^ık mesl^i mensupların herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi ^ÜFA^)'ne bildirmeleri gerekmektedir (www.titck. gov.trposta: [email protected]; tel:0 800 314 00 08; faks: 0 312 218 35 99)4.9 Doz aşr tedavisi Belirtibulgular:Klinik çalışmalarda ve pazarlama sonr^ı deneyimde, kazara veya kasti, tek b^ıa aripiprazol ile y^^^inle^ gömlen tahmini olarak 1260 mga kadarki akut dozölümdi bir durumla ka^k^m^rnştır. Aripiprazol doz ^nına b^^ olarak bildirilm^ belirti ve bulgular ar^^^a letarji, yüksek tansiyon, uyku hali, t^kardi, ishal, bulmı ve kusma bulunmaktır.Aynca, çocuklarda tek b^ına aripiprazol ile 195 mga kadarki kazara dozölüm^ bir durumla ka^b^m^mştır. Tıbbi açıdan ciddi olan belirti ve semptom olarak somnolans, ekstrapiramidal bulgular ve ^çici bilinç k^3i bildirmiştir. Hastane ort^^mda değerlendirilenhastalarda vital bulgular, laboratuvar değerlendirmeleri veya EKG ^^^ndan klinik olarak ciddiadvers d^^^dikler gözlenm^mştir. Doz aşımı tedavisi:Doz ^nı tedavisi destekleyici tedavi üzerin^^ ^ğunl^nmhr; yeterli bir havayolu, oksijenasyon ve ventilasyon s^lanmdı ve belirtiler tedavi edilmelidir. Çoklu il^ mnı ihtimaligöz önünde bulundurulmmiır. Dol^^^la kardiyov^üler izleme hemen b^l^mdı vemuhtemel aritmileri tespit etmek ^in sürekli elektrokardiyografik monitörizasyon y^^drnmiır.Kesinl^irilen ya da şüphelenilen herhangi bir aripiprazol doz ^nı sonr^ı, y^n medikalgözetim ve izleme hasta iyil^ene kadar devam etmelidir. Aripiprazolden bir saat sonra uygulanan aktif ^mür (50 g) aripipra^min EA^^n %51 ve Cmak^ıı %41 oranla^^^ düşü^^^ir ki, bu da kömümn doz ^nı tedavisinde etkinolabilec^^m gösterir. Hemodiyaliz:Her ne kadar aripiprazol doz ^^nnm tedavisinde hemodiyalizin etkisi hakkında hiç bir bilgi yoksa da, aripipra^min böbreklerden d^^meden mmam^ı ve plazma proteinle^^^^niksekoranda be^lanm^ nedeniyle hemodiyalizin yarar s^lam^ ol^ d^^dir. 5. FARMAKO^^M OZELUKLER5.1 Farmakodinamik özelliklerFarmakoter^ötik grup: Psikoleptikler, diğer antipsikotikler ATC kodu: N05AX12 Etki mekanizmdi:Aripipra^^in şizofrenideki ^^ ^^21A2Ares^ö^deki antagonist etkinin bir bileni ileb^b^lığı düşünülmektedir. Aripiprazol, dopaminerjik hiperaktivitenin hayvan modellerindeantagonist özellikler ve dopaminerjik hipoaktivitenin hayvan modellerinde agonist özelliklergöste^ştir.Farmakodinamik etkiler:in vitro,23IA2A4Ireseptörlerine iseorta derecede afinite ile b^bnır. Aripiprazol aynca serotonin geribölgesinde orta derecedeballanma afinitesi gösteriştir; muskarinik res^örlere karçı kayda de|er bir afinitesi yoktur. Dopamin ve serotonin alt tipleri dışmdaki res^örlerle olan etkilini aripipra^^to diğer kliniketkilerini açıklayabilir. 2 haft^k süre boyunca ^tode l defa 0.5 mg ila 30 mg ar^^da d^şen aripiprazol dozlan alan s^^klı gönüllülerde, D 23reseptör lig^iı olan llC-raklopridin pozitron emisyon tomografisiile tespit edilen caudata ve putamene b^lanm^^^^^ dozdan b^^ısız olarak yav^lamameydana g^toiştir.Klinik ve güvenlilikYetişkinlerŞizofreni: Pozitif ya da negatif bulgul^^österen 1.228 şizofrenisi olan hastan yer ^^ğı kısa süreli (4 ila 6 hafta) plasebo kont^lü üç çalışmada, aripiprazol plaseboya oranla psikotik bulgulardaistatistiksel olarak anl^^ı derecede daha fazla iyil^ıe meydana getiriştir. SAYFREN, ilk tedaviye y^ıt veren hastalarda tedavi sır^^da klinik iyil^nenin sindü^ lmesinde etkilidir. Haloperidol kont^lü çalışmalarda, 52 haftada tıbbi ü^e y^ıt verenhastalamı or^ı her iki grupta da benzerdir (aripiprazol %77 ve haloperidol %73). Aripiprazolgrubunda toplam tedaviyi tamamlama or^ı (%43) haloperidole oranla (%30) önemli ölçüdedaha yüksektir. PANSS ve Montgomery-Asberg Depresyon Ölçeni (MADRS) de ^ren ikincilsonlam olarak kulludan değerlendirme ölçeklerindeki mevcut skorlar haloperidolden dahafazla iyil^ıe s^b^^^ı gösteriştir.26 haft^k plasebo kont^lü çalışmada aripiprazol, relaps oramda önemli ölçüde daha jdiksek düşüşe sebep olmuştur, bu oran aripiprazol grubunda %34 ve plasebo grubunda %57 olarakbulunmuştur. Kilo a^ı: Klinik çalışmalarda aripipra^^in klinik olarak anl^lı kilo a^şı ile ilişkili olmadığı göstermiştir. 3l4 hastan kemliği ve primer sonlam nokt^ı kilo k^ıı olan 26 haft^c, olanzapin kont^^i, çi^cö^^^^ ^^mıluslu şizofreni çalışm^^da, olanzapinle ka^l^^^^^mda (N= 45,ya da hesaplanabilir hastalamı %3^dür) aripiprazol grubunda (N= l8, ya da hesaplanabilirhastalamı %l^miür) anl^lı derecede dahcas^^a hastada b^langca göre en az %7 or^^^^^kilo a^şı olmuştur ^r. b^l^^^ vücut ortalama 80,5 kg için en az 5,6 kg a^ş). Lipid parametreleri: Y^^^inlerde plasebo kont^lü klinik çalışmalardan lipid parametresi üzerindeki havuz analizinde, aripipra^^in total kolesterol, triglise^^^üksek yoğunluklu lipoprotein (HDL) vedüşük yoğunluklu lipoprotein (LDL) düzeylerinde klinik olar^^ ^kili d^^^dikleri etkilediğigösterilm^rnştir. ProlaktinProlaktin seviyeleri, tüm klinik çalışmalarda, aripipra^^toı büto dozlan için değerlendiriştir (n= 28.242). Aripiprazol ile tedavi edilen hastalarda; hiperprolaktinemi veya a^mış serumprolaktinin göine sıklığı (%0,3), plasebo (%0,2) ile benzerdir. Aripiprazol alan hastalarda,b^k^ıca kadar ge^en medirn süre 42 gün ve ortalama süre ise 34 gündür. Aripiprazol ile tedavi edilen hastalarda; hipoprolaktinemi veya aziıış serum prolaktinin göine sıklığı %0,4 iken plasebo tedavi ^iniş hastalarda bu d^er %0,02dir. Aripiprazolalan hastalarda, b^langca kadar g^en median ^re 30 gün ve ortalama ^ire 194 gündür. Bipolar I Bozuklukta Manik Epizodlar: Manik ya da karma epizodlu Bipolar I Bo^^hığu olan hastalarla gerçekl^irilen, 3 haftalık, dişken dozlu, plasebo kont^^^^^ıonoterapi ç^mala^^ haft^^ sürede aripipra^^i manikbulgulamı az^Mm^^ia plaseboya oranla d^^stün etkinl^e sahip olduğunu gösteiştir. Buçalışmalar psikotik özellikli ve hızı döngülü seyri olan ya da olmayan hastalan kapsamaktır. Manik ya da karma epizodlu Bipolar I Bozukluğu olan hastalarla g^ekl^irilen 3 haftalık, sabit dozlu, plasebo kont^lü monoterapi çalışm^^da, aripiprazol plase^^^ göre daha üstünetkinlik gösterm^mştir. Psikotik özellikli olan ya da olmayan manik ya da karma epizodlu Bipolar I Bo^^hığu olan hastalarla gerçekl^irilen 12 haftic plasebo ve aktif madde kont^lü monoterapiçalışmalarda, aripiprazol 3. haftada plaseboya gire daha üstün etkinlik göste^^tir ve etkininsür^üği 12. haftada lityum ya da haloperidol ile karçıl^ınlabilirdir. Aynca aripiprazolgrubunda manik epizoddan semptomatik remisyona giren hasta oranlan 12 haftada lityum vehaloperidol ile karçık^ınlabilir oranlardan. Psikotik özellikli olan ya da olmayan manik ya da karma epizodlu Bipolar I Bo^^uğu olan ve 2 hafta boyunca ter^^tik serum seviyelerinde lityum veya valproat monoterapisine kısmeny^ıt vermeyen hastalarla gerçekl^irilen 6 haftic, plasebo kont^lü çımada aripiprazolünilave tedavi olarak eklenmesiyle manik semptomlar azalm^^^^^ lityum veya valproatmonoterapisine göre üstünlük s^b^ıştır. Randomiz^^^ı öncesi stabil fazda olan ve daha önce aripiprazol ile remisyona ul^^rnş manik hastalarda yollan, 74 haftaya uz^inş 26 haftahk plasebo kontüü çımada, aripiprazol,bipolar epizodlarm tekrarlanm^ nn önlenmesinde, öncelikle de mani epizodla^m tekrarınönlenmesinde plas^^^ı gö^^ ^iılük göste^^tir ancak depresyon epizodla^mn tekrarmönlenmesinde ise plaseboya gire üstünlük gösterm^rnştir.12 haftic lityum veya valproat tedavisine ek aripiprazolle (10 mg^in - 30 mg/gün) süregelen remisyona giren son at^ı manik ya da karma epizod olan Bipolar I hastalarla (Young ManiDerecelendirme Ölçeği (Y-MRS) ve MADRS total skorlan <12) yü^tülen 52 haftic bir plasebo kont^lü ç^^mada ekleme tedavisinde aripiprazol riskte %4^k azalmayla (risk or^ı: 0,54) bipolar at^n tekrarlamanı önlemede plas^^^^^^inlük ortaya koymuş yine maninin tekramıı önlemede de plaseboya gire riski %65 az^toıştır (risk or^^g),35). Bununla birlikte ekleme tedavisinde aripiprazol depresyonun tekrarlam^^^^^ plaseboeklemesine gire üstün etkinlik ortaya koyam^mştır. Aripiprazol ekleme tedavisinde KlinikGlobal İzlenim Ö^ği - Bipolar versiyonu (KG-BP) Hast^M; Şiddeti Skorlan (SOI, mani) gibiikincil etkinlik ölçütlerinde de plaseboya üstündür. Bu çalışmada hastalara kısmi y^^sı^^ıbelirleyebilmek ^in açık etiketli fazda lityum ya da valproat monoterapisi ve^toiştir. Hastalaren az 12 a^^ık haft^k sürate aripiprazol ve duygu durum düzenleyicisi kombinasyonuylastabilize ^^teıiştir. Stabil hastalar bu fazdan sonra kullanmakta oldukla^^ ^ygu durumdüzenleyicisine devam ederken aripiprazol eklenecek ya da plasebo eklenec^ şekilde çift körrandomize ^^^işlerdir. Randomize fazda dört duygu durum düzenleyici alt- grubu mevcuttu:aripiprazol + lityum; aripiprazol + valproat; plasebo + lityum; plasebo + valproat. Herhangi birduygu durum at^^m yinelemesi ^in Kaplan-Meier oranlan aripiprazol+ lityum kolunda %16 ve aripiprazol + valproat kolunda %18ken, plasebo + lityum kolundabu oran %45 ve plasebo+valproat kolunda %19 b^^^mıuştur. Major depresif epizodlar: Aripipra^^in m^^OT depresif epizodlamı tedavisinde antidepresanlara ilave tedavi olarak ^^mliği m^^OT depresif epizodlar ^in DSM-IV kriterlerine uyan e^ıin hastalarda yollan üççift kör, kısa süreli (6 haft^^^ plasebo kontr^ü çalışm^^ gösterildi. Çımaya ^nanpopülasyonda mevcut epizodda d^a önceki antidepresan tedaviye (1 ila 3 kür) yetersiz yanıtöyküsü vaMı, aynca ter^^ötik dozda 8 haft ^kprospektif antidepresan tedaviye (paroksetinkontMIü s^n, venlafaksin uz^^^nış s^n, fluoksetin, essitalopram ya da sertralin) yetersizy^ıt ^^iığı da göste^Mşti. Prospektif tedavi ^in yetersiz y^ıt Hamilton DepresyonSkal^^ım 17 maddeli versiyonunda (HAM-D1^^üzelmenin %50den az olm^ı ve HAM-D17 skorunun >14 olm^ı ve Klinik Global İzlenim İyil^^^ pu^mım minimal düzelmedendaha iyi olmam^^la ta^mıhmlı.Üç ç^^mada da (n= 381, n= 362, n= 349) antidepresanlara ilave aripiprazol kullanımıyla Montgomery-Asberg Depresyon Skal^'nda (MADRS) b^l^jıca göre antidepresanmonoterapisiyle ka^l^ı^^^^^^da istatistik açısından anl^lı bir ortal^^a düz^^^ görüldü;aynca, y^ıt or^ı (MADRS Toplam Skor^'nda b^k^ı^ göre >%50 azalma olarakt^^nkmiı) ve remisyon or^^mda (MADRS Toplam Skor^'nun <10 obn^ı ve MADRS ToplamSkor^'nda b^l^jıca göre >%50 azalma olm^^la t^^nk^^ da anl^lı bir a^ va^ı. Bu çalışmalarda hastalara antidepresanlara ilave olarak aripiprazol günde 5 mg b^langıç dozuyla verildi. Tolerabilite ve ^^^liğe gire, dozlar birer hafta arayla 5 m^^k basamaklarla ayarlanabiliyordu. İzin verilen dozlar şöyleydi: 2 mg/gün, 5 mg/gün, 10 mg/gün, 15 mg/gün ve potent CYP2D6inhibitörleri olan fluoksetin ve paroksetin almayan hastalar ^in, 20 mg/gün. Üç çalışmada sonnoktada ortalama son doz 10,7 mg/gün, 11,4 mg/gün'dü. Pediyatrik popülasyonErgenlerde şizofreni (13 ila 17 y^ı):Pozitif ve negatif semptomlu 302 şizofreni ergen hastan dahil olduğu 6 haft^k plasebo kont^lü çalışmada, aripiprazol, plaseboya oranla, psikotik semptomlaraı istatistiksel olarakanl^lı ölçüde daha yüksek iyil^irilmesi ile ilişkilendi^toiştir. Kaydolan toplampopülasyonun %7^^ü temsil eden 15 ila 17 y^ ar^^daki ergen hastalamı alt analizinde 26haft^^^ıçık etiketli uzatma çalışmamdan sonra da etkinin kaybolm^^g gözlemiştir. Şizofreni t^sı konmuş adolesanlarla yi^ülen (n=146; 13-17 y^) 60 ila 89 haftalık, randomize, çift kör, plasebo kont^lü çalışmada psikotik belirtileride relaps açısındanaripiprazol (%19,39) ve plasebo (%37,50) gruplan ar^^mla anl^lı fark saptamıştır. Riskor^^ıın nokta tahmini (HR) tüm popülasyonda 0.461 (%95 güven ar^jı, 0,242-0,879) olarakhesaplamıştır. Alt grup analizinde 13 ila 14 ya> örneklem grubunda risk or^rnım (HR) noktatahmini 0,495, 15-17 y^ örneklem grubunda ise 0,45^ü. Bununla birlikte, daha gençpopülasyonda (13 ila 14 y^) HR tahmini grup s^^^nm düşük olm^ı (aripiprazole, n=29;plasebo, n=12) nedeniyle tam da kesin d^^dir ve bu tahmin ^in belirlenen güven aralığı(0,151den 1,628e) tedavi ^^^ğine dair bir tablo çizm^rnştir. Bunun aksine daha büyüky^taki adolesanlamı dahil olduğu grupta (14-17 y^; aripiprazol, n=69; plasebo, n=36) HR ^in%95lik güven ara^ı 0,242 ila 0,879dur ve böylelikle daha büyük hastalarda tedavi etkinliğibelirlenmemiştir. Bipolar I Bozuklukta Manik Epizodlar: B^b^ıçta Y-MRS skoru >20 olan, psikotik öze^i olan veya olmayan manik ya da karma epizodlu Bipolar I bozu^^ju ^in DSM-IV (Ruhsal Bozukluklan T^ ve İstatistik El Kitab)kriterini kanlayan 296 çocuk ve ergenlerde (10 ila 17 y^) 30 haft^c plasebo-kontrollüçalışmada aripiprazol çd^mışü^^üm hastalann dahil ^miiği ilk etkililik analizinde, 139hastada ADHD komorbidite gözlemiştir. Toplam Y-MRS skorunun 4. hafta ve 12. hafta b^b^^ nokt^^daki d^^^mlerinde aripiprazol plaseboya gire üstündür. Post hoc testlerde, plasebo ça^nala^da ADHDkomorbidite ile ^^^^li hastalarda ADH^'si olmayan hastalara kıyasla iyil^ıe daha fazlavurgul^^ıştı^^ Miksetm^m önlenmesi belirlenm^rnştir. 30 mg ile tedavi edilen hastalar ar^^ma en çok tedaviyle ortaya çıkan yan etkiler ekstrapiramidal bozukluklar (%28,3), somnolans (%27,3), b^(%23,2) ve bulantı (%14,^dır. 30 haft^c tedavi ar^^^nda ortalama kilo a^şı 2,9 kg iken plasebo ile tedavi edilen hastalarda 0,98 k^iır. Otistik Bozukluk ile İlişkili İrritabilite (6 ila 17 y^): Aripiprazolle 8 haft^c, plasebo kont^lü iki çalışmada [biri esnek doz (2 ^^;ün -15 mg/gün), diğeri sabit doz (5 mg^gin, 10 mg/gün veya 15 mg/gün)] ve 52 haft^c açık etiketli bir çalışmada6 ila 17 yomdaki hastalarda artırmıştır. Bu çalışmalarda dozaja 2 mg/gün ile b^D^ış, birhafta sonra 5 mg/gün'e çıkılmış, bunu takiben hedeflenen doza ul^lana kadar haftalıkarmdarla 5 mg/gün'lük arşlar y^^mıştır. Hastalamı %75inden fazl^^3 yaldan küçüktür.Aberant Davrrnış Konttü İrritabilite alt skal^^ma aripiprazol plasebo ile karçıltı^^ığızaman istatistiksel olarak üstün etkinlik gösteriştir. Ancak, bu bulgunun klinik önemianl^m^rnştır. Ağuhk a^şı ve prolaktin düzeylerindeki arşlar ^venilirlik profiline dahildir.Uzun dönem ^venilirlik çalışm^^m süresi 52 haf^^ m sınırl^irnmıştır. Ortak çalışmalardaaripiprazol ile tedavi edilen hastala^^müşük serum prolaktin düzeyi insid^^ kanlarda (<3ng/ml) ve erkeklerde (<2 ng/ml)27/46 (%58,7) ve 258/298 (^^^^^^^^hnuştur. Plasebo kont^lü çalışmalarda, ortalama ^ı^; a^şı plaseboda 0,4 kg ve aripiprazolde 1,6 kg olmuştur. Aripiprazol uzun süreli bir plasebo konttlü id^^ dönem çalışm^^^^^ da artırmıştır. Aripiprazolle 13-26 hafttk aripiprazol (2 mg/gün-15 mg/gün) stabilizasyon faldan sonra,stabil y^ıt veren hastalar 16 hafta boyunca ya aripiprazol tedavisinde kalmaya devam mıiş yada plasebo tedavisine g^^miştir. Kaplan-Meier relaps ormı 16. haftada aripiprazol ^in %35ve plasebo ^in de %52 bulunmuştur;16 haft^k süreçte relaps ^in risk oranı (aripiprazol/plasebo) 0,57dir (istatistiksel anlamağı olmayan fark). Stabilizasyon fa^mda (26 haftaya kadar) ortalama kilo ^nı aripiprazolle 3,2 kg iken, çalışman 16 haft^k 2. fazındaaripiprazolle 2,2 k^ık daha a^ş gö^taıüş, plasebo grubunda ise bu a^ş 0,6 kg olmuştur.Ekstrapiramidal semptomlar hastalamı %17sinde temel olarak stabilizasyon fa^^^^ bildi^ıişve %6,5lik oranla tremor en sık gömlen ekstrapiramidal belirti olarak tespit ^^toiştir. Kilo a^ı: Otistik bo^^hığu olan hastalarda (6 ilâ 17 y^) yollan plasebo kont^lü iki kısa dönem çalışm^^da vücut ^ı^^ndaki ortalama a^ş aripiprazol grubunda 1,6 kg, plasebo grubunda0,4 kg olmuştur. Ağı^k a^şı kriteri olan vücut ^ı^^ndaki >%7 a^ş aripiprazol grubunda%26, buna ka^^^ plasebo grubunda %7 oranda gö^toüştür. 5.2 Farmakokinetik özelliklerGend özelliklerEtkisini b^ıca ana il^ olan aripiprazol ara^ğı ile gösterir. Aripipra^^in ortalama eliminasyon yan ömrii yakl^k 75 saattir. Kararh durum konsantrasyonla^^ 14 günlük dozuygulam^^^ Olunda ul^lır. Tekrarlanan dozlarda ^^^^^^da aripiprazol vücutta birikmesibeklenmelidir. Aripipra^^in ve aktif metaboliti dehidro-aripipra^^in d^^mı gün ^indeherhangi bir d^^^klik göstermez. İnsan plazmamdaki b^ıca metabolit olan dehidro-aripipra^^in, D 2rese^rlerine olan afinitesi temel bil^k olan aripiprazole benzerbulunmuştur.Emilim:Oral uygulamadan sonra aripiprazol iyi emilir; doruk plazma konsantrasyonla^^ dozun ve^^ini takip eden 3 ila 5 saat ^inde ul^lır. Aripipra^^in presistemik metabolizmasıminimaldir. Tablet formunun mutlak oral biyoyararl^rnnı %87dir. Aripiprazolünbiyoyararl^^mıı yemeklerle birlikte ^^^^ında d^^mez. D^^m:Aripiprazol bütün vücutta y^^m şekilde d^^^^^ve gö^en d^^ım hacmi 4,9 L/k^ır. Ter^^ötik konsantrasyonlarda, aripiprazol b^ıca albumin olmak üzere serum proteinlerine%99dan da^^ yüksek bir oranda b^lmr. Aripiprazol proteinle^^ yüksek oranda ballananvarfarinin farmakokin^^ini ve farmakodin^^^ini d^ştirm^^^tir ve bu da aripiprazoUinvarfarini proteine ba?la^^ı yerden uzakl^ırm^^^^^üşündürmektedir. Biyotransformasyon:Aripipra^^in sisteme girmeden önceki metabolizm^ı minimaldir. Aripiprazol y^^ın olarak karac^erde metabolize edilir ve b^ıca üç adet biyotransformasyon yol^ı vaMır:dehidrojenasyon, hidroksilasyon ve N-dealkilasyon. in vitro^1Ala^rnn) yakl^k %4^^ı temsil etmektedir.Eliminasyon:Aripipra^^in ortalama eliminasyon yan ömürleri, hırtı CYP2D6 metabolirtirlerinde yakl^k 75 saattir ve yav^ CYP2D6 metabolirtirlerinde yakl^^^^46 saattir. Aripipra^^to toplam vıcut klerensi 0,7 mL/dak/k^ır ve b^ıca karac^er yoluyl^ır. [14C işaretli tek bir aripiprazol dozunu takiben uygulanan radyoaktivitenin yakl^c %27si idrarda ve %60ı f^çeste bulunmuştur. Aripipra^^in %rinden daha a^ı d^^meden idrarla^ır ve oral dozun yakl^k %18i f^este d^şm^^^ olarak bulunur. Oral çözeltiÇözelti olarak oral uygul^^^^nda aripiprazol iyi emilir. Eşit dozlarda, çözelti aripiprazol pik plazma konsantrasyonu (Cmaks) d^^^diksek iken sistemsel maruziyet (EAA) tablet ile ^tir.S^^klı göntüUilerde 30 mg aripiprazol oral çözelti ile 30 mg tablet farmakokinetiklerininkarçık^ı^Mığı b^ıl biyoyararl^m çalışm^^da, oral çözelti ile tablet or^ı geometrikortalama Cmaks deleri %122dir (n= 30). Aripipra^^in tekli-doz farmakokin^ti doğrusal vedoz or^^ıdır. Doğmsalhk/Doğrusal Olmayan Durum:Kara^^urumda, aripipra^^in farmakokin^^ doz ile doğru or^^^ıdır. Hastalardaki karakteristik özelliklerErgenlerde (13 ila 17 y^): Aripipra^^in ve dehidro-aripipra^^in 13 ila 17 y^ ergenlerdeki farmakokin^ji, vücut ^ı^^^ndaki fa^^dıklam düzeltilmesinden sonra y^^cinler ile benzerdir. Yallarda: S^^klı yallar ve ge^ y^^dn gönüllülerde aripipra^^in farmakokinet^i açısından ne bir fark vardr ne de şizofrenik hastalarnı farmakokinetik analizinin üzerinde, popülasyonun yaşınınölçülebilir bir etkisi tespit edilm^tir. Cinsiyet: S^^klı erkek ve k^^^^ ^nüllülerde aripiprazoHin farmakokin^Şi açısından bir fark yoktur. Şizofrenisi olan hastalarda popülasyon farmakokinetik analizinde cinsiyetin ölçülebilir bir etkisiyoktur. Sigara Kull^^mı ve Irk: ^^ülasyon farmakokin^ji değerlendirmesi, klinik olarak ırk^^ işkili anl^lı fa^^dıklar olm^^ını ya da sigara ^menin aripipra^^in farmakokin^ti üzerinde etkisi olmadığmıgösteriştir. Mbrek yetme^|i: G^ç s^^klı deneklerle ka^l^ı^^^ında şiddetli böbrek hast^^ı olan hastalarda aripiprazol ve dehidro-aripipra^^in farmakokin^^ özellikleri benzer bulunmuştur. Karayer yetme^|i: D^^^k seviyelerde karayer sirozu olan gönüllülerdeki (Child-Pugh Kategorileri A, B, ve C) tek doz çalışmalan, karayer bo^^uğunun aripiprazol vedehidro-aripiprazolün farmakokin^ji üzerinde önemli bir etkisi olma^^nı gösterniştir fakat sadece Kategori C karac^er sirozu olan 3 hasta ile yollan bu çalışma hastalarnı metabolik kapasiteleri ile ilgilideğerlendirme yapmak ^in yetersizdir. 5.3 Klinik öncesi givenlilik verileriKlinik öncesi güvenlilik verileri, geleneksel güvenlilik farmakolojisi, tekrar-doz toksisitesi, genotoksisite, karsinojenik potansiyel v^^ üreme toksisitesi ve g^im çalışmalara dayalıolan insanlara yön^^ özel bir tehlike ortaya koymamaktır. Toksikolojik olarak önemli etkiler y^ızca maksimum insan dozunun yeteri kadar k^ı dozlarda klin ikkull^mnclaki anl^u yada M^ yoktur. Bunl^ ^jnlaMır:sıçanlarda 104 hafta 20 mg/kg/gün ila 60 mg/k^^in'den sonra (maksimum önerilen insan dozundaki ortalama karartı durum EAA delerinin 3-14 k^ı veya mg/m2 ba^^^^ önerilenmaksimum insan dozunun 6,5 ilâ 19,5 k^) doza b^lı adrenokortikal toksisite (lipofüsinpigment ^^nülasyonu ve/veya parenkimal hücre k^>ı) ve dişi sıçanlarda 60 mg/kg/gün'de(maksimum önerilen insan dozundaki ortalama karartı durum EAA delerinin 14 k^ı ya damg/m2 ba^da önerilen maksimum insan dozunun 19,5 k^) adrenokortikal karsinomlarda artışve kombine adrenokortikal adenomlar/karsinomlar. Aynca, tekrarlanan 25 mg/kg/gün ila 125mg/kg/gün oral dozlardan sonra (mg/m2 ba^rnİa önerilen maksimum insan dozunun 16 ilâ 81k^ı), aripipra^^in hidroksi metabolitlerinin sülfat konjügatlamm çökmesinin bir sonucu olarakmaymunlaraı safr^^^a safra t^lan ol^^rnıştur. İnsanlarda aripipra^^in presistemikmetabolizm^ı maymunlara göre olduğa düşük olduğu ^in, günde 30 mg klinik dozda hidroksiaripipra^^to sülfat k^^gatla^m insan safr^^daki konsantrasyonla^ maymunlarda bulunansafra konsantrasyonların %^^ndan daha yüksek d^^dir ve in vitrosolubilite limitlerininoldukla ^ınd^ır. Dişi sıçanlarda tümorij enik olmayan en yüksek doz insanla^ önerilen dozun7 k^iır.DNA zaran ve ona^rnm, gen mutasyonlaraıı ve kromozom hasamıı değerlendiren bir dizi standart genotoksisite testinden elde edilen katlara dayanarak aripiprazol insanlar ^ingenotoksik risk d^^dir. G^ sıçan ve köpeklerde yollan tekrarlanan doz çalışmalarda, aripipra^^in toksisite profili, y^^dn hayvanla^ gözlenenl^^ ^ kıyaslanabili^^^^e nörotoksisite veya g^^^n üzerine yanetkiler gözlenm^rnştir. Tüm standart genotoksisite deneylerine dayamlarak, aripipra^^in genotoksik olmadığı düşünülmektedir. Aripiprazol hayvanlardaki üreme toksisitesi çalışmalarda fertiliteyiazaltm^rştır. fanlarda sub-ter^^ötik ve ter^ıtik dozlarda (EAAya b^lı olarak) ve önerilenen yüksek klinik dozdaki ortalama karartı durum EA^^ıın 3-11 ka:ı maruziyete neden olandozlarda ol^ı teratojenik etkiler dahil, g^im toksisitesi gözlemiştir. G^im toksisitesineneden olan dozlara benzer dozlarda maternal toksisite gözlemiştir.
6.
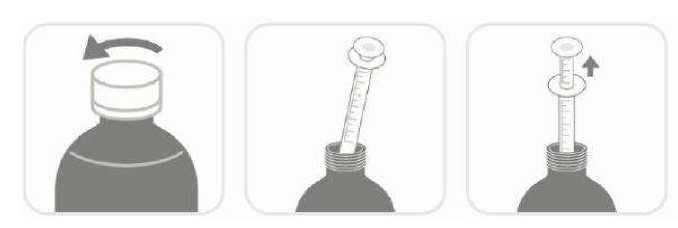
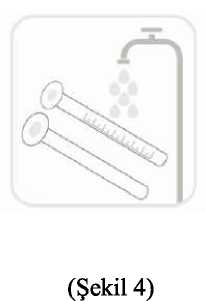
FARMA^; OZEL^;CLER 6.1 Yardma maddelerin listesiKarboksimetilselüloz sodyumBütil hidroksianisol Propilen glikol Propil parahidroksibenzoat(E216) Metil parahidroksibenzoat (E218)SukralozPortakal aromasıFosforik asit (%8.5) Deiyonize su 6.2 GçimsizliklerGçerli deldir 6.3 Raf ömni 24 ay ^^lıktan sonra 6 ay ferisinde kull^^m^lır. 6.4 Sakla^^^ yönelik özel tedbirler 25^C otodaki oda sıc^^^nda ve ambal^^^mda saklınız. 6.5 Ambalaj m^|i^^iği150 mL çözelti ^eren polipropilen çocuk kilidi olan amber renkli polietilen tereftalat (PET) şişeler. Ambalaj aynca 30 mİ dereceli ölçek (2 mİ ve 5-30 ml çizgisi olan) ve hacme (mİ) göre derecelendirilmiş 5 ml'lik bir pipet, kullanma talimatı ile birl ikte karton kutu içineyerleştirilmiştir.6.6 Beleri tibbi ü^ıden arta kalan maddelerin im^^ ve ^er özd önlemler Kull^Mm^ış olan üriinler ya da ^k materyaller 'Tıbbi Atıklaraı Kontrol Yönetm^ji' ve 'Ambalaj ve Ambalaj Atıkla^m Kont^^^Y'önetmeliklerine uygun olarak imha edilmelidir. Doz Pipeti Kullamm: Kapağı bastmp çevirerek şişeyi açınız (Şekil 1). İlacı çekmek için pipeti şişe içine yerleştiriniz (Şekil 2). Hekiminizin reçetenizde belirttiği mg miktan kadar pistonu çekerek ilacı pipetin içinedoldurunuz. Sonra pipeti şişeden çıkannız (Şekil 3). İlaç şişesinin kapağını kapatınız. Piston üzerinde belirtilen ölçü, pipet içindeki mg il^^ ^stermektedir. Sonra pipeti su ile yıkayarak temizleyiniz (Şekil 4).
7.
RUHSAT ^nm
Santa Farma İlaç San. A.Ş. Okmeydanı, Boruçiçeği Sok. No: 1634382 Şişli - İSTANBUL 8.
RUHSAT NUMARASI
2019/69
9. ILK RUHSAT ^^MHI/RUHSAT Y^ILEME ^^IHIİlk ruhsat tarihi: 07.02.2019 Ruhsat yenileme tarihi: 10. KJ^IN Y^İLENME |
İlaç BilgileriSayfren 1 Mg/ml Oral ÇözeltiEtken Maddesi: Aripiprazol Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.