Opsumit 10 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ¡BU ILAÇ EK IZLEMEYE TABIDIR. BU ÜÇGEN YENI GÜVENLILIK BILGISININ HıZLı OLARAK BELIRLENMESINI SAĞLAYACAKTıR. SAĞLıK MESLEĞI MENSUPLARıNıN ŞÜPHELI ADVERS REAKSIYONLARı TÜFAM'ABILDIRMELERI BEKLENMEKTEDIR. BAKıNıZ BÖLÜM 4.8 ADVERS REAKSIYONLAR NASıL RAPORLANıR?1. BEŞERİ TIBBİ ÜRÜNÜN ADIOPSUMİT 10 mg film kaplı tablet. 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her film kaplı tablet 10 mg masitentan içerir. Yardımcı maddeler:Her film kaplı tablet, Laktoz (monohidrat olarak) (sığır kaynaklı) _ 37 mg Lesitin (soya) (E322).............................. 0,06 mg içerir. Yardımcı maddelerin tam listesi için bölüm 6.1'e bakınız. 3. FARMASÖTİKFORMFilm kaplı tablet.Her iki tarafı "10" oymalı, 5,5 mm, yuvarlak, bikonveks, beyaz ile soluk beyaz arası tablet. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarOPSUMİT, monoterapi veya kombinasyon halinde, WHO Fonksiyonel Sınıfı (FS) II veya III olan pulmoner arteriyel hipertansiyonlu (PAH, WHO Grup 1) yetişkin hastaların uzunsüreli tedavisinde endikedir. Etkililiğin gösterildiği uzun süreli PAH çalışmasına, ağırlıklı olarak idiyopatik ve kalıtsal PAH, bağ doku hastalıkları ile ilişkili PAH ve düzeltilmiş basit konjenital kalp hastalığıile ilişkili PAH hastaları dahil edilmiştir (bkz. Bölüm 5.1). 4.2 Pozoloji ve uygulama şekliTedavi yalnızca PAH tedavisinde deneyimli bir doktor tarafından başlatılmalı ve izlenmelidir. Pozoloji /uygulama sıklığı ve süresi:OPSUMİT, yemekle birlikte veya yemekten bağımsız olarak günde bir kez 10 mg dozunda oral yolla alınır. OPSUMİT her gün yaklaşık olarak aynı zamanda alınmalıdır. Hastaya, bir OPSUMİT dozunu almayı unutursa, mümkün olan en kısa sürede alması ve sonraki dozu normal zamanındaalması söylenmelidir. Hastaya, bir doz unutulsa bile aynı anda iki doz almamasıhatırlatılmalıdır. Uygulama şekli:Film kaplı tabletler kırılmamalı ve bütün halinde suyla birlikte yutulmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Farmakokinetik verilere dayalı olarak, böbrek yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Masitentanın şiddetli böbrek yetmezliği olan PAH hastalarında kullanımınailişkin klinik deneyim yoktur. Diyalize giren hastalarda OPSUMİT kullanımıönerilmemektedir (bkz. Bölüm 4.4 ve 5.2). Karaciğer yetmezliği:Farmakokinetik verilere dayalı olarak, hafif, orta derece veya şiddetli karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 4.4 ve 5.2). Ancak, masitentanınorta derece veya şiddetli karaciğer yetmezliği olan PAH hastalarında kullanımına ilişkinklinik deneyim yoktur. OPSUMİT şiddetli karaciğer yetmezliği veya klinik olarak anlamlıölçüde yüksek hepatik aminotransferaz düzeyleri (Normalin Üst Sınırının (NÜS) 3 katındanfazla (> 3 x NÜS); bkz. Bölüm 4.3 ve 4.4) olan hastalarda başlatılmamalıdır. Pediyatrik popülasyon:Masitentanın çocuklardaki güvenliliği ve etkililiği henüz belirlenmemiştir. Bu sebeple 18 yaş altındaki çocuklarda kullanılmamalıdır. Geriyatrik popülasyon:65 yaş üzeri hastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). 4.3 Kontrendikasyonlar Etkin madde veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşıaşırı duyarlılık. Gebelik (bkz. Bölüm 4.6). Güvenilir bir doğum kontrol yöntemi kullanmayan çocuk doğurma potansiyeli olankadınlar (bkz. Bölüm 4.4 ve 4.6). Emzirme (bkz. Bölüm 4.6). Şiddetli karaciğer yetmezliği olan hastalar (siroz ile birlikte veya siroz olmadan) (bkz.Bölüm 4.2). Hepatik aminotransferaz başlangıç değerleri (> 3 x NÜS değerinde aspartataminotransferaz (AST) ve/veya alanin aminotransferaz (ALT) (bkz. Bölüm 4.2 ve 4.4). OPSUMİT soyadan elde edilen lesitin içerir. Fıstık ya da soyaya alerji durumunda kullanılmamalıdır. 4.4 Özel kullanım uyarıları ve önlemleriWHO Fonksiyonel Sınıfı (FS) I olan pulmoner arteriyel hipertansiyon hastalarında masitentanın fayda/risk dengesi belirlenmemiştir. Karaciğer fonksiyonuKaraciğer aminotransferazlarındaki (AST, ALT) artışlar, PAH ve endotelin reseptör antagonistleri (ERA) ile ilişkilendirilmiştir. OPSUMİT şiddetli karaciğer yetmezliği veyaartmış aminotransferaz düzeyleri (> 3 x NÜS) (bkz. Bölüm 4.2 ve 4.3) olan hastalardabaşlatılmamalıdır ve orta derece karaciğer yetmezliği olan hastalarda önerilmemektedir.OPSUMİT başlatılmadan önce karaciğer enzim testleri yapılmalıdır. Hastalar karaciğer hasarı belirtileri açısından izlenmelidir ve aylık ALT ve AST izlenmesi önerilmektedir. Uzun süren, açıklanamayan, klinik olarak ilgili aminotransferaz artışlarımeydana gelirse veya bu artışlar bilirubin düzeyinde >2 x NÜS artışla veya klinik karaciğerhasarı semptomlarıyla (ör. sarılık) birlikte izlenirse OPSUMİT tedavisi sonlandırılmalıdır. Karaciğer hasarına ilişkin klinik semptomları olmayan hastalarda karaciğer enzim düzeyleri normal aralığa geri döndükten sonra OPSUMİT tedavisinin yenidenbaşlatılması düşünülebilir. Bir hepatoloğa danışılması önerilmektedir. Hemoglobin konsantrasyonuDiğer ERA'larda olduğu gibi, masitentan tedavisi de hemoglobin konsantrasyonunda düşüş ile ilişkilendirilmiştir (bkz. Bölüm 4.8). Plasebo kontrollü çalışmalarda, hemoglobinkonsantrasyonunda masitentana bağlı düşüşler progresif olmayıp, tedavinin ilk 4-12haftasından sonra stabilize olmuş ve kronik tedavi boyunca stabil kalmıştır. Masitentanve diğer ERA'lar ile kan hücresi transfüzyonu gerektiren anemi vakaları bildirilmiştir.Şiddetli anemisi olan hastalarda OPSUMİT'in başlatılması önerilmemektedir. Tedavibaşlatılmadan önce hemoglobin konsantrasyonlarının ölçülmesi ve tedavi sırasında klinikolarak endike olduğunda testlerin tekrarlanması önerilmektedir. Pulmoner veno-oklüzif hastalıkVazodilatörlerin (ağırlıklı olarak prostasiklinler) pulmoner veno-oklüzif hastalığı olan hastalarda kullanılması sonucunda pulmoner ödem vakaları bildirilmiştir. Sonuç olarak,masitentan PAH hastalarına uygulanırken pulmoner ödem belirtileri meydana gelirsepulmoner veno-oklüzif hastalık olasılığı değerlendirilmelidir. Çocuk doğurma potansiyeli olan kadınlarda kullanımÇocuk doğurma potansiyeli olan kadınlarda OPSUMİT tedavisi yalnızca gebelik olmadığı doğrulandıktan, doğum kontrolüne ilişkin uygun öneri verildikten ve güvenilir bir doğumkontrol yöntemi uygulandıktan sonra başlatılmalıdır (bkz. Bölüm 4.3 ve 4.6). Kadınlar,OPSUMİT tedavisi sonlandırıldıktan sonra 1 ay boyunca gebe kalmamalıdır. Gebeliğinerken tespit edilmesi için OPSUMİT tedavisi sırasında her ay gebelik testi yapılmasıönerilmektedir. Güçlü CYP3A4 indükleyicileri ile eş zamanlı kullanımGüçlü CYP3A4 indükleyicilerinin varlığında masitentanın etkililiğinde azalma söz konusu olabilir. Masitentan ile güçlü CYP3A4 indükleyicilerinin (ör. rifampisin, sarı Güçlü CYP3A4 inhibitörleri ile eş zamanlı kullanımMasitentan güçlü CYP3A4 inhibitörleri (ör. itrakonazol, ketokonazol, vorikonazol, klaritromisin, telitromisin, nefazodon, ritonavir ve sakinavir) ile birlikte uygulandığındadikkatli olunmalıdır (bkz. Bölüm 4.5). Orta dereceli ikili veya kombine CYP3A4 ve CYP2C9 inhibitörleri ile eş zamanlı kullanımMasitentan orta dereceli ikili CYP3A4 ve CYP2C9 inhibitörleri (ör. flukonazol ve amiodaron) ile birlikte uygulandığında dikkatli olunmalıdır (bkz. Bölüm 4.5). Masitentan orta dereceli CYP3A4 inhibitörü (ör. siprofloksasin, siklosporin, diltiazem, eritromisin, verapamil) ve orta dereceli CYP2C9 inhibitörü (ör. mikonazol, piperin) ilebirlikte uygulandığında da dikkatli olunmalıdır (bkz. Bölüm 4.5). Böbrek yetmezliği olan hastalarBöbrek yetmezliği olan hastaların masitentan tedavisi sırasında hipotansiyon ve anemi yaşama riski yüksek olabilir. Bu nedenle, kan basıncı ve hemoglobin izlemesidüşünülmelidir. Masitentanın şiddetli böbrek yetmezliği olan PAH hastalarındakullanımına ilişkin klinik deneyim yoktur. Bu popülasyonda dikkatli olunmasıönerilmektedir. Masitentanın diyalize giren hastalarda kullanımına ilişkin deneyim yoktur,bu nedenle OPSUMİT bu popülasyonda önerilmemektedir (bkz. Bölüm 4.2 ve 5.2). Yardımcı maddelerOPSUMİT tablet laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacıkullanmamaları gerekir. OPSUMİT tablet soyadan elde edilen lesitin içerir. Soyaya aşırı duyarlılığı olan hastalar OPSUMİT kullanmamalıdır (bkz. Bölüm 4.3). 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriİn vitroçalışmalarSitokrom P450 CYP3A4 enzimi, CYP2C8, CYP2C9 ve CYP2C19 enzimlerinin minör katkısı ile masitentan metabolizmasında ve aktif metabolitinin oluşumunda rol oynayanana enzimdir (bkz. Bölüm 5.2). Masitentan ve aktif metabolitinin sitokrom P450 enzimleriüzerinde klinik olarak ilişkili inhibe edici veya indükleyici etkisi yoktur. Masitentan ve aktif metaboliti, organik anyon taşıyıcı polipeptitler de dahil olmak üzere (OATP1B1 ve OATP1B3), klinik olarak uygulanan konsantrasyonlarda karaciğer veyaböbrek alım taşıyıcılarının inhibitörleri değildir. Masitentan ve aktif metaboliti, OATP1B1ve OATP1B3'ün ilgili substratları olmamakla birlikte, pasif difüzyonla karaciğere girer. Masitentan ve aktif metaboliti, çoklu ilaç direnci proteini (P-gp, MDR-1) ve çoklu ilaç ve toksin ekstrüzyon taşıyıcıları da (MATE1 ve MATE2-K) dahil olmak üzere, klinikolarak ilgili konsantrasyonlarda karaciğer veya böbrek akış pompalarının inhibitörlerideğildir. Masitentan, P-gp/MDR-1'in substratı değildir. Masitentan ve aktif metaboliti, klinik olarak ilgili konsantrasyonlarda, karaciğer safra tuzu transportunda yer alan proteinlerle, yani safra tuzu eksport pompası (BSEP) vesodyuma bağlı taurokolat kotransport polipeptidi (NTCP) ile etkileşime girmez. İn vivoçalışmalarYalnızca yetişkinlerde etkileşim çalışmaları gerçekleştirilmiştir. Flukonazol:PBPK modeline göre, günlük 400 mg flukonazol (orta dereceli ikili CYP3A4 ve CYP2C9 inhibitörü) varlığında masitentana maruziyet yaklaşık 3,8 kat artabilir. Ancakmasitentanın aktif metabolitine maruziyette klinik olarak anlamlı değişiklik gözlenmemiştir.Bu tür bir modelin belirsizlikleri göz önünde bulundurulmalıdır. Masitentan orta dereceliikili CYP3A4 ve CYP2C9 inhibitörleri (ör. flukonazol ve amiodaron) ile birlikteuygulandığında dikkatli olunmalıdır (bkz. Bölüm 4.4).Masitentan orta dereceli CYP3A4 inhibitörü (ör. siprofloksasin, siklosporin, diltiazem, eritromisin, verapamil) ve orta dereceli CYP2C9 inhibitörü (ör. mikonazol, piperin) ilebirlikte uygulandığında da dikkatli olunmalıdır (bkz. Bölüm 4.4). Varfarin:Günde bir kez 10 mg'lık çoklu dozlar halinde verilen masitentanın, 25 mg'lık tek varfarin dozundan sonra S-varfarin (CYP2C9 substratı) veya R-varfarine (CYP3A4 substratı)maruziyet üzerinde etkisi olmamıştır. Masitentan, varfarinin Uluslararası NormalizeEdilmiş Oran (INR) üzerindeki farmakodinamik etkisini etkilememiştir. Varfarin,masitentan ve aktif metabolitinin farmakokinetiklerini etkilememiştir. Sildenafil:Günde bir kez 10 mg masitentan uygulaması sırasında, kararlı durumda, günde üç kez 20 mg sildenafile maruziyet %15 oranında artmıştır. Bir CYP3A4 substratı olan sildenafilmasitentanın farmakokinetiklerini etkilemezken, masitentanın aktif metabolitinemaruziyette %15 oranında azalma meydana gelmiştir. Bu değişiklikler klinik olarak anlamlıkabul edilmemektedir. PAH hastalarıyla yapılan plasebo kontrollü bir çalışmada, sildenafilile kombinasyon halinde masitentanın etkililiği ve güvenliliği kanıtlanmıştır. Ketokonazol:Güçlü bir CYP3A4 inhibitörü olan ketokonazolun günde bir kez 400 mg dozunda uygulanması, masitentana maruziyetini yaklaşık 2 kat artırmıştır. Günde iki kez 200 mgketokonazol uygulamasında, fizyolojik tabanlı farmakokinetik (PBPK) modellemekullanılarak tahmin edilen artış yaklaşık olarak 3 kattır. Bu modellemedeki belirsizliklerdikkate alınmalıdır. Masitentanın aktif metabolitine maruziyet %26 oranında azalmıştır.Masitentan güçlü CYP3A4 inhibitörleri ile birlikte uygulandığında dikkatli olunmalıdır(bkz. Bölüm 4.4). Siklosporin A:Kombine CYP3A4 ve OATP inhibitörü olan siklosporin A (günde iki kez 100 mg) ile eş zamanlı tedavi, masitentan ve aktif metabolitine kararlı durumda maruziyeti klinikolarak anlamlı ölçüde değiştirmemiştir. Güçlü CYP3A4 indükleyicileri:Güçlü bir CYP3A4 indükleyicisi olan rifampisin (günde bir kez 600 mg) ile eş zamanlı tedavi, masitentana kararlı durumda maruziyeti %79 oranında azaltırken, aktif metabolitemaruziyeti etkilememiştir. Rifampisin gibi güçlü bir CYP3A4 indükleyicisinin varlığındamasitentanın etkililiğinin azaldığı dikkate alınmalıdır. Masitentan ile güçlü CYP3A4indükleyicilerinin kombinasyonundan kaçınılmalıdır (bkz. Bölüm 4.4). Meme kanseri direnç proteini (BCRP) substrat ilaçları:Günde bir kez 10 mg masitentan bir BCRP substrat ilacının farmakokinetiğini (1 mg riosiguat; 10 mg rosuvastatin)etkilememiştir.Hormonal kontraseptifler:Özel popülasyonlara ilişkin ek bilgilerPediyatrik popülasyon:Etkileşim çalışmaları yalnızca yetişkinlerde gerçekleştirilmiştir. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: X Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadınlarda OPSUMİT tedavisi yalnızca gebelik olmadığı doğrulandıktan, doğum kontrolüne ilişkin uygun öneri verildikten ve güvenilir bir doğumkontrol yöntemi uygulandıktan sonra başlatılmalıdır (bkz. Bölüm 4.3 ve 4.4). Kadınlar,OPSUMİT tedavisi sonlandırıldıktan sonra 1 ay boyunca gebe kalmamalıdır. Gebeliğinerken tespit edilmesi için OPSUMİT tedavisi sırasında her ay gebelik testi yapılmasıönerilmektedir. Gebelik dönemiMasitentanın gebe kadınlarda kullanımına ilişkin veri yoktur. Klinik olmayan verilere göre, masitentanın gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarınayol açtığından şüphelenilmektedir. Hayvan çalışmaları üreme toksisitesi göstermiştir(bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk halen bilinmemektedir. OPSUMİTgebelik sırasında ve güvenilir bir doğum kontrol yöntemi kullanmayan çocuk doğurmapotansiyeli olan kadınlarda kontrendikedir (bkz. Bölüm 4.3). Çocuk doğurma potansiyeliolan kadınlar tedavi süresince (ve tedavinin ardından 1 aya kadar) etkili doğum kontrolüuygulamak zorundadırlar. Laktasyon dönemiMasitentanın anne sütüne geçip geçmediği bilinmemektedir. Sıçanlarda, masitentan ve metabolitleri emzirme sırasında süte geçmektedir (bkz. Bölüm 5.3). Emzirilen çocuğayönelik risk göz ardı edilemez. OPSUMİT emzirme sırasında kontrendikedir (bkz. Bölüm4.3). Üreme yeteneği/FertiliteMasitentan tedavisinden sonra erkek hayvanlarda testiküler tübüler atrofi gelişimi gözlemlenmiştir (bkz. Bölüm 5.3). ERA alan hastalarda sperm sayısında azalmalargözlenmiştir. Masitentan, diğer ERA'lar gibi, erkeklerde spermatogenez üzerindeolumsuz bir etkiye sahip olabilir. 4.7 Araç ve makine kullanımı üzerindeki etkilerMasitentanın araç ve makine kullanma yeteneği üzerinde hafif etkisi olabilir. Hastanın araç ve makine kullanma yeteneği değerlendirilirken, hastanın klinik durumu ve masitentanınadvers reaksiyon profili (baş ağrısı, hipotansiyon gibi) göz önünde bulundurulmalıdır (bkz.Bölüm 4.8). 4.8 İstenmeyen etkilerGüvenlilik profili özetiEn sık bildirilen advers ilaç reaksiyonları nazofarenjit (%14), baş ağrısı (%13,6) ve anemidir (%13,2, bkz. Bölüm 4.4). Advers reaksiyonların büyük kısmı hafif ile orta şiddettedir. Advers reaksiyonların tablo halinde listesiMasitentanın güvenliliği semptomatik PAH'ı olan 742 hastayı içeren uzun süreli, plasebo kontrollü bir çalışmada değerlendirilmiştir (SERAPHIN çalışması). Ortalama tedavi süresimasitentan 10 mg grubunda 103,9 hafta ve plasebo grubunda 85,3 haftadır. Bu klinikçalışmada masitentan ile ilişkili olarak gözlemlenen advers reaksiyonlar aşağıdaki tablodaverilmektedir. Pazarlama sonrası advers reaksiyonlar da dahil edilmektedir. Aşağıdaki terminolojik terimler istenmeyen etkilerin oluşumunu sınıflandırmak için kullanılmıştır: Çok yaygın (1/10); yaygın (1/100 ila <1/10); yaygın olmayan (1/1.000 ila <1/100); seyrek (1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor).
Çok yaygın Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
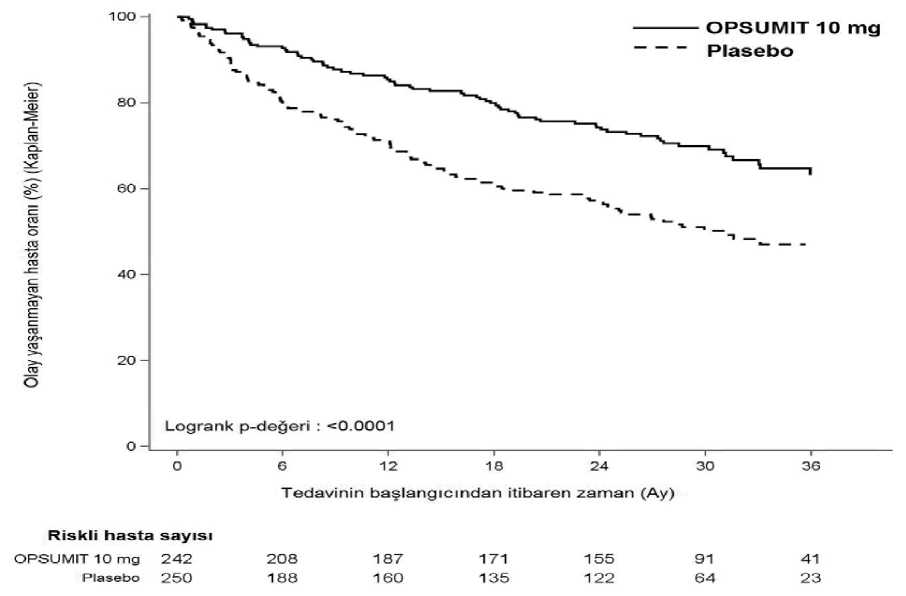
Ödem, sıvı tutulumu3 1 Veri havuzlaştırılmış plasebo-kontrollü çalışmalardan elde edilmiştir. Seçili advers reaksiyonların açıklaması2 Hipotansiyon, Masitentanın da dahil olduğu ERA kullanımıyla ilişkilendirilmektedir. PAHhastalarıyla yapılan uzun süreli, çift kör bir çalışmada, hipotansiyon masitentan 10 mgve plasebo verilen hastaların sırasıyla %7,0 ve %4,4'ünde bildirilmiştir. Bu oranlarmasitentan 10 mg grubunda 3,5 olay/100 hasta-yıl ve plasebo grubunda 2,7 olay/100 hasta-yıl'a karşılık gelmektedir. 3 Ödem / sıvı tutulumu Masitentanın da dahil olduğu ERA kullanımıyla ilişkilendirilmektedir.PAH hastalarıyla yapılan uzun süreli, çift kör bir masitentan çalışmasında, masitentan 10 mggrubunda ve plasebo tedavi grubunda ödem insidansı sırasıyla %21,9 ve % 20,5'tir. İdiyopatikpulmoner fibroz hastalarıyla yapılan çift kör bir çalışmada, masitentan ve plasebo tedavigruplarında periferik ödem insidansı sırasıyla % 11,8 ve % 6,8'dir. Sistemik skleroz ile ilişkilidijital ülser hastalarıyla yapılan iki çift kör klinik çalışmada, periferik ödem insidansımasitentan 10 mg grubunda % 13,4 ile % 16,1 aralığında, plasebo grubunda % 6,2 ile % 4,5aralığındadır. Laboratuvar anomalileri4 Karaciğer aminotransferazlarıPAH hastalarıyla yapılan çift kör bir çalışmada, >3 x NÜS düzeyinde aminotransferaz (ALT/AST) artışı insidansı masitentan 10 mg ile %3,4 ve placebo ile %4,5 oranındagözlemlenmiştir. > 5 x NÜS düzeyindeki artışlar masitentan 10 mg grubundaki hastaların%2,5'inde meydana gelirken, plasebo grubundaki hastaların %2'sinde meydana gelmiştir. 5 HemoglobinPAH hastalarıyla yapılan çift kör bir çalışmada, masitentan 10 mg plaseboya kıyasla hemoglobinde 1 g/dL'lik ortalama azalma ile ilişkilendirilmiştir. Masitentan 10 mg ile tedaviedilen hastaların %8,7'sinde ve plasebo ile tedavi edilen hastaların %3,4'ünde hemoglobinkonsantrasyonunda başlangıca göre 10 g/dL'nin altına düşen azalma bildirilmiştir. 6 AkyuvarlarPAH hastalarıyla yapılan çift kör bir çalışmada, masitentan 10 mg ortalama lökosit sayısında başlangıca göre 0,7 x 101 2 3/L'lik azalma ile ilişkilendirilirken, plasebo ile tedavi edilenhastalarda değişiklik görülmemiştir. süreli takibi, SERAPHIN çift kör fazı sırasında yukarıda tarif edildiği gibi tutarlı bir güvenlilik profili göstermiştir. Pediyatrik popülasyon:Masitentanın çocuklarda ve 18 yaşın altındaki adölesanlarda güvenliliği henüz belirlenmemiştir. Şüpheli advers olayların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks; 0 312 218 35 99). 4.9 Doz aşımı ve tedavisiOPSUMİT, sağlıklı gönüllülere 600 mg'a kadar tekli dozlarda uygulanmıştır. Baş ağrısı, mide bulantısı ve kusmayı içeren advers reaksiyonlar gözlemlenmiştir. Aşırı dozdurumunda, gerekirse standart destekleyici önlemler alınmalıdır. Masitentanın yüksekprotein bağlanma derecesi nedeniyle, diyalizin etkili olma olasılığı düşüktür. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötikgrup: Diğer antihipertansifler, pulmoner arteriyel hipertansiyon için antihipertansifler ATC kodu: C02KX04 Etki mekanizmasıEndotelin (ET)-1 ve reseptörleri (ET AB) vazokonstriksiyon, fibroz, proliferasyon, hipertrofi ve enflamasyon gibi çeşitli etkilere aracılık eder. PAH gibi hastalıklarda lokalET sistemi yukarı regüle edilir (up-regulation) ve vasküler hipertrofi ve organ hasarındarol oynar.Masitentan hem ET ABAin vitroyaklaşık 100 katdaha seçicidir. Masitentan insan pulmoner arteriyel düz kas hücrelerinde ET reseptörleriiçin yüksek afinite ve sürekli bağlanma gösterir. Bu da vazokonstriksiyon ve düz kashücresi proliferasyonuyla sonuçlanan ikinci haberci sistemlerin endotelin aracılıaktivasyonunu önler.Klinik etkililik ve güvenlilikPulmoner Arteriyel Hipertansiyonu (PAH) olan hastalarda etkililikSemptomatik PAH'ı olan 742 hastada yürütülen çok merkezli, çift kör, plasebo kontrollü, paralel gruplu, olay güdümlü, Faz 3 sonuç çalışmasında (AC-055-302/SERAPHIN),hastalar morbidite ve mortalite üzerindeki uzun süreli etkiyi değerlendirmek üzere üçtedavi grubuna randomize edilmiştir (plasebo [N = 250], günde bir kez 3 mg [N = 250]ve 10 mg [N = 242] masitentan). Başlangıçta, kaydedilen hastaların büyük kısmına (%64), oral fosfodiesteraz inhibitörleri (%61) ve/veya inhale/oral prostanoidlerle (%6) PAH için stabil dozda spesifik bir tedaviuygulanmakta idi. Primer sonlanım noktası, çift kör tedavinin sonuna kadar ölüm, atriyal septostomi ya da akciğer nakli, intravenöz (i.v.) ya da subkütanöz (s.c.) prostanoidlere başlanması veya'diğer PAH kötüleşmesi' olarak tanımlanan ilk morbidite veya mortalite olayınınoluşumuna kadar geçen süre olarak belirlenmiştir. 'Diğer PAH kötüleşmesi' şu üçbileşenin birlikte varlığı olarak tanımlanmıştır: 6 dakika yürüme mesafesinde (6DYM)başlangıca göre en az %15 oranında sürekli azalma, ve PAH semptomlarının kötüleşmesi(WHO fonksiyonel sınıfının veya sağ kalp yetmezliğinin kötüleşmesi) ve PAH içinyeni tedavi ihtiyacı. Tüm olaylar, tedavi randomizasyonuna körleştirilen bağımsız bir kararkomitesi tarafından doğrulanmıştır. Tüm hastalar çalışmanın sonuna kadar hayati durumları açısından takip edilmiştir. Çalışma sonu, önceden belirlenen sayıda primer sonlanım noktası olayına ulaşıldığında bildirilmiştir.Tedavi sonu ile çalışma sonu arasındaki dönemde, hastalar açık etiketli masitentan 10 mgveya alternatif PAH tedavisi alabilmiştir. Medyan çift kör tedavi süresi 115 hafta olmuştur(maksimum 188 hafta masitentan tedavisi). Tüm hastaların ortalama yaşı 46 olup (aralık: 12-85 yaş; 20 hasta 18 yaş altı, 706 hasta 18-74 arası ve 16 hasta 75 yaş ve üzeri), gönüllülerin büyük kısmı beyaz ırk (%55) ve kadındır(%77). Hastaların yaklaşık %52, %46 ve %2'si sırasıyla WHO fonksiyonel sınıf II, III veIV'tedir. Çalışma popülasyonundaki en yaygın etiyoloji idiyopatik veya kalıtsal PAH olup (%57), takip eden etiyolojiler bağ doku hastalıklarına bağlı PAH (%31), düzeltilmiş basit konjenitalkalp hastalığı ile ilişkili PAH (%8) ve diğer etiyolojilerle ilişkili PAH'tır (ilaç ve toksinler[%3] ve HIV [%1]). Sonlanım noktalarıMasitentan 10 mg tedavisi, tedavi sonuna kadar kompozit morbidite-mortalite sonlanım noktasında plaseboya göre %45 oranında risk azalması sağlamıştır (tehlike oranı [HR] 0,55;%97,5 GA: 0,39 ile 0,76; logrank p < 0,0001) [Şekil 1 ve Tablo 1]. Tedavi etkisi erken ortayaçıkmış ve çalışma boyunca sürmüştür. Masitentan 10 mg'ın primer sonlanım noktası üzerindeki etkililiği, monoterapi veya başka bir PAH tedavisi ile kombinasyon durumunda, tüm WHO FS gruplarında (I/II ve III/IV) ve yaş,cinsiyet, etnik köken, coğrafi bölge, ve etiyoloji alt grupları arasında tutarlı olmuştur.
Çalışma sonuna kadar tüm nedenlere bağlı ölüm sayısı masitentan 10 mg grubunda 35 ve plasebo grubunda 44'tür (HR 0,77; %97,5 GA: 0,46 ile 1,28). Tedavi sonuna kadar PAH'a bağlı ölüm veya PAH nedeniyle hastaneye yatma riski, masitentan 10 mg (50 olay) alan hastalarda plaseboya göre (84 olay) %50 oranındaazalmıştır (HR 0,50; %97,5 GA: 0,34 ile 0,75; logrank p < 0,0001). 36 ayda, plaseboalan hastaların %44,6'sı ve masitentan 10 mg alan hastaların %29,4'ü (Mutlak Risk Azalması = %15,2) PAH nedeniyle hastaneye yatırılmış veya PAH'a bağlı bir nedenden ölmüştür. Semptomatik sonlanım noktalarıEgzersiz kapasitesi sekonder sonlanım noktası olarak değerlendirilmiştir. Masitentan 10 mg tedavisi 6. ayda 6DYM'de 22 metrelik plaseboya göre düzeltilmiş ortalama artışsağlamıştır (%97,5 GA: 3 ile 41; p = 0,0078). 6DYM'nin fonksiyonel sınıfa göredeğerlendirmesi, FS III/IV olan hastalarda başlangıçtan 6. Aya kadar 37 metrelikplaseboya göre düzeltilmiş ortalama artışla (%97,5 GA: 5 ile 69) ve FS I/II olanhastalarda 12 metrelik artışla sonuçlanmıştır (%97,5 GA: -8 ile 33). Masitentan ile eldeedilen 6DYM artışı çalışma süresince korunmuştur. Plaseboya göre 6. ayda WHO FS iyileşmesi olasılığı, masitentan 10 mg tedavisi ile %74 daha fazla bulunmuştur (risk oranı 1,74; %97,5 GA: 1,10 ile 2,74; p = 0,0063). Masitentan 10 mg, SF-36 anketiyle değerlendirildiği üzere yaşam kalitesini artırmıştır. Hemodinamik sonlanım noktalarıHemodinamik parametreler 6 aylık tedaviden sonra bir hasta alt grubunda (plasebo [N = 67], masitentan 10 mg [N = 57]) değerlendirilmiştir. Masitentan 10 mg ile tedavi edilenhastalar plaseboya göre, pulmoner vasküler dirençte medyan %36,5 (%97,5 GA: %21,7ile %49,2) azalma ve kardiyak indekste medyan 0,58 L/dk./m2 (%97,5 GA: 0,28 ile 0,93L/dk./m ) artış elde etmiştir. Uzun süreli PAH verileriSERAPHIN çalışmasının çift kör (DB) fazında masitentan 10 mg ile tedavi edilen ve 182'si açık etiketli (OL) uzatma çalışmasında (SERAPHIN OL) masitentan ile devam eden (DB/OLkohortu) 242 hastanın uzun süreli takibinde, 1, 2, 5, 7 ve 9 yılın sonunda Kaplan-Meiersağkalım tahminleri sırasıyla %95, %89, %73, %63 ve %53'tür. Medyan takip süresi 5,9yıldır. 5.2 Farmakokinetik özelliklerGenel özelliklerMasitentan ve aktif metabolitinin farmakokinetikleri ağırlıklı olarak sağlıklı gönüllülerde belgelenmiştir. PAH hastalarında masitentana maruziyet, sağlıklı gönüllülere göreyaklaşık 1,2 kat daha yüksektir. Hastalarda masitentana göre yaklaşık 5 kat daha az güçlüolan aktif metabolite maruziyet sağlıklı gönüllülere göre yaklaşık 1,3 kat daha yüksekolmuştur. Masitentanın PAH hastalarındaki farmakokinetikleri hastalığın şiddetindenetkilenmemiştir. Tekrarlı uygulamadan sonra masitentan farmakokinetikleri 30 mg'a kadar (30 mg dahil) dozla orantılıdır. Emilim Masitentanın maksimum plazma konsantrasyonlarına uygulamadan yaklaşık 8 saat sonra ulaşılır. Ardından, masitentan ve aktif metabolitinin plazma konsantrasyonları, sırasıylayaklaşık 16 saat ve 48 saatlik görünür eliminasyon yarılanma ömrü ile, yavaş yavaş azalır. Sağlıklı gönüllülerde, masitentan ve aktif metabolitine maruziyet gıda varlığında değişmemiştir, dolayısıyla masitentan yemekle birlikte veya yemekten bağımsız olarakalınabilir. DağılımMasitentan ve aktif metaboliti temelde albümin ve daha düşük ölçüde alfa1-asit glikoprotein olmak üzere plazma proteinlerine yüksek oranda bağlanır (> %99). Masitentanve aktif metaboliti ACT-132577, masitentan ve ACT-132577 için sırasıyla yaklaşık 50 Lve 40 L olan görünür dağılım hacminden (Vss/F) anlaşıldığı üzere dokulara iyi bir şekildedağılır. BiyotransformasyonMasitentanın dört primer metabolik yolağı vardır. Sülfamidin oksidatif depropilasyonu farmakolojik olarak aktif metaboliti verir. Bu reaksiyon, CYP2C8, CYP2C9 veCYP2C19'un küçük katkılarıyla birlikte ağırlıklı olarak CYP3A4 (yaklaşık %99) olmaküzere sitokrom P450 sistemine bağlıdır. Aktif metabolit insan plazmasında dolaşıma girerve farmakolojik etkiye katkıda bulunuyor olabilir. Diğer metabolik yolaklar farmakolojikaktivitesi olmayan ürünler verir. Bu yolaklar için, CYP2C9 baskın bir rol oynarken,CYP2C8, CYP2C19 ve CYP3A4 minör katkı sağlar. EliminasyonMasitentan yalnızca kapsamlı metabolizmadan sonra atılır. Ana atılım yolu idrar olup, dozun yaklaşık %50'si idrarla atılır. Hastalardaki karakteristik özellikler:Özel popülasyonlarYaş, cinsiyet veya etnik kökenin masitentan ve aktif metabolitinin farmakokinetikleri üzerinde klinik olarak anlamlı bir etkisi yoktur. Böbrek yetmezliğiŞiddetli böbrek yetmezliği olan hastalarda masitentan ve aktif metabolitine maruziyet, sırasıyla, yaklaşık 1,3 ve 1,6 kat artmıştır. Bu artış klinik olarak anlamlı kabuledilmemektedir (bkz. Bölüm 4.2 ve 4.4). Karaciğer yetmezliğiHafif, orta derece ve şiddetli karaciğer yetmezliği olan hastalarda masitentana maruziyet sırasıyla %21, %34 ve %6 oranında azalırken, aktif metabolitine maruziyet sırasıyla%20, %25 ve %25 oranında azalmıştır. Bu azalma klinik olarak ilgili kabul edilmemektedir(bkz. Bölüm 4.2 ve 4.4).
Masitentan, köpeklerde terapötik insan maruziyetine benzer maruziyetlerde kan basıncım düşürmüştür. 4-39 haftalık tedaviden sonra insan maruziyetinin 17 katı olan düzeylerdekoroner arterlerde intimal kalınlaşma gözlemlenmiştir. Türe özgü hassasiyet ve güvenlikmarjına bağlı olarak, bu bulgu insanla ilgisiz kabul edilmiştir. Fare, sıçan ve köpeklerde masitentan tedavisinden sonra karaciğer ağırlığında artış ve hepatoselüler hipertrofi gözlemlenmiştir. Bu değişiklikler büyük oranda tersinir olup,karaciğerin artan metabolik talebe olumsuz olmayan adaptasyonu olarak kabul edilmiştir. Masitentan, fare karsinojenisite çalışmasında tüm dozlarda nazal kavitenin submukozasında minimum ile hafif mukozal hiperplazi ve enflamatuvar infiltrasyonaneden olmuştur. 3 aylık fare toksisitesi çalışması veya sıçan ve köpek çalışmalarındahiçbir nazal kavite bulgusu kaydedilmemiştir. Masitentan standart in vitroin vivoinvivofototoksik bulunmamıştır. 2 yıl süren karsinojenisite çalışmaları, sıçan ve farelerdeinsan maruziyetinin sırasıyla 18 ve 116 katı olan maruziyetlerde karsinojenik potansiyelortaya koymamıştır.Erkek sıçan ve köpeklerle yapılan kronik toksisite çalışmalarında, sırasıyla 11,6 ve 5,8 güvenlik marjıyla testiküler tübüler dilatasyon gözlemlenmiştir. Tübüler dilatasyontamamen tersinirdir. Sıçanlarda 2 yıllık tedaviden sonra insan maruziyetinin 4 katı olandozlarda testiküler tübüler atrofi görülmüştür. Sıçanlarda ömür boyu süren karsinojenisiteçalışmasında ve köpeklerde tekrarlı doz toksisite çalışmasında, sıçanlarda 9,7 veköpeklerde 23 güvenlik marjı veren maruziyetlerde hipospermatogenez gözlemlenmiştir.Fertilite için güvenlik marjları erkek sıçanlarda 18 ve dişi sıçanlarda 44 olarakbelirlenmiştir. 2 yıla kadar süren tedaviden sonra farelerde herhangi bir testiküler bulgukaydedilmemiştir. Masitentan, tavşan ve sıçanlarda test edilen tüm dozlarda teratojenik bulunmuştur. Her iki türde kardiyovasküler anomaliler ve mandibular ark füzyon anomalileri tespit edilmiştir. Masitentanın dişi sıçanlara geç gebelik döneminden emzirme dönemine kadar insan maruziyetinin 5 katı olan maternal maruziyetlerde uygulanması, yavru sağkalımındaazalmaya ve geç intrauterin ömrü sırasında ve emzirme döneminde süt aracılığıylamasitentana maruz kalan yavrunun üreme kabiliyetinde bozulmaya neden olmuştur. Juvenil sıçanlara doğum sonrası 4. Gün ile 114. Gün arasında uygulanan tedavi, vücut ağırlığı artışında azalmaya neden olarak, gelişim üzerinde sekonder etkilere (testisinmesinde hafif gecikme, uzun kemik uzunluğunda tersinir azalma, uzun süreli östrussiklusu) yol açmıştır. İnsan maruziyetinin 7 katı olan maruziyetlerde pre-implantasyon vepost-implantasyon kaybında hafif artış, ortalama yavru sayısında azalma, testis veepididimis ağırlığında azalma gözlemlenmiştir. Testiküler tübüler atrofi ve üremedeğişkenleri ile sperm morfolojisi üzerindeki minimum etkiler insan maruziyetinin 3,8 katıolan maruziyetlerde kaydedilmiştir. 6. FARMASOTIK ÖZELLİKLER6.1 Yardımcı maddelerin listesiTablet çekirdeğiLaktoz monohidrat (sığır kaynaklı) Mikrokristal selüloz (E460i) Sodyum nişasta glikolat Tip A Povidon Magnezyum stearat (E572) Polisorbat 80 (E433) Film kaplamaPolivinil alkol (E1203)Titanyum dioksit (E171) Talk(E553b) Lesitin [soya fasulyesi (E322)] Ksantan zamkı (E415) 6.2 GeçimsizlikleriGeçerli değildir. 6.3 Raf ömrü60 ay 6.4 Saklamaya yönelik özel tedbirler30°C'nin altındaki oda sıcaklığında saklayınız. 6.5 Ambalajın niteliği ve içeriği28 film kaplı tablet içeren karton kutularda beyaz, opak PVC/PE/PVdC/Alüminyum folyo blister. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve 'Ambalaj Atıklarının Kontrolü Yönetmelik'lerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİJohnson and Johnson Sıhhi Mal. San. ve Tic. Ltd. Şti. Kavacık/Beykoz/İstanbul 8. RUHSAT NUMARASI2021/25 9. ILK RUHSAT TARTHT/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 17.02.2021 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ1 Trombositler2 PAH hastalarıyla yapılan çift kör bir çalışmada, masitentan 10 mg ortalama trombosit 3
sayısında 17 x 10 /L'lik azalma ile ilişkilendirilirken, plasebo ile tedavi edilen hastalarda ortalama azalma 11 x 103/L olmuştur. Uzun süreli güvenlilikPivot SERAPHIN çift kör çalışmasına katılan 742 hastadan 550'si uzun süreli açık etiketli (OL) bir uzatma çalışmasına girmiştir. (OL kohortu, masitentan 10 mg'a devam eden 182hastayı ve plasebo veya masitentan 3 mg alan ve masitentan 10 mg'a geçen 368 hastayıiçermiştir.) Bu 550 hastanın medyan 3,3 yıllık maruziyet ve maksimum 10,9 yıllık maruziyet için uzun |
İlaç BilgileriOpsumit 10 Mg Film Kaplı TabletEtken Maddesi: Masitentan Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.