Sulpria Discair 50 Mcg/100 Mcg İnhalasyon Tozu Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERİ TIBBİ ÜRÜNÜN ADISULPRİA Discair 50 mcg/100 mcg İnhalasyon Tozu 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Salmeterol ksinafoat* 72,64 mcg Flutikazon propiyonat 100 mcg *50 mcg Salmeterol'e eşdeğer. Yardımcı maddeler:
12,82736 mg
Laktoz Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMUİnhalasyon için toz Blisterlenebilen Alü folyo içerisinde beyaz toz 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAstım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAHolgularında semptomları ve atak sıklığını azaltır. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:SULPRİA DİSCAİR sadece inhalasyon yolu ile uygulanır. Hastalar, belirtileri olmasa dahi optimum fayda için SULPRİA DİSCAİR'ı düzenli olarak kullanmaları gerektiği konusunda uyarılmalıdır. Hastaların düzenli olarak doktor kontrolünde bulundurularak aldıkları SULPRİA DİSCAİR dozunun optimum düzeyde kalması sağlanmalı ve sadece doktor önerisi ile değiştirilmelidir. Astım Doz, belirtileri etkili olarak kontrol eden en düşük doza ayarlanmalıdır. Günde 2 kez uygulanan SULPRİA DİSCAİR ile belirtilerin kontrolü sağlandığında, etkili en düşük doz açısından,günde 1 kez uygulanan SULPRİA DİSCAİR da değerlendirmeye dahil edilebilir. Hastalara hastalıklarının şiddetine göre uygun flutikazon propiyonat dozu içeren SULPRİA DİSCAİR verilmelidir. Eğer hasta yalnız inhale kortikosteroid tedavisi ile yeterli derecede kontrol edilemiyorsa tedavinin terapötik olarak eşdeğer kortikosteroid dozunda SULPRİA DİSCAİR iledeğiştirilmesi astım kontrolünde düzelme sağlayabilir. Astımı yalnız inhale kortikosteroidtedavisi ile yeterli derecede kontrol edilebilen hastalarda tedavinin SULPRİA DİSCAİR iledeğiştirilmesi astım kontrolünü sürdürürken kortikosteroid dozunun azaltılmasını sağlayabilir.Daha ayrıntılı bilgi için lütfen Farmakodinamik özellikler bölümüne bakınız. Tavsiye Edilen Dozlar 4 yaş ve üzeri çocuklar: Günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 100 mikrogram flutikazon propiyonat) 12 yaş ve üzeri adolesanlar: Günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 100 mikrogram flutikazon propiyonat). veya günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 250 mikrogram flutikazon propiyonat). veya günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 500 mikrogram flutikazon propiyonat). 18 yaş ve üzeri yetişkinler: Yetişkinlerde 14 güne kadar tüm SULPRİA DİSCAİR dozlarının iki katına çıkarılması ile düzenli olarak günde iki kez alınan doz karşılaştırılabilir güvenlilik ve tolerabilitededir ve budurum astım tedavi rehberlerinde gösterildiği gibi hastalar ilave kısa süreli inhale kortikosteroidtedavisine ihtiyaç duyduklarında (14 güne kadar) göz önünde bulundurulabilir. Kronik Obstrüktif Akciğer Hastalığı (KOAH) Yetişkin hastalar için tavsiye edilen doz günde 2 kez 1 inhalasyon 50/250 mikrogram-50/500 mikrogram salmeterol/flutikazon propiyonattır. Günde iki kez alınan 50/500 mikrogramlıkmaksimum salmeterol/flutikazon propiyonat dozunun tüm nedenlere bağlı ölümleri azalttığıgösterilmiştir (bkz.Uygulama şekli:SULPRİA DİSCAİR, sadece oral inhalasyon içindir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Doz modifikasyonu gerekli değildir. Pediyatrik popülasyon:4 yaşından küçük çocuklarda SULPRİA DİSCAİR kullanımı ile ilgili bilgi yoktur. Geriyatrik popülasyon:Doz modifikasyonu gerekli değildir. 4.3. KontrendikasyonlarSULPRİA DİSCAİR, bileşenlerinden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir (bkz.4.4. Özel kullanım uyarıları ve önlemleriAstım tedavisinde normalde kademeli bir program izlenmelidir ve hastanın yanıtı klinik olarak ve akciğer fonksiyon testleriyle izlenmelidir. SULPRİA DİSCAİR hafif astım tedavisi için önerilmez. SULPRİA DİSCAİR hızlı ve kısa etkili bir bronkodilatörün (örneğin salbutamol) kullanımını gerektiren akut belirtileri rahatlatmak için değildir. Hastalara rahatlamak için kullanmalarıgereken ilaçları her zaman yanlarında bulundurmaları tavsiye edilmelidir. Belirtileri gidermek için kısa etkili bronkodilatör kullanımının artması astım kontrolünün kötüleştiğini gösterir ve bu durumda olan hastalar bir hekim tarafından tekrar muayeneedilmelidir. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır.Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. Astım kontrolünün ani ve ilerleyen şekilde kötüleşmesi hayatı tehdit eden bir durumdur ve hastanın bir hekim tarafından tekrar muayene edilmesi gereklidir. Kortikosteroid dozununartırılması düşünülmelidir. SULPRİA DİSCAİR'ın mevcut dozunun astımı yeterli derecedekontrol edemediği durumda hasta hekim tarafından tekrar muayene edilmelidir. Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. Astımlı ya da KOAH'lı hastalarda alevlenme bir enfeksiyon ile ilişkili ise ilave kortikosteroid tedavisi ve antibiyotik uygulanması düşünülmelidir. Astımlı hastalarda alevlenme riski nedeniyle SULPRİA DİSCAİR tedavisi ani olarak kesilmemelidir, tedavi dozu hekim gözetiminde kademeli olarak azaltılmalıdır. KOAH'lıhastalarda tedavinin kesilmesine semptomatik dekompanzasyon eşlik edebilir ve tedavininkesilmesi bir hekim gözetiminde yapılmalıdır. KOAH'da yüksek doz kullanımınm avantaj sağladığına ilişkin klinik kanıtlar yetersizdir.Salmeterol/flutikazon propiyonat alan KOAH'lı hastalarla yapılan çalışmalarda pnömoni bildirimlerinde artış olmuştur (bkz.4.8 İstenmeyen Etkiler). Alevlenme ve pnömoninin kliniközellikleri sıklıkla birbirleriyle örtüştüğünden, hekimler KOAH'lı hastalarda pnömonigelişmesi olasılığına karşı dikkatli olmalıdır.Kortikosteroid içeren tüm inhale ilaçlarla olduğu gibi, aktif veya sessiz akciğer tüberkülozu olan hastalarda SULPRİA DİSCAİR dikkatli kullanılmalıdır. SULPRİA DİSCAİR tirotoksikozlu hastalarda dikkatli kullanılmalıdır. Tüm sempatomimetik ilaçlarla, özellikle terapötik dozlardan daha yüksek dozlarda uygulandıklarında, bazen sistolik kan basıncında ve kalp hızında artış gibi kardiyovasküleretkiler görülebilir. Bu nedenle SULPRİA DİSCAİR önceden kardiyovasküler hastalığıolanlarda dikkatli kullanılmalıdır. Tüm sempatomimetik ilaçlarla, terapötik dozdan daha yüksek dozlarda uygulandıklarında serum potasyum düzeylerinde geçici bir azalma meydana gelebilir. Bu nedenle, düşük serumpotasyum düzeylerine eğilimi olan hastalarda SULPRİA DİSCAİR dikkatli kullanılmalıdır. Herhangi bir inhale kortikosteroid özellikle yüksek dozlarda, uzun süre kullanıldığında sistemik etkiler oluşabilir. Oral kortikosteroid uygulamasına göre bu etkilerin oluşma olasılığı çok dahaazdır {bkz.4.9 Doz Aşımı). Olası sistemik etkiler; Cushing sendromu, Cushing benzeribelirtiler, adrenal supresyon, çocukların ve adolesanların büyümesinde gecikme, kemik mineraldansitesinde azalma, katarakt ve glokomu içerir. Bu nedenle, astımı olanlarda inhalekortikosteroid dozunun, etkili kontrolü sağlayan en düşük doza ayarlanması önemlidir.Stres yaratması muhtemel acil ve elektif durumlarda adrenal yanıt bozukluğu olasılığı daima akılda tutulmalıdır ve uygun kortikosteroid tedavisi düşünülmelidir (bkz.4.9 Doz Aşımı).Uzun süre inhale kortikosteroid tedavisi alan çocukların boyunun düzenli olarak izlenmesi tavsiye edilmektedir. Bazı bireyler inhale kortikosteroidlere çoğu hastada olduğundan daha fazla duyarlılık gösterebilir. Yetersiz adrenal cevap olasılığından dolayı, oral steroid tedavisinden inhale flutikazon propiyonat tedavisine geçirilen hastalar yakından izleyerek tedavi edilmeli ve adrenalfonksiyon düzenli olarak izlenmelidir. Sistemik kortikosteroidlerin kesilmesinden sonrahipotalamik pituiter adrenal aks (HPA) fonksiyonlarının düzelmesi için birkaç ay geçmesigerekmektedir. Stres ve şiddetli astım ataklarında sistemik steroid tedavisi kesilmiş olanhastalar tekrar oral kortikosteroid tedavisine başlamaları ve acil olarak hekimlerinebaşvurmaları hususunda bilgilendirilmelidir. İnhale flutikazon propiyonat tedavisinegeçildiğinde, sistemik steroid dozu yavaş yavaş azaltılmalı ve hastalar stres zamanlarında veşiddetli astım ataklarında ilave tedavi için gereklilik olabileceğini gösteren steroid uyarı kartlarıtaşımaları hususunda teşvik edilmelidir. İnhale flutikazon propiyonat tedavisine başlandığında, sistemik steroid dozu kademeli olarak azaltılmalı ve hastalar stres zamanlarında ek tedavinin gerekli olabileceğini gösteren steroiduyarı kartı taşımaları konusunda teşvik edilmelidir. Nadiren kan glukoz düzeylerinde artış rapor edilmiştir (bkz.4.8 İstenmeyen Etkiler) ve diabetes mellitus öyküsü olan hastalara reçete edilirken bu husus göz önünde bulundurulmalıdır.Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. ABD'de yapılan SMART adlı büyük çaplı bir çalışmada standart tedaviye eklenen salmeterol (salmeterol-flutikazon propiyonatın bir bileşeni) veya plasebo karşılaştırılmış ve elde edilenverilere göre salmeterol uygulanan hastalarda astıma bağlı ölümlerde anlamlı bir artışgörülmüştür. Bu çalışmada elde edilen veriler Afro-Amerikalı hastaların, salmeterol kullanımısırasında plaseboya kıyasla solunum ile ilgili ciddi olay veya ölüm riskine daha fazla maruzkalabileceğini düşündürmektedir. Bu artışın farmakogenetiğe veya diğer faktörlere bağlı olupolmadığı bilinmemektedir. SMART çalışması, inhalasyon yoluyla eşzamanlı kortikosteroidkullanımının astıma bağlı ölüm riskini artırıp artırmadığının belirlenmesi amacıylatasarlanmamıştır. (Bkz 5.1 Farmakodinamik Özellikler) İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altında almak için, hem inhale kortikosteroid hem deuzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. Laktoz uyarısı SULPRİA DİSCAİR'ın her bir dozu 12,82736 mg laktoz içermektedir. Bu miktar, laktoz intoleransı olan kişilerde normalde bir probleme neden olmamaktadır. KOAH hastalarında pnömoniKortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoniriskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarakgösterilmemiştir. Kortikosteroid içeren inhale ilaçların pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyladikkatli olmalıdırlar. KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içimi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır. 4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriKullanımı zorunlu olmadıkça, selektif veya selektif olmayan beta-blokerlerin kullanılmasından kaçınılmalıdır. Diğer beta adrenerjik içeren ilaçların eşzamanlı kullanımı potansiyel aditif etkiye sahip olabilir. Normal şartlar altında, inhalasyon yolu ile uygulanmasından sonra, geniş ilk geçiş metabolizması ve karaciğer ve bağırsakta sitokrom P450 3A4'ün aracılık ettiği yüksek sistemikklerens sonucu, flutikazon propiyonatın düşük plazma konsantrasyonlarına ulaşılır. Bu nedenle,flutikazon propiyonatın aracılık ettiği klinik olarak anlamlı ilaç etkileşimi olası değildir. Sağlıklı gönüllüler üzerinde yapılan bir ilaç etkileşim çalışması, ritonavirin (oldukça güçlü sitokrom P450 3A4 inhibitörü), flutikazon propiyonatın plazma konsantrasyonlarını büyükoranda artırabildiğini ve serum kortizol konsantrasyonlarında anlamlı azalmaya yol açtığınıgöstermiştir. Pazarlama sonrası kullanım sırasında intranazal veya inhale flutikazon propiyonatve ritonavir alan hastalarda Cushing sendromu ve adrenal supresyon dahil sistemikkortikosteroid etkiler ile sonuçlanan klinik olarak anlamlı ilaç etkileşimleri bildirilmiştir. Bunedenle, hastaya olan potansiyel yararı sistemik kortikosteroid yan etkileri riskinden fazlaolmadıkça, ritonavir ve flutikazon propiyonatın birlikte kullanımından kaçınılmalıdır. Çalışmalar, diğer sitokrom P450 3A4 inhibitörlerinin, serum kortizol konsantrasyonlarında önemli bir düşüş olmadan flutikazon propiyonata sistemik maruziyette ihmal edilebilir(eritromisin) ve küçük (ketokonazol) artışlara neden olduklarını göstermiştir. Bununla birlikte,flutikazon propiyonata sistemik olarak maruz kalma potansiyeli artacağından, güçlü P450 3A4inhibitörleri (örneğin ketokonazol) ile birlikte kullanıldığında dikkatli olunmalıdır. Bir ilaç etkileşim çalışmasında eşzamanlı sistemik ketokonazol kullanımının plazma salmeterol maruziyetini anlamlı derecede artırdığı gözlenmiştir (Cmaks 1.4 kat ve EAA 15 kat), bu durumQTc aralığında uzamaya neden olabilir (Bkz 5.2 Farmakokinetik Özellikler). Güçlü CYP3A4inhibitörleri (örn, ketokonazol) ile salmeterol birlikte uygulandığında dikkatli olunmalıdır. Ketokonazol ile eşzamanlı kullanımından, tedavinin yararları salmeterolün artan sistemik yan etkiler riskinden daha yüksek olmadığı sürece kaçınılmalıdır. Diğer potent CYP3A4inhibitörleri ile benzer bir etkileşim riskinin olması muhtemeldir (örn, itrakonazol, telitromisin,ritonavir). 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)SULPRİA DİSCAİR'un doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır. Gebelik dönemiGebelikte kullanım ile ilgili yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz. kısım 5.3). İnsanlara yönelikpotansiyel risk bilinmemektedir. Tek ilaç veya kombinasyon halindeki ilaçlarla hayvanlar üzerinde yapılan üreme toksisite çalışmaları, güçlü bir beta 2 adrenoreseptör agonistinin ve glukokortikosteroidin aşırı sistemikmaruziyet seviyelerinde beklenen fötal etkilerini açığa çıkarmıştır. İlaç kullanımı ancak anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir. Bu sınıftaki ilaçlarla ilgili geniş klinik deneyim, etkilerinin terapötik dozlarla ilişkili olduğuna dair bir kanıt ortaya koymamıştır. Ne salmeterol ksinafoatın ne de flutikazon propiyonatıngenetik toksisite potansiyeline sahip olduğu gösterilmiştir. Gerekli olmadıkça gebelikdöneminde kullanılmamalıdır. Laktasyon dönemiSalmeterol ksinafoat ve flutikazon propiyonatın gebelik ve emzirme döneminde kullanımı ile ilgili deneyimler yetersizdir. Emzirme döneminde tercihen kullanılmamalıdır. Salmeterol süte geçer. Terapötik dozlarda inhale edilen salmeterol ve flutikazon propiyonatın plazma düzeyleri çok düşüktür ve buna bağlı olarak anne sütündeki konsantrasyonların düşükolması muhtemeldir. Bu, sütünde düşük ilaç konsantrasyonları ölçülen emziren hayvanlarüzerinde yapılan çalışmalarla desteklenmiştir. Üreme yeteneği/Fertilite4.7. Araç ve makine kullanımı üzerindeki etkilerSULPRİA DİSCAİR'ın araç ve makine kullanımı üzerindeki etkileri ile ilgili spesifik bir çalışma yoktur, ancak her iki ilacın farmakolojisi herhangi bir etkisi olmayacağınıgöstermektedir. 4.8. İstenmeyen etkilerSULPRİA DİSCAİR, salmeterol ve flutikazon propiyonat içerdiğinden her iki bileşenle de ilişkili olan tipte ve şiddette advers reaksiyonlar görülebilir. Bu iki bileşiğin birlikteverilmesiyle ilave advers etki bildirilmemiştir. Diğer inhalasyon tedavilerinde olduğu gibi, ilaç alındıktan sonra hırıltılı solunumda ani artış ile paradoksal bronkospazm oluşabilir. Bu durum hızlı ve kısa etkili inhale bronkodilatör ile hementedavi edilmelidir. Salmeterol/flutikazon propiyonat kullanımı hemen kesilmeli, hasta kontroledilmeli ve gerekirse alternatif tedavi uygulanmalıdır. Salmeterol/flutikazon propiyonat ile ilgili advers olaylar aşağıda verilmiştir: Sıklık sınıflandırması, Çok yaygın (>1/10); yaygın (>1/100 ve <1/10); yaygın olmayan (>1/1000 ve <1/100); seyrek (>1/10.000 ila <1/1000) ve izole raporlar dahil çok seyrek (<1/10.000), bilinmiyor (eldekiverilerden hareketle tahmin edilemiyor) şeklinde tanımlanmıştır. Çok yaygın ve yaygın olaylar genellikle klinik çalışma verilerinden belirlenmiştir. Seyrek ve çok seyrek olaylar genellikle spontan verilere dayanmaktadır. Enfeksiyonlar ve enfestasyonlarYaygın: Ağız ve boğazda kandidiyaz, bronşit, pnömoni (KOAH'lı hastalarda) Bağışıklık sistemi hastalıklarıYaygın olmayan: Kütanöz duyarlılık reaksiyonları Endokrin hastalıklarıÇok seyrek: Cushing sendromu, Cushing benzeri özellikleri, adrenal süpresyonu, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineral yoğunluğu, katarakt, glokom. Metabolizma ve beslenme hastalıklarıYaygın: Hipokalemi Çok seyrek: Hiperglisemi Psikiyatrik hastalıklarÇok seyrek: Anksiyete, uyku bozuklukları ve hiperaktivite ve iritabilite (temelde çocuklarda) dahil davranış değişiklikleri. Bilinmiyor: Depresyon, huzursuzluk (çoğunlukla çocuklarda) Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısı Yaygın: Tremor Kardiyak hastalıklarYaygın: Palpitasyon Yaygın olmayan: Taşikardi Çok seyrek: Kardiyak aritmi (atrial fibrilasyon, supraventriküler taşikardi ve ekstrasistol dahil) Solunum, göğüs bozuklukları ve mediastinal hastalıklarÇok yaygın: Nazofarenjit Yaygın: Boğaz irritasyonu, ses kısıklığı/disfoni, sinüzit, pnömoni (KOAH'lı hastalarda) Çok seyrek: Paradoksikal bronkospazm Deri ve deri altı doku hastalıklarıYaygın: Kontüzyonlar Kas-iskelet bozuklukları, bağdoku ve kemik hastalıklarıYaygın: Kas krampları, travmatik kırıklar Çok seyrek: Artralji, miyalji Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; Tel: 0 800 314 00 08; Faks: 0 312 218 35 99) 4.9. Doz aşımı ve tedavisiSemptomlar ve bulgular SULPRİA DİSCAİR, salmeterol ve/veya flutikazon propiyonat ile ilgili doz aşımı bilgileri aşağıda verilmiştir: Salmeterolün aşırı dozu ile beklenen belirtiler ve bulgular tremor, baş ağrısı, taşikardi, sistolik kan basıncında artış ve hipokalemi gibi tipik aşırı beta2-adrenerjik stimülasyonuna bağlıdır.Flutikazon propiyonatın onaylanan dozlarını aşan dozlarda akut inhalasyonu geçici olarakhipotalamus-hipofiz-adrenal ekseninin baskılanmasına yol açabilir. Bu durum acil önlemalınmasını gerektirmez; adrenal fonksiyonlar birkaç gün içinde eski haline döner. Eğer onaylanan SULPRİA DİSCAİR dozunun üzerindeki dozlar uzun süre alınmaya devam edilirse anlamlı derecede adrenokortikal supresyon oluşabilir. Özellikle onaylanan dozunüzerinde uzun süre (birkaç ay ya da yıl) ilaca maruz kalan çocuklarda çok seyrek olarak akutadrenal krizler ile ilgili bildiriler bulunmaktadır. Gözlenen özelliklere bilinç kaybı ve/veyakonvülsiyonlarla ilişkili hipoglisemi dahildir. Travmaya maruz kalma, cerrahi girişim,enfeksiyon veya inhale flutikazon propiyonat dozunda hızlı azalma gibi durumlar akut adrenalkrizi tetikleyebilecek durumlardır. Hastaların, SULPRİA DİSCAİR'ı onaylanan dozların üzerindeki dozlarda kullanmaları tavsiye edilmemektedir. Tedavinin düzenli olarak gözden geçirilmesi ve dozun hastalığın etkilikontrolünü sağlayan en düşük onaylı doza azaltılması önemlidir {bkz.4.2 Pozoloji ve uygulamaşekli).Tedavi Tercih edilen antidotlar, bronkospazm hikayesi olan hastalarda dikkatli kullanılması gereken kardiyoselektif beta-bloker ajanlardır. Eğer SULPRİA DİSCAİR tedavisinin, ilacın beta-agonist bileşeninin aşırı dozundan dolayı kesilmesi gerekiyorsa, uygun kortikosteroidreplasman tedavisine başlanması düşünülmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerATC Kodu: R03A K06 Farmakoterapötik grubu: Adrenerjikler inhalantlar (Selektif beta-2-adrenerjik reseptör agonistleri) ve diğer inhalantlar (kortikosteroidler) Etki mekanizmasıSULPRİA DİSCAİR farklı etki mekanizmalarına sahip salmeterol ve flutikazon propiyonat içerir. Salmeterol belirtilere karşı korurken, flutikazon propiyonat akciğer fonksiyonlarını düzeltir ve alevlenmeleri önler. SULPRİA DİSCAİR eşzamanlı olarak beta-agonist ve inhalekortikosteroid tedavisi uygulanan hastalar için daha uygun bir rejim sunabilir. Her iki ilacın daetki mekanizmaları aşağıda verilmiştir: Salmeterol Salmeterol, reseptörün dış bölgesine bağlanan bir uzun yan zinciri olan, selektif uzun etkili (12 saat) bir beta2-adrenoseptör agonistidir. Salmeterolün bu farmakolojik özellikleri histaminin neden olduğu bronkokonstriksiyonu daha etkili bir şekilde önler ve kısa etkili konvansiyonel beta2-agonistlerin önerilen dozlarına göreen az 12 saat süren, daha uzun süreli bronkodilatasyon sağlar. İn vitrotestler salmeterolün, insan akciğerlerinde histamin, lökotrienler ve prostaglandin D2 gibi mast hücresi mediyatörlerinin salıverilmesininin güçlü ve uzun süreli bir inhibitörüolduğunu göstermiştir.İnsanda salmeterol inhale edilen alerjenlere karşı erken ve geç faz yanıtlarını inhibe eder; geç faz yanıtı önleyici etkisi tek bir dozu takiben 30 saat boyunca, bronkodilatör etki sona erdiğindebile devam eder. Tek bir salmeterol dozu bronşiyal aşırı cevaplılığı azaltır. Bu özelliklersalmeterolün ilave olarak non-bronkodilatör aktivitesi olduğunu göstermektedir ancak buetkinin klinik açıdan anlamı tam olarak açıklığa kavuşmamıştır. Bu mekanizmakortikosteroidlerin anti-enflamatuvar etki mekanizmasından farklıdır. Flutikazon propiyonat Flutikazon propiyonat, tavsiye edilen dozlarda inhalasyon yoluyla verildiğinde akciğerlerde güçlü bir anti-enflamatuvar etki gösteren ve sistemik olarak verilen kortikosteroidlerle gözlenenyan etkiler olmadan astımın belirtilerini ve alevlenmelerini azaltan bir glukokortikoiddir. İnhale flutikazon propiyonat ile kronik tedavi boyunca, günlük adrenokortikal hormon salıverilmesi, çocuklar ve yetişkinlerde tavsiye edilen en yüksek dozlarda bile genellikle normalsınırlar içinde kalmıştır. Diğer inhale steroidlerden inhale flutikazon propiyonata geçildiktensonra, günlük adrenokortikal hormonların salıverilmesi geçmişte ve halen aralıklı oral steroidkullanımına rağmen tedricen düzelir, böylece inhale flutikazon propiyonat ile normal adrenalfonksiyon değerlerine dönüldüğü gösterilmiş olur. Adrenal rezerv de kronik tedavi sırasında,stimülasyon testinde normal bir artışla ölçüldüğü üzere normal kalır. Bununla birlikte öncekitedaviden kalan herhangi bir rezidüel adrenal bozukluğun önemli bir süre devam edebileceğigöz önünde bulundurulmalıdır (bkz. 4.4 Özel kullanım uyarıları ve önlemleri).5.2. Farmakokinetik özellikleriHayvanlarda veya insanlarda inhalasyon yoluyla birlikte uygulanan salmeterol ve flutikazon propiyonatın birbirlerinin farmakokinetiğini etkilediğine dair herhangi bir bulgu yoktur. Bu nedenle farmakokinetik açıdan her iki bileşen ayrı ayrı düşünülebilir. 15 sağlıklı denekte yapılan plasebo kontrollü, çapraz geçişli bir çalışmada 7 gün süreyle birlikte salmeterol (inhalasyon yoluyla günde iki kez 50 mcg) ve bir CYP3A4 inhibitörü olanketokonazol (oral yolla günde bir kez 400 mg) uygulanması plazma salmeterol maruziyetindeanlamlı bir artışa neden olmuştur (Cmaks 1.4 kat ve EAA 15 kat). Tekrarlı dozlama ile salmeterolbirikiminde bir artış bulunmamaktadır. Üç denekte QTc uzaması veya sinüs taşikardisinin eşlikettiği palpitasyon nedeniyle, birlikte salmeterol ve ketokonazol uygulaması kesilmiştir. Kalan12 denekte birlikte salmeterol ve ketokonazol uygulanması kalp hızında, kan potasyumundaveya QTc aralığında klinik açıdan anlamlı bir etki yaratmamıştır. (bkz. 4.4 Özel kullanımuyarıları ve önlemleri ve 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri). Emilim:Salmeterol Salmeterol akciğerlerde lokal olarak etki eder, bu nedenle plazma seviyeleri terapötik etkinin belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra çok düşük plazmakonsantrasyonları gösterdiği için (yaklaşık 200 pg/ml veya daha az) plazmadaki ilaç miktarınıntayini teknik olarak zor olduğundan salmeterolün farmakokinetiği ile ilgili sadece sınırlı verilerbulunmaktadır. Salmeterol ksinafoatın düzenli kullanımını takiben, hidroksinaftoik asitsistemik dolaşımda tayin edilebilir ve kararlı durum konsantrasyonları yaklaşık 100 ng/ml'yeulaşır. Bu konsantrasyonlar, toksisite çalışmalarında gözlenen kararlı durumkonsantrasyonlarından 1000 kez daha düşüktür. Havayolu tıkanıklığı olan hastalarda uzunsüreli düzenli kullanımında (12 aydan fazla) herhangi bir zararlı etki görülmemiştir. Flutikazon propiyonat Her bir inhaler cihazı için flutikazon propiyonatın mutlak biyoyararlanımı inhalasyon veya intravenöz farmakokinetik verilerin çalışma içerisinde ve çalışmalar arasında karşılaştırılmasıile hesaplanmıştır. Sağlıklı erişkin deneklerde mutlak biyoyararlanım iki farklı kuru toz inhaleriile uygulanan flutikazon propiyonat (%7.8 ve %9.0), basınçlı ölçülü doz inhaler ile uygulananflutikazon propiyonat (%10.9), basınçlı ölçülü doz inhaler ile uygulanan salmeterol-flutikazonpropiyonat (%5.3) ve kuru toz inhaler ile uygulanan salmeterol-flutikazon propiyonat (%5.5)için belirlenmiştir. Astım ya da KOAH hastalarında flutikazon propiyonata sistemikmaruziyetin daha az derecede olduğu görülmüştür. Sistemik absorpsiyon başlıca akciğerlerdengerçekleşir ve başlangıçta hızlı olup daha sonra yavaşlamaktadır. Kalan inhale doz yutulabilir,fakat yutulan kısım sudaki düşük çözünürlüğü ve % 1'den daha az oral biyoyararlanımlasonuçlanan sistemik absorpsiyon öncesi metabolizmasından dolayı sistemik maruziyete çok azkatkıda bulunmaktadır. İnhale dozun arttırılmasıyla sistemik maruziyette doğrusal artış olur. Dağılım:Salmeterol Salmeterolün plazma proteinlerine bağlanma oranı %96'dır. Flutikazon propiyonat Flutikazon propiyonatın plazma proteinlerine bağlanma oranı orta derecede yüksektir (% 91). Kararlı durumdaki dağılım hacmi geniştir. Biyotransformasyon:Salmeterol İn vitrobir çalışma salmeterolün sitokrom P450 3A4 (CYP3A4) tarafından büyük oranda a-hidroksisalmeterole (alifatik oksidasyon) metabolize edildiğini göstermiştir.Flutikazon propiyonat Flutikazon propiyonat başlıca sitokrom P450 enzimi CYP3A4 tarafından inaktif karboksilik asite metabolize edilerek sistemik dolaşımdan çok hızlı temizlenir. CYP3A4 inhibitörleri olarakbilinen ajanlar ile birlikte kullanıldığında flutikazon propiyonata sistemik maruziyet potansiyelolarak artacağından dikkatli olunmalıdır. Eliminasyon:Salmeterol Eliminasyon yarılanma ömrü 5.5 saattir. Salmeterolün %60 dışkı ile %25 idrar ile itrah edilir. Flutikazon propiyonat Flutikazon propiyonatın dispozisyonu, yüksek plazma klerensi (1150 ml/dak) ve yaklaşık 8 saat olan terminal yarılanma ömrü ile karakterizedir. Flutikazon propiyonatın renal klerensi ihmaledilebilir düzeydedir (< % 0.2) ve % 5'ten azı metabolitleri şeklindedir. Hastalardaki karakteristik özellikler Böbrek/Karaciğer yetmezliği:Veri bulunmamaktadır. Değişik yaş grupları:Popülasyon farmakokinetiği analizi, astım hastalarıyla ilgili veriler kullanılarak yapılmış (flutikazon propiyonat (FP) için 9 ve salmeterol için 5 klinik çalışma) ve aşağıdakilerigöstermiştir: - Tek başına verilen FP (100 mikrogram) ile karşılaştırıldığında, salmeterol/flutikazonpropiyonat (50/100 mikrogram) verildikten sonra adolesanlarda ve yetişkinlerde (oran 1.52 [%90 GA 1.08, 2.13]) ve çocuklarda (oran 1.20 [% 90 GA 1.06, 1.37]) daha yüksek FP maruziyetigörülmüştür. - Adolesanlara ve yetişkinlere (oran 1.63 [%90 GA 1.35, 1.96]) kıyasla salmeterol/flutikazonpropiyonat (50/100 mikrogram) alan çocuklarda daha yüksek FP maruziyeti gözlenmiştir. - Bu bulguların klinik anlamı bilinmemektedir, ancak, hem adolesanlarda ve yetişkinlerde hemde çocuklarda, salmeterol/flutikazon propiyonat (50/100 mikrogram) ve FP'ı (100 mikrogram)karşılaştıran 12 hafta kadar süren klinik çalışmalarda hipotalamus-hipofiz-adrenal ekseniüzerindeki etkileri arasında farklılık gözlenmemiştir. 50/500 mikrogramlık daha yüksek salmeterol/flutikazon propiyonat dozu alındığında, tek başına uygulanan eşdeğerde FP dozu karşılaştırıldığında FP maruziyeti benzer bulunmuştur. - Adolesanlar ve yetişkinlere kıyasla salmeterol/flutikazon propiyonat (50/100 mikrogram) alançocuklarda daha yüksek salmeterol maruziyeti gözlenmiştir (oran 1.23 [% 90 GA 1.10, 1.38]). - Bu bulguların klinik anlamı bilinmemektedir, ancak, 12 hafta kadar süren çalışmalardayetişkinler, adolesanlar ve çocuklar arasında kardiyovasküler etkilerinde veya tremorbildirilerinde farklılık gözlenmemiştir. Klinik ÇalışmalarSalmeterol ile yapılan klinik çalışmalar Astım Salmeterol Çok Merkezli Astım Araştırma Çalışması (The Salmeterol Multi-center Asthma Research Trial) (SMART), standart tedaviye eklenen salmeterol veya plasebonungüvenliliğinin karşılaştırıldığı, ABD'de yapılan büyük çaplı bir çalışmadır. Primer sonlanmanoktasında (solunum ile ilişkili ölüm ve solunum ile ilişkili yaşamı tehdit eden olaylarınkombine sayısı) anlamlı farklar mevcut değildir. Bu çalışma salmeterol uygulanan hastalardaastıma bağlı ölüm vakalarında anlamlı bir artış göstermiştir (28 haftalık sürede plasebogrubundaki 13,179 hastada 3 ölüm vakasına karşı salmeterol grubundaki 13,176 hastada 13ölüm vakası). Bu çalışma inhalasyon yoluyla eşzamanlı kortikosteroid kullanımının etkisinindeğerlendirilmesi için tasarlanmamıştır. Bununla birlikte post-hoc analizler başlangıçtainhalasyon yoluyla alınan steroidler kullanan hastalar için astıma bağlı ölüm açısından tedavigrupları arasında anlamlı bir fark göstermemiştir (plasebo grubunda 3/6138'e karşı salmeterolgrubunda 4/6127). İnhalasyon yoluyla steroid kullanılmayan gruplardaki astıma bağlı ölümvakalarının sayısı salmeterol grubunda 9/7049 olurken plasebo grubunda 0/7041 idi. Ayrıca,Salmeterol-FP kolunda 8,030 ve flutikazon propionat kolunda 7,925 hastayı içeren 42 klinikçalışmanın bir meta analizi, ciddi solunum ile ilişkili olaylar veya astıma bağlı olarak hastaneyeyatma açısından salmeterol-FP ile flutikazon propionat arasında istatistiksel bir farkgöstermemiştir. Salmeterol/flutikazon propiyonat ile yapılan klinik çalışmalar Astım 3416 astım hastasının katıldığı 12 aylık geniş bir çalışmada (Optimal Astım Kontrolünün Sağlanması - Gaining Optimal Asthma controL, GOAL), önceden belirlenmiş astım kontroldüzeylerine ulaşmada salmeterol/flutikazon propiyonatın etkililik ve güvenliliği tek başınaverilen inhale kortikosteroid ile karşılaştırılmıştır. Tedavi dozu ## 'Tam kontrol' sağlanıncayaveya çalışma ilacının en yüksek dozuna ulaşıncaya kadar her 12 haftada bir artırılmıştır.Kontrolün, tedavinin son 8 haftasının en az 7'sinde devam etmesi gerekiyordu. Bu çalışmada aşağıdaki sonuçlar elde edilmiştir: Sadece inhale kortikosteroid ile tedavi edilen hastaların % 59'u #'iyi kontrol' düzeyineulaşırken salmeterol/flutikazon propiyonat kullanan hastalarda bu oran % 71 olmuştur. Sadece inhale kortikosteroid ile tedavi edilen hastaların % 28'i ##'tam kontrol' düzeyineulaşırken salmeterol/flutikazon propiyonat kullanan hastalarda bu oran % 41 olmuştur. Bu etkiler tek başına inhale kortikosteroide kıyasla, salmeterol/flutikazon propiyonat ile daha erken ve daha düşük inhale kortikosteroid dozunda görülmüştür. GOAL çalışmasında aynı zamanda aşağıdaki sonuçlara ulaşılmıştır: Sadece inhale kortikosteroid tedavisi ile karşılaştırıldığında salmeterol/flutikazonpropiyonat ile alevlenme oranı % 29 daha düşüktür. Astım kontrolünde 'İyi kontrol' ve 'Tam kontrol' durumuna ulaşma Yaşam Kalitesi'niartırmıştır. Salmeterol/flutikazon propiyonat ile tedaviden sonra hastaların % 61'iyaşam kalitelerinin 'minimal düzeyde bozulduğunu' veya 'hiç bozulmadığını'bildirmişlerdir. Başlangıçta %8 olan bu etki astıma özgü yaşam kalitesi anketi ileölçülmüştür. #İyi kontrol edilen astım: seyrek belirtiler veya seyrek olarak kısa etkili beta agonist kullanımı veya akciğer fonksiyonu beklenenin % 80'inden az olması artı gece uyanma yok, alevlenmeyok ve tedavide değişiklik gerektiren bir yan etki yok. ##Tam kontrol edilen astım: belirti yok, kısa etkili beta-agonist kullanımı yok, akciğer fonksiyonu beklenenin %80'ine eşit veya büyük, gece uyanma yok, alevlenme yok, tedavidedeğişiklik gerektiren bir yan etki yok. Başka iki çalışmada tek başına inhale kortikosteroid kullanımıyla karşılaştırıldığında salmeterol/flutikazon propiyonat ile akciğer fonksiyonunda düzelme ve belirtilerin görülmediğigünlerin yüzdesinde artma, kurtarıcı ilaç kullanımında azalma ve % 60 daha düşük inhalekortikosteroid dozu kullanma şeklinde iyileşme görülürken bronşiyal biyopsi ve bronkoalveolarlavaj ile ölçülen altta yatan havayolu enflamasyonunun kontrolü de devamlılık göstermiştir. İlave çalışmalar, salmeterol/flutikazon propiyonatın tek tek bileşenleri ve plasebo ile karşılaştırıldığında salmeterol/flutikazon propiyonatın anlamlı derecede astım belirtilerini veakciğer fonksiyonlarını iyileştirdiğini ve kurtarıcı ilaç kullanımını azalttığını göstermiştir.GOAL çalışmasının sonuçları bu sonlanma noktalarında salmeterol/flutikazon propiyonat ilegörülen iyileşmenin en az 12 ay devam ettiğini göstermiştir. KOAH Kısa etkili beta2-agonistlerine % 10 reversibilite kısıtlaması olmayan semptomatik KOAH hastaları: Altı ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/250 mikrogram ve 50/500 mikrogram'lık salmeterol/flutikazon propiyonatın düzenli kullanımının akciğer fonksiyonunuhızlı ve anlamlı derecede düzelttiğini, nefes darlığını ve rahatlatıcı ilaç kullanımını anlamlıderecede azalttığını göstermiştir. Aynı zamanda hastaların sağlık durumunda da anlamlıderecede düzelme olmuştur. Kısa etkili beta2-agonistlerine %10'dan daha az reversibilite gösteren semptomatik KOAH hastaları: 6 ve 12 ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/500 mikrogram salmeterol/flutikazon propiyonatın düzenli kullanımının akciğer fonksiyonunu hızlı ve anlamlıderecede düzelttiğini, nefes darlığını ve rahatlatıcı ilaç kullanımını anlamlı derecede azalttığınıgöstermiştir. 12 aylık periyod boyunca KOAH alevlenme riski ve ilave oral kortikosteroidihtiyacı anlamlı derecede azalmıştır. Aynı zamanda hastaların sağlık durumunda da anlamlıderecede düzelme olmuştur. Salmeterol/flutikazon propiyonat 50/500 mikrogram hem tedavi sırasında sigara içen, hem de sigarayı bırakmış hastalarda akciğer fonksiyonunu ve sağlık durumunu düzeltmede ve KOAHalevlenme riskini azaltmada etkili bulunmuştur. TORCH çalışması (TOwards a Revolution in COPD Health; KOAH'ta devrime doğru):TORCH, KOAH hastalarında, günde 2 kez 50/500 mikrogram salmeterol/flutikazonprop^^onat, günde 2 kez 50 mikrogram salmeterol, günde 2 kez 500 mikrogram FP (flutikazonpropiyonat) veya plasebo ile yapılan tedavinin tüm nedenlere bağlı ölümler üzerindeki etkisinideğerlendirmek için yapılan 3 yıllık bir çalışmadır. Başlangıç (bronkodilatörden önce) FEVı 'ibeklenen normal değerin % 60'ından az olan orta-şiddetli ve şiddetli KOAH hastaları çift-körtedavi almak üzere randomize edilmiştir. Çalışma boyunca, diğer inhale kortikosteroidler, uzunetkili bronkodilatörler ve uzun süre sistemik kortikosteroidler dışında, her zamanki KOAHtedavilerini almalarına izin verilmiştir. Üç yıllık hayatta kalma durumu, çalışmadan çıkıpçıkmadıklarına bakılmaksızın hastaların tümü için tespit edilmiştir. Başlıca sonlanma noktası,plaseboya kıyasla salmeterol/flutikazon propiyonat için 3 yılda tüm nedenlere bağlı ölümlerinazaltılmasıdır (Tablo 1).Tablo 1
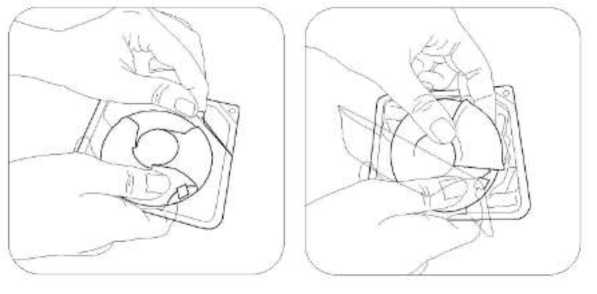
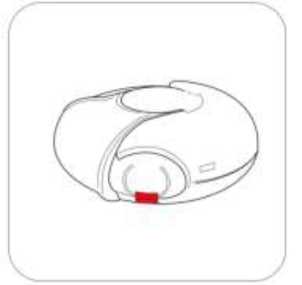
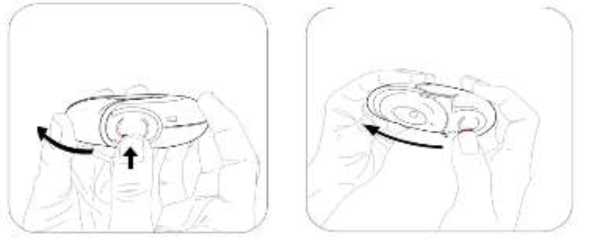
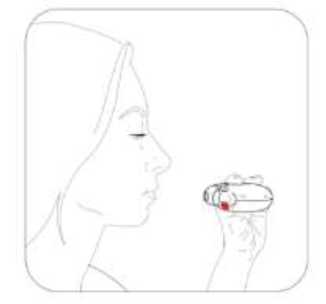
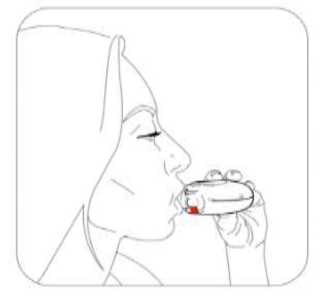
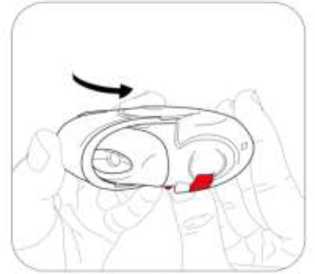
Salmeterol/flutikazon propiyonat, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskini % 17.5 oranında azaltmıştır (Risk Oranı 0.825 (% 95 GA 0.68, 1.00, p = 0.052; tümüara analizler için ayarlanmıştır). Plaseboya kıyasla, üç yıllık süre içinde herhangi bir zamandaherhangi bir nedenden dolayı şekillenen ölümlerde, salmeterol ile % 12 azalma (p = 0.180) veFP ile % 6 artış (p = 0.525) olmuştur (Tablo 1).Cox 'un Orantısal Risk modelinin kullanıldığı destekleyici bir analiz, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskinde % 19 azalma gösteren salmeterol/flutikazonpropiyonat için 0.811'lik (%95 GA 0.670, 0.982, p = 0.031) bir risk oranı olduğunugöstermiştir. Model önemli faktörler (sigara içme durumu, yaş, cinsiyet, bölge, başlangıç FEV1ve Vücut Kitle İndeksi) için ayarlanmıştır. Tedavi etkilerinin bu faktörlere göre değiştiğine dairkanıt yoktur (Tablo 1).Üç yıl içinde KOAH'a bağlı nedenlerden dolayı ölen hastaların yüzdesi plasebo için % 6.0, salmeterol için % 6.1, FP için % 6.9 ve salmeterol/flutikazon propiyonat için % 4.7'dir(Tablo1).Plaseboya kıyasla salmeterol/flutikazon prop^^onat, orta şiddetli ve şiddetli alevlenmeleri % 25 (% 95 GA: % 19 ve % 31 arasında; p < 0.001) oranında azaltmıştır. Salmeterol/flutikazonpropiyonat alevlenme oranını, salmeterol ile karşılaştırıldığında % 12 (% 95 GA: % 5 ve % 19arasında; p = 0.002), FP ile karşılaştırıldığında da % 9 (% 95 GA: % 1 ve % 16 arasında; p= 0.024) oranında azaltmıştır. Plaseboya kıyasla salmeterol ve FP alevlenme oranını anlamlıderecede sırasıyla % 15 (% 95 GA: % 7 ve % 22 arasında; p < 0.001) ve % 18 (% 95 GA: %11 ve % 24 arasında; p < 0.001) oranında azaltmıştır.St George Solunum Anketi (SGSA) ile ölçülen Sağlıkla İlişkili Yaşam Kalitesi, plaseboya kıyasla tüm aktif tedavi yöntemleri ile düzelmiştir. Üç yıl boyunca salmeterol/flutikazon propiyonat ilesağlanan ortalama düzelme plaseboya kıyasla - 3.1 birim (% 95 GA: - 4.1 ve - 2.1 arasında; p< 0.001), salmeterole kıyasla - 2.2 birim (p < 0.001) ve FP'ye kıyasla - 1.2 birimdir (p = 0.017).Üç yıllık tedavi süresi boyunca, FEV1 değerleri salmeterol/flutikazon propiyonat ile tedavi edilenlerde plasebo ile tedavi edilenlerden daha yüksektir (3 yıl boyunca ortalama fark 92 ml,% 95 GA: 75 - 108 ml; p < 0.001). FEV1'i düzeltmede salmeterol/flutikazon propiyonatsalmeterolden veya FP'den daha etkilidir (salmeterol için ortalama fark 50 ml, p < 0.001 veFP icin 44 mL 'dir, p < 0.001).Advers olay olarak bildirilen pnömoninin 3 yıllık tahmini olasılığı plasebo için % 12.3, salmeterol için % 13.3, FP için % 18.3 ve salmeterol/flutikazon propiyonat için % 19.6'dır(Salmeterol/flutikazon propiyonatın plaseboya karşı risk oranı: 1.64, % 95 GA: 1.33 ve 2.01arasında, p < 0.001). Pnömoni ile ilişkili ölümlerde artış olmamıştır; tedavi sırasında birincilolarak pnömoniye bağlı oldukları düşünülen ölümler plasebo için 7, salmeterol için 9, FP için13 ve salmeterol/flutikazon propiyonat için 8 olarak tespit edilmiştir. Kemik kırılmaolasılığında anlamlı farklılık yoktur (plasebo % 5.1, salmeterol % 5.1, FP % 5.4 vesalmeterol/flutikazon propiyonat %6.3; plaseboya karşı salmeterol/flutikazon propiyonat içinrisk oranı: 1.22, % 95 GA: 0.87 ve 1.72 arasında, p = 0.248). Göz bozuklukları, kemikbozuklukları ve hipotalamus hipofiz-adrenal eksen bozuklukları ile ilgili advers olaylarıninsidansı düşüktür ve tedaviler arasında farklılık gözlenmemiştir. Salmeterol alan tedavigruplarında kardiyak advers olaylarında artış olduğuna dair kanıt yoktur.5.3. Klinik öncesi güvenlilik verileriSalmeterol ksinafoat ve flutikazon propiyonat hayvanlar üzerinde yapılan toksisite testlerinde oldukça kapsamlı bir şekilde değerlendirilmiştir. Belirgin toksisite sadece insan kullanımı içintavsiye edilen dozlar aşıldığında oluşmuştur ve bunlar güçlü beta2-adrenoreseptör agonistlerinve glukortikosteroidlerin kullanılmasıyla beklenen etkilerle uyumludur. Uzun süreli çalışmalarda salmeterol ksinafoat sıçan mezovaryumunun ve fare uterusunun düz kaslarında benign tümörlerin oluşumuna yol açmıştır. Kemirgenler farmakolojik olarak indüklenen bu tümörlerin oluşumuna duyarlıdır. Salmeterolün insanlarda onkojenik yönden anlamlı bir risk oluşturduğu düşünülmemektedir. Salmeterol ve flutikazon propiyonatın yüksek dozlarda birlikte uygulanması, bazı kardiyovasküler etkileşimlere yol açmıştır. Sıçanlarda görülen hafif derecede atriyal miyokarditve fokal koroner arterit, normal dozların verilmesiyle düzelen geçici etkilerdir. Köpeklerde,salmeterolün tek başına verilmesi ile karşılaştırıldığında, birlikte yapılan uygulamalarınardından kalp atım hızındaki artışlar daha fazladır. Hayvanlarda, birlikte yapılan uygulamalar, ilaç sınıfları ile ilişkili diğer toksisitelerde bir değişikliğe neden olmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLaktoz 6.2. GeçimsizliklerGeçerli değildir. 6.3. Raf ömrü18 ay 6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında ve kuru yerde saklayınız. 6.5. Ambalajın niteliği ve içeriği60 dozluk inhalasyon için toz içeren blister, inhalasyon cihazında karton kutuda, kullanma talimatı ile birlikte sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİCeltis İlaç San. Ve Tic. A.Ş. Esenler / İstanbul Tel: 0850 201 23 23Faks: 0212 481 61 11e-mail: [email protected] 8. RUHSAT NUMARASI (LARI)17.05.2023 - 2023/188 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 11.08.2011 Ruhsat yenileme tarihi: 07.11.2017 10. KÜB'ÜN YENİLENME TARİHİInhalasyon cihazı kullanım talimatlarıKarton kutuda piyasaya sunulan inhalasyon cihazı güvenlik amaçlı koruyucu ambalaj içerisinde yer almaktadır. İnhalasyon cihazınızı kullanmadan önce şekilde gösterildiği gibi ambalajından çıkarınız. İnhalasyon cihazı, ambalajdan çıkardığınızda kapalı durumda olacaktır. Kullanılmamış bir inhalasyon cihazı içinde ayrı ayrı korunmuş olarak toz halde 60 dozluk ilaç bulunur. Doz göstergesi, inhalasyon cihazı içinde kaç doz ilaç kaldığını gösterir. Her doz tamolarak ölçülmüş olup hijyenik şartlara uygun olarak korunmaktadır. Bakıma veya yenidendoldurmaya gerek yoktur. İnhalasyon cihazını kullanmak kolaydır. İlacı alacağınız zaman yapacaklarınız aşağıdaki üç basamakta gösterilmiştir. 1. Açma 2. İçine çekme 3. Kapatma SULPRİA DİSCAİR İnhalasyon Cihazı Nasıl Çalışır?Kırmızı düğmeye (çocuk kilidi) basılarak dış kapak itilir. Dış kapak itilince ağızlık içinde küçük bir delik açılır ve bir dozluk ilaç inhale edilmek için hazırdır. İnhalasyon cihazı kapatılınca dışkapak ilk pozisyonuna döner ve bir sonraki kullanım için hazır hale gelir. Dış kapak,kullanılmadığı zamanlarda inhalasyon cihazını korur. 1.Açma-İnhalasyon cihazını nasıl kullanmalısınız?İnhalasyon cihazını açmak ve inhalasyon için hazır hale getirmek için kırmızı düğmeye basarak dış kapağı itmeniz yeterli olacaktır. İnhalasyon cihazını ağızlığı size dönük olacak şekildetutunuz. İnhalasyon cihazı artık kullanıma hazırdır. Dış kapağın her açılışında inhalasyon içinbir doz hazır hale gelir. Bu doz göstergesinde görülür. İlacı ziyan etmemek için dış kapak ileoynamayınız. 2.İçine çekmeİlacı içinize çekmeden önce bu bölümü dikkatli bir şekilde okuyunuz. İnhalasyon cihazını ağzınızdan uzak tutunuz. Nefesinizi rahatça yapabildiğiniz kadar dışarı veriniz. Unutmayınız-asla inhalasyon cihazının içine nefes vermeyiniz. Ağızlığı dudaklarınıza yaslayınız. Uzun ve derin nefes alınız-nefesi burnunuzdan değil, inhalasyon cihazının içinden alınız. inhalasyon cihazını ağzınızdan uzaklaştırınız. 10 saniye veya rahatça tutabildiğiniz kadar uzun bir süre nefesinizi tutunuz. Yavaşça nefes veriniz. 3.Kapatma İnhalasyon cihazını kapatmak için dış kapağı ilk pozisyonuna kaydırmanız yeterlidir. İnhalasyon cihazı yeniden kullanıma hazır hale gelmiştir. Eğer iki inhalasyon almanız tavsiye edildiyse 1'den 3'e kadar olan basamakları tekrar etmelisiniz. UNUTMAYINIZ!İnhalasyon cihazını kuru tutunuz. Kullanılmadığı zaman kapalı tutunuz. İnhalasyon cihazının içine asla nefes vermeyiniz. Dış kapağı ilacı almaya hazır olduğunuzda açınız.Söylenen dozdan daha fazla almayınız. |
İlaç BilgileriSulpria Discair 50 Mcg/100 Mcg İnhalasyon TozuEtken Maddesi: Salmeterol Ksinafoat, Flutikazon Propiyonat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.