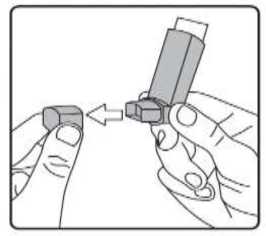
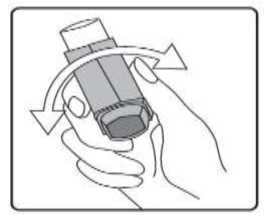
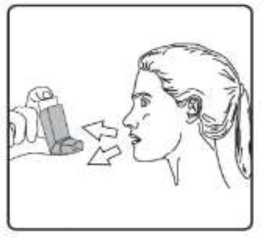
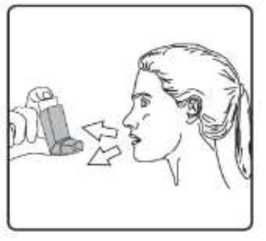
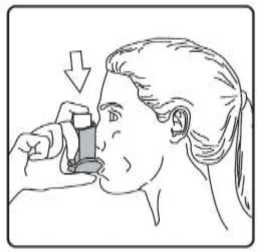
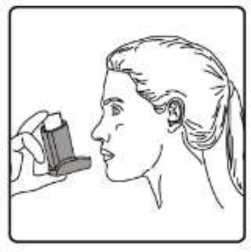
Sulpria 25 Mcg/125 Mcg Aerosol İnhalasyonu, Süspansiyon Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERİ TIBBİ ÜRÜNÜN ADISULPRİA 25 mcg /125 mcg Aerosol İnhalasyonu, Süspansiyon 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Salmeterol ksinafoat* 36,25 mcg Flutikazon propiyonat 125,00 mcg *: 25 mcg Salmeterol'e eşdeğer Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon için aerosol. Alüminyum inhaler kabı içinde basınçlı propellant gaz ile doldurulmuş süspansiyon. Alüminyum konteynere bir dozlam valfi eklidir. 4. KLINIK ÖZELLIKLER4.1. Terapötik endikasyonlarAstım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAH olgularındasemptomları ve atak sıklığını azaltır. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Hastalara semptomların görülmediği zamanlar da dahil olmak üzere, SULPRİA'nın optimum yarar sağlamak üzere günlük olarak kullanılması gerektiği yönünde bilgi verilmelidir. Hastalar düzenli olarak bir doktor tarafından değerlendirilmeli, aldıkları SULPRİA dozunun optimum düzeyde kalması sağlanmalı ve doz sadece doktor önerisi ile değiştirilmelidir. Doz,belirtileri etkili olarak kontrol eden en düşük doza ayarlanmalıdır. Günde iki kez uygulanan endüşük kombinasyon dozajıyla semptomların kontrolü sağlandığında, bir sonraki adımda inhalekortikosteroidin tek başına kullanımı test edilmelidir. Alternatif olarak, uzun süre etkili beta-2 agonistlerinin kullanılması gereken hastalar, reçete eden hekimin görüşüne göre hastalık kontrolünü sağlamakta yeterli olacağı düşünülüyorsa, günde birkez SULPRİA alacak şekilde de titre edilebilirler. Hastada gece görülen semptom öyküsü varsa vegünde bir kez dozlam uygulanıyorsa, doz geceleri verilmeli; hastada genellikle gündüz görülensemptom öyküsü varsa, doz sabahları verilmelidir. Hastalara hastalıklarının şiddetine göre uygun flutikazon propiyonat dozu içeren SULPRİA verilmelidir. Not: SULPRİA 25 mikrogram/ 50 mikrogram dozu şiddetli astımı olan erişkinlerde ve çocuklarda kullanıma uygun değildir. Reçete eden hekim, astımlı hastalarda flutikazon propiyonatınmikrogram cinsinden günlük dozun yaklaşık yarısı kadar dozda diğer inhale steroidler kadar etkinolduğunun bilincinde olmalıdırlar. Örneğin, 100 mcg flutikazon propiyonat yaklaşık 200 mcgbeklometazon dipropiyonata (CFC içeren) veya budesonide eşdeğerdir. Bireysel olarak bir hastada önerilen rejimin dışında dozajların gerekmesi durumunda, uygun beta-agonisti ve/veya kortikosteroid dozları reçete edilmelidir. Tavsiye edilen dozlar: AstımErişkinler ve 12 yaş ve üstündeki adolesanlar: Günde iki kez iki inhalasyon halinde 25 mikrogram salmeterol ve 50 mikrogram flutikazon propiyonat. Veya günde iki kez iki inhalasyon halinde 25 mikrogram salmeterol ve 125 mikrogram flutikazon propiyonat Veya günde iki kez iki inhalasyon halinde 25 mikrogram salmeterol ve 250 mikrogram flutikazon propiyonat. Astımın hızlı şekilde kontrol edilmesi gereken orta dereceli inatçı astımı olan erişkin veya adolesan hastalarda (hastanın günlük semptomlarına, günlük kurtarma ilacı kullanımına ve orta ila şiddetlihava yolu sınırlamasına göre tanımlanır), kısa süreli bir SULPRİA denemesi başlangıç tedavisiolarak kabul edilebilir. Bu durumlarda, önerilen başlangıç dozu günde iki kez iki inhalasyon olarak25 mikrogram salmeterol ve 50 mikrogram flutikazon propiyonattır. Astım kontrolü sağlandığında,tedavi tekrar gözden geçirilmeli ve hastaların tek başına inhale kortikosteroid alacak şekildedozlarının azaltılması düşünülmelidir. Tedavide doz azaltılırken hastaların düzenli olarakincelenmesi önemlidir. Bir veya iki hastalık şiddeti kriteri eksik olduğunda, başlangıç tedavisi olarak tek başına inhale flutikazon propiyonat kullanımına kıyasla net bir yarar gösterilmemiştir. Genel olarak inhalekortikosteroidler hastaların büyük çoğunluğunda birinci basamak tedavi olmaya devam etmektedir.SULPRİA'nın hafif astımın ilk tedavisinde kullanımı amaçlanmamaktadır. SULPRİA 25mikrogram /50 mikrogram dozları, şiddetli astımı olan çocuklarda ve erişkinlerde kullanıma uygundeğildir; şiddetli astım hastalarında herhangi bir sabit kombinasyonun kullanılmasından önceuygun inhale kortikosteroid dozunun gösterilmesi önemlidir. Kronik Obstrüktif Akciğer Hastalığı (KOAH)Yetişkinler: Yetişkin hastalar için tavsiye edilen doz günde 2 kez 2 inhalasyon 25/125 mikrogram - 25/250 mikrogram salmeterol/flutikazon propiyonattır. Günde iki kez alınan toplam 50/500 mikrogramlıkmaksimum salmeterol/flutikazon propiyonat dozunun tüm nedenlere bağlı ölümleri azalttığıgösterilmiştir (bkz.5.1 Klinik Çalışmalar).Hastalara inhaleri nasıl kullanacakları ve bakımını nasıl yapacakları konusunda bilgi verilmeli ve inhale ilacın akciğerlere optimum dağıtımını sağlamak üzere kullanım teknikleri kontroledilmelidir. Hasta inhaleri kullanmada sıkıntı yaşarsa, bir ara hazne (spacer cihazı) kullanabilir.Spacer cihazlarının değiştirilmesi akciğerlere giden doz miktarında değişiklik meydanagetirebileceğinden, hastalar aynı tip spacer cihazını kullanmaya devam etmelidirler. Bir spacer cihazı kullanılmaya başlandığında veya cihaz değiştirildiğinde daima tekrar en düşük doz titrasyonu gerçekleştirilmelidir. 12 yaşın altındaki çocuklar aerosol püskürtmeyi, nefes alma ile senkronize hale getirme konusunda güçlükler yaşayabilir. Püskürtmeyi, nefes alma ile koordine etme konusunda güçlükler yaşayanveya yaşama ihtimali olan hastalarda SULPRİA ile birlikte bir ara hazne (spacer cihazı) kullanımıtavsiye edilir. Uygulama şekli:SULPRİA, sadece inhalasyon şeklinde kullanıma yöneliktir. Hastalara inhalerlerini doğru şekilde kullanmaları için bilgi verilmelidir. İnhalasyon sırasında, hastanın tercihen ayakta veya dik oturur konumda olması gerekir. İnhaler dikey şekilde kullanılmaküzere tasarlanmıştır. İnhalasyon cihazı kullanma talimatı için bakınız ekli talimat. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda dozun ayarlanmasına gerek yoktur. Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda SULPRİA kullanımına ilişkin bilgi yoktur. Pediyatrik popülasyon:4-12 yaş arası çocuklarda: Günde iki kez iki inhalasyon halinde 25 mikrogram salmeterol ve 50 mikrogram flutikazon propiyonat. Çocuklarda SULPRİA ile verilen maksimum onaylı flutikazon propiyonat dozu, günde iki kez 100 mcg'dir. 4 yaşından küçük çocuklarda SULPRİA kullanımına ilişkin veri yoktur. Geriyatrik popülasyon:Yaşlı hastalarda dozun ayarlanmasına gerek yoktur. 4.3. KontrendikasyonlarSULPRİA, etkin madde veya yardımcı maddelerden birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleri- Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astımile ilgili solunum problemleri meydana gelebilir. - SULPRİA, astım hastalığının başlangıç tedavisi için önerilmez. - Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalıve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasındahastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. - İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediatrik ve adölesan hastalarda,her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzun etkili betaagonist içeren bir kombinasyon preparatı kullanılması önerilir. - Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astımşikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. - Astım tedavisinde normalde kademeli bir program izlenmeli ve hasta yanıtı klinik olarak veakciğer fonksiyon testleriyle izlenmelidir. - SULPRİA hızlı ve kısa etkili bir bronkodilatörün gerektiği akut astım semptomlarının tedavisindekullanılmamalıdır. Hastalara her zaman bir akut astım atağı durumunda semptomlarınhafifletilmesinde kullanılmak üzere ilaçlarını yanlarında bulundurmaları söylenmelidir. - Hastalarda bir alevlenme sırasında veya anlamlı şekilde kötüleşen veya akut şekilde şiddetlenenastım hastalıkları varsa SULPRİA tedavisi başlatılmamalıdır. - SULPRİA ile tedavi sırasında ciddi astım kaynaklı yan etkiler ve alevlenmeler meydana gelebilir.SULPRİA tedavisine başlandıktan sonra astım semptomları kontrol edilmezse veya kötüleşirsehastalara tedaviye devam etmeleri, ancak doktorlarına danışmaları gerektiği söylenmelidir. -Astım semptomlarının hafifletilmesi için kısa etkili bronkodilatörlerin artan kullanımı astımkontrolünün kötüleştiğini göstermektedir ve hasta, bir hekim tarafından incelenmelidir.- Astım kontrolündeki ani ve progresif bir kötüleşme potansiyel anlamda yaşamı tehdit edicidir vehastalar acil tıbbi yardım almalıdır. Kortikosteroid tedavisi dozunun artırılması düşünülmelidir.Hasta ayrıca mevcut SULPRİA dozunun yeterli astım kontrolü sağlayamadığı durumlarda tıbbiaçıdan incelenmelidir. Ek kortikosteroid tedavilerinin kullanımı düşünülmelidir. - Astım semptomları kontrol edildiğinde SULPRİA dozunun kademeli şekilde azaltılmasıdüşünülmelidir. Tedavi dozu azaltılırken hastaların düzenli şekilde incelenmesi önemlidir.SULPRİA'nın en düşük etkin dozu kullanılmalıdır. SULPRİA ile tedavi aniden kesilmemelidir. - Tüm inhale ilaç içeren kortikosteroidlerde olduğu gibi SULPRİA, akciğer tüberkülozlu hastalardadikkatli şekilde kullanılmalıdır. - Seyrek olarak SULPRİA yüksek terapötik dozlarda kardiyak aritmi (örn, supraventrikülertaşikardi, ekstrasistol ve atrial fibrilasyon) ve serum potasyumda hafif geçici bir düşmeye nedenolabilir. Bu nedenle SULPRİA şiddetli kardiyovasküler bozukluk, kalp ritim anomalileri, diabetesmellitus, tirotoksikoz, düzeltilmemiş hipokalemi veya düşük serum potasyum düzeylerine eğilimliolan hastalarda dikkatli şekilde kullanılmalıdır. - Seyrek olarak kan glukoz düzeylerinde artışlar bildirilmiş olup, diabetes mellitus öyküsü olanhastalara bu ilaç reçete edilirken bu dikkate alınmalıdır. - Diğer inhalasyon tedavilerinde olduğu gibi, dozlamdan sonra hırıltıda hızlı bir artışla paradoksikalbronkospazm meydana gelebilir. SULPRİA derhal kesilmeli, hasta değerlendirilmeli vegerektiğinde alternatif tedaviye başlanmalıdır. - Özellikle adrenal fonksiyonun önceki sistemik steroid tedavisi nedeniyle bozulduğunundüşünülmesi için herhangi bir gerekçe mevcutsa, hastalar SULPRİA tedavisine geçirilirken dikkatliolunmalıdır. - Özellikle uzun süreli periyotlarda önerilenden yüksek dozlarda olmak üzere tüm inhalekortikosteroid ilaçlarla sistemik etkiler meydana gelebilir. Bu etkiler oral kortikosteroidlere kıyaslaçok daha seyrek meydana gelmektedir. Olası sistemik etkiler Cushing sendromu, Cushingoidözellikleri, adrenal süpresyonu, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineralyoğunluğu, katarakt ve glokomu içermektedir. Bu nedenle hastaların düzenli şekilde incelenmesive inhale kortikosteroid dozunun astımın etkinlik kontrolünün sürdürüldüğü en düşük dozaindirilmesi önemlidir. - Salmeterol ve flutikazon propiyonatın sistemik emilimi büyük ölçüde akciğerlerdegerçekleşmektedir. Bir ölçülü doz inhaler ile bir spacer cihazının kullanımı akciğerlere ilaçsalınımını arttırabildiğinden, bunun sistemik yan etki riskinde bir artışa neden olma potansiyeliolduğu göz önünde bulundurulmalıdır. - İnhale flutikazon propiyonat tedavisinin yararları oral steroid ihtiyacını minimize edecektir, ancakoral steroidlerden bu ilaçla tedaviye geçirilen hastalarda uzun bir süre adrenal rezervde azalma riskidevam edebilir. Daha önce yüksek doz acil kortikosteroid tedavisine ihtiyaç duyan hastalar da riskliolabilir. Strese neden olması muhtemel acil ve elektif durumlarda daima rezidüel yetmezlikolasılığı göz önünde bulundurulmalı ve uygun kortikosteroid tedavisi düşünülmelidir. Adrenalyetmezlik boyutu, elektif prosedürlerden önce uzman önerisi gerektirebilir. Ritonavir plazmadakiflutikazon propiyonat konsantrasyonunu ciddi şekilde artırabilir. Bu nedenle, hasta için potansiyelyararı sistemik kortikosteroid yan etkileri riskinden daha yüksek olmadığı sürece eşzamanlıkullanımdan kaçınılmalıdır. Ayrıca flutikazon propiyonat ile diğer potent CYP3A inhibitörleribirlikte kullanıldığında sistemik yan etki riski artmaktadır. - Plaseboya kıyasla salmeterol/flutikazon propiyonat kombinasyonu alan Kronik ObstrüktifAkciğer Hastalığı (KOAH) bulunan hastalarda 3 yıllık bir çalışmada alt solunum yoluenfeksiyonları (özellikle pnömoni ve bronşit) daha sık bildirilmiştir. Üç yıllık KOAH çalışmasındayaşlı hastalar, daha düşük vücut kitle endeksi olan (< 25 kg/m2) hastalar ve çok şiddetli hastalığı(FEV1 beklenenin <%30'u) bulunan hastalarda, tedaviden bağımsız şekilde pnömoni gelişme riskien yüksek düzeydedir. Bu enfeksiyonların klinik özellikleri ve alevlenme sıklıkla aynı andameydana geldiğinden, hekimler KOAH hastalarında pnömoni ve diğer alt solunum yoluenfeksiyonlarının olası gelişimi konusunda dikkatli olmalıdır. Şiddetli KOAH bulunan hastadapnömoni gelişirse, SULPRİA ile tedavi yeniden değerlendirilmelidir. - Büyük ölçekli bir klinik çalışmada (Salmeterol Çok Merkezli Astım Araştırma Çalışması-SMART) veriler Afro-Amerikalı hastalarda, plaseboya kıyasla salmeterol kullanımı sırasındasolunum ile ilişkili ciddi olay veya ölüm riskinin daha yüksek olduğunu düşündürmüştür. Bu artışınfarmakogenetiğe veya diğer faktörlere bağlı olup olmadığı bilinmemektedir. Bu nedenle siyahAfrikalı veya Afro-Karayip kökenli hastalara, SULPRİA tedavisi sırasında astım semptomlarıkontrol edilmezse veya kötüleşirse tedaviye devam etmeleri gerektiği, ancak doktorlarınadanışmaları gerektiği söylenmelidir. - Eşzamanlı sistemik ketokonazol kullanımı, salmeterol maruziyetini anlamlı şekilde artırmaktadır.Bu sistemik etki insidansında (örn, QTc aralığında uzama ve palpitasyonlar) bir artışa nedenolabilir. Dolayısıyla, salmeterol tedavisinin yararları potansiyel anlamda artan sistemik yan etkiriskinden daha fazla olmadığı sürece ketokonazol veya diğer potent CYP3A4 inhibitörleri ileeşzamanlı tedaviden kaçınılmalıdır. Pediyatrik popülasyon- İnhale kortikosteroidlerin yüksek dozlarıyla hastalarda uzun süreli tedavi adrenal süpresyon ve akut adrenal krize neden olabilir. Yüksek flutikazon dozu (tipik olarak > 1000 mcg/gün) kullanançocuklar ve <16 yaşındaki adolesanlarda özellikle riskli olabilir. Çok seyrek vakalarda ayrıca 500ila <1000 mcg arasındaki flutikazon propiyonat dozlarıyla adrenal süpresyon ve akut adrenal kriztanımlanmıştır. Akut adrenal krizi tetikleme potansiyeli olan durumlar travma, cerrahi, enfeksiyonveya dozdaki herhangi bir hızlı azalmayı içermektedir. Görülen semptomlar tipik olarak belirsizdirve anoreksi, karın ağrısı, kilo kaybı, yorgunluk, baş ağrısı, bulantı, kusma, hipotansiyon, azalanbilinç düzeyi, hipoglisemi ve nöbetleri içerebilir. Stres veya elektif cerrahi periyotlarında eksistemik kortikosteroid kullanımı düşünülmelidir. KOAH hastalarında pnömoniKortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoni riskinde artışkanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarak gösterilmemiştir.Kortikosteroid içeren inhale ilaçların pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık içinkesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyla dikkatliolmalıdırlar. KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içimi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriSelektif ve selektif olmayan beta blokerler, kullanımları için güçlü gerekçeler olmadığı sürece astım hastalarında kullanılmamalıdır. Normal şartlar altında, bağırsak ve karaciğerde sitokrom P450 3A4 enziminin aracılık ettiği yoğun ilk geçiş metabolizması ve yüksek sistemik klirens nedeniyle inhale dozlamdan sonra flutikazonpropiyonatın düşük plazma konsantrasyonları elde edilmektedir. Bu nedenle flutikazon propiyonataracılı klinik açıdan anlamlı ilaç etkileşimleri muhtemel değildir. Sağlıklı deneklerde intranazal flutikazon propiyonat ile yapılan bir etkileşim çalışmasında, günde iki kez ritonavir (oldukça potent bir sitokrom P450 3A4 inibitörü) 100 mg dozu flutikazon propiyonat plazma konsantrasyonlarını yüzlerce kat artırmış ve serum kortizol konsantrasyonlarının belirgin şekilde azalmasına neden olmuştur. Bu etkileşime ilişkin bilgilerinhale flutikazon propiyonat için mevcut değildir, ancak flutikazon propiyonat plazma düzeyindebelirgin bir artış beklenmektedir. Cushing sendromu ve adrenal süpresyon vakaları bildirilmiştir.Yararları, artan sistemik kortikosteroid yan etkiler riskinden daha yüksek olmadığı sürece bukombinasyondan kaçınılmalıdır. Sağlıklı gönüllülerde yapılan küçük ölçekli bir çalışmada daha düşük potense sahip bir CYP3A inhibitörü olan ketokonazol, tek inhalasyondan sonra flutikazon propiyonat maruziyetini %150artırmıştır. Bu etki tek başına flutikazon propiyonata kıyasla plazma kortizol düzeyinde daha fazladüşüşe neden olmuştur. İtrakonazol gibi diğer potent CYP3A inhibitörleri ile birlikte tedavinin de,sistemik flutikazon propiyonat maruziyetini ve sistemik yan etki riskini artırması beklenmektedir.Dikkatli olunması ve bu ilaçlarla uzun süreli tedaviden mümkünse kaçınılması önerilmektedir. Salmeterol Potent CYP3A4 inhibitörleri 15 sağlıklı denekte 7 gün süreyle birlikte salmeterol (inhalasyon yoluyla günde iki kez 50 mcg) ve ketokonazol (oral yolla günde bir kez 400 mg) uygulanımı, plazma salmeterol maruziyetindeanlamlı bir artışa neden olmuştur (Cmaks 1.4 kat ve EAA 15 kat). Bu etki tek başına salmeterol veketokonazol tedavisine kıyasla salmeterol tedavisinin diğer sistemik yan etki insidansında (örn,QTc aralığında uzama ve palpitasyonlar) bir artışa neden olabilir. Kan basıncı, kalp hızı, kan glukoz ve kan potasyum düzeylerinde klinik açıdan anlamlı etkiler görülmemiştir. Ketokonazol ile birlikte uygulanımı, salmeterol eliminasyon yarı ömrünü veyatekrarlı dozlamla salmeterol birikimini artırmamıştır. Ketokonazol ile eşzamanlı kullanımından, tedavinin yararları salmeterolün artan sistemik yan etkiler riskinden daha yüksek olmadığı sürece kaçınılmalıdır. Diğer potent CYP3A4 inhibitörleriile benzer bir etkileşim riskinin olması muhtemeldir (örn, itrakonazol, telitromisin, ritonavir). Orta düzeyde CYP 3A4 inhibitörleri istatistiksel açıdan anlamlı olmayan bir artışa neden olmuştur (Cmaks 1.4 kat ve EAA 1.2 kat). Eritromisinin birlikte uygulanımı herhangi bir ciddi yan etki ile ilişkilendirilmemiştir. Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:İnhale kortikosteroid ile uzun süreli tedavi gören çocukların boyunun düzenli şekilde izlenmesi önerilmektedir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)SULPRİA'nın doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır. Gebelik dönemiGebelikte kullanım ile ilgili yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Kısım 5.3). İnsanlara yönelik potansiyel riskbilinmemektedir.İlaç kullanımı ancak anneye sağlaması beklenen yararı fetusa olan olası bir risktenfazla ise düşünülmelidir. Bu sınıftaki ilaçlarla ilgili geniş klinik deneyim, etkilerinin terapötik dozlarla ilişkili olduğuna dair bir kanıt ortaya koymamıştır. Ne salmeterol ksinafoatın ne de flutikazon propiyonatın genetiktoksisite potansiyeline sahip olduğu gösterilmiştir. Tek ilaç veya kombinasyon halindeki ilaçlarla hayvanlar üzerinde yapılan üreme toksisite çalışmaları, güçlü bir beta2-adrenoreseptör agonistinin ve glukokortikosteroidin aşırı sistemikmaruziyet seviyelerinde beklenen fötal etkilerini açığa çıkarmıştır. Laktasyon dönemiSalmeterol ksinafoat ve flutikazon propiyonatın gebelik ve emzirme döneminde kullanımı ile ilgili deneyimler yetersizdir. Emzirme döneminde tercihen kullanılmamalıdır. Salmeterol süte geçer. Terapötik dozlarda inhale edilen salmeterol ve flutikazon propiyonatın plazma düzeyleri çok düşüktür ve buna bağlı olarak anne sütündeki konsantrasyonların düşükolması muhtemeldir. Bu, sütünde düşük ilaç konsantrasyonları ölçülen emziren hayvanlar üzerindeyapılan çalışmalarla desteklenmiştir. Anne sütüyle beslenen yeni doğanlar/bebekler için mevcut risk göz ardı edilemez. Emzirmenin çocuk için ve tedavinin anne için faydası göz önünde bulundurularak emzirmeye veya SULPRİAtedavisine son verilmelidir. Üreme yeteneği/FertiliteVeri bulunmamaktadır. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerindeki etkilere ilişkin bir çalışma yapılmamıştır. 4.8. İstenmeyen etkilerSULPRİA salmeterol ve flutikazon propiyonat içerdiğinden, bileşiklerden her biriyle ilişkilendirilen tipte ve şiddette yan etkiler beklenebilir. İki bileşiğin eşzamanlı uygulanmasınıtakiben ek yan etki insidansı söz konusu değildir. Salmeterol/flutikazon propiyonat ile ilişkilendirilen yan etkiler aşağıda organ sistemi sınıfına ve frekansa göre liste halinde sunulmaktadır. Sıklıklar şu şekilde tanımlanmaktadır: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1000 ila <1/100), seyrek (>1/10.000 ila <1/1000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Çok yaygın, yaygın ve yaygın olmayan olaylar klinik çalışma verilerinden elde edilmiştir. Plasebo insidansı dikkate alınmamıştır. Çok seyrek olaylar pazarlama sonrası spontan verilerden elde edilmiştir. Enfeksiyonlar ve enfestasyonlarYaygın: Ağız ve boğazda kandidiyazis, bronşit, pnömoni (KOAH'lı hastalarda) Bağışıklık sistemi hastalıklarıYaygın olmayan: Deride aşırı duyarlılık reaksiyonları Çok seyrek: Anjiyoödem (temelde yüzde ve orofarinkste ödem), solunum semptomları (dispne ve/veya bronkospazm), anafilaktik şok dahil, anafilaktik reaksiyonlar Endokrin hastalıklarıÇok seyrek: Cushing sendromu, Cushingoid özellikleri, adrenal süpresyonu, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineral yoğunluğu Metabolizma ve beslenme hastalıklarıYaygın: Hipokalemi Çok seyrek: Hiperglisemi Psikiyatrik hastalıklarÇok seyrek: Anksiyete, uyku bozuklukları ve hiperaktivite ve iritabilite (temelde çocuklarda) davranış değişiklikleriBilinmiyor: Depresyon, huzursuzluk (çoğunlukla çocuklarda) Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısı Yaygın: Tremor Göz hastalıklarıÇok seyrek: Katarak, glokom Kardiyak hastalıklarYaygın: Palpitasyon Yaygın olmayan: TaşikardiÇok seyrek: Kardiyak aritmi (atrial fibrilasyon, supraventriküler taşikardi ve ekstrasistoller dahil) Solunum, göğüs bozuklukları ve mediastinal hastalıklarÇok yaygın: Nazofarenjit Yaygın: Boğaz irritasyonu, ses kısıklığı/disfoni, sinüzit, pnömoni (KOAH'lı hastalarda) Çok seyrek: Paradoksikal bronkospazm Deri ve deri altı doku hastalıklarıYaygın: Kontüzyonlar Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Kas krampları, travmatik özellikler Çok seyrek: Artralji, miyalji Seçilen advers etkilerin tanımlanması Beta2 agonist tedavisinin tremor, çarpıntı ve baş ağrısı gibi farmakolojik yan etkileri bildirilmiştir ancak bu etkiler geçici olma ve düzenli tedavi ile azalma eğilimi gösterir. Flutikazon propiyonat içerdiği için, bazı hastalarda ses kısıklığı ve ağızda kandidiyaz (pamukçuk) görülebilir. Ürünün kullanımından sonra suyla gargara yapılarak hem ses kısıklığı hem dekandidiyaz insidansı hafifletilebilir. Semptomatik kandidiyaz, SULPRİA kullanımına devamedilirken, topik anti-fungal ile tedavi edilebilir. Pediatrik popülasyon Olası sistemik etkiler Cushing sendromu, Cushingoid özellikler, adrenal süpresyon ve çocuklar ve ergenlerde büyüme geriliğidir. Çocuklarda, anksiyete, uyku bozuklukları ve hiperaktivite veirritabilite de dahil olmak üzere davranış değişiklikleri görülebilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr[email protected]. Doz aşımı ve tedavisiSULPRİA ile doz aşımına ilişkin klinik çalışmalardan elde edilmiş veri yoktur, ancak her iki madde ile doz aşımına yönelik veriler aşağıda sunulmaktadır: Salmeterol doz aşımının belirti ve semptomları tremor, baş ağrısı ve taşikardidir. Tercih edilen antidotlar, kardiyoselektif beta bloker maddelerdir, bu ilaçların bronkospazm öyküsü olanhastalarda dikkatli şekilde kullanılması gerekir. SULPRİA tedavisi ilacın beta agonistbileşenindeki doz aşımı nedeniyle kesilirse, uygun replasman steroid tedavisinin sağlanmasıdüşünülmelidir. Buna ek olarak hipokalemi meydana gelebilir ve potasyum replasmanıdüşünülmelidir. Akut: Önerilenden yüksek flutikazon propiyonat dozlarının akut inhalasyonu adrenal fonksiyonunda geçici süpresyona neden olabilir. Adrenal fonksiyonu birkaç günde normale döndüğünden (plazma kortizol ölçümleri doğrulamaktadır) bu doz acil tedavi gerektirmemektedir.İnhale flutikazon propiyonat ile kronik doz aşımı adrenal süpresyon riskini doğurmaktadır.Adrenal rezervin izlenmesi gerekli olabilir. Flutikazon propiyonat ile doz aşımı vakalarındasemptom kontrolü için uygun dozda SULPRİA tedavisine yine de devam edilebilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Kortikosteroidler ve diğer ilaçlar ile kombine adrenerjikler ATC Kodu: R03AK06 Salmeterol/flutikazon propiyonat astım klinik çalışmaları Uzun süreli astımlı 3416 erişkin ve adolesanda 12 aylık bir çalışmada (Optimal Astım Kontrolünün Sağlanması, OAKS) astım tedavisi hedeflerinin erişilebilir olup olmadığının belirlenmesi için, tekbaşına inhale kortikosteroidler (Flutikazon Propiyonat) ile salmeterol/flutikazon propiyonatınetkinlik ve güvenilirliği karşılaştırılmıştır. Tedavi dozu **Toplam kontrol sağlanana veya çalışmailacının en yüksek dozuna erişilene kadar 12 haftada bir artırılmıştır. OAKS salmeterol/flutikazonpropiyonat verilen daha fazla hastada, tek başına İKS verilen hastalara kıyasla astım kontrolüsağlandığı ve bu kontrolün daha düşük kortikosteroid dozunda elde edildiğini göstermiştir. İyi kontrollü astım tek başına İKS'ye kıyasla, salmeterol/flutikazon propiyonat ile daha hızlı şekilde elde edilmiştir. İlk bireysel iyi kontrollü haftanın elde edilmesi için deneklerin %50'sindekitedavi süresi salmeterol/flutikazon propiyonat için 16 gün ve İKS grubunda 37 gündü. Daha öncesteroid tedavisi görmeyen bir hasta alt grubunda bireysel iyi kontrollü haftaya kadar geçen süresalmeterol/flutikazon propionat ile 16 gün olurken, İKS ile 23 gündü. Genel çalışma bulguları aşağıdakileri göstermiştir:
>18 yaşındaki dirençli astım hastası 318 kişide yapılan bir çift kör, randomize, paralel gruplu çalışmada iki haftalık sürede günde iki kez iki inhalasyonla (çift doz) salmeterol/flutikazonpropiyonat kullanımmın güvenilirlik ve tolerabilitesi değerlendirilmiştir. Bu çalışma 14 güne kadarher salmeterol/flutikazon propiyonat dozu inhalasyonunun iki katına çıkarılmasının, günde iki keztek inhalasyona kıyasla beta agonist ile ilişkili yan etkilerde küçük bir artışa (tremor; 0'a karşı 1hasta [%1], palpitasyon; 1 hastaya [<%1] karşı 6 [%3], kas krampları; 1 [<%1] hastaya karşı 6[%3]) ve inhale kortikosteroid ile ilişkili yan etkilerde benzer bir insidansa neden olduğunugöstermiştir (örn, oral kandidiyazis; 16 hastaya [%8] karşı 6 [%6], ses kısıklığı; 4 hastaya [%2]karşı 2 [%2]). Salmeterol/flutikazon propiyonat dozunun ek kısa süreli (14 güne kadar) inhalekortikosteroid tedavisine ihtiyaç duyulan erişkin hastalarda iki katına çıkarılması düşünülürse, betaagonist ile ilişkili yan etkilerdeki küçük artış dikkate alınmalıdır. Salmeterol Çok Merkezli Astım Araştırma Çalışması (SMART) SMART çok merkezli, randomize, çift kör, plasebo kontrollü, paralel gruplu 28 haftalık bir çalışma olup ABD'de yapılan, hastanın normal astım tedavisinde ek olarak 13.176 hastanın salmeterol(günde iki kez 50 pg) ve 13.179 hastanın plasebo grubuna atandığı bir çalışmaydı. >12 yaşındaolan, astım tanısı konulan ve astım ilacı kullanmakta olan (ancak bir UESBA değil) hastalarçalışmaya dahil edilmiştir. Çalışma başlangıcında IKS kullanımı kaydedilmiş, ancak çalışmadabuna gerek duyulmamıştır. SMART çalışmasında primer sonlanma noktası, solunum ile ilişkiliölüm ve solunum ile ilişkili yaşamı tehdit eden olayların kombine sayısıydı.
SMART Çalışmasında Başlangıçta İnhale Steroidlerle İlişkili Temel Bulgular: Sekonder Sonlanma Noktaları
(*=plasebo grubunda hiç olay bulunmadığından hesaplanamamıştır. Koyu rakamla yazılan risk %95 düzeyinde istatistiksel olarak anlamlıdır. Yukarıdaki tablodaki sekonder sonlanma noktalarıtüm popülasyonda istatistiksel anlamlılığa erişmiştir). Kombine tüm nedenlere bağlı mortalite veyayaşamı tehdit edici deneyim, tüm nedenlere bağlı mortalite veya tüm nedenlere bağlı hastaneyeyatma sekonder sonlanma noktaları, tüm popülasyonda istatistiksel anlamlılığa erişmemiştir. KOAH Kısa etkili beta2-agonistlerine % 10 reversibilite kısıtlaması olmayan semptomatik KOAH hastaları: Altı ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/250 mikrogram ve 50/500 mikrogram'lık SULPRİA'nın düzenli kullanımının akciğer fonksiyonunu hızlı ve anlamlı derecededüzelttiğini, nefes darlığını ve rahatlatıcı ilaç kullanımını anlamlı derecede azalttığını göstermiştir.Aynı zamanda hastaların sağlık durumunda da anlamlı derecede düzelme olmuştur. Kısa etkili beta2-agonistlerine % 10'dan daha az reversibilite gösteren semptomatik KOAH hastaları: 6 ve 12 ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/500 mikrogram SULPRİA'nın düzenli kullammınm akciğer fonksiyonunu hızlı ve anlamlı derecede düzelttiğini,nefes darlığını ve rahatlatıcı ilaç kullanımım anlamlı derecede azalttığını göstermiştir. 12 aylıkperiyod boyunca KOAH alevlenme riski ve ilave oral kortikosteroid ihtiyacı anlamlı derecedeazalmıştır. Aynı zamanda hastaların sağlık durumunda da anlamlı derecede düzelme olmuştur.SULPRİA 50/500 mikrogram hem tedavi sırasında sigara içen, hem de sigarayı bırakmış hastalardaakciğer fonksiyonunu ve sağlık durumunu düzeltmede ve KOAH alevlenme riskini azaltmada etkilibulunmuştur. TORCH çalışması (TOwards a Revolution in COPD Health; KOAH'ta devrime doğru): TORCH, KOAH hastalarında, günde 2 kez 50/500 mikrogram SULPRİA Diskus/inhaler, günde 2 kez 50 mikrogram salmeterol Diskus/inhaler, günde 2 kez 500 mikrogram FP (flutikazonpropiyonat) Diskus/inhaler veya plasebo ile yapılan tedavinin tüm nedenlere bağlı ölümlerüzerindeki etkisini değerlendirmek için yapılan 3 yıllık bir çalışmadır. Başlangıç(bronkodilatatörden önce) FEV1'i beklenen normal değerin % 60'ından az olan orta-şiddetli veşiddetli KOAH hastaları çift-kör tedavi almak üzere randomize edilmiştir. Çalışma boyunca, diğerinhale kortikosteroidler, uzun etkili bronkodilatörler ve uzun süre sistemik kortikosteroidlerdışında, her zamanki KOAH tedavilerini almalarına izin verilmiştir. Üç yıllık hayattta kalmadurumu, çalışmadan çıkıp çıkmadıklarına bakılmaksızın hastaların tümü için tespit edilmiştir.Başlıca sonlanma noktası, plaseboya kıyasla SULPRİA için 3 yılda tüm nedenlere bağlı ölümlerinazaltılmasıdır. (Tablo 1)
1. birincil etkinlik karşılaştırılması üzerinde yapılmış 2 ara analizin sigara içme durumu açısından gruplandırılmış bir log-rank analizi için ayarlanmış P değeri, SULPRİA, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskini % 17.5 oranında azaltmıştır (Risk Oranı 0.825 (% 95 GA 0.68, 1.00, p = 0.052; tümü ara analizler içinayarlanmıştır). Plaseboya kıyasla, üç yıllık süre içinde herhangi bir zamanda herhangi bir nedendendolayı şekillenen ölümlerde, salmeterol ile % 12 azalma (p = 0.180) ve FP ile % 6 artış (p = 0.525)olmuştur. (Tablo 1) Cox'un Orantısal Risk modelinin kullanıldığı destekleyici bir analiz, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskinde % 19 azalma gösteren SULPRİA için 0.811'lik (% 95 GA0.670, 0.982, p = 0.031) bir risk oranı olduğunu göstermiştir. Model önemli faktörler (sigara içmedurumu, yaş, cinsiyet, bölge, başlangıç FEV1 ve Vücut Kitle İndeksi) için ayarlanmıştır. Tedavietkilerinin bu faktörlere göre değiştiğine dair kanıt yoktur. (Tablo 1) Üç yıl içinde KOAH'a bağlı nedenlerden dolayı ölen hastaların yüzdesi plasebo için % 6.0, salmeterol için % 6.1, FP için % 6.9 ve SULPRİA için % 4.7'dir. (Tablo 1) Plaseboya kıyasla SULPRİA, orta şiddetli ve şiddetli alevlenmeleri % 25 (% 95 GA: % 19 ve % 31 arasında; p < 0.001) oranında azaltmıştır. SULPRİA alevlenme oranını, salmeterol ilekarşılaştırıldığında % 12 (% 95 GA: % 5 ve % 19 arasında; p = 0.002), FP ile karşılaştırıldığındada % 9 (% 95 GA: % 1 ve % 16 arasında; p = 0.024) oranında azaltmıştır. Plaseboya kıyaslasalmeterol ve FP alevlenme oranını anlamlı derecede sırasıyla % 15 (% 95 GA: % 7 ve % 22arasında; p < 0.001) ve % 18 (% 95 GA: % 11 ve % 24 arasında; p < 0.001) oranında azaltmıştır.St George Solunum Anketi (SGSA) ile ölçülen Sağlıkla İlişkili Yaşam Kalitesi, plaseboya kıyaslatüm aktif tedavi yöntemleri ile düzelmiştir. Üç yıl boyunca SULPRİA ile sağlanan ortalamadüzelme plaseboya kıyasla - 3.1 birim (% 95 GA: - 4.1 ve - 2.1 arasında; p < 0.001), salmeterolekıyasla - 2.2 birim (p < 0.001) ve FP'ye kıyasla - 1.2 birimdir (p = 0.017). Üç yıllık tedavi süresi boyunca, FEV1 değerleri SULPRİA ile tedavi edilenlerde plasebo ile tedavi edilenlerden daha yüksektir (3 yıl boyunca ortalama fark 92 ml, % 95 GA: 75 - 108 ml; p < 0.001).FEV1'i düzeltmede SULPRİA salmeterolden veya FP'den daha etkilidir (salmeterol için ortalamafark 50 ml, p < 0.001 ve FP için 44 mL'dir, p < 0.001). Advers olay olarak bildirilen pnömoninin 3 yıllık tahmini olasılığı plasebo için % 12.3, salmeterol için % 13.3, FP için % 18.3 ve SULPRİA için % 19.6'dır (SULPRİA'nın plaseboya karşı risk oranı:1.64, % 95 GA: 1.33 ve 2.01 arasında, p < 0.001). Pnömoni ile ilişkili ölümlerde artış olmamıştır;tedavi sırasında birincil olarak pnömoniye bağlı oldukları düşünülen ölümler plasebo için 7,salmeterol için 9, FP için 13 ve SULPRİA için 8 olarak tespit edilmiştir. Kemik kırılma olasılığındaanlamlı farklılık yoktur (plasebo % 5.1, salmeterol % 5.1, FP % 5.4 ve SULPRİA % 6.3; plaseboyakarşı SULPRİA için risk oranı: 1.22, % 95 GA: 0.87 ve 1.72 arasında, p = 0.248). Göz bozuklukları,kemik bozuklukları ve hipotalamus-hipofiz-adrenal eksen bozuklukları ile ilgili advers olaylarıninsidansı düşüktür ve tedaviler arasında farklılık gözlenmemiştir. Salmeterol alan tedavigruplarında kardiyak advers olaylarında artış olduğuna dair kanıt yoktur. Etki mekanizması: SULPRİA, farklı etki şekline sahip salmeterol ve flutikazon propiyonat içermektedir. İki etkin maddenin ilgili etki mekanizmaları aşağıdaki gibidir: Salmeterol: Salmeterol reseptörün sekonder bağlanma bölgesine bağlanan uzun bir yan zincire sahip selektif uzun etkili (12 saat) bir beta-2-adrenoseptör agonisttir. Salmeterol klasik kısa etkili beta-2-agonistlerin önerilen dozlarına kıyasla, en az 12 saat süren daha uzun süreli bronkodilatasyon sağlar ve bu etki en az 12 saat sürer. Flutikazon propiyonat: Önerilen dozlarda inhalasyon yoluyla verilen flutikazon propiyonat, akciğerlerde bir glukokortikoid antienflamatuvar etkiye sahiptir ve bu etki, kortikosteroidler sistemik yollauygulandığında görülenden daha az yan etkiyle semptomlarda ve astım alevlenmelerinde azalmasağlamaktadır. 5.2. Farmakokinetik özelliklerGenel özelliklerSalmeterol ve flutikazon propiyonat inhalasyon yoluyla kombinasyon halinde uygulandığında her bileşenin farmakokinetiği, ilaçlar ayrı ayrı uygulandığında gözlenene benzerdi. Bu nedenlefarmakokinetik açıdan her bileşik ayrı ayrı ele alınabilir. Salmeterol: Emilim:Salmeterol akciğerde lokal olarak etki eder, bu nedenle plazma düzeyleri terapötik etkinin bir belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra çok düşük plazma konsantrasyonlarıgösterdiği için (yaklaşık 200 pg/ml veya daha az), plazmadaki ilaç miktarının tayini teknik olarakzor olduğundan salmeterolün farmakokinetiği ile ilgili sadece sınırlı veriler bulunmaktadır.Salmeterol ksinafoatın düzenli kullanımını takiben, hidroksinaftoik asit sistemik dolaşımda tayinedilebilir ve kararlı durum konsantrasyonları yaklaşık 100 ng/ml'ye ulaşır. Bu konsantrasyonlar,toksisite çalışmalarında gözlenen kararlı durum konsantrasyonlarından 1000 kez daha düşüktür.Hava yolu tıkanıklığı olan hastalarda uzun süreli düzenli kullanımında (12 aydan fazla) herhangibir zararlı etki görülmemiştir. Dağılım:Salmeterolün plazma proteinlerine bağlanma oranı % 96'dır. Biyotransformasyon:İn vitro bir çalışma salmeterolün sitokrom P450 (CYP3A4) tarafından büyük oranda a-hidroksisalmeterole (alifatik oksidasyon) metabolize edildiğini göstermiştir. Eliminasyon:Eliminasyon yarılanma ömrü 5.5 saattir. Salmeterol %60 dışkı ile, %25 idrar ile itrah edilir. Doğrusallık/ Doğrusal olmayan durum:Veri bulunmamaktadır. Flutikazon propiyonat: Emilim:Sağlıklı deneklerde inhalasyon yoluyla alınan tek doz flutikazon propiyonatın mutlak biyoyararlanımı, kullanılan inhalasyon cihazına göre nominal dozun yaklaşık %5-11'i arasındadeğişmektedir. Astımlı hastalarda inhale flutikazon propiyonata sistemik maruziyetin daha düşükbir düzeyi gözlenmiştir. Sistemik emilim temelde akciğerlerde meydana gelmekte olup, ilk başta hızlı ve sonrasında uzun sürelidir. İnhale dozun kalanı yutulabilir, ancak düşük suda çözünürlük ve presistemikmetabolizma nedeniyle sistemik maruziyete minimum katkıda bulunur ve oral biyoyararlanımının%1'den az olmasını sağlar. Dağılım:Flutikazon propiyonat kinetiği yüksek plazma klirensi (1150 mL/dak), kararlı durumda yüksek dağılım hacmi (yaklaşık 300 L) ve yaklaşık 8 saatlik terminal yarı ömürle karakterizedir. Plazma proteinine bağlanma oranı %91'dir. Biyotransformasyon:Flutikazon propiyonat sistemik dolaşımdan çok hızlı elimine edilmektedir. Temel yolak, sitokrom P450 enzim CYP3A4 tarafından inaktif karboksilik asit metabolitine metabolizasyondur. Ayrıcafeçeste tanımlanmamış diğer metabolitler tespit edilmektedir. Eliminasyon:Flutikazon propiyonatın renal klirensi önemsiz düzeydedir. Dozun %5'inden daha azı idrarda temelde metabolitler olarak atılmaktadır. Dozun büyük bir bölümü feçeste metabolitler vedeğişmemiş ilaç olarak atılmaktadır. Doğrusallık/ Doğrusal olmayan durum:Artan inhale dozla sistemik maruziyette doğrusal bir artış söz konusudur. 5.3. Klinik öncesi güvenlilik verileriHayvanlarda ayrı ayrı verilen salmeterol ksinafoat ve flutikazon propiyonat çalışmalarında görülen insanlarda kullanıma yönelik tek güvenilirlik sorunu, aşırı farmakolojik etkilerleilişkilendirilmiştir. Hayvan üreme çalışmalarında glukokortikosteroidlerin malformasyonlara (yarık damak, iskelet malformasyonları) neden olduğu gösterilmiştir. Bununla birlikte bu hayvan deneylerinin önerilendozların verildiği insanlar için anlamlı olduğu düşünülmemektedir. Salmeterol ksinafoat ile yapılanhayvan çalışmaları sadece yüksek maruziyet düzeylerinde embriyofetal toksisite göstermiştir. Birlikte uygulanımı takiben bilinen glukokortikoid kaynaklı anomalilerle ilişkilendirilen dozlarda, sıçanlarda artan transpoze umblikal arter ve ossipital kemikte eksik osifikasyon insidansı tespitedilmiştir. Kloroflorokarbon (CFC) olmayan itici Norfluranın iki yıllık periyotlarda günlük maruziyet uygulanan çok çeşitli hayvan türlerinde, hastaların bulunması muhtemel düzeylerden çok dahayüksek buhar konsantrasyonlarında toksik etki sergilemediği gösterilmiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiHFA134a 6.2. GeçimsizliklerBilinen geçimsizliği yoktur. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. Donmaktan ve doğrudan gün ışığından koruyunuz. Aerosol tüplerindeki bütün inhalasyon ilaçlarında olduğu gibi, terapötik etki aerosol tüpü soğukolduğunda azalabilir. Aerosol tüpü delinmemeli, boş olsa bile kırılmamalı veya yakılmamalıdır. 6.5. Ambalajın niteliği ve içeriğiSULPRİA 25 mcg /125 mcg Aerosol İnhalasyonu, Süspansiyon, 120 dozluk aerosol tüplerde karton kutuda kullanma talimatı ile birlikte sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir. İnhalerin test edilmesi:İlk kez kullanmadan önce, hastanın iki yanından hafifçe sıkarak ağızlık kapağını çıkarması, inhaleri iyice çalkalaması gerekir ve inhaleri parmakları arasında tutarak başparmağını alta, ağızlığın altkısmına yerleştirerek püskürtmelidir. Her bir püskürtmenin ardından inhaler derhalçalkalanmalıdır. Hasta inhaleri bir haftadan veya daha uzun süreden beri kullanılmamışsa, ağızlıkkapağını çıkarmalı, inhaleri iyice çalkalamalı ve havaya iki kez püskürtmelidir .İnhalasyon spreyinizi kullanacağınız zaman oturunuz veya ayakta dik durunuz. SULPRİA İnhaler'in kullanım talimatları1. Hasta kapağın iki yanından hafifçe sıkarak ağızlık kapağını çıkarmalıdır. 2. Hasta herhangi bir yabancı cisim olup olmadığını görmek üzere inhalerin içini ve dışını, ağızlıkkısmı da dahil olmak üzere kontrol etmelidir. 3. Hasta gevşek yabancı cisimleri gidermek ve inhalerin içeriğinin eşit şekilde karışmasınısağlamak üzere inhaleri iyice çalkalamalıdır. 4. Hasta inhaleri parmakları ve başparmağı arasında dik olarak tutmalı, başparmağı alt kısma,ağızlığın altına gelmelidir. 5. Hasta nefesini mümkün olduğunca uzun süreli olarak vermeli, ardından ağızlığı dişlerininarasına yerleştirerek dudaklarını etrafında kapatması gerekmektedir. Hastaya ağızlığı ısırmamasısöylenmelidir. 6. Hasta ağzından nefes almaya başladığı sırada halen düzenli ve derin şekilde nefes alır haldeykeninhalerin üst kısmına bastırarak SULPRİA püskürtmesini sağlamalıdır. 7. Hasta nefesini tuttuğu sırada inhaleri ağzından çıkarmalı ve parmağını inhalerin üstündençekmelidir. Hasta mümkün olduğunca uzun süre nefesini tutmalıdır. 8. İkinci bir inhalasyon uygulamak için hastanın inhaleri dik konumda tutması ve 3-7. adımlarıtekrarlamadan önce yaklaşık otuz saniye kadar beklemesi gerekmektedir. 9. Hastanın kapağı hafifçe iterek ve yerine oturtarak inhalasyondan hemen sonra ağızlık kapağınıgeri takmaları gerekmektedir. Kapak için aşırı kuvvet uygulamaya gerek yoktur, yerine oturacaktır. Hastanın 5, 6 ve 7. adımlara gelmek için acele etmemesi gerekmektedir. Hastanın inhaleri kullanmadan önce mümkün olduğunca yavaş şekilde nefes almaya başlaması önemlidir. Hasta ilkseferlerde ayna karşısına geçip pratik yapmalıdır. İnhalerden veya ağız kenarlarından buharçıktığını görmesi halinde 2. adımdan tekrar başlaması gerekmektedir. Temizlemeİnhalerinizi en az haftada bir kez temizlemeniz gerekmektedir. Ağızlık başlığını çıkarın. Tüpü plastik kabından çıkarmayın. Ağızlık kısmının içini ve dışını ve plastik kabı kuru bir bez veya mendille silin. Ağızlık başlığını doğru yönde geri takın. Kapak için aşırı kuvvet uygulamaya gerek yoktur, yerine oturacaktır. METAL AEROSOL TÜPÜNÜ SUYA SOKMAYINIZ. 7. RUHSAT SAHİBİCeltis İlaç San. Ve Tic. A.Ş.Esenler / İstanbul Tel: 0850 201 23 23Faks: 0212 481 61 11e-mail: [email protected] 8. RUHSAT NUMARASI (LARI)17.05.2023 - 2023/186 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 28.06.2012 Ruhsat yenileme tarihi: 11.12.2019 10. KÜB'ÜN YENİLENME TARİHİ1İyi kontrollü astım; ara sıra semptom görülmesi veya KESBA kullanımı veya beklenen akciğer fonksiyonunun %80'inden azı + gece uyanmaları yok, alevlenme ve tedavide bir değişikliğigerektiren yan etkiler yok. Tam astım kontrolü; semptom yok, KESBA kullanımı yok, beklenen akciğer fonksiyonunun >%80'i veya gece uyanmaları yok, alevlenme ve tedavide bir değişikliği gerektiren yan etkiler yok. Bu çalışmadaki bulgular günde iki kez salmeterol/flutikazon propiyonat 50/100 mcg dozunun, hızlı astım kontrolünün gerekli olduğu düşünülen orta şiddette dirençli astım hastalarında ilk idametedavisi olarak değerlendirilebileceğini düşündürmektedir. |
İlaç BilgileriSulpria 25 Mcg/125 Mcg Aerosol İnhalasyonu, SüspansiyonEtken Maddesi: Salmeterol Ksinafoat , Flutikazon Propiyonat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.