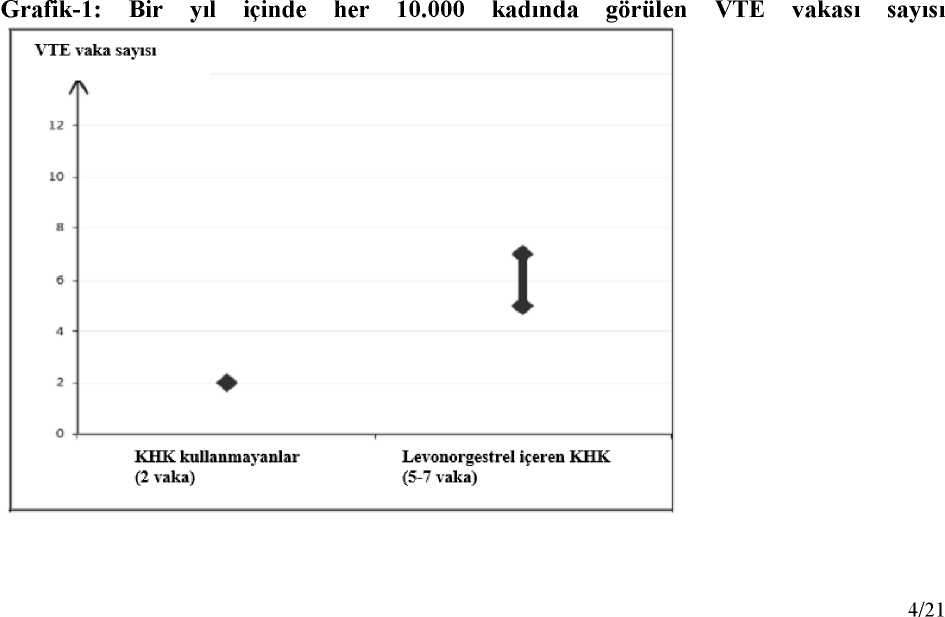
Microgynon 150 Mcg/30 Mcg Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BILGISI1. BEŞERI TIBBİ ÜRÜNÜN ADIMICROGYNON® 150 mcg/30 mcg kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeler:Her bir kaplı tablet 0,15 mg levonorgestrel ve 0,03 mg etinilestradiol içerir. Yardımcı maddeler:Laktoz monohidrat (sığır kaynaklı)....32,28 mg Sukroz................................................19,37 mg Yardımcı maddelerin tam listesi için 6.1'e bakınız. 3. FARMASÖTİK FORMKaplı tablet. Bej renkli tablet. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarOral kontrasepsiyon (doğum kontrolü). MICROGYNON reçete etme kararı, venöz tromboembolizmi (VTE) olan kadınlar başta olmak üzere her kadının mevcut risk faktörleri ve MICROGYNON ile ortaya çıkan VTEriskinin diğer kombine hormonal kontraseptifler (KHK) ile karşılaştırması (Bkz. Bölüm 4.3ve Bölüm 4.4) dikkate alınarak verilmelidir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Tabletler, blister ambalajda gösterilen sırada her gün yaklaşık olarak aynı saatte, gerekirse bir miktar sıvıyla birlikte oral yoldan alınmalıdır. Uygulama şekli:Oral kullanım İlk tedavi siklusu: Menstrüel siklusun ilk günü başlayarak 21 gün boyunca günde 1 tablet alınır. Kontraseptif koruma derhal başlar. Sonraki sikluslar: Bir sonraki MICROGYNON paketinden tablet alımına; tablet kullanılmayan 7 günlük aradan sonra, ilk paketle aynı günde başlayarak devam edilir. Tabletkullanılmayan dönemde genellikle çekilme kanaması gerçekleşir. 21 günlük kombine oral kontraseptiften geçiş: MICROGYNON'un ilk tableti bir önceki oral kontraseptif döngüsü bittikten sonraki ilk gün derhal alınmalıdır. Ek kontraseptif önlemalınması gerekmez. Kombine günlük haptan geçiş (28 günlük tabletler): MICROGYNON'a, günlük hap paketinin son aktif tableti alındıktan sonra başlanmalıdır. İlk MICROGYNON tableti bir sonraki günalınır. Bu durumda, ek kontraseptif önlem alınması gerekmez. Yalnız progestojen içeren haptan geçiş (POP): MICROGYNON'un ilk tableti, POP o gün alınmış olsa bile kanamanın ilk günü alınmalıdır. Ek kontraseptif önlem alınması gerekmez.Geri kalan yalnız progestojen içeren haplar atılmalıdır. Doğum veya kürtaj sonrası kullanım: Gebelikten sonra, hastanın tamamen ayağa kalkması ve puerperal komplikasyon olmaması kaydıyla, oral kontrasepsiyon vajinal doğumdan 21 günsonra başlatılabilir. Tabletin alındığı ilk 7 gün boyunca ek kontraseptif önlemler alınmalıdır.İlk doğum sonrası ovülasyon, ilk kanamadan önce gerçekleşebileceği için doğum ile ilk tabletdönemi arasındaki süreçte başka bir doğum kontrol yöntemi kullanılmalıdır. İlk trimesterdegerçekleşen kürtajdan sonra, oral kontrasepsiyon hemen başlatılabilir; bu durumda, ekkontraseptif önlem alınması gerekmez. Ek kontrasepsiyon gerektiren özel durumlar Hatalı uygulama: Alımı geciken bir tablet mümkün olduğunca kısa sürede alınmalıdır; söz konusu tablet, alınması gereken zamandan sonra 12 saat içinde alınırsa kontraseptif korumaetkisini kaybetmez. Daha uzun gecikmelerde ek kontrasepsiyon gerekir. Yalnızca alımıgeciken en son tablet alınmalı, daha önce unutulan tabletler atlanmalı ve bir sonraki 7 tabletinalındığı sonraki 7 gün boyunca ek hormonal olmayan kontrasepsiyon yöntemleri (ritim veyasıcaklık yöntemleri hariç) kullanılmalıdır. Ayrıca tablet alımı paketin son 7 günündeunutulduğu takdirde, bir sonraki pakete başlamadan önce ara verilmemelidir. Bu durumda,ikinci paket bitene kadar çekilme kanaması beklenmemelidir. Tablet alınan günlerde birmiktar ani kanama gerçekleşebilir ancak bu kanama klinik olarak anlamlı değildir. Hasta,ikinci paket bittikten sonra tablet kullanılmayan dönemde çekilme kanaması yaşamazsa birsonraki pakete başlamadan önce gebelik olasılığı dışlanmalıdır. Gastrointestinal rahatsızlıklar durumunda öneriler: Kusma ve diyare tam emilimi önleyerek oral kontraseptiflerin etkililiğini azaltabilir. Kusma veya diyare MICROGYNON tableti alındıktan sonra 4 saat içinde meydana gelirse mevcut paketten alınmaya devam edilmelidir. Gastrointestinal rahatsızlık sırasında verahatsızlığı takip eden 7 gün boyunca hormonal olmayan ek kontrasepsiyon yöntemleri (ritimveya sıcaklık yöntemleri hariç) kullanılmalıdır. Eğer bu 7 gün paketin sonunu aşarsa, birsonraki pakete ara vermeden başlanmalıdır. Bu durumda, ikinci paket bitene kadar geriçekilme kanaması beklenmemelidir. Hasta, ikinci paket bittikten sonra tablet kullanılmayandönemde çekilme kanaması yaşamazsa bir sonraki pakete başlamadan önce gebelik olasılığıdışlanmalıdır. Gastrointestinal rahatsızlığın uzaması muhtemel ise, başka doğum kontrolyöntemleri de düşünülmelidir. Diyareli hastalığın yalnızca ince bağırsağın katıldığı veya artan bağırsak hareketliliği (ör. ince bağırsak diyaresi veya şiddetli ya da uzayan diyare) ile ilişkili vakalarda steroid emiliminiaksatması beklenmektedir. Dolayısıyla sıradan diyare için ilave kontraseptif kullanımıuyarıları için bir tavsiyenin dahil edilmesi gerekçelendirilmemiştir, ancak şiddetli diyarelihastalık durumlarında kontraseptif etkililik bozulması hesaba katılmalıdır. Bu durumlardailave kontraseptif yöntemlerin yönetimine semptomların süresi ve şiddetine bağlı olarakmünferit bazda karar verilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:MICROGYNON böbrek yetmezliği olan hastalarda özel olarak araştırılmamıştır. Mevcut veriler bu hasta popülasyonun tedavisinde bir değişiklik yapılmasınıileri sürmemektedir.Karaciğer yetmezliği:MICROGYNON şiddetli karaciğer hastalıkları olan kadınlarda kontrendikedir. Ayrıca '4.3 Kontrendikasyonlar' bölümüne bakınız.Pediyatrik popülasyon:MICROGYNON yalnızca menarştan sonra endikedir.Geriyatrik popülasyon:4.3. KontrendikasyonlarKombine oral kontraseptifler (KOK) aşağıda belirtilen durumlarda kullanılmamalıdır. İlk kez KOK kullanırken aşağıdaki durumlardan herhangi birinin görülmesi halinde kullanım derhaldurdurulmalıdır. Venöz tromboembolizm (VTE) varlığı veya riski o Venöz tromboembolizm - mevcut VTE (antikoagülanlar üzerinde) veya öyküsü (örn. derin ven trombozu [DVT] veya pulmoner embolizm [PE]) o APC direnci (Faktör V Leiden dahil), antitrombin III eksikliği, protein C eksikliği, protein S eksikliği gibi VTE için bilinen kalıtımsal veya kazanılmış yatkınlık o Uzun süreli hareketsizliğe neden olan majör cerrahi müdahale (Bkz. Bölüm 4.4) o Çoklu risk faktörlerinin varlığından kaynaklanan yüksek VTE riski (Bkz. Bölüm 4.4) Arteriyel tromboembolizm (ATE) varlığı veya riski o Arteriyel tromboembolizmi - mevcut ATE, ATE öyküsü (örn. miyokard infarktüsü) veya prodromal durum (örn. anjina pektoris) o Serebrovasküler hastalık - mevcut inme, inme veya prodromal durum öyküsü (örn. geçici iskemik atak, TIA) o Hiperhomosisteinemi ve antifosfolipid antikorlar (antikardiyolipin antikorlar, lupus antikoagülanı) gibi ATE için bilinen kalıtımsal veya kazanılmış yatkınlık o Fokal nörolojik semptomlu migren öyküsü. o Çoklu risk faktörlerinden kaynaklanan yüksek ATE riski (Bkz. Bölüm 4.4) veya aşağıdaki gibi bir ciddi risk faktörü varlığı: vasküler semptomlu diabetes mellitus şiddetli hipertansiyon şiddetli dislipoproteinemi Ağır karaciğer hastalığı varlığı veya öyküsü, örn. aktif virütik hepatit ve ciddi siroz(karaciğer fonksiyon değerleri normale dönmedikçe) Ombitasvir/paritaprevir/ritonavir ve dasabuvir, glekaprevir/pibrentasvir veyasofosbuvir/velpatasvir/voxilaprevir içeren tıbbi ürünlerin eş zamanlı kullanımı (Bkz.Bölüm 4.5), Karaciğer tümörü varlığı ya da öyküsü (iyi ve kötü huylu) Meme kanseri varlığı veya meme kanseri öyküsü Tanı konulmamış vajinal kanama Bilinen gebelik varlığı ya da gebelik şüphesi Etkin ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılık (Bkz. Bölüm 6.1). 4.4 Özel kullanım uyarıları ve önlemleri UyarılarAşağıda belirtilen durum veya risk faktörlerinden herhangi biri varsa, MICROGYNON'un uygun olup olmadığı kadın ile tartışılmalıdır. Bu durumlardan veya risk faktörlerinden herhangi birinin şiddetlenmesi veya ilk kez ortaya çıkması halinde, kadının MICROGYNON kullanımının sonlandırılmasının gerekli olupolmadığının belirlenmesi için doktoru ile iletişime geçmesi tavsiye edilmelidir. Dolaşım bozuklukları Dolaşım bozuklıkları ile ilgili advers etkilerin ortaya çıkma riski özellikle 35 yaş üzeri ve sigara içen kadınlarda yüksektir. Venöz tromboembolizm (VTE) riskiKHK kullanan kadınlarda VTE riski kullanmayanlara göre artar. MICROGYNON gibi levonorgestrel içeren ürünler, norgestimat veya noretisteron içeren ürünler en düşükVTE riski ile ilişkilendirilmiştir. MICROGYNON kullanma kararı; kadınınMICROGYNON ile ilişkili VTE riskini, mevcut risk faktörlerinin bu riski nasıletkilediğini ve VTE riskinin kullanımın ilk yılında en yüksek olduğunu anladığındanemin olduktan sonra verilmelidir. Ayrıca kullanıma 4 hafta veya daha uzun süre araverildikten sonra KHK kullanımına tekrar başlandığında riskin arttığını gösteren bazıkanıtlar vardır.KHK kullanmayan ve gebe olmayan kadınlarda, 10.000 kişiden yaklaşık 2'si bir yıllık süre içinde VTE geliştirir. Bununla birlikte, herhangi bir kadında altta yatan risk faktörlerine bağlıolarak söz konusu risk çok daha yüksek olabilir (aşağı bakınız). Levonorgestrel içeren bir KHK kullanan 10.000 kadından yaklaşık 6'sının bir yıl içinde VTE geliştireceği tahmin edilmektedir.
Son derece nadir olarak, KHK kullamcılarmda diğer kan damarlarında (örn. hepatik, mesenter, renal, serebral veya retinal toplardamarlar ve atardamarlar) tromboz meydanageldiği rapor edilmiştir. VTE Risk faktörleriVenöz tromboembolik komplikasyon riski KHK kullamcılarmda özellikle çoklu risk faktörleri olduğunda, ilave risk faktörleri olan kadınlarda ciddi ölçüde artabilir (Bkz. Tablo 1:VTE Risk faktörleri). Yüksek venöz tromboz riski oluşturan çoklu risk faktörleri mevcut olan kadında MICROGYNON kullanımı kontrendikedir (Bkz. Bölüm 4.3). Bir kadın birden fazla riskfaktörü varsa, riskteki artışın ayrı ayrı faktörlerin toplamından daha yüksek olması olasılığıvardır. Bu durumda VTE toplam riski dikkate alınmalıdır. Fayda ve risk dengesinin negatifolduğu düşünülüyorsa, KHK reçete edilmemelidir (Bkz. Bölüm 4.3).
Variköz venlerin ve yüzeysel tromboflebitin venöz tromboembolideki olası rolü konusunda görüş birliği yoktur. Gebelikte ve özellikle 6 haftalık puerperium periyodunda tromboemboli riskindeki artış dikkate alınmalıdır (Bkz. Bölüm 4.6). VTE semptomları (Derin ven trombozu ve Pulmoner embolizm)Semptomlar olması halinde, kadınlara acil tıbbi yardım almaları ve sağlık çalışanlarını KHK aldıkları konusunda bilgilendirmeleri tavsiye edilmelidir. - bacakta/ayakta tek taraflı ya da bacaktaki bir damar boyunca şişme; - bacakta yalnızca ayakta dururken ya da yürürken hissedilebilen ağrı ya da hassasiyet, - etkilenen bacakta sıcaklık artışı; bacakta ciltte kırmızılık ya da renk değişmesi. Pulmoner embolizm (PE) semptomları aşağıdakileri kapsayabilir: - aniden ortaya çıkan, açıklanamayan nefes darlığı ya da hızlı soluma; - hemoptizi ile ilişkili ani öksürük; - keskin göğüs ağrısı; - şiddetli dengesizlik ya da baş dönmesi; - hızlı veya düzensiz kalp atışı. Bu semptomlardan bazıları (ör, nefes darlığı, öksürük) özgün değildir ve daha yaygın ya da daha az şiddetli olaylar (ör, solunum yolu enfeksiyonları) şeklinde yanlış yorumlanabilir.Vasküler oklüzyona ilişkin diğer belirtiler; bir ekstremitedeki ani ağrı, şişme ya da mavi tondahafif renk değişikliği olabilir. Gözdeki damarlarda tıkanma meydan geldiği takdirde, semptomlar ağrısız bulanık görme ile başlayıp görme kaybına kadar ilerleyebilir. Bazen, görme kaybı aniden meydana gelebilir. Arteriyel tromboembolizmi (ATE) riskiEpidemiyolojik çalışmalarda, KHK kullanımı ATE (miyokard enfarktüsü) veya serebrovasküler olay (ör. geçici iskemik atak, inme) riskinde artışla ilişkilendirilmiştir. ATEölümcül olabilir. ATE Risk faktörleriArteriyel tromboembolik komplikasyon veya serebrovaksüler olay riski, risk faktörleri olan KHK kullanıcılarında artar (Bkz. Tablo 2: ATE Risk faktörleri).Yüksek arteriyel tromboz riskine maruz bırakan ciddi ya da çoklu ATE risk faktörleri mevcut olan kadında MICROGYNON kullanımı kontrendikedir (Bkz. Bölüm 4.3). Bir kadında birdenfazla risk faktörü varsa, riskteki artışın ayrı ayrı faktörlerin toplamından daha yüksek olmasıolasılığı vardır. Bu durumda VTE toplam riski dikkate alınmalıdır. Fayda ve risk dengesininnegatif olduğu düşünülüyorsa, KHK reçete edilmemelidir (Bkz. Bölüm 4.3).
ATE semptomlarıSemptomlar görüldüğünde, en kısa sürede tıbbi yardıma başvurmaları ve KHK kullandıklarım sağlık uzmanına bildirmek konusunda kadınlar bilgilendirilmelidir. Serebrovasküler bir olaya ilişkin semptomlar şunlardır: - yüzde, bacak veya kolda, özellikle vücudun bir tarafında ani hissizlik ya da güçsüzlük; - ani konfüzyon, konuşma ya da kavramada güçlük; - bir ya da her iki gözde ani görme güçlüğü; ani yürüme güçlüğü, - baş dönmesi, denge ya da koordinasyon kaybı; - bilinen nedeni olmayan ani, şiddetli veya uzun süren baş ağrısı; - bilinç kaybı ya da nöbetin eşlik ettiği ya da tek başına bayılma. Geçici belirtiler olayın geçici iskemik atak olduğunu göstermektedir. Miyokard enfarktüsü (MI) semptomları şunları kapsayabilir: - göğüs, kol ya da göğüs kemiği altında ağrı, rahatsızlık, basınç, ağırlık, sıkışma ya dadolgunluk hissi; - sırt, çene, boğaz, kol ve mideye yayılan rahatsızlık; - dolgunluk, hazımsızlık ya da sıkıştırma hissi; - terleme, bulantı, kusma ya da baş dönmesi; - aşırı güçsüzlük, anksiyete, nefes darlığı; - hızlı veya düzensiz kalp atışı. Tıbbi Muayene Hastanın oral kontraseptif kullanmaya başlamadan ya da kullanmaya devam etmeden önce ve sonrasında düzenli aralıklarla tıbbi öyküsü (aile öyküsünü de içerecek şekilde)değerlendirilmelidir ve gebelik ekarte edilmelidir. Kan basıncı ölçülmeli ve fiziksel muayenekontrendikasyonlar (Bkz. Bölüm 4.3) ile uyarılar (Bkz. Bölüm 4.4) doğrultusundagerçekleştirilmelidir. VTE ve ATE semptomları, bilinen risk faktörleri ve şüpheli trombozdurumunda ne yapılacağı, MICROGYNON'un diğer KHK'lara kıyasla riski de dahil olmaküzere venöz ve arteriyel tromboz bilgilerine kadının dikkatini çekmek önemlidir. Ayrıca kadın, kullanma talimatını dikkatle okuması ve yapılan tavsiyelere uyması gerektiği konusunda bilgilendirilmelidir. Bu değerlendirmelerin içeriği ve sıklığı ilgili kılavuzlardoğrultusunda olmalı ve kadına özgü şekilde uyarlanmalıdır. Hormonal kontraseptiflerin HIV enfeksiyonu (AIDS) ve diğer cinsel yolla bulaşan hastalıklara karşı koruyucu olmadığı bilgisi kullanıcılara verilmelidir. Tanı konmamış altta yatan nedene ilişki şüpheli bulunan vajinal kanama araştırılmalıdır. Sıkı tıbbi gözetim gerektiren durumlar KOK reçete edilmesi konusu klinik karar kullanılarak ve hastanın fikri alınarak kararlaştırılmalıdır. Bu durum veya risk faktörlerinden birinin ilk kez ortaya çıkması veyaalevlenmesi oral kontraseptif kullanımının kesilmesi gerektiğine işaret edebilir. Kadındoktoruna danışmalı, doktor da KOK kullanımına son verilip verilmemesine ilişkin kararvermelidir: Hafif vasküler hastalık veya hafif nefropati, retinopati veya nöropatinin eşlik ettiğidiyabet Yeterli kontrol altında olan (sistolik >140 ila 159 mm Hg veyadiyastolik >90 ila 94 mm Hg hipertansiyon (Ayrıca Bkz. Bölüm 'Oralkontrasepsiyonun derhal kesilmesini gerektiren nedenler:') Porfiri Obezite Migren Kardiyovasküler hastalıklar Oral kontrasepsiyonun derhal kesilmesini gerektiren nedenler: Oral kontrasepsiyon alımı kesildiğinde, kontrasepsiyonun devamlılığını sağlamak için hormonal olmayan kontrasepsiyon kullanılmalıdır. 2 1 3 4. Elektif majör operasyondan (örn. abdominal, ortopedik) en az dört hafta önce,bacaklarla ilgili herhangi bir ameliyat, variköz venlerle ilgili ilaç tedavisi veya uzunsüreli hareketsizlik (örn. kaza veya ameliyat sonrasında). Hasta tam olarak yürümeyebaşladıktan sonra en az iki 2 hafta geçmeden başlanmamalıdır. Acil ameliyat halinde,genellikle trombotik profilaksi (örn. subkutan heparin) endikedir. 5. Sarılık, hepatit, tüm vücutta kaşıntı başlangıcı 6. Kan basıncında anlamlı yükselme 7. Şiddetli üst karın ağrısı veya karaciğer büyümesi 8. Oral kontrasepsiyon veya gebelik sırasında kötüleşme ihtimali olduğu bilinendurumlara ilişkin belirgin alevlenme (Bkz. Bölüm '4.4 Özel kullanım uyarıları veönlemleri/Diğer durumlar/Gebelikle veya önceki KOK kullanımı ile kötüleşendurumlar') Tümörler Birçok epidemiyolojik çalışma KOK kullanan kadınlarda over, endometriyum, serviks ve meme kanseri riskiyle ilgili bilgi sağlamıştır. Kanıtlar yüksek doz kombine oralkontraseptiflerin over ve endometrium kanseri bakımından önemli oranda koruma sağladığınıaçıkça ortaya koymaktadır. Bununla birlikte, düşük doz KOK'ların aynı düzeyde koruyucuetki sağlayıp sağlamadığı açık değildir. Meme kanseri 54 epidemiyolojik çalışmanın meta analizleri sonucu, halen KOK kullanan kadınlarda tanı konan meme kanseri relatif riskinde (RR=1,24) hafif artış olduğunu göstermektedir. Gözlenenartmış risk örneğin, KOK kullananlarda meme kanserinin daha erken tanısına, KOK'larınbiyolojik etkilerine veya bu ikisinin kombinasyonuna bağlı olabilir. Halen KOK kullananveya son on yıl içinde KOK kullanmış kadınlarda tanısı konan ek meme kanserleri, KOKkullanmamış kadınlara oranla daha çok memede lokalize olmaktadır. Meme kanseri 40 yaşın altındaki kadınlarda, KOK kullanmış olsun ya da olmasın seyrek görülür. Arka plandaki riskler yaşla birlikte artarken halen KOK kullanan veya KOKkullanmış kadınlardaki meme kanseri tanılarındaki artış, tüm meme kanseri riski ilekarşılaştırıldığında düşüktür. (Bkz. grafik). KOK kullanıcılarında meme kanseri için en önemli risk faktörü kadının KOK'u bırakma yaşıdır; bırakma yaşı daha büyük kadınlarda, daha fazla meme kanseri tanısı konmaktadır.Kullanım süresi daha az önemlidir ve aşırı risk KOK kullanmayı bıraktıktan sonra 10 yılboyunca kaybolur, öyle ki 10 yıl boyunca da aşırı görülmez. Meme kanseri riskindeki olası artış KOK kullanan kadınlara anlatılmalı, KOK'ların diğer kanser riski oluşumlarına (örn. over ve endometriyum kanseri) karşı önemli koruma sağlıyorolması göz önüne alınarak yarar ve risk değerlendirilmelidir. Grafik-2:Hiç KOK kullanmamış 10.000 kadında teşhis edilen meme kanseri sayısına kıyasla, 5 yıllık kullanım sonunda ve KOK kullanımı bırakıldıktan sonra 10 yıla kadar tanıkonulmuş 10.000 kadın başına tahmini kümülatif meme kanseri sayısı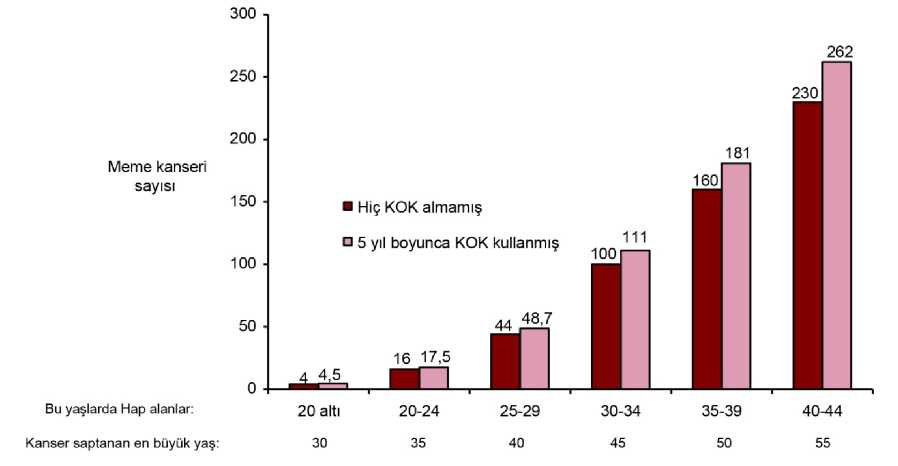
Serviks kanseri Serviks kanseriyle ilgili en önemli risk faktörü kalıcı HPV enfeksiyonudur. Bazı epidemiyolojik çalışmalar uzun süreli KOK kullanımının bu risk artışını daha daartırabileceğini göstermiş olmakla birlikte, bu bulgunun etki karışımı yapan faktörlere, örn.servikal tarama ve bariyer kontraseptif kullanımı dahil cinsel davranışı ne ölçüdeatfedilebileceği tartışmalı bir konudur. Karaciğer kanseri Seyrek olguda benign ve daha seyrek olguda malign olmak üzere izole olgularda yaşamı tehdit eden intraabdominal kanamaya neden olan karaciğer tümörler MICROGYNON'dabulunanlar gibi hormonal maddelerin kullanımından sonra gözlenmiştir. Üst abdomendeşiddetli şikayetler, karaciğer büyümesi veya intraabdominal kanama belirtileri meydanagelirse, ayırıcı tanı karaciğer tümörünü de içermelidir. Maligniteler hayatı tehdit edebilir ya da ölümcül seyredebilir. Diğer durumlar MICROGYNON kullanımı sırasında birtakım kronik hastalıkların zaman zaman kötüleşmesi olasılığı göz ardı edilemez. Bilinen hiperlipidemiler Hipertrigliseridemi varlığı ya da aile öyküsü KOK kullanımı sırasında pankreatit bakımından risk artışı olabilir. Hiperlipidemisi olan kadınlar arteriyel hastalık bakımından artmış risk altındadır (Bkz. Bölüm 4.4 'ATE Risk faktörleri'). Bununla birlikte, KOK kullanan kadınlarda rutin tarama yapılmasıuygun değildir. Kan basıncı Hipertansiyon inme ve miyokard enfarktüsüyle ilgili bir risk faktörüdür (Bkz. Bölüm 4.4 'Arteriyel tromboembolizm (ATE) riski'). KOK östrojen/progesteron kombinasyonlarıkullanan birçok kadında kan basıncında hafif artış bildirilmiş olmasına karşın, klinik açıdananlamlı artış nadiren gözlenmektedir. Bununla birlikte, KOK kullanımı sırasında kalıcıhipertansiyon gelişmesi halinde, antihipertansif tedavi komplike olmayan hastalar için160/100 mm Hg düzeyinde, hedef organ hasarı, tanı almış kardiyovasküler hastalık, diyabetya da kardiyovasküler risk faktörlerinde artış olanlarda ise 140/90 mm Hg düzeyindebaşlatılmalıdır. KOK kullanımına devam edilip edilmemesi konusu daha düşük kan basıncıdüzeylerinde kararlaştırılmalıdır ve alternatif kontrasepsiyon tavsiye edilmelidir. Gebelikle veya önceki KOK kullanımı ile kötüleşen durumlar: Aşağıdaki koşulların hem gebelikte hem de bir KOK kullanımı ile bozulduğu bildirilmiştir, Aşağıdakilerin herhangi birinin kullanım sırasında meydana gelmesi halinde,MICROGYNON bırakılması değerlendirilmelidir. Kolestaz ile ilişkili sarılık ve/veya kaşıntı KOK'lar safra kesesi taşı oluşumu riskini artırabilir veya mevcut hastalığı kötüleştirebilir. Sistemik lupus eritematozus; Herpes gestasyones Otoskleroza bağlı işitme kaybı; Orak hücre anemisi Renal disfonksiyon; Herediter anjiyoödem Gebelik sırasında veya önceki KOK kullanımı sırasında kadının kötüleşme yaşadığı herhangi bir diğer durum.
Anjiyoödem Ekzojen östrojenler,şiddetlendirebilir.
herediter ve kazanılmış anjiyoödem semptomlarını uyarabilir veya Karaciğer fonksiyonlarında bozulma Karaciğer fonksiyonlarının akut veya kronik bozulmaları, karaciğer fonksiyon testlerinin normale dönmesine kadar KOK kullanımının kesilmesini gerektirebilir. İlk kez gebelikte yada daha önce seks steroidlerinin kullanımı sırasında oluşmuş olan kolestatik sarılığıntekrarlaması KOK kullanımının sonlandırılmasını gerektirir. Diyabet (Vasküler tutulum olmayan) Vasküler hastalığı olmayan, insüline bağlı kullanan diyabetik hastalar KOK kullanabilir. Ancak tüm diyabetiklerin arteriyel hastalık bakımından artmış risk altında olduğuunutulmamalı ve KOK reçete edilirken bu durum dikkate alınmalıdır. Mevcut vaskülerhastalığı olan diyabetiklerin KOK kullanması kontrendikedir (Bkz. Bölüm 4.3). KOK'lar periferik insülin direnci ve glukoz toleransı üzerinde etkili olabiliyorsa da, düşük dozlu (<0,05 mg etinilestradiol) KOK kullanan bir diyabetik hastada tedavi rejimindedeğişiklikler yapma gerekliliğini gösteren bir kanıt yoktur. Ancak, KOK kullanan diyabetikkadınlar dikkatle gözlenmelidir. Psikiyatrik bozukluklar Depresif ruh hali ve depresyon, hormonal kontraseptif kullammmm iyi bilinen istenmeyen etkilerindendir (Bkz. Bölüm 4.8). Depresyon ciddi olabilir ve intihara eğilimli davranışlar ile intihar için iyi bilinen risk faktörüdür. Kadınların, tedaviye başladıktan kısa bir süre sonra da dahil olmak üzereduygudurum değişiklikleri ve depresif semptomlar göstermeleri durumunda doktorlarınabaşvurmaları önerilmelidir. Kloazma Kloazma, özellikle kloazma gravidarum öyküsü olan kadınlarda bazen gelişebilir. Kloazmaya eğilimi olan kadınlar KOK kullandıkları sürece güneşe veya ultraviyole ışınlarına maruzkalmaktan kaçınmalıdırlar. Menstrual değişiklikler Menstrual akışın azalması: Bu durum olağan dışı değildir ve bazı hastalarda olması beklenir. Elbette önceden şiddetli periyod geçirenlerde bu durum yararlı olabilir. Menstruasyon atlaması: Bazen çekilme kanaması hiç olmaz. Tabletler doğru olarak alındıysa hamilelik muhtemel değildir. Çekilme kanamasında aksama tablete ara verilen dönemdegerçekleşirse, gebelik olasılığı diğer pakete başlanmadan önce ortadan kaldırılmalıdır. Intermenstrual kanama: Düzensiz kanama (lekelenme veya ara kanama) özellikle kullanımın ilk aylarında ortaya çıkabilir. Bu nedenle, düzensiz kanamaların oluşumu ancak yaklaşık üçdöngü süren adaptasyon döneminden sonra önem kazanmaktadır. Önceden düzenli olandöngüler sonrasında kanama düzensizlikleri ortaya çıktığı veya var olan düzensizlikler devamettiği takdirde, hormonal olmayan nedenler değerlendirilmeli ve malignite veya gebeliğindışlanması için uygun tanı amaçlı yöntemler kullanılmalıdır. Buna kürtaj da dahildir. Bazı kadınlarda oral kontraseptifler kesildikten sonra amenore veya oligomenore (özellikle önceden bu tip sorunları olanlarda) gelişebilir. Kadınlar bu olasılık konusundabilgilendirilmelidir. Azalmış etkinlik KOK'ların etkinliği tablet alımı unutulduğunda, kusma veya diyare olması halinde (ya da eş zamanlı ilaç tedavilerinde azalabilir. Laktoz: Her bir tablet 32,82 mg laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz galaktoz malabsorpsiyon problemi olan hastaların bu ilacıkullanmaması gerekir. Sukroz: Her bir tablet 19,371 mg sukroz içerir. Nadir kalıtımsal fruktoz intoleransı, glikoz-galaktoz malabsorpsiyon veya sükraz-izomaltaz yetmezliği problemi olan hastaların bu ilacıkullanmamaları gerekir. 1 KHK kullamlmamasma göre levonorgestrel içeren KHK kullanımı için belirlenen yaklaşık 2,3 - 3,6 düzeyindeki bağıl riske dayalı olarak, 10.000 kadın-yıl başına aralığın orta noktası4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri Etkileşimler Enzim indükleyiciler Mikromozal enzimleri indükleyen ilaçlar (özellikle sitokrom P450 3A4) ile arasındaki etkileşimler seks hormonu klirensinde artışa neden olabilir, bu durum da kırılma kanamalarınave/veya kontraseptif başarısızlığa yol açabilirler. Birkaç günlük tedavinin ardından enzim indüksiyonu gözlemlenebilir. En fazla enzim indüksiyonu genellikle birkaç hafta içinde görülür. Enzim indüksiyonu, ilaç tedavisininkesilmesinin ardından 4 hafta kadar sürebilir. Bu ilaçlardan herhangi biriyle kısa süreli tedavi alan kadınların geçici olarak KOK'a ilave olarak bir bariyer yöntemi kullanmaları veya diğer bir kontrasepsiyon yöntemi seçmelerigerekmektedir. Bariyer yöntemi, eşzamanlı ilaç tedavisi ve bunu takip eden 28 gün süresincekullanılmalıdır. Bariyer yönteminin kullanıldığı dönem bir paketin içeriğini geçecek olursa,tablet alınmayan herhangi bir ara verilmeksizin sonraki kutuya başlanmalıdır. Bu durumda,ikinci kutunun sonuna kadar geri çekilme kanaması beklenmemelidir. Hastada ikinci kutununbitiminden sonraki tablet kullanılmayan aralıkta geri çekilme kanaması olmadığı takdirde,sıradaki kutuya devam edilmeden önce gebelik olasılığı dışlanmalıdır. Hepatik enzim uyarıcılarla indükleyicilerle uzun süreli tedavi gören kadınlarda farklı bir kontrasepsiyon yöntemi kullanılmalıdır. Aşağıdakilerin KOK'lar ile klinik olarak önemli etkileşimler gösterdiği görülmüştür: Antiretroviral ajanlar Ritonavir Nelfinavir Nevirapin Not: Seks hormonlarının plazma konsantrasyonunu arttırabilecek başka antiretroviral ajanlar da vardır. Antikonvül sanlar Barbitüratlar (fenobarbital dahil) Primidon Fenitoin Karbamazepin Okskarbazepin Topiramat Antibiyotikler/antifungaller Griseofulvin Rifampisin Bitkisel ilaçlar Sarı kantaron otu (Hypericum perforatum) KOK klirensini artıran maddeler (enzimlerin uyarılmasıyla KOK etkililiğinin azalması), örn.: Fenitoin, barbitüratlar, primidon, karbamazepin, rifampisin ve muhtemelen oksakarbazepin,topiramat, felbamat, griseofulvin ve sarı kantaron (St John's wort) içeren ürünler. KOK klirensi üzerine değişken etkilere sahip maddeler; örn; KOK ile birlikte uygulandığında birçok HIV/HCV proteaz inhibitörü ve nükleozid olmayan ters transkriptaz inhibitörleri plazma östrojen veya progesteron konsantrasyonlarınıazaltabilmekte ya da artırabilmektedir. Bu değişiklikler bazı olgularda klinik açıdan anlamlıolabilir. KOK klirensini azaltan maddeler (enzim inhibitörleri): Azol antifungaller (ör. itrakonazol, vorikonazol, flukonazol), verapamil, makrolidler (ör.klaritromisin, eritromisin), diltiazem ve greyfurt suyu gibi kuvvetli ve orta düzeydeCYP3A4 inhibitörleri östrojen veya progesteron veya her ikisinin de plazmakonsantrasyonunu artırabilir. 60 - 120 mg/gün etorikoksib dozlarının 0,035 mg etinilestradiol içeren KHK ile eş zamanlı olarak alındığı takdirde etinilestradiolün plazma konsantrasyonlarını sırasıyla 1,4 - 1,6 katarttırdığı görülmüştür. KOK'ların diğer tıbbi ürünler üzerine etkisi KOK'lar diğer bazı ilaçların metabolizmasını etkileyebilir. Bunun sonucu olarak, plazma ve doku konsantrasyonları artabilmekte (örn. tizanidin, teofilin siklosporin) veyaazalabilmektedir (örn. lamotrijin). İn vitroetinilestradiol hem CYP2C19, CYP1A1 ve CYP1A2'nin geri döndürülebilir inhibitörü, hem de CYP3A4/5, CYP2C8, ve CYP2J2'nin mekanizma temelli inhibitörüdür.Klinik çalışmalarda etinilestradiol içeren hormonal kontraseptifin uygulanması CYP3A4substratlarının (ör. midazolam) plazma konsantrasyonlarında herhangi bir artışa yol açmaz yada sadece zayıf bir artışa yol açarken, CYP1A2 substratlarının plazma konsantrasyonları hafif(ör. teofilin) veya orta düzeyde (ör. melatonin ve tizanidin) artabilmektedir.Not: Olası etkileşimlerin tanımlanması için eşzamanlı ilaçların reçeteleme bilgilerine bakılmalıdır. Farmakodinamik etkileşimler Hepatit C virüs enfeksiyonu (HCV) için ombitasvir/paritabrevir/ritonavir ve ribavirin ile beraber ya da olmadan dasabuvir içeren tıbbi ürünleri ile tedavi edilen hastalarla yapılanklinik çalışmalar sırasında, kombine hormonal kontraseptif (KOK) gibi etinilestradiol içerenilaçlar kullanan kadınlarda normal üst limitin (ULN) 5 katı kadara yüksek transaminaz (ALT)artışları anlamlı derecede daha sık görülmektedir. Glekaprevir/pibrentasvir vesofosbuvir/velpatasvir/voksilaprevir içeren HCV anti-viral tıbbi ürünleriyle de ALT artışıgözlenmiştir. (Bkz. Bölüm 4.3). Bu nedenle, MICROGYNON kullamcılan, bu kombinasyon ilaç rejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örneğin yalnız progestagen içerenkontrasepsiyon veya hormonal olmayan yöntemler) geçmelidir. Bu kombinasyon ilaç rejimiile tedavinin tamamlanmasından 2 hafta sonra MICROGYNON yeniden başlatılabilir. Laboratuvar testleri Oral kontraseptif kullanımı karaciğer, tiroid, adrenal ve renal fonksiyonlara ilişkin biyokimyasal parametreleri, kortikosteroid bağlayıcı globülin ve lipid/lipoprotein fraksiyonugibi taşıyıcı protein plazma düzeyleri, karbonhidrat metabolizması parametreleri ve pıhtılaşmaile fibrinoliz parametreleri gibi bazı laboratuvar testlerinin bulgularını etkileyebilir.Dolayısıyla, laboratuvar personeli laboratuvar testleri talep edildiğinde oral kontraseptifkullanımı konusunda bilgilendirilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:4.6. Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi: X Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon):MICROGYNON doğum kontrolü amacıyla kullanılmaktadır. Kullanıldığı sürece fertiliteyi engeller. Gebelik dönemi:MICROGYNON'un gebelikte kullanımı kontrendikedir. MICROGYNON kullanımı sırasında gebelik meydana gelmesi durumunda kullanım durdurulmalıdır. Ancak, yaygınepidemiyolojik çalışmalar ne gebeliğinden önce KOK kullanmış olan kadınların çocuklarındadoğumsal kusur riskinde herhangi bir artışı ne de erken gebeliği süresince yanlışlıkla KOKkullanıldığında oluşan bir teratojenik etkiyi göstermemiştir. MICROGYNON kullanımına yeniden başlarken postpartum dönem sırasında artan VTE riski dikkate alınmalıdır (Bkz. Bölüm 4.2 ve Bölüm 4.4). Laktasyon dönemi:Kombine oral kontraseptiflerin kullanımı süt miktarında azalmaya ve sütün bileşiminde değişikliğe yol açabileceğinden dolayı laktasyon etkilenebilir. Bu yüzden emziren annebebeğini sütten kesinceye kadar KOK kullanımı genellikle önerilmemelidir. Kontraseptifsteroidler ve metabolitleri küçük miktarlarda süte geçebilir. Üreme yeteneği / Fertilite:MICROGYNON, bir oral kontraseptiftir. Kullanıldığı sürece fertiliteyi engeller. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma becerileri üzerinde etkisi ile ilgili herhangi bir çalışma yapılmamıştır. KOK kullanımının araç ve makine kullanma becerileri üzerinde herhangi biretkisi gözlenmemiştir.4.8. İstenmeyen etkilerMICROGYNON ile en yaygın olarak bildirilen advers reaksiyonlar mide bulantısı, abdominal ağrı, kilo artışı, baş ağrısı, depresif ruh hali, duygu durum bozukluğu, meme ağrısı, memehassasiyetidir. Kullanıcılarm > %1'inde meydana gelir. Ciddi advers reaksiyonlar ATE ve VTE'dir. Advers reaksiyonlar, aşağıda sistem-organ sınıfı (MedDRA) ve sıklık derecesine göre listelenmektedir. Sıklık dereceleri şu şekilde tanımlanmaktadır; çok yaygın (>1/10), yaygın(>1/100, <1/10), yaygın olmayan (>1/1.000, <1/100), seyrek (>1/10.000 ila <1/1.000), çokseyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Etinilestradiol/levonorgestrel kullanımı sırasında aşağıdaki advers etkiler bildirilmiştir: Bağışıklık sistemi hastalıklarıSeyrek: Aşırı duyarlılık Metabolizma ve beslenme hastalıklarıYaygın olmayan: Sıvı tutulumu Psikiyatrik hastalıklarYaygın: Depresif duygu durumu, duygu durum değişiklikleri Yaygın olmayan: Libido azalmasıSeyrek: Libido artışı Sinir sistemi hastalıklarıYaygın: Baş ağrısı Yaygın olmayan: Migren Göz hastalıklarıSeyrek: Kontakt lense toleranssızlık Vasküler hastalıklarıSeyrek: Venöz tromboembolik bozukluklar4, arteriyel tromboembolik bozukluklar4 Gastrointestinal hastalıklarYaygın: Bulantı, karın ağrısı Yaygın olmayan: Kusma, diyare Deri ve deri altı doku hastalıklarıYaygın olmayan: Döküntü, ürtiker Seyrek: Eritema nodozum, eritema multiforme AraştırmalarYaygın: Kiloda artış Seyrek: Kiloda azalma Üreme sistemi ve meme hastalıklarıYaygın: Meme ağrısı, meme hassasiyeti Yaygın olmayan: Memede hipertrofi Seyrek: Vajinal akıntı, memede akıntı * -Bir grup KOK'u kapsayan epidemiyolojik çalışmalardan gelen tahmini sıklık. - 'Venöz ve arteriyel tromboembolik olaylar' aşağıda belirtilen tıbbi kayıtları özetler: Periferik derin venöz oklüzyonu, tromboz ve embolizm/Pulmoner vasküler oklüzyon, tromboz, embolizm ve enfarktüs/Miyokard enfarktüsü/Serebral enfarktüs ve hemorajik olarakbelirtilmeyen inme Pazarlama sonrası raporlanan advers olaylarBağışıklık sistemi hastalıklarıHerediter anjiyoödemin şiddetlenmesi Metabolizma ve beslenme hastalıklarıHipertrigliseridemi Sinir sistemi hastalıklarıKorenin şiddetlenmesi Gastrointestinal hastalıklarCrohn hastalığı, ülseratif kolit Hepato-bilier hastalıklarKaraciğer fonksiyon bozuklukları Deri ve deri altı doku hastalıklarıKloazma Üreme sistemi ve meme hastalıklarıMenstural kanamada azalma, lekelenme, ani kanama ve atlanan çekilme kanaması, ilaç sonrası amenore Seçilmiş advers reaksiyonların tanımı KOK kullanan kadınlarda miyokard infarktüsü, inme, geçici iskemik ataklar, venöz tromboz ve pulmoner emboli dahil olmak üzere arteriyel ve venöz trombotik ve tromboembolik olaylarriskinde artış gözlenmiştir, bölüm 4.4'te daha ayrıntılı olarak tartışılmaktadır. KOK kullamcılarmda meme kanseri tanısının sıklığı çok hafif bir artış göstermiştir. Meme kanseri 40 yaş altı kadınlarda seyrek görüldüğünden, rakamdaki artış genel meme kanseririskiyle kıyaslandığında düşüktür. KOK kullanımı ile nedensel ilişkisi bilinmemektedir. Dahafazla bilgi için Bkz. Bölüm 4.3 ve 4.4. Gebelik veya önceden KOK kullanımıyla kötüleştiği bildirilen koşullar: Kolestazla ilgili sarılık ve/veya kaşıntı; safra taşı oluşumu; sistemik lupus eritematozus; herpes gestasyonis; otoskleroza bağlı duyma kaybı; orak hücreli anemi; renal fonksiyonbozukluğu; herediter anjiyoödem; porfiri; serviks kanseri. KOK kullanan kadınlarda, glukoz toleransında değişiklik veya periferik insülin direnci üzerinde etki bildirilmiştir (Bkz. Bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;[email protected];4.9. Doz aşımı ve tedavisiDoz aşımına bağlı bildirilen ciddi yan etki yoktur. Görülebilecek belirtiler, bulantı, kusma ve kadınlarda çekilme kanamasıdır. Çekilme kanaması, ilacı yanlışlıkla almaları halinde kızçocuklarında menarştan önce bile görülebilir. Antidotu yoktur ve tedavisi semptomatikolmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Seks hormonları ve genital sistem modülatörleri, progestojenler ve östrojenler, fiks kombinasyonlarATC kodu: G03AA07 Kombine oral kontraseptiflerin etkisi, başlıca ovülasyon inhibisyonu ve servikal salgılamadaki değişiklikler gibi faktörlerin etkileşimine dayanmaktadır. MICROGYNON luteinizan hormonun siklus ortasındaki artışını baskılayarak ovulasyonu inhibe etmek, servikal mukusu koyulaştırıp spermlere karşı bir bariyer oluşturmak veendometriumun implantasyona yanıtsız kalmasını sağlamak suretiyle etki gösteren biröstrojen-progesteron kombinasyonudur. 5.2. Farmakokinetik özelliklerGenel ÖzelliklerLevonorgestrel Emilim:Levonorgestrel, hızla ve tamamen absorbe edilir. MICROGYNON alındıktan yalnızca bir saat sonra serumda yaklaşık 3 ng/ml olan maksimum etkin madde düzeylerine ulaşılır. Ardından, serum konsantrasyonları yarılanma ömrü yaklaşık 0,5 saat ve 20 saat olarak 2 aşamada düşer. Plazmadan metabolik klirens hızı yaklaşık 1,5 ml/dk./kg'dır. Dağılım:Levonorgestrel, serum albümine ve SHBG'ye bağlıdır. İlgili toplam konsantrasyonun yalnızca %1,5'u bağlı olmayan formda bulunur, yaklaşık %65 ise SHBG'ye bağlıdır. İlgilioranlar (serbest, albümine bağlı, SHBG'ye bağlı), SHBG konsantrasyonuna bağlıdır.Etinilestradiol ile indüksiyonuna bağlı olarak SHBG artışından sonra, SHBG'ye bağlanankısım artarken, serbest kısım ve albümine bağlanan kısım azalır. Biyotransformasyon:Levonorgestrel büyük ölçüde metabolize olur. Plazmadaki ana metabolitler konjüge ve konjüge olmayan 3a, SP-tetrahidrolevonorgestrelin formlarıdır. İn vitroin vi^voçalışmalaragöre CYP3A4, levonorgestrel metabolizmasına dahil olan ana enzimdir.Plazmadan klirens hızı yaklaşık 1,3 - 1,6 ml/dak./kg'dır. Eliminasyon:Levonorgestrel değişmemiş formda değil, yaklaşık bir günlük yarılanma ömrü olan metabolitler formunda, böbrek ve safra üzerinden neredeyse eşit oranlarda elimine edilir.Maternal dozun yaklaşık %0,1'i anne sütüyle aracılığıyla bebeğe geçebilir. Doğrusallık / doğrusal olmayan durum:Tekrarlanan günlük uygulama sonrası, levonorgestrel yaklaşık 2 faktör oranında birikir. Kararlı duruma, tedavi siklusunun ikinci yarısında erişilir. Levonorgestrelin farmakokinetikleri, plazmadaki SHBG konsantrasyonuna bağlıdır. MICROGYNON tedavisi sırasında SHBG düzeylerindeki (yaklaşık 1,7 kat) artış, spesifikbağlanma kapasitesinde eş zamanlı artışa ve dolayısıyla levonorgestrel serum düzeylerindeartışa yol açar. MICROGYNON tedavisiyle, SHBG seviyelerindeki bir artış spesifik bağlanma kapasitesindeki eşzamanlı bir artışı, dolayısıyla levonorgestrel serum seviyelerindeki bir artışıetkiler. Levonorgestrel serum seviyeleri, SHBG indüksiyonunun sona ermiş olması nedeniyle 1 - 3 kullanım döngüsünden sonra daha fazla değişmez. Tek uygulamaya kıyasla, kararlı durumkoşullarında 3-4 kat daha yüksek levonorgestrel serum seviyelerine ulaşılır. Levonorgestrelin mutlak biyoyararlanımı neredeyse %100'e ulaşır. Etinilestradiol Emilim:Oral yolla uygulanan etinilestradiol hızla ve tamamen absorbe edilir. MICROGYNON alındıktan 1 - 2 saat sonra yaklaşık 100 pg/ml'lik maksimum plazma düzeylerine ulaşılır.Ardından, etkin madde konsantrasyonu yarılanma ömrü yaklaşık 1 - 2 saat ve yaklaşık 20 saatolarak belirlenen 2 aşamada düşer. Teknik nedenlerle, bu veriler yalnızca yüksek dozlardahesaplanabilmektedir. Etinilestradiolün mutlak biyoyararlanımı bireyler arasında büyük oranda değişiklik gösterir. Oral uygulamadan sonra dozun yaklaşık %40 - 60'ına karşılık gelir. Dağılım:Etinilestradiolün sanal dağılım hacmi yaklaşık 5 l/kg ve plazmadan metabolik klirens hızı yaklaşık 5 ml/dk./kg olarak belirlenmiştir. Etinilestradiol, serum albümine spesifik olmayanşekilde %98 oranında bağlanır. Biyotransformasyon:Etinilestradiolün emilim aşamasında ve ilk karaciğer geçişi sırasında dahi metabolize olması, oral biyoyararlanımın azalmasına ve bireysel değişkenlik göstermesine yol açar. Diğer ilaçlar, etinilestradiolün sistemik yararlanımı üzerinde negatif veya pozitif etki yaratabilir. C vitamini ile etkileşimi yoktur. Sürekli kullanılan etinilestradiol, CBG veSHBG'nin hepatik sentezini indüklerken, SHBG indüksiyonunun kapsamı eş zamanlıuygulanan progesteronun tipine ve dozuna bağlıdır. Eliminasyon:Etinilestradiol değişmemiş formda değil, yaklaşık bir günlük yarılanma ömrü olan metabolitler formunda elimine edilir.Atılım oranı 40 (idrar): 60 (safra) olarak tespit edilmiştir. Emzirmenin tamamen yerleşik bir uygulama haline geldiği kadınlarda, maternal dozun yaklaşık %0,02'si anne sütüyle aracılığıyla bebeğe geçebilir. Doğrusallık / doğrusal olmayan durum:Plazmadan terminal eliminasyon aşamasının yarılanma ömrü nedeniyle, yaklaşık 5 - 6 günlük uygulamadan sonra %30 - %40 daha yüksek plazma madde düzeyiyle karakterize olan kararlıduruma erişilir. Etinilestradiol, absorpsiyon evresinde ve ilk karaciğer geçişi sırasında dahi metabolize olur azalan ve bireyden bireye değişen oral biyoyararlanıma yol açar. Etinilestradiolün mutlak biyoyararlanımında bireyler arası değişkenliği önemli ölçüdedir. Oral alımdan sonra, dozun yaklaşık %40 ila %60'ına karşılık gelir. 5.3. Klinik öncesi güvenlilik verileriTekrarlanan doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üreme toksisitesi üzerine yapılan geleneksel çalışmalara dayanan preklinik veriler, insanda özel bir risk olduğunugöstermemiştir. Ancak, yine de seksüel steroidlerin hormona bağlı dokuların ve tümörlerinbüyümesini uyarabileceği akıldan çıkarılmamalıdır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLaktoz monohidrat (sığır kaynaklı) Mısır nişastası Povidon 25Talk Magnezyum stearat SukrozPovidon 90Makragol 6000Kalsiyum karbonatMontanglikol mumuSarı demir oksit (E172) Gliserol %85 6.2. GeçimsizliklerHerhangi bir geçimsizlik yoktur. 6.3. Raf ömrü60 ay 6.4. Saklamaya yönelik özel tedbirler30°C altında oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriğiPVC/Aluminyum folyo blister. 21 tabletlik takvimli ambalaj 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller, Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBayer Türk Kimya San. Ltd. Şti. Fatih Sultan Mehmet Mah. Balkan Cad. No:53 34770 Ümraniye/İstanbulTel:(0216) 528 36 00 Faks: (0216) 645 39 50 8. RUHSAT NUMARASI2014/32 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 29.01.2014 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ1Ani görme veya duyma bozuklukları ya da diğer algısal bozukluklar Migren tipi ya da olağan dışı sıklıkta veya olağan dışı şiddette baş ağrısının ilk kezortaya çıkması veya alevlenmesi Tromboz veya kan pıhtılarına ilişkin ilk belirtiler (örn. bacakta/bacaklarda olağan dışıağrı veya şişme, nefes alırken keskin ağrı ya da nedensiz öksürük). Göğüste ağrı vedarlık hissi Venöz tromboembolik bozukluklar Arteriyel tromboembolik bozukluklar İnme (ör. geçici iskemik atak, iskemik inme, hemorajik inme) Hipertansiyon Karaciğer tümörleri (benign ve malign) Ekzojen östrojenler herediter ve kazanılmış anjiyoödem semptomlarını uyarabilir veyaşiddetlendirebilir. |
İlaç BilgileriMicrogynon 150 Mcg/30 Mcg Kaplı TabletEtken Maddesi: Levonorgestrel, Etinilestradiol Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.