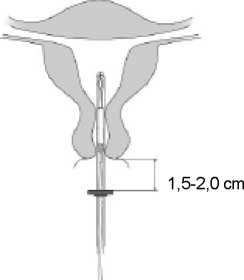
Mirena 52 Mg Rahim Içi Sistem Kısa Ürün BilgisiKISA ÜRÜN BILGISI1. BEŞERI TIBBİ ÜRÜNÜN ADIMIRENA® 52 mg rahim içi sistem Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Levonorgestrel 52 mg. Yardımcı maddeler:Yardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMRahim içi sistem. Levonorgestrel (LNG) RİS (Rahim içi sistem) opak membranla kaplı beyaz veya hafif grimsi beyaz arası ilaç çekirdeğinden oluşmakta olup T-gövdenin dikey sapına monte edilir. BeyazT-gövdenin dikey sapının bir ucunda bir lup ve diğer ucunda iki yatay kol bulunmaktadır.Kahverengi çıkarma iplikleri lupa takılıdır. MIRENA'nın T-gövdesi baryum sülfat içerir veböylelikle X-ışını muayenesinde görünür hale gelir. RİS'in dikey sapı, aplikatörün ucundakiuygulama tüpüne yerleştirilir. RİS ve aplikatör esasen görünür safsızlık içermezler. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlar Kontrasepsiyon (gebeliğin önlenmesi), İdiyopatik menoraji, Östrojen replasman tedavisi sırasında endometrial hiperplaziye karşı korunma. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi: Kontrasepsiyon ve idiyopatik menoraji: Doğurganlık çağındaki kadınlarda MIRENA uterus boşluğuna menstrüasyonun ilk yedi günü içinde yerleştirilmelidir. M IRENA siklusun herhangi bir gününde yeni bir sistemledeğiştirilebilir.Postpartum sonrası yerleştirme:IRENA ilk trimester düşüklerini takiben hemen uygulanabilir.MIRENA kontrasepsiyon ve idiyopatik menoraji endikasyonlarında 5 yıl süreyle endikedir ve bu sebeple sistem 5 yıl sonra çıkarılmalıdır. Kullanıcı aynı yönteme devam etmekarzusundaysa yeni bir rahim içi sistem aynı anda yerleştirilebilir ve bu durumda ilave birkoruma gerekli olmaz. Eğer gebelik arzu edilmiyorsa, MIRENA doğurganlık yaşındaki kadınlarda adet başlangıcından itibaren 7 gün içinde çıkarılmalıdır, ancak bunun koşulu kadının düzenli adetgörmesidir. Sistem adet sırasında başka bir zamanda çıkarılırsa veya kadın düzenli adetgörmüyorsa ve bir hafta içinde cinsel ilişki yaşamışsa, gebelik riski taşımaktadır.Kontrasepsiyonun sürekliliğini sağlamak için, yeni bir sistem hemen takılmalı veya alternatifbir kontraseptif yöntem başlatılmalıdır. Östrojen replasman tedavisi sırasında endometrial hiperplaziye karşı korunma: MIRENA östrojen replasman tedavisi sırasında rahim duvarını korumak için kullanıldığında, adet görmeyen kadına (aylık kanaması olmayan kadın) herhangi bir zamanda veya adetin songünleri sırasında veya çekilme kanaması sırasında takılabilir. Östrojen replasman tedavisi sırasında endometrial hiperplaziye karşı korunma endikasyonda 4 yılı aşan kullanıma ait klinik veriler (18 yaş ve üstü kadınlar ile yapılan klinik çalışmalar)sınırlıdır. Bu nedenle MIRENA 4 yıldan sonra çıkarılmalıdır. MIRENA hormon replasman tedavisinin (HRT) progesteron bileşenini sağlar. Bu nedenle HRT alan kadınlarda, MIRENA ilave eksojen progesteron olmadan oral ya da transdermalöstrojen preparatları ile birlikte kullanılabilir. Endometriyal kanser, meme kanseri ve venöztromboembolizm riski gibi HRT ile ilişkilendirilen önemli risk faktörlerinin dikkate alınmasıgerektiği için M IRUygulama şekli:Kullanma ve işlem talimatlarıYalnızca eğitimli bir doktor / sağlık çalışanı tarafından aseptik teknikler kullanılarak yerleştirilecektir.MIRENA takılacağı zamana kadar açılmaması gereken steril bir paket halinde sunulmaktadır. Açılmış ürün aseptik koşullara uyularak kullanılmalıdır. Steril paketin ambalajında hasarmevcutsa, ürün atılmalıdır ().MIRENA'nın sadece uygulama açısından deneyimli ve/veya uygulama için yeterli eğitim almış doktor / sağlık çalışanı tarafından takılması önerilir. Yerleştirme zor olursa ve/veya yerleştirme sırasında veya sonrasında olağan dışı ağrı veya kanama meydana gelirse lütfen Bölüm 4.4'e bakınız. MIRENA etilen oksit ile sterilize edilmiş şekilde steril olarak satışa sunulur. Tekrarsterilize etmeyiniz. Tek kullanımlıktır. İç ambalajı hasar görmüş veya açılmış ürünükullanmayınız. Ambalajda belirtilen ay ve yıldan önce yerleştiriniz. MIRENA aşağıdaki yerleştirme talimatları dikkatli şekilde uygulanarak, pakettençıkan yerleştirici ile (şekil 1) rahim boşluğuna yerleştirilir. Uygulama öncesi hazırlık MIRENA uygulanmadan önce uterusun büyüklük ve pozisyonunun belirlenmesi, akutgenital enfeksiyon veya herhangi bir kontrendikasyon ile ilgili belirti olup olmadığınınsaptanması ve gebelik olasılığın elimine edilmesi amacıyla hasta muayene edilmelidir. Bir spekulum kullanılarak serviks görülmeli, sonrasında serviks ve vajina uygun aseptikbir solüsyonla temizlenmelidir. Gerek görüldüğünde bir yardımcı bulundurulur. Uterusun stabilize edilmesi için serviksin anterior dudağı bir tenakulum veya forsepler ilekavranır. Uterus retrovert durumda ise, serviksin posterior dudağının kavranması dahauygun olabilir. Pensin hafif traksiyonu servikal kanalın düzleştirilmesi için kullanılabilir.Pens takma işlemi boyunca sabit tutulmalı ve servikste aksi yönde hafif traksiyonkorunmalıdır. Uterus ve boşluğunun derinliğinin ölçülmesi ve yönünün doğrulanması ve herhangi birintrauterin anormallik (örn: septum, submukoz fibroid) veya önceden yerleştirilmiş olupçıkarılmamış olan bir rahim içi doğum kontrol sistemi olmadığından emin olunması içinbir uterus sondası servikal kanal üzerinden fundusa kadar ilerletilmelidir. Zorlanmaolması halinde, kanalın dilatasyonu düşünülmelidir. Servikal dilatasyonun gerekli olmasıhalinde, analjezik kullanımına ve/veya paraservikal blokaja gerek olup olmadığına kararverilmelidir. Uygulama1.İlk önce steril paket tamamen açılır (Şekil 1). Ardından steril teknik ve steril eldivenlerkullanılır.Şekil 1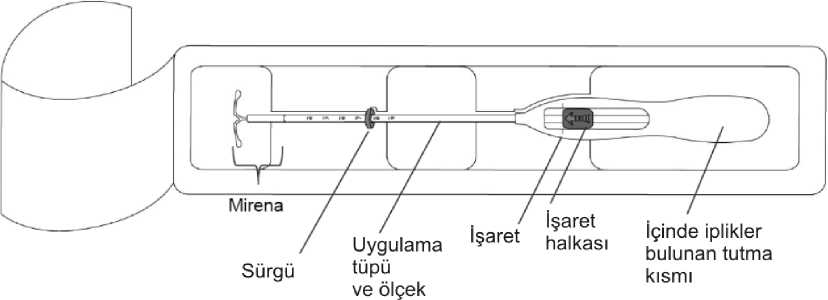
2.MIRENA'nın uygulama tüpüne yüklenmesi için sürgü ok yönünde ileriye doğru en uzakpozisyona itilir (Şekil 2).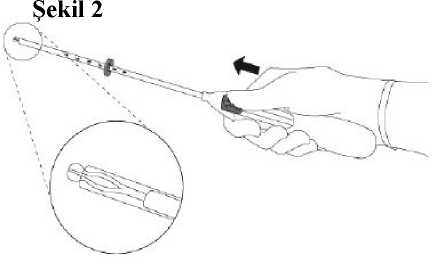 
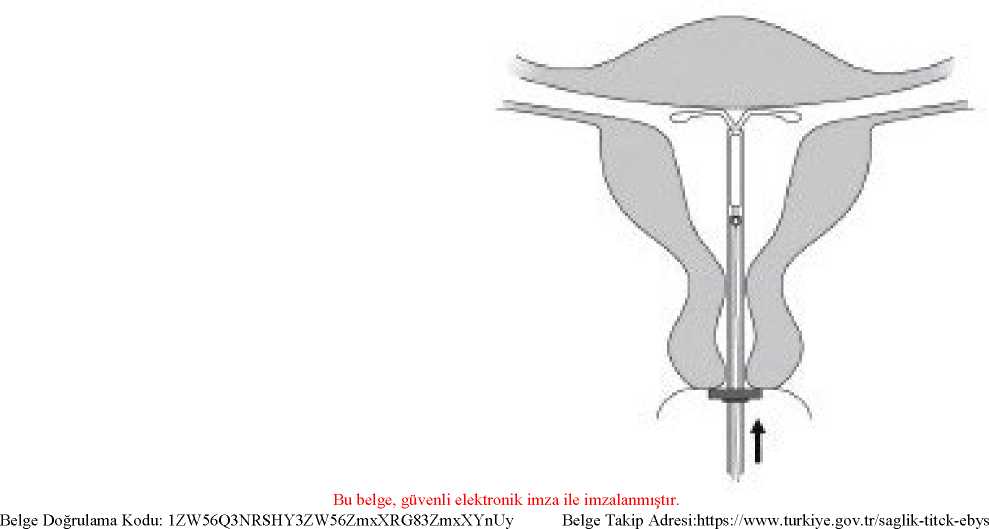
ÖNEMLİ:MIRENA'nın erken serbest kalmasına neden olabileceğinden ötürü, sürgü aşağıya doğru çekilmemelidir. M TRENA serbestleştikten sonra, tekrar yüklenemez.3.Sürgü en uzak pozisyonda tutularak, işaret halkasının üst ucu ölçülen uterus boşluğununderinliğine denk gelecek şekilde ayarlanmalıdır (Şekil 3).Şekil 3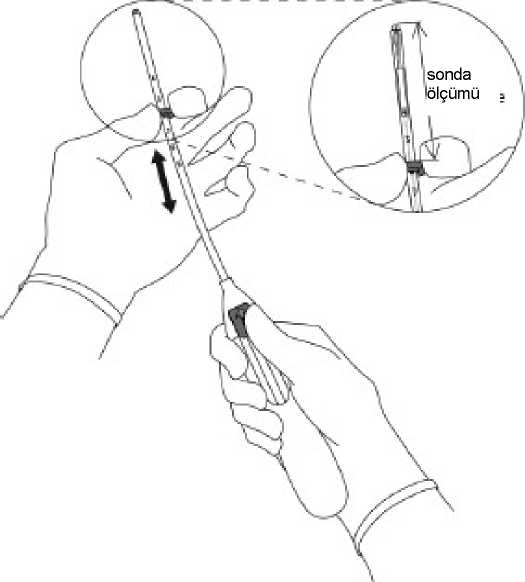 4.Sürgü en uzak pozisyonda tutularak, aplikatör serviks boyunca itilerek işaret halkasıylauterus serviksi arasında yaklaşık 1,5-2,0 cm kalması sağlanır (Şekil 4).
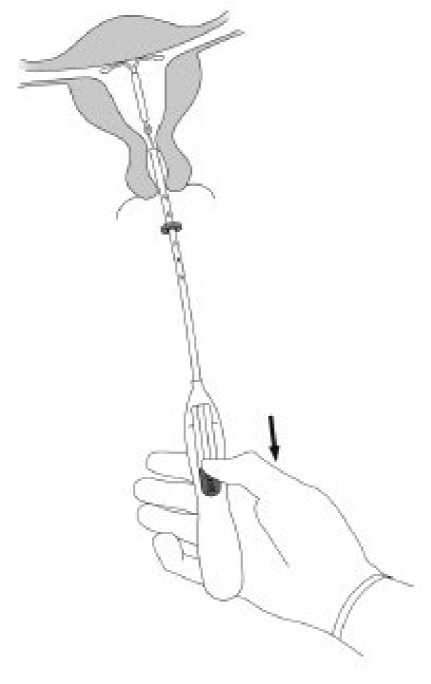
ÖNEMLİ:Bu işlem güç kullanmadan yapılmalıdır. Gerekliyse, servikal kanal genişletilmelidir. 5.MIRENA'nın kollarının yatay olarak açılması için aplikatör sabit tutularak, sürgü işaretedoğru çekilir (Şekil 5). Horizontal kolların tamamen açılması için 5-10 saniye kadar beklenir. Şekil 5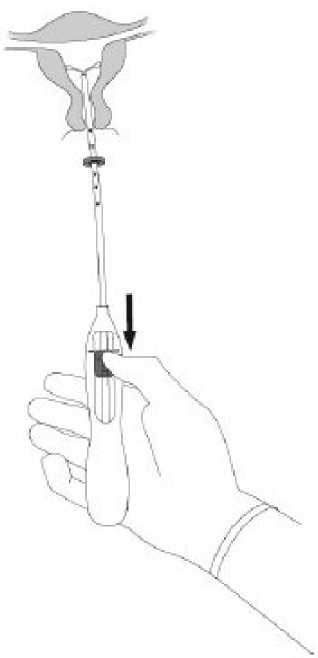
 7.Aplikatör sabit tutularak ve sürgü tamamen geri çekilerek MIRENA serbest bırakılır (Şekil 7). Sürgü tamamen aşağıya doğru tutulurken aplikatör çekilerek nazikçe çıkartılır. İpliklerserviks dışında 2-3 cm görünecek kadar kesilir.
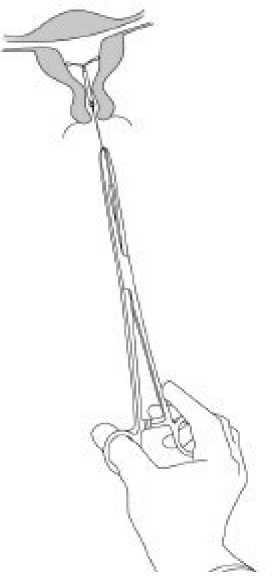
ÖNEMLİ:Sistemin doğru yerleştirilmediğinden şüphelenildiğinde, yeri kontrol edilmelidir (örn: ultrason ile). Sistem uterus boşluğu içine uygun şekilde yerleştirilmemişse, sistem çıkarılmalıdır.Çıkarılmış bir sistem tekrar takılmamalıdır.  Çıkarma/ Tekrar YerleştirmeÇıkarma/tekrar yerleştirme için lütfen M TRENA Kısa Ürün Bilgisi'nin ilgili bölümlerine bakınız.MTRENA iplikleri bir pensle tutulup çekilerek çıkarılır (Şekil 8). Çıkarıldıktan hemen sonra yeni bir M TRENA takılabilir.
M TRENA bir forseps yardımıyla ipliklerinden nazikçe çekilerek çıkarılır. Eğer iplikler görülemiyorsa ve sistem uterus boşluğu içindeyse ince bir tenakulum yardımıyla çıkarılabilir.Bu yöntem, servikal kanalın dilatasyonunu ya da diğer cerrahi girişimleri gerektirebilir.MTRENA çıkarıldıktan sonra sistemin sağlam olup olmadığı kontrol edilmelidir. Sistemin çıkarılmasında güçlüklerin yaşandığı durumda nadir olgularda hormon silindirinin yataykollar üzerinde kaydığı ve bunların silindir içinde saklı kaldığı bildirilmiştir. Bu durumdaRİS'in bütünlüğü kesinleştirilmiş ise daha ileri bir müdahale gerekli görülmez. Yatay kollarınboğum kısımları, genellikle, silindirin T-gövdesinden ayrılmasını engeller. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:IRENA böbrek yetmezliği olan kadınlarda denenmemiştir.Karaciğer yetmezliği:MIR^NA akut karaciğer hastalığı ve karaciğer tümörü olan kadınlarda kontrendikedir (bkz. Bölüm 4.3).
Pediyatrik popülasyon:MIRENA'nın etkililik ve güvenliliği üreme çağındaki kadınlarda incelenmiştir. MIRENA'nın menarştan önce kullanımı endike değildir.Geriyatrik popülasyon:4.3. KontrendikasyonlarGebelik veya gebelik şüphesi, Meme kanseri dahil teyit edilmiş ya da şüphelenilen hormona bağlı tümörler Mevcut ya da tekrarlayan pelvik inflamatuvar hastalık, Servisit Mevcut genital enfeksiyon, Postpartum endometrit, son 3 ay içinde enfeksiyona bağlı olarak gelişen düşük, Artmış enfeksiyon eğilimine yol açan durumlar, Servikal displazi, Rahim ya da serviksin malign tümörleri, Tanı konmamış anormal uterus kanamaları, Rahim boşluğunun biçimini bozan fibroidler de dahil olmak üzere konjenital ya da edinilmiş uterus anomalileri, Karaciğer tümörü veya akut ya da ciddi karaciğer hastalıkları Gerileme dönemi haricinde lösemi ya da kanı etkileyen akut malignitelerhCG seviyeleri yüksekliğini korurken yakın zamanda geçirilmiş trofoblastik hastalıkEtkin madde ya da yardımcı maddelere karşı hipersensitivite. MIRENA HRT kullanımı için östrojen ile birlikte kullanıldığında aktif ya da önceden geçirilmiş şiddetli inme veya miyokard enfarktüsü gibi kardiyovasküler hastalıklardakullanımı kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriTıbbi muayeneYerleştirmeden önce kişinin ve ailesinin tam tıbbi geçmişi alınmalıdır. Fiziksel muayene buna ve kontrendikasyonlara ve kullanıma yönelik uyarılara göre yapılmalıdır. Nabız ve kanbasıncı ölçülmeli ve uterus oryantasyonunu tespit etmek üzere bimanuel pelvik muayenegerçekleştirilmelidir. Hasta yerleştirmeden altı hafta sonra tekrar muayene edilmeli ve klinikolarak endike olduğunda başka muayeneler de yapılmalı ve bunlar rutin prosedürden ziyadeher kadına özel olarak adapte edilmelidir. Yerleştirmeden önce gebelik ekarte edilmeli vegenital enfeksiyonlar başarılı bir şekilde tedavi edilmelidir. Kadınlar ayrıca MIRENA'nınAIDS (HIV enfeksiyonu) ve diğer cinsel yolla bulaşan hastalıklara karşı koruma sağlamadığıkonusunda bilgilendirilmelidir (lütfen pelvik enfeksiyonlarla ilgili aşağıdaki bölüme bakın). Kadınlar yaşlarına uygun servikal ve meme taramasına girmeleri konusunda teşvik edilmelidir. Menopoz sonrası semptomların tedavileri için, HRT yalnızca yaşam kalitesi üzerinde ters etki eden semptomlar için başlatılmalıdır. Tüm durumlarda, en azından yıllık olarak fayda ve riskdikkatli bir şekilde değerlendirilmeli ve yalnızca faydanın riske ağır bastığı durumlardaHRT'ye devam edilmelidir. Östrojen bileşeni için uyarılar ve kontrendikasyonlar HRT rejimibaşlamadan önce dikkate alınmalıdır. Özel kullanım uyarıları Aşağıdaki durumlardan herhangi biri varsa ya da ilk kez ortaya çıkıyorsa, sistemin çıkarılması düşünülmelidir: Auralı migren Alışılmışın dışında şiddetli ya da olağan dışı sık baş ağrısı, Sarılık, Belirgin tansiyon yükselmesi, Kanı etkileyen malign tümör veya remisyondaki lösemiler, Kronik kortikosteroid tedavisi kullanımı, Semptomatik fonksiyonel over kistleriyle ilgili geçmiş öykü, İnme ya da miyokard enfarktüsü gibi aktif ya da daha önceden geçirilmiş ağır arteriyelhastalıklar (MIRENA HRT kullanımı için östrojen ile birlikte kullanıldığında bkz. Bölüm4.3). Arteriyel hastalıkla ilgili şiddetli veya çok sayıda risk faktörü, Trombotik arteriyel veya mevcut herhangi bir embolik hastalık, Akut venöz tromboemboli Genel olarak hormonal kontrasepsiyon kullanan kadınlar sigarayı bırakmak konusunda teşvik edilmelidir. MIRENA, ileri rahim atrofisi olan menopoz sonrası kadınlarda dikkatli bir şekilde kullanılmalıdır. Yerleştirme/çıkarma uyarıları ve önlemleriGenel bilgiler:Yerleştirme tekniği diğer rahim içi cihazlardan farklı olduğu için, doğru yerleştirme tekniğinin öğretilmesinin özellikle üzerinde durulmalıdır. Yerleştirme talimatlarıürünün paketinde bulunmaktadır.Yerleştirme ve çıkarma biraz ağrı ve kanama ile ilişkili olabilir. Yerleştirme zor olursa ve/veya yerleştirme sırasında veya sonrasında olağan dışı ağrı veya kanama meydana gelirse,perforasyon ihtimali düşünülmelidir ve fiziksel muayene ve ultrason gibi uygun işlemleryapılmalıdır (ayrıca bkz. Bölüm 4.4 /Perforasyon) Tek başına fiziksel muayene (iplerinkontrolü dahil) kısmi perforasyonu ekarte etmek için yeterli olmayabilir.Prosedür, bir vazovagal reaksiyon olarak bayılmaya veya bir epilepsi hastasında nöbete neden olabilir. Vazovagal nöbet ile ilgili erken belirtilerin olması halinde, yerleştirmedenvazgeçilmesi veya sistemin çıkarılması gerekebilir. Gerektiğinde serebral kan akışınınsağlanması için kadın supin (yatay) pozisyonda tutulmalı, başı alçaltılmalı ve bacakları dikeypozisyona getirilmelidir. Solunum yolunun açık olması sağlanmalı, hava yolu sistemi (airway)hazırda tutulmalıdır. Persistan bradikardi intravenöz atropinle kontrol altına alınabilir. Mevcutise, oksijen uygulanabilir. Perforasyon: Korpus uterin ya da serviks perforasyonu çoğunlukla yerleştirme sorasında meydana gelebilir ancak bir süre geçene kadar fark edilmeyebilir. Bu şiddetli ağrı ve devameden kanama ile ilişkilendirilebilir. Perforasyondan şüpheleniliyorsa, sistem mümkün olduğukadar erken çıkarılmalıdır; cerrahi müdahale gerekli olabilir. Rahim içi araç/sistem (RİA/RİS) kullamcılarmda (N= 61.448 kadın) yapılan 1 yıllık gözlemleme periyodu olan büyük, prospektif, karşılaştırmalı, girişimsel olmayan bir kohortçalışmasında perforasyon insidansı tüm çalışma kohortunda 1000 insersiyon başına 1,3 (%95GA: 1,1 -1,6); MIRENA kohortunda 1000 yerleştirme başına 1,4 (%95 GA: 1,1-1,8) ve bakırRİA kohortunda 1000 yerleştirme başına 1,1 (% 95 GA: 0,7-1,6) olarak bulunmuştur. Buçalışmanın bir altgrubunda (N = 39.009 MIRENA veya bakır RİA kullanan kadın) gözlemperiyodu 5 yıla uzatıldığında, tüm 5 yıllık periyot boyunca herhangi bir zamanda tespit edilenperforasyon insidansı her 1000 insersiyon için 2 (%95 GA: 1,6 - 2,5) olmuştur. Bu çalışma, insersiyon tarihinde emzirmenin ve doğumdan sonra 36 haftaya kadar insersiyonun perforasyon riskinde artışla ilişkili olduğunu göstermiştir (bkz. Tablo 1). Bu risk faktörleri 5 yılboyunca takip edilen alt grupta doğrulanmıştır. Her iki risk faktörü de yerleştirilen RİA/RİStipinden bağımsızdır. Tablo 1: 1 yılı aşkın süredir gözlemlenen, emzirme ve insersiyon sırasında doğumdan sonra geçen zamana (doğum yapan kadınlar) göre katmanlandırılan tüm çalışma kohortunda 1000insersiyon başına perforasyon insidansı
Perforasyon riski, uterusu retrovert kadınlarda artabilir. Yerleştirmeden sonra tekrar muayene sırasında yukarıdaki Tıbbi muayene" başlığı altında verilen kılavuz bilgiler takip edilmelidir ve bunlar da perforasyon risk faktörleri olan klinikolarak endike olan kadınlara uyarlanabilir.Pelvik enfeksiyon Yerleştirme tüpü, MIRENA'yı yerleştirme sırasında mikroorganizmalarla kontaminasyondan korumaktadır ve MIRENA yerleştirme cihazı enfeksiyon riskini minimuma indirmek üzeretasarlanmıştır. Bakır RİA kullanıcılarında, yerleştirmeden sonraki ilk ayda daha yüksekoranda pelvik enfeksiyon oluşur ve zamanla azalır. Çok sayıda partnerin varlığı, sık cinsel ilişki ve genç yaş pelvik inflamatuvar hastalıklar için bilinen bir risk faktörüdür. Pelvik enfeksiyonun ciddi sonuçları olabilir, fertiliteye zararverebilir ve ektopik gebelik riskini artırabilir. Son derece nadir olmasına rağmen diğer jinekolojik veya cerrahi prosedürlerde olduğu gibi, RİS yerleştirme sonrası şiddetli enfeksiyon veya sepsis (grup A streptokok sepsis dahil)oluşabilir. MIRENA kullanan ve pelvik enfeksiyona ait bulgu ve şikayetleri olan kadınlar için bakteriyolojik muayene endikedir ve hastanın izlenmesi tavsiye edilir ve uygunantibiyotiklere başlanmalıdır. Semptomlar takip eden 72 saat içinde çözümleniyorsa ya dakadın MIRENA'nın çıkarılmasını istemiyorsa M IRBaşarısızlığa yol açan komplikasyonlarYerinden çıkma Rahim içi araçların kısmen ya da bütünüyle yerinden çıkmalarına ilişkin belirtiler arasında kanama ve ağrı mevcuttur. Ancak sistem, kontraseptif korunma kaybına yol açacak şekildekadın fark etmeden de rahim boşluğundan çıkabilir. MIRENA normal şartlar altında kanamamiktarını azalttığından, kanama miktarında meydana gelen bir artış, sistemin yerinden çıkmışolmasına işaret edilebilir. Yerinden çıkma riskleri aşağıdaki durumlarda artabilir: -Yoğun adet kanaması öyküsü olan kadınlarda, -Yerleştirme sırasında vücut kütle indeksi (VKI) normalden fazla olan kadınlarda: bu risk artan VKI ile birlikte artar. Kullanıcıya olası yerinden çıkma belirtileri konusunda tavsiyede bulunulmalı ve MIRENA'nın ipliklerini nasıl kontrol edeceği konusunda talimat verilmelidir. İpliklerhissedilemiyorsa doktoruyla iletişime geçmesi ve MIRENA'nın yeri doğrulanana kadar cinselilişkiden kaçınması veya bir bariyer kontraseptif (kondom gibi) kullanması tavsiyeedilmelidir. Kısmi yerinden çıkarma MIRENA'nın etkililiğini azaltabilir. MIRENA, yerinden kısmen oynamışsa çıkarılmalıdır. Çıkarma esnasında isteniyorsa gebelik ekarte edilerek yenisi takılabilir. İpliklerin görülmemesi Kontrol muayenelerinde servikste geri çekme iplikleri görülmüyorsa, ilk önce gebelik ekarte edilmelidir. İplikler rahim ya da serviks kanalına kaçmış olabilir ve bir sonraki adetkanamasında tekrar ortaya çıkabilir. Gebelik olasılığını ortadan kaldırdıktan sonra ipliklerinyeri uygun bir gereçle nazikçe araştırılarak bulunabilir. Eğer iplikler bulunamazsa, yerindençıkma veya perforasyon olasılığı değerlendirilmelidir. Sistemin gerçek konumunu belirlemekiçin ultrasondan yararlanılabilir ve eş zamanlı olarak alternatif bir kontrasepsiyon yöntemiönerilmelidir. Eğer ultrasonografi cihazı mevcut değilse ya da sonuç alınamazsa batın röntgentetkiki ile MIRENA'nın rahim dışında olma olasılığı kontrol edilmelidir. Kanama düzensizlikleriDüzensiz kanama MIRENA 3 ile 6 aylık bir tedavide adet kanamasında çoğunlukla önemli bir azalma elde eder. Artan menstrüel akış ya da beklenmedik kanama cihazın çıktığına dair gösterge olabilir.Menoraji devam ederse, kadın tekrar muayene edilmelidir. Rahim boşluğunundeğerlendirmesi ultrason taraması ile yapılmalıdır. Endometrial biyopsi de göz önündebulundurulmalıdır. Menopoz öncesi dönemdeki kadınlarda riskMenopoz öncesi kadınlarda tedavinin ilk aylarında düzensiz kanama/lekelenme yaygın olduğu için, MIRENA yerleştirilmeden önce endometriyal patolojinin ekarte edilmesiönerilmektedir. Menopoz dönemi sonrası kadınlarda riskHastanın kontrasepsiyon için önceden yerleştirilen MIRENA'yı kullanmaya devam etmesi durumunda, östrojen replasman tedavisi başlatıldıktan sonra kanama bozukluklarının ortayaçıkması ihtimaline karşı endometriyal patoloji ekarte edilmelidir. Uzun süreli bir tedavisırasında kanama düzensizlikleri gelişirse, düzensiz kanamalar endometrial polip ya da kansersemptomlarını ve işaretlerini maskeleyebileceği için uygun tanısal önlemler alınmalıdır. Çocuk doğurma potansiyeli olan kadınlarda gebelik ne zaman kontrol edilmelidir?: Önceki adetin başlangıcından itibaren altı hafta içinde adet görülmezse, gebelik ihtimali göz önünde bulundurulmalıdır ve sistemin dışarı atılması ekarte edilmelidir. Başka semptomlartarafından endike olmadıkça, adet görmeyen kadınlarda gebelik testinin tekrarlanmasına gerekyoktur. Doğum kontrolü için MIRENA kullanan kadınlar ile yapılan bir çalışmada (n=130),kullanımın ilk yılının sonunda kadınların % 57'si ve % 16'sında sırasıyla oligomenore veamenore görülmüştür. Menoraji için tedavi inceleme önerisi: MIRENA 3 ile 6 aylık bir tedavide adet kanamasında çoğunlukla önemli bir azalma elde eder. Bu süreler dahilinde kan kaybında önemli bir azalma elde edilmezse, alternatif tedavilerdikkate alınmalıdır. Kullanım sırasında diğer risklerEktopik gebelik Ektopik gebelik konusunda mutlak risk M IRIRENA yerindeyken bir kadın hamile kalırsa, ektopik gebeliğin bağıl olasılığı artar. Alt abdominalağrı durumunda ektopik gebelik olasılığı özellikle geciken adetler ile bağlantılı olarak ya daadet görmeyen kadında kanama başlarsa dikkate alınmalıdır. Klinik çalışmalarda MIRENAkullanıcılarında ektopik gebeliğin oranı yaklaşık yılda % 0,1'dir. Gözlem süresi 1 yıl olanbüyük, prospektif, karşılaştırmalı girişimsel olmayan kohort bir çalışmada MIRENA ileektopik gebelik oranı % 0,02'dir. Bu oran herhangi bir kontrasepsiyon kullanmayan kadınlaragöre daha düşüktür (yılda % 0,3-0,5). Önceden dış gebelik öyküsü olan kadınların dış gebelikriski daha yüksektir.Over kistleri MIRENA'nın kontraseptif etkisi başlıca lokal etkisine bağlı olduğundan, fertil yaştaki kadınlarda folikül çatlamasının görüldüğü ovulatuar sikluslar sıklıkla gerçekleşir. Bazenfolikülün atrezisi gecikir ve folikülogenez devam edebilir. Bu büyümüş foliküller, overkistlerinden klinik olarak ayırt edilememektedir. Klinik çalışmalarda elde edilen verilere göreMIRENA kullanan kadınların yaklaşık %7'sinde advers ilaç reaksiyonu olarak over kistibildirilmiştir. Ancak yayınlanan bazı çalışmalar daha yüksek over kisti insidansı bildirmiştir(buna, ultrason taramasının sıklığı ve kriterleri ve hasta popülasyonu dahil faktörler etkiediyor olabilir). Bazı durumlarda pelvik ağrı ya da ağrılı cinsel birleşme söz konusu olsa dabu foliküller çoğunlukla asemptomatiktir. Over kistleri umumiyetle iki ila üç ay içerisinde kendiliğinden kaybolurlar. Bunun gerçekleşmediği olgularda, durumun ultrason vasıtasıyla takip edilmesi ya da diğer tanısal /terapötik önlemlerin alınması önerilir. Cerrahi bir girişim, nadiren gerekebilir. Meme kanseri Menopoz öncesi dönemdeki kadınlarda risk54 epidemiyolojik çalışmanın meta analizine göre, östrojen-progesteron preparatları başta olmak üzere, halihazırda kombine doğum kontrol yöntemlerini (KOK'lar) kullanan kadınlardameme kanseri tanısı konma riskinin göreceli olarak az da olsa arttığı (RR=1,24) bildirilmiştir.Artan risk KOK kullanımının kesilmesinden sonraki 10 yıllık süre içerisinde yavaş yavaşkaybolur. Meme kanseri 40 yaş altı kadınlarda nadir görüldüğünden, halihazırda ve yakınzamanda KOK kullanan kadınlarda meme kanseri tanısına ilişkin yüksek sayı, genel memekanseri riskine göre düşüktür. MIRENA dahil salt progesteron içeren yöntemlerin (POPlar, implantlar ve enjekte edilen ilaçlar) kullanıcılarında teşhis edilen meme kanseri olma riski muhtemelen KOK ileilişkilendirilen ile benzer büyüklüktedir. Ancak, sadece progesteron preparatları için, kanıtçok daha küçük bir kullanıcı popülasyonuna dayanmaktadır ve KOK'lar için olduğu kadarkesin değildir. Menopoz dönemi sonrası kadınlarda riskMeme kanseri riski sistemik (yani oral ya da transdermal) hormon replasman tedavisi (HRT) kullanan menopoz dönemi sonrası kadınlarda artmaktadır. Risk yalnızca östrojen HRT'yegöre birleştirilmiş östrojen-progesteron HRT ile daha yüksektir. M IRPsikiyatrik bozukluklarDepresif duygudurumu ve depresyon, hormonal kontraseptif kullanımıyla sık görülen istenmeyen etkilerdir (bkz. bölüm 4.8. İstenmeyen etkiler). Depresyon ciddi olabilir ve intihardavranışı ve intihar için iyi bilinen bir risk faktörüdür. Duygudurum dalgalanmaları vedepresif semptomlar olması halinde, bu semptomlar tedavinin başlamasından kısa bir süresonra ortaya çıksa dahi kadınlara doktorlarına başvurmaları önerilmelidir. Genel BilgiGlukoz toleransı: Düşük dozlu levonorgestrel glukoz toleransına etki edebilir ve MIRENA kullanan diyabetiklerde kan glukoz konsantrasyonu izlenmelidir. Postkoital Kontrasepsiyon: Sınırlı sayıda deneyim MIRENA'nın postkoital kontraseptif olarak kullanılmaya uygun olmadığını önermektedir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriNot: Muhtemel etkileşimleri tanımlamak üzere eş zamanlı alınan ilaçların reçete bilgilerine bakılmalıdır. Diğer tıbbi ürünlerin MIRENA üzerine etkisiArtan veya azalan cinsiyet hormonları klerensine yol açabilecek mikrozomal enzimleri indükleyen veya inhibe eden ilaçlarla etkileşimler meydana gelebilir. Levonorgestrelklerensini arttıran maddeler, örn.:Fenitoin, barbituratlar, pirimidon, karbamazepin, rifampisin ve muhtemelen ayrıca okskarbazepin, topiramat, felbamat, griseofulvin ve Sarı Kantaron içeren ürünlerBu ilaçların MIRENA'nın kontraseptif etkililiği üzerindeki etkisi bilinmemekte, ancak lokaletki mekanizması nedeniyle çok önemli olduğuna inanılmamaktadır. Levonorgestrelin klerensi üzerinde değişken etkileri olan maddeler:Cinsiyet hormonları ile birlikte uygulandığında, çoğu HIV/HCV proteaz inhibitörü ve non-nükleosit ters transkriptaz inhibitörü, progestin'in plazma konsantrasyonlarını artırabilir veya azaltabilir. Levonorgestrelin klerensini azaltan maddeler (enzim inhibitörleri), örn.:Azol antifungaller (örn. flukonazol, itrakonazol, ketokonazol, vorikonazol), verapamil, makrolidler (örn. klaritromisin, eritromisin), diltiazem ve greyfurt suyu gibi güçlü ve ortaderece CYP3A4 inhibitörleri progestin'in plazma konsantrasyonlarını artırabilir Özel popülasyonlara ilişkin ek bilgilerPediyatrik popülasyon:4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: X Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)MIRENA intrauterin kontrasepsiyon için endikedir. Gebelik dönemiBir gebelik varlığı ya da şüphesinde M IRENA kullanımı kontrendikedir (bkz. Bölüm 4.3). MIRENA kullanımı esnasında bir gebelik meydana gelirse, kullanılmakta olan herhangi birrahim içi doğum kontrol sistemi düşük ve erken doğum riskini artırabileceğinden, sisteminçıkarılması önerilmektedir. MIRENA'nın çıkarılması ya da uterusun içinde aranması spontanabortusla sonuçlanabilir. Ektopik gebelik ekarte edilmelidir (bkz bölüm 4.4). Bu prosedürlerinmümkün olmaması halinde, kadın bakır ve plastik RİA'ların kullanımı sırasında artan spontandüşük ya da erken doğum olasılığı konusunda bilgilendirilmelidir. Bu tür bir gebelik yakındanizlenmelidir. Kadın, ateşli abdominal kramplar gibi gebeliğin komplikasyonları olaraksayılabilecek her türlü belirtiyi bildirmesi konusunda uyarılmalıdır.Ek olarak, intrauterin levonorgestrel maruziyeti nedeniyle dişi bir fetüste artan virilizan etki riski göz ardı edilemez. Levonorgestrel (LNG) RİS (Rahim içi sistem) takılıyken oluşangebelik sırasında levonorgestrele lokal maruziyetin ardından dişi fetüsün dış genitalorganlarının erkekleştirilmesine ilişkin izole vakalar olmuştur. Laktasyon dönemiLevonorgestrel dozunun yaklaşık % 0,1'i emzirme sırasında bebeğe aktarılır. Ancak uterus boşluğuna yerleştirilmiş MIRENA'dan salınan dozun bebek için bir risk oluşturması olasıgörülmemektedir. MIRENA'nın doğum sonrası altıncı haftadan itibaren kullanıldığıdurumlarda, bebeğin büyümesi veya gelişimi ile ilgili zararlı etkilere rastlanmamıştır.Yalnızca progesteron içeren kontrasepsiyon yöntemlerinin anne sütü miktarını ve kalitesinietkilediği gösterilememiştir. Rahim kanaması emzirme döneminde MIRENA kullanankadınlarda nadiren bildirilmiştir. Üreme yeteneği/FertiliteÇalışmalar planlanmış bir gebelik için MIRENA'yı bırakan kadınlarda bir yılda gebelik oranının doğum kontrolü kullanmayanlara benzer olduğunu önermektedir. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerine bilinen bir etkisi yoktur. 4.8. İstenmeyen etkilerAdvers reaksiyonlar, aşağıda sistem-organ sınıfı (MedDRA) ve sıklık derecesine göre listelenmektedir. Sıklık dereceleri şu şekilde tanımlanmaktadır: Çok yaygın (>1/10); yaygın(>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000);çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).İstenmeyen etkiler yerleştirme sonrasındaki ilk bir ayda daha yaygındır ve uzun sürelikullanımda azalır. Çok yaygın olarak görülen istenmeyen etkiler (kullanıcıların %10'undan fazlasında oluşan) arasında lekelenme, oligomenore, amenore dahil rahim/vajinal kanama bulunur (bkz. Bölüm 5.1) İyi huylu yumurtalık kistleri sıklığı kullanılan teşhis yöntemine bağlıdır (bkz. Bölüm 4.4) ancak klinik çalışma verilerinde kullanıcıların % 7'sinde oluştuğu bildirilmiştir. Bağışıklık sistemi hastalıklarıBilinmiyor: Döküntü, ürtiker ve anjiyoödemi içeren hipersensitivite Psikiyatrik hastalıklarıYaygın: Depresif duygu durumu, depresyon, sinirlilik, libido azalması Sinir sistemi hastalıklarıYaygın: Baş ağrısı, migren Vasküler hastalıklarıYaygın: Baş dönmesi Gastrointestinal hastalıklarıYaygın: Abdominal ağrı, bulantı Yaygın olmayan: Abdominal şişkinlik Deri ve derialtı doku hastalıklarıYaygın: Akne, hirsutizm Yaygın olmayan: Saç dökülmesi, prurit, egzama, kloazma/ deri hiperpigmentasyon Seyrek: Döküntü Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıklarıYaygın: Sırt ağrısı Üreme sistemi ve meme hastalıklarıÇok yaygın: lekelenme, oligomenore, amenore dahil rahim/vajinal kanama Yaygın: Over kistleri, pelvik ağrı, dismenore, vajinal akıntı, vulvuvajinit, meme hassasiyeti, memede ağrı Yaygın olmayan: Uterus perforasyonu*, Pelvik inflamatuvar hastalık, endometrit, Servisit Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıYaygın: Dışarı atılan intrauterin kontraseptif cihazlar Yaygın olmayan: Ödem AraştırmalarYaygın: Kilo artışı Bilinmiyor: Kan basıncı artışı *Bu sıklık, RİA/RİS kullanıcıları ile yapılan ve insersiyon sırasında emzirmenin ve doğum yaptıktan sonra 36 haftaya kadar insersiyonun perforasyon için bağımsız risk faktörleriolduğunu gösteren geniş çaplı, prospektif, karşılaştırmalı, girişimsel olmayan bir kohortçalışmaya dayanmaktadır (bkz. Bölüm 4.4). Emziren kadınların dahil edilmediği, MIRENAile yapılan klinik çalışmalarda perforasyon sıklığı seyrek bulunmuştur. Diğer RİS'ler için, yerleştirmeyi takiben sepsis (grup A streptokok sepsis dahil) vakaları bildirilmiştir (bkz. Bölüm 4.4). Bir kadın MIRENA takılı iken gebe kalırsa ektopik gebelik olasılığı göreceli olarak artar (bkz. Bölüm 4.4 ve Bölüm 4.6 ).MIRENA kullanıcılarında meme kanseri vakaları bildirilmiştir (bkz. Bölüm 4.4). Cinsel ilişki sırasında kadının eşi tarafından rahim içi sistemin çıkma riski olduğu hissedilebilir. Östrojen replasman tedavisi sırasında endometrial hiperplazi korumasında MIRENA kullanımımdaki meme kanseri riski bilinmemektedir. Meme kanseri vakaları bildirilmiştir(sıklığı bilinmemektedir, bkz. Bölüm 4.4). Aşağıdaki advers ilaç reaksiyonları MIRENA 'nın yerleştirilmesi ya da çıkarılması ile ilgili olarak bildirilmiştir: Uygulama işlemine bağlı ağrı, Kanama, Baş dönmesi ya da senkop ile ortaya çıkan vazovagal reaksiyonİşlem epileptik hastada nöbete neden olabilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiGeçerli değildir. 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Rahim içi kontraseptifler, Progestojen içeren plastik RİA ATC kodu: G02BA03 Levonorgestrel jinekolojide birçok amaçla kullanılan, anti-östrojenik aktivitesi olan bir progesterondur: oral kontraseptiflerin ve hormon replasman tedavisinin progesteron bileşeniolarak veya tek başına, sadece progesteron içeren gebeliği önleyici haplarda ve subdermalimplantlarda kullanılır. Levonorgestrel aynı zamanda bir rahim içi salım sistemi ile rahimboşluğuna da uygulanabilmektedir. Hormon salımı doğrudan hedef organdagerçekleştiğinden, çok düşük günlük dozlarla tedaviye olanak sağlanır. MIRENA'nın kontraseptif etki mekanizması aslen aşağıdaki değişiklikleri üreten hormonal etkilere dayalıdır: - Endometriumun proliferasyonunun önlenmesi - Servikal mukusun kalınlaşarak spermin geçisinin engellenmesi - Bazı kadınlarda ovülasyonun baskılanması. Sistemin rahimde fiziksel varlığınında kontraseptif etkisine küçük bir katkıda bulunabileceği beklenmelidir. MIRENA kullanan 3330 kadının katıldığı 5 büyük klinik çalışmada M IRENA'nın kontraseptif etkililiği üzerine çalışılmıştır. Başarısızlık oranı (Pearl İndeks) yaklaşık 1 yılda%0,2, kümülatif hata oranı 5 yılda yaklaşık %0,7'dir. Başarısızlık oranı, saptanmamışyerinden çıkmalar ve perforasyonlara bağlı gebelikleri de içermektedir. MIRENA kullanan17000'dan fazla kadın ile yapılan geniş bir pazarlama sonrası çalışmada benzer kontraseptifetkililik gözlenmiştir.43000 MIRENA kullanıcısını içeren ve gözlem süresi 1 yıl olan büyük, prospektif, karşılaştırmalı girişimsel olmayan kohort bir çalışmada MIRENA nin Pearl Endeksi % 0,06'dır (% 95 GA: 0,04-0,09). M IRENA kullanımı kullanıcıların günlük alım uyumunugerektirmediğinden, "tipik kullanımdaki" gebelik oranları kontrollü klinik çalışmalardagözlenenlerle benzerdir ("mükemmel kullanım").MIRENA özellikle aşırı adet kanaması olan hastalarda doğum kontrolü için faydalı olabilir ve idiyopatik menoraji tedavisinde başarıyla kullanılabilir. Menorajik kadında menstrual kankaybı 3 ay sonunda %62-94 ve 6 ay sonunda %71-95 oranında azalmıştır. Endometrialablasyon ya da rezeksiyona göre MIRENA iki yıla dek menstrual kan kaybı azalmasında eşitetkililik göstermiştir. Submukozal fibroidlerin neden olduğu menoraji bu tedaviye daha azyanıt verebilir. Azalmış kanama hemoglobin konsantrasyonunu artırır. M IRENA'nın aynızamanda dismenore üzerinde de olumlu etkileri görülmüştür.Oral ya da transdermal kesintisiz Östrojen tedavisi sırasında MIRENA endometrial hiperplaziyi eşit etkililikte önlemiştir. Östrojen tedavisinin yalnız başına verildiği durumlardahiperplazi gözlenme oranı % 20 gibi yüksek bir değerdir. Toplam 634 perimenopozal vepostmenopozal MIRENA kullanıcısında yapılan klinik çalışmalarda, dört yıla kadar herhangibir endometriyal hiperplazi görülmemiştir. Kanama Durumları:Farklı türde kanama değişiklikleri (sık, uzun süreli ya da ağır kanama, lekelenme, oligomenore, amenore) MIRENA kullamcılarm hepsi tarafından deneyimlenmiştir. Doğurgankadınlarda ortalama lekelenme günü/ay sayısı kullanımın ilk altı ayı boyunca dokuzdan dörtgüne doğru kademeli olarak azalmaktadır. Uzun süreli kanama yaşayan kadınların yüzdesi(sekiz günden fazla) kullanımın ilk üç ayı sırasında %20'den %3'e azalmaktadır. Klinikçalışmalarda kullanımın ilk yılında kadınların %17'si en az üç aylık süreli amenore yaşamıştır. Östrojen replasman tedavisi ile birlikte kullanıldığında, MIRENA'nın menopoz öncesi kullanıcıları tedavinin ilk aylarında lekelenme ve düzensiz kanama yaşayabilir. Kanamamiktarı ilk yıl içinde minimal hale gelir ve kullanıcıların %30-60'ının kanamaları tamamendurur. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:MIRENA'nın etkin maddesi levonorgestreldir. Levonorgestrel doğrudan uterus boşluğuna salınır. Farklı zaman noktaları için tahmini in vivosalım hızları Tablo 2'de sunulmaktadır.Düşük plazma konsantrasyonları nedeniyle metabolizma üzerinde yalnızca önemsiz etkiler vardır.
Dağılım:Levonorgestrelin farmakokinetik özellikleri kapsamlı olarak araştırılmış ve literatürde rapor edilmiştir. Oral olmayan eş zamanlı östrojen alan Menopoz sonrası dönemdeki MIRENAkullanıcılarında plazma Levonorgestrel konsantrasyonları 56 hafta, 24 ay ve 48 ayda sırasıyla276 ±119 pg/ml, 196 ± 87pg/ml ve 177 ± 70 pg/ml olmuştur. Biyotransformasyon:Levonorgestrel yoğun olarak proteinlere bağlanır (aslen seks hormonu bağlayıcı globulin (SHBG)) ve yoğun şekilde büyük sayıda inaktif metabolitler olarak metabolize edilir. Eliminasyon:20 saatlik bir yarılanma ömrü en iyi tahmin olarak kabul edilirken bazı çalışmalar 9 saat kadar kısa, bazıları ise 80 saat kadar uzun değerler bildirmiştir. Diğer sentetik steroidler ile olandeneyim ile uyumlu olsa da bir başka önemli bulgu, ilacın intravenöz yolla verilmesinerağmen kişiler arasında metabolik temizlenme açısından dikkat çeken farklılıklardır.  Doğrusallık/Doğrusal olmayan durum:Levonorgestrelin farmakokinetiği, östrojenler ve androjenlerden etkilenen SHBG konsantrasyonuna bağlıdır. SHBG konsantrasyonundaki bir azalma, serumdaki toplam levonorgestrel konsantrasyonunda bir azalmaya yol açar, bu da levonorgestrelin zamana göre doğrusal olmayanfarmakokinetiğini gösterir. MIRENA'nın esas olarak lokal etkisine dayanarak, MIRENA'nınetkinliği üzerinde herhangi bir etki beklenmemektedir. 5.3. Klinik öncesi güvenlilik verileriLevonorgestrel anti-östrojenik aktivitesi olan iyi değerlendirilmiş bir progesterondur. Sistemik uygulama sonrasındaki emniyet profili yeterli düzeyde belgelenmiştir. Levonorgestrelinmaymunlarda 12 ay boyunca uterus içi salınımı, lokal farmakolojik aktivitesinin iyi bir lokaltolerans gösterdiğini ve hiçbir sistemik toksisite belirtisi olmadığını doğrulamıştır.Levonorgestrelin tavşanlarda uterus içi uygulanması sonrasında hiçbir embriyotoksisiteyerastlanmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiPolidimetilsiloksan elastomer Susuz kolloidal silikaPolietilenBaryum sülfatDemir oksit 6.2. GeçimsizliklerGeçerli değildir. Raf ömrü6.3.36 ay 6.4. Saklamaya yönelik özel tedbirler30°C altında, güneş ışığından ve nemden uzak bir yerde saklayınız. 6.5. Ambalajın niteliği ve içeriğiÜrün, soyulabilir kapaklı, termoformlu blister ambalaj içindedir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller, Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBayer Türk Kimya San. Ltd. Şti. Fatih Sultan Mehmet Mah. Balkan Cad. No: 53 34770 Ümraniye/İstanbulTel: 0216 528 36 00Faks: 0216 645 39 50 8. RUHSAT NUMARASI106/94  9. ILK RUHSAT TARIHI / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 13.12.1999 Ruhsat yenileme tarihi: 13.12.2009 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriMirena 52 Mg Rahim Içi SistemEtken Maddesi: Levonorgestrel Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.