Rivoksar 2,5 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA URUN BILGISI¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBI URUNUN ADIRİVOKSAR 2,5 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:
2,5 mg
Rivaroksaban Yardımcı maddeler:
147,5 mg
Laktoz granül (laktoz monohidrat SD) (sığır sütünden elde edilir) Yardımcı maddelerin tam listesi için 6.1'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet. RİVOKSAR 2,5 mg Film Kaplı Tablet; sarı renkli, yuvarlak, bikonveks, bir yüzü ''R1' 'baskılı diğer yüzü düz film kaplı tablettir. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarRİVOKSAR, tek başına asetilsalisilik asit (ASA) ya da ASA ile birlikte tienopiridinler (klopidogrel veya tiklopidin) ile kombinasyon şeklinde, akut koroner sendrom (AKS) (STelevasyonsuz ya da ST elevasyonlu miyokard infarktüsü (MI) ya da anstabil angina) sonrasıhastalarda kardiyovasküler (KV) ölüm, miyokard infarktüsü ve stent trombozununönlenmesinde endikedir (bkz. bölüm 4.2). RİVOKSAR, ASA ile birlikte uygulandığında, yüksek iskemik olay riski taşıyan koroner arter hastalığı (KAH) veya semptomatik periferik arter hastalığı (PAH) olan yetişkin hastalardaaterotrombotik olayların önlenmesinde endikedir. 4.2 Pozoloji ve uygulama şekliPozolojiÖnerilen doz günde iki kez 2,5 mg'dır.  Pozoloji ve uygulama sıklığıAKSGünde iki kez RİVOKSAR 2,5 mg alan hastalar ayrıca 75-100 mg/gün ASA dozu ya da 75 mg/gün klopidogrel veya standart günlük tiklopidin dozuna ek olarak 75-100 mg/gün ASAdozu almalıdır. KAH veya PAHGünde iki kez RİVOKSAR 2,5 mg alan hastalar aynı zamanda 75 - 100 mg ASA/gün dozu da almalıdır. Uygulama süresiAKSTedavi, düzenli olarak hasta bazında değerlendirilmeli; iskemik olay riski, kanama riski karşısında tartılmalıdır. 24 aya kadar olan deneyimler sınırlı olduğundan, tedavinin 12 aydanuzun süreyle devam ettirilmesi hasta bazında değerlendirilmelidir (bkz. bölüm 5.1). KAH veya PAHTedavi süresi, düzenli değerlendirmelere göre her bir hasta için belirlenmeli ve kanama risklerine karşı trombotik olay riski göz önüne alınmalıdır. Uygulama şekliRİVOKSAR oral kullanım içindir. RİVOKSAR yemeklerle birlikte ya da ayrı alınabilir (bkz. bölüm 4.5 ve bölüm 5.2). Tabletleri bütün olarak yutamayan hastalar için RİVOKSAR tablet kullanımdan hemen önce ezilip su veya elma püresi gibi yumuşak gıdalarla karıştırılarak oral yoldankullanılabilmektedir. Ezilen RİVOKSAR tablet tüpün doğru gastrik pozisyonda olduğu doğrulandıktan sonra gastrik tüp yoluyla da verilebilir. Ezilen tablet, gastrik tüp aracılığıyla az miktarda su içindeuygulanmalı ve ardından tüp su ile yıkanmalıdır (bkz. bölüm 5.2). AKSRİVOKSAR ile tedavi, AKS olayının (revaskülarizasyon prosedürleri dahil) stabilizasyonundan sonra mümkün olan en kısa sürede; hastanın hastaneye kabulünden en erken24 saat sonra ve parenteral antikoagülasyon tedavisinin normalde kesileceği zamanbaşlatılmalıdır. KAH veya PAHAkut trombotik olay veya vasküler prosedürü olan ve ikili antiplatelet tedavisine ihtiyaç duyan hastalarda günde iki kez RİVOKSAR 2,5 mg uygulamasının sürdürülmesi, olayın veyaprosedürün türüne ve antiplatelet rejimine bağlı olarak değerlendirilmelidir. ASA artıklopidrogel/tiklopidinle kombine olarak günde iki kez RİVOKSAR 2,5 mg'ın güvenliliği veetkililiğine dair sadece yakın zamanda AKS'si olan hastalarla çalışma yapılmıştır (bkz. bölüm4.1). KAH veya PAH hastalarında günde iki kez RİVOKSAR 2,5 mg ile kombine olarak ikiliantiplatelet tedavisine ilişkin çalışma yapılmamıştır (bkz. bölüm 4.4 ve bölüm 5.1). Bir doz atlanması halinde, hasta bir sonraki programlanmış zamanda tavsiye edilen şekilde normal dozu almaya devam etmelidir. Eksik dozu telafi etmek için iki kat doz alınmamalıdır.
Tedavinin VitaminKAntagonistlerinden (VKA) RİVOKSAR'a değiştirilmesiVKA tedavisi gören hastalarda tedavinin RİVOKSAR'a değiştirilmesinde, RİVOKSARalınmasının ardından INR (Uluslararası Normalizasyon Oranı değerleri yalancı yükselmegösterecektir. INR, RİVOKSAR'ın antikoagülan aktivitesinin ölçümü için geçerli bir ölçümdeğildir ve bu nedenle kullanılmamalıdır (bkz. bölüm 4.5).Tedavinin RİVOKSAR'dan Vitamin K antagonistlerine (VKA) değiştirilmesiRİVOKSAR tedavisinden VKA tedavisine geçiş sırasında yetersiz antikoagülasyon olasılığımevcuttur. Alternatif herhangi bir antikoagülana geçişte sürekli ve yeterli antikoagülasyonsağlanmalıdır. RİVOKSAR'ın INR yükselmesine katkıda bulunabileceğine de dikkatedilmelidir.RİVOKSAR tedavisinden VKA tedavisine geçiş yapılan hastalarda INR > 2.0 olana dek VKA eş zamanlı olarak verilmelidir. Değişim periyodunun ilk iki gününde VKA'nın standartbaşlangıç dozu kullanılmalı ve onu INR testi rehberliğinde VKA dozu takip etmelidir. Hastalarhem RİVOKSAR ve hem de VKA kullanırken INR, RİVOKSAR'ın bir sonraki dozundan öncetest edilmeli ancak önceki dozdan sonra 24 saatten önce test edilmemelidir. RİVOKSAR'ınkesilmesinin ardından son dozdan 24 saat sonra INR testi güvenilir biçimde yapılabilir (bkz.bölüm 4.5). Tedavinin parenteral antikoagülanlardan RİVOKSAR' 'a değiştirilmesiHalihazırda parenteral antikoagülan ile tedavi edilen hastalarda parenteral antikoagülan kesilir ve RİVOKSAR tedavisine parenteral ilacın (örn. düşük molekül ağırlıklı heparin) bir sonrakiplanlanan dozundan 0 ila 2 saat önce ya da sürekli uygulanan parenteral ilacın (örn. intravenözfraksiyone olmayan heparin) kesilme zamanında başlanır. Tedavinin RİVOKSAR'danparenteral antikoagülanlara değiştirilmesiİlk parenteral antikoagülan dozu bir sonraki RİVOKSAR dozunun alınacağı zamanda uygulanmalıdır. Özel popülasyonlara ilişkin ek bilgilerBöbrek yetmezliği:Ciddi böbrek yetmezliği olan hastalardan (kreatinin klirensi 5 - 29 mL/dak) elde edilen kısıtlı klinik veriler, bu hasta popülasyonunda rivaroksaban plazma düzeylerinin anlamlı derecedearttığına işaret etmektedir. Bu nedenle, RİVOKSAR bu hasta popülasyonunda dikkatlikullanılmalıdır (bkz. bölüm 4.4). Kreatinin klirensi <15 mL/dak olan hastalarda RİVOKSAR kullanımı önerilmemektedir (bkz. bölüm 5.2). Hafif (kreatinin klirensi: 50-80 mL/dak) veya orta derecede (kreatinin klerensi: 30 - 49 mL/dak) derecede böbrek yetmezliği olan hastalarda doz ayarlaması gerekmemektedir (bkz. bölüm 4.3ve 5.2). Karaciğer yetmezliği:RİVOKSAR, Child Pugh B ve C derecesinde sirozu olan hastalar dahil olmak üzere koagülopati ve klinik açıdan anlamlı kanama riski ile ilişkili karaciğer hastalığı olan hastalardakontrendikedir (bkz. bölüm 4.3 ve bölüm 5.2).
Pediyatrik popülasyon:RİVOKSAR'ın güvenlilik ve etkililiği 0 ile 18 yaş arası çocuklarda belirlenmemiştir. Bu konuda veri bulunmamaktadır. Bu nedenle, 18 yaşından küçüklerde RİVOKSAR kullanımıönerilmemektedir. Geriyatrik popülasyon:Doz ayarlaması gerekmemektedir (bkz. bölüm 4.4 ve bölüm 5.2). Kanama riski, yaş ilerledikçe artar (bkz. bölüm 4.4). Diğer:Vücut ağırlığı:Doz ayarlaması gerekmemektedir (bkz. bölüm 4.4 ve bölüm 5.2). Cinsiyet:Doz ayarlaması gerekmemektedir (bkz. bölüm 5.2). 4.3 KontrendikasyonlarRİVOKSAR aşağıdaki durumlarda kontrendikedir: Rivaroksabana ya da tablet içeriğindeki diğer maddelere (bkz. Bölüm 6.1) karşı aşırıduyarlılık, Klinik olarak anlamlı kanama, Mevcut veya yeni geçirilmiş gastrointestinal ülserasyon veya kanama riski yüksekmalign neoplazm varlığı, yeni geçirilmiş beyin veya omurilik yaralanmaları, yenigeçirilmiş beyin, omurilik ameliyatı veya oftalmik ameliyat, yakın zamanda gelişmişolan intrakraniyal kanama, bilinen veya şüphelenilen özefagus varisleri, arteriyovenözmalformasyonlar, vasküler anevrizmalar veya majör intraspinal ya da intraserebralvasküler anomaliler gibi majör kanama bakımından anlamlı risk teşkil eden lezyon veyadurumlar, Açık bir santral venöz veya arteriyel kateterin açık kalması için gereken dozlardafraksiyone olmayan heparin (UFH) kullanılan durumlar veya antikoagülan tedavidegeçiş yapılan özel koşullar (bkz. bölüm 4.2) hariç olmak üzere, herhangi bir diğerantikoagülan ilaçla [örn. UFH, düşük molekül ağırlıklı heparinler (enoksaparin,dalteparin vb.), heparin türevleri (fondaparinuks vb.) oral antikoagülanlar (varfarin,apiksaban, dabigatran eteksilat, edoksaban vb.)] eş zamanlı tedavi (bkz. bölüm 4.5), Önceden inme veya geçici iskemik atak (TİA) geçirmiş olan hastalarda AKS tedavisiiçin antiplatelet tedavisiyle eş zamanlı tedavi (bkz. bölüm 4.4), Önceden hemorajik veya laküner inme veya bir ay içinde inme geçirmiş hastalardaKAH/PAH tedavisi ile eş zamanlı ASA tedavisi (bkz. bölüm 4.4), Child Pugh B ve C'li siroz hastaları dahil olmak üzere koagülopati ve klinik açıdananlamlı kanama riskiyle ilişki i hgpatik iha&tal(bkztııbölüm 5.2),  4 Gebelik ve laktasyon döneminde (bkz. bölüm 4.6). 4.4 Özel kullanım uyarıları ve önlemleriAKS hastalarında, rivaroksaban 2,5 mg'ın etkililiği ve güvenliliği tek başına ASA antiplatelet ajanlarıyla kombine olarak veya ASA artı klopidrogel/tiklopidinle araştırılmıştır. Prasugrelveya tikagrelor vb. diğer antiplatelet ajanlarıyla kombine tedavi hakkında çalışmayapılmamıştır, dolayısıyla önerilmemektedir. Yüksek iskemik olay riski olan KAH/PAH hastalarında, rivaroksaban 2,5 mg'ın etkililiği ve güvenliliği ASA ile kombine olarak incelenmiştir. Antikoagülasyon uygulamasına paralel klinik gözetim tedavi dönemi boyunca önerilmektedir. Kanama riski:Diğer antikoagülanlarla olduğu gibi, RİVOKSAR alan hastaların kanama belirtileri açısından dikkatle gözlemlenmesi gerekir. Kanama riskinin arttığı durumlarda dikkatle kullanılmasıtavsiye edilir. Ciddi kanama meydana gelirse RİVOKSAR uygulaması kesilmelidir (bkz. bölüm4.9). Klinik çalışmalarda, mukozal kanamalar (burun, dişeti kanaması, gastrointestinal kanama, anormal vajinal kanama veya artan adet kanaması dahil genito üriner kanama) ve anemi, teklive çift anti-platelet tedavisinin yanı sıra uzun süreli rivaroksaban tedavisi sırasında daha sıkgörülmüştür. Bu yüzden, yeterli klinik gözetime ek olarak, hemoglobin/hematokrite yöneliklaboratuvar testleri, okült kanamayı tespit etmek ve uygun olduğu kararı verildiği üzere açıkkanamanın klinik açıdan anlamının miktarını tayin etmek için çok değerli olabilir. Aşağıda ayrıntılı açıklandığı üzere, pek çok hasta alt grubu artmış kanama riski altındadır. Bu hastalarda, çift anti-platelet tedavisi ile kombine olarak RİVOKSAR kullanımı, kanamaaçısından riske karşı aterotrombotik olayların önlenmesi açısından faydaya karşıdengelenmelidir. Buna ilaveten, bu hastalar tedavi başlatıldıktan sonra kanamakomplikasyonları ve anemi belirti ve bulguları açısından dikkatlice izlenmelidir (bkz. bölüm4.8). Hemoglobin de ya da kan basıncında herhangi bir açıklanamayan düşüş varsa, kanama yeri aranmalıdır. Rivaroksaban ile tedavi, rutin maruziyet takibi gerektirmez. Bununla birlikte, doz aşımı ve acil cerrahi gereksinim gibi istisnai klinik durumlarda kararları almaya yardım edebileceği istisnaidurumlarda, kalibre edilmiş kantitatif bir anti-faktör Xa testi ile ölçülen rivaroksaban seviyeleriile sağlanan rivaroksaban maruziyeti bilgisi faydalı olabilir (bkz. bölüm 5.1 ve bölüm 5.2). Böbrek yetmezliği:Ciddi böbrek yetmezliği olan hastalarda (kreatinin klirensi < 30 mL/dak.) rivaroksaban plazma düzeyleri, kanama riskinde artışa yol açabilecek şekilde anlamlı derecede (ortalama 1,6 kat)yükselebilir. RİVOKSAR, kreatinin klirensi 15-29 mL/dak. olan hastalarda dikkatlikullanılmalıdır. Kreatinin klirensi < 15 mL/dak. olan hastalarda kullanılması önerilmemektedir(bkz. bölüm 4.2 ve bölüm 5.2).
Orta derecede böbrek yetmezliği olan (kreatinin klirensi 30 - 49 mL/dak.) ve eş zamanlı olarak rivaroksaban plazma konsantrasyonlarını artıran başka ilaçlar almakta olan hastalardaRİVOKSAR dikkatli kullanılmalıdır (bkz. bölüm 4.5). Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri:Azol-antimikotikler (örn. ketokonazol, itrakonazol, vorikonazol ve posakonazol) veya HIV proteaz inhibitörleri (örn. ritonavir) ile eş zamanlı sistemik tedavi gören hastalarda RİVOKSARkullanımı tavsiye edilmez. Bu etkin maddeler hem CYP3A4'ün, hem de P glikoproteinin (p-gp)'in güçlü inhibitörleridir, bu ilaçlar rivaroksaban plazma konsantrasyonunu klinik olarakönemli derecede (ortalama 2,6 kat) arttırabilir; bu da kanama riskinde yükselmeye yol açabilir(bkz. bölüm 4.5). Hastalar, non-steroid anti-inflamatuvar ilaçlar (NSAID'ler), asetilsalisilik asit (ASA), trombosit agregasyon inhibitörleri veya seçici serotonin geri alım inhibitörleri (SSRI) veya serotoninnorepinefrin geri alım inhibitörleri (SNRI) gibi hemostazı etkileyen tıbbi ürünlerle eş zamanlıolarak tedavi edilirken dikkatli olunmalıdır. Ülseratif gastrointestinal hastalık riski olanhastalarda uygun bir profilaktik tedavi düşünülebilir (bkz. bölüm 4.5 ve bölüm 5.1). RİVOKSAR ve ASA veya RİVOKSAR ve ASA artı klopidogrel/tiklopidin tedavisi uygulanan hastalara, sadece faydanın kanama riskine ağır basması halinde NSAID'lerle kronik eş zamanlıtedavi uygulanmalıdır. Diğer kanama riski faktörleri:RİVOKSAR, diğer antitrombotikler gibi, kanama riskinin arttığı aşağıdaki durumlarda önerilmemektedir: Konjenital ya da edinilmiş kanama bozuklukları Kontrolsüz ciddi arteriyel hipertansiyon Aktif ülser olmaksızın kanama komplikasyonuna yol açabilecek diğer gastrointestinalhastalıklar (ör. inflamatuar bağırsak hastalığı, özefajit, gastrit ve gaströzefageal reflühastalığı) Vasküler retinopati Bronşiektazi ya da pulmoner kanama öyküsü Aşağıdaki AKS ve KAH/PAH hastalarında dikkatli kullanılmalıdır: - >75 yaş, tek başına ASA veya ASA + klopidogrel veya tiklopidin ile eş zamanlıuygulandığında, Tedavinin fayda risk dengesi düzenli olarak ayrı ayrı değerlendirilmelidir. - Vücut ağırlığı düşük olan (60 kg'dan az), tek başına ASA veya ASA + klopidogrel veyatiklopidin ile eş zamanlı uygulandığında. - Şiddetli semptomatik kalp yetmezliği olan KAH hastaları. Çalışma verileri bu tür hastaların rivaroksaban tedavisinden daha az fayda sağlayabileceğinigöstermektedir (bkz. bölüm 5.1). Kanser hastaları:Malign hastalığı olan hastalar aynı zamanda yüksek kanama ve tromboz riskiyle de karşı karşıya olabilir. Antitrombotik tedavinin bireysel faydası, tümörün yeri, antineoplastik tedavive hastalığın evresine bağlı olarak aktif kanserli hastalarda kanama riskine göredeğerlendirilmelidir. Gastrointestinal veya genitoüriner kanalda bulunan tümörler rivaroksaban .1 j1'Bu belge. güvenliıelektr<)mk İmza ik imzakrunıstır..tgdavaisoâırasın4ak&a3Ç}s&in«rIAlifkilenderıig(mıliK.Belge Do¦dresi:https://www.turkiye.gov.tr/saglik-titck-ebys Yüksek kanama riski bulunan malign neoplazmı olan hastalarda rivaroksaban kullanımı kontrendikedir (bkz. bölüm 4.3). Prostetik kalp kapakçığı olan hastalar:Rivaroksaban, yakın zamanda transkateter aort kapak replasmanı (TAVR) geçirmiş hastalarda tromboprofilaksi için kullanılmamalıdır. Prostetik kalp kapağı olan hastalarda rivaroksabanıngüvenliliği ve etkililiğine ilişkin çalışma yapılmamıştır; dolayısıyla RİVOKSAR'ın bu hastapopülasyonu için yeterli anti-koagülasyon sağladığını destekleyen veri mevcut değildir. Buhastalar için Rivaroksaban ile tedavi önerilmemektedir. Antifosfolipid antikor sendromlu olan hastalarAntifosfolipid antikor sendromu tanısı ve tromboz öyküsü bulunan hastalarda, rivaroksaban dahil olmak üzere direkt etkili oral antikoagülan (DOAK) kullanımı önerilmez. Özellikle üçlüpozitif (lupus antikoagülanı, antikardiyolipin antikorları ve anti-beta 2-glikoprotein Iantikorları) hastalarda, DOAK tedavisi, K vitamin antagonisti tedavisine kıyasla, daha yüksekoranda rekürren trombotik olaylarla ilişkili olabilir. Önceden inme ve/veya TİA'sı olan hastalar:AKS hastalarıRİVOKSAR 2,5 mg, önceden inme veya TİA öyküsü olan hastalarda AKS tedavisi için kontrendikedir (bkz. bölüm 4.3). Önceden inme veya TİA geçirmiş olup AKS gelişen az sayıdahastayla çalışılmış olmakla birlikte, mevcut sınırlı etkililik verileri bu hastaların tedavidenfayda görmeyeceğine işaret etmektedir. KAH/PAH hastalarıÖnceden hemorajik veya lakünar inme öyküsü olan veya önceki ay içinde laküner olmayan inme geçirmiş KAH/PAH hastaları ile ilgili çalışma yapılmamıştır (bkz. bölüm 4.3). Spinal/epidural anestezi veya ponksiyon:Tromboembolik komplikasyonların önlenmesi için antitrombotik ajanlarla tedavi gören hastalarda nöraksiyal anestezi (spinal/epidural anestezi) ya da spinal/epidural ponksiyonuygulandığında, uzun dönemli veya kalıcı paralizi ile sonuçlanabilecek epidural ya da spinalhematom gelişme riski ile karşı karşıya gelir. Bu olaylara ilişkin risk, kalıcı epidural kateterlerin kullanımı sırasında ya da hemostazı etkileyen tıbbi ürünlerin eş zamanlı kullanımıyla artabilir. Bu risk, travmatik ya da tekrarlananepidural veya spinal ponksiyon ile de artabilir. Hastaların nörolojik bozukluk belirti ve bulgularına (örn. sersemlik hissi, bacaklarda güçsüzlük, bağırsak veya mesane işlev bozuklukları) karşı sık sık izlenmesi gerekmektedir. Nörolojikbozukluk görülürse, acil tanı ve tedavi gerekir. Antikoagüle olmuş hastalarda veyatromboprofilaksi için antikoagüle edilecek hastalarda nöraksiyal müdahaleden önce, doktorunriske karşı olası faydayı değerlendirmesi gerekir. Bu durum için rivaroksaban 2,5 mg'ın tekbaşına ASA ile birlikte veya ASA artı klopidrogel veya tiklopidinle kullanımına ilişkin klinikdeneyim mevcut değildir.
Nöraksiyal (epidural/spinal) anestezi veya spinal ponksiyon uygulamaları ile eş zamanlı rivaroksaban kullanım ile ilişkili olası kanama riskini azaltmak için rivaroksabanınfarmakokinetik profili göz önünde bulundurulmalıdır. Epidural kateter yerleştirme veya çıkarma veya lombar ponksiyon işlemi en iyi şekilde, rivaroksabanın antikoagülan etkisi düşük iken uygulanabilir (bkz. bölüm 5.2). Bununla birlikte,her hastada yeterli derecede düşük bir antikoagülan etkiye ulaşmak için kesin sürebilinmemektedir. Trombosit agregasyon inhibitörleri, ürünlerin kısa ürün bilgilerinin belirttiği şekilde kesilmelidir. İnvazif prosedürler ve cerrahi müdahale öncesinde ve sonrasında doz önerileri:Bir invazif prosedür veya cerrahi müdahale gerekiyorsa, RİVOKSAR 2,5 mg müdahaleden en az 12 saat önce ve doktorun klinik kararına göre kesilmelidir. Bir hasta elektif cerrahigeçirecekse ve antiplatelet etki istenmiyorsa, trombosit agregasyon inhibitörleri, ürünlerin kısaürün bilgilerinin belirttiği şekilde kesilmelidir. Prosedür geciktirilemeyecekse, müdahalenin aciliyetine karşı artan kanama riski değerlendirilmelidir. Rivaroksaban, klinik durumun izin vermesi ve tedavi eden doktorun belirlediği şekilde yeterli hemostaz gerçekleştirilmesi koşuluyla, invazif prosedür veya cerrahi müdahaleden sonramümkün olan en kısa sürede yeniden başlatılmalıdır (bkz. bölüm 5.2). Geriyatrik popülasyon:Yaş ilerledikçe hemorajik risk artabilir (bkz. bölüm 5.1 ve bölüm 5.2). Dermatolojik reaksiyonlar:Rivaroksaban kullanımıyla ilişkili olarak pazarlama sonrası gözetim sırasında Stevens-Johnson sendromu/toksik epidermal nekroliz ve DRESS sendromu dahil olmak üzere, ciddi ciltreaksiyonları bildirilmiştir (bkz. bölüm 4.8). Hastalar bu reaksiyonlarla ilgili en yüksek riskitedavi sürecinin başlarında taşımaktadır: reaksiyon başlangıcı vakaların büyük bölümündetedavinin ilk haftalarında meydana gelir. Rivaroksaban, ciddi cilt döküntüsü (örn. yayılan,şiddetli ve/veya vezikül oluşturan) veya mukozal lezyonlarla ilişkili başka bir hipersensitivitebulgusu ilk ortaya çıktığında kesilmelidir. Yardımcı maddeler ile ilgili bilgi:RİVOKSAR laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorbsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriCYP3A4 ve P glikoprotein (P-gp) inhibitörleri:Rivaroksabanın ketokonazol (günde bir kez 400 mg) veya ritonavir ile (günde iki kez 600 mg) eş zamanlı kullanımı, farmakodinamik etkilerde kanama riskinin artmasına yol açabilecekanlamlı artışlarla birlikte, ortalama rivaroksaban EAA'sında (eğri altına alan) 2,6 kat / 2,5 katartışa ve ortalama rivaroksaban Cmaks'ında 1,7 kat / 1,6 kat artışa yol açmıştır. Bu nedenle, Rivaroksaban'ın eş zamanli,oâjak'kstok9flâzoizitEak0nazolr. vorikonaz°l ve posakonaz°l gibi  8azol-antimikotikler ya da HIV proteaz inhibitörleri (örn. ritonavir) ile sistemik tedavi gören hastalarda kullanılması önerilmemektedir. Bu etkin maddeler hem CYP3A4 hem de P-gp'ningüçlü inhibitörleridir (bkz. bölüm 4.4). Rivaroksabanın eliminasyon yollarından (CYP3A4 ya da P-gp) sadece birini kuvvetli şekilde inhibe eden diğer etkin maddelerin, rivaroksaban plazma konsantrasyonlarını daha düşük birdüzeyde arttırması beklenmektedir. Örneğin, güçlü bir CYP3A4 inhibitörü ve orta derecede birP-gp inhibitörü olarak kabul edilen klaritromisin (günde iki kez 500 mg), ortalama rivaroksabanEAA'sında 1,5 kat, ve Cmaks'ında 1,4 kat artışa yol açar. Klaritromisin ile etkileşimin çoğu hastada klinik olarak anlamlı olması muhtemel olmamakla birlikte, yüksek risk taşıyan hastalarda anlamlı olabilir. (Böbrek yetmezliği olan hastalar için,bkz. bölüm 4.4). CYP3A4 ve P-gp'yi orta derecede inhibe eden eritromisin (500 mg günde üç kez), ortalama rivaroksaban EAA'sı ve Cmaks'ında 1,3 kat artışa neden olmuştur. Eritromisin ile etkileşiminçoğu hastada klinik olarak anlamlı olması muhtemel olmamakla birlikte, yüksek risk taşıyanhastalarda anlamlı olabilir. Hafif böbrek yetmezliği olan hastalarda, eritromisin (günde üç kez 500 mg) böbrek fonksiyonu normal olan gönüllülere göre ortalama rivaroksaban EAA değerinde 1,8 kat artış ve Cmaksdeğerinde 1,6 kat artışa yol açmıştır. Orta düzey böbrek yetmezliği olan hastalarda, eritromisinböbrek fonksiyonu normal olan gönüllülere göre ortalama rivaroksaban EAA değerinde 2 katartış ve Cmaks değerinde 1,6 kat artışa yol açmıştır. Eritromisin böbrek yetmezliğinin etkisineek bir etki yaratmıştır (bkz. bölüm 4.4). Orta derece kuvvetli CYP3A4 inhibitörü olarak değerlendirilen flukonazol (günde bir kez 400 mg), ortalama rivaroksaban EAA değerinde 1,4 kat, ortalama Cmaks değerinde ise 1,3 kat artışaneden olmuştur. Flukonazol ile etkileşimin çoğu hastada klinik olarak anlamlı olması muhtemelolmamakla birlikte, yüksek risk taşıyan hastalarda anlamlı olabilir. (Böbrek yetmezliği olanhastalar için, bkz. bölüm 4.4). Dronedaron ile ilgili klinik veriler sınırlı olduğundan, rivaroksaban ile eşzamanlı kullanımından kaçınılmalıdır. Antikoagülanlar:Enoksaparin (40 mg tek doz) ile rivaroksabanın (10 mg tek doz) kombine kullanımından sonra, pıhtılaşma testlerine (protrombin zamanı [PTZ], aktive edilmiş parsiyel tromboplastin zamanı[aPTT]) ilave bir etkisi olmaksızın anti-faktör Xa aktivitesine ilave etki gözlenmiştir.Enoksaparin, rivaroksabanın farmakokinetiğini etkilememiştir. Artan kanama riski nedeniyle,diğer antikoagülanlarla eş zamanlı tedavi gören hastalarda dikkatli olunmalıdır (bkz. bölüm4.4). NSAİİ/trombosit agregasyon inhibitörleri:Rivaroksaban (15 mg) ve 500 mg naproksenin eşzamanlı uygulanmasından sonra kanama zamanında klinik olarak önemli bir uzama gözlenmemiştir. Bununla beraber, daha belirginfarmakodinamik cevap veren bireyler olabilir (bkz. bölüm 4.4 Özel kullanım uyarıları veönlemleri). Rivaroksaban 500 mg ASA ile birlikte ,uygulandığında klinik olarak anlamlı farmakokinetik ® Bu Delge, güvemi eleMPemK imza ite ımzalanmışûr.Belge DeveyefaEmafcodiialkie'fekBleşimFeRTgözilsmtenmemEştir.Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys
Klopidogrel (300 mg yükleme dozu, ardından 75 mg idame dozu) rivaroksaban (15 mg) ile farmakokinetik bir etkileşim göstermez, ancak hastaların bir alt grubunda kanama zamanındatrombosit agregasyonu, P-selektin ya da GPIIb / IIIa reseptör seviyesi ile korelasyongöstermeyen bir artış gözlenmiştir (bkz. bölüm 4.4). Hastalar NSAID'ler (ASA dahil) ve trombosit agregasyon inhibitörleri ile eş zamanlı olarak tedavi görüyorsa dikkatli olunmalıdır, zira bu tıbbi ürünler tipik olarak kanama riskiniarttırmaktadır (bkz. bölüm 4.4). SSRI'lar/SNRI'lar:Diğer antikoagülanlarda olduğu gibi, trombositler üzerindeki bildirilmiş etkileri nedeniyle SSRI veya SNRI'ların eş zamanlı kullanımı durumunda hastaların kanama riskinin yükselmesiolasılığı bulunmaktadır. Rivaroksaban klinik programında eş zamanlı kullanıldığında, tümtedavi gruplarında önemli veya önemli olmayan klinik olarak ilgili kanama oranlarının sayısalolarak daha yüksek olduğu gözlenmiştir. Varfarin:Tedavinin varfarinden (INR 2.0 - 3.0) rivaroksabana (20 mg) ya da rivaroksabandan (20 mg) varfarine (INR 2.0 - 3.0) geçirilmesi PTZ/INR (Neoplastin) testinde beklenenden fazla artışa(12'ye varan münferit INR değerleri gözlenebilir) yol açmıştır; aPTT, Faktör Xa (FXa) aktiviteinhibisyonu ve endojen trombin potansiyeli üzerindeki etkiler ise aditif olmuştur. İlaç değişim periyodu sırasında rivaroksabanın farmakodinamik etkileri test edilmek istendiğinde, anti-faktör Xa aktivitesi, PiCT (Prothrombinase-induced Clotting Time) veHepTest® kullanılabilir; bu testler varfarinden etkilenmemektedir. Varfarin kesildikten sonra4. günden itibaren tüm testler (PT, aPTT, FXa aktivitesinin inhibisyonu ve ETP [EndojenTrombin Potansiyeli] dahil) yalnızca rivaroksaban etkisini yansıtır (bkz. bölüm 4.2). İlaç değişim periyodu sırasında varfarinin farmakodinamik etkileri test edilmek istendiğinde, rivaroksaban Cvadi (önceki rivaroksaban dozundan 24 saat sonra) değerinde INR ölçümüyapılabilir; bu nokta bu testin rivaroksabandan en az etkilendiği noktadır. Varfarin verivaroksaban arasında farmakokinetik etkileşim gözlenmemiştir. CYP3A4 indükleyicileri:Rivaroksabanın güçlü CYP3A4 ve P-gp indükleyicisi rifampisin ile beraber uygulanması, ortalama rivaroksaban EAA'sında yaklaşık %50 azalma ile farmakodinamik etkilerinde paralelbir azalmaya neden olmuştur. Rivaroksabanın diğer güçlü CYP3A4 indükleyicileri (ör.fenitoin, karbamazepin, fenobarbital ya da St. John bitkisi (sarı kantaron otu, Hypericumperforatum))ile eş zamanlı kullanımı da rivaroksaban plazma konsantrasyonunda azalmaya yolaçabilir. Bu nedenle, hasta tromboz belirti ve bulguları açısından yakından izlenmediği sürecegüçlü CYP3A4 indükleyicileriyle eş zamanlı uygulamadan kaçınılmalıdır.Diğer eş zamanlı tedavilerRivaroksaban ile midazolam (CYP3A4 substratı), digoksin (P-gp substratı), atorvastatin (CYP3A4 ve P-gp substratı) veya omeprazol (proton pompası inhibitörü) eş zamanlıuygulandığında klinik olarak anlamlı farmakokinetik veya farmakodinamik etkileşimlergözlenmemiştir. Rivaroksaban, CYP3A4 gibi herhangi bir majör CYP izoformunu inhibe etmezve indüklemez. Klinik açıdan önemli herhangi bir gıda etkileşimi gözlenmemiştir (bkz. bölüm Belge Dc4r2)ma Kodu: lZW56Q3NRSHY3Q3NRaklUYnUyRG83SHY3 Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys  10 Laboratuvar parametreleri:Rivaroksabanın etki mekanizmasına uygun olarak beklendiği üzere, pıhtılaşma parametresi testleri (PTZ, aPTT, HepTest®) etkilenmektedir (bkz bölüm 5.1). 4.6 Gebelik ve laktasyonGenel tavsiye:Çocuk doğurma potansiyeli olan kadınlar / Doğum kontrolü (kontrasepsiyon):Çocuk doğurma potansiyeli olan kadınlar rivaroksaban ile tedavi süresince gebe kalmaktan kaçınmalıdır. Gebelik dönemi:Gebe kadınlarda Rivaroksaban'ın güvenlilik ve etkililiği bilinmemektedir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. bölüm 5.3). İnsanlarayönelik potansiyel risk bilinmemektedir. Olası üreme toksisitesi, doğal olarak meydana gelenkanama riski ve rivaroksabanın plasentaya geçtiği yönündeki veriler nedeniyle RİVOKSARgebelikte kontrendikedir (bkz. bölüm 4.3 ve bölüm 5.3). Laktasyon dönemi:Rivaroksabanın insan sütüyle atılıp atılmadığı, emziren kadınlarda güvenlilik ve etkililiği bilinmemektedir. Hayvanlar üzerinde yapılan çalışmalar, rivaroksabanın sütle atıldığınıgöstermektedir. Rivaroksaban emzirme döneminde kontrendikedir (bkz. bölüm 4.3).Emzirmenin durdurulup durdurulmayacağına ya da Rivaroksaban tedavisinin durdurulupdurdurulmayacağına / tedaviden kaçınılıp ka Rivaroksaban çınılmayacağına ilişkin kararverilirken, emzirmenin çocuk açısından faydası ve RİVOKSAR tedavisinin emziren anneaçısından faydası dikkate alınmalıdır. Üreme yeteneği / Fertilite:Fertilite üzerindeki etkileri değerlendirmek için insanlarla özel rivaroksaban çalışmaları yapılmamıştır. Sıçanlarda erkek ve dişi fertilitesine ilişkin bir çalışmada, hiçbir etkigörülmemiştir (bkz. bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkilerRİVOKSAR'ın araç ve makine kullanma yeteneği üzerinde önemsiz bir etkisi vardır. Senkop (sıklık: yaygın olmayan) ve baş dönmesi (sıklık: yaygın) gibi advers reaksiyonlar bildirilmiştir(bkz. bölüm 4.8). Bu advers reaksiyonların görüldüğü hastalar araç ya da makinekullanmamalıdır. 4.8 İstenmeyen etkilerGüvenlilik profilinin özetiRivaroksabanın güvenliliği, 13 faz III çalışmada değerlendirilmiştir (bkz. Tablo 1). Toplamda, 19 faz III çalışmada 69.608 yetişkin hasta ve 2 faz II ve 2 faz III çalışmasında 488 pediyatrik hasta rivaroksabana maruz bırakılmıştır.
Tablo 1: Rivaroksaban faz III çalışmalarında çalışılan hasta sayısı, total günlük doz ve maksimum tedavi süresi
Rivaroksaban alan hastalarda en yaygın olarak bildirilen advers reaksiyon kanamadır (bkz. aşağıda bölüm 4.4 ve Seçilen advers reaksiyonların açıklaması) (Tablo 2). En yaygın olarakbildirilen kanamalar epistaksis (%4,5) ve gastrointestinal kanal hemorajidir (%3,8). Tablo 2: Tamamlanmış faz III çalışmaları boyunca rivaroksabana maruz kalan hastalarda kanama* ve anemi olaylarının oranıEndikasyonHerhangi bir kanamaAnemi
Elektif kalça veya diz replasman cerrahisi geçiren yetişkinhastalarda VTE'nin önlenmesi
hastaların %6,8'i
hastaların %5,9'u
hastaların %2,1'i
hastaların %12,6'sı
Hastalarda VTE'nin önlenmesi DVT, PE tedavisi ve nüksün önlenmesi Doğrulama Kodu: 1 ZW5603NRSHY303NRaklUYnUvRcİ:
hastaların %23'ü
hastaların %1,6'sı elektronik imza ile imzalanmış ır.83SHY3_Belge Takip Adresi:https://www.turkive.gov.tr/sag1ik-titck-ehvs
* Tüm rivaroksaban çalışmaları için, bütün kanama olayları toplanır, bildirilir ve karara bağlanır. ** COMPASS çalışmasında, advers olay toplanmasına yönelik seçici bir yaklaşım uygulandığı için düşük bir anemi insidansı mevcuttur. Yetişkin hastalarda faz III klinik çalışmalarda veya pazarlama sonrası kullanımda ve pediyatrik hastalarda yapılan 2 faz II ve 2 faz III çalışmasında bildirilen tüm adversreaksiyonlarRivaroksaban kullanımında bildirilen advers ilaç reaksiyonlarının sıklıkları aşağıda özetlenmiştir. İstenmeyen etkiler, her bir sıklık grubunda azalan ciddiyet derecesine göresıralanmıştır. Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila<1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek (<1/10.000) ve bilinmiyor (eldekiverilerden hareketle tahmin edilemiyor) olarak tanımlanmıştır. Kan ve Lenf sistemi hastalıklarıYaygın: Anemi (ilgili laboratuvar parametreleri dahil) Yaygın olmayan: Trombositoz (trombosit sayısı artışı dahil)A, trombositopeni Bağışıklık sistemi hastalıklarıYaygın olmayan: Alerjik reaksiyon, alerjik dermatit, anjiyoödem ve alerjik ödem Çok seyrek: Anafilaktik şok da dahil olmak üzere anafilaktik reaksiyonlar Sinir sistemi hastalıklarıYaygın: Baş dönmesi, baş ağrısı Yaygın olmayan: Serebral ve intrakranial kanama, senkop Göz hastalıklarıYaygın: Gözde kanama (Konjunktival kanama dahil) Kardiyak hastalıklarYaygın olmayan: Taşikardi Vasküler hastalıklarYaygın: Hipotansiyon, hematom Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Epistaksis, hemoptizi Çok Seyrek: Eozinofilik pnömoni
Gastrointestinal hastalıklarYaygın: Jinjival kanama, gastrointestinal sistem kanaması (rektal kanama dahil), abdominal ve gastrointestinal ağrı, dispepsi, bulantı, konstipasyonA, diyare, kusmaAYaygın olmayan: Ağız kuruluğu Hepatobiliyer hastalıklarYaygın: Transaminaz artışı Yaygın olmayan: Karaciğer yetmezliği, bilirubin artışı, kan alkalen fosfataz artışıA, GGT artışıA Seyrek: Sarılık, konjuge bilirubin artışı (eş zamanlı ALT artışı ile veya ALT artışı olmadan),kolestaz, hepatit (hepatoselüler yaralanma dahil) Deri ve derialtı dokusu hastalıklarıYaygın: Kaşıntı (nadiren jeneralize kaşıntı dahil), döküntü, ekimoz, deri ve derialtında kanama Yaygın olmayan: Ürtiker Çok seyrek: Stevens-Johnson sendromu/Toksik Epidermal Nekroliz, DRESS sendromu Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıklarıYaygın: Ekstremite ağrısıA Yaygın olmayan: HemartrozSeyrek: Kas içine kanama Bilinmiyor: Kanamaya sekonder kompartman sendromu Böbrek ve idrar yolu hastalıklarıYaygın: Ürogenital sistem kanaması (hematüri ve menoraji dahilB), renal bozukluk (kan kreatinin artışı, kan üre artışı dahil) Bilinmiyor: Böbrek yetmezliği/hipoperfüzyona neden olmaya yetecek ölçüde kanamaya sekonder akut böbrek yetmezliği Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: AteşA, periferik ödem, genel güç ve enerjide azalma (yorgunluk ve asteni dahil) Yaygın olmayan: İyi hissetmeme (malezi dahil) Seyrek: Lokalize ödemA AraştırmalarYaygın olmayan: LDH artışıA, lipaz artışıA, amilaz artışıA Yaralanma, Zehirlenme ve Prosedüre Bağlı KomplikasyonlarYaygın: Prosedür sonrası kanama (postoperatif anemi ve yarada kanama da dahil), konfüzyon, yara yeri sızıntısıA Seyrek: Vasküler psödoanevrizmaC A: Elektif kalça veya diz replasman cerrahisi geçiren yetişkin hastalarda VTE'nin önlenmesinde gözlemlenmiştir. B: <55 yaş kadınlarda çok yaygın olarak DVT, PE tedavisi ve nüksün önlenmesinde gözlemlenmiştir. C: AKS sonrası önleme tedavisinde (perkütan koroner girişimin ardından) yaygın olmayan olarak gözlenmiştir. * Advers olay toplanmasında önceden belirtilen seçici bir yaklaşım uygulanmıştır. Advers reaksiyonların insidansı artmadığı ve yeni advers reaksiyon saptanmadığı için, bu tablodakifrekans hesaplamasına COMPASS çalışması verileri dahil edilmemiştir.
Seçilen advers reaksiyonların tanımıFarmakolojik etki mekanizmasına bağlı olarak, rivaroksaban posthemorajik anemi ile sonuçlanabilecek, herhangi bir doku ve organda gelişebilecek açık ya da gizli kanama riskindeartışla ilişkili olabilir. Belirti, bulgu ve şiddet (ölümcül sonuç dahil) kanama ve/veya anemininyerleşimi ve derecesine göre değişir (bkz. bölüm 4.9). Klinik çalışmalarda, mukozal kanamalar (epistaksis, dişeti kanaması, gastrointestinal kanama, anormal vajinal kanama veya artan menstrüel kanama dahil genito üriner kanama) ve anemi,VKA tedavisiyle kıyaslandığında uzun süreli rivaroksaban tedavisinde daha sık görülmüştür.Bu yüzden, yeterli klinik gözetime ek olarak, hemoglobin/hematokrite yönelik laboratuvartestleri, okült kanamayı tespit etmek ve uygun olduğu kararı verildiği üzere açık kanamanınklinik açıdan anlamının miktarını tayin etmek için çok değerli olabilir. Kanama riski belirli hasta gruplarında artabilir, örn. kontrol altında olmayan şiddetli arteriyel hipertansiyonu olan ve/veya eş zamanlı olarak hemostazı etkileyen ilaçlar almakta olan hastalar(bkz. bölüm 4.4 Özel kullanım uyarıları ve önlemleri / Kanama riski). Menstrüal kanamaşiddetlenebilir ve/veya süresi uzayabilir. Hemorajik komplikasyonlar, güçsüzlük, solukluk, baş dönmesi, baş ağrısı ya da açıklanamayan şişlikler, dispne ve açıklanamayan şok olarak görülebilir. Bazı olgularda, aneminin bir sonucuolarak göğüs ağrısı veya anjina pektoris gibi kardiyak iskemi bulguları gözlenmiştir. Rivaroksaban ile kompartman sendromu ve hipoperfüzyon nedeniyle renal yetmezlik gibi şiddetli kanamaya bağlı gelişen komplikasyonlar bildirilmiştir. Bu nedenle, antikoagülankullanan her hasta değerlendirilirken hemoraji olasılığı düşünülmelidir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9 Doz aşımı ve tedavisi1.960 mg'a kadar doz aşımı vakaları bildirilmiştir. Doz aşımı durumunda, hasta kanama komplikasyonlarına veya diğer yan etkilere karşı dikkatlice gözlemlenmelidir (bkz. Kanamatedavisi bölümü). Sınırlı emilim nedeniyle >50 mg supraterapötik dozlarda ortalama plazmamaruziyetinde daha fazla artış olmadan bir tavan etkisi beklenir. Rivaroksabanın farmakolojik etkisini antagonize eden spesifik bir geri dönüştürücü ajan (andeksanet alfa) bulunmaktadır (detaylı bilgi için bkz. bu preparata ait Kısa Ürün Bilgisi).Rivaroksaban doz aşımı durumunda emilimi azaltmak için aktif kömür kullanımı düşünülebilir. Kanamanın yönetimiRivaroksaban kullanan bir hastada kanama komplikasyonu meydana gelirse, bir sonraki rivaroksaban uygulaması geciktirilmeli veya uygun şekilde tedavi kesilmelidir. Rivaroksabanınyarı ömrü yaklaşık 5 ila 13 saattir (bkz. Bölüm 5.2). Kanama yönetimi, kanamanın ciddiyetineve yerine göre kişiye özel hale getirilmelidir. Gerektiğinde mekanik kompresyon (örn. şiddetli e ipjıt,aksis: o!sHs«9d4vkas8makostiglElemler''iİ5ir!iftISffta,hi,,hsm£it yai.ş',vLrse6aasmai 15 ve hemodinamik destek, kan ürünleri (anemi ya da koagülopatiye göre kırmızı kan hücresi, taze donmuş plazma) ya da trombosit gibi uygun semptomatik tedavi uygulanmalıdır. Kanama yukarıdaki önlemlerle kontrol edilemediğinde, ya rivaroksabanın farmakodinamik etkilerini antagonize eden spesifik bir faktör Xa inhibitörü geri dönüştürücü ajanı (andeksanetalfa) ya da protrombin kompleks konsantratı (PCC), aktive protrombin kompleks konsantratı(APCC) veya rekombinant faktör VIIa (r-FVIIa) gibi özgün prokoagülan geri döndürücü ilaçkullanılması düşünülmelidir. Bununla birlikte, bugün için, bu ilaçların rivaroksaban alankişilerde kullanımına dair klinik tecrübe oldukça kısıtlıdır. Tavsiye de sınırlı klinik dışı verilere dayanmaktadır. Rekombinant Faktör VIIa'nın yeniden doz ayarlaması düşünülebilir ve kanamanın gelişimine göre titre edilebilir. Majör kanamalaresnasında, lokal olarak uygun olma durumuna bağlı olarak, hematoloji uzmanı ile konsültasyondüşünülmelidir (bkz. bölüm 5.1). Protamin sülfat ve K vitamininin rivaroksabanın antikoagülan aktivitesini etkilemesi beklenmez. Rivaroksaban alan hastalarda, traneksamik asit ile ilgili deneyim sınırlı olup, aminokaproik asit ve aprotinin ile deneyim bulunmamaktadır. Rivaroksaban kullanan hastalarda sistemikhemostatik olan desmopresin kullanımıyla ilgili olarak fayda açısından bilimsel gerekçe veyadeneyim bulunmamaktadır. Plazma proteinlerine bağlanma oranının yüksek olması nedeniyle,rivaroksabanın diyaliz ile uzaklaştırılması beklenmemektedir. 5. FARMAKOLOJIK ÖZELLIKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Antitrombotik ajanlar, direkt faktör Xa inhibitörüdür. ATC kodu: B01AF01 Etki mekanizması:Rivaroksaban oral biyoyararlanımı olan oldukça selektif direkt bir Faktör Xa (FXa) inhibitörüdür. FXa'nın inhibisyonu, hem trombin oluşumunu hem de tromboz gelişimini inhibe ederek kan koagülasyon kaskadının intrinsik ve ekstrinsik yolağını bozmaktadır. Rivaroksaban trombini(aktive faktör II) inhibe etmez ve trombositler üzerinde herhangi bir etkisi olmadığıkanıtlanmıştır. Farmakodinamik etkiler:İnsanlarda FXa aktivitesinin doza bağımlı şekilde inhibe olduğu gözlenmiştir. Eğer testte Neoplastin® kullanılırsa, PTZ, plazma konsantrasyonları (r değeri 0,98'e eşit) ile yakın ilişkiliolarak doz bağımlı şekilde rivaroksabandan etkilenir. Diğer reaktifler farklı sonuçlarsağlayacaktır. INR sadece kumarinler için kalibre edildiği ve onaylandığından ve herhangidiğer bir antikoagülan için kullanılamadığından, PTZ okuması saniyeler içinde yapılmalıdır. Sağlıklı yetişkin gönüllülerde (n=22) rivaroksabanın farmakodinamik özelliklerinin geri Belge Domfisineilbikklinfafm?kolâ!Sllışmaslflda,5fiklörJü/CC(aktörItfysIXvecX),5Ve
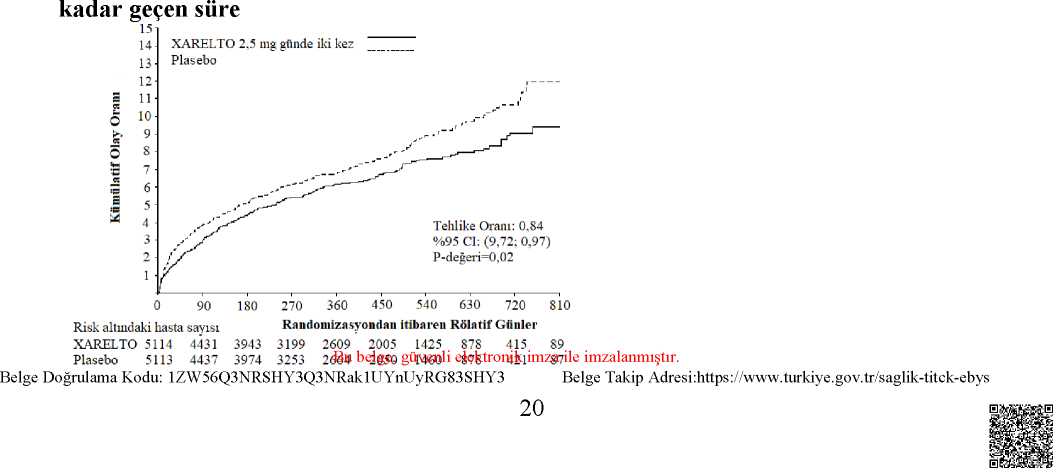
4 faktörlü PCC'nin (Faktör II, VII, IX ve X) olmak üzere iki farklı PCC tipinin tek dozlarının etkileri (50 IU/kg) değerlendirilmiştir. 3 faktörlü PCC ortalama Neoplastin PTZ değerlerini 30dakika içinde yaklaşık 1 saniye azaltırken, 4 faktörlü PCC ile yaklaşık 3,5 saniyelik düşüşlergözlemlenmiştir. Buna karşın, 3 faktörlü PCC, 4 faktörlü PCC'ye kıyasla, endojen trombinoluşumunda değişiklikleri geri çevirme üzerinde daha büyük ve daha hızlı bir genel etkiyapmıştır (bkz. bölüm 4.9). Aktive parsiyel tromboplastin zamanı (aPTT) ve HepTest® de doza bağımlı şekilde uzarlar; ancak rivaroksabanın farmakodinamik etkisinin değerlendirmek için önerilmezler. Klinikrutinde rivaroksaban ile tedavi sırasında koagülasyon parametrelerinin izlenmesine gerekyoktur. Ancak, klinik olarak belirtilirse rivaroksaban seviyeleri, kalibre edilmiş nicel anti-faktör Xa testleriyle ölçülebilir (bkz. bölüm 5.2). Klinik etkililik ve güvenlilik:AKSRivaroksaban klinik programı, yakın dönemde AKS (ST-elevasyonlu miyokard infarktüsü [STEMI], ST-elevasyonsuz miyokard infarktüsü [NSTEMI] ya da unstabil angina [UA])geçirmiş bireylerde KV ölüm, MI ya da inmenin önlenmesinde rivaroksabanın etkililiğinigöstermek için tasarlanmıştır. Pivotal çift kör ATLAS AKS 2 TIMI 51 çalışmasında yer alan15.526 hasta 3 tedavi grubundan birine 1:1:1 oranında randomize edilmiştir: Oral olarak gündeiki kez rivaroksaban 2,5 mg grubu, oral olarak günde iki kez rivaroksaban 5 mg grubu ya dagünde iki kez tek başına ASA veya ASA artı bir tiyenopridin (klopidogrel veya tiklopidin) ilebirlikte verilen plasebo grubu. 55 yaşın altındaki AKS hastalarında diabetes mellitus veyaönceden MI öyküsü olması gerekmiştir. Medyan tedavi süresi 13 ay ve genel tedavi süresiyaklaşık olarak 3 yıla kadardır. Hastaların %93,2'si eş zamanlı olarak ASA ile birlikte tienopiridin tedavisi ve %6,8'i yalnızca ASA almıştır. İkili antitrombosit tedavisi gören hastaların %98,8'i klopidogrel, %0,9'u tiklopidin ve %0,3'ü prasugrel almıştır. Hastalar, hastaneye kabulden en az 24 saat sonra ve 7 güne kadar (ortalama 4,7 gün), AKS olay indeksinin (revaskülarizasyon prosedürleri dahil) stabilizasyonundan sonra mümkün olan enkısa sürede ve parenteral antikoagülasyon tedavisinin normalde kesileceği zaman ilkrivaroksaban dozunu almıştır. Günde iki kez 2,5 mg ve günde iki kez 5 mg rivaroksaban rejimlerinin her ikisi de standart antitrombosit tedavinin yanı sıra KV olayların insidansının daha fazla düşürülmesinde de etkiliolmuştur. Günde iki kez 2,5 mg rejimi mortaliteyi azaltmıştır ve düşük dozun daha düşükkanama riski oluşturduğuna dair kanıtlar mevcuttur; dolayısıyla kardiyak biyomarkerlarınyüksek olduğu AKS sonrası hastalarda aterotrombotik olayların önlenmesi için tek başınaasetilsalisilik asit (ASA) ya da ASA ve klopidogrel veya tiklopidin ile kombinasyon şeklindegünde iki kez 2,5 mg rivaroksaban kullanılması önerilmektedir. Rivaroksaban, plasebo ile karşılaştırıldığında KV ölüm, MI ya da inmenin primer birleşik sonlanım noktasını anlamlı oranda azaltmıştır. KV ölüm ve MI'deki azalma ile sağlanan fayda, erken ortaya çıktı ve tüm tedavi periyodu boyunca sabit bir etki ile devam etti (bkz. Tablo 3 ve Şekil 1). Ayrıca ilk sekonder sonlanım noktas Ha|SSy3§eya";aİİLderecı4e.tuagyaelmış?AragHİ-\axeebybir  17 retrospektif analiz, plaseboya kıyasla stent tromboz insidans oranlarında nominal olarak anlamlı bir azalma göstermiştir (bkz. Tablo 3). Temel güvenlilik sonlanım insidans oranları (koronerarter bypass grefti [CABG] ile ilişkili olmayan TIMI majör kanama olayları), rivaroksaban iletedavi edilen hastalarda plasebo alan hastalara kıyasla yüksektir (bkz. Tablo 5). Bununla birlikteinsidans oranları, ölümcül kanama olayları intravenöz inotropik ilaçlar ile tedavi gerektirenhipotansiyon ve devam eden kanamaya yönelik cerrahi müdahale bileşenleri için rivaroksabanve plasebo arasında dengelenmiştir. Tablo 4'te, perkütanöz koroner girişim (PCI) geçiren hastaların etkililik sonuçları sunulmaktadır. Bu PCI geçiren hasta alt grubundaki güvenlilik sonuçları genel güvenliliksonuçlarına benzerdir. Biyomarkerlarda (troponin veya CK-MB) yükselme olan ve önceden inme/TİA geçirmemiş hastalar çalışma popülasyonunun %80'ini oluşturmuştur. Bu hasta popülasyonunun sonuçlarıda genel etkililik ve güvenlilik sonuçları ile tutarlıdır. Tablo 3: Faz III ATLAS AKS 2 TIMI 51'den elde edilen etkililik sonuçları
 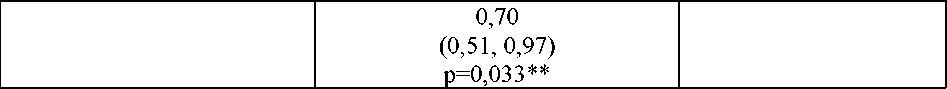
a) modifiye tedaviye niyet popülasyonu analizi seti (stent trombozu için tedaviye niyettoplam analiz seti) b) plaseboya karşı; Log-rank p-değeri* istatistiksel olarak üstün ** nominal olarak anlamlı GA; güven aralığı, HR; tehlike oranı, KV; kardiyovasküler, MI; miyokard enfarktüsü Tablo 4: PCI uygulanan hastalarda Faz III ATLAS AKS 2 TIMI 51'den elde edilen
GA; güven aralığı, HR; tehlike oranı, KV; kardiyovasküler, MI; miyokard enfarktüsü, PCI; *7... Bu belgeBelge Doin Wor°nerİ lgirİŞim.aklUYnUyRG83SHY3 Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys
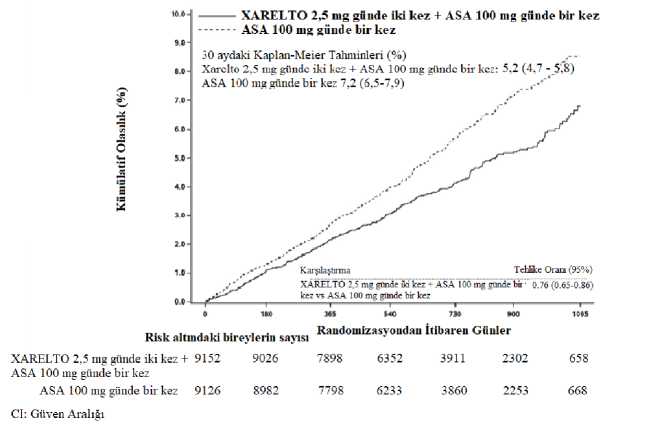
KAH veya PAHFaz III COMPASS çalışması (27.395 hasta, %78 erkek, %22 kadın), yüksek iskemik olay riski taşıyan KAH'lı veya semptomatik PAH'lı hastalarda KV ölüm, MI, inme bileşimininönlenmesinde rivaroksabanın etkililiğini ve güvenliliğini göstermiştir. Hastalar ortalama 23 ayve en fazla 3,9 yıl izlenmiştir. Bir proton pompası inhibitörü ile sürekli tedaviye ihtiyaç duymayan gönüllüler pantoprazol veya plaseboya randomize edilmiştir. Tüm hastalar daha sonra 1:1:1 olarak günde iki kez rivaroksaban 2,5 mg/günde bir kez ASA 100 mg'a, günde iki kez rivaroksaban 5 mg'a veya tek başına günde bir kere ASA 100 mg'a vebunlara karşılık gelen plasebolara randomize edilmiştir. KAH hastalarında çok damarlı KAH ve/veya önceden MI öyküsü vardır. 65 yaş üstü hastalar için, en az iki vasküler yatak içeren ateroskleroz veya en az iki ilave kardiyovasküler risk faktörügerekmiştir. PAH hastaları, arteriyel vasküler hastalık, ayak bileği/kol kan basınç oranı <0,9 olan intermittan klaudikasyo ve/veya anlamlı periferik arter stenozu, karotid revaskülarizasyonu öyküsü veya%50 ve üzerinde asemptomatik karotid arter stenozu nedeniyle önceden bypass ameliyatı,perkütan transluminal anjiyoplasti veya bacak ya da ayak ampütasyonu gibi müdahalelergeçirmiştir. Dışlama kriterleri arasında, ikili trombosit tedavi, diğer ASA olmayan antitrombosit tedavi veya oral antikoagülan tedavi gerekliliğinin yanı sıra, yüksek kanama riski taşıyan, ejeksiyonfraksiyonu %30'un altında ya da New York Kalp Derneği sınıf II veya IV olan kalp yetmezliğibulunan, 1 ay içinde herhangi bir iskemik, laküner olmayan inme geçiren veya herhangi birkanama ya da laküner inme öyküsü olan hastalar bulunmaktadır. Günde bir kez ASA 100 mg ile kombine olarak günde iki kez rivaroksaban 2,5 mg kullanımı, ASA 100 mg kullanımına kıyasla, KV ölüm, MI, inme primer birleşik sonlanımınazaltılmasında daha üstün olmuştur (bkz. Tablo 6 ve Şekil 2). ASA 100 mg alan hastalara kıyasla günde bir kez ASA 100 mg ile kombine olarak günde iki kez rivaroksaban 2,5 mg alan hastalarda, primer güvenlilik sonlanımında (modifiye ISTHmajör kanama olayları) anlamlı bir artış olmuştur (bkz. Tablo 7). Primer etkililik sonlanımı için, günde bir kez ASA 100 mg'a kıyasla günde iki kez rivaroksaban 2,5 mg artı günde bir kez ASA 100 mg'ın gözlemlenen faydası 75 yaş ve üzeri hastalarda(insidans: %7,0'ye karşı %6,3) HR=0,89 (%95 %95 GA, 1,1 - 0,7) ve 75 yaş altı hastalarda(%5,0'e karşı %3,6) HR=0,7'dir (%95 GA 0,6-0,8). Modifiye ISTH majör kanama için,gözlemlenen risk artışı 75 yaş ve üzeri hastalarda (%2,5'e karşı %5,2) HR=2,12 (%95 GA, 3,0- 1,5) ve 75 yaş altı hastalarda (%1,7'ye karşı %2,6) HR=1,53'tür (%95 GA, 1,9-1,2). Proton pompası inhibitörüne klinik gereksinimi olmayan hastalarda antitrombotik çalışma ilacına ek olarak günde bir kez 40 mg pantoprazol kullanımı, üst gastrointestinal olayların (yaniüst gastrointestinal kanama, ülserasyon, perforasyon bileşiminin) önlenmesinde faydagöstermemiştir; üst gastrointestinal olayların görülme oranı günde bir kez 40 mg pantoprazolgrubunda 0,39/100 hasta-yıl ve günde bir kez plasebo grubunda 0,44/100 hasta-yıl'dır. 
a) Tedavi amacına yönelik analiz seti, primer analizler b) ASA 100 mg'a karşı; Log-rank p-değeri * Primer etkililik sonucundaki azalma istatistiksel olarak üstün olmuştur. HR; tehlike oranı, GA: güven aralığı, % KM: 900 günde hesaplanan kümülatif insidans riske yönelik Kaplan-Meier tahminleri; KV: kardiyovasküler; MI: miyokard enfarktüsü

a) tedavi amacına yönelik analiz setleri, primer analizler b) ASA 100 mg'a karşı; Log-rank p-değeri GA: güven aralığı, Küm. Risk: 30 aydaki kümülatif insidans riski (Kaplan-Meier Tahminleri); ISTH: Uluslararası Tromboz ve Hemostaz Birliği
belge, güvenli elektronik imza ile imzalanmıştu---------tr: sıras" ------ Belge DiCOMMANDER HF çalışması, dekompanse kalp yetmezliğinin (KY) hastanede tedavisinin ardından kalp yetmezliği veönemli koroner arter hastalığı (KAH) olan, şu iki tedavi grubundan ~ İle İmzalanmıştır. . ,.,,tâiylaaigüeiiikezvrjvaEoksafeanSstm-ajN  = 2.507) veya karşılık gelen plasebo (N = 2.515). Genel ortalama çalışma tedavi süresi 504 gündür. Hastalarda en az 3 aydır semptomatik KY ve kayıttan sonraki bir yıl içinde < %40 sol ventrikül ejeksiyon fraksiyonu (SVEF) olmalıdır. Başlangıçta, medyan ejeksiyon fraksiyonu %34 olmuştur (IQR: %28-38) ve gönüllülerin %53'ü NYHA Sınıf III veya IV'tür. Birincil etkililik analizi (tüm nedenlere bağlı mortalite, MI veya inme bileşimi), HR = 0,94 (%95 GA 0,84 - 1,05), p= 0,27 olmak üzere, günde iki kez rivaroksaban 2,5 mg grubu ile plasebogrubu arasında istatistiksel olarak anlamlı bir fark ortaya koymamıştır. Tüm nedenlere bağlımortalite için, rivaroksaban ve plasebo arasında olay sayısı açısından fark yoktur (100 hasta-yılbaşına olay oranı; 11,41'e karşı 11,63, HR: 0,98; %95 GA: 0,87 ila 1,10; p=0,743). MI için 100hasta-yıl başına olay oranları 2,08'e karşı 2,52 (HR 0,83; %95 GA: 0,63 ila 1,08; p = 0,165) veinme için 100 hasta-yıl başına olay oranları 1,08'e karşı 1,62'dir (HR: 0,66; %95 GA: 0,47 ila0,95; p=0,023). Temel güvenlilik sonuçları (yani ölümcül kanama veya kalıcı sakatlanma potansiyeli olan kritik bir alana kanamanın bileşimi), sırasıyla, günde iki kez rivaroksaban 2,5 mg tedavi grubunda 18(%0,7) hastada ve plasebo grubunda 23 (%0,9) hastada meydana gelmiştir (HR = 0,80; %95GA 0,43 - 1,49; p = 0,484). Rivaroksaban grubunda ISTH majör kanamasında plaseboya kıyaslaistatistiksel olarak anlamlı bir artış olmuştur (100 hasta-yıl başına olay oranı: 2,04'e karşı 1,21,HR 1,68; %95 GA: 1,18 ila 2,39; p=0,003). Hafif ve orta derecede kalp yetmezliği olan hastalarda, COMPASS çalışma alt grubunun tedavi etkileri tüm çalışma popülasyonunun tedavi etkilerine benzer olmuştur (bkz. KAH veya PAHbölümü).Yüksek risk taşıyan üçlü pozitif antifosfolipid antikor sendromlu hastalar5.2 Farmakokinetik özelliklerGenel özelliklerEmilim:
Tablet alımından sonra rivaroksaban hızla emilir ve maksimum konsantrasyonlar (Cmaks) 2-4 saatte görülür. Rivaroksabanın oral emilimi neredeyse tamdır ve oral biyoyararlanımı 2,5 mg ve 10 mg tablet dozu için açlık/tokluk durumundan bağımsız olarak yüksektir (%80-100). Yiyeceklerle birliktealınması, 10 mg dozda rivaroksabanın EAA ya da Cmaks değerlerini etkilemez. Rivaroksaban2,5 mg ve 10 mg tabletler yemeklerle birlikte ya da ayrı alınabilir (bkz. bölüm 4.2). Rivaroksaban farmakokinetiğindeki değişkenlik, bireyler arası %30-40 (%CV) ile orta derecededir. Rivaroksabanın emilimi ilaç salınımının gastrointestinal kanalın hangi bölgesinde gerçekleştiğine bağlıdır. Rivaroksaban granülü ince bağırsak proksimalinde salındığı zamanEAA ve Cmaks bakımından tablete kıyasla emilimde %29 ve %56 azalma olduğu bildirilmiştir.İlaç salınımı ince bağırsak distalinde veya çıkan kolonda gerçekleştiğinde maruziyet daha daazalmaktadır. Bundan dolayı, rivaroksabanın midenin distaline uygulanmasındankaçınılmalıdır, bu durum emilimin ve ilgili rivaroksaban maruziyetinin azalmasına nedenolabilir. 20 mg rivaroksabanın biyoyararlanımı (EAA ve Cmaks), tam bir tablet haline kıyasla, ezilmiş bir tabletin elma püresine karıştırılarak oral yoldan uygulanması veya suda süspansiyon halinegetirilerek sıvı bir öğünün ardından gastrik sonda ile uygulanması için benzerdir. Rivaroksabanın öngörülebilen, dozla orantılı farmakokinetik profili dikkate alındığında, bu çalışmada elde edilen biyoyararlanım bulgularının daha düşük rivaroksaban dozları için degeçerli olma ihtimali bulunmaktadır. Dağılım:İnsanlarda plazma proteinlerine bağlanma yaklaşık % 92 - % 95 ile yüksek orandadır ve serum albumini temel bağlayıcı bileşendir. Dağılım hacmi Vss yaklaşık 50 L olmak üzere, ortadüzeydedir. Biyotransformasyon:Uygulanan rivaroksaban dozunun yaklaşık 2/3'ü metabolik degradasyona uğrar. Eliminasyon:Degradasyondan uğrayan kısmın yarısı renal, diğer yarısı da fekal yoldan elimine edilir. Uygulanan dozun kalan 1/3'ü başlıca, aktif renal sekresyon yoluyla olmak üzere, direkt renalekskresyona uğrar ve idrarda değişmemiş aktif etken madde şeklinde bulunur. Rivaroksaban, CYP3A4, CYP2J2 ve CYP'den bağımsız mekanizmalarla metabolize edilir. Morfolinonun oksidatif degradasyonu ve amid bağlarının hidrolizi majör biyotransformasyonalanlarıdır. In vitroaraştırmalara dayanarak, rivaroksaban P-gp (P-glikoprotein) ve Bcrp (memekanseri direnç proteini) taşıyıcı proteinlerinin bir substratıdır.Değişmemiş rivaroksaban insan plazmasındaki en önemli bileşiktir, dolaşımda majör ya da aktif metaboliti bulunmaz. Yaklaşık 10 L/saat'lik sistemik klirensi ile rivaroksaban düşük klerenslibir ilaç olarak sınıflandırılabilir. 1 mg dozun intravenöz uygulanmasından sonra, eliminasyon yarılanma ömrü yaklaşık 5 bsaatüreOrâiruygu[afflffl«§oöra eliminasyon, absorbsiy°n hız Belge Do limitli hale gelir. Rivaroksabanın plazmadan eliminasyonu genç bireylerde 5-9 saatlik, yaşlılarda 11-13 saatlik terminal yarılanma ömrü ile gerçekleşir. Hastalardaki farmakokinetik verilerAkut koroner sendromlu hastalarda aterotrombotik olayların önlenmesi için günde iki kez 2,5 mg rivaroksaban alan hastalarda, doz sonrası 2. - 4. saatte ve yaklaşık 12. saatte (yaklaşık olarakdoz aralığı sırasındaki maksimum ve minimum konsantrasyonları temsil eder) geometrikortalama konsantrasyon (%90 tahmin aralığı) (kabaca doz aralığı sırasında maksimum veminimum konsantrasyonları temsil eder), sırasıyla 47 (13 - 123) ve 9,2 (4,4 - 18) mikrogram/lolarak saptanmıştır. Farmakokinetik/farmakodinamik ilişkiRivaroksaban plazma konsantrasyonu ile birkaç farmakodinamik (FD) sonlanım noktası (faktör-Xa inhibisyonu, PTZ, aPTT, Heptest) arasındaki farmakokinetik/farmakodinamik(FK/FD) ilişki, geniş bir doz aralığının (günde iki kez 5-30 mg) uygulanmasından sonradeğerlendirilmiştir. Rivaroksaban konsantrasyonu ve FXa aktivitesi arasındaki ilişkiyi en iyiaçıklayan yöntem Emaks modeli olmuştur. PTZ için genellikle doğrusal kesiştirme modeliverileri daha iyi açıklamaktadır. Kullanılan farklı PTZ reaktiflerine bağlı olarak, eğim önemlioranda değişiklik sergilemiştir. Neoplastin PTZ kullanıldığında başlangıç PTZ değeri yaklaşık13 saniye, eğim ise 3 ila 4 s/(100 mikrogram/L) olmuştur. Faz II ve III çalışmalarındaki FK/FDanalizlerinin sonuçları sağlıklı kişilerde elde edilen verilerle tutarlılık sergilemiştir. Doğrusallık/ Doğrusal olmayan durum:Rivaroksabanın farmakokinetiği günde bir kez uygulanan 15 mg'lık dozuna kadar doğrusaldır. Daha yüksek dozlarda rivaroksaban, artan dozla azalan emilim oranı ve azalmışbiyoyararlanımın görüldüğü çözünmeyle sınırlı emilim gösterir. Bu durum tokluk durumunakıyasla aç karnına daha belirgindir. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Kreatinin klirensi ölçümü yoluyla değerlendirilen renal fonksiyonda azalmayla korele olarak, rivaroksaban maruziyetinde artış vardır. Hafif (kreatinin klirensi: 50-80 mL/dak), orta (kreatinin klirensi: 30-49 mL/dak) ya da ciddi (kreatinin klirensi: 15 - 29 mL/dak) böbrek yetmezliği olan bireylerde, rivaroksaban plazmakonsantrasyonları (EAA) sırasıyla 1,4, 1,5 ve 1,6 kat artmıştır. Farmakodinamik etkilerde buduruma karşlık gelen artış daha belirgindir. Hafif, orta ya da ciddi böbrek yetmezliği olan bireylerde,FXa aktivitesinin genel inhibisyonu sağlıklı gönüllülerle karşılaştırıldığında sırasıyla 1,5, 1,9 ve 2kat artmıştır; PTZ benzer şekilde sırasıyla 1,3, 2,2 ve 2,4 kat uzamıştır. Kreatinin klirensi <15 mL/dak olan hastalar için veri bulunmamaktadır. Plazma proteinlerine bağlanma oranının yüksek olması nedeniyle, rivaroksabanın diyaliz ile uzaklaştırılması beklenmemektedir. Kreatinin klirensi <15 mL/dak. olan hastalarda kullanımı önerilmemektedir. Rivaroksaban, kreatinin klirensi 15 - 29 mL/dak. olan hastalarda dikkatle kullanılmalıdır (bkz. bölüm 4.4). Karaciğer yetmezliği:Hafif karaciğer yetmezliği izlenen sirozlu hastalar (Child Pugh A olarak sınıflandırılanlar), .11f'11 Bu.belge, güvenli£İektromk imza ile ûnzalanmıştır.ı ı ı ı , ııBelge D.Tisa5ak&abanın5 6farm#kokintluözelrnPe neregeyâep uysuftpağlkikontrtolagg[uElasa
benzer düzeyde, yalnızca minör değişiklikler sergilemiştir (ortalama olarak rivaroksaban EAA değerinde 1,2 kat artış). Orta derecede karaciğer yetmezliği izlenen sirozlu hastalarda (ChildPugh B olarak sınıflandırılanlar), rivaroksabanın ortalama EAA değeri sağlıklı gönüllülerekıyasla 2,3 kat olmak üzere anlamlı derecede artmıştır. Serbest ilaç EAA değeri 2,6 katartmıştır. Bu hastalarda, orta derecede böbrek yetmezliği hastalarına benzer şekilde, renaleliminasyon da azalmıştır. Şiddetli karaciğer yetmezliği izlenen hastalarla ilgili veri bulunmamaktadır. FXa inhibisyonu, orta derecede karaciğer yetmezliği izlenen hastalarda sağlıklı gönüllülere kıyasla 2,6 kat artmıştır; PTZ uzamasında da benzer şekilde 2,1 kat artış gözlenmiştir. Ortaderecede karaciğer yetmezliği izlenen hastalar rivaroksabana karşı daha duyarlı olduğundankonsantrasyon ve PT arasında daha dik bir FK/FD ilişkisi söz konusu olmuştur. Rivaroksaban, Child Pugh B ve C derecesinde sirozlu olan hastalar dahil olmak üzere koagülopati ve klinik açıdan anlamlı kanama riski ile ilişkili karaciğer hastalığı izlenenhastalarda kontrendikedir (bkz. bölüm 4.3). Pediyatrik PopülasyonGüvenlilik ve etkililik, çocuklarda ve 18 yaşına kadar adölesanlarda belirlenmemiştir. Geriatrik PopülasyonYaşlı hastalar, temel olarak düşük (belirgin) total ve renal klerense bağlı olarak ortalama yaklaşık 1,5 kat yüksek EAA değerleri ile genç hastalardan daha yüksek plazmakonsantrasyonları sergilemiştir. Doz ayarlamasına gerek yoktur. CinsiyetErkek ve kadın hastalar arasında farmakokinetik özelliklerde klinik olarak belirgin farklılıklar yoktur. Vücut ağırlığı:Vücut ağırlığındaki uç noktaların (<50 kg vs >120 kg) rivaroksaban plazma konsantrasyonları üzerinde sadece küçük bir etkisi vardır (%25'ten daha az). Doz ayarlamasına gerek yoktur. Etnik farklılıklar:Beyaz, Afrikalı-Amerikalı, Latin kökenli, Japon ya da Çinli hastalar arasında rivaroksabanın farmakokinetik ve farmakodinamik özellikleri ile ilgili klinik olarak belirgin etnik farklılıklargözlenmemiştir. 5.3 Klinik öncesi güvenlilik verileriRivaroksabanın konvansiyonel güvenlilik farmakolojisi, tekli ve tekrarlı doz toksisitesi, fototoksisite, genotoksisite, karsinojenisite ve üreme toksisitesi çalışmaları ile değerlendirilenklinik dışı güvenlilik verisi insanlar için özel bir tehlike ortaya çıkarmamaktadır. Tekrarlanan doz toksisitesi çalışmalarında gözlemlenen etkiler, esasen rivaroksabanın aşırı farmakodinamik aktivitesinden kaynaklanmıştır. Sıçanlarda, artan IgG ve IgA plazmaseviyeleri, klinik olarak önemli maruziyet seviyelerinde görülmüştür.
Sıçanlarda, erkek veya dişi fertilitesi üzerinde herhangi bir etki görülmemiştir. Hayvan çalışmaları, rivaroksabanın farmakolojik etki mekanizmasıyla ilgili üreme toksisitesi (örn.hemorajik komplikasyonlar) göstermiştir. Klinik olarak anlamlı plazma konsantrasyonlarında,embriyo-fetal toksisite (implantasyon sonrası kayıp, gerilemiş/ilerlemiş osifikasyon,karaciğerde çoklu açık renkli noktalar) ve yaygın şekil bozuklukları insidansının artmasınınyanı sıra plasentada değişiklikler gözlemlenmiştir. Sıçanlarla prenatal ve postnatalçalışmalarda, dişiler için toksik olan dozlarda yavru canlılığında azalma gözlemlenmiştir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesi- Mikrokristalin selüloz (Tip 102) - Laktoz granül (laktoz monohidrat SD) (sığır sütünden elde edilir) - Kroskarmelloz sodyum - Hidroksipropil metil selüloz (E5) (hipromelloz) - Magnezyum stearat - Poloksamer 188 (mikronize) - Opadry 04F220012 yellow* *HPMC 2910/hipromelloz Makrogol / PEG Titanyum dioksitSarı demir oksit 6.2 GeçimsizliklerBilinen herhangi bir geçimsizliği bulunmamaktadır. 6.3 Raf ömrü36 ay 6.4 Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. 6.5 Ambalajın niteliği ve içeriğiPVC/PE/PVDC-Aluminyum folyo blister ambalaj. 56 tabletlik kutularda. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerÖzel bir gereksinim yoktur. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.
7. RUHSAT SAHIBIAbdi İbrahim İlaç San. ve Tic. A.Ş. Reşitpaşa Mahallesi Eski Büyükdere Cad. No:4 34467 Maslak / Sarıyer / İstanbulTel: 0212 366 84 00Faks: 0212 276 20 20 8. RUHSAT NUMARASI2019/195 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 01.04.2019 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriRivoksar 2,5 Mg Film Kaplı TabletEtken Maddesi: Rivaroksaban Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.