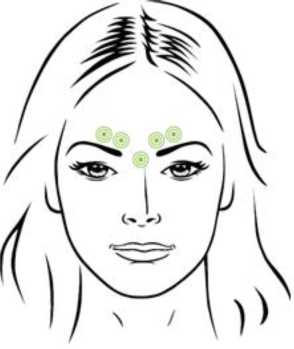
Nabota 100 Ünite Enjeksiyonluk Çözelti Hazırlamak İçin Liyofilize Toz Kısa Ürün BilgisiKISA URUN BILGISIBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBİ ÜRÜNÜN ADINABOTA 100 Ünite enjeksiyonluk çözelti hazırlamak için liyofilize toz Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Botulinum toksini* tip A, 100 Ünite/flakon. * Clostridium botulinumkaynaklıBotulinum toksin üniteleri, ürünler arası değiştirilebilir değildir. Yardımcı maddeler:Sodyum klorür 0,9 mg Yardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti hazırlamak için liyofilize toz.Beyaz ila sarımsı toz şeklindedir. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarNABOTA;20 ila 65 yaş arası yetişkinlerde korrugator kas ve/veya proserus kasının aktiviteleriyle ilişkili orta ila şiddetli glabella çizgilerinin (kaşlar arasındaki dikey çizgiler)görünümünde geçici iyileşme, 18 ila 65 yaş arası yetişkinlerde orbikülaris oküli kası aktiviteleriyle ilişkili orta dereceli lateral kantal çizgilerin (kaz ayağı çizgileri) görünümünde geçici iyileşmetedavilerinde endikedir. 4.2 Pozoloji ve uygulama şekliPozoloji, uygulama sıklığı ve süresi/Uygulama şekli:Botulinum toksin üniteleri, ürünler arasında birbiri yerine kullanılamaz. Önerilen dozlar, diğer botulinum toksin preparatlarından farklıdır. NABOTA yalnızca tedavide ve ilgili branşda uzmanlığa sahip olan hekimler tarafından uygulanmalıdır. Bu ürün yalnızca tek kullanım içindir ve kullanılmayan çözelti atılmalıdır. Glabella çizgileri için uygulama şekli; 100U/2,5 ml (4U/0,1 ml) konsantrasyonu elde etmek için koruyucu içermeyen, steril salin çözeltisiyle seyreltilerek sulandırılır, steril 30-gauge iğne kullanılarak 5 enjeksiyon bölgesininher birine 0,1 ml doz enjekte edilir: Her bir korrugator kasa 2 enjeksiyon ve proserus kasına 1enjeksiyon olmak üzere toplamda 20 Ünitelik doz. Pitoz komplikasyonunu azaltmak için,özellikle kaş depresör kompleksleri (depressor supercilii) daha büyük olan hastalarda, levatorpalpebrae superioris kasının yakınına enjeksiyon yapılmasından kaçınılmalıdır. İç korrugatorkaslara ve kaş santraline enjeksiyonlar, kemikli supraorbital sırtın en az 1 cm yukarısınayapılmalıdır.
Bu ürünün kan damarına enjeksiyonunu önlemek için dikkatli özen gösterilmelidir. Orbital sınır altına ekstravazasyonu önlemek için, başparmak veya işaret parmağı orbital sınırın altınasıkıca yerleştirilmelidir. İğne, enjeksiyon sırasında süperior ve medial yönde tutulmalı vedoğru hacmin enjekte edilmesi için dikkatli özen gösterilmelidir. Glabella yüz çizgileri, korrugator kas ve orbikülaris oküli kasının aktivitesiyle ortaya çıkar. Bu kaslar kaşı medial yönde hareket ettirir ve proserus kası ve depressor supercilii kası kaşıinferior yönde çeker. Bu kaş çatılmasını ya da fissürlü kaş görünümü yaratır. Kasların yeri,boyutu ve kullanımı bireyler arasında belirgin değişkenlik gösterir. Yüz çizgileri için etkilidoz, hastanın enjeksiyon yapılan yüzeyel kaslarını aktive etme yeteneğinin gözle kabacagözlenmesiyle belirlenir. Her tedavinin etkisi yaklaşık üç-dört ay sürer. Güvenliliği veetkililiği gösterilmediği için bu ürünün daha sık enjeksiyonu önerilmemektedir. Tipik olarak botulinum toksininin başlangıç dozları, enjeksiyon yapılan kaslardaki kimyasal denervasyonu enjeksiyondan bir ila iki gün sonra, şiddeti ilk haftada artacak şekilde indükler. Lateral kantal çizgiler (kaz ayağı çizgileri) için uygulama şekli; Lateral kantal çizgiler, büyük ölçüde, göz kırpma ve göz kapağının kapanmasından sorumlu olan göz çevresindeki orbikülaris oküli kaslarının aktivitesinden kaynaklanır. Orbikülarisokülinin kuvvetli kasılması, lateral kantustan ileri gelen lateral ve radyal yönelimli kıvrımlara(kaz ayağı çizgileri) neden olur. Bu radyal çizgilerin dağılımı hastalar arasında farklılıkgösterir. Enjeksiyonlar, iğne ucu üst eğik şekilde, gözden uzak olacak şekilde yapılmalıdır. 30-33-gauge iğne kullanarak, her iki yanda bulunan lateral orbikülaris oküli kasındaki 3 enjeksiyon yerinin her birine (toplam 6 enjeksiyon yeri, toplam 24 Ünite) 0,1 mL (4U) sulandırılmışNABOTA enjekte edilir. İlk enjeksiyon, lateral kantusa yaklaşık 1.5-2.0 cm temporal veorbital rime temporal yapılmalıdır. Maksimum gülüş durumunda lateral kantaldaki çizgilerlateral kantusun üstünde ve aşağısındaysa, "Şekil-2" ye göre enjeksiyon gerçekleştirilmelidir.
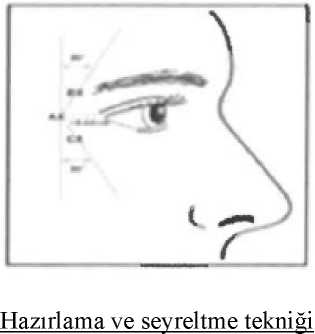
Enjeksiyon öncesinde, liyofilize ürün, koruyucu içermeyen, steril salin ile seyreltilir. %0,9 sodyum klorür enjeksiyonu önerilen seyrelticidir. Uygun boyutta enjektöre doğru miktardaseyreltici çekilir. Bu ürün, kabarcıklanma ya da benzeri bir kuvvetli çalkalama ile denatüreolduğu için seyreltici, flakon içine yavaşça enjekte edilmelidir. Eğer bir vakum oluşupseyreltici flakona çekilmezse flakonu atılmalıdır. Etiket üzerindeki boşluğa seyreltme tarihi vesaati kaydedilmelidir. Bu ürün, sulandırıldıktan sonraki 24 saat içinde uygulanmalıdır. Budönemde sulandırılan ürün buzdolabında saklanmalıdır (2 - 8oC). Sulandırılan ürün berrak,renksiz olmalı ve parçacık içermemelidir. Parenteral müstahzarlar, uygulama öncesindeparçacık madde ve renk değişikliği açısından görsel olarak incelenmelidir. Bu ürün veseyrelticisi herhangi bir koruyucu içermediği için, bu ürünün bir flakonu tek bir hasta içinkullanılmalıdır. Tavsiye edilen doza göre uygulama yapıldıktan sonra geriye kalan çözeltiatılmalıdır.
Enjeksiyonluk tozun sulandırılması, flakonların taşınması ve imhasına ilişkin talimatlar için lütfen bölüm 6.6'ya bakınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Böbrek ve karaciğer yetmezliğinde kullanımıyla ilgili veri bulunmamaktadır. Pediyatrik popülasyon:NABOTA'nın glabella ve lateral kantal çizgilerinin iyileşmesi endikasyonunda, çocuklarda ve 20 yaş altı adölesanlarda güvenliliği ve etkililiği ile ilgili veri bulunmamaktadır. Geriyatrik popülasyon:Yaşlılarda kullanımına yönelik özel doz ayarlaması önerisi bulunmamaktadır. 4.3 KontrendikasyonlarNABOTA aşağıdaki durumlarda kontrendikedir: Botulinum toksini tip A'ya veya bu ürünün formül asyonundaki herhangi bir maddeye karşı aşırı duyarlılığı olan hastalar. - Önerilen enjeksiyon bölge(ler)inde enfeksiyon varlığı olan hastalarda. - Nöromusküler bileşke bozuklukları (örn., miyastenya gravis, Lambert-Eaton sendromuveya amiyotropik lateral skleroz) olan hastalarda. Hastalıklar, bu müstahzarın kasrelaksasyon aktivitesi nedeniyle alevlenebilir. - Servikal distoni tedavisinde kullanıldığında, şiddetli respiratuvar bozuklukları olanhastalarda. - Detrüsör kasa enjekte edildiğinde, nörojenik detrüsör aşırı aktivitesi olup, aynı zamandaakut üriner sistem enfeksiyonu olan hastalar ve rutin olarak temiz aralıklı kateterizasyonyapmayan akut enürezli hastalar. Gebe ve çocuk doğurma potansiyeli olan kadınlarda veya emziren annelerde 4.4 Özel kullanım uyarıları ve önlemleriÖzel uyarılar Bu tıbbi ürün, insan plazması ürünü olan albümin içermektedir. İnsan plazmasından elde edilen ilaçlar, virüsler ve teorik olarak Varyant Creutzfeldt-Jacob (v-CJD) gibi,çeşitli hastalıklara yol açabilen enfeksiyon yapıcı ajanlar içerebilirler. NABOTA'daVaryant Creutzfeldt-Jacob hastalığının bulaşma riski teorik olarak minimumken, klasikCreutzfeldt-Jacob hastalığının bulaşma riski hiçbir kanıtla desteklenmez. Alınanönlemlere rağmen, bu tür ürünler halen potansiyel olarak hastalık bulaştırabilir.Bu tip ürünlerin enfeksiyon yapıcı ajanları bulaştırma riski, plazma verenlerin belirli virüslere önceden maruz kalıp kalmadığının izlenmesi, belirli virüs enfeksiyonlarınınhalihazırda varlığının test edilmesi ve belirli virüslerin yok edilmesi ve/veyainaktivasyonu ile azaltılmıştır. Bütün bu önlemlere rağmen, bu ürünler hala potansiyelolarak hastalık bulaştırabilirler. Ayrıca, henüz bilinmeyen enfeksiyon yapıcı ajanlarınbu ürünlerin içerisinde bulunma ihtimali mevcuttur.HIV, HBV, HCV gibi zarflı virüsler ve HAV gibi zarflı olmayan virüsler için etkili önlemlerin alınmasına dikkat edilmelidir. Parvovirüs B19 gibi zarflı olmayan virüslerekarşı alınan tedbirler sınırlı sayıda olabilir. Parvovirüs B19 enfeksiyonu, gebelikte (fetalinfeksiyon) ve immün yetmezlik ya da kırmızı kan hücre üretiminde artış olanhastalarda tehlikeli olabilir (hemolitik anemi gibi).Doktor, bu ilacı hastaya reçete etmeden veya uygulamadan önce hastası ile risk ve yararlarını tartışmalıdır.Ayrıca; NABOTA kullanılması gerekiyorsa hekim tarafından, hastalık yapıcı etkenlerin hastaya bulaşmasını önlemek için uygun aşıların (Hepatit A, Hepatit B vb.) yaptırılması önerilebilir. Hastalar açısından NABOTA her uygulandığında, hastayla ürünün seri numarası arasındaki bağlantının korunabilmesi için, ürünün adı ve seri numarası kaydedilmelidir. Bu tıbbi ürünün etkin maddesi Clostridium botulinum'danClostridium botulinum,toksin tip A olduğu için, bu bölümdeki bilgilerin tam olarak anlaşılmış olması ve önerilendozaj ve uygulama yöntemlerine sıkı sıkıya uyulmalıdır. Bu tıbbi ürünü uygulayan hekimler,uygulama alanının ilgili nöromusküler ve/veya orbital anatomisini ve önceki cerrahi işlemlerve standart elektromiyografik teknikler nedeniyle anatomideki olası değişiklikleri yeterlidüzeyde anlamalıdır. Önerilen dozajlar ve uygulama sıklıkları aşılmamalıdır.Toksin etkisinin yayılması Botulinum toksin ürünlerinin etkileri enjeksiyon alanında yayılıp, olumsuz belirtiler oluşturabilir. Bu belirtiler arasında asteni, yaygın kas zayıflığı, disfoni, dizartri, kekeleme,üriner inkontinans, nefes almada güçlükler, disfaji, diplopi, bulanık görme ve pitozis vardır.Yutma ve nefes alma güçlükleri hayatı tehdit edici olabilir ve toksin etkilerinin yayılmasıylailişkili ölüm raporları olmuştur. Bu semptomların oluşma riski olasılıkla spastik serebral palsiiçin tedavi edilen çocuklarda en yüksek düzeydedir, ancak spastik serebral palsi ve diğernedenlerle tedavi edilen erişkinlerde de bu semptomlar gelişebilir. Yukarıdaki adversreaksiyonların geliştiği olgular, servikal distoni tedavisinde kullanılan dozlar veya daha düşükdozlarda kullanımı ile gözlenmiştir. Aşırı duyarlılık reaksiyonları Diğer botulinum toksin ürünlerinde ciddi ve/veya ani aşırı duyarlılık reaksiyonları bildirilmiştir. Bu reaksiyonlar arasında anafilaksi, ürtiker, yumuşak doku ödemi ve dispnevardır. Lidokainin seyreltici olarak kullanıldığı bir fatal anafilaksi olgusu bildirilmiştir vesonuç olarak nedensel ajan, güvenilir olarak belirlenmemiştir. Böyle bir reaksiyon görülürsebu müstahzardan daha fazla enjeksiyon yapılmamalı ve uygun tıbbi tedavi bir an öncebaşlatılmalıdır. Önceden var olan nöromusküler bozukluklar Periferik motor nöropatik hastalıkları (örn., amiyotrofik lateral skleroz veya motor nöropati) ya da nöromusküler bileşke bozuklukları (örn., miyastenya gravis veya Lambert-Eatonsendromu) olan bireylerde, bu ürünün tipik dozlarında şiddetli disfaji ve respiratuvar bozulmagibi klinik olarak anlamlı sistemik etkiler açısından risk artışı olabilir. Diğer botulinum toksiniürünleriyle yayınlanmış tıbbi literatürlerde, bilinen ya da tanı konmamış nöromuskülerbozuklukları olan hastalara botulinum toksini uygulanması ve hastaların tipik klinik dozlarınsistemik etkilerine ciddi aşırı duyarlılık gösterdiği şeklinde seyrek olgular bildirilmiştir. Bazıolgularda disfaji, birkaç ay sürmüş ve gastrik beslenme tüpü yerleştirilmesi gerekmiştir. Disfaji Servikal distoni hastalarının botulinum toksinleri ile tedavisini takiben görülen disfaji, yaygın olarak bildirilen bir advers olaydır. Bu hastalarda, gastrik beslenme tüpü yerleştirilmesinigerektirecek ciddiyette nadir disfaji olguları da vardır. Aynı zamanda, bir hastada disfajibulgusunu takiben aspirasyon pnömonisi gelişmesi ve ölüm görülmesi şeklinde nadir olguraporları da vardır. Diğer botulinum toksini ürünleri ile, aritmi ve miyokard enfarktüsü dahil olmak üzere kardiyovasküler sistemi içeren ve bazıları da fatal sonuçlar doğuran advers reaksiyonlar dabildirilmiştir. Bu hastaların bazılarında kardiyovasküler hastalık gibi risk faktörleri vardı. Strabismus tedavisi için diğer botulinum toksin ürünlerinin uygulanması sırasında, iğnenin göz etrafındaki alanlara penetrasyonu nedeniyle retinal dolaşımı bozmaya yeterli retrobulberhemorajiler görülmüştür. Orbitayı dekomprese etmeye uygun araçların erişilebilir olmasıönerilir. İğnelerle, oküler (küre) penetrasyonlar da görülmüştür. Bu durumun tanısını koymakiçin bir oftalmoskop bulunmalıdır. Bir ya da daha fazla ekstraoküler kasta paralizi oluşturmakboyutsal dezoryantasyon, çift görme veya hedefteki objenin yerinin doğru tespit edilememesiile sonuçlanabilir. Etkilenen gözün kapatılması bu belirtileri hafifletebilir. Blefarospazm Botulinum toksininin, orbikülaris kasına enjeksiyonundan kaynaklanan göz kırpması azalması, özellikle VII sinir bozuklukları olan hastalarda, korneal maruziyete, persistanepitelyal defekte ve korneal ülserasyona neden olabilir. Blefarospazm tedavisi için diğerbotulinum toksin ürünlerinin kullanımında, bu etki nedeniyle afakik bir gözde, kornealgreftleme gerektiren bir korneal perforasyon olgusu görülmüştür Önceden opere edilengözlerde korneal his dikkatli test edilmeli ve ektropiyon riskini azaltmak için alt göz kapağıalanına enjeksiyondan kaçınılmalıdır. Herhangi bir epitelyal defekt için etkin tedaviuygulanmalıdır. Bu tedavi koruyucu damlaları, merhemi, terapötik yumuşak kontakt lensleriya da gözün yamalama ya da diğer yöntemlerle kapatılmasını gerektirebilir. Yumuşak göz kapağı dokularında kolayca ekimoz oluşur. Bu, enjeksiyondan hemen sonra enjeksiyon bölgesine hafif basınç uygulayarak en aza indirilebilir. Botulinum toksininin antikolinerjik aktivitesi nedeniyle, anatomik olarak dar açıları olan hastalar dahil olmak üzere açı kapanması glokomu açısından risk olan hastaların tedavisindedikkatli olunmalıdır. Botulinum toksini ürünleri arasında değişiklik yapılamaması Botulinum toksininin potens üniteleri, ürünlerin kendilerine spesifik olduğu için, diğer botulinum toksini ürünleriyle değiştirilebilir değillerdir. Bu nedenle, botulinum toksinininbiyolojik aktivite üniteleri, başka bir spesifik analiz yöntemiyle değerlendirilen herhangi birdiğer botulinum toksini ürününün üniteleriyle kıyaslanamaz ya da bu ünitelere çevrilemez. Korunmasız anatomik yapılardaki veya bunların yakınlarındaki enjeksiyonlar Korunmasız anatomik yapılara ya da yakınlarına enjeksiyon yapılırken dikkatli olunmalıdır.Botulinum toksini, doğrudan tükürük bezlerine, oro-lingual-faringeal bölgeye, özefagusa vemideye doğrudan enjeksiyon yapılan hastalarda fatal sonuçlar da dahil olmak üzere ciddiadvers olaylar bildirilmiştir (bu enjeksiyon bölgeleriyle ilgili endikasyonlar için güvenlilik veetkililik gösterilmemiştir). Botulinum toksininin toraksa yakın uygulanmasını takibenenjeksiyon işlemiyle ilişkili pnömotoraks bildirilmiştir. Akciğere özellikle apekslere yakınenjeksiyon yapılırken dikkat gerekmektedir. Nörolojik durumla ilişkili spastisite ya da detrüsör aşırı aktivitesi tedavi alan ve respiratuvar durumu bozulmuş hastalarda botulinum toksininin pulmoner etkileri Üst ekstremite spastisitesi ve respiratuvar bozukluğu olan hastalarda, üst solunum yolları enfeksiyonları ve akciğer fonksiyonundan azalma (Zorlu Vital Kapasitede [FVC] > %15azalma), plaseboya kıyasla diğer botulinum toksini ürünleri uygulandığında daha sıkbildirilmiştir. Nörolojik bir durumla ilişkili detrüsör aşırı aktivitesi için diğer botulinumtoksini ürünleriyle tedavi edilen hastalarda akciğer fonksiyonlarında azalmalar (Zorlu VitalKapasitede [FVC] > %15 azalma) da bildirilmiştir. Spastisite tedavisi alan hastalarda bronşit ve üst solunum yolu enfeksiyonları Üst ekstremite spastisitesi için botulinum toksini tedavisi alan hastalarda bronşit, adversreaksiyon olarak plaseboya kıyasla daha sık bildirilmiştir. Üst ekstremite spastisitesi tedavisialan akciğer fonksiyonu azalmış hastalarda, üst solunum yolları enfeksiyonları da botulinumtoksini alan hastalarda plaseboya kıyasla advers reaksiyonlar olarak daha sık bildirilmiştir.Üst ekstremite spastisitesi tedavisi alan 195 hastada terapötik faydaları doğrulamak içinyapılan klinik çalışmada, test grubunda (NABOTA ile tedavi edilmiş) 2 ve kontrol grubunda 1üst solunum yolu enfeksiyonu vakası bildirilmiştir. Pediyatrik kullanım NABOTA'nın bölüm 4.1'deki pediyatrik popülasyon için güvenliliği ve etkililiği gösterilmemiştir. Aşağıdaki hastalara dikkatle uygulanmalıdır: Diğer kas gevşeticileri (örn., tübokürarin klorür, dantrolen sodyum ve benzeri) ile tedavi altındaki hastalar - Kas gevşemesi güçlenebilir ya da disfaji riskleri artabilir. Kas gevşetme aktivitesi olan ilaçlarla tedavi altındaki hastalar, örneğin, spektinomisin HCl, aminoglikozid antibiyotikler (gentamisin sülfat, neomisin sülfat ve benzeri), polipeptidantibiyotikler (polimiksin B sülfat ve benzeri), tetrasiklin antibiyotikler, linkomisinantibiyotikler (linkozamidler), kas gevşeticiler (baklofen ve benzeri), anti-kolinerjik ajanlar(skopolamin butilbromür, trihekzilfenidil HCl ve benzeri), benzodiazepin ve diğer benzerilaçlar (diazepam, etizolam ve benzeri) ve benzamid ilaçlar (tiyaprid HCl, sülpirid ve benzeri).Kas gevşemesi güçlenebilir ya da disfaji riskleri artabilir. Genel önlemler Tedavi edilen hastalığın doğası gereği bu müstahzarın, araç ve makine kullanım yeteneği üzerindeki etkileri tahmin edilemez. Glabella çizgisi Botulinum toksininin, orbikülaris kasına enjeksiyonundan kaynaklanan göz kırpması azalması, özellikle VII. sinir bozuklukları olan hastalarda, korneal maruziyete, persistanepitelyal defekte ve korneal ülserasyona neden olabilir. Enjeksiyon bölgesinde cilt hastalığı, enfeksiyon ve skarlar gibi cilt bozuklukları olan hastalar, glabella kısmında (alın dahil) yüz gerdirme ve kalıcı implant gibi tedavi öyküsü olan hastalar,fasyal sinir paralizisi ya da göz kapağı pitozis belirtileri öyküsü olan hastalar, glabellaçizgileri el kullanılarak dahi düzleştirilemediği için fiziksel yöntemle tatmin edici bir şekildedüzelme gösteremeyecek hastalar, faz III güvenlilik ve etkililik çalışmalarında hariçtutulmuştur, bu nedenle uyarılmalıdır. Bu ürünün enjeksiyonu, üç ayda birden daha sıkolmamalıdır ve minimum etkili doz kullanılmalıdır. Sodyum NABOTA her dozunda 1mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında sodyum içermez. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriHerhangi bir anti-trombosit (aspirin benzeri) ürün veya antikoagülan (kan sulandırıcı) kullanan hastalarda dikkatli olunmalıdır. Botulinum toksini ürünlerinin etkileri genel olarak, aminoglikozid antibiyotiklerle ya da tübokürarin-tipi kas gevşeticiler gibi nöromusküler iletimi etkileyen diğer ilaçlarla birliktekullanıldığında güçlenir. Aminoglikozidler veya spektinomisin ile birlikte kullanımıkontrendikedir. Bu ürün enjekte edilen hastalarda polimiksin, tetrasiklin ve linkomisindikkatli kullanılmalıdır. Farklı botulinum nörotoksin serotiplerinin aynı zamanda ya da birkaç ay içinde uygulanmasının etkileri bilinmemektedir. Daha önceden uygulanmış botulinum toksinininetkileri kaybolmadan başka bir botulinum toksini ürününün uygulanması ile aşırınöromusküler güçsüzlük alevlenebilir. Özel popülasyonlara ilişkin ek bilgilerÖzel veri bulunmamaktadır. Pediyatrik popülasyon:Çocuklarda etkileşim çalışması bulunmamaktadır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar tedavi süresince etkili doğum kontrol yöntemi uygulamalıdır. Gebelik dönemiBotulinum toksininin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir. İnsanlara yönelik potansiyel risk bilinmemektedir. Bu ilacın (0.5, 1, 4U/kg) organogenez döneminde (gebeliğin 6 ila 16. gestasyon günleri) gebe sıçanlara intramüsküler yoldan enjekte edilmesinden sonra, maternal durum ve embriyofetalgelişim üzerindeki etkisi değerlendirilmiştir. Sonuç olarak, 4U/kg doz grubunda annesıçanlarda çekiç parmak deformitsi, paralitik yürüyüş, ayak parmaklarında kıvrılma ve fetüsteosteopeni gözlenmiştir. Bunlar istatistiksel olarak anlamlı bulunmamıştır. NABOTA kesinlikle gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiBotulinum toksininin insan sütüyle atılıp atılmadığı bilinmemektedir. NABOTA emzirme döneminde kullanılmamalıdır. Üreme yeteneği/Fertilite
kadınlarda kullanımının fertilite
Botulinum toksini tip A'nin doğurganlık çağındaki üzerindeki etkilerine ilişkin yeterli veri bulunmamaktadır. 4.7 Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerindeki etkilere ilişkin bir çalışma gerçekleştirilmemiştir. Tedavi edilen hastalığın doğası gereği bu tıbbi ürünün, araç ve makine kullanım yeteneğiüzerindeki etkileri tahmin edilemez. Ancak hastalar, güç kaybı, kas güçsüzlüğü, bulanık görme ya da göz kapaklarında sarkma olması durumunda araç kullanmamaları ya da herhangi başka bir potansiyel olarak tehlikelifaaliyette bulunmamaları konusunda uyarılmalıdır. 4.8 İstenmeyen etkilerGenel Botulinum toksini tedavisi durumunda bazen disfaji, pnömoni ve/veya anlamlı debilite ya da anafilaksi ile ilişkili ölümün bildirildiği spontan raporlar olmuştur. Bazıları fatal sonuçdoğuran aritmi ve miyokard enfarktüsü dahil olmak üzere kardiyovasküler sistemi içerenseyrek advers olay raporları da olmuştur. Bu olayların botulinum toksini enjeksiyonuyla tamilişkisi gösterilmemiştir. Aşağıdaki olaylar diğer botulinum toksinleri ile bildirilmiştir veenjekte edilen botulinum toksiniyle nedensel ilişkisi bilinmemektedir: cilt döküntüsü (eritemamultiforme, ürtiker ve psöriaziform erüpsiyon), kaşıntı ve alerjik reaksiyon. Genelde advers reaksiyonlar enjeksiyonu takiben ilk hafta içinde meydana gelir ve genel olarak geçici olsalar da, birkaç ay sürenleri de olabilir. Enjeksiyon ile ilişkili olarakenjeksiyon bölgesinde ya da yakındaki kaslarda lokalize ağrı, hassasiyet, morarma, çekme(traksiyon), şişlik, sıcaklık hissi ya da hipertoni görülebilir. Enjeksiyon kasındaki ya dakaslarındaki lokal güçsüzlük, botulinum toksininin beklenen farmakolojik etkisini temsiletmektedir. Ancak toksinin yayılması nedeniyle yakın kaslarda güçsüzlük de görülebilir.Blefarospazm ya da servikal distoni hastalarına enjekte edildiğinde, enjeksiyon bölgesindenuzak bazı kaslarda, klinik güçsüzlükle ya da diğer elektrofizyolojik anomali tipleriyle ilişkiliolmayan elektrofizyolojik seğirme artışı (bir dalga formunda hızlı varyasyon) görülebilir. Glabella çizgileri Bu ürünün güvenliliği, yaşları 20 ila 65 arasında değişken ve orta ila şiddetli glabella çizgileri olan 268 hastanın dahil edildiği çok merkezli, karşılaştırmalı, çift-kör, randomize çalışmadadeğerlendirilmiştir (test grubu 135, kontrol grubu 133). Advers reaksiyonlar test grubunun%20,00'ında ve kontrol grubunun %18,05'inde gözlenmiştir. Advers reaksiyonların çoğu hafifti ve hiçbiri şiddetli değildi. Bu ilacın test grubunda %1'den daha fazla bildirilen advers reaksiyonlar sıklıklarına göre; pitozis (%2,22), kaşlarda kalkma(%1,48) ve vertigo (%1,48) şeklinde listelenmektedir. Glabella çizgilerinin görünümünü iyileştirme tedavisi için randomize, aktif-kontrollü klinik çalışmalarda değerlendirilen 20 ile 65 yaş arasındaki NABOTA ile tedavi grubunda (N=135)ve kontrol grubunda (N=133) raporlanan advers reaksiyonların listesi aşağıda verilmiştir. Lateral kantal çizgiler (kaz ayağı çizgileri) Bu ürünün güvenliliği, yaşları 18 ila 75 arasında orta ila şiddetli lateral kantal çizgileri olan 204 hastanın dahil edildiği çok merkezli, karşılaştırmalı, çift kör, randomize çalışmalardadeğerlendirilmiştir. Deneklerin %9.8'inde (20/204 hasta, 28 vaka) lateral kantal çizgileriyleilişkili olmayan advers olaylar gözlenmiştir. Dokuz vaka hafif, 19 vaka orta şiddette olmuştur.Bu vakaların hiçbiri akut reaksiyon değildir ve bu ürün tedavisi ile ilişkili bulunmamıştır.Hem test hem de kontrol grubunda 1 hastada (%0,49, her grupta 1 hasta) lateral kantalçizgilerle ilişkili advers ilaç reaksiyonları gözlenmiş olup bunların tümü hafif reaksiyonlarolarak bulunmuştur (Test ilacı enjeksiyon bölgesinde: kaşıntı, Referans ilaç enjeksiyonbölgesinde: hassasiyet). Pazarlama sonrası gözetim bulgularıGlabella çizgileri914 hasta ile 4 yıl boyunca yapılan pazarlama sonrası gözetim çalışması sonucunda, yurt içi kullanımda %2.5 oranında (23/914, 25 vaka) advers reaksiyon gözlenmiştir. Bu vakalararasında bu ürünle nedensel ilişkisi dışlanamayan advers reaksiyon oranı sırasıyla %1.6(15/914, 17 vaka) olup %0,5 (5/914, 5 vaka) oranında baş ağrısı, %0,2 (2/914, her birinden 2vaka) oranında göz yorgunluğu ve göz çevresinde şişlik ve %0.1 (1/914, her birinden 1 vaka)oranında kas sertliği, yorgunluk, fasyal paraliz, enjeksiyon yeri reaksiyonu, döküntü,hassasiyet, enjeksiyon yerinde ağrı ve kaşıntı gözlenmiştir. Ciddi advers olay ve ciddi adversreaksiyon tespit edilmemiştir. Beklenmeyen advers olay oranı %1.5(14/914, 16 vaka) olup %0.8(7/914, 7 vaka) oranında baş ağrısı, %0.2 (2/914, her birinden 2 vaka) oranında göz yorgunluğu ve farenjit ve %0.1(1/914, her birinden 1 vaka) oranında sırt ağrısı, kas sertliği, yorgunluk, fasyal paraliz ve ciltkırışıklıkları gözlenmiştir. Bu ürünle nedensel ilişkisi dışlanamayan beklenmeyen adversolayların oranı %0,9'dur (8/914, 10 vaka). Bu vakalardan baş ağrısı %0.5(5/914, 5 vaka)oranında, göz yorgunluğu %0.2(2/914, 2 vaka) oranında ve kas sertliği, yorgunluk ve fasyalparaliz %0.1 oranında (1/914, her birinden 1 vaka) bildirilmiştir. Ciddi, beklenmeyen adversolay ve ciddi, beklenmeyen advers reaksiyon tanımlanmamıştır. Bu ilacın yurt içindeki advers olay ve spontan yan etki raporlarının yeniden incelemesi, pazarlama onayı olan tüm yerli ilaçların advers olay raporları ile yapılan yeniden incelemesonunda değerlendirilmiştir. Sonuç olarak, diğer tüm ilaçlara kıyasla bu ilaçta bildirilenistatistiksel olarak anlamlı yan etkiler arasında, yeni tespit edilen vakalar aşağıdaki gibidir.Ancak bu sonuç, bu bileşen ile aşağıdaki advers olaylar arasındaki nedensel ilişkininkurulduğu anlamına gelmez. Deri ve deri altı doku hastalıkları: göz çevresinde şişlik (göz kapaklarında şişme) Sinir sistemi: baş ağrısı Aşağıda ilgili advers reaksiyonlar sistem organ sınıflandırmasına göre listelenmiştir: Çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10); yaygın olmayan (> 1/1.000 ila < 1/100); seyrek(> 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000); Bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Sinir sistemi hastalıklarıYaygın: Baş dönmesi Göz hastalıklarıYaygın: Göz küresi kası bozuklukları, göz kapağında düşüklük Gastrointestinal hastalıklarYaygın: Bulantı Deri ve deri altı doku hastalıklarıYaygın: Pruritus, deride gerginlik NABOTA ile tedavide halihazırda gözlenmemiş olsa da, sınıf etkisi nedeniyle ilaveten aşağıdaki yan etkilerin de görülmesi muhtemeldir. Enfeksiyonlar ve enfestasyonlarYaygın olmayan: Enfeksiyon Psikiyatrik hastalıklarYaygın olmayan: Anksiyete Sinir sistemi hastalıklarıYaygın: Baş ağrısı, parestezi Göz hastalıklarıYaygın olmayan: Blefarit, göz ağrısı, görme bozukluğu (bulanık görme dahil) Gastrointestinal hastalıklarYaygın olmayan: Ağız kuruluğu Deri ve deri altı doku hastalıklarıYaygın: Eritem
fotosensitivite reaksiyonu, deri
Yaygın olmayan: Ödem (yüz, göz kapağı, periorbital), kuruluğu Kas-iskelet ve bağ dokusu hastalıklarıYaygın: Lokalize kas zayıflığı Yaygın olmayan: Kas seyirmesi Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Yüz ağrısı, enjeksiyon yerinde ödem, ekimoz, enjeksiyon yerinde ağrı, enjeksiyon yerinde iritasyon Yaygın olmayan: Grip sendromu, asteni, ateş. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadr. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TUFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9 Doz aşımı ve tedavisiDoz aşımı bulgu ve belirtileri, enjeksiyondan hemen sonra belirgin şekilde görülmez. Kaza eseri enjeksiyon ya da oral kullanım meydana gelmesi durumunda kişi, sistemik güçsüzlükveya kas paralizisinin bulgu ya da belirtileri açısından birkaç haftaya kadar tıbbi olarakizlenmelidir. Doz aşımı ya da yanlış uygulamanın hemen öğrenilmesi durumunda birantitoksin kullanılabilir. Antitoksin, uygulanması zamanında halihazırda ortaya çıkmışherhangi bir botulinum toksini ile oluşan kas güçsüzlüğünü geri döndürmeyecektir. Eğer orofarinks ve özefagus kasları etkilenirse, aspirasyon pnömonisine neden olacak şekilde aspirasyon görülebilir. Solunum kasları paralize olmuşsa veya tedavi sonucu güçsüzleşmişse,iyileşme gerçekleşene kadar hastanın entübasyonu gerekebilir. Destekleyici bakım, diğergenel destekleyici bakıma ek olarak trakeostomi ve/veya uzamış mekanik ventilasyonihtiyacını içerebilir. Bu hastalar, daha ileri tıbbi değerlendirme için ele alınmalı ve hastaneyeyatışı da içerebilen şekilde uygun tıbbi tedavi derhal başlatılmalıdır. 5. FARMAKOLOJIK ÖZELLIKLER5.1 Farmakodinamik özelliklerFarmakokinetik grup: Diğer kas gevşeticileri, periferik etkili ajanlar. ATC kodu: M03AX01 Etki mekanizması Clostridium botulinumClostridium botulinumtip Atoksini enjeksiyonu terapötik dozlarda intramusküler olarak enjekte edildiğinde enjeksiyon,kas aktivitesinde lokalize azalma oluşturacak şekilde kasta kısmi kimyasal denervasyonoluşturur.Ek olarak kas atrofisi, aksonal filizlenme ve bileşke dışı asetilkolin reseptörleri gelişimi görülebilir. Kas reinnervasyonunun görülebileceğine, dolayısıyla Clostridium botulinumtip Atoksini enjeksiyonundan kaynaklanan kas denervasyonunun yavaşça geri dönebileceğineilişkin kanıt vardır.Klinik etkililik ve güvenlilik Glabella çizgileri NABOTA'nın, orta ila şiddetli glabella çizgilerinin tedavisi için erişkin hastalardaki etkililiğini ve güvenliliğini değerlendirmek için çok merkezli, randomize, çift-kör, aktif ilaçkontrollü, bir faz III lokal klinik çalışma yürütülmüştür. Toplamda 281 gönüllü bu çalışmadabilgilendirilmiş onam vermiştir. Bunlardan 13 gönüllü, tarama döneminde çalışmayıbırakmıştır. Toplamda 268 gönüllü randomize edilmiş ve bunlara test ilacı ya da kontrol ilacıuygulanmıştır. Bunlardan 5 tanesi çalışmayı bırakmış ve 263 gönüllü bu çalışmayıtamamlamıştır. Güvenlilik analizinde, birden fazla güvenlilik değerlendirilmesi yapılan toplamda 268 gönüllü kullanılmıştır. Bunlardan 3 kişi haricinde 265 tanesi, FA analizinde kullanılmıştır. Bunlardan263 tanesi, primer etkililik değerlendirmesine (PPS1) katılmıştır ve iki gönüllü, sırasıylaziyaret 3'teki ziyaret çerçevesinin ihlali ve yasaklanmış eş zamanlı ilaç uygulanmasınedeniyle hariç tutulmuştur. Ek olarak sekonder etkililik değerlendirmesine (PPS2), çalışmayıprotokole uygun tamamlayamayan 18 kişi haricinde 245 gönüllü dahil edilmiştir. Faz III'ün etkililik analizi sonuçları aşağıdaki şekildedir; Bu çalışmadaki birincil sonlanma noktası, dozdan sonraki 4. haftada maksimum kaş çatmada glabella çizgisinin araştırmacı tarafından değerlendirilmesiydi. PP analizinde iyileşme oranıtest grubunda %93,89 (%95 GA: 89,79, 97,99) ve kontrol grubunda %88,64'tü (%95 GA:83,22, 94,05). Test grubu ve kontrol grubu arasındaki iyileşme oranlarının farkına ilişkin%97,5 tek taraflı güven aralığının alt sınırı -%1,53'tü. Yani, güven aralığının alt sınırının>-%15 olması nedeniyle test grubunun kontrol grubuna non-inferioritesi doğrulanmıştır. FA analizinde, maksimum kaş çatmada glabella çizgisinin iyileşme oranı test grubunda %93,98 (%95 GA: 89,94, 98,03) ve kontrol grubunda %88,64'tü (%95 GA: 83,22, 94,05).Test grubu ve kontrol grubu arasındaki iyileşme oranlarının farkına ilişkin %97,5 tek taraflıgüven aralığının alt sınırı -%1,41'di. Bu sonuç PP1 analiz sonucuna çok benzerdi. İkincil sonlanma noktalarının analiz sonuçlarında, her ziyarette uygulama öncesi karşılaştırmaları arasında anlamlı farklılık gösterildi ve test grubu ve kontrol grubu arasındaistatistiksel olarak anlamlı fark yoktu. Bu çalışmadaki ikincil sonlanma noktaları şuşekildeydi; Dozdan sonra 8., 12. ve 16. haftada Maksimum Kaş Çatmada Glabella ÇizgisiŞiddeti için İyileşme Oranları, Dozdan sonra 8., 12. ve 16. haftada Dinlenme Halinde GlabellaÇizgisi Şiddeti için İyileşme Oranları, Maksimum Kaş Çatmada ve Dinlenme Halinde DışAraştırmacı Fotoğraf Değerlendirmesinde İyileşme Oranları, Glabella Çizgisi Şiddeti içinGönüllünün Değerlendirdiği İyileşme Oranları ve Gönüllü Memnuniyetinin Araştırılması. FAanalizi de benzer sonuçlar gösterdi. Güvenlilik analizi sonuçlarında, advers olayların insidansı test grubunda ve kontrol grubunda sırasıyla %20,00 (27/135 kişi, 44 olgu) ve %18,05 (24/133 kişi, 36 olgu) ve toplamda 80advers olay olgusu görüldü (p=0,6835). Advers ilaç reaksiyonları insidansı test grubunda vekontrol grubunda sırasıyla %5,93 (8/135 kişi, 10 olgu) ve %4,51'di (6/133 kişi, 8 olgu). Diğerbir deyişle, toplamda 18 tane advers ilaç reaksiyonu olgusu görüldü ve iki grup arasındaistatistiksel olarak anlamlı bir fark yoktu (p=0,6028). Kontrol grubunda bir olguda ciddiadvers olay görüldü (1/133 kişi, %0,75) ve iki grup arasında istatistiksel olarak anlamlı farkyoktu (p=0,4963). Her iki grupta da ciddi advers ilaç reaksiyonu yoktu. Sonuç olarak testgrubundaki ve kontrol grubundaki advers olaylar insidansı çok benzerdi. Görülen adversolayların tipi, iki grup arasında bir miktar farklıydı ancak çoğu önceden biliniyordu.Laboratuvar testlerindeki, vital bulgulardaki ve fizik muayenedeki güvenlilik verilerinin biranalizinde, iki tedavi grubu arasında çoğu madde açısından anlamlı bir fark yoktu. Maddelerinbazılarında bir miktar fark vardı ancak klinik olarak anlamlı varyasyon değildi. Botulinumtoksini tip A için antikor testi sonucunda, ziyaret 1'de antikoru olan bir olgu yoktu veolguların hiçbirinde 16 hafta sonrasında bir antikor oluşmadı. Sonuç olarak, NABOTA enjeksiyonunun, Faz III'te güvenlilik ve etkililik açısından kontrol ilacına benzer olduğu doğrulanmıştır. Daha fazla önlem aldırmayı gerektirecek bir güvenlilikbilgisi yoktu. Bu çalışma ile NABOTA enjeksiyonunun, glabella çizgileri olan gönüllülerde kontrol ilacına non-inferioritesi doğrulanmıştır. Advers olay ve advers ilaç reaksiyonu insidansı açısındanNABOTA enjeksiyonu, kontrole benzerdi. Sonuç olarak NABOTA enjeksiyonunun, kontrolilacı kadar etkili ve güvenli kullanılabildiği değerlendirilmiştir. Lateral kantal çizgiler Faz III klinik çalışmalarda; çok merkezli, karşılaştırmalı, randomize, çift kör çalışmada, orta ila şiddetli lateral kantal çizgilerin (LCL) iyileştirilmesine ihtiyaç duyan 204 yetişkin hasta(18 ila 75 yaş arası) değerlendirilmiştir. Deneklere, sağ veya sol lateral kantal çizgilererastgele enjekte edilen NABOTA veya diğer botulinum toksin uygulanmıştır. Sonuçlar, uygulamadan dört hafta sonra araştırmacı değerlendirmesini takiben maksimum gülümseme sırasında lateral kantal çizgilerde iyileşme oranının, NABOTA uygulanan bölgede%65.02 (132/203 denek) ve diğer botulinum toksininin uygulandığı bölgede %62.56 (127/203denek) olduğunu göstermiştir. Buna göre 4 haftalık uygulamadan sonra araştırmacınındeğerlendirmesine dayanarak maksimum gülümsemede lateral kantal çizgilerin iyileşmeoranı, NABOTA uygulama bölgesinde %65.02 (132/203 denek) ve diğer botulinum toksinininuygulandığı bölgede %62.56 (127/203 denek) olmuştur. İki uygulama yeri arasındaki %95güven aralığının alt sınırı %-0.91 idi, bu nedenle NABOTA'nın etkinliği, diğer botulinumtoksin ilacına eşit etkin bulunmuştur. Tek gruplu, açık ve çok merkezli genişletilmiş klinik çalışmada, yukarıda bahsedilen faz III klinik çalışmalara katılan ve orta ila şiddetli lateral kantal çizgiler (LCL) veya Glabellaçizgilerinin (GL) iyileştirilmesine ihtiyaç duyan 109 yetişkin değerlendirilmiştir. Lateralkantal çizgilere tek doz 24U ve Glabella çizgilere 20 U enjekte edilmiştir. Sonuç olarak, 4haftalık uygulamadan sonra araştırmacının değerlendirmesine dayalı olarak maksimumgülümsemede lateral kantal çizgilerin iyileşme oranı, faz III klinik çalışmalarındagözlemlenen sonuçlara benzer olmuştur. 5.2 Farmakokinetik özelliklerGenel ÖzelliklerBotulinum toksini tip A'nın aşırı toksisitesi nedeniyle etkin maddeye ilişkin klasik emilim, dağılım, biyotransformasyon ve eliminasyon çalışmaları gerçekleştirilmemiştir. Botulinum Toksini Tip A'nın, önerilen dozlarda IM ya da intradermal enjeksiyonunu takiben periferik kanda ölçülebilir düzeylerde bulunması beklenmez. Her tedavi seansındauygulanacak önerilen nörotoksin miktarlarının, nöromusküler fonksiyon bozukluğu olmayanhastalarda sistemik, aşikar uzak klinik etkilere, yani kas güçsüzlüğüne yol açması beklenmez.Ancak bildirilen farmakokinetik çalışmalarda, IM botulinum toksini dozlarından sonra, klinikolarak gözlenebilir lokal kas güçsüzlüğü oluşturmaya uygun tek-fiberli elektromiyografi ilesub-klinik sistemik etkiler gösterilmiştir. 5.3 Klinik öncesi güvenlilik verileriKarsinojenite, mutajenite, fertilite Karsinojenik potansiyeli değerlendirmek için hayvanlarda uzun dönemli çalışmalar gerçekleştirilmemiştir. Hayvanlarda toksisite Başka botulinum toksini ürünüyle, yanlışlıkla yapılan mesane çevresi uygulamasını değerlendirmek için yapılan bir çalışmada, prostatik üretra ve proksimal rektuma bölünmüşolarak toplamda 6,8 U/kg (tek uygulama) enjekte edilen 4 erkek maymunun 1'inde mesanetaşları gözlenmiştir. Tek ya da 4 tekrarlı doz enjeksiyon şeklinde doğrudan mesaneye 36U/kg'ye (~12NABOTA insan dozu) kadar enjeksiyonu takiben erkek veya dişi maymunlardaya da 100 U/kg'ye (~33NABOTA insan dozu) kadar tek enjeksiyonda dişi sıçanlarda mesanetaşı gözlenmemiştir. 6. FARMASOTIK ÖZELLİKLER6.1 Yardımcı maddelerin listesiİnsan serum albumini Sodyum klorür 6.2 GeçimsizliklerGeçimlilik çalışmaları olmadığı için bu tıbbi ürün, diğer tıbbi ürünlerle karıştırılmamalıdır. Botulinum toksininin potens üniteleri, ürünlerin kendilerine spesifik olduğu için, diğer botulinum toksini ürünleriyle değiştirilebilir değillerdir. Bu nedenle, botulinum toksinininbiyolojik aktivite üniteleri, başka bir spesifik analiz yöntemiyle değerlendirilen herhangi birdiğer botulinum toksini ürününün üniteleriyle kıyaslanamaz ya da bu ünitelere çevrilemez. 6.3 Raf ömrüRaf ömrü üretim tarihinden itibaren 36 aydır. Sulandırıldıktan sonra, 2°C - 8°C'de 24 saat boyunca stabilite gösterilmiştir. 6.4 Saklamaya yönelik özel tedbirlerBu tıbbi ürünün açılmamış flakonları 2 - 8oC'de buzdolabında saklanmalıdır. Sulandırılmış ürün, sulandırıldıktan sonra 24 saate kadar buzdolabında (2 - 8°C) saklanabilir. Flakon üzerindeki son kullanma tarihinden sonra kullanmayınız. NABOTA sulandırıldıktan sonraki 24 saat içinde uygulanmalıdır ve bu dönemde NABOTA buzdolabında saklanmalı (2° ila 8°C) ve dondurulmamalıdır. Sulandırılan NABOTA berrak,renksiz, şeffaf ve parçacıklı madde içermeyen şekilde olmalıdır. 6.5 Ambalajın niteliği ve içeriğiNABOTA, 100 Ünitelik tek kullanımlık flakonda sunulur. Renksiz ve şeffaf bir flakonda beyaz ila sarımsı enjeksiyonluk toz. Seyrelticide (fizyolojik salin çözeltisi) çözdürüldüğünde berrak, renksiz, şeffaf bir sıvı olmalıdır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerHazırlama ve seyreltme tekniğiEnjeksiyon öncesinde, vakumla kurutulmuş ürün, koruyucu içermeyen, steril salin ile sulandırılır. %0,9 sodyum klorür enjeksiyonu önerilen seyrelticidir. Uygun boyutta enjektöredoğru miktarda seyreltici çekilir. Bu ürün, kabarcıklanma ya da benzeri bir kuvvetli çalkalamaile denatüre olduğu için seyreltici, flakon içine yavaşça enjekte edilmelidir. Eğer seyrelticivakumla flakona çekilmezse flakon atılmalıdır. Etiket üzerindeki boşluğa sulandırma tarihi vesaati kaydedilmelidir. Bu ürün, sulandırıldıktan sonraki 24 saat içinde uygulanmalıdır. Budönemde sulandırılan ürün buzdolabında saklanmalıdır (2 - 8°C). Sulandırılan ürün berrak,renksiz olmalı ve parçacık içermemelidir. Parenteral müstahzarlar, uygulama öncesindeparçacıklı madde ve renk değişikliği açısından görsel olarak incelenmelidir. Bu ürün veseyrelticisi herhangi bir koruyucu içermediği için, bu ürünün bir flakonu tek bir hasta içinkullanılmalıdır. Geriye kalan/kullanılmayan çözelti imha prosedürüne uygun şekildeatılmalıdır. İmhaGüvenli imha için, tarihi geçmiş flakonlar dahil tüm flakonlar ya da ilaçla doğrudan temas etmiş tüm ekipman tıbbi atık olarak imha edilmelidir. Eğer inaktivasyon gerekirse (örn.,dökülmeler), tıbbi atık olarak imha öncesinde seyreltik hipoklorit çözeltisinin (%0,5 ya da%1) kullanılması önerilir. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİSELTEK İlaç Pazarlama ve Dış Tic. A.Ş. Kavacık Mah. Okul Cad. No:3 Kat:6 Sezer Plaza Beykoz/İstanbulTelefon : 0 216 680 34 44Faks : 0 216 680 34 48 8. RUHSAT NUMARASI2021/116 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 21.04.2021 Son yenileme tarihi: 10. KUB'UN YENİLENME TARİHİ |
İlaç BilgileriNabota 100 Ünite Enjeksiyonluk Çözelti Hazırlamak İçin Liyofilize TozEtken Maddesi: Botulinum Toksini Tip A Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.