Ocrevus 300 Mg/10 Ml İnfüzyonluk Çözelti Hazırlamak İçin Konsantre Kısa Ürün BilgisiKISA URUN BILGISIBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBİ ÜRÜNÜN ADIOCREVUS 300 mg/10 mL infüzyonluk çözelti hazırlamak için konsantre 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her flakon, 30 mg/mL konsantrasyonda ocrelizumab çözeltisi içerir. Toplamda her flakonda 10 mL'de 300 mg ocrelizumab bulunmaktadır. Dilüsyon sonrasında elde edilen ilaçkonsantrasyonu yaklaşık 1,2 mg/mL' dir. Ocrelizumab, rekombinant DNA teknolojisiyle Çin Hamsteri Yumurtalığı hücre diz ilerinde üretilen bir humanize monoklonal antikorudur. Yardımcı maddeler:Sodyum asetat trihidrat 21,4 mg Diğer yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMSteril İnfüzyonluk çözelti hazırlamak için konsantre. Berrak ila hafif opalesan ve renksiz ila açık kahverengi çözelti. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarAtaklarla seyreden (RMS) veya primer progresif MS (PPMS) vakalarında endikedir. 4.2 Pozoloji ve uygulama şekliTedavi, ciddi infüzyonla ilişkili reaksiyonlar (İİR) gibi şiddetli reaksiyonların yönetiminde uygun tıbbi desteğe erişimi olan, deneyimli bir sağlık uzmanı tarafından başlatılmalı ve takipedilmelidir. İnfüzyonla ilişkili reaksiyonlar için premedikasyonİİR'lerin sıklığı ve şiddetini daha da azaltmak amacıyla her ocrelizumab infüzyonundan önce aşağıdaki iki premedikasyon önerilmektedir (bkz. Bölüm 4.4): Her infüzyondan yaklaşık 30 dakika önce 100 mg intravenöz metilprednisolon veyaeşdeğer dozda diğer kortikosteroidlerin uygulanması; İnfüzyondan yaklaşık 30-60 dakika önce antihistaminik bir ilaç (ör: difenhidramin)uygulanması İlave olarak, infüzyondan 30-60 dakika önce antipiretikler ile premedikasyon (ör: parasetamol) ayrıca değerlendirilebilir. Pozoloji/Uygulama sıklığı ve süresi:Başlangıç dozu:600 mg başlangıç dozu, iki ayrı intravenöz infüzyon olarak uygulanır; ilk 300 mg infüzyonu 2 hafta sonra ikinci 300 mg infüzyon takip eder (bkz. Tablo 1). Sonraki dozlar:Sonraki ocrelizumab dozları 6 ayda bir, tek bir 600 mg intravenöz infüzyon olarak uygulanır (bkz. Tablo 1). İkinci doz, ilk dozun uygulanmasının ardından 6 ay sonra uygulanmalıdır. Her ocrelizumab dozunun arasında minimum 5 aylık ara olmalıdır. IIR meydana gelmesi durumunda infüzyon ayarlamaları:Yaşamı tehdit edici lİR'lerİnfüzyon sırasında, akut aşırı duyarlılık veya akut solunum güçlüğü sendromu gibi yaşamı tehdit edici veya sakat bırakan bir İİR'nin belirtileri olursa, infüzyon derhal kesilmelidir. Hastauygun şekilde tedavi görmelidir. Bu hastalarda infüzyon kalıcı olarak kesilmelidir (bkz. Bölüm4.3). Şiddetli lİR'lerHasta şiddetli bir İİR (ör. dispne) veya kızarma, ateş ve boğaz ağrısı semptomları yaşarsa, infüzyon hemen kesilmeli ve hastaya semptomatik tedavi uygulanmalıdır. İnfüzyon ancaksemptomlar düzeldikten sonra tekrar başlatılmalıdır. İnfüzyona yeniden başlandığındainfüzyon hızı, reaksiyonun başlangıç zamanında uygulanan infüzyon hızının yarısı olmalıdır.Hasta İİR yaşamazsa, sonraki infüzyonlarda infüzyon hızı ayarlaması gerekli değildir. Hafif ila orta şiddette lİR'lerHasta hafif ila orta şiddette İİR (ör. baş ağrısı) yaşarsa, infüzyon hızı, olay başlangıcında verilen hızın yarısına azaltılmalıdır. Bu azaltılmış hız en az 30 dakika korunmalıdır. Tolere edilirse,infüzyon hızı hastanın başlangıç infüzyon planına göre artırılabilir. Hasta İİR yaşamazsa,sonraki infüzyonlarda infüzyon hızı ayarlaması gerekli değildir. Tedavi sırasında doz ayarlamaları:Yukarıdaki doz kesintisi ve yavaşlama örnekleri (hafif ila orta şiddette ve şiddetli İİR'ler için) infüzyon hızındaki bir değişikliğe ve infüzyonun toplam süresinde artmaya neden olur ancaktoplam dozu etkilemez. Doz azaltımı önerilmez. Unutulan veya geç alınan dozlar:Eğer bir infüzyon unutulursa, mümkün olan en kısa sürede uygulanmalı, planlanan bir sonraki doza kadar beklenmemelidir. Unutulan dozun uygulanmasından 6 ay sonra bir sonraki dozuygulanacak şekilde doz planı yeniden oluşturulmalıdır. Dozları arasında tedavi aralığıminimum 5 ay olmalıdır (bkz. Tablo 1). Uygulama şekli:Seyreltme sonrasında, tedavi özel bir infüzyon setiyle IV infüzyon olarak uygulanır. İnfüzyonlar, intravenöz puşe veya bolus olarak uygulanmamalıdır (bkz. Tablo 1). Hastalar daha önce herhangi ciddi bir infüzyonla ilişkili reaksiyon (İİR) yaşamamışsa, sonraki dozlar için daha kısa (2 saatlik) bir infüzyon süresi uygulanabilir (Tablo 1, Seçenek 2). Tablo 1: Doz ve PlanUygulanacakocrelizumabMiktarıİnfüzyon talimatıilk doz (600 mg)İki infüzyona bölünmüş
İnfüzyon 1 İnfüzyon 2 (2 hafta sonra)
250 mL'de 300 mg
250 mL'de 300 mg İnfüzyona 30 dakika boyunca 30 mL/sahızındabaşlanmalıdır Sonrasında, hızı her 30 dakikada bir 30mL/saat artırarakmaksimum 180mL/saat'eçıkartılmalıdır Her bir infüzyon yaklaşık 2,5 saatboyunca uygulanmalıdırSonraki dozlar (600 mg)tek infüzyon6 ayda bir
500 mL'de 600 mg Seçenek 1 İnfüzyon süresi yaklaşık 3.5 saat İnfüzyona 30 dakika boyunca 40 mL/sahızındabaşlanmalıdır Sonrasında, hızı her 30 dakikada bir 40mL/saat artırarakmaksimum 200mL/saat'eçıkartılmalıdırHer bir infüzyonyaklaşık 3,5 saatboyuncauygulanmalıdır
Veya Seçenek 2 İnfüzyon süresi yaklaşık 2 saat
500 mL'de 600 mg İnfüzyona ilk 15 dakika için 100mL/sa hızındabaşlanmalıdır Bir sonraki 15 dakika için infüzyon hızı200 mL/saat'eçıkartılmalıdır Bir sonraki 30 dk için infüzyon hızını 250mL/saat'e artırınız Kalan 60 dakika için infüzyon hızı 300mL/saat'eçıkartılmalıdır Her bir infüzyon yaklaşık 2 saatboyuncauygulanmalıdır Intravenöz infüzyon çözeltileri konsantrenin 9 mg/mL (%0,9) sodyum klorür içeren infüzyon torbası ile dilüe edilerek hazırlanır ve sonuç ocrelizumab konsantrasyonu yaklaşık 1,2mg/mL'dir. İlave bilgi için Bölüm 6.6'ya bakınız. Tıbbi ürünün uygulanmadan önce seyreltilmesine ilişkin talimatlar için, bkz. Bölüm 6.6. İnfüzyon sırasında ve infüzyon tamamlandıktan sonra hastalar en az 1 saat gözlenmelidir (bkz. Bölüm 4.4). Özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği:Karaciğer bozukluğu olan hastalarda ocrelizumabın güvenliliği ve etkililiği üzerinde resmi olarak çalışılmamıştır. Hafif karaciğer yetmezliği olan hastalar klinik çalış malara dahiledilmiştir. Orta ve ciddi seviyede karaciğer yetmezliği olan hastalarda deneyim mevcut değildir.Ocrelizumab, bir monoklonal antikordur ve atılımı katabolizma yoluyla (karaciğermetabolizmasından ziyade) gerçekleşmekte olup, karaciğer yetmezliği olan hastalar için dozayarlaması gereksinimi beklenmemektedir (bkz. Bölüm 5.2). Böbrek yetmezliği:Böbrek bozukluğu olan hastalarda ocrelizumabın güvenliliği ve etkililiği üzerinde resmi olarak çalışılmamıştır. Hafif böbrek yetmezliği olan hastalar klinik çalışmalara dahil edilmiştir. Ortave ciddi seviyede böbrek yetmezliği olan hastalarda deneyim mevcut değildir. Ocrelizumab, birmonoklonal antikordur ve atılımı katabolizma yoluyla (örn. peptitlere ve amino asitlereparçalanma) gerçekleşmekte olup, böbrek yetmezliği olan hastalar için doz ayarlamasıgereksinimi beklenmemektedir (bkz. Bölüm 5.2). Pediyatrik popülasyon:0 ila 18 yaş arasındaki çocuklarda OCREVUS'un güvenliliği ve etkililiği üzerinde henüz çalışılmamıştır. Bu konu ile ilgili veri mevcut değildir. Geriyatrik popülasyon:Mevcut kısıtlı verilere dayanarak (bkz. Bölüm 5.1 ve 5.2) 55 yaşın üzerindeki hastalarda pozoloji ayarlaması gerekmemektedir. Devam eden klinik çalışmalarda yer alan hastalar da, 55yaş ve üzerine geldiklerinde, her 6 ayda bir 600 mg ocrelizumab uygulanmasına devamedilmektedir. 4.3 KontrendikasyonlarOCREVUS aşağıdaki durumlarda kontrendikedir: - Ocrelizumaba veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırıduyarlılığı olan hastalarda - Aktif enfeksiyonu olan hastalarda (bkz. Bölüm 4.4) - İmmun sistemi ciddi şekilde baskılanmış durumda olan hastalarda (bkz. Bölüm 4.4) - Bilinen aktif malignitesi olan hastalarda 4.4 Özel kullanım uyarıları ve önlemleriİzlenebilirlikBiyolojik tıbbi ürünlerin izlenebilirliğini artırmak için, uygulanan ürünün ticari adı ve seri numarası net bir şekilde hasta dosyasına kaydedilmelidir. İnfüzyonla İlişkili Reaksiyonlar (İİR)Ocrelizumab, sitokin salınımına ve/veya diğer kimyasal mediyatörlerle ilişkili olabilecek infüzyonla ilişkili reaksiyonlarla ilişkilendirilebilir. İİR semptomları herhangi bir ocrelizumab infüzyonu sırasında meydana gelebilir ancak sıklıkla ilk infüzyon sırasında rapor edilmiştir. İİR'ler infüzyondan sonra 24 saat içerisinde meydanagelebilir (bkz. Bölüm 4.8). Bu reaksiyonlar, kaşıntı, döküntü, ürtiker, eritem, , boğazirritasyonu, orofaringeal ağrı, dispne, faringeal veya laringeal ödem, yüzde kızarıklık,hipotansiyon, yüksek ateş, yorgunluk, baş ağrısı, sersemlik hali, bulantı,taşikardi ve anafilaksişeklinde ortaya çıkabilir. İnfüzyondan önce: Şiddetli reaksiyonların yönetimi: İİR, aşırı duyarlılık reaksiyonları ve/veya anafilaktikreaksiyonlar gibi şiddetli reaksiyonların yönetimi için uygun kaynaklar hazırbulundurulmalıdır. Hipotansiyon: OCREVUS infüzyonları sırasında bir İİR semptomu olarak hipotansiyongörülebilir. Bu nedenle her bir OCREVUS infüzyonundan 12 saat önce ve infüzyonboyunca antihipertansif tedavilerin kesilmesi düşünülmelidir. Konjestif kalp yetmezliğiöyküsü (New York Kalp Birliği III ve IV) olan hastalar araştırılmamıştır. Premedikasyon:İnfüzyon reaksiyonlarmm sıklığını ve şiddetini azaltmak için premedikasyon uygulanmalıdır (bkz. Bölüm 4.2 - İnfüzyonla ilişkili reaksiyonlar için premedikasyon). İnfüzyon esnasında: Bronkospazm ve astım alevlenmesi gibi şiddetli pulmoner semptomlar görülen hastalardaaşağıdaki önlemler alınmalıdır: - İnfüzyon hemen ve kalıcı olarak durdurulmalıdır - Semptomatik tedavi uygulanmalıdır - Klinik semptomlarda başlangıçtaki iyileşme sonrasında tekrar kötüleşmegörülebildiğinden, hastalar pulmoner semptomlar tamamen düzelene kadargözlemlenmelidir. Semptom olarak aşırı duyarlılığın İİR'den ayırt edilmesi zor olabilir. İnfüzyon sırasındabir aşırı duyarlılık reaksiyonundan şüphelenilirse infüzyon hemen ve kalıcı olarakdurdurulmalıdır (bkz. Aşırı duyarlılık reaksiyonları) İnfüzyon sonrasında: Hastalar, infüzyon sırasında ve infüzyon tamamlandıktan sonra en az bir saat süreyleİİR'ye karşı gözlenmelidir. Hastalar, infüzyondan sonraki 24 saate kadar infüzyon reaksiyonlarının görülebileceğikonusunda bilgilendirilmelidir. İnfüzyonla ilişkili reaksiyon belirtileri gösteren hastalardaki infüzyon ayarlamaları için Bölüm 4.2'ye bakınız. Aşırı duyarlılık reaksiyonlarıAşırı duyarlılık reaksiyon (ilaca karşı akut alerjik reaksiyon) da görülebilir. Tip I akut aşırı duyarlılık reaksiyonları (IgE aracılı), klinik olarak İİR'lerden ayırt edilemeyebilir. İlk infüzyon sırasında genellikle görülmemekle birlikte, infüzyon esnasında bir aşırı duyarlılık reaksiyonu oluşabilir. Sonraki infüzyonlarda, öncekinden daha şiddetli semptomlar veya yenisemptomlar görülmesi, olası bir aşırı duyarlılık reaksiyonunu akla getirmelidir. Ocrelizumabakarşı bilinen IgE aracılı duyarlılığı olan hastalar ocrelizumab ile tedavi edilmemelidir (bkz.Bölüm 4.3). EnfeksiyonlarAktif enfeksiyonu olan hastalarda enfeksiyon düzelene kadar ocrelizumab uygulaması ertelenmelidir. Şiddetli immun yetmezliği (lenfopeni. nötropeni, hipogamaglobulinemi gibi) olan hastalarda ocrelizumab kullanılmaması gerektiğinden, uygulamadan önce hastanın bağışıklık durumukontrol edilmelidir (bkz. Bölüm 4.3 ve 4.8).Ciddi enfeksiyon geçiren hastaların genel oranı interferon beta-1a ve plaseboya benzer olmuştur (bkz. Bölüm 4.8). Derece 4 (yaşamı tehdit eden) ve derece 5 (ölümcül)enfeksiyonların sıklığı tüm tedavi gruplarında düşüktür, ancak PPMS'de yaşamı tehdit eden (%1,6'ya karşı % 0,4) ve ölümcül (% 0,6'ya karşı % 0) enfeksiyonlar ocrelizumab ile plaseboyakıyasla daha yüksek görülmüştür. Yaşamı tehdit eden tüm enfeksiyonlar, ocrelizumabtedavisinin kesilmesi gerekmeden düzelmiştir. PPMS'de yutma güçlüğü çeken hastalarda aspirasyon pnömonisi görülme riski daha fazladır. Bu hastalarda tedavi şiddetli pnömoni riskini artırır. Pnömoni görülen hastalarda acil önlemalınmalıdır. Progresif Multifokal Lökoensefalopati (PML)Ocrelizumab dahil anti-CD20 antikorları ile tedavi edilen ve çoğunlukla bazı risk faktörleri ile ilişkilendirilmiş (hasta popülasyonu örn. lenfopeni, ileri yaş, immunosupresif ajanlar ilepoliterapi) hastalarda John Cunningham Virüsünün (JCV) neden olduğu PML vakaları çoknadir gözlemlenmiştir. Yeni nöbetler veya nörolojik bulguların kötüleşmesi gibi MS hastalığının seyriyle benzer olabilecek erken PML belirtilerine karşı doktorlar dikkatli olmalıdır. PML'den şüphelendiği anda ocrelizumab tedavisi durdurulmalıdır. Tercihen kontrastlı MRG taraması (tedavi öncesi MRG ile karşılaştırılması), JCV Deoksiribonükleik Asit (DNA) içindoğrulayıcı beyin-omurilik sıvısı (BOS) testi ve tekrar nörolojik değerlendirmelerdüşünülmelidir. PML konfirme edilirse tedavi kalıcı olarak kesilmelidir. Hepatit B Virüsü (HBV) ReaktivasyonuAnti-CD20 antikorları ile tedavi edilen hastalarda bazı durumlarda fulminan hepatit, karaciğer yetmezliği ve ölüm ile sonuçlanan HBV reaktivasyonu rapor edilmiştir. Kılavuzlara göre tedaviye başlamadan önce tüm hastalarda HBV taraması gerçekleştirilmelidir. HBsAg ve anti-HB testlerinde pozitif sonuçlar ile doğrulanan aktif HBV'si olan hastalaraocrelizumab uygulanmamalıdır (bkz. Bölüm 4.3). Pozitif serolojisi olan (HBsAg için negatif veHB çekirdek antikoru için pozitif (HBcAb+) veya HBV (yüzey antijeni HbsAg+ için pozitif)taşıyıcıları olan hastalarda, tedaviye başlanmadan önce ve tedavi sırasında karaciğerhastalıkları uzmanlarına danışılmalı ve bu hastalar, hepatit B tekrar aktivasyonunu önlemekiçin izlenmelidir. Geç nötropeniGeç nötropeni başlangıcı vakaları ocrelizumab infüzyonundan en az 4 hafta sonra bildirilmiştir (bkz. Bölüm 4.8). Bazı vakalar Derece 3 veya 4 olsa da, vakaların çoğu Derece 1 veya 2'dir.Enfeksiyon belirtisi ve semptomları olan hastalarda, kan nötrofillerinin ölçümü tavsiye edilir. MalignitelerKlinik çalışmalarda kontrol gruplarına kıyasla ocrelizumabla tedavi edilen hastalarda malignite (meme kanserleri dahil) sayısında artış gözlenmiştir. Insidans bir MS popülasyonu içinbeklenen arka plan oranı dahilinde görülmüştür. Bilinen aktif malignitesi olan hastalaraocrelizumab tedavisi uygulanmamalıdır (bkz. Bölüm 4.3). Malignite için bilinen risk faktörleritaşıyan ve malignite nüksü bakımından aktif bir şekilde takip edilen hastalarda bireyselyarar-risk göz önünde bulundurulmalıdır. Hastalara standart meme kanseri taramasıuygulanmalıdır. Klinik çalışmaların kontrollü periyodunda, melanom dışı deri kanserlerinin insidansının düşük olduğu ve tedavi grupları arasında dengesizlik olmadığı görülmüştür. Bazal hücreli karsinomnedeniyle tedavinin 3 ve 4. yılları arasında bir insidans artışı gözlenmiş olup, böyle bir artışsonraki yıllarda gözlenmemiştir. İnsidansın bir MS popülasyonu için beklenen arka plan oranıdahilinde olduğu görülmektedir. İmmun sistemi ciddi şekilde baskılanmış olan hastaların tedavisiİmmun sistemi ciddi şekilde baskılanmış olan hastalara bu durum ortadan kalkana kadar tedavi uygulanmamalıdır (bkz. Bölüm 4.3). Diğer oto-immun rahatsızlıklarda, immunosupresiflerle (örneğin kronik kortikosteroidler, biyolojik ve biyolojik olmayan hastalık modifiye edici antiromatizmal ilaçlar, mikofenolatmofetil, siklofosfamid, azatiyoprin) eşzamanlı ocrelizumab kullanımı fırsatçı enfeksiyonlardahil olmak üzere ciddi enfeksiyonlarda artışa neden olmuştur. Enfeksiyonlar atipik pnömonive pneumocystis jiroveciipnömonisi, varisella pnömonisi, tüberküloz ve histoplazmozukapsamaktadır ancak bunlarla sınırlı değildir. Nadir vakalarda, bu enfeksiyonların bazılarınınölümcül olduğu görülmüştür. Açıklayıcı bir analizde ciddi enfeksiyon riskiyle ilişkilendirilenşu faktörler tespit edilmiştir: MS için önerilenden daha yüksek ocrelizumab dozları, diğerkomorbiditeler ve kronik immunosupresif/kortikosteroid kullanımı.Relapsların semptomatik tedavisine yönelik kortikosteroidler hariç olmak üzere ocrelizumab ile eşzamanlı olarak başka immunosupresiflerin kullanılması önerilmemektedir. Klinikuygulamada relapsların semptomatik tedavisi için eşzamanlı steroid kullanımının enfeksiyonriskinde artışla ilişkilendirilip ilişkilendirilmediğine dair bilgi sınırlıdır. Ocrelizumaba yönelikpivotal MS çalışmalarında relaps tedavisi için kortikosteroid uygulaması ciddi enfeksiyonriskinde artışla ilişkilendirilmemiştir. Bir immunosupresif tedavinin ardından ocrelizumaba başlarken veya ocrelizumabdan sonra bir immunosupresif tedaviye başlarken, farmakodinamik etkilerin çakışma olasılığı göz önündebulundurulmalıdır (bkz. Bölüm 5.1). ocrelizumab reçete edilirken hastalık modifiye edici diğerMS tedavilerinin farmakodinamiği göz önünde bulundurularak dikkatli olunmalıdır. AşılarTedavi sonrasında canlı veya canlı atenüe aşılar ile bağışıklamanın güvenliliği henüz çalışılmamıştır ve tedavi sırasında ve B hücresi replesyonuna kadar (klinik çalışmalardamedyan süre 72 hafta olmuştur) canlı atenüe veya canlı aşılar ile aşılama önerilmemektedir(bkz. Bölüm 5.1). RMS hastaları, açık etiketli randomize bir çalışmada, tetanoz toksoid, pekiştirme dozunun uygulandığı veya uygulanmadığı 23-valanslı pnömokoksal polisakkarit, keyhole limpethemosiyanin neoantijeni ve mevsimsel influenza aşılarına azalmış da olsa hümoral yanıtlarverebilmiştir. (bkz. Bölüm 4.5 ve 5.1) Ocrelizumab ile tedavi edilen hastaların, mevsimsel inaktif influenza aşıları ile aşılanması tavsiye edilmektedir. Ocrelizımab tedavisine başlanmadan önce hastaların immunizasyon durumları gözden geçirilmelidir. Aşılama gerektiren hastalarda, aşıların uygulanması ocrelizumab tedavisinebaşlamadan en az 6 hafta önce tamamlanmalıdır. İn utero ocrelizumab maruziyeti ve yenidoğan ve infantların canlı veya canlı atenüe aşılarla aşılanmasıGebelik esnasında ocrelizumab maruziyeti görülen annelerin bebeklerindeki B hücresi deplesyon potansiyeli nedeniyle, canlı veya canlı atenüe aşılarla aşı uygulamalarının, bebeğinB hücresi sayımı iyileşene kadar ertelenmesi önerilmektedir. Dolayısıyla aşı uygulamasıgerçekleştirilmeden önce yenidoğanlarda ve infantlarda CD19-pozitif B hücre sayımı tavsiyeedilmektedir. Canlı veya canlı atenüe aşılar haricindeki diğer tüm aşı uygulamaları için yerel aşılama takviminin takip edilmesi ve aşının etkililiği azalabileceğinden, bireylerde koruyucu bir immünyanıt oluşup oluşmadığını kontrol etmek amacıyla aşı ile sağlanan yanıt titrelerinin ölçülmesiönerilmektedir. Aşılamanın güvenliliği ve zamanlaması bebeğin doktoru ile tartışılmalıdır (bkz. Bölüm 4.6). SodyumBu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında sodyum içermez. 4.5 Diğer tıbbi ürünlerle etkileşim ve diğer etkileşim şekilleriSitokrom P450 enzimleri, diğer metabolize edici enzimler veya taşıyıcılar üzerinden hiçbir etkileşim beklenmediğinden, etkileşim çalışmaları yürütülmemiştir. AşılarOcrelizumab tedavisi sonrasında canlı veya canlı atenüe aşılar ile bağışıklamanın güvenliliği henüz çalışılmamıştır. Ocrelizumab alan hastalarda tetanoz toksoid, 23-valanslı pnömokoksal polisakkarit, keyhole limpet hemosiyanin neoantijen ve mevsimsel influenza aşılarının etkilerine ait veri mevcuttur.(bkz. Bölüm 4.4 ve 5.1) 2 yılı aşkın tedavinin ardından, S. Pnömoni,kabakulak, rubella ve varicella'ya karşı pozitif antikor titresi olan hastaların oranları, başlangıçtaki ile aynıdır.İmmunosupresif tedaviler:Relapsların semptomatik tedavisi için kortikosteroidler dışında ocrelizumab ile birlikte diğer immunosupresif tedavilerin kullanılması önerilmez (bkz. Bölüm 4.4). Özel popülasyonlara ilişkin ek bilgiler:Ocrelizumab ile herhangi bir farmakokinetik ilaç etkileşimi çalışması yapılmamıştır. Pediyatrik popülasyon:Ocrelizumab ile pediyatrik popülasyonda herhangi bir farmakokinetik ilaç etkileşimi çalışması yapılmamıştır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar, ocrelizumab alırken ve son ocrelizumab infüzyonundan sonra 12 ay boyunca doğum kontrol yöntemi kullanmalıdırlar (bkz. Bölüm 5.1ve 5.2). Gebelik dönemiOcrelizumabın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3).İnsanlara yönelik potansiyel risk bilinmemektedir. Ocrelizumabm gebe kadınlarda kullanımı ile ilişkili gelişimsel risk konusundaki veriler yetersizdir. Ocrelizumab bir immünoglobulin G (IgG)'dir. IgG'nin plasenta bariyerini geçtiğibilinmektedir. Gebelikte ocrelizumaba maruz kalan annelerden doğan yenidoğan vebebeklerde canlı ya da canlı atenüe aşılarla aşılamanın ertelenmesi düşünülmelidir.Ocrelizumaba maruz kalan yenidoğanlarda ve bebeklerde B-hücre sayımı verisi toplanmamıştırve B-hücre deplesyonun potansiyel devam süresi bilinmemektedir (bkz. Bölüm 4.4). Gebelik sırasında diğer anti-CD20 antikorlara maruz kalmış olan annelerin bebeklerinde geçici periferik B-hücre deplesyonu ve lenfositopeni rapor edilmiştir. Hayvan çalışmaları (embriyo-fetal toksisite) teratojenik etkilere işaret etmemektedir. Ancak, uteroda B-hücre deplesyonu tespit edimiştir. Doğum öncesi ve sonrası geliştirmeçalışmalarında üreme toksisitesi gözlenmiştir (bkz. Bölüm 5.3). Anne için olan potansiyel fayda fetüse potansiyel riskten ağır basmadığı sürece gebelikte ocrelizumab uygulamasından kaçınılmalıdır. Laktasyon dönemiOcrelizumabın ve metabolitlerinin insan sütüne karışıp karışmadığı bilinmemektedir. Hayvan çalışmalarında, ocrelizumabın anne sütüyle atılımı gösterilmiştir (bkz. Bölüm 5.3). Yenidoğanve bebeklerdeki risk göz ardı edilemez. Kadın hastalara tedavi sırasında emzirmeyi kesmeleriönerilmelidir. Üreme yeteneği/FertiliteSinomolgus maymunlarında erkek ve dişi doğurganlığı hakkında yapılan çalışmalara dayanan klinik öncesi veriler, insanlara yönelik özel bir tehlikeye işaret etmemektedir. 4.7 Araç ve makine kullanımı üzerindeki etkilerOCREVUS'un araç ve makine kullanma yeteneği üzerinde etkisi yoktur yada ihmal edilebilir düzeydedir. 4.8 İstenmeyen etkilerGüvenlilik profilinin özetiEn önemli ve sık bildirilen advers reaksiyonlar (AİR'ler); İİR'ler (RMS ve PPMS'te sırasıyla %34,3 ve %40,1) , ve enfeksiyonlardır (RMS ve PPMS'te sırasıyla %58,5 ve %72,2)(bkz. Bölüm 4.4). . Advers olayların tablo halinde listesiKlinik çalışmalarda bildirilen ve spontan raporlamadan elde edilen advers reaksiyonlar aşağıda Tablo 2'de listelenmiştir. Advers reaksiyonlar MedDRA sistem organ sınıfı ve sıklıkkategorilerine göre listelenmiştir. Sıklık kategorileri bu şekilde tanımlanmaktadır: çok yaygın(>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100), seyrek (>1/10.000ila <1/1.000), çok seyrek (<1/10.000), ve bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Her bir sıklık grubunun içinde istenmeyen etkiler azalan ciddiyet sırası ilesunulmaktadır.
Seçilen advers reaksiyonların açıklamasıİnfüzyonla ilişkili reaksiyonlarRMS ve PPMS çalışmalarında İİR'lerle ilgili semptomlar belirtilenlerle sınırlı olmamakla birlikte şunları içerir: kaşıntı, döküntü, ürtiker, eritem, yüzde kızarıklık, hipotansiyon, ateş,yorgunluk, baş ağrısı, baş dönmesi, boğazda tahriş, orofaringeal ağrı, dispne, faringeal veyalaringeal ödem, bulantı, taşikardi. Kontrollü çalışmalarda ölümcül İİR'ler olmamıştır. Ek olarak,İİR'lerle ilgili semptomlara pazarlama sonrası verilerde anafilaksi dahil edilmiştir. Aktif kontrollü (RMS) klinik çalışmalarda, interferon beta-1a tedavi grubunda (plasebo infüzyonu) %9,9'luk insidansa kıyasla, ocrelizumab ile tedavi edilen grupta %34,3'lük genelinsidansla İİR'ler en yaygın advers reaksiyondur. İİR'lerin insidansı, 1. doz, 1. infüzyon(%27,5) sırasında en yüksek düzeyde olmuş ve zamanla 4. dozda <%10'a düşmüştür. Her ikitedavi grubunda İİR'lerin çoğunluğu hafif ila orta şiddette olmuştur. ocrelizumab ile tedaviedilen hastalar sırasıyla %21,7 ve %10,1'i hafif veya orta, % 2,4'ü şiddetli İİR ve % 0,1 hayatıtehdit eden İİR deneyimlemiştir. Plasebo kontrollü (PPMS) klinik çalışmada, plasebo grubundaki %25,5'lik insidansa kıyasla, ocrelizumab ile tedavi edilen grupta %40,1'lik genel insidansla İİR'ler en yaygın adversreaksiyondur. İİR'lerin insidansı, 1. doz, 1. infüzyon (%27,4) sırasında en yüksek düzeydeolmuş ve zamanla 4. dozda <%10'a düşmüştür. Her grupta her dozun ilk infüzyonunda o dozunikinci infüzyonuna kıyasla daha büyük bir hasta oranı İİR'ler yaşamıştır. İİR'lerin çoğunluğuhafif ila orta şiddetli olmuştur. Ocrelizumab ile tedavi edilen hastalar sırasıyla %26,7ve %11,9'u hafif veya orta şiddette, % 1,4'ü şiddetli İİR deneyimlemiştir. Hayatı tehdit edenİİR görülmemiştir (bkz. Bölüm 4.4). Sonraki dozlar için alternatif hızlandırılmış infüzyonAtaklarla seyreden Multipl Sklerozlu (RMS) hastalarda daha kısa (2 saatlik) ocrelizumab infüzyonlarmm güvenlilik profilini karakterize etmek için tasarlanmış bir çalışmada (MA30143Hızlandırılmış İnfüzyon Çalışması), İİR'lerin görülme sıklığı, yoğunluğu ve tipleri 3,5 saatsüren infüzyon ile görülen İİR profili ile uyumlu bulunmuştur (bkz Bölüm 5.1). Her ikiinfüzyon grubunda da ihtiyaç duyulan genel müdahale sayısı düşüktür, ancak 3,5 saatlikinfüzyon grubuna kıyasla, kısa (2 saatlik) infüzyon grubunda İİR'leri yönetebilmek için dahafazla müdahale (yavaşlama veya geçici kesintiler) gerekmiştir (sırasıyla% 8,7'ye karşı% 4,8). EnfeksiyonAktif kontrollü RMS çalışmalarında, ocrelizumab alan hastaların %58,5'inde ve interferon beta- 1a alan hastaların %52,5'inde enfeksiyon gözlenmiştir.ocrelizumab alan hastaların %1,3'üne karşılık interferon beta-1a alan hastaların %2,9'unda ciddi enfeksiyon gözlenmiştir. Plasebo kontrollü PPMS çalışmasında ocrelizumab alan hastaların %72,2'sindeve plasebo alan hastaların %69,9'unda enfeksiyon gözlenmiştir. Ocrelizumab alanhastaların %6,2'sine karşılık plasebo alan hastaların %6,7'sinde ciddi enfeksiyon meydanagelmiştir. Hem RMS hem de PPMS çalışmalarında tüm hastalar açık etiketli fazdaocrelizumaba geçmiştir. RMS'de ciddi enfeksiyon riskinde artış 2. ve 3. yıllar arasındagözlenmiş olup takip eden yıllarda gözlenmemiştir.PPMS'de ise herhangi bir artış gözlenmemiştir. Solunum yolu enfeksiyonlarıSolunum yolu enfeksiyonlarının oranı, interferon beta-1a ve plaseboya kıyasla ocrelizumab ile tedavi edilen hastalarda daha yüksek olmuştur. RMS klinik çalışmalarında ocrelizumab ile tedavi edilen hastaların %39,9'u ve interferon beta-1a ile tedavi edilen hastaların % 33,2 'ü üst solunum yolları enfeksiyonu; ocrelizumab iletedavi edilen hastaların %7,5'i ve interferon beta-1a ile tedavi edilen hastaların %5,2'si altsolunum yolları enfeksiyonu deneyimlemiştir. PPMS klinik çalışmasında, ocrelizumab iletedavi edilen hastaların %48,8'i ve plasebo alan hastaların %42,7'si üst solunum yollarıenfeksiyonu; ocrelizumab ile tedavi edilen hastaların %9,9'u ve plasebo alan hastaların %9,2'sialt solunum yolları enfeksiyonu deneyimlemiştir. Ocrelizumab ile tedavi edilen hastalarınsolunum yolları enfeksiyonu ağırlıklı olarak hafif ila orta olarak raporlanmıştır (%80-90). HerpesAktif kontrollü (RMS) klinik çalışmalarda, herpes enfeksiyonları, ocrelizumab ile tedavi edilen hastalarda interferon beta-1a ile tedavi edilen hastalara kıyasla daha sık bildirilmiştir: herpeszoster (%2,1 ile %1), herpes simpleks (% 0,7 ile % 0,1) ve oral herpes (%3 ile %2,2), genitalherpes (%0,1 ile %0) ve herpes virüs enfeksiyonu (%0,1 ile %0). Tüm enfeksiyonlar, bir taneDerece 3 hariç, hafif ila orta şiddetli olmuş ve hastalar standart tedavi uygulanmasıylaiyileşmişlerdir. Plasebo kontrollü (PPMS) klinik çalışmada, oral herpesi olan hastalar ocrelizumab tedavi kolunda, plaseboya göre daha sık rapor edilmiştir (%2,7'ye karşı %0,8). Laboratuvar anormallikleriİmmunoglobulinlerOcrelizumab tedavisi, ağırlıklı olarak IgM'deki azalmaya bağlı olarak çalışmaların kontrollü döneminde toplam immunoglobulinlerde azalmayla sonuçlanmıştır. Klinik çalışma verileri,IgG'de sürekli azalma (ve IgM ve IgA için daha az) ile ciddi enfeksiyonlar arasında bir ilişki olduğunu göstermiştir. LenfositlerRMS'de, interferon beta-1a ile tedavi edilen hastaların %32,6'sına karşılık ocrelizumab ile tedavi edilen hastaların %20,7'sinde lenfositin NAS'ın (normalin alt sınırı) altına düştüğügözlenmiştir. PPMS'de plaseboyla tedavi edilen hastaların %11,7'sine karşılık ocrelizumab iletedavi edilen hastaların %26,3'ünde lenfositlerin NAS'ın altına düştüğü gözlenmiştir. Ocrelizumab ile tedavi edilen hastalarda bildirilen bu düşüşlerin çoğunun şiddet olarak Derece 1 (<NSA- 800 hücre/mm3) ve Derece 2 (500-800 hücre/mm3) olduğu görülmüştür.Ocrelizumab grubundaki hastaların yaklaşık %1'inde Derece 3 lenfopeni (200-500 hücre/mm3)olduğu görülmüştür. Hastaların hiçbirinde Derece 4 lenfopeni (<200 hücre/mm3)bildirilmemiştir. Ocrelizumabla tedavi edilen hastalarda doğrulanmış total lenfosit sayımı düşüş epizotları esnasında ciddi enfeksiyonların oranında artış gözlenmiştir. Ciddi enfeksiyon sayısının, kesinsonuçlara varmak için çok düşük olduğu görülmüştür. NötrofilAktif kontrollü (RMS) tedavi döneminde, interferon beta-1a ile tedavi edilen hastaların %40,9'una kıyasla, ocrelizumab ile tedavi edilen hastaların %14,7'sinde nötrofillerinNSA'ın altına düştüğü gözlenmiştir. Plasebo kontrollü (PPMS) klinik çalışmada, nötrofilseviyelerinde azalma görülen ocrelizumab hastalarının oranı, plasebo hastalarına (%12,9)kıyasla daha yüksek (%10,0) olmuştur. Plasebo grubundaki hastaların %1,3'üne karşılıkocrelizumab grubunda daha yüksek oranda hastada (%4,3) yada >Derece 2 nötropeni görülmüş;plasebo grubundaki hastaların %0'ına karşılık ocrelizumab grubundaki hastalarınyaklaşık %1'inde Derece 4 nötropeni görülmüştür. Nötrofil düşüşlerinin çoğunun geçici nitelikt e (sadece ocrelizumab ile tedavi edilen belirli bir hastada bir defa gözlenmiştir) ve şiddet olarak Derece 1 ve 2 (sırasıyla <NAS ve 1500hücre/mm3 arasında ve 1000-1500 hücre/mm3) olduğu belirlenmiştir. Genel olarak,ocrelizumab grubundaki hastaların yaklaşık %1'inde Derece 3 veya 4 nötropeni vardı. Derece 3(500 - 1000 hücre/mm3) nötropenili bir hasta ve Derece 4(<500 hücre/mm3) nötropenili birhasta granülosit-koloni uyarıcı faktörle spesifik tedaviye ihtiyaç duymuş ve epizot sonrasındaocrelizumab tedavisine devam etmiştir. Nötropeni, ocrelizumab uygulamasından birkaç aysonra ortaya çıkabilir (bkz. Bölüm 4.4). Diğer2000 mg ocrelizumab alan başka bir hasta ise en son infüzyondan 12 hafta sonra uygulanan manyetik rezonans görüntülemesinin (MRG) ardından etiyolojisi bilinmeyen sistemikenflamatuvar yanıt sendromu (SEYS) nedeniyle ölmüştür; MRG için uygulanan gadolinyumlukontrast maddeye karşı gelişen anafilaktoid reaksiyon SEYS'nin ortaya çıkmasına katkıdabulunmuş olabilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi'ne (TÜFAM) bildirmeleri gerekmektedir ( Onaylı intravenöz ocrelizumab dozundan daha yüksek dozlarda klinik çalışma deneyimi sınırlıdır. MS hastalarında bugüne kadar test edilen en yüksek doz, 2 hafta arayla iki 1000 mgintravenöz infüzyon olarak uygulanan 2000 mg'dır (RRMS'de Faz II doz bulma çalışması).Advers reaksiyonları, merkezi klinik çalışmalarda güvenlilik profiliyle tutarlı olmuştur. Doz aşımı olması durumunda spesifik bir antidot yoktur; infüzyon hemen durdurulmalı ve hasta İİR'ler açısından gözlenmelidir (bkz. Bölüm 4.4). Farmakoterapötik grup: Antineoplastik ve İmmünomodülatör Ajanlar, İmmünosupresanlar, Selektif İmmünosupresanlarATC kodu: L04AA36 Ocrelizumab, CD20 eksprese eden B hücrelerini seçici olarak hedefleyen bir rekombinant hümanize monoklonal antikordur. CD20, ön-B hücreleri, olgun ve bellek B hücrelerinde bulunan ama lenfoid kök hücreleri ve plazma hücrelerinde eksprese edilmeyen bir hücre yüzeyi antijenidir. Ocrelizumabın MS'te terapötik klinik etkilerini gösterdiği kesin mekanizmalar tam olarak açıklanmamıştır ama CD20 eksprese eden B hücrelerinin sayısı ve fonksiyonunda azalmaylaimmunomodülasyona neden olduğu varsayılır. Hücre yüzeyindeki bağlanmanın ardından,ocrelizumab, antikor bağımlı sellüler fagositoz (ADCP), antikor bağımlı sellüler sitotoksisite(ADCC), kompleman bağımlı sitotoksisite (CDC) ve apoptoz aracılığıyla CD20 eksprese edenB hücrelerini seçici olarak tüketir. B hücresi rekonstitüsyon kapasitesi ve önceden var olanhumoral bağışıklık korunur. Ayrıca doğuştan bağışıklık ve toplam T hücresi sayılarıetkilenmez. Ocrelizumab ile tedavi, beklenen bir farmakolojik etki olarak, tedaviden 14 gün sonra (değerlendirmenin ilk zaman noktası) kanda CD19+ B hücrelerinin hızlı tükenmesine yol açar.Bu, tedavi dönemi boyunca sürdürülmüştür. Ocrelizumabın varlığı miktar tayiniyle CD20'nintanınmasını engellediği için, B hücre sayımları için CD19 kullanılır. Faz III çalışmalarda, her ocrelizumab dozunun arasında, hastaların %5'ine kadarı en az bir zaman noktasında B hücresi deplesyonu (> normalin alt sınırı (NAS) veya başlangıç)sergilemiştir. B hücresi tükenmesinin derecesi ve süresi, PPMS ve RMS çalışmalarında tutarlıolmuştur. Son Ocrelizumab infüzyonundan sonraki en uzun takip süresi (Faz II WA21493, N=51), B hücresi çoğalmasına kadar geçen medyan sürenin (hangisinin daha önce olduğuna bağlı olarakbaşlangıca veya LLN'ye geri dönmüştür) 72 hafta (27 - 175 haftalık aralık) olduğunugöstermektedir. Tüm hastaların yüzde doksanında, son infüzyondan yaklaşık iki buçuk yılsonra B hücreleri LLN veya başlangıca göre çoğalmıştır. Ocrelizumabın etkililiği ve güvenliliği, ataklarla seyreden MS formları olan hastalarda tasarımları aynı olan iki randomize, çift kör, çift plasebolu, aktif komparatör kontrollü klinikçalışmada (WA21092 ve WA21093) değerlendirilmiştir (2010 McDonald kriterlerine uygunolarak). Çalışma tasarımı ve çalışma popülasyonunun başlangıç özellikleri Tablo 3'teözetlenmektedir. Demografi ve başlangıç özellikleri açısından her iki tedavi grubu iyi dengelenmiştir. Ocrelizumab alan hastalara (Grup A) 6 ayda bir 600 mg (1. Doz 2 hafta arayla 2 x 300 mgintravenöz infüzyonlar halinde) verilmiş ve sonraki dozlar tek bir 600 mg intravenöz infüzyonolarak uygulanmıştır. Grup B'deki hastalara haftada 3 kez subkütan (S.C.) enjeksiyonlaİnterferon beta-1a 44 mcg verilmiştir.
* Genişletilmiş Yeti Yitimi Durumu Ölçeği **Randomizasyondan önceki 2 sene içinde bir hastalık modifiye edici tedavi (DMT) ile tedavi edilmemiş hastalar Temel klinik ve MRG etkililiği sonuçları Tablo 4 ve Şekil 1'de sunulmaktadır. Bu çalışmaların sonuçları, interferon beta-1a 44mcg SC'ye kıyasla ocrelizumabın relapsları, MRG ile ölçülen klinik ve subklinik hastalık aktivitesi ve hastalık progresyonunu önemliölçüde baskıladığını göstermektedir. Tablo 4 WA21092 ve WA21093 Çalışmalarından Temel Klinik ve MRG Sonlanım
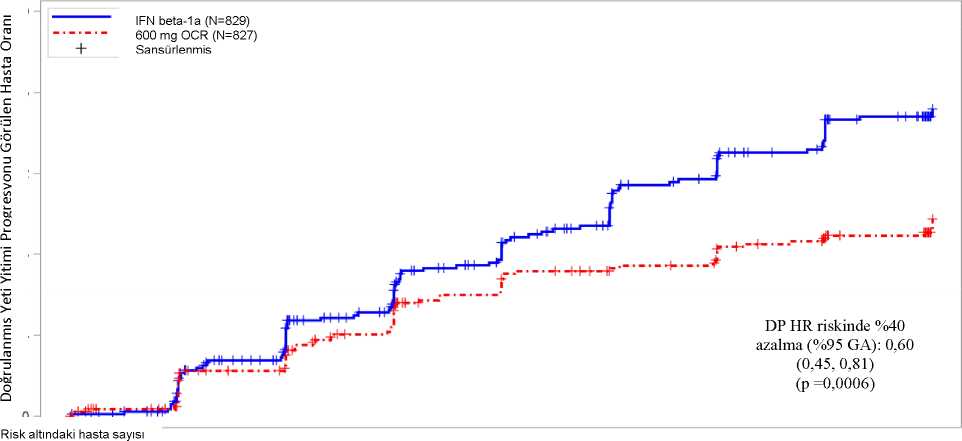
tahminleri 4EDSS skorunda, başlangıç skoru >2 ve <5,5 olan hastalarda en az İveya başlangıç skoru 5,5'in üzerinde olan hastalarda en az 0,5 azalma olarak tanımlanmıştır. Başlangıç skoru 2'nin altındaolan hastalar analize dahil edilmemiştir. 5NEDA, tüm 96 haftalık tedavi boyunca protokolde tanımlanmış relapsların, (12 hafta CDP) ve herhangi bir MRG aktivitesinin (ya Gd tutulumlu T1 lezyonlar ya da yeni veya büyüyen T2lezyonlar) görülmemesi olarak tanımlanmıştır. Keşfedici bulgular tüm ITT popülasyonadayanmaktadır. 6Doğrulayıcı olmayan p-değeri; sonlanım noktasına erişilmeden önce hiyerarşik test prosedürü sonlandırılmıştır. 7Log-rank test 8 Doğrulanmış nüksler (EDSS'de klinik olarak anlamlı bir değişikliğin eşlik ettiği). Şekil 1: En Az 12 Hafta Boyunca Sürdürülen Doğrulanmış Yeti Yitimi Progresyonunun Başlangıcına Kadar Geçen Süre ve Çift-Kör Tedavi Dönemi Boyunca Meydana Gelen İlkNörolojik Kötüleşme Olayına İlişkin Kaplan-Meier Grafiği* (Birleştirilmiş ITTpopülasyonu)*
OPERA I VE II'NIN ÖNCEDEN BELIRLENMIŞ BIRLEŞTIRILMIŞ ANALIZIEn az 12 hafta sürdürülen CDP'ye kadar geçen sürenin önceden belirlenen havuzlanmış analizlerinin sonuçları (interferon beta-1a'ya kıyasla ocrelizumab için %40 risk azaltımı,(p=0,0006), en az 24 hafta sürdürülen sonuçlarla (interferon beta-1a'ya kıyasla ocrelizumabiçin %40 risk azaltımı, p=0,0025) son derece tutarlı olmuştur. Çalışmalarda aktif hastalığı olan hastalar dahil edilmiştir. Bu hastalarda, klinik ve radyolojik açıdan aktif, tedavi naif ve önceki tedavilerine yetersiz cevap geliştirmiş hastalar dahildir. Çokaktif ve aktif hastalık durumu da dahil olmak üzere farklı başlangıç seviyelerinde hastalıkaktiviteleri olan hasta popülasyonu analizleri, ocrelizumab etkililiğinin ARR'de ve CDP ile 12haftada genel popülasyon ile aynı olduğunu ortaya koymuştur. Primer progresif multipl skleroz (PPMS)Ocrelizumabın etkililik ve güvenliliği ayrıca ana dahil etme kriterlerine (18-55 yaş (bu yaşlar dahil), taramada 3- 6,5 puan arası EDSS, MS semptomlarının ortaya çıkışından itibaren geçenhastalık süresi: taramadaki EDSS puanı <5olan hastalarda <10 yıl ve EDSS puanı <5olanhastalarda <15 yıl) göre hastalığın erken evresinde olan primer progresif MS'li hastalarayönelik randomize, çift-kör, plasebo-kontrollü bir çalışmada (Çalışma WA25046)değerlendirilmiştir. Hastalık aktivitesi bakımından, progresif MS'te dahi enflamatuvaretkinliğe özgü özellikler görüntülemeyle ilişkili olabilir (T1 Gd-kontrast tutan lezyonlarve/veya aktif (yeni veya büyüyen) T2 lezyonları). Bütün hastalarda enflamatuvar etkinliğidoğrulamak için MRG bulguları kullanılmalıdır. 55 yaşın üzerindeki hastalar incelenmemiştir.Çalışma tasarımı ve çalışma popülasyonunun başlangıç özellikleri Tablo 5'te sunulmuştur.Demografik özellikler ve başlangıç özelliklerinin iki tedavi grubu arasında dengeli olduğugörülmüştür. Kraniyal MRG T1 Gd-kontrast tutan lezyonlar veya T2 lezyonları olarakenflamatuvar etkinliğe özgü görüntüleme özellikleri göstermiştir. Faz III PPMS çalışması sırasında, hastalar her 6 ayda bir 600 mg ocrelizumab dozunu, iki hafta ara ile uygulanan 2 adet 300 mg'lık infüzyonlar şeklinde almıştır. RMS'de 600 mg infüzyonlarve PPMS'de 300 mg x 2 infüzyonlar uyumluPK/PD profilleri göstermiştir. İnfüzyon başına İİRprofilleri tek seferde 600 mg veya iki hafta arayla 300 mg doz uygulanmasından bağımsızolarak benzerdir (bkz. Bölüm 4.8 ve 5.2). Ancak 2x300 mg doz rejimi ile toplamdaki infüzyonsayısı daha yüksek olduğunda, toplam İİR sayısı daha yüksektir. Bu nedenle, Doz 1'den sonratoplam infüzyon sayısını düşürmek için (metilprednisolon ve antihistaminik ile eş zamanlıuygulanması sırasında) ocrelizumabın 600 mg'lık tek bir infüzyon olarak uygulanması tavsiyeedilir (bkz. Bölüm 4.2).
Bu çalışmanın sonuçları, ocrelizumabın plaseboya kıyasla hastalık progresyonunu önemli ölçüde geciktirdiğini ve yürüme hızındaki kötüleşmeyi azalttığını göstermektedir.
Şekil2:Çift Kör Tedavi Döneminde Meydana Gelen İlk Nörolojik Kötüleşme Olayıyla En Az 12 Hafta Sürdürülen Doğrulanmış Sakatlık Progresyonunun Başlangıcına KadarGeçen Sürenin Kaplan-Meier Grafiği (ITT Popülasyonu)*
6050---- CDP riskinde %24 azalmaHR (%95 GA): 0,76 (0,59, 0,98); p=0,03214030
20 r
10 0Risk altındaki hasta sayısıPlasebo244232212OCR&ÛÛtiigl 4S7462450145319120 261135304169414153336162355172376199 431Başlangıç 12 24364860728496103120132144156168180192204216Doğrulanmış Yeti Yitimi Progresyonunun Başlangıcına Kadar Geçen Süre (Hafta)* Bu analizdeki tüm hastalar en az 12U hatta boyunca takıp edilmiştir. Birincil analiz değerlendirilen tüm olaylara dayanmaktadır. Birincil sonlanım noktasına yönelik önceden tanımlanmış, yeterli güce sahip olmayan alt grup analizi, genç veya başlangıçta T1 Gd-kontrast tutan lezyonları olan hastaların yaşlı veya T1Gd-kontrast tutan lezyonları olmayan hastalara kıyasla tedaviden daha fazla fayda sağladığınıgöstermektedir (< 45 yaş: HR 0,64 [0,45, 0,92], >45 yaş: HR 0,88 [0,62, 1,26]; başlangıçta T1Gd-kontrast tutan lezyonları olan hastalar: HR 0,65 [0,4-1,06], T1 Gd-kontrast tutan lezyonlarıolmayan hastalar: HR 0,84 [0,62-1,13]). Ayrıca, post-hoc analizler başlangıçta T1 Gd-kontrast tutan lezyonları olan genç hastalarda tedavinin daha iyi bir etki gösterdiğini ortaya koymuştur (< 45 yaş: HR 0,52 [0,27-1]; < 46 yaş[WA25046 çalışmasındaki medyan yaş]; HR 0,48 [0,25-0,92]; <51 yaş: HR 0,53 [0,31-0,89]). Açık Etiket Uzantısına (AEU) devam etmeden önce veya çalışma tedavisinden ayrılana kadar ek olarak yaklaşık 9 aylık kontrollü takip ve çift kör tedavi içeren Genişletilmiş KontrollüDönemde (GKD) post-hoc analizler gerçekleştirilmiştir. 24 haftalık Doğrulanmış EngellilikProgresyonunun (CDP) EDSS>7 olan hastaların oranı (EDSS>7'nin 24W-CDP'si, tekerleklisandalyeye kadar geçen süre), tedavinin 144. haftasında plasebo grubunda %9,1 iken,ocrelizumab grubunda %4,8 olmuş ve bu oran GKD sırasında tekerlekli sandalyeye geçişsüresinin %47 risk azalmasına (HR 0,53, [0,31, 0,92]) neden olmuştur. Bu sonuçlar doğalarıgereği keşif amaçlı olduğundan ve körleme kaldırıldıktan sonra veriler içerdiğinden, dikkatleyorumlanmalıdır. Hızlandırılmış infüzyon çalışması Hızlandırılmış (2 saatlik) ocrelizumab infüzyonunun güvenliliği, diğer hastalık modifiye edici tedavilere naif olan Ataklarla Seyreden Multipl Sklerozlu (RMS) hastalarda MA30143(Ensemble) çalışmasının alt kolu olan prospektif, çok merkezli, randomize, çift kör, kontrollü,paralel kollu bir çalışma ile değerlendirilmiştir. İlk doz 14 gün arayla iki 300 mg infüzyon(toplam 600 mg) olarak uygulanmıştır. Hastalar ikinci dozlarından sonra (Doz 2 ila 6) 1: 1oranında ya ocrelizumabın 24 haftada bir uygulanan yaklaşık 3.5 saat boyunca infüze edilmişkonvansiyonel infüzyon grubuna ya da ocrelizumabın 24 haftada bir uygulanan yaklaşık 2 saatsüren daha kısa infüzyon süresi grubuna randomize edilmiştir. Randomizasyon, bölgeye vehastaların ilk randomize edildiği doza göre tabakalandırılmıştır. Birincil sonlanım noktası, ilk randomize infüzyonu sırasında yada takip eden 24 saat içinde İİR meydana gelen hastaların oranıdır. Primer analiz 580 hasta randomize edildiğinde yapılmıştır.İlk randomize infüzyon sırasında yada takiben 24 saat içinde İİR meydana gelen hastalarınoranı, hızlandırılmış infüzyonda % 24,6 iken, konvansiyonel infüzyon grubunda % 23,1olmuştur. Tabakalı grup farkı benzerdir. Genel olarak, tüm randomize dozlarda, İİR'lerinçoğunluğu hafif veya orta düzeydeydi ve her iki grupta birer İİR olmak üzere sadece iki İİRşiddetli olmuştur. Hayatı tehdit eden, ölümcül veya ciddi İİR'lergörülmemiştir. İmmunojenisiteMS çalışmalarındaki (WA21092, WA21093 ve WA25046) hastalar birçok zaman noktasında (başlangıç ve çalışma süresi boyunca tedavi sonrası 6 ayda bir) anti-ilaç antikorları (AİA'lar)açısından test edilmiştir. Ocrelizumab ile tedavi edilen 1311 hastadan 12'si (~%1) tedaviyleortaya çıkan AİA'lar açısından pozitif sonuç vermiş, bunların 2'si nötralize edici antikorlaraçısından pozitif sonuç vermiştir. Ocrelizumab ile ilişkili düşük AİA insidansı düşünülürse,tedaviyle ortaya çıkan AİA'ların güvenlilik ve etkililik üzerindeki etkisi değerlendirilemez. İmmunizasyonlarRMS hastalarında gerçekleştirilen açık etiketli, randomize bir çalışmada (N=102), aşı uygulamasından sonra 8. haftada tetanoz aşısına pozitif yanıt veren hastaların oranı, kontrolgrubunda %54,5'e kıyasla ocrelizumab grubunda %23,9 olarak bulunmuştur (interferon-betaharicinde hastalığı modifiye edici herhangi bir tedavi mevcut değildir). 8. haftada anti-tetanoztoksoidine spesifik antikor titresi geometrik ortalaması sırasıyla 3,74 ve 9,81 IU/mL olaraktespit edilmiştir. Aşı uygulamasından sonra 4. haftada 23-PPV'de bulunan >5 serotipe verilenpozitif yanıt oranı, kontrol grubunda %100 ve ocrelizumab grubunda %71,6'dır. Ocrelizumabile tedavi edilen hastalarda 23-PPV'den 4 hafta sonra uygulanan rapel aşısı (pekiştirmedozu/13-PCV), 23-PPV ile ortak 12 serotipe verilen yanıtı belirgin bir şekilde arttırmamıştır.Beş influenza suşuna karşı seroprotektif titreleri bulunan hastaların yüzdesi, ocrelizumab iletedavi edilen hastalarda ve kontrol grubunda sırasıyla, aşılama öncesinde %20,0-60,0ve %16,7-43,8 ve aşılamadan 4 hafta sonra %55,6-80,0 ve %75,0-97,0 aralıklarındabulunmuştur. (bkz. Bölüm 4.4 ve 4.5) 5.2 Farmakokinetik özelliklerGenel özelliklerEmilim:Ocrelizumab intravenöz infüzyon olarak uygulanır. Diğer uygulama yollarıyla çalışma gerçekleştirilmemiştir. Dağılım:Merkezi dağıtım hacminin popülasyon farmakokinetiği tahmini 2,78 L olmuştur. Periferal hacim ve kompartmanlar arası klerens 2,68 L ve 0,294 L/gün olarak tahmin edilmiştir. Biyotransformasyon:Antikorlar ağırlıklı olarak katabolizmayla (ör: peptid ve amino asitlere yıkılma) uzaklaştırıldığından, ocrelizumabın metabolizması üzerinde doğrudan çalışılmamıştır. Eliminasyon:Sabit klerens 0,17 L/gün tahmin edilirken, başlangıçtaki zamana bağımlı klerens 0,0489 L/gün olarak tahmin edilmiş ve 33 haftalık yarı ömürle birlikte düşmüştür. Ocrelizumabın terminaleliminasyon yarı ömrü 26 gün olmuştur. Doğrusallık/doğrusal olmayan durum:MS çalışmalarında ocrelizumabın farmakokinetiği, zamana bağlı klerens ve bir IgG1 monoklonal antikor için tipik PK parametreleri sergileyen, iki bölümlü bir modelleaçıklanmıştır. Genel maruziyet (24 haftalık dozlama aralıklarında EAA), aynı dozun uygulandığı düşünülürse bekleneceği üzere, PPMS çalışmalarında 2 x 300 mg ve RMS çalışmalarında 1 x 600 mg'daaynı olmuştur. 600 mg ocrelizumabın 4. dozundan sonra eğri altı alan (EAAt) 3510mcg/mL*gün ve ortalama maksimum konsantrasyon (Cmaks) RMS'de (600 mg infüzyon) 212mcg/mL, PPMS'de (300 mg infüzyonlar) 141 mcg/mL olmuştur. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:18 yaşının altındaki çocuklarda ocrelizumabın farmakokinetiğini araştırmak amacıyla çalışma yürütülmemiştir. Geriyatrik popülasyon:55 yaş ve üzerindeki hastalarda ocrelizumabın farmakokinetiğini araştırmak amacıyla çalışma yürütülmemiştir. Böbrek yetmezliği :Resmi farmakokinetik çalışma yürütülmemiştir. Hafif böbrek yetmezliği olan hastalar klinik çalışmalara dahil edilmiş ve bu hastalarda ocrelizumabın farmakokinetiğinde değişiklikgözlenmemiştir. Ciddi veya orta seviyede böbrek hasarı olan hastalara ait farmakokinetikveriler mevcut değildir. Karaciğer yetmezliği :Resmi farmakokinetik çalışma yürütülmemiştir. Hafif karaciğer yetmezliği olan hastalar klinik çalışmalara dahil edilmiş ve bu hastalarda OCREVUS'un farmakokinetiğinde değişiklikgözlenmemiştir. Ciddi veya orta seviyede karaciğer hasarı olan hastalara ait farmakokinetikveriler mevcut değildir. 5.3 Klinik öncesi güvenlilik verileriKlinik dışı veriler; güvenlilik farmakolojisi, tekrarlı doz toksisitesi ve embriyo-fötal gelişime yönelik konvansiyonel çalışmalara dayalı olarak insanlar için özel bir risk olmadığınıgöstermektedir. Ocrelizumabla karsinojenisite veya mutajenisite çalışmaları yapılmamıştır. Sinomolgus maymunları üzerinde gerçekleştirilen iki pre- ve post-natal gelişim çalışmalarında gestasyonun 20. gününden en azından doğumda kadar ocrelizumab uygulanması;glomerülopati, kemik iliğinde lenfoid folikül oluşumu, lenfoplazmasitik renal enflamasyon veyavrunun testis ağırlığında azalmayla ilişkilendirilmiştir. Bu çalışma larda uygulanan maternaldozlar, klinik ortamda beklenenden 4,5 ila 21 kat daha yüksek maksimum ortalama serumkonsantrasyonlarına (Cmaks) neden olmuştur. Çalışmada beş ölümcül vaka görülmüş (5/24) olup, biri prematüre doğum nedeniyle güçsüzlükle birlikte fırsatçı enfeksiyona, diğeri aktif enfeksiyonlu (mastit) bir anne hayvanınyavrusunun serebellumunu içeren bir enfektif meningoensefaliteye ve diğer üçü sarılık vehepatik hasar kanıtı, şüphelenilen viral etiyoloji, muhtemelen bir poliomavirüse atfedilmiştir.Bu beş doğrulanmış veya şüphelenilen neonatal enfeksiyonun seyri B hücre tükenmesindenpotansiyel olarak etkilenmiş olabilir. Ocrelizumab maruz kalmış anne hayvanların yenidoğanyavrularında post natal fazda B hücresi popülasyonlarının tükendiği fark edilmiştir. Emzirmedöneminde sütte ölçülebilir ocrelizumab düzeyleri saptanmıştır (serum düzeylerinde kararlıdurumun yaklaşık %0,2'si). 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSodyum asetat trihidrat (E262) Glasiyal asetik asit a,a-Trehaloz sihidratPolisorbat 20 (E432) Enjeksiyonluk su 6.2 GeçimsizliklerBu tıbbi ürün ile polivinil klorür (PVC) veya polyolefin (PO) poşetler ve intravenöz uygulaması setleri arasında uyumsuzluk gözlenmemiştir. Bu tıbbi ürün, Bölüm 6.6'da bahsedilenlerden başka tıbbi ürünlerle karıştırılmamalıdır. 6.3 Raf ömrüAçılmamış flakon24 ay Seyreltilmiş intravenöz infüzyonluk çözeltiKullanım sırasındaki kimyasal ve fiziksel stabilitesi, 2-8°C'de 24 saat ve oda sıcaklığında 8 saat süreyle gösterilmiştir. Mikrobiyolojik açıdan, hazırlanan infüzyon hemen kullanılmalıdır. Hemen kullanılmazsa, kullanım sırasındaki saklama süreleri ve kullanım öncesi koşullar kullanıcınınsorumluluğundadır ve seyreltme işlemi kontrol altında ve valide edilmiş aseptik koşullardayapılmadığı takdirde, bu süre normalde 2-8°C'de 24 saati, oda sıcaklığında 8 saatigeçmemelidir. Bir intravenöz infüzyonun aynı gün tamamlanamaması durumunda, kalan çözelti atılmalıdır. 6.4 Saklamaya yönelik özel tedbirlerBuzdolabında saklayınız (2°C - 8 °C). Dondurmayınız. Işıktan korumak için flakonları karton kutusunda saklayınız. Tıbbi ürünün seyreltmeden sonraki saklama koşulları için, bkz. Bölüm 6.3. 6.5 Ambalajın niteliği ve içeriğiKutuda, flororeçine ile lamine butil kauçuk tıpalı, ALU mühürlü, plastik geçme kapaklı, 10 mL konsantre içeren 15mL'lik renksiz tip I cam flakon. 1 veya 2 flakonluk ambalajlarda bulunmaktadır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerSeyreltme talimatlarıÜrün bir sağlık uzmanı tarafından aseptik teknik kullanılarak hazırlanmalıdır. Flakonu çalkalamayınız. Seyreltilmiş infüzyon çözeltisini hazırlamak için steril bir iğne ve şırıngakullanılmalıdır. Ürün koruyucu madde içermez ve sadece tek kullanım içindir. Rengi bozulmuşsa veya yabancı partikül madde içeriyorsa, konsantreyi kullanmayınız. Tıbbi ürünü uygulama öncesinde seyreltilmelidir. İntravenöz uygulama için çözeltiler, tıbbi ürünün izotonik sodyum klorür 9 mg/mL (%0,9) enjeksiyon için çözelti (300 mg /250 mL veya600 mg/500 mL) içeren bir infüzyon torbasında seyreltilerek yaklaşık 1,2 mg/mL ocrelizumabkonsantrasyonu elde edilmesiyle hazırlanır. Seyreltilmiş çözelti, 0,2 veya 0,22 mikron genişliğinde filtreli bir infüzyon seti kullanılarak uygulanmalıdır. İntravenöz infüzyon başlatılmadan önce, infüzyon torbasının içeriği oda sıcaklığında olmalıdır. İmhaKullanılmamış olan ürünler ya da atık materyaller, Tıbbi Atıkların Kontrolü Yönetmeliği' ' ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİRoche Müstahzarları Sanayi Anonim Şirketi Uniq İstanbulAyazağa Cad. No:4, D/10134396 Maslak, Sarıyer- İstanbul 8. RUHSAT NUMARASI(LARI)2018/119 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 07.03.2018 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ1Veriler prospektif olarak birleştirilmiş Çalışma 1 ve 2'den elde edilmiştir ^Doğrulayıcı olmayan p-değeri analizi; önceden belirlenmiş test hiyerarşisi kapsamında değildir Genişletilmiş Yeti Yitimi Durumu Ölçeği (EDSS) skorunda, başlangıç skoru 5,5 veya daha az olan hastalarda başlangıca kıyasla en az 1veya başlangıç skoru 5,5'in üzerinde olan hastalardabaşlangıca kıyasla en az 0,5 artış olarak CDP tanımlanmıştır, 96. Haftadaki Kaplan-Meier |
İlaç BilgileriOcrevus 300 Mg/10 Ml İnfüzyonluk Çözelti Hazırlamak İçin KonsantreEtken Maddesi: Ocrelizumab Kullanma talimatı ve kısa ürün bilgileri |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.