Bulsef 1 G I.m. Enjeksiyonluk Çözelti İçin Toz İçeren Flakon Kısa Ürün BilgisiKISA URUN BILGILERI1. BEŞERI TIBBI ÜRÜNÜN ADIBULSEF 1 g I.M. enjeksiyonluk çözelti için toz içeren flakon Steril 2. KALITATIF VE KANTİTATIF BILEŞIMHer bir flakonda: Etkin madde: seftriakson sodyum 1.193 g (1 g seftriaksona eşdeğer)Yardımcı madde:Yardımcı madde bulunmamaktadır.Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTIK FORMEnjeksiyonluk çözelti tozu Beyaz ila sarımsı renkli, kristalimsi toz. 4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlarBULSEF'e duyarlı patojenlerin neden olduğu enfeksiyonlar: - Sepsis, - Menenjit, - Dissemine Lyme borreliosis'i (hastalığın erken ve geç evreleri), - Abdominal enfeksiyonlar (peritonit, safra ve gastrointestinal sistem enfeksiyonları), - Kemik, eklem, yumuşak doku, cilt ve yara enfeksiyonları, - İmmün sistem bozukluğuna bağlı enfeksiyonlar, - Böbrek ve idrar yolları enfeksiyonları, - Solunum yolları enfeksiyonları, özellikle pnömoni, kulak-burun-boğaz enfeksiyonları, akutbakteriyel komplike olmayan otitis media, - Gonore dahil olmak üzere genital enfeksiyonlar, - Preoperatif enfeksiyon profilaksisi. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresiStandart doz Yetişkinler ve 12 yaşından büyük çocuklar: Normal olarak günde tek doz 1-2 g (24 saatte bir) BULSEF'tir. Ağır vakalarda veya orta derecede duyarlı organizmaların neden olduğu enfeksiyonlarda günde tek doz, 4 g'a çıkabilir. Tedavi süresi: Tedavi süresi hastalığın seyrine göre değişir. Genellikle bütün antibiyotik tedavilerinde olduğu gibi, hastanın ateşi düştükten veya bakteriyel eradikasyon sağlandıktan sonra en az 48-72 saatBULSEF tedavisine devam edilmelidir.
Kombine tedavi: Deneysel koşullar, birçok gram-negatif bakterilere karşı seftriakson sodyum ile aminoglikozidler arasında sinerji olduğunu göstermektedir. Bu tür kombinasyonlarda aktiviteartışı her zaman kesin olmasa da Pseudomonas aeruginosa gibi patojenlerin neden olduğu ciddive hayatı tehdit eden enfeksiyonlarda BULSEF ile aminoglikozidler kombine edilebilinir. Ancak bu iki ilaç, aralarındaki fiziksel geçimsizlik nedeniyle önerilen dozlarda ayrı ayrı uygulanmalıdır. Menenjit:Bebek ve çocuklardaki bakteriyel menenjitte tedaviye günde tek doz 100 mg/kg (4 g aşılmamalıdır) ile başlanır. Etken organizmalar belirlenip duyarlılık testleri yapıldıktan sonra,gerekirse doz azaltılabilir. En iyi tedavi sonuçları aşağıdaki tedavi sürelerinde elde edilmiştir:Neisseria meningitidis: 4 günHaemophilus influenzae: 6 günStreptococcus pneumoniae: 7 günLyme borreliosis:Çocuk ve yetişkinlerde, 14 gün boyunca günde tek doz olarak 50 mg/kg ile en fazla 2 g arasında uygulanır.Gonore:Gonore (penisilinaz üreten ve üretmeyen suşlar) tedavisinde I.M. olarak 250 mg tek doz BULSEF önerilir.Preoperatif profilaksi:Uygulama şekli:BULSEF çözeltisi hazırlandıktan hemen sonra kullanılmalıdır. BULSEF, intramusküler enjeksiyon ile uygulama içindir. Bir bölgeye 1 gramdan daha fazla enjeksiyon yapılmaması önerilmektedir. Lidokain çözeltisi kesinlikle intravenöz olarak uygulanmamalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Sadece böbrek fonksiyon bozukluğu olan, karaciğer fonksiyonları normal hastalarda BULSEF dozunu azaltmaya gerek yoktur. Ancak preterminal safhada böbrek yetmezliği olanlarda(kreatinin klirensi < 10 ml/dakika) BULSEF dozu günde 2 g'ı aşmamalıdır. Sadece karaciğerhasarı olan, böbrek fonksiyonları normal hastalarda BULSEF dozunu azaltmaya gerek yoktur.Ciddi böbrek ve karaciğer fonksiyon bozukluklarının bir arada görüldüğü vakalarda, seftriaksonplazma konsantrasyonları düzenli olarak kontrol edilmeli ve gerektiğinde doz ayarlamasıyapılmalıdır. Diyalize alınan hastalara diyaliz sonrasında supleman olarak ilave dozlara gerekyoktur. Ancak bu hastalarda eliminasyon oranı değişmiş olabileceğinden, doz ayarlamasınıngerekli olup olmadığını belirlemek için serum konsantrasyonları kontrol edilmelidir.
Pediyatrik popülasyon:Yenidoğan, bebek ve 12 yaşından küçük çocuklarda: Aşağıda belirtilen doz şeması günde tek dozda uygulanır.
50
Yenidoğanlar (14 günlüğe kadar): Günde tek doz 20-50 mg/kg vücut ağırlığı; günlük doz mg/kg'ı aşmamalıdır. Prematüre ve matür bebekler için farklı uygulama gerekli değildir. Seftriakson ve intravenöz kalsiyum içeren ürünlerin eş zamanlı olarak yeni doğanlarda (<28 gün) kullanımı kontrendikedir. Kalsiyum içeren intravenöz ürünleri kullanan (veya bu ürünlerikullanması beklenen) yeni doğanlarda BULSEF kullanılmamalıdır (Bkz. Bölüm 4.3). Bebek ve çocuklar (15 günlükten 12 yaşına kadar): Günde tek doz 20-80 mg/kg. Vücut ağırlığı 50 kg veya üstünde olan normal çocuklarda normal yetişkin dozu kullanılmalıdır. Akut bakteriyel komplike olmayan otitis media tedavisi için 50 mg/kg dozunda (1g'ı aşmamakkoşuluyla) tek uygulama önerilmektedir (single-shot therapy). Geriyatrik popülasyon:Geriatrik hastalarda, yetişkinler için önerilen dozlar kullanılır. 4.3. KontrendikasyonlarSeftriaksona, ilacın içeriğindeki maddelerin herhangi birine (bkz. Bölüm 6.1) ve herhangi bir sefalosporine karşı aşırı duyarlılığı bulunan ve herhangi beta laktam antibakteriyel ajana (örn.penisilinler, monobaktamlar, karbapenemler) karşı anafilaktik reaksiyon gibi ciddi aşırıduyarlılık geçmişi olan hastalarda BULSEF kontrendikedir. Seftriaksyon aşağıda durumlarda kontendikedir: 41 haftalık postmenstrüal yaşa kadar (gebelik yaşı + kronolojik yaş) olan prematüre yenidoğanlarda kullanım* Normal doğumlu yenidoğanlarda (28 günlüğe kadar olanlarda) kullanım: - Hiperbilirubinemili, sarılığı bulunan veya hipoalbuminemik ve asidozu olan normal doğumlu28 günlüğe kadar olan yenidoğanlarda bilirubin bağlanması etkilenebileceğindenkontrendikedir*. - Seftriakson-kalsiyum tuzu çökmesi riski nedeniyle, intravenöz kalsiyum tedavisi veyakalsiyum içeren intravenöz solüsyonlar ile tedaviye ihtiyaç duyan veya ihtiyaç duymasıbeklenen 28 günlüğe kadar olan yenidoğanlarda kontrendikedir (bkz. Bölüm 4.4, 4.8 ve 6.2). * In vitroçalışmalar, seftriaksonun bilirubini serum albumin bağlanma noktalarından uzaklaştırabileceğini ve böylece bu hastalarda olası bilirubin ensefalopatisi riskine yolaçabileceğini göstermiştir.Seftriakson ve intravenöz kalsiyum içeren ürünlerin eş zamanlı olarak yenidoğanlarda (< 28 gün) kullanımı kontrendikedir. Kalsiyum içeren intravenöz ürünleri kullanan (veya bu ürünlerikullanması beklenen) yenidoğanlarda seftriakson kullanılmamalıdır. ^ BıH)elgemi eleKtroniK imza ile imzalanmıştır.Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysBelge Do Lidokaine yönelik kontrendikasyonlar, lidokain çözeltisi çözücü olarak kullanıldığında seftriaksonun intramüsküler enjeksiyonu öncesinde ekarte edilmelidir (bkz. Bölüm 4.4).Lidokainin Kısa Ürün Bilgisine, özellikle kontrendikasyonlar bölümüne bakınız. Lidokain içeren seftriakson çözeltileri asla intravenöz olarak uygulanmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriHipersensitivite reaksiyonları:Tüm beta laktam antibakteriyel ajanlarda olduğu gibi, ciddi ve duruma göre ölümcül hipersentivite reaksiyonları bildirilmiştir (bkz. Bölüm 4.8). Ciddi hipersensitivite reaksiyonlarıdurumunda seftriakson tedavisi derhal kesilmeli ve gerekli acil durum aksiyonlarıbaşlatılmalıdır. Tedaviye başlamadan önce hastanın seftriaksona, diğer sefalosporinlere veherhangi bir beta laktam ajanına karşı hipersensitivite geçmişinin olup olmadığı belirlenmelidir.Diğer beta laktam ajanlarına karşı ciddi olmayan hipersenstivite geçmişi olan hastalaraseftriakson verilirken dikkatli olunmalıdır. Seftriakson tedavisi ile ilişkili olarak hayatı tehdit edici veya ölümcül olabilen şiddetli kutanöz advers reaksiyonlar (Stevens Johnson sendromu veya Lyell sendromu/toksik epidermal nekrozve eozinofili ve sistemik semptomların eşlik ettiği ilaç reaksiyonu (DRESS)) bildirilmişolmasına karşın bu olayların sıklığı bilinmemektedir (bkz. Bölüm 4.8). Kalsiyum içeren ürünler ile etkileşim:Term ve preterm bebeklerin akciğer ve böbreklerinde ölümcül olan seftriakson-kalsiyum çökeltileri bildirilmiştir. Bunlardan en az biri seftriakson ve kalsiyumu farklı zamanlarda farklıintravenöz hatları aracılığıyla almıştır. Yenidoğanlardan farklı olarak, mevcut bilimselverilerde, seftriakson ve kalsiyum içeren solüsyonlar veya kalsiyum içeren herhangi bir ürünletedavi edilen hastalarda intravasküler çökeltiler ile ilgili bir bilgi bulunmamaktadır. In vitroçalışmalar, yenidoğanların diğer yaş grupları ile kıyaslandığında daha yüksek seftriakson-kalsiyum çökelmesi riskine sahip olduğunu göstermiştir.28 günlükten büyük hastalarda seftriakson ve kalsiyum içeren ürünler ardışık olarak kullanılabilir. Bu durumda infüzyon yolu uygun sıvılar verilerek iyice yıkanmalıdır. Seftriaksonhiçbir yaş grubunda intravenöz kalsiyum içeren solüsyonlarla aynı anda bir Y- setikullanılarak verilememelidir. Seftriakson Ringer ve Hartmann solüsyonu gibi kalsiyum içerensolüsyonlarla veya kalsiyum içeren parenteral beslenme solüsyonu ile sulandırılmamalı veyakarıştırılmamalıdır. İntravenöz seftriakson ve oral kalsiyum içeren ürünler arasında veyaintramusküler seftriakson ile intravenöz veya oral kalsiyum içeren ürünler arasındaki etkileşimkonusunda henüz yeterli bilgi bulunmamaktadır. Kalsiyum içeren total parenteral nutrisyon(TPN) ile sürekli infüzyona ihtiyaç duyan hastalarda sağlık profesyonelleri çökme riskigöstermeyecek alternatif bir antibakteriyel tedavi uygulamayı isteyebilir. Sürekli nutrisyonaihtiyaç duyan hastalarda seftriakson kullanımı gerekiyorsa TPN çözeltileri ve seftriakson farklıinfüzyon noktalarında farklı infüzyon hatları ile eş zamanlı olarak uygulanabilir. Alternatifolarak, seftriakson infüzyonu süresince TPN solüsyonu infüzyonu kesilebilir ve solüsyonlar Belgeww ¦turkiye.gov.tr/saglik-titck-ebys
Pediyatrik popülasyon:Bölüm 4.2'de belirtilen dozlar için BULSEF'in etkililiği ve güvenliliği yenidoğanlarda, bebeklerde ve çocuklarda kanıtlanmıştır. Çalışmalar, diğer bazı sefalosporinlerde olduğu gibi,seftriaksonun bilirubini serum albumininden ayırabileceğini göstermiştir. BULSEF, bilirubin ensefalopatisi geliştirme riski olan prematüre ve normal doğumlu yenidoğanlarda kontrendikedir (bkz. Bölüm 4.3). İmmun aracılı hemolitik anemi:BULSEF de dahil olmak üzere sefalosporin sınıfı antibakteriyel ilaç kullanan hastalarda immun sistem aracılı hemolitik anemi görülmüştür (bkz. Bölüm 4.8). BULSEF tedavisi sırasında, ölümde dahil olmak üzere, yetişkinlerde ve çocuklarda ciddi hemolitik anemi vakaları bildirilmiştir. Seftriakson tedavisi sırasında kansızlık gelişirse sefalosporin ilişkili kansızlık tanısı göz önüne alınmalı ve etiyoloji belirlenene dek seftriakson tedavisine ara verilmelidir. Uzun dönem tedavi:Uzun dönem tedavi süresince belirli dönemlerde tam kan sayımı gerçekleştirilmelidir. Kolit/Duyarlı olmayan mikroorganizmaların aşırı büyümesi:Antibakteriyel ajan ilişkili kolit ve psödomembranöz kolit seftriakson da dahil olmak üzere neredeyse tüm antibakteriyel ajanlar ile bildirilmiştir ve ciddiyeti hafiften yaşamı tehdit edecekseviyeye kadar değişebilir. Bu nedenle, seftriakson tedavisi sırasında veya sonrasında diyareolan hastalarda bu tanıyı göz önünde bulundurmak büyük önem taşımaktadır (bkz. Bölüm 4.8).Seftriakson tedavisinin sonlandırılması ve Clostridium difficile için spesifik tedaviyebaşlanması dikkate alınmalıdır. Peristaltik hareketi inhibe eden tıbbi ürünler kullanılmamalıdır. Diğer antibakteriyel ajanlarda olduğu gibi duyarlı olmayan mikroorganizmalar ile süperenfeksiyonlar meydana gelebilir. Şiddetli böbrek ve karaciğer yetmezliği:Ciddi renal ve hepatik yetmezlik durumunda etkililik ve güvenlilik için yakın takip önerilmektedir (bkz. Bölüm 4.2). Serolojik test ile etkileşim:BULSEF yanlış pozitif sonuçlara yol açabileceğinden Coombs testleri ile etkileşimler meydana gelebilir. BULSEF, galaktozemi için de yanlış pozitif sonuçlara neden olabilir (bkz. Bölüm4.8). Ürindeki glikoz tayini için enzimatik olmayan metotlar yanlış pozitif sonuçlar verebilir. BULSEF tedavisi sırasında ürin glikoz tayini enzimatik olarak yapılmalıdır (bkz. Bölüm 4.8).
Seftriakson, bazı kan glikoz inceleme sistemleri ile elde edilen tahmini kan glikoz değerlerini daha düşük gösterebilir. Lütfen her sistemin nasıl kullanıldığı ile ilgili bilgi edininiz. Eğergerekli ise alternatif test metotları kullanılmalıdır. Antibakteriyel spektrum:Seftriakson sınırlı bir antibakteriyel aktivite spektrumuna sahiptir ve patojenin tespit edilemediği durumlarda bazı enfeksiyon tiplerinin tedavisinde tek başına yeterli olmayabilir(bkz. Bölüm 4.2). Seftriaksona dirençli organizmaları da içeren şüpheli patojenlerin olduğupolimikrobiyal enfeksiyonlarda başka bir antibiyotiğin kullanımı göz önüne alınmalıdır. Lidokainin kullanımı: Lidokain çözeltisinin çözücü olarak kullanıldığı durumda seftriakson çözeltileri yalnızca intramüsküler enjeksiyon için kullanılmalıdır. Kullanımından önce lidokainin Kısa ÜrünBilgisi'nde yer alan kontrendikasyonlar, uyarılar ve diğer önemli bilgiler dikkatleincelenmelidir (bkz. Bölüm 4.3). Lidokain çözelti asla intravenöz olarak kullanılmamalıdır. Safra taşı:Sonogramlarda gölgeler görüldüğünde kalsiyum seftriakson çökelti oluşumu olasılığı dikkate alınmalıdır. Safta taşları ile karıştırılan bu gölgeler safra kesesi sonogramlarında tespitedilmiştir ve günlük 1 gram ve üzeri seftriakson dozlarında daha sık görülmüştür. Özelliklepediyatrik popülasyon için özel dikkat gerekmektedir. Bu gölgeler seftriakson terapisininsonlandırılmasının ardından kaybolmaktadır. Kalsiyum seftriakson çökeltileri nadiren birtakımsemptomlarla ilişkilidir. Semptomik vakalarda cerrahi olmayan konservatif tedavi önerilir vespesifik fayda-zarar değerlendirmesine dayanarak hekim kararına göre seftriakson tedavisineara verilebilmektedir (bkz. Bölüm 4.8). Biliyer staz:seftriakson ile tedavi edilen hastalarda muhtemelen biliyer obstruksiyon nedeniyle meydana gelen pankreatit vakaları bildirilmiştir (bkz. Bölüm 4.8). Çoğu hastada majör terapi öncesi,ciddi hastalık ve total parenteral nutrisyon gibi biliyer staz ve biliyer çamur için risk faktörlerigörülmüştür. BULSEF ile ilişkili biliyer çökelmenin tetikleyicisi veya kofaktörü göz ardıedilemez. Böbrek taşı:Renal litiyaz vakaları bildirilmiş olup bu durum seftriakson tedavisinin kesilmesi ile birlikte ortadan kalkmaktadır (bkz. Bölüm 4.8). Semptomik vakalarda sonografi yapılmalıdır. Renallitiyaz geçmişi olan veya hiperkalsiürisi bulunan hastalarda BULSEF kullanımına hekimtarafından yapılan fayda-zarar değerlendirmesine göre karar verilmelidir. Jarisch-Herxheimer reaksiyonu (JHR):Spiroket enfeksiyonları olan bazı hastalar, seftriakson tedavisi başladıktan kısa bir süre sonra bir Jarisch-Herxheimer reaksiyonu (JHR) yaşayabilir. JHR genellikle kendi kendini sınırlayanbir durumdur veya semptomatik tedavi ile yönetilebilir. Böyle bir reaksiyon meydana gelirse ''^ Bu belgenli elektronik imza ıle imzalanmıştır.JBelgeBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys Ensefalopati: Ensefalopati, seftriakson kullanımıyla (bkz. Bölüm 4.8), özellikle şiddetli böbrek yetmezliği (bkz. Bölüm 4.2) veya merkezi sinir sistemi bozuklukları olan yaşlı hastalarda bildirilmiştir.Eğer seftriaksona bağlı ensefalopatiden şüpheleniliyorsa (örn. bilinç düzeyinde azalma, mentaldurumda değişiklik, miyoklonus, konvülsiyonlar), seftriakson tedavisinin sonlandırılmasıdüşünülmelidir. Sodyum:Her 1 gram BULSEF 3,6 mmol sodyum içerir. Bu durum kontrollü sodyum diyetinde olan hastalar için gözönünde bulundurulmalıdır. 4.5.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriÇökelti oluşabileceğinden; BULSEF flakonları sulandırmak veya sulandırılmış bir flakonu IV uygulama için seyreltmek üzere Ringer çözeltisi veya Hartmann çözeltisi gibi kalsiyum içerençözücülerle beraber kullanmayınız. Seftriakson-kalsiyum çökeltisi seftriaksonun aynı intravenöz uygulama hattında kalsiyum içeren solüsyonlar ile karıştırılması durumunda da meydana gelebilmektedir. Seftriakson, Y setiaracılığı ile parenteral nutrisyon gibi kalsiyum içeren infüzyonlar da dahil olmak üzerekalsiyum içeren intravenöz solüsyonlar ile eş zamanlı olarak uygulanmamalıdır. Bununlabirlikte, yenidoğanlar dışındaki hastalarda seftriakson ve kalsiyum içeren solüsyonlar, infüzyonhatlarının infüzyonlar arasında uygun bir sıvı ile yıkanması koşulu ile, sıra ile uygulanabilir.Kordon kanından yetişkin ve neonatal plazma kullanılarak yapılan in vitro çalışmalarseftriakson-kalsiyum çökelti oluşma riskinin yenidoğanlarda daha yüksek olduğunugöstermiştir (bkz. Bölüm 4.2, 4.3, 4.4, 4.8 ve 6.2). BULSEF'in oral antikoagülanlar ile eş zamanlı kullanımı anti K vitamini etkisini ve kanama riskini artırabilir. Seftriakson ile tedavi sırasında ve sonrasında Uluslararası Normalize Oranı(International Normalised Ratio, INR) yakından takip edilmeli ve anti vitamin K ilacınınpozolojisi buna göre ayarlanmalıdır (bkz. Bölüm 4.8). Sefalosporinler ile birlikte kullanıldığında amoniglikozitlerin renal toksisitesinde olası artış olduğu ile ilgili çelişkili bulgular bulunmaktadır. Bu gibi vakalarda klinik aminoglikozitseviyeleri ve renal fonksiyonun yakından takip edilmesi ile ilgili öneriler göz önüne alınmalıdır. Bir in vitroçalışmada kloramfinekol ve seftriaksonun kombinasyonu durumunda antagonistik etkiler görülmüştür. Bu bulgunun klinik yaygınlığı bilinmemektedir.Seftriakson ve oral kalsiyum içeren ürünler veya intramüsküler seftriakson ile kalsiyum içeren ürünler (intravenöz veya oral) arasında etkileşimi gösteren herhangi bir veri bulunmamaktadır. Seftriakson ile tedavi edilen hastalarda Coombstesti yalancı pozitif sonuçlar verebilmektedir.Lİanmıştır.Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysDiğer antibiyotikler gibi seftriakson da .galaktozemi testinde yalancı pozitif sonuçlara neden 5olabilmektedir.  Benzer şekilde, idrarda glukoz tayini için kullanılan enzimatik olmayan metotlar da yalancı pozitif sonuçlar verebilmektedir. Bu nedenle, idrarda glukoz seviyesi tayini seftriakson tedavisisırasında enzimatik metotlar ile yapılmalıdır. Furosemit gibi potent diüretikler ve seftriaksonun yüksek dozlarının birlikte uygulanmasını takiben renal fonksiyonda herhangi bir bozukluk görülmemiştir. Probenesidin eş zamanlı uygulanması seftriakson eliminasyonunu azaltmamaktadır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda seftriakson sodyum kullanımına ilişkin klinik veri mevcut değildir. Çocuk doğurma potansiyeli bulunan kadınlar, BULSEF tedavisi sırasında etkili bir doğum kontrol yöntemi kullanmalıdır. Gebelik dönemiSeftriakson plasenta bariyerini aşar. Gebe kadınlarda seftriakson kullanımı ile ilgili veriler sınırlıdır. Hayvanlar üzerinde yapılan çalışmalar embriyonal/fetal, perinatal ve postnatalgelişim açısından doğrudan veya dolaylı herhangi bir zarar göstermemiştir (bkz. Bölüm 5.3).Seftriakson, gebelik sırasında ve özellikle gebeliğin ilk üç aylık döneminde, yalnızca faydasınınzararından fazla olması durumunda uygulanmalıdır. Gebe kadınlara verilirken tedbirli olunmalıdır. Laktasyon dönemiSeftriakson düşük konsantrasyonlarda anne sütüne geçmektedir ancak seftriaksonun terapötik dozlarında emzirilen yenidoğanlarda herhangi bir etki beklenmemektedir. Buna karşın, diyareve mukoz membranların fungal enfeksiyon riski gözardı edilemez. Sensitizasyon olasılığıayrıca dikkate alınmalıdır. Laktasyonun sonlandırılması veya seftriakson tedavisininsonlandırılması/yapılmaması kararı verilirken laktasyonun çocuk için faydası ile tedavinin anneiçin faydası göz önünde bulundurulmalıdır. Üreme yeteneği /Fertilite:Üreme ile ilgili çalışmalar kadın veya erkek fertilitesi üzerinde herhangi bir advers etki göstermemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkilerSeftriakson tedavisi sırasında sersemlik, baş dönmesi gibi araç veya makine kullanımım etkileyebilen istenmeyen etkiler görülebilmektedir (bkz. Bölüm 4.8). Hastalar araç veya makinekullanırken dikkatli olmalıdır. 4.8. İstenmeyen etkilerSeftriakson için en sık raporlanan advers reaksiyonlar eozinofili, lökopeni, trombositopeni, diyare, döküntü ve karaciğer enzimlerinde artış şeklindedir. Seftriakson advers reaksiyonlarının sıklığını belirlemek için kullanılan veriler klinik çalışmalardan elde edilmiştir. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor).


a Pazarlama sonrası raporlara göre. Bu reaksiyonlar belirli olmayan boyuttaki popülasyon tarafından gönüllü olarak bildirildiğinden bu reaksiyonların sıklığı güvenilir bir şekildebelirlenememekte ve bu yüzden bilinmiyor şeklinde kategorize edilmektedir.b bkz. Bölüm 4.4 c Genellikle seftriakson kullanımın kesilmesi ile geri dönüşümlüdür Seçilmiş advers reaksiyonların tanımıEnfeksiyonlar ve enfestasyonlar:Seftriakson kullanımı sonrası görülen diyare Clostridium difficile ile ilişkili olabilir. Uygun sıvı ve elektrolit idaresi uygulanmalıdır (bkz. Bölüm 4.4). Seftriakson-kalsiyum tuzu çökeltisi:İntravenöz seftriakson ve kalsiyum ile tedavi edilmiş olan preterm ve normal doğumlu yenidoğanlarda (28 günlükten küçük) seyrek, ciddi ve bazı vakalarda ölümcül adversreaksiyonlar bildirilmiştir. Ölüm sonrası vakalarda akciğer ve böbreklerde seftriakson-kalsiyumtuzu çökeltileri görülmüştür. Yenidoğanlardaki yüksek çökelme riskinin nedeni yetişkinlerekıyasla kan hacimlerinin düşük olması ve seftriaksonun daha uzun yarılanma ömrüdür (bkz.Bölüm 4.3, 4.4 ve 5.2). Çoğunlukla yüksek dozla (80 mg/kg/gün veya 10 gramı aşan toplam dozlar gibi) tedavi edilen veya dehidrasyon, yatağa bağlılık gibi başka risk faktörleri olan çocuklarda idrar yollarındaseftriakson çökeltisi vakaları bildirilmiştir. Bu durum semptomik veya asemptomik olabilir veüreteral obstrüksiyon ve postrenal akut renal yetmezliğe yol açabilir ancak genellikleseftriakson tedavisinin kesilmesi ile tersine çevrilebilir (bkz. Bölüm 4.4). Öncelikle önerilen standart dozdan yüksek dozlarla tedavi edilen hastalarda safra kesesinde seftriakson kalisyum tuzu çökeltileri görülmüştür. Yapılan prospektif çalışmalar, çocuklardaintravenöz uygulamayla gözlenen çökelme insidansı (bazı çalışmalarda %30'un üzerinde)değişkenlik göstermiştir. İnsidans yavaş infüzyon ile (20-30 dakika) daha düşük olarak tespitedilmiştir. Bu etki genellikle asemptomiktir ancak çökeltilere seyrek vakalarda genellikle ağrı,bulantı ve kusma gibi klinik semptomlar eşlik etmiştir. Bu vakalarda semptomik tedaviönerilmektedir. Çökelti oluşumu seftriakson tedavisinin kesilmesi ile tersine çevrilebilir (bkz.Bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine 'İrjDerge, guVenlı eleiareMK imza ile imzalanmıştır.Belge Do
Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiDoz aşımında, bulantı, kusma veya diyare semptomları görülebilir. Seftriaksonkonsantrasyonu hemodiyaliz veya periton diyaliziyle azaltılmamaktadır. Spesifik bir antidot bulunmamaktadır.Doz aşımı tedavisi semptomatik olmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diğer beta-laktam antibiyotikleri (3. Kuşak sefalosporinler) ATC kodu: J01DD04 Etki mekanizmasıSeftriakson, penisilin bağlayan proteinlere (PBP'ler) bağlanmayı takiben bakteriyel hücre duvarı sentezini inhibe eder. Hücre duvarı biyosentezinin (peptidoglikan) bozulması, hücrelizisine ve bakteri hücresinin ölmesine neden olur. DirençSeftriaksona bakteriyel direnç, aşağıdaki mekanizmalardan bir veya daha fazlasına bağlı olabilir: Genişletilmiş spektrumlu beta-laktamazlar (ESBL'ler), karbapenemazlar ve belirli aerobikGram-negatif bakteri türlerinde indüklenebilen veya stabil olarak baskılanabilen Amp Cenzimleri dahil beta-laktamazlarla hidroliz. Seftriakson için penisilin bağlayıcı proteinlerin afinitesinin azalması. Gram-negatif organizmaların dış membranlarının geçirgenliğinin olmaması. Bakteriyel efluks pompaları., Duyarlılık testi sınır değerleriAvrupa Antimikrobiyal Duyarlılık Testi (EUCAST) Komitesi tarafından belirlenen minimum

a. Duyarlılık, sefoksitin duyarlılığından anlaşılmıştır. b. Duyarlılık penisilin duyarlılığından anlaşılmıştır. c. Duyarlı sınır değerinin üzerinde seftriakson MİK değerine sahip izolatlar nadirdir vebulunursa yeniden test edilmeli ve doğrulanırsa bir referans laboratuvara gönderilmelidir. d. Sınır değerler, günlük 1g x 1 intravenöz doz ve en az 2g x 1 yüksek doz için geçerlidir. Spesifik patojenlere karşı klinik etkinlikEdinilmiş direncin yaygınlığı coğrafi olarak ve zamanla değişebilir ve özellikle şiddetli enfeksiyonları tedavi ederken dirençle ilgili yerel bilgi istenir. Seftriaksonun en azından bazıenfeksiyon türlerinde kullanımının yerel tekrarlama sıklığının şüpheli olduğu durumlardagerektiğinde uzman tavsiyesi alınmalıdır. Yaygın olarak duyarlı türlerGram pozitif aeroblarStaphylococcus aureus (metisiline duyarlı)£ Stafilokok koagülaz negatif (metisiline duyarlı)£Streptococcus pyogenes (Grup A) Streptococcus pneumoniae Viridans Group Streptococci Gram negatif aeroblarBorrelia burgdorferi Haemophilus influenzaeHaemophilus parainfluenzaeMoraxella catarrhalisNeisseria gonoreNeisseria meningitidisProteus mirabilisProvidencia türleriTreponema pallidum Edinilmiş direncin sorun olabileceği türlerGram pozitif aeroblarStaphylococcus epidermidis+ Staphylococcus haemolyticus+Staphylococcus hominis+ Gram negatif aeroblar
Citrobacter freundii Bu belgeBelge DoBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys Enterobacter aerogenes Enterobacter cloacaeEscherichia coli%Klebsiella pneumoniae%Klebsiella oxytoca%Morganella morganiiProteus vulgarisSerratia marcescens AnaeroblarBacteroides türleri Fusobacterium türleriPeptostreptococcus türleriClostridium perfringens Doğası gereği dirençli organizmalarGram-positive aerobesEnterococcus türleri Listeria monocytogenes Gram-negative aerobesAcinetobacter baumannii Pseudomonas aeruginosaStenotrophomonas maltophilia AnaerobesClostridium difficile Others:Chlamydia türleri Chlamydophila türleriMycoplasma türleriLegionella türleriUreaplasma urealyticum
£ Metisiline dirençli tüm stafilokoklar, seftriaksona dirençlidir. + En az bir bölgede direnç oranları>% 50% ESBL üreten suşlar her zaman dirençlidir  5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:İntramasküler uygulamaİntramasküler enjeksiyonu takiben, ortalama pik plazma seftriakson seviyeleri, eşdeğer bir dozun intravenöz uygulamasından sonra gözlemlenenlerin yaklaşık yarısıdır. 1 g'lıkuygulamadan sonraki 2-3 saat içinde ulaşılan maksimum plazma konsantrasyonu 81 mg/l'dir. İntramüsküler uygulamadan sonra plazma konsantrasyonu-zaman eğrisinin altındaki alan, eşdeğer bir dozun intravenöz uygulamasından sonraki alana eşdeğerdir. İntravenöz uygulama500 mg ve 1 g seftriaksonun intravenöz bolus uygulamasından sonra, ortalama pik plazma seftriakson seviyeleri sırasıyla yaklaşık 120 ve 200 mg / l'dir. Seftriakson 500 mg, 1g ve 2gintravenöz infüzyonundan sonra, plazma seftriakson seviyeleri sırasıyla yaklaşık 80, 150 ve 250mg/l'dir. Dağılım:Seftriaksonun dağılım hacmi 7-12 litredir. En ilgili patojenlerin minimal inhibe edici konsantrasyonlarının çok üzerindeki konsantrasyonlar, akciğer, kalp, safra yolu / karaciğer, bademcik, orta kulak ve burun mukozası,kemik, serebrospinal, plevral, prostat ve sinovyal sıvılarda tespit edilebilir. Tekrarlananuygulamalarda ortalama pik plazma konsantrasyonunda (Cmax) % 8-15'lik bir artış görülür;kararlı duruma çoğu durumda uygulama yoluna bağlı olarak 48-72 saat içinde ulaşılır. Belirli dokulara nüfuz etme:Seftriakson beyin ve omurilik zarına (meninksler) nüfuz eder. Meninksler iltihaplandığında penetrasyon en yüksektir. Bakteriyel menenjitli hastalarda beyin omurilik sıvısında (BOS)ortalama pik seftriakson konsantrasyonlarının, iltihaplanmamış meninksleri olan hastalardaplazma düzeylerinin %2'si ile karşılaştırıldığında, plazma düzeylerinin %25'ine kadar olduğubildirilmiştir. BOS'ta pik seftriakson konsantrasyonlarına intravenöz enjeksiyondan yaklaşık 46 saat sonra ulaşılır. Seftriakson plasenta bariyerini geçer ve düşük konsantrasyonlarda annesütüne geçer (bkz.Bölüm 4.6). Protein bağlama:Seftriakson, geri dönüşümlü olarak albümine bağlanır. Plazma proteinlerine bağlanma, 100 mg/l'nin altındaki plazma konsantrasyonlarında yaklaşık %95'tir. Bağlanma doyurulabilirdir vebağlanan kısım artan konsantrasyonla azalır (300 mg/l plazma konsantrasyonunda %85'ekadar). Biyotransformasyon:Seftriakson sistematik olarak metabolize edilmez, fakat bağırsak florası tarafından inaktif metabolitlere dönüştürülür. , ,., * Bu belge Belge Do Eliminasyon:Seftriaksonun (bağlı ve serbest) total plazma klerensi 10-22 ml/dakika'dır. Renal klerens 5-12 ml/dakikadır. Seftriaksonun %50-60'ı değişmemiş olarak idrarla (tamamına yakını glomerülerfiltrasyon ile), %40-50'si ise değişmemiş olarak safrayla ve bağırsaklarla atılır. Yetişkinlerdeeliminasyon yarı-ömrü yaklaşık 8 saattir. Doğrusallık/ doğrusal olmayan durum:Seftriaksonun farmakokinetiği lineer değildir. Toplam ilaç konsantrasyonu bazında eliminasyon yarı-ömrü hariç, tüm temel farmakokinetik parametreler doza bağımlıdır ve dozlaorantılı olarak daha az artar. Doğrusal olmama, plazma protein bağlanmasının doygunluğundankaynaklanır ve bu nedenle toplam plazma seftriakson için gözlenir, ancak serbest(bağlanmamış) seftriakson için gözlenmez. Hastalardaki karakteristik özellikler:Geriyatrik popülasyon75 yaşın üstündeki yaşlı hastalarda ortalama eliminasyon yarı ömrü genç yetişkinlerle karşılaştırıldığında genellikle 2-3 kez daha uzundur. Pediyatrik popülasyonYeni doğanlarda seftriaksonun yarı ömrü uzar. Doğumdan 14 günlük yaşa kadar, serbest seftriakson seviyeleri, azalmış glomerüler filtrasyon ve değişen protein bağlanması gibifaktörlerle daha da artırılabilir. Çocukluk döneminde yarı ömür, yeni doğanlara veyayetişkinlere göre daha düşüktür. Toplam seftriaksonun plazma klirensi ve dağılım hacmi, yeni doğanlarda, bebeklerde ve çocuklarda yetişkinlere göre daha yüksektir. Böbrek ve karaciğer yetmezliği olan hastalar:Böbrek veya karaciğer yetmezliği olan hastalarda, seftriaksonun farmakokinetik özelliklerinde eliminasyon yarı-ömrünün hafif düzeyde uzaması ile (2 katından daha az) ciddi böbrekyetmezliği olan hastalarda dahi çok az değişiklik gözlenir. Böbrek yetmezliği olan hastalardayarı-ömrün göreceli olarak daha az artması, protein bağlanmasında azalmaya ve toplamseftriakson miktarının böbrek dışındaki yollarla atılımının artmasına neden olarak böbrek dışıatılımda dengeleyici bir artışın olmasıyla açıklanır. Karaciğer yetmezliği olan hastalarda, renal klerenste dengeleyici bir artış olması nedeniyle seftriaksonun eliminasyon yarılanma ömrü artmaz. Bunun sebebi, plazmadaki serbestseftriakson fraksiyonunun toplam ilaç klerensinde gözlemlenen paradoksikal artışa katkısağlaması ve toplam klerensle paralel olarak dağılım hacminin artmasıdır. Farmakokinetik / farmakodinamik ilişki(ler):in vivoetkinlik ile en iyi korelasyonu gösteren için bağlanmamış imzalanmıştır.isBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysfarmakokinetik-farmakodinamik indeks, bağımsız hedef türler nli elekıroniK imza ile imzalanmıştır.Belge Do konsantrasyonun minimum inhibitör seftriakson konsantrasyonunun (MİK) üzerinde kaldığı dozlama aralığının yüzdesidir (%T > MİK). 5.3. Klinik öncesi güvenlilik verileriKlinik dışı çalışmalardan elde edilen veriler yüksek seftriakson kalsiyum tuzu dozunun köpek ve maymunların safra keselerinde geriye döndürülebilir konkrementlere ve çökeltilere yolaçtığını göstermiştir. Hayvanlar üzerinde yapılan çalışmalar reprodüksiyon ve genotoksisite üzerinde toksik herhangi bir etki göstermemiştir. Seftriakson üzerinde karsinojenisite çalışmaları ise yapılmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiBULSEF 1 g I.M. Enjeksiyonluk Çözelti için Toz İçeren Flakon herhangi bir yardımcı madde içermemektedir. 6.2. GeçimsizliklerSeftriakson içeren çözeltiler Bölüm 6.6'da belirtilenler dışında diğer ajanlar ile karıştırılmamalı veya diğer ajanlara eklenmemelidir. Özellikle, kalsiyum içeren seyrelticiler (örneğin Ringerçözeltisi veya Hartman çözeltisi) seftriakson flakonlarını rekonstitüe etmek için veyarekonstitüe edilmiş bir flakonu intravenöz uygulama için daha fazla seyreltmek amacıylakullanılmamalıdır çünkü çökelti oluşabilir. Seftriakson ve total parenteral nutrisyon da dahilolmak üzere kalsiyum içeren çözeltiler karıştırılmamalı veya aynı anda uygulanmamalıdır (bkz.Bölüm 4.2, 4.3, 4.4 ve 4.8). Seftriakson ile başka bir antibiyotik kombinasyonu ile tedavi amaçlanıyorsa, uygulama aynı şırıngada veya aynı infüzyon solüsyonunda yapılmamalıdır. 6.3. Raf ömrü48 ay. 6.4. Saklamaya yönelik özel tedbirlerSulandırılmadan önce 25°C'nin altındaki oda sıcaklığında, ışıktan koruyarak saklanmalıdır. Sulandırıldıktan sonra 25°C'nin altındaki oda sıcaklığında 6 saat, buzdolabında 24 saatsaklanmalıdır. 6.5. Ambalajın niteliği ve içeriğiŞeffaf Alüminyum/plastik flip-off kapak ile sabitleştirilmiş gri renkli bromo bütil kauçuk tıpalı, 15 ml'lik tip III şeffaf cam flakon ve 3,5 ml % 1 lidokain çözeltisi içeren ampul. Bir ampul 35 mg susuz lidokain hidroklorüre eşdeğer 37.3 mg lidokain hidroklorür monohidrat ve steril enjeksiyonluk su içerir. Belge D(gernbiK(kutuda "İ3iı^ıiiiçercen ı 1t®mpul^"ı^^unmaktad-ıttpk-ebys
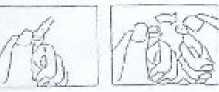
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTıbbi atıkların kontrolü yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmeliklerine uygun olarak imha edilmelidir. Kural olarak, çözeltiler hazırlandıktan sonra hemen kullanılmalıdır. Çözeltilerin renkleri, konsantrasyon ve saklanma sürelerine bağlı olarak açık sarı ile bal rengi arasında değişir. Solüsyonun renginin değişmesi ilacın etki ve toleransını etkilemez. İntramüsküler enjeksiyon: İntramüsküler enjeksiyon için 1 g BULSEF, 3,5 ml %1'lik lidokain çözeltisinde çözülür ve derin intragluteal enjeksiyon seklinde uygulanır. Her iki tarafa da 1 g'dan fazla enjekte edilmemesi önerilmektedir. Lidokain içermeyen i.m. enjeksiyonlar ağrılıdır. Lidokain çözeltisi asla i.v. uygulanmamalıdır. Mavi nokta yukarıda bulunacak şekilde tutulur. Ampulün baş kısmı ok yönünde aşağıya çekilir. Testere kullanılmasına gerek yoktur. 7. RUHSAT SAHİBİWorld Medicine İlaçları Ltd. Şti. Bağcılar/İstanbul 8. RUHSAT NUMARASI254/88 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 13.12.2013 Ruhsat yenileme tarihi: 04.12.2018 10. KÜB'ÜN YENİLENME TARİHİ
|
İlaç BilgileriBulsef 1 G I.m. Enjeksiyonluk Çözelti İçin Toz İçeren FlakonEtken Maddesi: Seftriakson Sodyum Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.