Karfilib 60 Mg I.v. Enjeksiyonluk Çözelti Hazırlamak İçin Toz Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'a bildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERİ TIBBİ ÜRÜNÜN ADIKARFİLİB 60 mg I.V. enjeksiyonluk çözelti hazırlamak için toz Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir flakon 60 mg karfilzomib içerir. Önerilen şekilde rekonstitüye edildiğinde mL başına 2 mg etkin madde elde edilir. Yardımcı madde(ler):Sulandırıldıktan sonra KARFİLİB'in her ml'si, 7,2 mg sodyuma karşılık gelen 0,3 mmol sodyum içerir. Yardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti hazırlamak için toz Beyaz veya beyazımsı liyofilize toz. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarKARFİLİB daha önce 1-3 seri tedavi almış yetişkin relaps veya refrakter multipl miyelom hastalarının tedavisinde aşağıdakiler ile kombinasyon halinde kullanımda endikedir. Lenalidomid ve deksametazon ya da Deksametazon KARFİLİB daha önce bortezomib ve immunmodülatuar ilaç (IMID) içeren en az 1-3 sıra kombinasyon tedavisi uygulanmış relaps ve refrakter multipl miyelom hastalarındaDaratumumab ve deksametazon ile kombinasyon halinde kullanımda endikedir. KARFİLİB daha önce 1 veya daha fazla seri tedavi almış yetişkin relaps veya refrakter multipl miyelom hastalarının tedavisinde tek başına kullanımda endikedir. 4.2 Pozoloji ve uygulama şekliKARFİLİB tedavisi anti-kanser tedavilerinde deneyimli bir doktor tarafından izlenmelidir. Yardımcı madde siklodekstrinin süreli kullanımınm taşıdığı güvenlik riskleri nedeniyle, ürünün 14 günlük tedavi sonrasında, hekim tarafından gerekli değerlendirmenin yapılıp, kullanımadevam edilip edilmeyeceğinin belirlenmesi gerekmektedir. Pozoloji/uygulama sıklığı ve süresi:Uygulamada dikkat edilmesi gereken konularHidrasyon- 1. döngüde dozlama öncesinde, özellikle tümör lizis sendromu (TLS) veya renal toksisite riski yüksek olan hastalarda yeterli hidrasyon gereklidir. Hem oral sıvılar (1.döngü, 1. günden en az 48 saat önce 30 ml/kg) hem de intravenöz sıvılar (1. döngüde herdoz öncesinde 250 mL ila 500 mL uygun intravenöz sıvı) ile hidrasyondüşünülmelidir.KARFİLİB uygulamasının ardından, eğer gerekirse 250 mL ila 500 mL ilaveintravenöz sıvı verilebilir. Sonraki döngülerde oral ve/veya intravenöz sıvı ile hidrasyonagerektikçe devam edilir. Özellikle kalp yetmezliği olan veya kalp yetmezliği riski taşıyanhastalar aşırı miktarda sıvı yüklemesi açısından izlenmelidir ve hidrasyon her hastanıngereksinimlerine göre ayarlanmalıdır (bkz. Bölüm 4.4).Elektrolit izleme -KARFİLİB ile tedavi süresince serum potasyum düzeyleri düzenli olarak izlenmelidir (bkz. Bölüm 4.4).Premedikasyonlar ve Eşlik Eden İlaçlar- Monoterapi için deksametazonun önerilen dozu ile veya kombinasyon tedavisinin parçası olarak uygulanan deksametazon ilepremedikasyon uygulanmalıdır (bkz. Bölüm 4.2). İnfüzyonla ilişkili reaksiyonlarınıninsidansını ve şiddetini azaltmak amacıyla 1. döngü sırasında KARFİLİB'in tümdozlarınının uygulanmasından en az 30 dakika, en fazla 4 saat öncesinde oral veyaintrevanöz yoldan deksametazon uygulanmalıdır (bkz. Bölüm 4.4). Sonraki döngülersırasında bu semptomlar ortaya çıkarsa tekrar deksametazon premedikasyonuuygulanmalıdır.KARFİLİB'in diğer tedaviler ile birlikte kombinasyon halinde uygulanacağı hastalarda tromboprofilaksi sağlanmalıdır (bkz. bölüm 4.4). Herpes zoster reaktivasyonu riskini azaltmak için antiviral profilaksi düşünülmelidir (bkz. bölüm 4.8). Doz hesaplama -Önerilen dozlamaDeksametazon ile kombinasyon halinde KARFİLİB30 dakikalık infüzyonla haftada bir 20/70 mg/m2 rejimi rejimiKARFİLİB Tablo 1'de gösterildiği gibi, hastalık progresyonuna veya kabul edilemez toksisite meydana gelene kadar deksametazon ile kombinasyon halinde her 28 günlük döngünün 1, 8 ve15. Günlerinde 30 dakikalık infüzyon şeklinde intravenöz yolla uygulanır.1. Döngünün 1.Gününde KARFİLİB için önerilen başlangıç dozu 20 mg/m2'dir.Tolere edilirse, 1. Döngünün8. Gününde doz 70 mg/m2'ye çıkarılır.. Deksametazon, KARFİLİB'ten 30 dakika ila 4 saatönce uygulanır. Ek dozaj bilgileri için deksametazonun Ürün Bilgilerine bakın. Tablo 1: Deksametazonla kombinasyon halinde haftada bir KARFİLİB 20/70 mg/m2 (30 dakikalık infüzyon) (30 dakikalık infüzyon)
30 dakikalık infüzyonla haftada iki defa 20/56 mg/m2 rejimiKARFİLİB Tablo 2'de gösterildiği gibi, hastalık progresyonuna veya kabul edilemez toksisite meydana gelene kadar deksametazon ile kombinasyon halinde her 28 günlük döngünün 1, 2, 8,9, 15 ve 16. Günlerinde 30 dakikalık infüzyon şeklinde intravenöz yolla uygulanır. 1. Döngünün1. ve 2. Günlerinde KARFİLİB için önerilen başlangıç dozu 20 mg/m2'dir. Tolere edilirse, 1.Döngünün 8. Gününde doz 56 mg/m2'ye çıkarılır. 28 günlük döngülerin her birinin 1, 2, 8, 9,15, 16, 22 ve 23. Günlerinde ağızdan veya intravenöz yolla 20 mg deksametazon alınır. Deksametazon, KARFİLİB'ten 30 dakika ila 4 saat önce uygulanır. Ek dozaj bilgileri için deksametazonun Ürün Bilgilerine bakın. Tablo2:Deksametazonla kombinasyon halinde haftada iki defa KARFİLİB 20/56 mg/m2 (30 dakikalık infüzyon)(30 dakikalık infüzyon)
Lenalidomid ve deksametazon ile kombinasyon halinde KARFİLİBKARFİLİB Tablo 3'te gösterildiği gibi, 12. Döngüye kadar lenalidomid ve deksametazon ile kombinasyon halinde her 28 günlük döngünün 1, 2, 8, 9, 15 ve 16. Günlerinde 10 dakikalıkinfüzyon şeklinde intravenöz yolla uygulanmalıdır. KARFİLİB için önerilen başlangıç dozu 1.döngünün 1. ve 2. günlerinde 20 mg/m2'dir. Tolere edilirse, 1. döngünün 8. gününde doz 27mg/m2'ye çıkartılmalıdır. KARFİLİB'i 13. döngüden 18. döngüye kadar 1., 2., 15. ve 16.günlerde uygulayınız. 18. döngüden sonra KARFİLİB uygulaması kesilmelidir. Lenalidomidve deksametazona, hastalık progresyonuna veya kabul edilemez toksisite meydana gelene kadardevam edilmelidir. Ek dozaj bilgileri için lenalidomid ve deksametazonun Ürün Bilgilerinebakın. Tablo 3: Lenalidomid ve deksametazon ile kombinasyon halinde haftada iki defa KARFİLİB 20/27 mg/m2 (10 dakikalık infüzyon) (10 dakikalık infüzyon)
a KARFILIB 18. döngüye kadar uygulanmalıdır, sonrasında lenalidomid ve deksametazon ile devam edilmelidir. İntravenöz Daratumumab ve Deksametazon ile Kombinasyon Halinde KARFİLİBHaftada iki defa 30 dakikalık infüzyonla 20/56 mg/m2 rejimi rejimiKARFİLİB Tablo 4'te gösterildiği gibi, hastalık progresyonuna veya kabul edilemez toksisite meydana gelene kadar intravenöz daratumumab ve deksametazon ile kombinasyon halinde her28 günlük döngünün 1, 2, 8, 9, 15 ve 16. Günlerinde 30 dakikalık infüzyon şeklinde intravenözyolla uygulanır. KARFILİB için önerilen başlangıç dozu 1. Döngünün 1 ve 2. Günlerinde 20mg/m2'dir. Tolere edilirse 1. Döngünün 8. Gününde ve sonrasında doz 56 mg/m2'ye çıkarılır.Deksametazon, KARFILİB dozundan 30 dakika ila 4 saat önce ve intravenöz daratumumabdozundan 1 ila 3 saat önce uygulanır. Ek dozaj bilgileri için intravenöz daratumumab vedeksametazonun Ürün Bilgilerine bakın. Tablo 4: İntravenöz Daratumumab ve Deksametazon ile Kombinasyon Halinde Haftada İki Defa KARFİLİB 20/56 mg/m2 (30 Dakikalık İnfüzyon) (30 Dakikalık İnfüzyon)
Haftada bir defa 30 dakikalık infüzyonla 20/70 mg/m2 rejimiKARFİLİB Tablo 5'te gösterildiği gibi, hastalık progresyonuna veya kabul edilemez toksisite meydana gelene kadar intravenöz daratumumab ve deksametazon ile kombinasyon halinde her28 günlük döngünün 1, 8 ve 15. Günlerinde 30 dakikalık infüzyon şeklinde intravenöz yollauygulanmalıdır. KARFİLİB için önerilen başlangıç dozu 1. Döngünün 1. Gününde 20mg/m2'dir. Tolere edilirse, 1. Döngünün 8. Gününde ve sonrasında doz 70 mg/m2'ye çıkarılır.Deksametazon, KARFİLİB dozundan 30 dakika ila 4 saat önce ve intravenöz daratumumabdozundan 1 ila 3 saat önce uygulanır. Ek dozaj bilgileri için intravenöz daratumumab vedeksametazonun Ürün Bilgilerine bakın.
KARFİLİB monoterapisiHaftada iki defa 10 dakikalık infüzyonla 20/27 mg/m2 rejimiKARFİLİB intravenöz yoldan 10 dakikalık infüzyon şeklinde uygulanır (bkz. Bölüm 5.1). 1. döngüden 12. döngüye kadar KARFİLİB Tablo 6'da gösterildiği gibi, her 28 günlük döngünün1, 2, 8, 9, 15 ve 16. Günlerinde uygulanır. 13. döngüden sonra KARFİLİB her 28 günlükdöngünün 1, 2, 15 ve 16. Günlerinde uygulanır. 1. döngüde ve sonrasında gerektikçe infüzyonreaksiyonlarını önlemeye yardımcı olmak için her KARFİLİB dozundan önce 30 dakika ila 4saate kadar süre içinde oral veya intravenöz yoldan 4 mg deksametazon ile ön ilaç uygulamasıyapılır (bkz. Bölüm 4.2). KARFİLİB için önerilen başlangıç dozu, 1. döngünün 1. ve 2. günlerinde 20 mg/m2'dir. Eğer tolere edilirse, 1. döngünün 8. gününde dozu 27 mg/m2'ye yükseltilir. Hastalık progresyonunakadar veya kabul edilemeyen toksisiteye kadar KARFİLİB'e devam edilir. Tablo 6: Haftada iki defa 20/27 mg/m2 KARFİLİB monoterapisi (10 dakikalık infüzyon) KARFİLİB monoterapisi (10 dakikalık infüzyon)
Haftada iki defa 30 dakikalık infüzyonla 20/56 mg/m2 rejimiKARFİLİB intravenöz yoldan 30 dakikalık infüzyon şeklinde uygulanır (bkz. Bölüm 5.1). 1. döngüden 12. döngüye kadar KARFİLİB Tablo 7'de gösterildiği gibi, her 28 günlük döngünün1, 2, 8, 9, 15 ve 16. Günlerinde uygulanır. 13. döngüden sonra KARFİLİB her 28 günlükdöngünün 1, 2, 15 ve 16. Günlerinde uygulanır. 1. döngüde ve ardından gerektikçe infüzyonlailişkili reaksiyonları en aza indirmek için her KARFİLİB dozundan önce 30 dakika ila 4 saatekadar süre içinde oral veya intravenöz yoldan 8 mg deksametazon ile ön ilaç uygulaması yapılır(bkz. Bölüm 4.2). KARFİLİB için önerilen başlangıç dozu 1. döngünün 1. ve 2. günlerinde 20 mg/m2'dir. Eğer tolere edilirse, 1. döngünün 8. gününde doz 56 mg/m2'ye çıkarılır. Hastalık progresyonuna veyakabul edilemez toksisiteye kadar KARFİLİB'e devam edilir.
Advers reaksiyonlar için dozaj modifikasyonlarıKARFİLİB için öneriler ve dozaj modifikasyonları Tablo 8'de verilmiştir. Doz düzeyi azaltımları Tablo 9'da sunulmaktadır. Lenalidomid, intravenöz daratumumab vedeksametazonun dozaj modifikasyonları için Ürün Bilgilerine ayrıca bakılmalıdır. Tablo 8: Advers reaksiyonlara için dozaj modifikasyonları için dozaj modifikasyonları
Trombosit sayısı 10 x 109/l'den az veya trombositopeni ile birlikte kanamabulgusu
Doz kesilmelidir - 10 X 109/l'den yüksek veya bu düzeyeeşit iyileşme olursa ve/veya kanamakontrol altına alınırsa aynı dozdüzeyinde devam edilmelidir - Sonraki 10 x 109/1'nin altına düşüşleriçin yukarıdaki önerilerin aynısıuygulanmalıdır ve yeniden KARFİLİBbaşlarken 1 doz düzeyi azaltımıdüşünülmelidira Renal toksisite (bkz. bölüm 4.4)Önerilen aksiyon Serum kreatinin başlangıç düzeyinin 2katından büyük veya buna eşit; veya Kreatinin klirensinin 15 mL/dak'dan azveya kreatinin klirensinin başlangıçdüzeyinin %50'sinin altına veya budüzeye inmesi veya hemodiyalizgerekmesi Doz kesilmelidir ve renal fonksiyonizlemeye devam edilmelidir (serumkreatinin veya kreatinin klirensi) - KARFİLİB ile ilişkiliyse,renal fonksiyon başlangıç düzeyinin %25'i dahiline iyileştiğinde devam edilmelidir;1 doz düzeyi azaltımla başlanılmalıdıra - KARFİLİB ile ilişkili değilse, hekimintakdirine göre dozlamaya devamedilebilir KARFİLİB alan hemodiyaliz hastalarındadoz, hemodiyaliz prosedüründen sonrauygulanmalıdır Diğer hematolojik olmayan toksisite (bkz. bölüm 4.8)Önerilen aksiyon Diğer tüm şiddetli veya yaşamı tehdit edenb hematolojik olmayan toksisiteler Düzelene veya başlangıca dönene kadarkesilmelidir Bir sonraki planlanmış tedaviye 1 dozdüzeyi azaltımıyla yeniden başlanmasıdüşünülmelidir MNS = mutlak nötrofil sayısı a Doz düzeyi azaltımları için bkz. Tablo 9.b CTCAE 3 ve 4. Derece Tablo 9: Advers reaksiyonlar için doz düzeyi azaltımları
Karaciğer yetmezliği için dozaj modifikasyonlarıHafif (normalin üst sınırının (ULN) 1 ila 1,5 katı total bilirubin ve herhangi bir AST düzeyi veya total bilirubin < ULN ve AST > ULN) veya orta derece (total bilirubin > 1,5 - 3xULN veherhangi bir AST düzeyi) karaciğer yetmezliği olan hastalarda KARFİLİB dozu %25 oranındaazaltılmalıdır (bkz. Bölüm 4.2 ve 5.2). Son Evre Böbrek Hastalığı (SEBH) için Önerilen DozajSEBH bulunan ve hemodiyalize giren hastalarda, KARFİLİB hemodiyaliz prosedüründen sonra uygulanmalıdır. Uygulama şekli:İntravenöz yoldan uygulanır. Hazırlanmasına ve kullanımına ilişkin talimatlar, bölüm 6.6'da verilmiştir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Hemodiyaliz uygulanan SEBH hastalarında karfilzomibin AUC değeri böbrek fonksiyonu normal olan hastalara göre %33 oranında daha yüksek gözlenmiştir. Karfilzomibkonsantrasyonlarının hemodiyaliz klirensi araştırılmamış olduğundan, ilaç hemodiyalizprosedüründen sonra uygulanmalıdır. Karaciğer yetmezliği:Hafif (normalin üst sınırının (ULN) 1 ila 1,5 katı total bilirubin ve herhangi bir AST düzeyi veya total bilirubin < ULN ve AST > ULN) veya orta derece (total bilirubin > 1,5 - 3^ULN veherhangi bir AST düzeyi) karaciğer yetmezliği olan hastalarda KARFİLİB dozu %25 oranındaazaltılmalıdır. Şiddetli karaciğer yetmezliği (total bilirubin > 3 x ULN ve herhangi bir ASTdüzeyi) olan hastalarda KARFİLİB için önerilen doz belirlenmemiştir (bkz. bölüm 4.2 ve 5.2). Ciddi advers reaksiyon insidansı hafif, orta derece ve şiddetli karaciğer yetmezliği olan hastalarda (22/35 veya %63) karaciğer fonksiyonu normal olan hastalara (3/11 veya %27) göredaha yüksek bulunmuştur (bkz. Bölüm 4.4 ve 5.2). Geriyatrik popülasyon:Karfilzomibe ilişkin klinik çalışmalarda, 2.387 hastanın %51'i 65 yaş ve üzerindedir ve %14'ü 75 yaş ve üzerindedir. 65 yaş altı hastalarda ciddi advers reaksiyonların insidansmın %49, 65ila 74 yaş arasındaki hastalarda %58 ve 75 yaş ve üzeri hastalarda %63 olduğu görülmüştür.CANDOR çalışmasında DKd alan 308 hastanın %47'si 65 yaş ve üzerindeyken %9'u 75 yaşve üzerindedir. CANDOR çalışmasının DKd kolundaki ölümcül advers reaksiyonlar, 65 yaşaltı hastaların %6'sında, 65 ila 74 yaş arasındaki hastaların %14'ünde ve 75 yaş ve üzerihastaların %14'ünde meydana gelmiştir (bkz. bölüm 4.8). Daha yaşlı ve daha genç hastalararasında etkililik açısından genel olarak bir fark gözlenmemiştir. Pediyatrik popülasyon:Pediyatrik hastalarda karfilzomibin güvenliliği ve etkililiği belirlenmemiştir. 4.3 Kontrendikasyonlar Etkin maddeye veya bölüm 6.1'de listelenmiş olan yardımcı maddelerin herhangi birinekarşı aşırı duyarlılık Emziren kadınlar (bkz. Bölüm 4.6) 4.4 Özel kullanım uyarıları ve önlemleriKARFİLİB diğer tıbbi ürünler ile kombinasyon halinde uygulandığından KARFİLİB ile tedaviye başlamadan önce söz konusu diğer tıbbi ürünlere ait kısa ürün bilgileri incelenmelidir.KARFİLİB ile kombinasyon halinde lenalidomid kullanılabileceği için lenalidomid gebeliktesti ve önleme gerekliliklerine özellikle dikkat edilmesi gerekmektedir (bkz. Bölüm 4.6). Kardiyak toksisitelerKarfilzomib uygulamasının ardından, yeni başlayan veya önceden mevcut olup kötüleşen kalp yetmezliği (örneğin konjestif kalp yetmezliği, pulmoner ödem, düşük ejeksiyon fraksiyonu),kardiyomiyopati ve fataliteler dahil miyokard iskemisi ve miyokard enfarktüsü meydanagelmiştir. Bazı olaylar başlangıç ventrikül fonksiyonu normal olan hastalarda meydanagelmiştir. Karfilzomib ile yapılan klinik çalışmalarda, bu olaylar karfilzomib tedavisininuygulanması boyunca meydana gelmiştir. Karfilzomib uygulamasından sonraki bir güniçerisinde kardiyak areste bağlı ölüm meydana gelmiştir. Kombinasyon tedavilerine ilişkinrandomize, açık etiketli, çok merkezli çalışmalarda kalp yetmezliği olaylarının insidansı %8 vearitmilerin insidansı (büyük bir kısmı atriyal fibrilasyon ve sinüs taşikardisi olan) %8 olmuştur(bkz. Bölüm 4.8). Hastalar kalp yetmezliği veya kardiyak iskemi klinik belirtileri veya semptomları için izlenmelidir. Kardiyak toksisite şüphesi varsa hemen değerlendirme yapılmalıdır. 3. veya 4.derece kardiyak advers reaksiyonların görülmesi durumunda KARFİLİB bu olaylar düzelenekadar durdurulmalıdır ve yarar/risk değerlendirmesinin sonucuna göre KARFİLİB'i 1 dozdüzeyinde azaltarak tekrar başlanıp başlanılmamasına karar verilmelidir (bkz. Bölüm 4.2). 1. döngüde her dozdan önce yeterli sıvı yüklemesi gereklidir, fakat tüm hastalar ve özellikle kalp yetmezliği olan hastalar fazla miktarda sıvı yüklenmesine karşı da izlenmelidir.Başlangıçta kalp yetmezliği olan veya kalp yetmezliği riski taşıyan hastalarda total sıvı alımıklinik olarak uygun şekilde düzenlemelidir (bkz. Bölüm 4.2). 75 yaş ve üzerindeki hastalarda kalp yetmezliği riski daha genç hastalara göre daha yüksektir. New York Kalp Derneği (New York Heart Association (NYHA)) sınıflamasına göre Sınıf IIIve IV kalp yetmezliği olan, yakın zamanda miyokard enfarktüsü geçirmiş olan ve tıbbi ilaçlarlakontrol edilemeyen ileti anomalileri, angina veya aritmileri olan hastalar klinik çalışmalaradahil edilmemiştir. Bu hastalarda kardiyak komplikasyonların gelişme riski daha yüksektir. Buhastalar için KARFİLİB ile tedaviye başlamadan önce kapsamlı bir tıbbi değerlendirme (kanbasıncı kontrolü ve sıvı yönetimini içeren) tamamlanmalı ve bu hastalar yakından takipedilmelidir. Elektrokardiyografik değişikliklerKlinik çalışmalarda QT intervalinde uzama saptanan olgular bildirilmiştir. Karfilzomibin QT intervali üzerindeki etkisi gözardı edilmemelidir (bkz. Bölüm 5.1). Akut böbrek yetmezliğiKarfilzomib kullanan hastalarda akut böbrek yetmezliği olguları meydana gelmiştir. Bu olgulardan bazıları ölümle sonuçlanmıştır. Karfilzomib kullanan hastaların yaklaşık %9'undaböbrek yetersizliği (böbrek yetmezliğini de içeren) meydana gelmiştir. Karfilzomibmonoterapisi uygulanan ileri evre relaps ve refrakter multipl miyelomlu hastalarda akut böbrekyetmezliğinin daha sık görüldüğü bildirilmiştir. Başlangıç tahmini kreatinin klirensi düşük(Cockcroft-Gault denklemi kullanarak hesaplanır) olan hastalarda ölümcül böbrek yetmezliğiriski daha yüksektir. Renal fonksiyon, serum kreatininin ve/veya tahmini kreatinin klirensininölçümüyle düzenli olarak izlenmelidir. Doz uygun şekilde azaltılmalı veya kesilmelidir (bkz.Bölüm 4.2). Tümör lizis sendromuKarfilzomib ile tedavi gören hastalarda ölümcül sonuçlar da görülebilen TLS olguları bildirilmiştir. Yüksek tümör yükü olan multipl miyelomlu hastalarda TLS riskinin daha fazlaolduğu dikkate alınmalıdır. 1. döngüde ve gerektiğinde takip eden döngülerde, KARFİLİBverilmeden önce intravenöz sıvılar uygulanmalıdır. TLS riski altında olan hastalarda ürik asitazaltıcı ilaçlar düşünülmelidir. Tedavi sırasında hastalar TLS kanıtları yönünden izlenmeli vebunların bulunması durumunda TLS düzelene kadar KARFİLİB'e ara vermek de dahil hızlıcatedavi edilmelidir (bkz. Bölüm 4.2). Pulmoner toksisiteKarfilzomib alan hastaların yaklaşık %2'sinde Akut Solunum Sıkıntısı Sendromu (Acute Respiratory Distress Syndrome (ARDS)) ve akut solunum yetmezliği meydana gelmiştir.Ayrıca, karfilzomib kullanan hastaların yaklaşık %2'sinde pnömoni ve interstisyel akciğerrahatsızlığı gibi akut diffüz infiltratif pulmoner hastalıklar da görülmüştür. Bu olgulardanbazıları ölümle sonuçlanmıştır. İlaca bağlı pulmoner toksisite durumunda KARFİLİBkesilmelidir. Pulmoner hipertansiyonKarfilzomib kullanan hastaların yaklaşık %2'sinde pulmoner arteriyel hipertansiyon rapor edilmiştir; %1'inden azında 3. derece veya üzerindedir. Hastalar kardiyak görüntüleme ve/veyagereken diğer testlerle değerlendirilmelidir. Pulmoner hipertansiyon durumunda olay düzeleneveya başlangıç durumuna dönene kadar KARFİLİB durdurulmalı ve yarar/risk değerlendirmesiesas alınarak KARFİLİB'in yeniden başlanıp başlanmamasına karar verilmelidir (bkz. Bölüm4.2). DispneKarfilzomib ile tedavi edilen hastaların %25'inde dispne rapor edilmiştir; %4'ünde 3. derece veya üzerindedir. Kalp yetmezliği ve pulmoner sendromlar gibi kardiyopulmoner hastalıklarıdışlamak için dispne değerlendirmesi yapılmalıdır. 3 veya 4. derece dispne olduğunda düzeleneveya başlangıç durumuna dönene kadar KARFİLİB tedavisi durdurulmalıdır. Yarar/riskdeğerlendirmesi esas alınarak KARFİLİB'in yeniden başlanıp başlanmamasına kararverilmelidir (bkz. Bölüm 4.4 ve 4.8). HipertansiyonKarfilzomib tedavisi ile hipertansif kriz ve acil hipertansif tablo dahil olmak üzere hipertansiyon gözlenmiştir. ASPIRE çalışmasında hipertansiyon olaylarının insidansı KRdkolunda %17, Rd kolunda ise %9 olmuştur. ENDEAVOR çalışmasında hipertansiyonolaylarının insidansı Kd kolunda %34, Vd kolunda ise %11 olmuştur. CANDOR çalışmasındahipertansiyon olaylarının insidansı DKd kolunda %31, Kd kolunda ise %28 olmuştur. Buolgulardan bazılarının ölümcül olduğu kaydedilmiştir. Karfilzomibe başlamadan önce kanbasıncı optimize edilmelidir. KARFİLİB almakta olan tüm hastalarda kan basıncı düzenliolarak izlenmelidir. Hipertansiyonun yeterince kontrol edilemediği durumlarda KARFİLİBkesilmeli ve değerlendirme yapılmalıdır. Yarar/risk değerlendirmesi esas alınarak KARFİLİB'eyeniden başlayıp başlamamak düşünülmelidir. Venöz trombozKarfilzomib ile venöz tromboembolik olaylar (derin ven trombozunu ve pulmoner emboliyi içerecek şekilde) gözlenmiştir. Her iki kolda tromboprofilaksi kullanılan ASPIRE çalışmasındailk 12 döngüde venöz tromboembolik olayların insidansı KRd kolunda %13, Rd kolunda ise%6 olmuştur. ENDEAVOR çalışmasında venöz tromboembolik olayların insidansı 1 ila 6aylarda Kd kolunda %9, Vd kolunda ise %2 olmuştur. Karfilzomib monoterapisi ile venöztromboembolik olayların insidansı %2 olmuştur. Karfilzomib'in lenalidomid ve deksametazon; deksametazon veya intravenöz daratumumab ve deksametazon ile kombinasyon halinde uygulanacağı hastalar için tromboprofilaksiuygulanmalıdır. Tromboprofilaksi rejimi, hastanın altta yatan riskleri esas alınarak seçilmelidir. Oral kontraseptifler veya tromboz riskiyle ilişkili hormonal gebelikten korunma yöntemi kullanan hastalar için kombinasyon halinde KARFİLİB uygulandığında, tedavi sırasındagebelikten korunmak için hormonal olmayan bir yöntem düşünülmelidir (bkz. Bölüm 4.6). İnfüzyonla ilişkili reaksiyonlarKarfilzomib alan hastalarda yaşamı tehdit eden reaksiyonlar da dahil, infüzyonla ilişkili reaksiyonlar meydana gelmiştir. Belirti ve semptomlar arasında ateş, ürperme, artralji, miyalji,yüzde ateş basması, yüzde ödem, laringeal ödem, kusma, güçsüzlük, nefes darlığı,hipotansiyon, senkop, göğüs sıkışması veya angina yer alır. Bu reaksiyonlar, karfilzomibuygulamasından hemen sonra veya 24 saat içinde meydana gelebilir. İnfüzyonla ilişkilireaksiyonların insidansını ve şiddetini azaltmak amacıyla KARFİLİB öncesinde deksametazonuygulanmalıdır (bkz. Bölüm 4.2 ve 4.8). HemorajiKarfilzomib ile tedavi edilen hastalarda ölümcül veya ciddi hemoraji vakaları rapor edilmiştir (bkz. bölüm 4.8). Hemorajik olaylar gastrointestinal, pulmoner ve intrakraniyal hemorajiyi veepistaksisi içermiştir. Kanama spontan olabilir ve intrakraniyal hemoraji travma olmadanmeydana gelmiş olabilir. Hemoraji trombosit sayımları düşük veya normal olan hastalardabildirilmiştir. Hemoraji ayrıca antitrombosit tedavisi veya antikoagülasyon uygulanmayanhastalarda da bildirilmiştir. Kan kaybına ilişkin belirtiler ve semptomlar hemendeğerlendirilmelidir. Doz uygun şekilde azaltılmalı veya kesilmelidir (bkz. Bölüm 4.2). TrombositopeniKarfilzomib, en düşük trombosit değerinin her bir 28 günlük döngünün 8. ve 15. günleri arasında gözlendiği ve trombosit sayısının genellikle bir sonraki döngünün başından öncebaşlangıç değerine döndüğü trombositopeniye neden olmaktadır (bkz. Bölüm 4.8). Karfilzomibile yapılan klinik çalışmalarda hastaların yaklaşık %32'sinde trombositopeni rapor edilmiştir.Hemoraji meydana gelebilir (bkz. bölüm 4.4 ve 4.8). KARFİLİB ile tedavi sırasında trombositsayımları sık sık izlenmelidir. Doz uygun şekilde azaltılmalı veya kesilmelidir (bkz. Bölüm4.2). Hepatik toksisite ve hepatik yetmezlikKarfilzomib ile tedavi sırasında ölümcül olgular dahil olmak üzere, hepatik yetmezlik olguları bildirilmiştir (%2). KARFİLİB serum transaminazlarının yükselmesine neden olabilir (bkz.bölüm 4.8). Başlangıç değerleri dikkate alınmadan, karaciğer enzimleri düzenli olarakizlenmelidir. Doz uygun şekilde azaltılmalı veya kesilmelidir (bkz. Bölüm 4.2). Trombotik mikroanjiyopatiKarfilzomib ile tedavi gören hastalarda trombotik trombositopenik purpura ve hemolitik üremik sendrom (TTP/HUS) da dahil olmak üzere trombotik mikroanjiyopati olguları bildirilmiştir. Buolgulardan bazılarının ölümcül olduğu kaydedilmiştir. TTP/HUS belirtileri ve semptomlarıizlenmelidir. Tanıdan şüpheleniliyorsa KARFİLİB kullanımı sonlandırılmalı ve değerlendirmeyapılmalıdır. TTP/HUS tanısı dışlandığında KARFİLİB kullanımına tekrar başlanabilir. Önceden TTP/HUS gelişmiş olan hastalarda karfılzomib tedavisinin yeniden başlatılmasının güvenliliği bilinmemektedir. Posterior geri dönüşlü ensefalopati sendromuKarfılzomib ile tedavi gören hastalarda posterior geri dönüşlü ensefalopati sendromu (PRES) olguları rapor edilmiştir. Daha önce geri dönüşlü posterior lökoensefalopati sendromu (RPLS)olarak adlandırılmış olan PRES bir nörolojik bozukluk olup nöbet, baş ağrısı, letarji, konfüzyon,körlük, bilinç düzeyinde değişimler ve başka görme bozuklukları ve nörolojik rahatsızlıklarlaberaber hipertansiyonla kendini belli edebilmektedir. Tanı nöro-radyolojik görüntülemeyle(MRI) doğrulanmaktadır. PRES'ten kuşkulanıldığında KARFİLİB kesilmeli vedeğerlendirilmelidir. Daha önce PRES gelişen hastalarda karfilzomib terapisine yenidenbaşlanmanın güvenliliği bilinmemektedir. Progresif multifokal lökoensefalopatiKarfilzomib ile ölümcül olabilen progresif multifokal lökoensefalopati (PML) bildirilmiştir. Karfilzomib dışında, bu duruma katkıda bulunabilecek diğer olası faktörler arasındaimmünosüpresyona yol açabilecek immünosüpresif tedavinin önceden veya eşzamanlıkullanımı yer almaktadır. Yeni başlangıçlı nörolojik bulgu veya semptomları olan ya daönceden var olan nörolojik bulgu veya semptomlarında değişiklik görülen tüm hastalarda PMLdüşünülmelidir. PML şüphesi olduğu takdirde, KARFİLİB kesilmeli ve nörolojikonsültasyonunu da içeren PML değerlendirmesi başlatılmalıdır. Transplant için uygun olmayan yeni tanı konmuş hastalarda melfalan ve prednizon ile kombinasyon halinde ölümcül ve ciddi toksisitelerde artışTransplant için uygun olmayan yeni tanı konmuş multipl miyelomlu 955 hastanın karfilzomib (20/36 mg/m2, altı haftalık siklusların dört haftasında haftada iki kez 30 dakikalık infüzyonolarak) melfalan ve prednizon (KMP) veya bortezomib, melfalan ve prednizon (VMP)kullanacak şekilde randomize edildiği bir klinik çalışma olan CLARION çalışmasında KMPkolunda VMP kolundaki hastalarla karşılaştırıldığında sırasıyla ölümcül advers reaksiyonlar(%7'ye karşı %4) ve ciddi advers reaksiyonların (%50'ye karşı %42) insidansının daha yüksekolduğu gözlenmiştir. KMP kolundaki hastalarda kalp yetmezliği (%11'e karşı %4),hipertansiyon (%25'e karşı %8), akut böbrek yetmezliği (%14'e karşı %6) ve dispneyi (%18'ekarşı %9) de içeren herhangi bir derecede advers reaksiyonların insidansının daha yüksekolduğu gözlenmiştir. Bu çalışmada KMP kolunda primer sonuç ölçütü olan progresyonsuzsağkalım (PFS) üstünlüğü karşılanmamıştır. Transplant için uygun olmayan yeni tanı konmuşmultipl miyelomlu hastalarda KARFİLİB melfalan ve prednizon ile kombine kullanımdaendike değildir. Embriyo-fetal toksisiteEtki mekanizması ve hayvanlarda elde edilmiş bulgular ışığında karfilzomib, hamile kadınlara uygulandığında fetüse zarar verebilir. Karfilzomib organogenez döneminde gebe tavşanlaraVYA esas alınıp 27 mg/m2'lik klinik dozun yaklaşık %40'ı düzeyinde bir dozda intravenözyolla uygulandığında implantasyon sonrası kayba ve fetüs ağırlığında azalmaya nedenolmuştur. Gebe kadınlar fetüse yönelik potansiyel risk konusunda bilgilendirilmelidir. Üreme potansiyeli olan kadınlara KARFİLİB tedavisi sırasında ve son dozu takip eden 6 ay süresince doğumkontrol yöntemi uygulamaları tavsiye edilmelidir. Üreme potansiyeline sahip kadın partneriolan erkeklere KARFİLİB ile tedavileri sırasında ve son dozu takip eden 3 ay süresince doğumkontrol yöntemi uygulamaları tavsiye edilmelidir (bkz. Bölüm 4.6 ve 5.3). KontrasepsiyonÇocuk doğurma potansiyeli bulunan kadın hastalar, gebeliği önlemek için tedavi sırasında ve tedavinin tamamlanmasının ardından 6 ay süreyle etkili doğum kontrol yöntemleri kullanmalıveya cinsel ilişkiden kaçınmalıdır. Üreme potansiyeli bulunan erkek hastalar, gebeliği önlemekiçin tedavi sırasında ve tedavinin tamamlanmasının ardından 3 ay süreyle etkili doğum kontrolyöntemleri kullanmalı veya cinsel ilişkiden kaçınmalıdır (bkz. Bölüm 4.6). Karfilzomib oralkontraseptiflerin etkililiğini azaltabilir (bkz. bölüm 4.5). Sodyum içeriğiBu tıbbi ürün sulandırılmış çözeltinin her ml'sinde 0,3 mmol (7,2 mg) sodyum içermektedir. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. Yardımcı madde siklodekstrinin süreli kullanımının taşıdığı güvenlik riskleri nedeniyle, ürünün 14 günlük tedavi sonrasında, hekim tarafından gerekli değerlendirmenin yapılıp, kullanımadevam edilip edilmeyeceğinin belirlenmesi gerekmektedir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriKarfilzomib ağırlıklı olarak peptidaz ve epoksit hidrolaz aktiviteleri aracılığıyla metabolize edilir ve sonuç olarak, karfilzomibin farmakokinetik profilinin sitokrom P450 inhibitörleri veindükleyicilerinin eş zamanlı uygulamasından etkilenmesi olası değildir. In vitroçalışmalar karfilzomibin kültürlenmiş insan hepatositlerinde insan CYP3A4'ü indüklemediğini göstermiştir. CYP3A probu olarak oral midazolamın kullanıldığı bir klinikçalışma, midazolamın farmakokinetiğinin eş zamanlı karfilzomib uygulamasındanetkilenmediğini ortaya koyarak karfilzomibin CYP3A4/5 substratlarının metabolizmasınıinhibe etmesinin beklenmediğini ve insan gönüllülerde CYP3A4 indükleyicisi olmadığınıgöstermiştir. Bununla birlikte, karfilzomibin terapötik konsantrasyonlarda CYP1A2, 2C8, 2C9,2C19 ve 2B6'nın indükleyicisi olup olmadığı bilinmemektedir. Karfilzomib, bu enzimlerinsubstratları olan oral kontraseptifler gibi tıbbi ürünlerle birlikte uygulandığında dikkatliolunmalıdır. Gebeliği önlemeye yönelik etkili önlemler alınmalıdır (bkz. Bölüm 4.6), hasta oralkontraseptifler kullanıyorsa alternatif bir etkili doğum kontrol yöntemi kullanılmalıdır.Karfilzomib CYP1A2, 2B6, 2C8, 2C9, 2C19 ve 2D6'yı in vitro inhibe etmez ve bu nedenle, inhibisyon sonucu olarak bu enzimlerin substratları olan tıbbi ürünlerin maruziyetini etkilemesibeklenmez. Karfilzomib bir P-glikoprotein (P-gp) substratıdır ancak BCRP substratı değildir. Bununla birlikte, karfilzomibin intravenöz olarak uygulandığı ve büyük ölçüde metabolize olduğudikkate alındığında, karfilzomibin farmakokinetik profilinin P-gp veya BCRP inhibitörleri veyaindükleyicilerinden etkilenmesi olası değildir. İn vitro,terapötik dozlarda beklenenlerden dahadüşük konsantrasyonlarda (3 pM), karfilzomib P-gp substratı olan digoksinin hücre dışınataşınmasını %25 oranında inhibe eder. Karfilzomib, P-gp substratlarıyla (örn. digoksin,kolşisin) birlikte uygulandığında dikkatli olunmalıdır.I^n vitro,Özel popülasyonlara ilişkin ek bilgiler:Özel popülasyonlara ilişkin etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin etkileşim çalışması yapılmamıştır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi:Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Üreme potansiyeli olan kadınlara KARFİLİB tedavisi sırasında ve son dozu takip eden en az 6 ay boyunca etkili doğum kontrolü uygulamaları tavsiye edilmelidir. Karfilzomib tedavisi sırasında oral kontraseptiflerin etkililiğinin azalma olasılığı dışlanamaz (bkz. Bölüm 4.5). Ayrıca, karfilzomib ile ilişkili venöz tromboembolik olaylar riskindeki artışnedeniyle, kadınlar karfilzomib ile tedavi sırasında tromboz riski taşıyabilen hormonalkontraseptiflerin kullanımından kaçınmalıdır (bkz. Bölüm 4.4 ve 4.8). Hasta mevcut durumdaoral kontraseptifler veya tromboz riski taşıyabilen hormonal kontrasepsiyon kullanıyorsa,alternatif etkili doğum kontrol yöntemine geçmelidir. Üreme potansiyeli bulunan ve kadın cinsel partneri olan erkeklere, KARFİLİB tedavisi sırasında ve son dozu takip eden en az 3 ay boyunca etkili doğum kontrolü uygulamaları tavsiyeedilmelidir. Gebelik dönemiKarfilzomibin gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. Gebelik testi, üreme potansiyeli bulunan kadınlara, KARFİLİB tedavisi başlanmadan uygulanmalıdır. KARFİLİB gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Etki mekanizmasına ve hayvanlardaki bulgulara dayanarak karfilzomib fetüse zarar verebilir. İlaçla ilişkili risklerideğerlendirmek üzere gebe kadınlarda karfilzomib kullanımına ilişkin herhangi bir veribulunmamaktadır. Karfilzomib tavşanlarda klinik dozdan daha düşük dozlarda embriyo-fetalölümlere neden olmuştur. Gebe kadınlara fetüs açısından söz konusu olan potansiyel riskkonusunda bilgi verilmelidir. Endikasyon bulunan popülasyonun majör doğum kusurları ve düşüğe ilişkin tahmini arka plan riski bilinmemektedir. Tüm hamileliklerde doğum kusuru, kayıp veya diğer advers sonuçlarailişkin bir arka plan risk söz konusudur. Lenalidomid, yapısal açıdan talidomid ile bağlantılıdır. Talidomid, ciddi ve hayatı tehdit edici doğum kusurlarına sebep olduğu bilinen bir insan teratojenik aktif maddedir. Lenalidomidgebelik sırasında alınırsa lenalidomidin insanlarda teratojenik etki göstermesi beklenir.Hastanın çocuk doğurma potansiyelinin bulunmadığına dair güvenilir kanıt olmadığı takdirdetüm hastalar lenalidomid için Gebeliği Önleme Programının şartlarına uymalıdır. Lütfen güncellenalidomid kısa ürün bilgisine bakınız. Laktasyon dönemiKarfilzomibin anne sütündeki varlığı, emzirilen çocuğa ve ilacın süt üretimine etkisi hakkında veri bulunmamaktadır. Emzirilen bir çocukta ciddi advers reaksiyon potansiyelinden dolayı birönlem olarak, KARFİLİB ile tedavi sırasında ve tedaviden sonra 2 hafta süreyle emzirmekontrendikedir. Üreme yeteneği/FertiliteEtki mekanizması ışığında karfilzomib, erkek veya kadın fertilitesi üzerinde etki gösterebilir (bkz. Bölüm 5.1 ve 5.3). Karfilzomibin insan fertilitesi üzerindeki etkisine ilişkin veri mevcutdeğildir. 4.7 Araç ve makine kullanımı üzerindeki etkilerKarfilzomibin araç ve makine kullanımı üzerine minör etkisi vardır. Klinik çalışmalarda yorgunluk, baş dönmesini de içeren sersemlik hali, baygınlık, bulanık görme, uyku hali ve/veya tansiyon düşmesi gözlenmiştir. KARFİLİB tedavisi gören hastalar busemptomlardan biri ile karşılaşırlarsa araç veya makine kullanmamaları tavsiye edilmelidir. 4.8 İstenmeyen etkilerGüvenlilik profilinin özetiKARFİLİB tedavisi sırasında meydana gelebilecek ciddi advers reaksiyonlar şunları içerir: kalp yetmezliği, miyokard enfarktüsü, kardiyak arest, miyokard iskemisi, interstisyel akciğerhastalığı, pnömonit, akut solunum sıkıntısı sendromu, akut solunum yetmezliği, pulmonerhipertansiyon, dispne, hipertansif krizler dahil hipertansiyon, akut böbrek hasarı, tümör lizissendromu, infüzyonla ilişkili reaksiyon, gastrointestinal kanama, intrakraniyal kanama,pulmoner kanama, trombositopeni, karaciğer yetmezliği, PRES, trombotik mikroanjiyopati veTTP/HUS. Karfilzomib ile yapılan klinik çalışmalarda kardiyak toksisite ve dispne tipik olarakkarfilzomib tedavisinin başlarında meydana gelmiştir (bkz. Bölüm 4.4). En yaygın adversolaylar (gönüllülerin %20'sinden fazlasında meydana gelen) şunlar olmuştur: anemi,yorgunluk, trombositopeni, bulantı, ishal, pireksi, dispne, solunum yolu enfeksiyonu, öksürükve nötropeni. 20 mg/m2 düzeyindeki ilk karfilzomib dozlarının ardından, doz ASPIRE çalışmasında 27 mg/m2'ye ve ENDEAVOR çalışmasında 56 mg/m2'ye yükseltilmiştir (bkz. Bölüm 5.1).ENDEAVOR çalışmasının karfilzomib ve deksametazon (Kd) kolunda meydana gelen adversreaksiyonlar ile ASPIRE çalışmasının karfilzomib, lenalidomid ve deksametazon (KRd)kolunda meydana gelen advers reaksiyonlar arası karşılaştırması, aşağıdaki adversreaksiyonlarda dozla potansiyel ilişki olabileceğini ortaya koymuştur: kalp yetmezliği (Kd%8,2, KRd %6,4), dispne (Kd %30,9, KRd %22,7), hipertansiyon (Kd %25,9, KRd %15,8) vepulmoner hipertansiyon (Kd %1,3, KRd %0,8). Karfilzomib'in daratumumab ve deksametazon (KdD) ile kombinasyon halinde uygulanmasının, deksametazon ile kombinasyon halindeki karfilzomib (Kd) ile karşılaştırıldığıCANDOR çalışmasında (bkz. bölüm 5.1), herhangi bir çalışma tedavisinin son dozundansonraki 30 gün içinde gerçekleşen advers olaylara bağlı ölümler, KdD kolundaki hastaların%10'unda ve Kd kolundaki hastaların ise %5'inde meydana gelmiştir. İki koldaki (KdD'yekarşı Kd) hastalarda gerçekleşen ölüm olaylarının en yaygın nedeni, enfeksiyonlar (%5'e karşı%3) olmuştur. Tedavi ile ortaya çıkan ölümcül advers olay riski, 65 yaş ve üzeri hastalarda dahayüksek olmuştur. KdD kolundaki hastaların %56'sında ve Kd kolundaki hastaların %46'sındaciddi advers olaylar bildirilmiştir. Kd koluna kıyasla KdD kolunda bildirilen en yaygın ciddiadvers olaylar; anemi (%2'ye karşı %1), ishal (%2'ye karşı %0), pireksi (%4'e karşı %2),pnömoni (%12'ye karşı %9), influenza (%4'e karşı %1), sepsis (%4'e karşı %1) ve bronşit(%2'ye karşı %0) olmuştur. Advers reaksiyonların tablo halinde listesiAdvers reaksiyonlar aşağıdaki sistem organ sınıfı ve sıklık kategorisine göre sunulmaktadır (bkz. Tablo 10). Sıklık kategorileri havuzlanmış klinik çalışmalardan oluşan veri kümesindeher advers reaksiyon için rapor edilen kaba insidans oranından belirlenmiştir (n = 3.878). Hersistem organ sınıfı ve sıklık kategorisinde advers olaylar azalan ciddiyet sırasına göresunulmaktadır. Advers reaksiyonların insidansı, sistem organ sınıfları ve sıklık esas alınarak aşağıda listelenmiştir. Sıklık şu şekilde tanımlanır: Çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10);yaygın olmayan (> 1/1.000 ila < 1/100); seyrek (> 1/10.000 ila < 1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Tablo 10: Advers reaksiyonların tablo halinde listesi
Seçilmiş advers reaksiyonların tanımlanmasıKalp yetmezliği, miyokard enfarktüsü ve miyokard iskemisiKarfilzomib ile ilgili klinik çalışmalarda hastaların yaklaşık %5'inde kalp yetmezliği (hastaların yaklaşık %3'ünde 3. derece ve üstü olgu gelişmiştir), yaklaşık %1'inde miyokardenfarktüsü (hastaların yaklaşık %1'inde 3. derece ve üstü olgu gelişmiştir) ve %1'inde ve dahaazında miyokard iskemisi (hastaların %1'inden daha azında 3. derece ve üstü olgu gelişmiştir)bildirilmiştir. Bu olgular tipik olarak karfilzomib tedavisinin erken döneminde (< 5 döngü) meydana gelmiştir. Karfilzomib tedavisi sırasında kardiyak bozuklukların klinik tedavisi için bkz. Bölüm 4.4. CANDOR çalışmasında, başlangıçta vasküler bozuklukları veya başlangıçta hipertansiyonu olan hastalardan oluşan alt gruptaki kardiyak bozuklukların (tüm ve herhangi bir derece olgu)genel insidansı, sırasıyla %29,9'a karşı %19,8 (KdD'ye karşı Kd) ve %30,6'ya karşı %18,1olmuştur. Ölümcül kardiyak olgular için insidans, sırasıyla %1,9'a karşı %0,0 (KdD'ye karşıKd) ve %1,5'e karşı %0,0 olmuştur. Başlangıçta vasküler bozuklukları veya başlangıçtahipertansiyonu olan hastalardan oluşan alt grupta KdD ve Kd kolları arasında bildirilen farktatek bir kardiyak olgu tipi dikkate alınmamıştır. DispneKarfilzomib ile ilgili klinik çalışmalarda hastaların yaklaşık %30'unda dispne bildirilmiştir. Dispne advers reaksiyonlarının çoğunluğu ciddi olmamış (hastaların %5'inden daha azında 3.derece ve üstü olgu gelişmiştir), giderilmiş, nadiren tedavinin kesilmesi ile sonuçlanmış veçalışmanın erken bir döneminde (< 3 döngü) ortaya çıkma özelliği göstermiştir. Karfilzomibtedavisi sırasında dispnenin klinik tedavisi için bkz. Bölüm 4.4. Hipertansif krizler dahil hipertansiyonKarfilzomib uygulamasından sonra hipertansif krizler (hipertansif aciliyet veya acil hipertansif tablo) görülmüştür. Bu olgulardan bazılarının ölümcül olduğu kaydedilmiştir. Klinikçalışmalarda hipertansiyon advers reaksiyonları hastaların yaklaşık %21'inde görülmüş,yaklaşık %8'inde 3. derece ve üstü hipertansiyon olgusu gelişmiş, %0,5'inden daha azında isehipertansif kriz görülmüştür. Hipertansiyon advers reaksiyonlarının insidansı, öncedenhipertansiyon ile ilgili tıbbi öyküsü olan veya olmayan hastalar arasında benzerlik göstermiştir.Karfilzomib tedavisi sırasında hipertansiyonun klinik tedavisi için bkz. Bölüm 4.4. TrombositopeniKarfilzomib ile ilgili klinik çalışmalarda hastaların yaklaşık %33'ünde trombositopeni bildirilmiş ve yaklaşık %20'sinde 3. derece ve üstü olgu gelişmiştir. CANDOR çalışmasında,3. derece ve üstü trombositopeni insidansı KdD kolunda %24,4 ve Kd kolunda ise %16,3olmuştur. Karfilzomib, megakaryositlerden trombosit gelişiminin inhibisyonu yoluylatrombositopeniye neden olmakta, bu durum her 28 günlük döngünün 8. veya 15. gününde ortayaçıkan en düşük trombosit düzeyi ile klasik döngüsel bir trombositopeniye yol açmakta vegenellikle bir sonraki döngünün başlangıcında başlangıç değerine geri dönüş ileilişkilendirilmektedir. Karfilzomib tedavisi sırasında trombositopeninin klinik tedavisi için bkz.Bölüm 4.4. Venöz tromboembolik olgularKarfilzomib alan hastalarda, ölümcül sonuçları olan derin ven trombozu ve pulmoner emboliyi de içeren venöz tromboembolik olgular bildirilmiştir (bkz. Bölüm 4.4). İki farklı faz 3çalışmasının karfilzomib kollarında venöz tromboembolik olguların genel insidansı dahayüksek olmuştur. ASPIRE çalışmasında venöz tromboembolik olguların insidansı KRd kolunda%15,6, Rd kolunda ise %9,0 olmuştur. KRd kolundaki hastaların %5,6'sında, Rd kolundakihastaların ise %3,9'unda 3. derece ve daha üstü venöz tromboembolik olgu bildirilmiştir.ENDEAVOR çalışmasında, venöz tromboembolik olguların insidansı Kd kolunda %12,5,bortezomib ve deksametazon (Vd) kolunda ise %3,3 olmuştur. Kd kolundaki hastaların%3,5'inde, Vd kolundaki hastaların ise %1,8'inde 3. derece ve daha üstü venöz tromboembolikolgu bildirilmiştir. CANDOR çalışmasında, venöz tromboembolik olguların insidansı KdDkolunda %6,2 ve Kd kolunda ise %11,1 olmuştur. KdD kolundaki hastaların %1,9'unda, Kdkolundaki hastaların ise %6,5'inde 3. derece ve üstü venöz tromboembolik olgu bildirilmiştir. Karaciğer yetmezliğiKarfilzomib ile ilgili klinik çalışmalarda hastaların %1'inden azında ölümcül olgular da dahil olmak üzere karaciğer yetmezliği olguları bildirilmiştir. Karfilzomib tedavisi sırasında hepatiktoksisitenin klinik tedavisi için bkz. Bölüm 4.4. Periferik nöropatiDeksametazon ile kombinasyon halinde 30 dakikalık infüzyon yoluyla karfilzomib 20/56 mg/m2 alan hastaları (Kd, n = 464) bortezomib ve deksametazon alan hastalar (Vd, n = 465) ilekarşılaştıran randomize, açık etiketli çok merkezli bir çalışmada Kd kolunda multipl miyelomhastalarının %7'sinde 2. derece ve daha üzeri periferik nöropati vakaları bildirilmiş, öncedenplanlanmış Genel Sağkalım (OS) analizi yapıldığı sırada Vd kolunda ise bu oran %35 olmuştur.CANDOR çalışmasında, KdD kolunda relaps multipl miyelom hastalarının %10,1'inde, Kdkolunda ise %3,9'unda 2. derece ve üstü periferik nöropati vakaları bildirilmiştir. İnfüzyon reaksiyonuCANDOR çalışmasında karfilzomib, daratumumab ile birlikte uygulandığında infüzyon enfeksiyonu riski daha yüksek olmuştur. Solunum yolu enfeksiyonlarıCANDOR çalışmasında, her bir tedavi grubunda (KdD kolunda %27,6 ve Kd kolunda %15,0) ciddi advers reaksiyon olarak bildirilen solunum yolu enfeksiyonları meydana gelmiştir.CANDOR çalışmasında, her bir tedavi grubunda (KdD kolunda %15,3 ve Kd kolunda %9,8)ciddi advers reaksiyon olarak bildirilen pnömoni meydana gelmiştir. KdD ve Kd kollarındasırasıyla %1,3 ve %0 olgunun ölümcül olduğu kaydedilmiştir. Sekonder primer malignitelerCANDOR çalışmasında, her bir tedavi grubunda (KdD kolunda %1,9 ve Kd kolunda %1,3) sekonder primer maligniteler bildirilmiştir. Fırsatçı enfeksiyonlarCANDOR çalışmasında, her bir tedavi grubunda (KdD kolunda %9,4 ve Kd kolunda %3,9) fırsatçı enfeksiyonlar bildirilmiştir. KdD kolundaki hastaların %1'inde ve daha fazlasındameydana gelen fırsatçı enfeksiyonlar arasında herpes zoster, oral kandidiyazis, oral herpes veherpes simpleks yer almıştır. Hepatit B reaktivasyonuCANDOR çalışmasında hepatit B reaktivasyonu insidansı KdD kolunda %0,6, Kd kolunda ise %0 olmuştur. Özel popülasyonlara ilişkin ek bilgiler:Geriyatrik popülasyon:Genel olarak bazı advers olayların (kardiyak aritmiler, kardiyak yetmezlik (bkz. Bölüm 4.4), dispne, lökopeni ve trombositopeni dahil olmak üzere) karfilzomibin klinik çalışmalarındagörülme sıklığı, 75 yaş altındaki hastalarla kıyaslandığında 75 yaş ve üstü hastalar için dahayüksektir. CANDOR çalışmasında haftada iki defa KdD 20/56 mg/m2 alan 308 hastanın %47'si, 65 yaş ve üzerindedir. Çalışmanın KdD kolunda, 65 yaşından küçük hastaların %6'sında ve 65 yaş veüzeri hastaların %14'ünde tedavi ile ortaya çıkan ölümcül advers olay meydana gelmiştir. Kdkolunda, 65 yaşından küçük hastaların %8'inde ve 65 yaş ve üzeri hastaların %3'ünde buolaylar meydana gelmiştir. Pazarlama sonrası deneyimKarfilzomib ile onay sonrası kullanımda aşağıdaki advers reaksiyonlar tanımlanmıştır. Bu reaksiyonlar büyüklüğü belli olmayan bir popülasyondan gönüllülük ilkesine dayanarakraporlandığından sıklıklarını güvenilir biçimde tahmin etmek veya ilaç maruziyetiyle nedenselbir ilişki kurmak her zaman mümkün değildir: hemolitik üremik sendrom (HUS), hepatit Breaktivasyonu, gastrointestinal perforasyon, perikardit ve koryoretinit, pnömonit, enterokolit,viremi, intestinal obstrüksiyon ve akut pankreatit dahil sitomegalovirüs enfeksiyonu. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr;[email protected] Doz aşımı ve tedavisiKarfilzomib 200 mg dozunun yanlışlıkla uygulanmasının ardından akut başlangıçlı ürperme, hipotansiyon, böbrek yetmezliği, trombositopeni ve lenfopeni rapor edilmiştir. Karfilzomib doz aşımı için bilinen spesifik antidot yoktur. Doz aşımı durumunda, hastalar izlenmeli ve uygun görüldüğü şekilde destekleyici bakım sağlanmalıdır. 5. FARMAKOLOJIK ÖZELLIKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ajanlar /Proteazom inhibitörü ATC kodu: L01XG02 Etki mekanizmasıKarfilzomib 26S proteazomunun içerisindeki proteolitik çekirdek partikül olan 20S proteazomunun N-terminal treonin-içeren aktif yerlerine geri dönüşsüz olarak bağlanantetrapeptit yapısındaki bir epoksiketon proteazom inhibitörüdür. Karfilzomib solid vehematolojik tümör hücreleri üzerinde in vitroantiproliferatif ve proapoptotik aktiviteleresahiptir. Hayvanlarda, karfilzomib kan ve dokulardaki proteazom aktivitesini inhibe etmiş vemultipl miyelom, hematolojik ve solid tümör modellerinde tümörün büyümesini geciktirmiştir.Farmakodinamik etkilerİntravenöz karfilzomib uygulanması, kanda ilk dozdan 1 saat sonra ölçüldüğünde, proteazom kimotripsin-benzeri (chymotrypsin like (CT-L)) aktivitesinin süpresyonuyla sonuçlanmıştır.Lenalidomid ve deksametazon ile veya tek başına > 15 mg/m2 düzeyinde karfilzomib dozlarıproteazomun CT-L aktivitesinin > %80 inhibisyonunu indüklemiştir. Buna ek olarak, tek ajanolarak intravenöz yoldan 20 mg/m2 karfilzomib, proteazomun düşük moleküler kütlelipolipeptid 2 (low molecular mass polypeptide 2 (LMP2)) ve multikatalitik endopeptidazkompleksi benzeri 1 (multicatalytic endopeptidase complex-like 1 (MECL1)) alt birimlerininsırasıyla %26 ila %32 ve %41 ila %49 ortalama inhibisyonuyla sonuçlanmıştır. Proteazominhibisyonu, dozlamanın her haftasında, karfilzomibin ilk dozunu takiben > 48 saat süreyledevam etmiştir. Daha yüksek 56 mg/m2 dozunda CT-L alt birimlerinde 15 ila 20 mg/m2 dozuna kıyasla daha yüksek inhibisyon (>%90) görülmesinin yanı sıra diğer proteazom alt birimlerinde (LMP7,MECL1 ve LMP2) de daha yüksek inhibisyon saptanmıştır. 56 mg/m2 dozunda LMP7, MECL1ve LMP2 alt birimlerinde 15 ila 20 mg/m2 dozuna kıyasla inhibisyonda sırasıyla %8, %23 ve%34 artış gözlemlenmiştir. Karfilzomib ile benzer proteazom inhibisyonu, test edildiği 2 dozseviyesinde (20 ve 36 mg/m2) 2 ila 10 dakikalık ve 30 dakikalık infüzyonlar ile elde edilmiştir. Klinik etkililik ve güvenlilikRelaps veya refrakter multipl miyelom için lenalidomid ve deksametazon ile kombinasyon halindeASPIREASPIRE, 1 ila 3 seri tedavi (burada tedavi serisi, relaps veya progresif hastalık gibi etkililik eksikliği nedeniyle kesintiye uğramamış olan planlanmış bir tedavi kürüdür [sıralı indüksiyon,transplantasyon, konsolidasyon ve/veya idame dahildir]) almış olan relaps veya refraktermultipl miyelom hastalarında karfilzomibin lenalidomid ve deksametazon (KRd) ilekombinasyonunu tek başına lenalidomid ve deksametazon (Rd) ile karşılaştırarak değerlendirenrandomize, açık etiketli, çok merkezli çalışmadır. Aşağıdaki hastalar çalışmaya alınmamıştır:en son rejimde bortezomibe refrakter, en son rejimde lenalidomid ve deksametazona refrakter,önceki hiçbir rejime yanıt vermemiş olan, kreatinin klirensi < 50 ml/dak, ALT/AST > 3,5 xULN ve bilirubin > 2 x ULN; New York Kalp Derneği sınıf III ila IV konjestif kalp yetmezliğiveya son 4 ay içinde miyokard enfarktüsü geçiren hastalar. KRd kolunda karfilzomib başlangıçdozu olarak 20 mg/m2 düzeyinde değerlendirilmiş, bu düzey 1. döngünün 8. gününde vesonrasında 27 mg/m2'ye yükseltilmiştir. Karfilzomib 1. döngüden 12. döngüye kadar her 28günlük döngünün 1, 2, 8, 9, 15 ve 16. günlerinde 10 dakikalık infüzyon olarak uygulanmıştır.Karfilzomib, 13. döngüden 18. döngüye kadar her 28 günlük döngünün 1, 2, 15 ve 16.günlerinde dozlanmıştır. Deksametazon 40 mg her döngünün 1, 8, 15 ve 22. gününde oral veyaintravenöz yoldan uygulanmıştır. Lenalidomid, her 28 günlük döngünün 1 ila 21. günlerinde 25mg oral yoldan verilmiştir. Rd tedavi kolunda lenalidomid ve deksametazon rejimi KRd tedavikolu ile aynıdır. Karfilzomib, hastalık progresyonu veya kabul edilemez toksisite nedeniyleerken kesilene kadar en fazla 18 döngü uygulanmıştır. Lenalidomid ve deksametazonuygulamasına hastalık progresyonuna veya kabul edilemez toksisiteye kadar devam edilmiştir.Her iki kol için tromboprofilaksi ve bir proton pompa inhibitörünün eşzamanlı kullanımı veKRd kolu için antiviral profilaksi gerekli görülmüştür. ASPIRE çalışmasında 792 hasta KRd veya Rd koluna 1:1 oranında randomize edilmiştir. Demografik bilgiler ve başlangıç özellikleri iki grup arasında iyi bir dengededir (bkz. Tablo11). Hastaların sadece %53'ünde genetik mutasyon için test yapılmıştır; KRd kolundakihastaların %12'sinde ve Rd kolundaki hastaların %13'ünde yüksek riskli bir genetik mutasyonsaptanmıştır. Tablo 11: ASPIRE çalışmasında demografik bilgiler ve başlangıç özellikleri
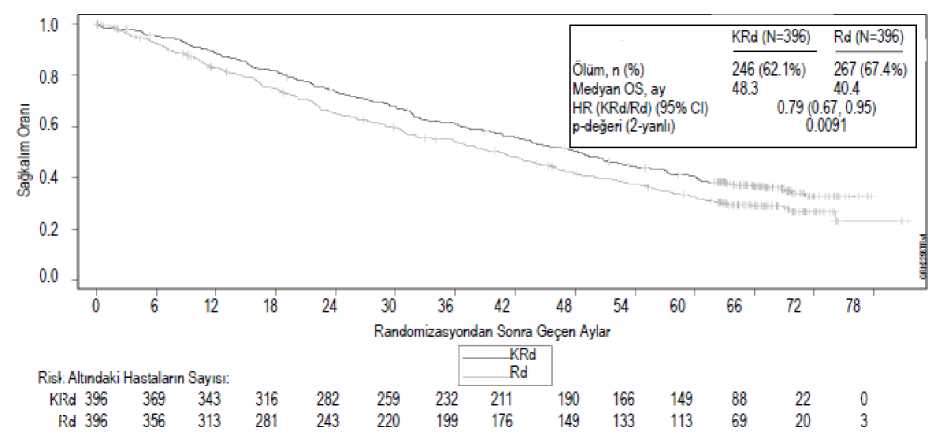
Bağımsız İnceleme Komitesi (Independent Review Committee (IRC)) tarafından Standart Uluslararası Miyelom Çalışma Grubu (International Myeloma Working Group(IMWG))/Avrupa Kan ve Kemik İliği Nakli (European Blood and Marrow Transplantation(EBMT)) yanıt kriterleri kullanılarak belirlendiğine göre KRd kolundaki hastalar Rdkolundakilere göre daha iyi PFS sergilemiştir (HR = 0,69, 2 yanlı P-değeri = 0,0001 ile). Medyan PFS süresi KRd kolunda 26,3 ay, Rd kolunda ise 17,6 ay olmuştur (bkz. Tablo 12 ve Şekil 1). KRd kolunda 246 ölümün ve Rd kolunda 267 ölümün ardından önceden planlanmış bir genel sağkalım (OS) analizi gerçekleştirilmiştir. Medyan takip süresi yaklaşık 67 ay olmuştur. KRdkolundaki hastalarda, Rd kolundaki hastalara kıyasla OS'de istatistiksel açıdan anlamlı biravantaj gözlenmiştir (bkz. Tablo 12 ve Şekil 2). Tablo 12: ASPIRE çalışmasında etkililik sonuçlarıa
Medyan yanıt süresi (DOR), KRd kolunda yanıt elde eden 345 hasta için 28,6 ay (%95 CI: 24,9; 31,3) ve Rd kolunda yanıt elde eden 264 hasta için 21,2 ay (%95 CI: 16,7; 25,8) olmuştur.Yanıta kadar geçen medyan süre, KRd kolunda 1 ay (aralık: 1 ila 14 ay) ve Rd kolunda da 1 ay(aralık 1 ila 16 ay) olmuştur. Şekil 1: ASPIRE Çalışmasında Progresyonsuz Sağkalımın Kaplan-Meier Eğrisi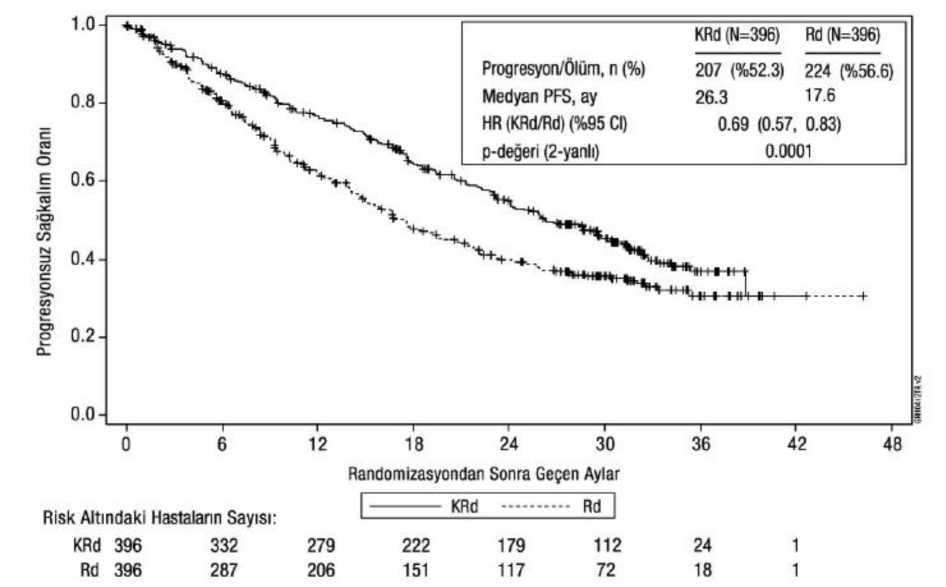
CI = güven aralığı; EBMT = Avrupa Kan ve Kemik İliği Nakli (European Blood and Marrow Transplantation); IMWG = Uluslararası Miyelom Çalışma Grubu (International Myeloma Working Group); HR = risk oranı; KRd= karfilzomib, lenalidomid ve deksametazon kolu; PFS = Progresyonsuz Sağkalım; Rd = lenalidomid vedeksametazon kolu Not: Yanıt ve PH (progresif hastalık) sonuçları standart objektif IMWG/EBMT yanıt kriterleri kullanılarak tayin edilmiştir. Şekil 2: ASPIRE Çalışmasında Genel Sağkalımın Kaplan-Meier Eğrisi
Relaps veya refrakter multipl miyelom için deksametazon ile kombinasyonDeksametazon ile kombinasyon halindeki karfilzomib'in etkililiği, iki açık etiketli, randomize çalışmada (ENDEAVOR ve ARROW) değerlendirilmiştir. ENDEAVORENDEAVOR, 1 ila 3 basamak tedavi almış olan relaps veya refrakter multipl miyelom hastalarında karfilzomib ve deksametazona (Kd) karşı bortezomib ve deksametazonu (Vd)karşılaştırarak değerlendiren randomize, açık etiketli, çok merkezli bir çalışmadır. Toplam 929hasta kaydedilmiş ve randomize edilmiştir (464 hasta Kd koluna; 465 hasta Vd koluna).Randomizasyon önceki proteazom inhibitörü tedavisi (var veya yok), önceki tedavi basamakları(1'e karşılık 2 veya 3), güncel Uluslararası Evreleme Sistemi evresi (1'e karşılık 2 veya 3) veplanlanan bortezomib uygulama yoluna göre tabakalandırılmıştır. Önceki rejimlerde yanıtlarıPR'den daha az; kreatinin klirensi < 15 ml/dak; hepatik transaminazları > 3 X ULN; sol ventrikülejeksiyon fraksiyonu < %40 veya başka önemli bir kalp sorunu olan hastalar çalışmayaalınmamıştır. Bu çalışmada karfilzomib başlangıç dozu olarak 20 mg/m2 ile başlayıp, 1.döngünün 8. gününde ve sonrasında 56 mg/m2'ye yükseltilmesi değerlendirilmiştir.Karfilzomib her 28 günlük döngünün 1, 2, 8, 9, 15 ve 16. gününde 30 dakikalık infüzyon olarakhaftada iki kez uygulanmıştır. Deksametazon 20 mg her döngünün 1, 2, 8, 9, 15, 16, 22 ve 23.günlerinde oral veya intravenöz yoldan uygulanmıştır. Vd kolunda bortezomib 21 günlükdöngünün 1, 4, 8 ve 11. günlerinde 1,3 mg/m2 dozda intravenöz veya subkutan yoldandozlanmış, deksametazon 20 mg her döngünün 1, 2, 4, 5, 8, 9, 11 ve 12. günlerinde oral veyaintravenöz yoldan uygulanmıştır. Eşzamanlı olarak tromboprofilaksi uygulanması isteğe bağlıolmuş, ve bir antiviral ajan ve proton pompa inhibitörü ile profilaksi ise gerekli görülmüştür.Vd kolundaki 465 hastanın 381'i subkutan yoldan bortezomib almıştır. Hastalık progresyonunaveya kabul edilemez toksisiteye kadar tedaviye devam edilmiştir. Demografik bilgiler ve başlangıç özellikleri Tablo 13'te özetlenmektedir. Tablo 13: ENDEAVOR çalışmasında demografik bilgiler ve başlangıç özellikleri
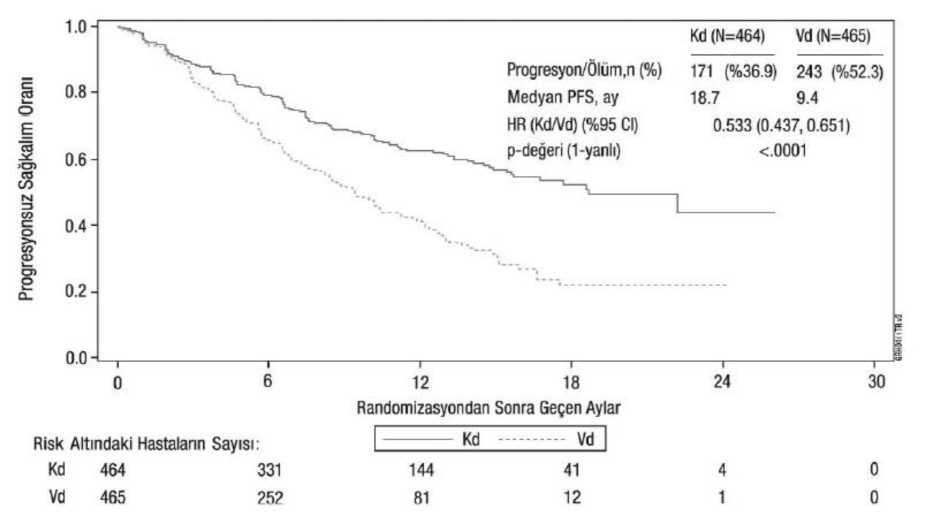
Karfilzomib etkililiği, IMWG yanıt kriterleri kullanılarak IRC tarafından belirlenen PFS'ye göre değerlendirilmiştir. Çalışmada Kd kolunda 18,7 ay ve Vd kolunda 9,4 ay medyan PFSgörülmüştür (bkz. Şekil 3 ve Tablo 12).
Diğer sonlanım noktaları OS ve genel yanıt oranını (ORR) içermektedir. Kd kolunda 189 ölümün ve Vd kolunda 209 ölümün ardından önceden planlanmış bir OS analizi gerçekleştirilmiştir. Medyan takip süresi yaklaşık 37 ay olmuştur. Kd kolundakihastalarda, Vd kolundaki hastalarla karşılaştırıldığında anlamlı düzeyde daha uzun OSgözlenmiştir (HR = 0,79; %95 CI: 0,65; 0,96; P değeri = 0,01). Sonuçlar Tablo 14 ve Şekil 4'tesunulmaktadır. Tablo 14: ENDEAVOR'da önemli sonuçların özeti (tedavisi amaçlanan popülasyon)a
g P-değeri, Cochran Mantel Haenszel testi kullanılarak türetilmiştir. h Her kolda en iyi yanıtı doğrulanmış PR olmayabilen bir hasta içerir. Şekil 4: ENDEAVOR Çalışmasında Kaplan-Meier Genel Sağkalım Grafiği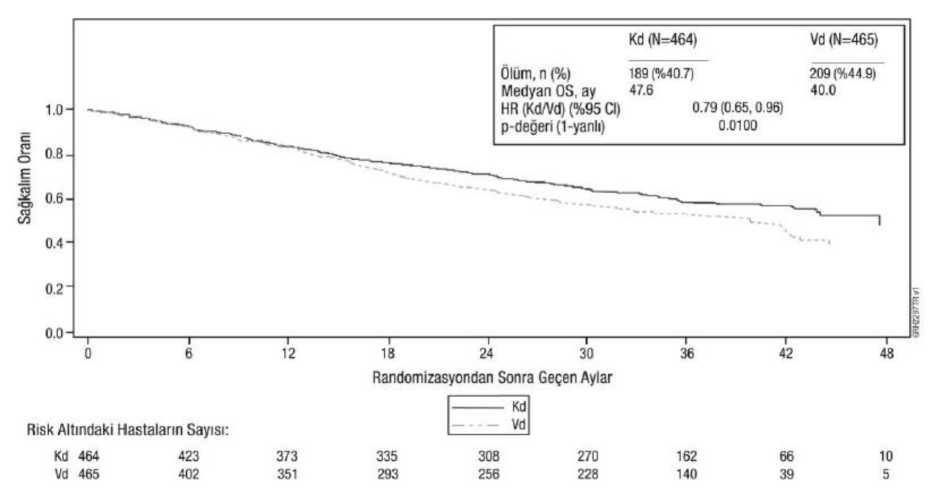
CI = güven aralığı; HR = risk oranı; Kd = karfilzomib ve deksametazon; OS = genel sağkalım; Vd = bortezomib ve deksametazon PR veya daha iyi bir yanıt elde edilen gönüllülerde medyan DOR, Kd kolunda 21,3 ay (%95 CI: 21,3, tahmin edilemez) ve Vd kolunda 10,4 ay (%95 CI: 9,3; 13,8) olmuştur. Yanıta kadargeçen medyan süre her iki kolda 1 ay (aralık: < 1 ila 8 ay) olmuştur. ARROWARROW, daha önce 2 ila 3 basamak tedavi görmüş olan relaps, refrakter multipl miyelom hastalarında haftada bir defa uygulanan karfilzomib ve deksametazon (Kd) (20/70 mg/m2) ile haftada iki defa uygulanan Kd'nin (20/27 mg/m2) karşılaştırıldığı randomize, açık etiketli, çok merkezli ve üstünlük gösterilmesi hedeflenen bir çalışmadır. Daha önceki basamaklardan en azbirine PR'nin altında yanıt vermiş olup; kreatinin klirensi < 30 mL/dak olan; hepatiktransaminazları > 3 x ULN olan; sol ventriküler ejeksiyon fraksiyonu < %40 olan veya başkaanlamlı kardiyak durumları olan hastalar tedaviye alınmamıştır. Toplam 478 hasta kaydedilmişve randomize edilmiştir (20/70 mg/m2 kolunda 240; 20/27 mg/m2 kolunda 238).Randomizasyon, güncel Evrelendirme Sistemi evresine (evre 1 veya evre 2 ya da 3), bortezomibtedavisine dirençli durumuna (evet veya hayır) ve yaşa (< 65 veya > 65 yaş) görebasamaklandırılmıştır. Çalışmanın 1. Kolunda 1. Döngünün 8. Gününden itibaren 70 mg/m2'yeyükseltilen 20 mg/m2'lik başlangıç dozunda karfilzomib değerlendirilmiştir. 1. Koldakarfilzomib haftada bir defa, 28 günlük döngülerin her birinin 1, 8 ve 15. günlerinde 30dakikalık infüzyon şeklinde uygulanmıştır. Çalışmanın 2. Kolunda 1. Döngünün 8. Günündenitibaren 27 mg/m2'ye yükseltilen 20 mg/m2'lik başlangıç dozunda karfilzomibdeğerlendirilmiştir. 2. Kolda karfilzomib haftada iki defa, 28 günlük döngülerin her birinin 1,2, 8, 9, 15 ve 16. günlerinde 10 dakikalık infüzyon şeklinde uygulanmıştır. Her iki rejimde detüm döngülerin 1, 8, 15. Günlerinde ve yalnızca 1 ila 9. Döngünün 22. Gününde oral yolla 40mg deksametazon uygulanmıştır. Eşzamanlı tromboprofilaksi uygulaması isteğe bağlıbırakılmıştır, bir antiviral ajanla profilaksi önerilmiştir ve bir proton pompası inhibitorü ileprofilaksi zorunlu kılınmıştır. Hastalık progresyonu veya kabul edilemez toksisite ortaya çıkanakadar tedaviye devam edilmiştir. Demografik özellikler ve başlangıç özellikleri Tablo 15'te özetlenmektedir. Tablo 15: ARROW Çalışmasındaki Demografik Özellikler ve Başlangıç Özellikleri
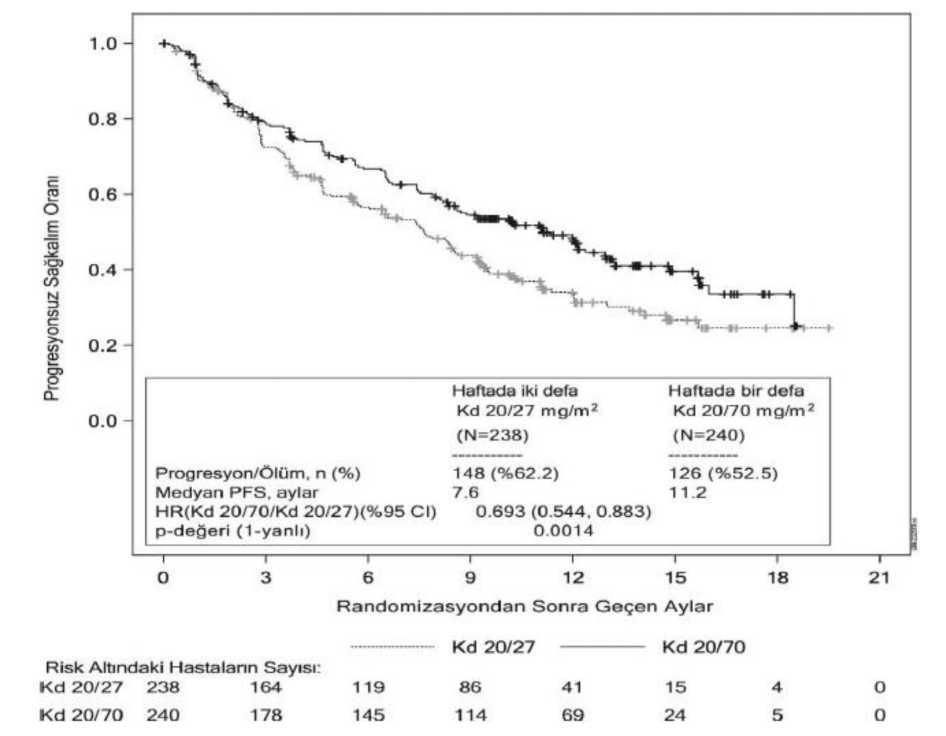
Karfilzomibin etkililiği IMWG yanıt kriterleri kullanılarak PFS'ye göre değerlendirilmiştir. Etkililik sonuçları Tablo 16 ve Şekil 5'te sunulmaktadır.
CI = güven aralığı; CR = tam yanıt; HR = risk oranı; Kd = karfilzomib/deksametazon; ORR = genel yanıt oranı; PFS = progresyonsuz sağkalım; VGPR = çok iyi kısmi yanıt; PR = kısmi yanıt; sCR = kesin tam yanıta Genel yanıt, en iyi genel PR, VGPR, CR veya sCR yanıtına ulaşmak şeklinde tanımlanmaktadır. PR veya daha iyi bir yanıt elde edilen gönüllülerde medyan DOR, 20/70 mg/m2 Kd kolunda 15 ay (%95 CI: 12,2, hesaplanabilir değildir), 20/27 mg/m2 Kd kolunda ise 13,8 ay (%95 CI: 9,5,hesaplanabilir değildir) olmuştur. Yanıt ortaya çıkana kadar geçen medyan süre 20/70 mg/m2Kd kolunda 1,1 ay, 20/27 mg/m2 Kd kolunda ise 1,9 ay olmuştur. Karfilzomib tek başına deksametazon ile kombinasyon halinde haftada iki defa 20/27 mg/m2 şeklindeki uygulama için onaylı değildir. Relaps veya Refrakter Multipl Miyelom için İntravenöz Daratumumab ve Deksametazon ile Kombinasyon HalindeKarfilzomib'in daratumumab ve deksametazon (DKd) ile kombinasyon halindeki etkililiği, iki açık etiketli klinik çalışmada (CANDOR ve EQUULEUS) değerlendirilmiştir. CANDORCANDOR, daha önce 1 ila 3 basamak tedavi almış olan relaps veya refrakter multipl miyelom hastalarında haftada iki defa uygulanan karfilzomib 20/56 mg/m2'nin intravenöz daratumumabve deksametazon (DKd) ile kombinasyonuna kıyasla haftada iki defa uygulanan karfilzomib20/56 mg/m2 ve deksametazonu (Kd) değerlendiren randomize, açık etiketli, çok merkezli birçalışmadır. Aşağıdaki hastalar çalışmaya alınmamıştır: son 2 yıl içinde bilinen orta ila şiddetliderecede inatçı astımı olan, FEV1'i öngörülen normalin %50'sinden az olan ve bilinen kronikobstrüktif akciğer hastalığı (COPD) bulunan veya aktif konjestif kalp yetmezliği olan hastalar.Randomizasyon taramasında ISS (evre 1 veya 2'ye karşılık evre 3), önceki proteazominhibitörü maruziyeti (var veya yok), önceki tedavi basamağı sayısı (1'e karşılık 2 veya dahafazla) ya da önceki küme farklılaşma antijeni 38 (CD38) antikor tedavisine (var veya yok) göresınıflandırma yapılmıştır. Karfilzomib 1. Döngünün 1 ve 2. Günlerinde 20 mg/m2'lik; 1. Döngünün 8, 9, 15 ve 16. Günlerinde ve ardından her 28 günlük döngünün 1, 2, 8, 9, 15 ve 16. Günlerinde 56 mg/m2'likdozlar halinde intravenöz yoldan 30 dakika uygulanmıştır. 1, 2, 8, 9, 15 ve 16. Günlerde oralveya intravenöz yoldan deksametazon 20 mg ve ardından her 28 günlük döngünün 22. Günündeoral veya intravenöz yoldan 40 mg uygulanmıştır. DKd kolunda, 1. Döngünün 1 ve 2.Günlerinde intravenöz yoldan 8 mg/kg daratumumab uygulanmıştır. Ardından 1. Döngünün 8,15 ve 22. Günlerinde; 2. Döngünün 1, 8, 15 ve 22. Günlerinde; 3 ila 6. Döngülerin 1 ve 15.Günlerinde ve kalan döngüler için veya hastalık progresyonuna kadar 1. Günde intravenözyoldan 16 mg/kg daratumumab uygulanmıştır. 20 mg'a düşürülmüş deksametazon dozunu alan75 yaş üzeri hastalar için 20 mg'lık dozun tamamı, daratumumabın uygulandığı günlerdedaratumumab pre-infüzyon ilacı olarak verilmiştir. Her iki çalışma kolunda karfilzomibuygulandığında ise deksametazon dozajı günlere bölünmüştür. Hastalık progresyonuna veyakabul edilemez toksisiteye kadar her iki kolda tedaviye devam edilmiştir. Toplam 466 hasta randomize edilmiştir (312 hasta DKd koluna ve 154 hasta Kd koluna). Demografik bilgiler ve başlangıç özellikleri Tablo 17'de özetlenmektedir. Tablo 17: CANDOR Çalışmasında Demografik Bilgiler ve Başlangıç Özellikleri
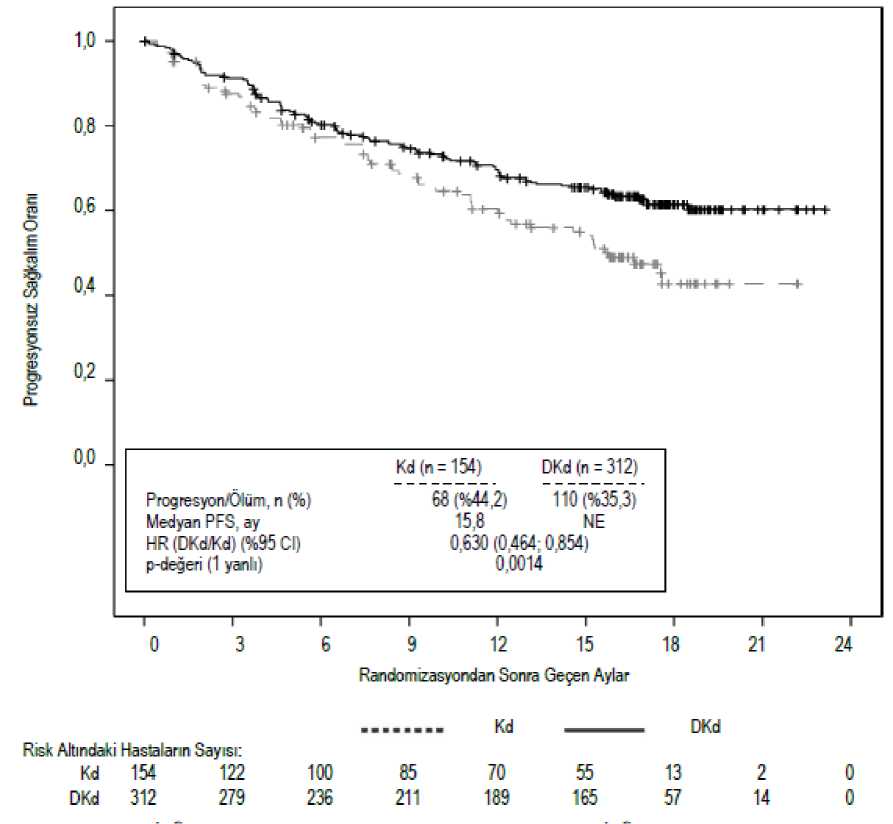
ECOG = Doğu Kooperatif Onkoloji Grubu; FISH = Fluoresans in situ hibridizasyon; ISS = Uluslararası Evreleme Sistemi; DKd = karfılzomib, daratumumab ve deksametazon *Daha önce 3 'ten daha fazla rejim almış olan hastaların sayısı, DKd kolunda 0 ve Kd kolunda 1 olmuştur. Etkililik, IMWG yanıt kriterleri kullanılarak IRC'nin PFS değerlendirmesine göre değerlendirmiştir. Etkililik sonuçları Tablo 18 ve Şekil 6'da sunulmaktadır. DKd kolundamedyan yanıt süresine ulaşılmamıştır ve medyan yanıt süresi Kd kolunda 16,6 ay (13,9; NE)olmuştur. Yanıta kadar geçen medyan (min, maks) süre, DKd kolu için 1,0 (1; 14) ay ve Kdkolu için 1,0 (1; 10) ay olmuştur. Şekil 6: CANDOR Çalışmasında Progresyonsuz Sağkalıma İlişkin Kaplan-Meier Grafiği
Tablo 18: CANDOR Çalışmasında Önemli Sonuçların Özeti (Tedavi Amaçlı Popülasyon)

CI = güven aralığı; CR = tam yanıt; HR = risk oranı; DKd = karfilzomib, daratumumab ve deksametazon; Kd = karfilzomib ve deksametazon; ORR = genel yanıt oranı; PFS = progresyonsuz sağkalım; PR = kısmi yanıt; MRD[-] CR = minimal rezidüel hastalık negatif-tam yanıt; NE = hesaplanabilir değildir; VGPR = çok iyi kısmi yanıt a P-değeri tabakalandırılmış log sıra testi kullanılarak türetilmiştir. d MRD [-] CR (10-5 düzeyinde), çalışma esnasındaki herhangi bir zaman noktasında yeni nesil dizileme testi (ClonoSEQ) ile değerlendirildiği şekilde IMWG-URC ve MRD[-] durumuna göre CR'nin elde edilmesi olaraktanımlanır. EQUULEUS EQUULEUS, daha önce 1 ila 3 basamak tedavi almış olan relaps veya refrakter multipl miyelom hastalarında karfilzomib'in intravenöz daratumumab ve deksametazon ilekombinasyonunu değerlendiren açık etiketli, çok kohortlu bir çalışmadır. Aşağıdaki hastalarçalışmaya alınmamıştır: son 2 yıl içinde bilinen orta ila şiddetli inatçı astımı olan, FEVl'iöngörülen normalin %50'sinden az olan ve bilinen kronik obstrüktif akciğer hastalığı (COPD)bulunan veya aktif konjestif kalp yetmezliği (New York Kalp Derneği Sınıf III-IV olaraktanımlanır) olan hastalar. Karfilzomib haftada bir defa 1. Döngünün 1. Gününde 20 mg/m2'lik doz halinde intravenöz yoldan 30 dakika uygulanmış ve doz 1. Döngünün 8 ve 15. Günlerinde ve her 28 günlükdöngünün 1, 8 ve 15. Günlerinde 70 mg/m2'ye çıkarılmıştır. On hastaya 1. Döngünün 1.Gününde intravenöz yoldan 16 mg/kg daratumumab ve kalan hastalara 1. Döngünün 1 ve 2.Günlerinde intravenöz yoldan 8 mg/kg daratumumab uygulanmıştır. Ardından 1. Döngünün 8,15 ve 22. Günlerinde; 2. Döngünün 1, 8, 15 ve 22. Günlerinde; 3 ila 6. Döngülerin 1 ve 15. Günlerinde ve daha sonra her 28 günlük döngünün kalan döngüleri için 1. Günde intravenöz yoldan 16 mg/kg daratumumab uygulanmıştır. 1 ve 2. Döngüde 1, 2, 8, 9, 15, 16, 22 ve 23.Günlerde oral veya intravenöz yoldan deksametazon 20 mg; 3 ila 6. döngülerde 1, 2, 15 ve 16.Günlerde oral veya intravenöz yoldan deksametazon 20 mg ve 8 ve 22. Günlerde 40 mg ve 7.döngü ve sonrasında 1 ve 2. Günlerde oral veya intravenöz yoldan deksametazon 20 mg ve 8,15 ve 22. Günlerde 40 mg uygulanmıştır. 75 yaş üzeri hastalar için deksametazon 20 mg, ilkhaftadan sonra haftada bir defa oral veya intravenöz yoldan uygulanmıştır. Hastalıkprogresyonu veya kabul edilemez toksisite ortaya çıkana kadar tedaviye devam edilmiştir.EQUULEUS çalışmasına 85 hasta dahil edilmiştir. Demografik bilgiler ve başlangıç özellikleriTablo 19'da özetlenmektedir. Tablo 19: EQUULEUS Çalışmasının DKd 20/70 mg/m2 Rejimindeki Demografik Bilgiler ve Başlangıç Özellikleri (Relaps veya Refrakter Multipl Miyelom için KombinasyonTedavisi)
ECOG = Doğu Kooperatif Onkoloji Grubu; FISH = Fluoresans in situ hibridizasyon Etkililik sonuçlan için IMWG kriterleri kullanılarak genel yanıt oranı esas alınmıştır; PI = proteazom inhibitörü; IMiD = immünomodülatör ajan. Etkililik sonuçları için IMWG kriterleri kullanılarak genel yanıt oranı esas alınmıştır. Etkililik sonuçları Tablo 20'de sunulmaktadır. Yanıta kadar geçen medyan süre 0,95 ay (aralık: 0,9;14,3) olmuştur. Medyan yanıt süresi 28 ay (%95 CI: 20,5; tahmin edilemez) olmuştur. Tablo 20: EQUULEUS Çalışmasında Önemli Sonuçların Özeti (Tedavi Amaçlı Popülasyon)
Relaps veya refrakter multipl miyelom için monoterapiÇalışma PX-171-007 (NCT00531284)Çalışma PX-171-007, 2 veya daha fazla tedavi basamağından sonra relaps veya refrakter multipl myelom hastalarında 30 dakikalık infüzyon olarak karfilzomib monoterapisiningüvenliliğini değerlendiren çok merkezli, açık etiketli, doz yükseltme, tek kollu biraraştırmadır. Kreatinin klirensi < 20 ml/dak; ALT > 3 x ULN, bilirubin > 1,5 x ULN; NewYork Kalp Derneği Sınıf III veya IV konjestif kalp yetmezliği veya başka bir önemli kalpsorunu olan hastalar çalışmaya alınmamıştır. Toplam 24 multipl myelom hastası 20/56 mg/m2maksimum tolere edilen doz düzeyinde dahil edilmiştir. Karfilzomib 28 günlük döngününardışık 3 haftasında haftada iki kez uygulanmıştır (1, 2, 8, 9, 15 ve 16. günlerde). 13. döngü vesonrasında 8. ve 9. günlerde karfilzomib dozları atlanabilmiştir. Hastalar 1. döngünün 1. ve 2.günlerinde 20 mg/m2 başlangıç dozuyla karfilzomib almış, bu doz sonraki tüm dozlarda 56mg/m2'ye çıkarılmıştır. 1. döngüde her karfilzomib dozundan önce oral veya intravenöz yoldan8 mg deksametazon ile ön ilaç uygulaması gerekli görülmüş, sonraki döngülerde isteğe bağlıolmuştur. Hastalık progresyonuna kadar veya kabul edilemeyen toksisite oluşana kadartedaviye devam edilmiştir. Etkililik ORR ve DOR değerlerine göre değerlendirilmiştir. IMWG kriterlerine göre araştırmacı değerlendirmesiyle ORR %50 olmuştur (%95 CI: 29; 71) (bkz. Tablo 21). PR veya daha iyisinielde eden gönüllülerde medyan DOR 8,0 ay olmuştur (Aralık: 1,4; 32,5).
Çalışma PX-171-003 A1 (NCT00511238)Çalışma PX-171-003 A1, en fazla 10 dakikalık infüzyonla uygulanan karfılzomib monoterapisi için tek kollu, çok merkezli klinik çalışmadır. Uygun hastalar relaps ve refrakter multiplmiyelomu olup daha önce en az iki basamak tedavi almış olan (bortezomib ve talidomid ve/veyalenalidomid dahil) ve en son tedaviye < %25 yanıt veren veya en son tedavi sırasında ya daizleyen 60 gün içinde hastalığı progresyon gösterenlerdir. Önceki tüm tedavilere refrakter olan,total bilirubin > 2 x ULN; kreatinin klirensi < 30 ml/dak; New York Kalp Derneği Sınıf III ilaIV konjestif kalp yetmezliği; semptomatik kardiyak iskemi; son 6 ay içinde miyokardenfarktüsü; Derece 3 veya 4 periferik nöropati veya ağrılı Derece 2 periferik nöropati; tedavigerektiren aktif enfeksiyonlar veya plevral efüzyonu olan hastalar çalışmaya dahil edilmemiştir. Karfilzomib üç hafta süreyle, her haftanın iki ardışık gününde intravenöz yoldan en fazla 10 dakika içinde uygulanmış, bunu 12 günlük dinlenme dönemi izlemiştir (28 günlük tedavidöngüsü). Hastaların tedavisi hastalık progresyonuna, kabul edilemeyen toksisite oluşana veyamaksimum 12 döngüye kadar sürdürülmüştür. Hastalar 1. döngüde her dozda 20 mg/m2 vesonraki döngülerde her dozda 27 mg/m2 almışlardır. Birinci ve ikinci döngülerde karfilzomibdozlarından önce oral veya intravenöz yoldan 4 mg deksametazon uygulanmıştır. Toplam 266 hasta dahil edilmiştir. Başlangıç hasta ve hastalık özellikleri Tablo 22'de özetlenmektedir. Tablo 22: PX-171-003 Al'de demografik bilgiler ve başlangıç özellikleri (20/27 mg/m2 monoterapi rejimi)monoterapi rejimi)
Etkililik, IMWG kriterleri kullanan IRC değerlendirmesiyle ORR değerlerine göre değerlendirilmiştir. Etkililik sonuçları Tablo 23'te sunulmaktadır. Medyan DOR 7,8 aydır (%95CI: 5,6; 9,2). Tablo 23: Çalışma PX-171-003 Al'de yanıt kategorileri (20/27 mg/m2 monoterapi rejimi) monoterapi rejimi)
Çalışma PX-171-004 Bölüm 2, en fazla 10 dakikalık infüzyonla uygulanan karfilzomib monoterapisi için tek kollu, çok merkezli klinik çalışmadır. Uygun hastalar relaps veya refraktermultipl miyelomu olup daha önce bortezomib almamış, önceden bir ila üç basamak tedavi almışolan ve tedaviye < %25 yanıt veren veya tedavi sırasında ya da tedavinin tamamlanmasındansonraki 60 gün içinde hastalığı progresyon gösterenlerdir. Standart birinci basamak tedaviyerefrakter olan, total bilirubin > 2 x ULN; kreatinin klirensi < 30 ml/dak; New York KalpDerneği Sınıf III ila IV konjestif kalp yetmezliği; semptomatik kardiyak iskemi; son 6 ay içindemiyokard enfarktüsü; tedavi gerektiren aktif enfeksiyonlar; veya plevral efüzyonu olan hastalarçalışmaya dahil edilmemiştir. Karfilzomib hastalık progresyonuna, kabul edilemez toksisiteye veya en fazla 12 döngüye kadar üç hafta süreyle her hafta ardışık iki günde en fazla 10 dakika içinde intravenöz yoldanuygulanmıştır, ardından 12 günlük dinlenme dönemi bırakılmıştır (28 günlük tedavi döngüsü).Hastalar 1. döngüde her dozda 20 mg/m2 ve sonraki döngülerde 27 mg/m2 almıştır. Birinci veikinci döngülerde karfilzomib dozlarından önce oral veya intravenöz yoldan 4 mgdeksametazon uygulanmıştır. 20/27 mg/m2 rejimiyle toplam 70 hasta tedavi edilmiştir. Başlangıç hasta ve hastalık özellikleri Tablo 24'te özetlenmektedir. Tablo 24: Çalışma PX-171-004 Bölüm 2'de demografik bilgiler ve başlangıç özellikleri (20/27 mg/m2 monoterapi rejimi) monoterapi rejimi)
Etkililik, IMWG kriterleri kullanan IRC değerlendirmesiyle ORR değerlerine göre değerlendirilmiştir. Etkililik sonuçları Tablo 25'te sunulmaktadır. Medyan DOR'a ulaşılmadı.
Kardiyak elektrofizyolojiKarfılzomibin kalp fonksiyonu üzerindeki olası etkilerinin değerlendirmesi, multipl miyelom dahil olmak üzere ilerlemiş malignitelerin olduğu 154 gönüllüde üçlü EKG'nin merkezi körokunması yoluyla analiz edilerek yapılmıştır. Fridericia düzeltmesi ile QT aralığı (QTcFaralığı) kullanılarak karfilzomibin kardiyak repolarizasyon üzerindeki etkisi ve konsantrasyon-QTc ilişkilerinin analizi doza bağlı herhangi bir etkiye ilişkin açık bir sinyal ortayakoymamıştır. Cmaks düzeyinde QTcF üzerindeki öngörülen etki için tek yanlı %95 güvenaralığının (CI) üst sınırı 4,8 milisaniye olmuştur. Bazett düzeltmesi (QTcB aralığı)kullanıldığında Cmaks düzeyinde QTcB üzerindeki öngörülen etki için tek yanlı %95 güvenaralığının (CI) üst sınırı 5,9 milisaniye olmuştur. 5.2 Farmakokinetik özelliklerGenel ÖzelliklerEmilim:30 dakikalık infüzyon şeklinde uygulanan 20 mg/m2 ile 70 mg/m2 arasındaki dozlarda karfilzomib multipl miyelom hastalarında maksimum plazma konsantrasyonlarında (Cmaks) vesonsuza giden zaman içinde eğri altında kalan alanda (AUCo-İnf) doza bağımlı artışgöstermiştir. Aynı zamanda relaps, refrakter multipl miyelom hastalarında 2 ila 10 dakikalıkinfüzyon şeklinde 20 mg/m2 ve 56 mg/m2 arası karfilzomible de Cmaks ve AUCo-İnf değerlerindedoza bağımlı bir artış gözlenmiştir. 30 dakikalık bir infüzyon, aynı dozda 2 ila 10 dakikalık birinfüzyonla gözlenene benzer bir AUCo-İnf fakat 2 ila 3 kat daha düşük bir Cmaks ortayaçıkarmıştır. Haftada bir 30 dakikalık infüzyon halinde 70 mg/m2 veya haftada iki defa 2 ila 10dakikalık infüzyon halinde 15 ve 20 mg/m2 karfilzomibin tekrarlanan şekilde uygulanmasınıtakiben karfilzomib birikimine işaret eden kanıt ortaya çıkmamıştır. Tablo 26'da farklı doz rejimleri için birinci döngüde hesaplanan ortalama günlük eğri altındaki alan (AUCc1,avg), kararlı durumdaki ortalama günlük eğri altındaki alan (AUCss) ve birincidöngüdeki en yüksek dozda ortaya çıkan Cmaks (Cmaks,c1) listelenmektedir. Tablo 26: Farklı Doz Rejimleri için Karfilzomib Maruziyeti Parametreleri
CV: Coefficient of variation Dağılım:Ortalama kararlı-durum dağılım hacmi 20 mg/m2 karfilzomib dozunda 28 L olmuştur. Karfilzomib %97 oranında insan plazma proteinlerine bağlanır ve 0,4 - 4 mikromolar aralığıiçindeki konsantrasyonlarda in vitroortalama %97'dir.Biyotransformasyon:Karfilzomib peptidaz klivajı ile hızlı, şekilde metabolize olur ve epoksit hidrolizi metabolizmanın temel yolağıdır. Sitokrom P450-aracılıklı mekanizmalar genel karfilzomibmetabolizmasına minör bir katkıda bulunur. Eliminasyon:Karfilzomibin yarı ömrü 1. Döngünün 1. Gününde > 15 mg/m2'lik intravenöz dozları takiben < 1 saattir. 30 dakikalık infüzyon veya 2 ila 10 dakikalık infüzyon şeklinde uygulandığında yarıömrün benzer olduğu görülmüştür. Sistemik klirens, 151 ile 263 L/saat arasında değişmiştir. Uygulanan karfilzomib dozunun yaklaşık %25'i 24 saat içinde idrarda metabolit olarak atılmıştır. Ana bileşiğin idrar ve dışkıyla atılımı önemsiz miktardadır (toplam dozun %0,3'ü). Doğrusallık/Doğrusal olmayan durum:Veri bulunmamaktadır. Hastalardaki karakteristik özelliklerSpesifik popülasyonlar:Yaş (35-89 yaş), cinsiyet, ırk veya etnisite (%80 Beyaz, %11 Siyah, %6 Asyalı, %3 Latin) ve hafif ila şiddetli böbrek yetmezliği (kreatinin klirensi 15-89 mL/dak) karfilzomibinfarmakokinetiği üzerinde klinik açıdan anlamlı etki ortaya çıkarmamıştır. Karaciğer yetmezliğiHafif (total bilirubin 1 ila 1,5 x ULN ve herhangi bir AST veya total bilirubin < ULN ve AST > ULN) ve orta derece (total bilirubin > 1,5 ila 3 x ULN ve herhangi bir AST) karaciğeryetmezliği olan hastalarda, karfilzomibin AUC değeri karaciğer fonksiyonu normal olanhastalara göre yaklaşık %50 oranında artmıştır. Şiddetli karaciğer yetmezliği (total bilirubin >3xULN ve herhangibir AST) olan hastalarda karfilzomibin farmakokinetiği değerlendirilmemiştir. Böbrek yetmezliğiHemodiyaliz uygulanan SEBH hastalarında karfilzomibin AUC değeri böbrek fonksiyonu normal olan hastalara göre %33 oranında daha yüksek gözlenmiştir. Karfilzomibkonsantrasyonlarının hemodiyaliz klirensi araştırılmamış olduğundan, ilaç hemodiyalizprosedüründen sonra uygulanmalıdır. İlaç etkileşim çalışmalarıKlinik çalışmalarKarfilzomibin hassas CYP3A substratı üzerine etkisiMidazolamın (hassas bir CYP3A substratı) farmakokinetiği karfilzomib uygulamasından etkilenmemiştir. In vitroçalışmalarKarfilzomibin CYP450 enzimi üzerine etkisiKarfilzomib direkt ve zamana bağımlı CYP3A inhibisyonu sergilemiştir fakat in vitroCYP1A2 ve CYP3A4'ü indüklememiştir.Taşıyıcıların karfilzomib üzerine etkisiKarfilzomib in vitrobir P-glikoprotein (P-gp) substratıdır.Karfılzomibin taşıyıcılar üzerine etkisiKarfilzomib in vitro5.3 Klinik öncesi güvenlilik verileriGebelikGebe sıçanlar ve tavşanlara organogenez döneminde intravenöz yoldan uygulanan karfilzomib sıçanlarda 2 mg/kg/gün ve tavşanlarda 0,8 mg/kg/gün dozlarına kadar teratojenik olmamıştır.Karfilzomib test edilen herhangi bir dozda teratojenik olmamıştır. Tavşanlarda, > 0,4mg/kg/gün dozunda pre-implantasyon kaybında bir artış ve erken rezorpsiyonlarda ve post-implantasyon kayıplarında artış ve maternal toksik doz olan 0,8 mg/kg/gün dozunda fetalağırlıkta bir azalma olmuştur. Tavşanlarda 0,4 ve 0,8 mg/kg/gün dozları VYA'ya dayalı olarakinsanlarda önerilen doz olan 27 mg/m2 dozunun sırasıyla, ortalama %20 ve %40'ına karşılıkgelmektedir. Karsinogenez, mutagenez, fertilitede bozulmaKarfilzomib ile karsinojenisite çalışmaları yapılmamıştır.Karfilzomib periferik kan lenfositlerinde in vitroin vitroin vivofare kemik iliği mikronükleus tayininde klastojenik olmamıştır.Karfilzomib ile fertilite çalışmaları yapılmamıştır. Üreme dokuları üzerinde 28 günlük yinelenen doz sıçan ve maymun toksisite çalışmalarında veya 6 aylık rat ve 9 aylık maymunkronik toksisite çalışmalarında etkiler saptanmamıştır. Hayvan toksikolojisi ve/veya farmakolojisiKardiyovasküler toksisite: Tek bolus intravenöz doz olarak 3 mg/kg karfilzomib uygulanan maymunlarda (VYA'ya göre insanlarda önerilen doz olan 27 mg/m2 dozunun ortalama 1,3katına karşılık gelmektedir) hipotansiyon, kalp hızında artış ve troponin-T serum düzeylerindeartış görülmüştür. Kronik uygulama: Klinik olarak kullanılanlara benzer doz programı ile sıçanlarda karfilzomibin > 2 mg/kg/dozunda ve maymunlarda 2 mg/kg/dozunda yinelenen bolus intravenöz uygulaması,kardiyovasküler (kalp yetmezliği, kardiyak fibroz, perikardiyal sıvı toplanması, kardiyakhemoraji/dejenerasyon), gastrointestinal (nekroz/hemoraji), renal (glomerülonefropati, tübülernekroz, disfonksiyon) ve pulmoner (hemoraji/inflamasyon) sistemlerdeki toksisitelere bağlımortalitelerle sonuçlanmıştır. Sıçanlardaki 2 mg/kg/dozu, VYA'ya göre insanlarda önerilen dozolan 27 mg/m2 dozunun ortalama yarısı kadardır. Maymunlardaki 2 mg/kg/dozu, VYA'ya göreinsanlarda önerilen doza yaklaşık olarak eşdeğerdir. 6. FARMASOTIK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSülfobütil eter beta-siklodekstrin sodyum tuzu (Sülfobütilbetadeks sodyum) Sitrik asit susuz Sodyum hidroksit 6.2 GeçimsizliklerGeçimsizlik çalışmaları mevcut olmadığından bu beşeri tıbbi ürün başka beşeri tıbbi ürünlerle karıştırılmamalıdır. KARFİLİB enjektabl %0,9 sodyum klorürle karıştırılmamalıdır. 6.3 Raf ömrü24 ay. Rekonstitüye edildikten ve seyreltildikten sonra oda sıcaklığında (25°C'nin altında) saklanmak koşuluyla 4 saat içerisinde veya 2°C-8°C arasında saklanmak koşuluyla 24 saat içerisindekullanılmalıdır. Kullanıma hazırlanmasından uygulamaya kadar geçen toplam zaman 24 saati aşmamalıdır. KARFİLİB infüzyon karışımına çözeltinin kimyasal veya fiziksel stabilitesi üzerine etkisi tespit edilmeden, hiçbir ilaç veya kimyasal madde ilavesi yapılmamalıdır. 6.4 Saklamaya yönelik özel tedbirler2°C-8°C arasında buzdolabında saklayınız. Dondurmayınız. Flakonu orijinal ambalajında ışıktan koruyarak saklayınız. 6.5 Ambalajın niteliği ve içeriğiÜrünümüzün primer ambalaj malzemesi olarak; gri renkli, bromobutil liyofilizasyon tıpası ile kapatılmış ve kahverengi flip-off ile sızdırmazlığı sağlanmış, 50R, şeffaf, renksiz, Tip I camflakon kullanılmaktadır. Bir karton kutuda bir adet flakon ve kullanma talimatı ile birlikte sunulmaktadır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKARFİLİB flakonları antimikrobiyal koruyucu maddeler içermez ve sadece tek doz olarak kullanılması amaçlanmıştır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmelikleri ne uygun olarak imha edilmelidir. Hazırlama ve uygulamaSulandırılmış çözelti 2 mg/mL konsantrasyonunda karfilzomib içermektedir. Hazırlamadan önce hazırlama talimatlarını eksiksiz okuyunuz. Parenteral ürünler kullanılmadan önce renktedeğişiklik olup olmadığı ve partikül içerip içermediği, solüsyon ve kabı izin verdiği ölçüdekontrol edilmelidir. 1. Flakonu kullanımdan hemen önce buzdolabından çıkarın. 2. Gereken KARFİLİB dozunu (mg/m2) ve flakon sayısını hastanın başlangıçtaki VYAdeğerini kullanarak hesaplayın. 3. Her bir KARFİLİB flakonunu yalnızca Steril Enjeksiyonluk Su ile aşağıda açıklanan hacmikullanarak aseptik şekilde sulandırın. 21 gauge veya daha büyük bir iğne (dış çapı 0,8 mmveya daha küçük olan iğne) kullanarak her flakonu yavaşça 29 mL steril enjeksiyonluk suenjekte ederek hazırlayın, köpüklenmeyi minimize etmek için Steril Enjeksiyonluk Suyu tıpaüzerinden FLAKONUN İÇ DUVARINA doğru yönlendirin. KARFİLİB ile kapalı sistem transfer cihazlarının kullanımını destekleyen veri mevcut değildir.
4. Flakonu yaklaşık 1 dakika kadar veya tam olarak çözünene kadar nazikçe döndürün ve/veyayavaşça ters çevirin. Köpük oluşmasından kaçınmak için flakonu ÇALKALAMAYIN.Köpük oluşursa, flakondaki köpüklenme çökene (yaklaşık 5 dakika) ve çözelti berrak halegelene kadar çözeltinin oturmasını bekleyin. 5. Uygulamadan önce partikül madde veya renk değişimine karşı çıplak gözle inceleyin.Hazırlanmış ürün berrak, renksiz bir çözelti olmalı ve herhangi bir renk değişikliği veyapartikül madde gözlenirse uygulanmamalıdır. 6. Flakonda kalan kullanılmayan kısım varsa atın. Flakonlardaki kullanılmayan kısımlarıBİRLEŞTİRMEYİN. Bir flakondan birden fazla doz UYGULAMAYIN. 7. KARFİLİB direkt olarak intravenöz infüzyonla veya %5 Enjeksiyonluk Dekstroz içeren 50ml ila 100 ml'lik bir intravenöz torba içinde uygulayın. İntravenöz push veya bolus olarakuygulanmamalıdır. 8. Bir intravenöz torba içerisinde uygulanırken 21 gauge veya daha büyük bir iğne (dış çapı0,8 mm veya daha küçük olan iğne) kullanarak hesaplanmış olan dozu flakondan çekin ve yalnızca %5 enjeksiyonluk dekstroz çözeltisi içeren 50 mL veya 100 mL'lik intravenöztorbanın içindeseyreltin (hesaplanan toplam doz ve infüzyon süresine göre).9. KARFİLİB uygulamasının hemen öncesinde ve sonrasında normal salin çözeltisi veya %5Enjeksiyonluk Dekstroz ile intravenöz uygulama yolunu yıkayın. 10. KARFİLİB'i başka tıbbi ürünlerle karıştırmayın veya infüzyon şeklinde başka tıbbiürünlerle birlikte uygulamayın. 7. RUHSAT SAHİBİSaba İlaç Sanayi ve Ticaret A.Ş. Halkalı Merkez Mah. Basın Ekspres Cad. No:1 34303 Küçükçekmece/İSTANBUL Tel: 0212 692 92 92Faks: 0212 697 00 24E-posta: [email protected] 8. RUHSAT NUMARASI2023/310 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 12.08.2023 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriKarfilib 60 Mg I.v. Enjeksiyonluk Çözelti Hazırlamak İçin TozEtken Maddesi: Karfilzomib Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.