Tecentriq 840 Mg/14 Ml İnfüzyonluk Çözelti Hazırlamak İçin Konsantre Kısa Ürün BilgisiKISA URUN BILGISIBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBİ ÜRÜNÜN ADITECENTRIQ 840 mg/14 mL infüzyonluk çözelti hazırlamak için konsantre Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMİEtkin madde:14 mL konsantre bir flakon içinde 840 mg atezolizumab içerir. Dilüsyondan sonra 1 mL solüsyon yaklaşık olarak 3,2 mg atezolizumab içerir (bkz. Bölüm 6.6). Atezolizumab, rekombinant DNA teknolojisiyle Çin hamsteri yumurtalık hücrelerinde üretilen, bir Fc bölgesi değiştirilmiş, hümanize IgG1 anti-programlı ölüm-ligandı 1 (PD-L1)monoklonal antikorudur. Yardımcı madde(ler):Yardımcı maddeler için Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMİnfüzyonluk çözelti hazırlamak için steril konsantre Berrak, renksiz ila hafif sarımsı sıvı 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarTECENTRIQ'in, tümörde PDL1 ekspresyonu %1 ve üzerinde olan (SP142 Ventana İmmünhistokimya ile), daha önce kemoterapi almamış metastatik veya rezeke edilemeyen üçlünegatif meme kanserli (ÜNMK) hastaların tedavisinde nab-paklitaksel ile kombine olarakkullanımı endikedir. Hastalar önceden adjuvan kemoterapi almışlarsa hastalıksız interval 12 ayve üzeri olmalıdır. 4.2. Pozoloji ve uygulama şekliTECENTRIQ, kanser tedavisinde deneyimli bir hekimin gözetimi altında uygulanmalıdır. Daha önce tedavi almamış ÜNMK hastaları, geçerliliği gösterilmiş bir test ile doğrulanan PD-L1 tümör ekspresyonuna dayanarak tedavi için seçilmelidir (bkz. Bölüm 5.1). Pozoloji/uygulama sıklığı ve süresi:Önerilen TECENTRIQ dozu, 100 mg/m2 nab-paklitakselden önce intravenöz yoldan uygulanan 840 mg'dır. Her 28 günlük siklusta, TECENTRIQ 1. ve 15. günlerde, nab-paklitaksel ise 1., 8.ve 15. günlerde uygulanır. Tedavi süresi:Klinik faydanın kaybedilmesine (bkz. Bölüm 5.1) veya yönetilemeyen toksisiteye kadar hastaların TECENTRIQ ile tedavi edilmeleri önerilmektedir. Geciken veya atlanan dozlar:Planlanmış bir TECENTRIQ dozu atlanırsa mümkün olan en kısa sürede uygulanmalıdır; planlanan sonraki doza kadar beklenmemelidir. Uygulama planı, dozlar arasında uygun biraralık korunacak şekilde ayarlanmalıdır. Tedavi sırasında doz modifikasyonları:TECENTRIQ için doz azaltımı önerilmez. Doz gecikmesi veya kesilmesi (ayrıca bkz. Bölüm 4.4 ve 4.8):
Hipotiroidizm veya hipertiroidizmAdrenal yetmezlikHipofizitŞiddet
Semptomatik
Semptomatik
2. veya 3. derece
4. derece Tedavi modifikasyonuTECENTRIQ tedavisine ara verilir. Hipotiroidizm:Semptomlar tiroid replasman tedavisi ile kontrol altınaalındığında ve TSH düzeyleridüşmeyebaşladığında tedaviye devam edilebilir. Hipertiroidizm:Semptomlar anti-tiroidilaçları ile kontrol altına alındığındave tiroid fonksiyonuiyileşmeyebaşladığında tedaviye devam edilebilir. TECENTRIQ tedavisine ara verilir. Semptomlar 12 hafta içinde 0. derece veya 1. dereceyeiyileştiğindeve kortikosteroidler günde <10 mg oral prednizon veyaeşdeğerine düşürüldüğündeve hastanın durumureplasman tedavisinde stabilhale geldiğinde tedaviyedevam edilebilir. TECENTRIQ tedavisine ara verilir. Semptomlar 12 hafta içinde 0. derece veya 1. dereceyeiyileştiğindeve kortikosteroidler günde <10 mg oral prednizon veyaeşdeğerine düşürüldüğündeve hastanın durumureplasman tedavisinde stabilhale geldiğinde tedaviyedevam edilebilir.
TECENTRIQ tamamen kesilir.
tedavisi
TECENTRIQ ile tedavi edilen hastalara ilacın riskleri hakkında bilgi veren Hasta Uyarı Kartları verilmelidir. Uygulama şekli:TECENTRIQ intravenöz kullanım içindir. TECENTRIQ infüzyonları intravenöz puşe veya bolus şeklinde uygulanmamalıdır. İlk TECENTRIQ dozu 60 dakika uygulanmalıdır. İlk infüzyon iyi tolere edilirse, sonraki tüm infüzyonlar 30 dakikada uygulanabilir. Tıbbi ürünün uygulanmadan önceden seyreltilmesi ve kullanımına ilişkin talimatlar için Bölüm 6.6'ya bakınız. Özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği:Popülasyon farmakokinetik analizine göre hafif veya orta derecede karaciğer bozukluğu olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer bozukluğu olan hastalara ilişkinveri mevcut değildir (bkz. Bölüm 5.2). Böbrek yetmezliği:Popülasyon farmakokinetik analizine göre hafif veya orta derecede böbrek bozukluğu olan hastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). Şiddetli böbrek yetmezliği olanhastalardan elde edilen veriler, bu popülasyon hakkında sonuca varmak için çok sınırlıdır. Pediyatrik popülasyon:TECENTRIQ'in 18 yaşından küçük çocuklarda ve adolesanlarda güvenliliği ve etkililiği belirlenmemiştir. Mevcut veriler Bölüm 4.8, 5.1 ve 5.2'de açıklanmıştır, ancak pozolojikonusunda herhangi bir öneri yapılamaz. Geriyatrik popülasyon:Popülasyon farmakokinetik analizine göre > 65 yaşındaki hastalarda TECENTRIQ doz ayarlaması gerekli değildir (bkz. Bölüm 4.8 ve 5.1). Doğu İşbirliği Onkoloji Grubu (ECOG) performans durumu skoru > 2:ECOG performans durumu skoru > 2 olan hastalar UNMK klinik çalışmasına dahil edilmemiştir (bkz. Bölüm 4.4 ve 5.1). 4.3. KontrendikasyonlarTECENTRIQ'in etkin maddesi atezolizumaba veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşırı duyarlılığı olan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriİmmünite ile ilişkili advers reaksiyonlar:TECENTRIQ ile tedavi sırasında oluşan immünite ile ilişkili advers reaksiyonların çoğu ilacın kesilmesi ve kortikosteroidlerin ve/veya destekleyici tedavinin başlatılmasıyla geridöndürülebilir olmuştur. Birden fazla vücut sistemini etkileyen immünite ile ilişkili adversreaksiyonlar görülmüştür ve bu reaksiyonlar TECENTRIQ'in son dozundan sonra daoluşabilir. İmmünite ile ilişkili şüpheli advers reaksiyonlar için etiyolojiyi doğrulamak veya diğer nedenleri dışlamak için yeterli değerlendirme yapılmalıdır. Advers etkilerin şiddetine bağlıolarak, TECENTRIQ tedavisine ara verilir ve kortikosteroid uygulanır. Olay < 1. dereceyeiyileştiğinde kortikosteroid kullanımı 1 ay boyunca azaltılarak kesilmelidir. İmmünite ileilişkili istenmeyen reaksiyonların kortikosteroid kullanımı ile kontrol edilemediği hastalarda,klinik çalışmalardan elde edilen sınırlı verilere dayanarak, diğer sistemik immunosupresanajanların kullanımı düşünülebilir. Herhangi bir > 3. derece toksisite ikinci defa ortaya çıkarsa ve replasman hormonlar ile kontrol edilen endokrinopatiler hariç herhangi bir 4. derece immünite ile ilişkili advers reaksiyongörülürse TECENTRIQ tedavisi tamamen kesilir (bkz. Bölüm 4.2 ve 4.8). İmmünite ile ilişkili pnömoni:TECENTRIQ ile yürütülen klinik çalışmalarda ölümcül vakalar da dahil olmak üzere pnömoni vakaları gözlenmiştir (bkz. Bölüm 4.8). Hastalar pnömoni belirtileri ve semptomları içinizlenmeli ve immün ilişkili pnömoni dışındaki nedenler dışlanmalıdır. 2. derece pnömoni durumunda TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg prednizon veya eşdeğeri ile tedavi başlatılmalıdır. Semptomlar <1. dereceye iyileşirsekortikosteroidler >1 ayda azaltılmalıdır. Olay 12 hafta içinde <1. dereceye iyileşirse vekortikosteroidler günde <10 mg oral prednizon veya eşdeğerine düşürülürse TECENTRIQ iletedaviye devam edilebilir. 3. veya 4. derece pnömoni durumunda TECENTRIQ ile tedavi kalıcıolarak bırakılmalıdır. İmmünite ile ilişkili hepatit:TECENTRIQ ile yürütülen klinik çalışmalarda bazıları ölümcül sonuçlara yol açan hepatit vakaları gözlenmiştir (bkz. Bölüm 4.8). Hastalar hepatit belirtileri ve semptomları içinizlenmelidir. Aspartat aminotransferaz (AST), alanin aminotransferaz (ALT) ve bilirubin, TECENTRIQ ile tedaviye başlamadan önce ve tedavi sırasında periyodik olarak ve klinik değerlendirmeye göreendike olduğu gibi izlenmelidir. 2. derece olay (ALT veya AST >3-5 x NÜS veya kan bilirubin >1,5-3 x NÜS) 5-7 günden uzun süre devam ederse TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg prednizon veyaeşdeğeri ile tedavi başlatılmalıdır. Olay <1. dereceye iyileşirse kortikosteroidler >1 aydaazaltılmalıdır. Olay 12 hafta içinde <1. dereceye iyileşirse ve kortikosteroidler günde <10 mg oral prednizon veya eşdeğerine düşürülürse TECENTRIQ ile tedaviye devam edilebilir. 3. veya 4. dereceolaylarda (ALT veya AST >5 x NÜS veya kan bilirubin >3 x NÜS) TECENTRIQ ile tedavikalıcı olarak bırakılmalıdır. İmmünite ile ilişkili kolit:TECENTRIQ ile yürütülen klinik çalışmalarda ishal veya kolit vakaları gözlenmiştir (bkz. Bölüm 4.8). Hastalar kolit belirtileri ve semptomları için izlenmelidir. 2. veya 3. derece ishal (başlangıca göre >4 dışkı/gün artış) veya kolit (semptomatik) durumunda TECENTRIQ ile tedaviye ara verilmelidir. 2. derece ishal veya kolit durumunda semptomlar >5 gün devam ederse veya nüksederse, günde 1-2 mg/kg prednizon veya eşdeğeri ile tedavibaşlatılmalıdır. 3. derece ishal veya kolit durumunda intravenöz kortikosteroidlerle (1-2mg/kg/gün metilprednizolon veya eşdeğeri) tedavi başlatılmalı ve iyileşme sonrasında oralkortikosteroidlere (günde 1-2 mg/kg prednizon veya eşdeğeri) geçilmelidir. Semptomlar <1.dereceye iyileşirse kortikosteroidler >1 ayda azaltılmalıdır. Olay 12 hafta içinde <1. dereceyeiyileşirse ve kortikosteroidler günde <10 mg oral prednizon veya eşdeğerine düşürülürseTECENTRIQ ile tedaviye devam edilebilir. 4. derece (yaşamı tehdit edici; acil müdahaleendike) ishal veya kolit durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır. Kolitile ilişkili potansiyel gastrointestinal perforasyon komplikasyonu dikkate alınmalıdır. İmmünite ile ilişkili endokrinopatiler:TECENTRIQ ile yürütülen klinik çalışmalarda hipotiroidizm, hipertiroidizm, adrenal yetmezlik, hipofizit ve diyabetik ketoasidoz dahil olmak üzere tip 1 diabetes mellitus vakalarıgözlenmiştir (bkz. Bölüm 4.8). Hastalar endokrinopatilerin klinik belirtileri ve semptomları için izlenmelidir. Tiroid fonksiyonu TECENTRIQ ile tedavi öncesinde ve tedavi sırasında periyodik olarak izlenmelidir.Başlangıçta anormal tiroid fonksiyon testleri olan hastaların uygun şekilde tedavi edilmesidüşünülmelidir. Anormal tiroid fonksiyonu olan asemptomatik hastalar TECENTRIQ alabilir. Semptomatik hipotiroidizm durumunda TECENTRIQ ile tedaviye ara verilmeli ve tiroid hormonureplasmanı gerektiğinde başlatılmalıdır. İzole hipotiroidizm kortikosteroidler kullanılmadanreplasman tedavisi ile yönetilebilir. Semptomatik hipertiroidizm durumunda TECENTRIQ iletedaviye ara verilmeli ve bir anti-tiroid tıbbi ürün gerektiği gibi başlatılmalıdır. Semptomlarkontrol altına alındığında ve tiroid fonksiyonu iyileştiğinde TECENTRIQ ile tedaviye devamedilebilir. Semptomatik adrenal yetmezlik durumunda TECENTRIQ ile tedaviye ara verilmeli ve intravenöz kortikosteroid (günde 1-2 mg/kg metilprednizolon veya eşdeğeri) ile tedavibaşlatılmalıdır. Semptomlar iyileştiğinde günde 1-2 mg/kg oral prednizon veya eşdeğeri iletedavi uygulanmalıdır. Semptomlar <1. dereceye iyileşirse kortikosteroidler >1 aydaazaltılmalıdır. Olay 12 hafta içinde <1. dereceye iyileşirse ve kortikosteroidler günde <10 mgoral prednizon veya eşdeğerine düşürülürse ve hastanın durumu replasman tedavisinde(gerektiyse) stabilse tedaviye devam edilebilir. 2. veya 3. derece hipofizit için TECENTRIQ ile tedaviye ara verilmeli ve intravenöz kortikosteroidler (1 ila 2 mg/kg/gün metilprednizolon veya eşdeğeri) ile tedavi başlatılmalı veihtiyaca göre hormon replasman tedavisi başlatılmalıdır. Belirtiler düzeldiğinde 1-2 mg/kg/günprednizon veya eşdeğeri ile tedavi uygulanmalıdır. Semptomlar <1. dereceye kadar yükselirse,kortikosteroidler > 1 ay boyunca azaltılarak kesilebilir. Olay, 12 hafta içinde <1. dereceyeyükselir ve kortikosteroidler günde < 10 mg prednizona veya eşdeğerine düşürülürse ve hastayedek tedavide (eğer gerekliyse) stabil kalırsa, tedaviye devam edilebilir. 4. derece hipofizitiçin TECENTRIQ tedavisine ara verilmelidir. Tip 1 diabetes mellitus için insülin tedavisi başlatılmalıdır. >3. derece hiperglisemi (açlık glikozu >250 mg/dL veya 13,9 mmol/L) durumunda TECENTRIQ ile tedaviye ara verilmelidir.İnsülin replasman tedavisinde metabolik kontrol elde edilirse TECENTRIQ ile tedaviye devamedilebilir. İmmünite ile ilişkili meningoensefalit:TECENTRIQ ile yürütülen klinik çalışmalarda meningoensefalit gözlenmiştir (bkz. Bölüm 4.8). Hastalar menenjit veya ensefalitin klinik belirtileri ve semptomları için izlenmelidir. Herhangi bir derece menenjit veya ensefalit durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır. İntravenöz kortikosteroidler (günde 1-2 mg/kg metilprednizolon veya eşdeğeri)ile tedavi başlatılmalı ve hastanın durumu iyileştiğinde 1-2 mg/kg oral prednizon veyaeşdeğerine geçilmelidir. İmmünite ile ilişkili nöropatiler:TECENTRIQ tedavisi gören hastalarda yaşamı tehdit edici olabilen miyastenik sendrom/miyastenia gravis veya Guillain-Barre sendromu gözlenmiştir. Hastalar motor veduyusal nöropati semptomları için izlenmelidir. Herhangi bir derece miyastenik sendrom/miyastenia gravis veya Guillain-Barre sendromu durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır. Günde 1-2 mg/kg dozda oralprednizon veya eşdeğeriyle sistemik kortikosteroidlerin başlatılması düşünülmelidir. İmmünite ile ilişkili pankreatit:TECENTRIQ ile yürütülen klinik çalışmalarda serum amilaz ve lipaz düzeylerinde artışlar dahil olmak üzere pankreatit gözlenmiştir (bkz. Bölüm 4.8). Hastalar akut pankreatitidüşündüren belirtiler ve semptomlar için yakından izlenmelidir. Serum amilaz veya lipaz düzeylerinde >3. derece artış (>2 x NÜS) veya 2. veya 3. derece pankreatit durumunda TECENTRIQ ile tedaviye ara verilmeli ve intravenöz kortikosteroidler(günde 1-2 mg/kg metilprednizolon veya eşdeğeri) ile tedavi başlatılmalıdır. Semptomlariyileştiğinde günde 1-2 mg/kg oral prednizon veya eşdeğeri ile tedavi uygulanmalıdır. Serumamilaz ve lipaz düzeyleri 12 hafta içinde <1. dereceye iyileştiğinde veya pankreatitsemptomları düzeldiğinde ve kortikosteroidler günde <10 mg oral prednizon veya eşdeğerinedüşürüldüğünde TECENTRIQ ile tedaviye devam edilebilir. 4. derece veya herhangi birderecede nükseden pankreatit durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır. İmmünite ile ilişkili miyokardit:TECENTRIQ ile yürütülen klinik çalışmalarda ölümcül vakalar da dahil olmak üzere miyokardit gözlemlenmiştir (bkz. Bölüm 4.8). Hastalar miyokarditi düşündüren belirtiler vesemptomlar için yakından izlenmelidir. Miyokardit ayrıca miyozitin klinik bir belirtisi olabilirve buna uygun olarak tedavi edilmelidir. Kardiyak veya kardiyopulmoner semptomları olan hastalar, uygun önlemlerin erken evrede başlatılabilmesi için potansiyel miyokardit açısından değerlendirilmelidir. Miyokardit şüphesivarsa, TECENTRIQ tedavisine ara verilmeli, günde 1 ila 2 mg/kg vücut ağırlığı/gün prednizonveya eşdeğeriyle sistemik kortikosteroidler başlanmalı ve güncel klinik kılavuzlara göre tanısalçalışmayla birlikte derhal kardiyoloji konsültasyonu yapılmalıdır. Miyokardit tanısıkonulduğunda, derece > 2 miyokardit için atezolizumab tedavisi kalıcı olarak kesilmelidir (bkz.Bölüm 4.2). İmmünite ile ilişkili nefrit:TECENTRIQ ile yapılan klinik çalışmalarda nefrit gözlenmiştir (bkz. Bölüm 4.8). Hastalar böbrek fonksiyonundaki değişiklikler açısından izlenmelidir. 2. derece nefrit durumunda TECENTRIQ tedavisine ara verilmeli ve günde 1 ila 2 mg/kg vücut ağırlığı/gün prednizon veya eşdeğeriyle sistemik kortikosteroidler başlanmalıdır. Olay 12 haftaiçinde derece < 1'e yükselirse ve kortikosteroidler günde < 10 mg prednizon veya eşdeğerinedüşürülürse atezolizumab ile tedaviye devam edilebilir. 3. veya 4. derece nefrit içinTECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır. İmmünite ile ilişkili miyozit:Atezolizumab ile ölümcül vakalar dahil miyozit vakaları gözlenmiştir (bkz. Bölüm 4.8). Hastalar miyozit belirti ve semptomları açısından izlenmelidir. Olası miyoziti olan hastalarmiyokardit belirtileri açısından izlenmelidir. Bir hastada miyozit belirti ve semptomları gelişirse, yakından takip edilmeli ve hasta zaman kaybetmeden değerlendirme ve tedavi için bir uzmana yönlendirilmelidir. 2. veya 3. derecemiyozit durumunda TECENTRIQ tedavisine ara verilmeli ve kortikosteroid tedavisi (1-2mg/kg vücut ağırlığı/gün prednizon veya eşdeğeri) başlatılmalıdır. Semptomlar derece < 1'eyükselirse, klinik olarak belirtildiği gibi kortikosteroidler azaltılmalıdır. Olay 12 hafta içindederece < 1'e yükselirse ve kortikosteroidler günde < 10 mg oral prednizon veya eşdeğerinedüşürülürse TECENTRIQ ile tedaviye devam edilebilir. 4. veya 3. derece tekrarlayan miyozitdurumunda veya başlangıçtan sonraki 12 hafta içinde kortikosteroid dozu günde <10 mgprednizon eşdeğerine düşürülemediğinde TECENTRIQ ile tedavi kalıcı olarak kesilmelidir. İmmünite ile ilişkili şiddetli kutanöz advers reaksiyonlar:TECENTRIQ ile tedavi edilen hastalarda Stevens-Johnson sendromu (SJS) ve toksik epidermal nekroliz (TEN) vakaları dahil olmak üzere immünite ile ilişkili şiddetli kutanöz adversreaksiyonlar (SCAR'lar) bildirilmiştir. Hastalar, şüpheli şiddetli cilt reaksiyonlar açısındanizlenmeli ve diğer sebepler dışlanmalıdır. Şüpheli SCAR'lar varlığında hastalar ileri tanı vetedavi için bir uzmana yönlendirilmelidir. Advers reaksiyonun derecesine bağlı olarak, 3. derece cilt reaksiyonu durumunda TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg prednizon veya eşdeğeri ilesistemik kortikosteroidler başlanmalıdır. Olay 12 hafta içinde derece < 1'e iyileşir vekortikosteroidler günde <10 mg prednizon veya eşdeğerine düşürülürse TECENTRIQ iletedaviye devam edilebilir. 4. derece cilt reaksiyonları için TECENTRIQ tedavisi kalıcı olarakbırakılmalı ve kortikosteroidler uygulanmalıdır. SJS veya TEN şüphesi olan hastalarda TECENTRIQ tedavisine ara verilmelidir. Doğrulanmış SJS veya TEN durumunda TECENTRIQ tedavisi kalıcı olarak kesilmelidir. Daha önce diğer immün sistemi uyarıcı antikanser ajanlarla tedavi sırasında ciddi veya yaşamı tehdit eden bir kutanöz advers reaksiyon deneyimleyen bir hastada TECENTRIQ kullanımıdüşünülürken dikkatli olunmalıdır. İmmünite ile ilişkili perikardiyal bozukluklar:TECENTRIQ ile perikardit, perikardiyal efüzyon ve kardiyak tamponad gibi bazıları ölümcül sonuçlara yol açan perikardiyal bozukluklar gözlenmiştir (bkz. Bölüm 4.8). Hastalar,perikardiyal bozuklukların klinik belirtileri ve semptomları açısından izlenmelidir. 1. derece perikardit şüphesi durumunda TECENTRIQ tedavisi durdurulmalı ve mevcut klinik kılavuzlara göre tanısal çalışmalarla derhal kardiyoloji konsültasyonu başlatılmalıdır. > 2. derece perikardiyal bozukluklardan şüphelenildiğinde, TECENTRIQ tedavisi kesilmeli, 1 ila 2 mg/kg vücut ağırlığı/gün prednizon veya eşdeğeri dozunda sistemik kortikosteroidlerle aciltedaviye başlanmalı ve mevcut klinik kılavuzlar doğrultusunda tanısal tetkik ile derhalkardiyoloji konsültasyonu başlatılmalıdır. Bir perikardiyal bozukluk olayı tanısı konulduktansonra, > 2. derece perikardiyal bozukluklar için TECENTRIQ tedavisi kalıcı olarakkesilmelidir (bkz. Bölüm 4.2). Hemofagositik lenfohistiyositoz:TECENTRIQ alan hastalarda ölümcül vakalar dahil olmak üzere hemofagositik lenfohistiyositoz (HLH) bildirilmiştir (bkz. Bölüm 4.8). Atipik veya uzamış sitokin salınımsendromu varlığı durumunda HLH değerlendirilmelidir. Hastalar HLH'nin klinik belirtileri vesemptomları açısından izlenmelidir. Şüpheli HLH durumunda TECENTRIQ kalıcı olarakkesilmeli ve hastalar ileri tanı ve tedavi için bir uzmana yönlendirilmelidir. İmmünite ile ilişkili diğer advers reaksiyonlar:TECENTRIQ'in etki mekanizması göz önüne alındığında, enfektif olmayan sistit dahil olmak üzere bağışıklıkla ilgili diğer potansiyel advers reaksiyonlar meydana gelebilir. Diğer nedenleri dışlamak için bağışıklıkla ilgili tüm şüpheli advers reaksiyonlar değerlendirilmelidir. Hastalar, bağışıklıkla ilgili advers reaksiyonların belirti ve semptomlarıaçısından izlenmeli ve reaksiyonun ciddiyetine bağlı olarak, klinik olarak belirtildiği gibi tedavideğişiklikleri ve kortikosteroidlerle gözetim altında tutulmalıdır (bkz. Bölüm 4.2 ve Bölüm4.8). İnfüzyon ile ilişkili reaksiyonlar:TECENTRIQ ile yürütülen klinik çalışmalarda infüzyon ile ilgili reaksiyonlar gözlenmiştir (bkz. Bölüm 4.8). 1. veya 2. derece infüzyon ile ilişkili reaksiyon görüldüğünde infüzyon hızı düşürülmeli veya tedaviye ara verilmelidir. 3. veya 4. derece infüzyon ile ilgili reaksiyon görüldüğündeTECENTRIQ tedavisi tamamen sonlandırılmalıdır. 1. veya 2. derece infüzyon ile ilişkilireaksiyon görülen hastalar yakından izlenerek TECENTRIQ almaya devam edebilir; buhastalarda antipiretik ve antihistaminiklerle premedikasyon değerlendirilebilir. Hastalığa özgü önlemlerMetastatik ÜNMK'de TECENTRIQ'in nab-paklitaksel ile kombinasyon halinde kullanımıTECENTRIQ ve nab-paklitaksel ile tedavi sırasında ortaya çıkan nötropeni ve periferik nöropatiler, nab-paklitakselin kesilmesiyle geri dönüşlü olabilir. Doktorlar, bu ilacın özelönlemleri ve kontrendikasyonları için nab-paklitaksel Kısa Ürün Bilgisine (KÜB)başvurmalıdır. Klinik çalışmalardan dışlanan hastalar:Otoimmün hastalık geçmişi, pnömoni geçmişi, aktif beyin metastazı, HIV, hepatit B veya hepatit C enfeksiyonu, önemli kardiyovasküler hastalık ve yetersiz hematolojik ve uç organişlevi olan hastalar TECENTRIQ ile yürütülen klinik çalışmalara alınmamıştır. Kayıttan önceki28 gün içinde canlı, atenüe aşı uygulanan hastalar; 4 hafta içinde sistemik immün sistemiuyarıcı ajan alan hastalar veya çalışmaya girişten 2 hafta önce sistemik immunosupresif tıbbiürün kullanan hastalar; çalışma tedavisinin başlamasından önceki 2 hafta içinde terapötik oralveya intravenöz antibiyotik kullanan hastalar klinik çalışmalara alınmamıştır. Hasta Uyarı Kartı:TECENTRIQ reçete eden hekimin hasta ile TECENTRIQ tedavisinin risklerini konuşması gerekmektedir. TECENTRIQ ile tedavi edilen hastalara ilacın riskleri hakkında bilgi verenHasta Uyarı Kartları verilmeli ve kartı her zaman yanlarında taşımaları söylenmelidir. Biyoteknolojik ürünlerin takip edilebilirliği:Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir. 4.5. Diğer tıbbi ürünlerle etkileşim ve diğer etkileşim biçimleriTECENTRIQ ile herhangi bir resmi farmakokinetik ilaç etkileşimi çalışması yapılmamıştır. TECENTRIQ dolaşımdan katabolizma ile temizlendiği için metabolik ilaç-ilaç etkileşimleribeklenmemektedir. TECENTRIQ ile tedaviye başlamadan önce, TECENTRIQ'in farmakodinamik aktivitesine ve etkililiğine yapabilecekleri potansiyel etkiler nedeniyle sistemik kortikosteroidlerin veyaimmunosupresanların kullanılmasından kaçınılmalıdır. Bununla birlikte, sistemikkortikosteroidler veya diğer immunosupresif maddeler, TECENTRIQ tedavisine başladıktansonra immünite ile ilişkili advers reaksiyonların tedavisinde kullanılabilir (bkz. Bölüm 4.4). Özel popülasyonlara ilişkin ek bilgiler:TECENTRIQ ile herhangi bir farmakokinetik ilaç etkileşimi çalışması yapılmamıştır. Pediyatrik popülasyon:TECENTRIQ ile pediyatrik popülasyonda herhangi bir farmakokinetik ilaç etkileşimi çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi: D Çocuk doğurma potansiyeli bulunan kadınlar/doğum kontrolü (kontrasepsiyon):Çocuk doğurma potansiyeline sahip kadınlar TECENTRIQ ile tedavi sırasında ve tedaviden 5 ay sonrasına kadar etkili bir doğum kontrol yöntemi kullanmalıdır. Gebelik dönemi:Atezolizumabın fetüs üzerinde zararlı farmakolojik etkileri bulunmaktadır. Atezolizumab ile gelişimsel çalışmalar ve üreme çalışmaları yapılmamıştır. Hayvan çalışmalarıyla, PD-L1/PD-1yolak inhibisyonunun fare veya sıçan gebelik modellerinde immünite ile ilişkili, fetüs ölümüylesonuçlanan fetüs gelişiminin reddine sebep olduğu gösterilmiştir (bkz. Bölüm 5.3). İnsanlarayönelik potansiyel risk bilinmemektedir ancak hayvan çalışmalarından alınan sonuçlar, etkimekanizmasına bağlı olarak, gebelik döneminde atezolizumab uygulamasının artmış düşük veölü doğum oranları dahil olmak üzere fötal zarara sebep olabileceğini göstermektedir. Atezolizumab bir insan G1 immünoglobülinidir (IgG1) ve IgG1'in plasenta engelini aştığı bilinmektedir. Bu nedenle, atezolizumabın anneden gelişmekte olan fetüse geçme potansiyelibulunmaktadır. Gebe kadınların klinik durumu atezolizumab ile tedavi gerektirmedikçe gebelik sırasında TECENTRIQ kullanılmamalıdır. Laktasyon dönemi:Atezolizumabın anne sütüne geçip geçmediği bilinmemektedir. Atezolizumab bir monoklonal antikordur ve ilk gelen sütte bulunması ve daha sonra da az miktarda sütte bulunmasıbeklenmektedir. Yeni doğanlar ve infantlar üzerindeki risk dışlanamaz. Emzirmenin çocuk içinfaydaları ve tedavinin anne için faydaları dikkate alınarak emzirmenin kesilmesi veyaTECENTRIQ tedavisinin kesilmesi kararlaştırılmalıdır. Üreme yeteneği/fertilite:Atezolizumabın fertilite üzerindeki olası etkilerine ilişkin veri bulunmamaktadır. Atezolizumabın doğurganlık üzerindeki etkisini değerlendirme amaçlı reprodüktif vegelişimsel toksisite çalışmaları yapılmamıştır. Bununla birlikte, 26 haftalık tekrarlanan doztoksisitesi çalışmasına dayalı olarak, atezolizumabın, önerilen dozu alan hastalarda eğri altıalanı (EAA)'nın yaklaşık 6 katı tahmini bir EAA'da adet döngüleri üzerinde bir etkiye sahipolduğu ve bu etkinin geri dönüşümlü olduğu görülmüştür (bkz. Bölüm 5.3). Erkek üremeorganları üzerinde etki görülmemiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerTECENTRIQ'in araç ve makine kullanma yeteneği üzerinde düşük düzeyde etkisi vardır. Yorgunluk hisseden hastalara semptomlar hafifleyene kadar araç ve makine kullanmamalarıtavsiyesinde bulunulmalıdır (bkz. Bölüm 4.8). 4.8. İstenmeyen etkilerGüvenlilik profilinin özeti:TECENTRIQ monoterapisinin güvenliliği, birden fazla tümör tipinde 4349 hastadan toplanan verilere dayanmaktadır. En yaygın advers reaksiyonlar, (>%10) yorgunluk (%30,1), iştahazalması (%21,3), bulantı (%20), döküntü (%19,3), ateş (%19), öksürük (%18,6), ishal (%18),dispne (%17,2), artralji (%16,7), asteni (%13,2), kaşıntı (%13,2), sırt ağrısı (%12,8), kusma(%12,5), idrar yolu enfeksiyonu (%11,5) ve baş ağrısı (%10,3) olmuştur. TECENTRIQmonoterapi çalışmalarının tanımı için, TECENTRIQ 1200 mg/20 mL infüzyonluk çözeltihazırlamak için konsantre'nin Kısa Ürün Bilgisi'ne bakınız. Diğer tıbbi ürünlerle kombinasyon halinde verilen TECENTRIQ'in güvenliliği, birden fazla tümör tipinde 4535 hastada değerlendirilmiştir. En yaygın advers reaksiyonlar (> %20) anemi(%36,8), nötropeni (%36,6), bulantı (%35,5), yorgunluk (%33,1), alopesi (%28,1), döküntü(%27,8), ishal (27,6), trombositopeni (%27,1), kabızlık (%25,8), iştah azalması (%24,7) veperiferik nöropati (%24,4) olmuştur. Ciddi advers reaksiyonlarla ilgili daha fazla bilgi için bkz. Bölüm 4.4. Advers reaksiyonların tablo halinde listesi:Advers İlaç Reaksiyonları (ADR), TECENTRIQ monoterapisi ve kombinasyon terapisi için Tablo 2'de MedDRA sistem organ sınıfına (SOC)ve sıklık kategorilerine göre aşağıda listelenmiştir.Aşağıdaki sıklık kategorileri kullanılmıştır: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketletahmin edilemiyor). Her bir sıklık grubunda advers reaksiyonlar azalan ciddiyet sırasına göreverilmektedir. Tablo 2: TECENTRIQ ile tedavi edilen hastalarda meydana gelen advers reaksiyonların özeti
a İdrar yolu enfeksiyonu, sistit, piyelonefrit, escherichia idrar yolu enfeksiyonu, bakteriyel idrar yolu enfeksiyonu, böbrek enfeksiyonu, akut piyelonefrit, kronik piyelonefrit, piyelit, böbrek apsesi, streptokokal idrar yoluenfeksiyonu, üretrit, idrar yolu enfeksiyonu mantarı, psödomonal idrar yollan enfeksiyon raporlarını içerir.b Pnömoni, bronşit, alt solunum yolu enfeksiyonu, enfeksiyöz plevral efüzyon, trakeobronşit, atipik pnömoni,akciğer apsesi, kronik obstrüktif solunum yolu hastalığının enfektif alevlenmesi, parakanseröz pnömoni,piyopnömotoraks, plevral enfeksiyon, prosedür sonrası pnömoni raporlarını içerir.c Kan kreatinin artışı, hiperkreatininemi raporlarını içerir.d Trombositopeni, trombosit sayısında azalma raporlarım içerir.e Nötropeni, nötrofil sayısında azalma, ateşli nötropeni, nötropenik sepsis, granülositopeni raporlarını içerir. f Beyaz kan hücresi sayısında azalma, lökopeni raporlarını içerir.g Lenfopeni, lenfosit sayısında azalma raporlarını içerir.h İnfüzyonla ilgili reaksiyon, sitokin salınım sendromu, aşın duyarlılık, anafilaksi raporlarını içerir. i Anti-tiroid antikoru pozitif, otoimmün hipotiroidizm, otoimmün tiroidit, kan tiroid uyarıcı hormon anormal, kantiroid uyarıcı hormon azalmış, kan tiroid uyarıcı hormon artmış, ötiroid hasta sendromu, guatr, hipotiroidizm,immün aracılı hipotiroidizm, miksödem, miksödem koma, primer hipotiroidizm, tiroid bozukluğu, tiroidhormonlarında azalma, tiroid fonksiyon testlerinde anormallik, tiroidit, akut tiroidit, tiroksin azalması, tiroksinserbestliği azalması, tiroksin serbest artışı, tiroksin artışı, tri-iyodotironin azalması, tri-iyodotironin serbestanormal, tri-iyodotironin serbest azalmış, tri-iyodotironin serbest artmış, sessiz tiroidit, kronik tiroidit raporlarınıiçerir.j Hipertiroidizm, Basedow hastalığı, endokrin oftalmopati, ekzoftalmi raporlarını içerir. k Diabetes mellitus, tip 1 diabetes mellitus, diyabetik ketoasidoz, ketoasidoz raporlarını içerir.' Adrenal yetmezlik, kan kortikotropininde azalma, glukokortikoid eksikliği, primer adrenal yetmezlik, sekonder adrenokortikal yetmezlik raporlarını içerir.m Hipofizit, sıcaklık düzenleme bozukluğu raporlarını içerir. n Hipomagnezemi, kan magnezyumunda azalma raporlarını içerir.o Periferik nöropati, otoimmün nöropati, periferik duyusal nöropati, polinöropati, herpes zoster, periferik motor nöropati, nevraljik amiyotrofi, periferik sensorimotor nöropati, toksik nöropati, aksonal nöropati, lumbosakralpleksopati, nöropatik artropati, periferik sinir enfeksiyonu, nevrit, immün- aracılı nöropati raporlarını içerir.p Guillain-Barre sendromu, demiyelinizan polinöropati raporlarını içerir.q Ensefalit, otoimmün ensefalit, menenjit, fotofobi raporlarını içerir.r Myastenia gravis raporlarını içerir.s Miyokardit, otoimmün miyokardit ve immün aracılı miyokardit raporlarını içerir.* Pnömonit, akciğer infiltrasyonu, bronşiolit, immün aracılı pnömoni, interstisyel akciğer hastalığı, alveolit, akciğer opasitesi, pulmoner toksisite, radyasyon pnömonisi raporlarını içerir.u İshal, dışkılama aciliyeti, sık bağırsak hareketleri, hemorajik ishal, gastrointestinal hipermotilite raporlarını içerir.v Kolit, otoimmün kolit, iskemik kolit, mikroskobik kolit, ülseratif kolit, diversiyon kolit, immün aracılı enterokolit raporlarını içerir.w Orofaringeal ağrı, orofaringeal rahatsızlık, boğaz tahrişi raporlarını içerir. x Otoimmün pankreatit, pankreatit, akut pankreatit, lipaz artışı, amilaz artışı raporlarını içerir.y Asit, otoimmün hepatit, hepatoselüler hasar, hepatit, akut hepatit, toksik hepatit, hepatotoksisite, karaciğerbozukluğu, ilaca bağlı karaciğer hasarı, karaciğer yetmezliği, karaciğer yağlanması, karaciğer lezyonu, özofagusvaris kanaması, özofagus varisi raporlarını içerir.z Akne, püstüler akne, su toplaması, kan kabarcığı, dermatit, akneiform dermatit, alerjik dermatit, eksfolyatif dermatit, ilaç döküntüsü, egzama, enfekte egzama, eritem, göz kapağı eritemi, göz kapağı döküntüsü, sabitdöküntü, folikülit, fronkül, el dermatit, dudak kabarcığı, oral kan kabarcığı, palmar-plantar eritrodisestezisendromu, pemfigoid, döküntü, eritematöz döküntü, foliküler döküntü, jeneralize döküntü, maküler döküntü,makülo-papüler döküntü, papüler döküntü, papüloskuamöz döküntü, kaşıntılı döküntü, püstüler döküntü,veziküler döküntü , skrotal dermatit, seboreik dermatit, cilt pul pul dökülme, cilt toksisitesi, cilt ülseri.aa Kas-iskelet ağrısı, kas ağrısı, kemik ağrısı raporlarını içerir.ab Miyozit, rabdomiyoliz, polimiyalji romatika, dermatomiyozit, kas apsesi, idrarda miyoglobin varlığı raporlarını içerir.ac Proteinüri, idrarda protein varlığı, hemoglobinüre, idrar anormalliği, nefrotik sendrom, albüminüri raporlarını içerir.ad Nefrit, otoimmün nefrit, Henoch-Schonlein Purpura nefriti, paraneoplastik glomerülonefrit, tübülointerstisyel nefrit raporlarını içerir.ae Hipokalemi, kan potasyumunda azalma raporlarını içerir.af Hiponatremi, kan sodyumunda azalma raporlarını içerir.ag Hipoksi, oksijen satürasyonunda azalma, pO2azalması raporlarını içerir.Alopesi, madarosis, alopecia areata, alopecia totalis, hipotrikoz raporlarını içerir. ai Hipertansiyon, kan basıncı artışı, hipertansif kriz, sistolik kan basıncı artışı, diyastolik hipertansiyon, uygunşekilde kontrol edilemeyen kan basıncı, hipertansif retinopati, hipertansif nefropati, esansiyel hipertansiyon,ortostatik hipertansiyon raporlarını içerir.aj Sepsis, septik şok, ürosepsis, nötropenik sepsis, pulmoner sepsis, bakteriyel sepsis, klebsiella sepsis, abdominal sepsis, kandida sepsisi, escherichia sepsis, pseudomonal sepsis, stafilokokal sepsis raporlarını içerir.ak Dermatit büllöz, eksfolyatif döküntü, eritema multiforme, genelleştirilmiş dermatit eksfolyatif, toksik deridöküntüsü, Stevens-Johnson sendromu, eozinofili ile ilaç reaksiyonu ve sistemik semptomlar, toksik epidermalnekroliz, kutanöz vaskülit raporlarını içerir.al Enfektif olmayan sistit ve immün aracılı sistit raporlarını içerir.Nazofarenjit, burun tıkanıklığı ve burun akıntısı raporlarını içerir.Sedef hastalığı, sedef dermatiti, guttat sedef hastalığı raporlarını içerir. ao Perikardit, perikardiyal efüzyon, kardiyak tamponad ve konstriktif perikardit raporlarını içerirSeçilen advers reaksiyonların açıklaması:Aşağıdaki veriler, klinik açıdan anlamlı advers reaksiyonlarla ilgili olarak TECENTRIQ monoterapisine maruziyeti yansıtır (bkz. Bölüm 5.1). Kombinasyon tedavisi olarakverildiğinde TECENTRIQ için seçilen advers reaksiyonlarla ilgili ayrıntılar, yalnızcaTECENTRIQ monoterapisine kıyasla klinik açıdan anlamlı farklılıkların bildirilmesidurumunda sunulmaktadır. Bu advers reaksiyonlar için yönetim kılavuzları Bölüm 4.2 ve 4.4'tetanımlanmıştır. İmmünite ile ilişkili pnömoni:Pnömoni, TECENTRIQ monoterapisi gören hastaların %3'ünde (130/4349) meydana gelmiştir. 130 hasta içinde iki ölümcül olay olmuştur. Başlangıca kadar geçen medyan süre 4 ay (aralık: 3gün - 29,8 ay) olmuştur. Medyan süre 1,6 ay (aralık: 1 gün - 27,8+ ay; "+" sansürlenmiş birdeğeri gösterir) olmuştur. Pnömoni, 29 hastada (%0,7) TECENTRİQ'in bırakılmasına yolaçmıştır. Kortikosteroid kullanımı gerektiren pnömoni, TECENTRIQ monoterapisi görenhastaların % 1,7'sinde (76/4349) meydana gelmiştir. İmmünite ile ilişkili hepatit:Hepatit, TECENTRIQ monoterapisi gören hastaların %1,7'sinde (75/4349) meydana gelmiştir. 75 hasta içinde iki ölümcül olay olmuştur. Başlangıca kadargeçen medyan süre 1,6 ay (aralık: 7 gün - 18,8 ay) olmuştur. Medyan süre 2,1 ay (aralık: 1 gün- 22+ ay; "+" sansürlenmiş bir değeri gösterir) olmuştur. Hepatit, 13 hastada (%0,3)atezolizumabın bırakılmasına yol açmıştır. Kortikosteroid kullanımı gerektiren hepatit,TECENTRIQ monoterapisi gören hastaların %0,5'inde (22/4349) meydana gelmiştir.İmmünite ile ilişkili kolit:Kolit, TECENTRIQ monoterapisi gören hastaların %1,1'inde (50/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 5,1 ay (aralık: 15 gün - 17,2 ay) olmuştur. Medyan süre1,2 ay (aralık: 1 gün - 35,9+ ay; "+" sansürlenmiş bir değeri gösterir) olmuştur. Kolit, 17hastada (%0,4) atezolizumabın bırakılmasına yol açmıştır. Kortikosteroid kullanımı gerektirenkolit TECENTRIQ monoterapisi gören hastaların %0,6'sında (24/4349) meydana gelmiştir. İmmünite ile ilişkili endokrinopatiler:Tiroid bozuklukları:Hipotiroidizm, TECENTRIQ monoterapisi gören hastaların % 7,6'sında (331/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 4,3 ay (aralık: 1 gün - 34,5 ay) olmuştur. Hipertiroidizm, TECENTRIQ monoterapisi gören hastaların %2,1'inde (93/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 2,6 ay (aralık: 1 gün - 24,3 ay) olmuştur. Adrenal yetmezlik:Adrenal yetmezlik, TECENTRIQ monoterapisi gören hastaların %0,5'inde (21/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 6,1 ay (aralık: 2 gün - 21,4 ay) olmuştur.Adrenal yetmezlik nedeniyle 5 (%0,1) hastada TECENTRİQ kullanımı bırakılmıştır.Kortikosteroid kullanımı gerektiren adrenal yetmezlik TECENTRIQ monoterapisi görenhastaların %0,4'ünde (17/4349) meydana gelmiştir. Hipofizit:Hipofizit, TECENTRIQ monoterapisi gören hastaların %0,1'inden azında (4/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 6,1 ay (aralık: 23 gün - 13,7 ay'dır) olmuştur.Üç hastada (<%0,1) kortikosteroid kullanımı gerekmiştir ve 1 (<%0,1) hastada TECENTRIQtedavisi durdurulmuştur. Hipofizit, TECENTRIQ ile kombinasyon halinde nab-paklitaksel ve karboplatin tedavisi gören hastaların %0,4'ünde (2/473) meydana gelmiştir. Başlangıca kadar geçen medyan süre 5,2 ay(aralık: 5,1 - 5,3 ay) olmuştur. Her iki hastada da kortikosteroid kullanımı gerekmiştir. Diabetes mellitus:Diabetes mellitus, TECENTRIQ monoterapisi gören hastaların % 0,5'inde (20/4.349) meydana gelmiştir. Medyan süre 5,5 ay (aralık: 4 gün - 29 ay) olmuştur. Diabetes mellitus, <%0,1(3/4.349) hastada TECENTRIQ'in bırakılmasına yol açmıştır. İmmünite ile ilişkili meningoensefalit:Menenjit, TECENTRIQ monoterapisi gören hastaların %0,4'ünde (18/4.349) meydana gelmiştir. Başlangıca kadar geçen süre 16 gün (aralık: 1 gün - 12,5 ay) olmuştur. Medyan süre22 gün (aralık: 6 gün ila 14,5+ ay; +, sansürlenmiş bir değeri gösterir) olmuştur. Kortikosteroid kullanımını gerektiren menenjit TECENTRIQ tedavisi gören
,2) hastada TECENTRIQ'in
hastaların %0,2'sinde (10/4.349) meydana gelmiştir ve 8 bırakılmasına yol açmıştır. İmmünite ile ilişkili nöropatiler:Guillain-Barre sendromu ve demiyalizan polinöropati, TECENTRIQ monoterapisi gören hastaların %0,1'inde (6/4.349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 4,1 ay(aralık: 17 gün - 8,1 ay) olmuştur. Medyan süre 8 ay (aralık: 19 gün - 24,5 ay+, "+"sansürlenmiş bir değeri gösterir). Bir (<%0,1) hasta, Guillain-Barre sendromu nedeniyleTECENTRIQ kullanımını bırakmıştır. Kortikosteroid kullanımı gerektiren Guillain-Barresendromu TECENTRIQ tedavisi gören hastaların %0,1'inden azında (3/4.349) meydanagelmiştir. Miyastenik sendrom:Miyestenia gravis, TECENTRIQ monoterapisi gören hastaların <%0,1'inde (1/4349) meydana gelmiştir. Başlangıca kadar geçen süre 1,2 aydır. İmmünite ile ilişkili pankreatit:Yüksek amilaz ve yüksek lipaz dahil olmak üzere pankreatit, TECENTRIQ monoterapisi gören hastaların %0,7'sinde (32/4.349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 5,5ay (aralık: 1 gün - 24,8 ay) olmuştur. Medyan süre 24 gün (aralık: 3+ gün - 22,4+ ay; "+"sansürlenmiş bir değeri gösterir) olmuştur. Pankreatit, 3 hastada (<%0,1) TECENTRIQ'inbırakılmasına yol açmıştır. Kortikosteroid kullanımı gerektiren pankreatit olgularıTECENTRIQ monoterapisi gören hastaların %0,1'inde (5/4.349) meydana gelmiştir. İmmünite ile ilişkili miyokardit:Miyokardit, TECENTRIQ monoterapisi gören hastaların <%0,1'inde (3/4.349) meydana gelmiştir. 3 hastadan biri, adjuvan KHDAK tedavisi sırasında ölümcül bir olay yaşamıştır.Başlangıca kadar geçen medyan süre 2,1 ay (aralık: 1,5 ay - 4,9 ay) olmuştur. Medyan süre 14gün (aralık: 14 gün - 2,8 ay) olmuştur. İki hastada (<%0,1) kortikosteroid kullanımı gerekmiştirve 2 (<%0,1) hastada TECENTRIQ tedavisi durdurulmuştur. İmmünite ile ilişkili nefrit:Nefrit, TECENTRIQ tedavisi gören hastaların %0,2'sinde (10/4.349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 5 ay (aralık: 2 gün - 17,5 ay) olmuştur. Nefrit 5 hastada(%0,1) TECENTRIQ'in bırakılmasına neden olmuştur. Dört hastada (<%0,1) kortikosteroidkullanımına gerek duyulmuştur. İmmünite ile ilişkili miyozit:Miyozit, TECENTRIQ monoterapisi gören hastaların %0,5'inde (20/4.349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 3,3 aydır (aralık: 12 gün - 11 ay). Medyan süre 5,7 ay(aralık: 2 gün - 36,9 +ay; + sansürlenmiş bir değeri gösterir). Miyozit 2 hastada (<%0,1)TECENTRIQ'in bırakılmasına neden olmuştur. 7 hastada (%0,2) kortikosteroid kullanımınagerek duyulmuştur. İmmünite ile ilişkili şiddetli kutanöz advers reaksiyonlar:TECENTRIQ monoterapisi gören hastaların %0,6'sında (28/4.349) şiddetli kutanöz advers reaksiyonlar meydana gelmiştir. 28 hastadan birinde ölümcül olay meydana gelmiştir.Başlangıca kadar geçen medyan süre 5,2 aydır (aralık: 4 gün - 15,5 ay). Medyan süre 2,4 ay(aralık: 1 gün - 37,5 +ay; + sansürlenmiş bir değeri gösterir). Şiddetli kutanöz adversreaksiyonlar 3 hastada (< %0,1) TECENTRIQ tedavisinin bırakılmasına neden olmuştur. %0,2hastada (9/4.349) kortikosteroid kullanımına gerek duyulmuştur. İmmünite ile ilişkili perikardiyal bozukluklar:TECENTRIQ monoterapisi gören hastaların %1,1'inde (47/4349) perikardiyal bozukluklar meydana gelmiştir. Başlangıca kadar geçen medyan süre 1,4 aydır (aralık: 6 gün - 17,5 ay).Medyan süre 1,4 aydır (aralık: 0 ila 19,3+ ay; "+" sansürlenmiş bir değeri gösterir). Perikardiyalbozukluklar 3 hastada (< %0,1) TECENTRIQ tedavisinin kesilmesine neden olmuştur.Kortikosteroid kullanımını gerektiren perikardiyal bozukluklar hastaların %0,2'sinde (7/4349)meydana gelmiştir. İmmünojenite:Çoklu faz II ve III çalışmalarında, hastaların %13,1 ile %54,1'i tedaviyle ortaya çıkan anti-ilaç antikorları (ADA) geliştirmiştir. Tedavi sonucu oluşmuş anti-ilaç antikoru (ADA) gelişenhastaların başlangıçta genel olarak sağlık durumu ve hastalık özellikleri açısından daha zayıfolduğu görülmüştür. Başlangıçtaki bu sağlık ve hastalık özelliklerindeki dengesizlikler,farmakokinetik, etkililik ve güvenlilik analizlerinin yorumlanmasında karışıklıkyaratabilmektedir. Anti-ilaç antikorlarının (ADA) etkililiğe etkisini araştırmak içinbaşlangıçtaki sağlık ve hastalık özelliklerindeki dengesizlikleri ayarlayan keşif analizleriyapılmıştır. Bu analizlerde ADA geliştiren hastaların, ADA geliştirmeyen hastalara kıyaslaetkililik faydasında azalma olasılığı gözardı edilmemiştir. Anti-ilaç antikorlarının başlangıcakadar geçen medyan süresi 3 ila 5 hafta olmuştur. TECENTRIQ monoterapisi (N=3.460) ve kombinasyon tedavisi (N=2285) gören hastalardan elde edilen hasta havuzu verilerinden, ADA-pozitif popülasyonuna karşı ADA-negatifpopülasyonundan elde edilen advers olayların sıklığı sırasıyla: Monoterapi için; 3. ve 4. dereceyan etkiler %42,6'ya karşı %39,4, ciddi yan etkiler %39,6'ya karşı %33,3, tedavininkesilmesine neden olan yan etkiler %8,5'e karşı %7,8 iken; Kombinasyon tedavisi için 3. ve 4.derece yan etkiler, %63,9'a karşı %60,9, ciddi yan etkiler %43,9'a karşı 35,6, tedavininkesilmesine neden olan yan etkiler % 22,8'e karşı %18,4 olmuştur (kombinasyon tedavisiiçin).Ancak mevcut verilerden yola çıkarak olası ilaç advers reaksiyonlarının yolağı hakkındakesin sonuçlara varılamamaktadır. Pediyatrik popülasyon:TECENTRIQ'in çocuklar ve adölesanlardaki güvenliliği bilinmemektedir. 69 pediyatrik hastada (<18 yaş) yapılan bir klinik çalışmada yeni bir güvenlilik sinyali oluşmamıştır vegüvenlilik profili erişkinlerinki ile karşılaştırılabilirdir. Geriyatrik popülasyon:TECENTRIQ monoterapisi gören 65 yaş ve üzerindeki hastalar ile daha genç hastalar arasında genel olarak bir güvenlilik farklılığı gözlemlenmemiştir. Şüpheli advers reaksiyonların raporlanması:Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarmm raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr[email protected]:4.9. Doz aşımı ve tedavisiAtezolizumab doz aşımına ilişkin bilgi mevcut değildir. Doz aşımı durumunda, hastalar advers reaksiyon belirtileri veya semptomları bakımından yakından izlenmeli ve uygun semptomatik tedavi başlatılmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastikler ve İmmünomodülatör ajanlar, Monoklonal Antikorlar ve Antikor İlaç Konjugatları, PD-1/PDL-1 (Programlanmış hücre ölüm proteini 1 /ölüm ligandı 1) İnhibitörleri ATC kodu: L01FF05 Etki mekanizması:Hümanize IgG1 anti-programlı ölüm-ligandı 1(PD-L1), tümör hücreleri ve/veya tümör infiltre eden immün hücrelerinde eksprese olabilir ve tümör mikroortamında anti-tümör immünyanıtının inhibisyonuna katkıda bulunabilir. PD-L1'in T-hücrelerinde ve antijen sunanhücrelerde bulunan PD-1 ve B7.1 reseptörlerine bağlanması, sitotoksik T-hücre aktivitesini,T-hücre çoğalmasını ve sitokin üretimini baskılar. Atezolizumab Fc bölgesi değiştirilmiş bir hümanize immünoglobülin G1 (IgG1) monoklonal antikorudur; doğrudan PD-L1'e bağlanır ve PD-1 ve B7.1 reseptörlerinin ikili blokajınısağlayarak, antikor bağımlı hücresel sitotoksisiteyi indüklemeden antitümör immün yanıtınyeniden aktive edilmesi de dahil, immün yanıtın PD-L1/PD-1 aracılı inhibisyonunu serbestbırakır. Atezolizumab, PD-L2/PD-1 etkileşimini koruyarak PD-L2/PD-1 aracılı inhibitörsinyallerin devam etmesine izin verir. Klinik etkililik ve güvenlilik:1200 mg dozda üç haftada bir uygulanan TECENTRIQ ile yapılan çalışmaların tanımı için, TECENTRIQ 1200 mg/20 mL infüzyonluk çözelti hazırlamak için konsantre'nin Kısa ÜrünBilgisi'ne bakınız. Üçlü negatif meme kanseri IMpassion130 (WO29522): Daha önce metastatik hastalık için tedavi edilmemiş, lokal ileri veya metastatik ÜNMK hastalarında randomize faz III çalışmaMetastatik hastalık için daha önce kemoterapi almamış, rezeke edilemeyen, lokal ileri veya metastatik ÜNMK olan hastalarda, atezolizumab ile nab-paklitakselin etkililik ve güvenliliğinideğerlendirmek için Faz III, çift kör, iki kollu, çok merkezli, uluslararası, randomize, plasebokontrollü bir çalışma olan IMpassion130 yürütülmüştür. Taksan monoterapisi için uygun olanhastalar seçilmiştir (yani hızlı klinik ilerlemenin olmaması, yaşamı tehdit eden viseralmetastazların veya hızlı semptom ve/veya hastalık kontrolü ihtiyacının olmaması). Son 12 ayiçerisinde neoadjuvan veya adjuvan ortamında kemoterapi alan hastalar, otoimmün hastalıköyküsü olan, randomizasyondan önceki 4 hafta içinde bir canlı atenüe aşı, randomizasyondanönceki 4 hafta içinde sistemik immünostimülatör ajan uygulanmış veya randomizasyondanönceki 2 hafta içinde sistemik immunosupresif tıbbi ürün kullanmış hastalar, tedavi edilmemişsemptomatik veya kortikosteroide bağlı beyin metastazı öyküsü olan hastalar dahiledilmemiştir. Tümör değerlendirmeleri, 1. döngünün (1. gün) ardından ilk 12 ay süreyle 8haftada (± 1 hafta) bir ve sonrasında 12 haftada (± 1 hafta) bir olmak üzere gerçekleştirilmiştir. Toplamda 902 hasta çalışmaya dahil edilmiş ve karaciğer metastazı varlığı, taksan tedavisi öyküsü ve tümör infiltre edici immün hücrelerde (IC) PD-L1 ekspresyonu durumuna göretabakalandırılmıştır (PD-L1 ile boyanmış tümör infiltre edici immün hücreler [IC] < %1VENTANA PD-L1 (SP142) testi ile değerlendirilen tümör alanına karşı tümör alanının > %1'i). Hastalar, her 28 günlük siklusta 1. ve 15. günlerde intravenöz infüzyon yoluyla atezolizumab 840 mg veya plasebo ve her 28 günlük siklusta 1., 8. ve 15. günlerde intravenöz infüzyonyoluyla nab-paklitaksel (100 mg/m2) almak üzere randomize edilmiştir. Hastalar, RECIST v1.1uyarınca radyografik hastalıkta ilerleme veya kabul edilemez bir toksisite meydana gelenekadar tedavi görmüştür. Kabul edilemez toksisite nedeniyle nab-paklitaksel durdurulduğundaatezolizumab ile tedaviye devam edilebilir. Her tedavi kolunda medyan tedavi döngüsü sayısıatezolizumab için 7 ve nab-paklitaksel için 6'dır. Çalışma popülasyonunun demografik ve başlangıç özellikleri, tedavi kolları arasında iyi dengelenmiştir. Hastaların çoğu kadındır (%99,6), %67,5'i beyaz, %17,8'i Asyalıdır. Medyanyaş 55' dir (aralık: 20-86). Başlangıçta ECOG performans skoru 0 (%58,4) veya 1'dir (%41,3).Genel olarak, dahil edilen hastaların %41'inde başlangıçta PD-L1 ekspresyonu > %1iken, %27'sinde karaciğer metastazları ve %7'sinde beyin metastazları mevcuttur. Yaklaşıkolarak hastaların yarısı, (neo)adjuvan koşullarda bir taksan (%51) veya antrasiklin (%54)almıştır. PD-L1 ekspresyonu > %1 olan hastalarda demografik bilgiler ve başlangıç tümörhastalığı, genel itibariyle daha geniş çalışma popülasyonunu temsil ediyordu. Eş birincil etkililik sonlanım noktaları, ITT popülasyonunda ve RECIST v1.1 uyarınca PD-L1 ekspresyonu > %1 olan hastalarda araştırmacı tarafından değerlendirilen, progresyonsuzsağkalımın (PS) yanı sıra ITT popülasyonunda ve PD-L1 ekspresyonu > %1 olan hastalardagenel sağkalımı (GS) içermiştir. İkincil etkililik sonlanım noktaları, RECIST v1.1 uyarıncaobjektif yanıt oranı (OYO) ve yanıt süresini (YS) içermiştir. Medyan sağkalım takibi 13 aylık olan progresyonsuz sağkalım (PS) için son analiz sırasında PD-L1 ekspresyonu >%1 olan hastalar için IMpassion130'un PS, OYO ve YS sonuçları Tablo3'de özetlenmiştir ve PS için Kaplan-Meier eğrileri PD-L1 ekspresyonu <%1 olan hastalarŞekil 1'de gösterilmektedir. Nab-paklitaksele atezolizumab eklendiğinde PS'de iyileşmegözlenmemiştir (TO 0,94, %95 GA 0,78, 1,13). Nihai GS analizi, PD-L1 ekspresyonu >%1 olan ve medyan takip süresi 19,12 olan hastalarda yapılmıştır. GS sonuçları Tablo 3'de ve Kaplan-Meier eğrileri Şekil 1'de sunulmaktadır. PD-L1ekspresyonu <%1 olan hastalar, nab-paklitaksele atezolizumab eklendiğinde gelişmiş GSgözlenmemiştir (TO 1,02, %95 GA 0,84, 1,24). PD-L1 ekspresyonu >%1 olan hastalarda, önceki (neo)adjuvan tedavi, BRCA1/2 mutasyonu ve başlangıçta asemptomatik beyin metastazları araştırılarak keşif amaçlı alt grup analizleri yapılmıştır. Daha önce (neo) adjuvan tedavi almış hastalarda (n=242) birincil (nihai) PS için tehlike oranı 0,79 ve final GS için 0,77 iken, daha önce (neo)adjuvan tedavi almamış hastalarda(n=127), birincil (nihai) PS için tehlike oranı, final GS için 0,44 ve 0,54 olarak saptanmıştır. IMpassion130 çalışmasında, test edilen 614 hastanın 89'u (%15) patojenik BRCA1/2 mutasyonları taşımaktaydı. PD-L1+/BRCA1/2 mutant alt grubundan 19 hasta atezolizumab artınab-paklitaksel ve 26 plasebo artı nab-paklitaksel almıştır. Araştırmacı analize dayanarak veküçük örnek boyutunun kabul edilmesiyle, BRCA1/2 mutasyonunun varlığı, atezolizumab venab-paklitakselin PS klinik yararını etkilemiyor gibi görünmektedir. Tedavi edilen hasta sayısı az olmasına rağmen, başlangıçta asemptomatik beyin metastazı olan hastalarda etkililik kanıtı yoktu; medyan PS, atezolizumab artı nab-paklitaksel kolunda (n=15)2,2 ay iken, plasebo artı nab-paklitaksel kolunda (n=11) 5,6 aydır (TO 1,40; %95 GA 0,57,3,44). Tablo 3: PD-L1 ekspresyonu > %1 olan hastalarda etkililik özeti (IMpassion130)
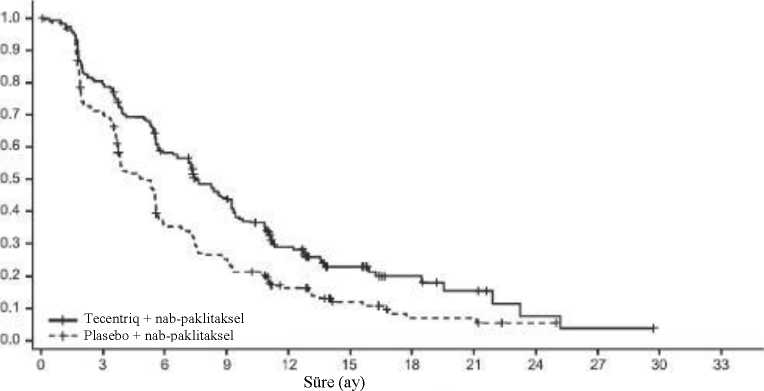
1 Tabakalandırılmış log-rank testine dayalıdır2 PD-L1 ekspresyonu > %1 olan hastalarda tedavi kolları arasında GS karşılaştırmaları, önceden tanımlanmışanaliz hiyerarşisine göre resmi olarak test edilmemiştir.3 17 Nisan 2018'deki klinik sonlanımda PS, OYO, YS için son analiz ve GS için ilk ara analiz başına4 2 Ocak 2019'daki klinik sonlanımda araştırma/deneme amaçlı PS analizi başına5 14 Nisan 2020'deki klinik sonlanımda GS için son analiz başınaI Karaciğer metastazı varlığı ve taksan tedavisi öyküsüne göre tabakalandırılmıştır.PS= Progresyonsuz sağkalım; RECIST= Solid Tümörlerde Yanıt Değerlendirme Kriterleri v1.1.; GA= Güven aralığı; OYO= Objektif yanıt oranı; YS= Yanıt süresi; GS= Genel sağkalımŞekil 1: PD-L1 ekspresyonu > %1 olan hastalarda Progresyonsuz Sağkalım için Kaplan-Meier Eğrisi (IMpassion130)
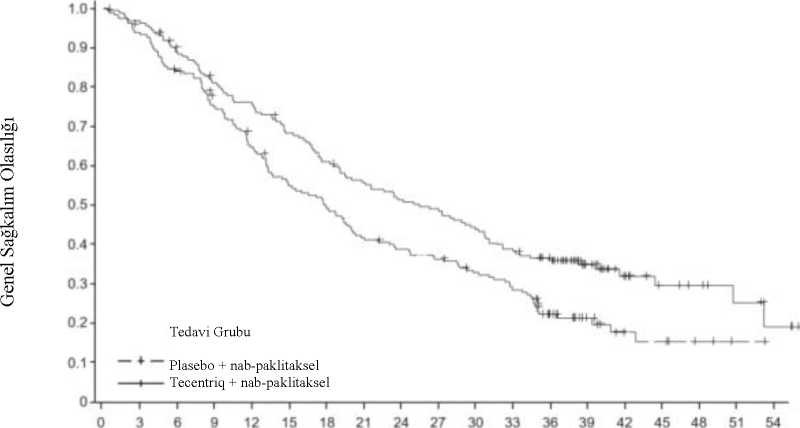
c3O c3>OX)C3O) Ö O OX)o1-HCLHRiskli Hasta Sayısı Tecentriq + nab-paklitakselPlasebo + nab-paklitakselŞekil2:PD-L1 ekspresyonu > %1 olan hastalarda Genel Sağkalım için Kaplan-Meier Eğrisi (IMpassion130)
EORTC QLQ-C30 ile ölçülen hasta tarafından bildirilen genel sağlık durumu/sağlıkla ilişkili yaşam kalitesinin (HRQoL) bozulmasına kadar geçen süre (başlangıç puanından sürekli >10puanlık bir düşüş) her tedavi grubunda benzerdir ve bu tüm hastaların karşılaştırılabilir bir süreboyunca temel HRQoL'lerini koruduğunu göstermektedir. 5.2. Farmakokinetik özelliklerGenel özelliklerAtezolizumaba maruziyet 1 mg/kg - 20 mg/kg doz aralığında 3 haftada bir uygulanan sabit doz 1200 mg doz ile orantılı olarak artmıştır. 472 hastayı içeren bir popülasyon analizi, aşağıdakidoz aralığı için atezolizumab farmakokinetiğini birinci derece eliminasyonla bir doğrusal ikibölmeli düzenleme modeli ile 1 - 20 mg/kg olarak açıklamıştır. Üç haftada bir uygulanan 1200mg atezolizumab dozu ve 2 haftada bir uygulanan 840 mg atezolizumab dozu ve 4 haftada biruygulanan 1680 mg atezolizumab dozunun farmakokinetik özellikleri aynıdır. Bu üç dozrejimiyle karşılaştırılabilir toplam maruziyetlere ulaşılması beklenmektedir. Bir popülasyonfarmakokinetik analizi, 6-9 hafta tekrarlı dozlamadan sonra kararlı durumun elde edildiğini önesürmektedir. Eğri altındaki alanda, maksimum konsantrasyon ve en düşük konsantrasyondasistemik birikim sırasıyla 1,91; 1,46 ve 2,75 kat olmuştur. Emilim:Atezolizumab intravenöz infüzyon şeklinde uygulanır. Diğer uygulama yollarıyla yapılan çalışmalar olmamıştır. Dağılım:Popülasyon farmakokinetik analizi, bir hastada merkezi kompartman dağılım hacminin 3,28 L ve kararlı durumunda hacmin 6,91 L olduğunu göstermektedir. Biyotransformasyon:Atezolizumabın metabolizması doğrudan araştırılmamıştır. Antikor klerensi esas olarak katabolizmayla gerçekleşir. Eliminasyon:Popülasyon farmakokinetik analizi, atezolizumabın klerensinin 0,2 L/gün ve tipik terminal eliminasyon yarı ömrünün 27 gün olduğunu göstermektedir. Özel popülasyonlara ilişkin ek bilgiler:Popülasyon farmakokinetiği ve maruziyet-yanıt analizlerine göre aşağıdaki faktörlerin atezolizumabın farmakokinetiği üzerinde bir etkisi yoktur: Yaş, (21-89 yaş), bölge, etnik köken,böbrek bozukluğu, hafif karaciğer bozukluğu, PD-L1 ekspresyonu düzeyi veya ECOGperformans durumu. Vücut ağırlığı, cinsiyet, pozitif ADA durumu, albümin seviyeleri ve tümöryükünün atezolizumab farmakokinetiği üzerindeki etkisi istatistiki olarak anlamlı ancak klinikolarak anlamlı değildir. Doz ayarlaması önerilmemektedir. Pediyatrik popülasyon:Pediyatrik (<18 yaş, n=69) ve genç erişkin (18-30 yaş, n=18) hastalarda yürütülen erken faz, çok merkezli, açık etiketli bir çalışmadan elde edilen farmakokinetik sonuçlar, atezolizumabklerensi ve dağılım hacminin, normal vücut ağırlığına göre normalize edildiğinde 15 mg/kgalan pediyatrik hastalar ve her 3 haftada bir 1200 mg atezolizumab alan genç erişkin hastalararasında karşılaştırılabilir olduğunu göstermiştir. Maruziyetin ise, vücut ağırlığı düştükçepediyatrik hastalarda arttığı gözlenmiştir. Bu değişiklikler, atezolizumab konsantrasyonununterapötik hedef maruziyetinin altına düşmesi ile bağlantılı değildir. 2 yaş altındaki çocuklar içinveriler sınırlıdır, bu nedenle kesin sonuçlara varılamamaktadır. Geriyatrik popülasyon:Yaşlı hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Yaşın atezolizumabın farmakokinetiği üzerindeki etkisi bir popülasyon farmakokinetik analizinde değerlendirilmiştir.Yaş, 21-89 yaş aralığındaki (n=472) ve medyan 62 yaşındaki hastalar temel alındığında,atezolizumabın farmakokinetiğini etkileyen önemli bir kovaryant olarak tanımlanmamıştır.<65 yaşındaki (n=274), 65-75 yaşındaki (n=152) ve >75 yaşındaki (n=46) hastalardaatezolizumabın farmakokinetiğinde klinik açıdan anlamlı bir fark gözlenmemiştir (bkz. Bölüm4.2). Böbrek yetmezliği:Böbrek yetmezliğiolan hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Popülasyon farmakokinetik analizinde, böbrek fonksiyonu normal (90 mL/dk/1,73 m2 veya üzeri tahmini glomerüler filtrasyon hızı [eGFR]; n=140) olan hastalarla karşılaştırıldığında,hafif (60 - 89 mL/dk/1,73 m2 eGFR; n=208) veya orta şiddetli (30 - 59 mL/dk/1,73 m2 eGFR;n=116) böbrek yetmezliği olan hastalarda atezolizumabın klerensinde klinik açıdan önemlifarklar bulunmamıştır. Yalnızca birkaç hastada şiddetli böbrek yetmezliği vardır (eGFR 15 - 29mL/dk/1,73 m2; n=8) (bkz. Bölüm 4.2). Şiddetli böbrek yetmezliğinin atezolizumabınfarmakokinetiği üzerindeki etkisi bilinmemektedir. Karaciğer yetmezliği:Karaciğer bozukluğu olan hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Popülasyon farmakokinetik analizinde, hafif (bilirubin <NÜS ve AST>NÜS veya bilirubin >1- 1,5 x NÜS ve herhangi bir AST) veya orta (bilirubin > 1,5 - 3 x NÜS ve herhangi bir AST)karaciğer yetmezliği olan ve normal karaciğer fonksiyonu (bilirubin < NÜS ve AST <NÜS)olan hastalar arasında atezolizumabın klerensi bakımından klinik olarak önemli farklarbulunmamıştır. Şiddetli (bilirubin > 3 x NÜS ve herhangi bir AST) karaciğer yetmezliği olanhastalara ilişkin veri mevcut değildir. Karaciğer yetmezliği, Ulusal Kanser Enstitüsü (NCI)karaciğer fonksiyon bozukluğu kriterlerine göre tanımlanmıştır (bkz. Bölüm 4.2). Şiddetlikaraciğer yetmezliğinin (bilirubin > 3 x NÜS ve herhangi bir AST) atezolizumabınfarmakokinetiği üzerindeki etkisi bilinmemektedir. 5.3. Klinik öncesi güvenlilik verileriKarsinojenite: TECENTRIQ'in karsinojenik potansiyelini belirlemek için karsinojenite çalışması yapılmamıştır. Mutajenite: TECENTRIQ'in mutajenik potansiyelini belirlemek için mutajenite çalışması yapılmamıştır. Bununla birlikte, monoklonal antikorların DNA veya kromozomları değiştirmesibeklenmemektedir. Fertilite: TECENTRIQ ile herhangi bir doğurganlık çalışması yapılmamıştır. Bununla birlikte, kronik toksisite çalışmasına sinomolgus maymunlarında erkek ve dişi üreme organlarınındeğerlendirilmesi dahil edilmiştir. Atezolizumabın dişi maymunlara tahmini EAA'dauygulanması (önerilen dozu alan hastalardaki EAA'nın yaklaşık 6 katı), geri dönüşümlü olarakdüzensiz adet döngüsüne ve yumurtalıklarda yeni oluşturulmuş korpus lutea eksikliğine nedenolmuştur. Erkek üreme organları üzerinde herhangi bir etkisi olmamıştır. Teratojenite: TECENTRIQ ile hayvanlarda üreme veya teratojenite çalışmaları yapılmamıştır. Hayvan çalışmaları, PD-L1/PD-1 yolağının inhibisyonunun, gelişen fetüsün bağışıklıkla ilişkili reddineyol açarak fetal ölümle sonuçlanabileceğini göstermiştir. TECENTRIQ uygulaması,embriyo-fetal ölüm dahil olmak üzere fetal zarara neden olabilir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiL-histidin Glasiyal asetik asitSükrozPolisorbat 20Enjeksiyonluk su 6.2. GeçimsizliklerBu tıbbi ürün, Bölüm 6.6'da belirtilenlerin dışında diğer tıbbi ürünlerle karıştırılmamalıdır. 6.3. Raf ömrüAçılmamış flakon: 36 ay Seyreltilmiş çözelti: Hazırlama zamanından sonra 2-8°C'de 24 saat ve ortam sıcaklığında (<30°C) 24 saat içinde kullanımdaki kimyasal ve fiziksel stabilite gösterilmiştir. Mikrobiyolojik açıdan, hazırlanan infüzyonluk çözelti hemen kullanılmalıdır. Hemen kullanılmazsa, kullanım sırasındaki saklama süreleri ve kullanım öncesi koşullar kullamcınmsorumluluğundadır ve normalde 2-8°C'de 24 saatten fazla veya ortam sıcaklığında (<25°C) 8saatten fazla olmamalıdır.6.4. Saklamaya yönelik özel tedbirlerBuzdolabında saklayınız (2°C-8°C).Işıktan korumak için flakonu karton kutusunda saklayınız.Dondurmayınız. Çalkalamayınız.Tıbbi ürünün seyreltme sonrasında saklama koşulları için bkz. Bölüm 6.3.6.5. Ambalajın niteliği ve içeriği14 mL çözelti içeren tapalı (butil kauçuk) flakon (Tip I cam).Bir flakonluk paket.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTECENTRIQ herhangi bir antimikrobiyal koruyucu içermez ve bir sağlık meslek mensubu tarafından aseptik teknik kullanılarak hazırlanmalıdır.Seyreltme talimatları:14 mL TECENTRIQ konsantresi flakondan çekilmeli ve içinde sodyum klorür 9 mg/mL (% 0,9) enjeksiyonluk çözelti bulunan 250 mL'lik bir PVC, polietilen (PE) veya poliolefininfüzyon torbası içine seyreltilmelidir. Seyreltmeden sonra çözeltinin bir mL'si yaklaşık 3,2 mgTECENTRIQ (840 mg/264 mL) içermelidir. Torba, köpük oluşumuna izin vermeden çözeltiyikarıştırmak için yavaşça alt üst edilmelidir. İnfüzyon hazırlandığında hemen uygulanmalıdır(bkz. Bölüm 6.3).Parenteral tıbbi ürünler uygulanmadan önce partiküller ve renk değişimi açısından çıplak gözle incelenmelidir. Partiküller veya renk değişimi gözlenirse çözelti kullanılmamalıdır.TECENTRIQ ile ürüne temas eden polivinil klorür (PVC), polietilen (PE) veya poliolefin (PO) yüzeyleri olan intravenöz torbalar arasında geçimsizlik gözlenmemiştir. İlave olarak,polietersülfon veya polisülfon içeren düz eksenli filtre membranları ve infüzyon setleri ile PVC,PE, polibutadien veya polieterüretan içeren diğer infüzyon yardımcıları ile de geçimsizlikgözlenmemiştir. Düz eksenli filtre membranlarının kullanılması seçime bağlıdır.Kullanılmamış/son kullanma tarihi geçmiş ilaçların imhası:Tıbbi ürünlerinin çevreye salınması en aza indirilmelidir. İlaçlar, atık suyla birlikte atılmamalıdır ve evsel atıklarla imhasından kaçınılmalıdır.Kullanılmamış olan ürünler ya da atık materyaller, Tıbbi Atıkların Kontrolü Yönetmeliği'' ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.7.RUHSAT SAHIBIRoche Müstahzarları Sanayi Anonim ŞirketiUniq İstanbul, Ayazağa Cad. No:4, D/101 Maslak 34396, Sarıyer- İstanbul 8. RUHSAT NUMARASI(LARI)2023/46 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 21.02.2023 Ruhsat yenileme tarihi: - 10. KÜB'ÜN YENİLENME TARİHİ
29 |
İlaç BilgileriTecentriq 840 Mg/14 Ml İnfüzyonluk Çözelti Hazırlamak İçin KonsantreEtken Maddesi: Atezolizumab Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.