Airpuff 25 Mcg /125 Mcg Aerosol İnhalasyonu, Süspansiyon Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERİ TIBBİ ÜRÜNÜN ADIAIRPUFF® 25 mcg /125 mcg aerosol inhalasyonu, süspansiyon 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her püskürtmede; Salmeterol ksinafoat* 36,25 mcg Flutikazon propiyonat 125,00 mcg *: 25 mcg Salmeterol'e eşdeğer Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon için aerosol. Alüminyum inhaler kabı içinde basınçlı propellant gaz ile doldurulmuş süspansiyon. Alüminyum konteynere bir dozlam valfi eklidir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAstım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAH olgularındasemptomları ve atak sıklığını azaltır. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:AIRPUFF sadece inhalasyon yolu ile uygulanır. Hastalara semptomların görülmediği zamanlar da dahil olmak üzere, AIRPUFF'un optimum yarar sağlamak üzere günlük olarak kullanılması gerektiği yönünde bilgi verilmelidir. Hastalar düzenli olarak bir doktor tarafından değerlendirilmeli, aldıkları AIRPUFF dozunun optimum düzeyde kalması sağlanmalı ve doz sadece doktor önerisi ile değiştirilmelidir. Doz, belirtileri etkili olarak kontrol eden en düşük doza ayarlanmalıdır. Günde iki kez uygulanan en düşük kombinasyon dozajıyla semptomların kontrolü sağlandığında, bir sonraki adımda inhalekortikosteroidin tek başına kullanımı test edilmelidir. Alternatif olarak, uzun süre etkili beta-2 agonistlerinin kullanılması gereken hastalar, reçete eden hekimin görüşüne göre hastalık kontrolünü sağlamakta yeterli olacağı düşünülüyorsa, günde birkez AIRPUFF alacak şekilde de titre edilebilirler. Hastada gece görülen semptom öyküsü varsave günde bir kez dozlam uygulanıyorsa, doz geceleri verilmeli; hastada genellikle gündüz görülensemptom öyküsü varsa, doz sabahları verilmelidir. Hastalara hastalıklarının şiddetine göre uygun flutikazon propiyonat dozu içeren AIRPUFF verilmelidir. Not: AIRPUFF 25 mcg / 50 mcg dozu şiddetli astımı olan erişkinlerde ve çocuklarda kullanıma uygun değildir. Reçete eden hekim, astımlı hastalarda flutikazon propiyonatın mikrogramcinsinden günlük dozun yaklaşık yarısı kadar dozda diğer inhale steroidler kadar etkin olduğununbilincinde olmalıdırlar. Bireysel olarak bir hastada önerilen rejimin dışında dozajların gerekmesidurumunda, uygun beta-agonisti ve/veya kortikosteroid dozları reçete edilmelidir. Tavsiye edilen dozlar:AstımErişkinler ve 12 yaş ve üstündeki adolesanlar: Günde iki kez iki inhalasyon halinde 25 mcg salmeterol ve 50 mcg flutikazon propiyonat. Veya günde iki kez iki inhalasyon halinde 25 mcg salmeterol ve 125 mcg flutikazon propiyonat Veya günde iki kez iki inhalasyon halinde 25 mcg salmeterol ve 250 mcg flutikazon propiyonat. Astımın hızlı şekilde kontrol edilmesi gereken orta dereceli inatçı astımı olan erişkin veya adolesan hastalarda (hastanın günlük semptomlarına, günlük kurtarma ilacı kullanımına ve ortaila şiddetli hava yolu sınırlamasına göre tanımlanır), kısa süreli bir AIRPUFF denemesi başlangıçtedavisi olarak kabul edilebilir. Bu durumlarda, önerilen başlangıç dozu günde iki kez ikiinhalasyon olarak 25 mcg salmeterol ve 50 mcg flutikazon propiyonattır. Astım kontrolüsağlandığında, tedavi tekrar gözden geçirilmeli ve hastaların tek başına inhale kortikosteroidalacak şekilde dozlarının azaltılması düşünülmelidir. Tedavide doz azaltılırken hastaların düzenliolarak incelenmesi önemlidir. Bir veya iki hastalık şiddeti kriteri eksik olduğunda, başlangıç tedavisi olarak tek başına inhale flutikazon propiyonat kullanımına kıyasla net bir yarar gösterilmemiştir. Genel olarak inhalekortikosteroidler hastaların büyük çoğunluğunda birinci basamak tedavi olmaya devametmektedir. AIRPUFF'un hafif astımın ilk tedavisinde kullanımı amaçlanmamaktadır. AIRPUFF25 mcg /50 mcg dozları, şiddetli astımı olan çocuklarda ve erişkinlerde kullanıma uygundeğildir; şiddetli astım hastalarında herhangi bir sabit kombinasyonun kullanılmasından önceuygun inhale kortikosteroid dozunun gösterilmesi önemlidir. Kronik Obstrüktif Akciğer Hastalığı (KOAH)Yetişkinler:Yetişkin hastalar için tavsiye edilen doz günde 2 kez 2 inhalasyon 25 mcg /125 mcg - 25 mcg/250 mcg salmeterol/flutikazon propiyonattır. Kullanımı: Hastalara inhaleri nasıl kullanacakları ve bakımını nasıl yapacakları konusunda bilgi verilmeli ve inhale ilacın akciğerlere optimum dağıtımını sağlamak üzere kullanım teknikleri kontroledilmelidir. Hasta inhaleri kullanmada sıkıntı yaşarsa, bir spacer cihazı kullanabilir. Spacercihazlarının değiştirilmesi akciğerlere giden doz miktarında değişiklik meydanagetirebileceğinden, hastalar aynı tip spacer cihazını kullanmaya devam etmelidirler. Bir spacer cihazı kullanılmaya başlandığında veya cihaz değiştirildiğinde daima tekrar en düşük doz titrasyonu gerçekleştirilmelidir. Uygulama şekli:AIRPUFF, sadece inhalasyon şeklinde kullanıma yöneliktir. Hastalara inhalerlerini doğru şekilde kullanmaları için bilgi verilmelidir. İnhalasyon sırasında, hastanın tercihen ayakta veya dik oturur konumda olması gerekir. İnhaler dikey şekildekullanılmak üzere tasarlanmıştır. İnhalasyon cihazı kullanma talimatı için bakınız ekli talimat. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda dozun ayarlanmasına gerek yoktur. Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda AIRPUFF kullanımına ilişkin bilgi yoktur. Pediyatrik popülasyon:4-12 yaş arası çocuklarda: Günde iki kez iki inhalasyon halinde 25 mcg salmeterol ve 50 mcg flutikazon propiyonat. Çocuklarda AIRPUFF ile verilen maksimum onaylı flutikazon propiyonat dozu, günde iki kez 100 mcg'dir. 4 yaşından küçük çocuklarda AIRPUFF kullanımına ilişkin veri yoktur. Geriyatrik popülasyon:Yaşlı hastalarda dozun ayarlanmasına gerek yoktur. 4.3. KontrendikasyonlarAIRPUFF, etkin madde veya yardımcı maddelerden birine karşı aşırı duyarlılığı olan hastalarda Kontrendikedir (bkz. Bölüm 6.1).4.4. Özel kullanım uyarıları ve önlemleriHastalığın kötüleşmesiAIRPUFF'un içeriğinde bulunan salmeterol gibi uzun etkili P2 agonistler kullanılırken, özellikle astım ile ilgili advers olaylar bakımından, bu ilaç başlandıktan sonra ilk üç ay hastalar yakındantakip edilmelidir. AIRPUFF hızlı ve kısa etkili bronkodilatör (örneğin salbutamol) kullanımı gerektiren akut belirtileri rahatlatmak için kullanılmamalıdır. Hastalara akut astım ataklarında rahatlamak içinkullanmaları gereken ilaçları her zaman yanlarında bulundurmaları tavsiye edilmelidir. Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. AIRPUFF ile tedavi sırasında astımla ilişki ciddi advers etkiler veya alevlenmeler gerçekleşebilir. Hastalara, AIRPUFF tedavisine başladıktan sonra astım semptomları kontrol altına alınamaz veyakötüleşirse tedaviye devam etmeleri, ancak yine de hekimlerine danışmaları gerektiğianlatılmalıdır. Rahatlatıcı ilaç (kısa etkili bronkodilatörler) kullanımı gereksinimlerinde artış veya rahatlatıcı ilaçlara yanıtta azalma astım kontrolünde bozulmaya işaret eder ve hastalar bir hekim tarafındandeğerlendirilmelidir. Astım kontrolünün ani ve ilerleyen şekilde kötüleşmesi hayatı tehdit eden bir durumdur ve hastanın bir hekim tarafından tekrar muayene edilmesi gereklidir. Kortikosteroid dozununartırılması düşünülmelidir. Astım semptomları kontrol altına alındığında, AIRPUFF dozunun kademeli olarak azaltılması değerlendirilebilir. Tedavi kademeli olarak azaltılırken hastaların düzenli olarak kontrol edilmesiönemlidir. AIRPUFF etkili en düşük dozu kullanılmalıdır (bkz. Bölüm 4.2). Astımlı hastalarda alevlenme riski nedeniyle AIRPUFF tedavisi ani olarak kesilmemelidir, tedavi dozu hekim gözetiminde kademeli olarak azaltılmalıdır. KOAH'lı hastalarda tedavininkesilmesine semptomatik dekompanzasyon eşlik edebilir ve tedavinin kesilmesi bir hekimgözetiminde yapılmalıdır. Kortikosteroid içeren tüm inhale ilaçlarla olduğu gibi, aktif veya sessiz akciğer tüberkülozu olan hastalarda ve mantar, virüs ya da diğer solunum yolu enfeksiyonları olan hastalarda AIRPUFFdikkatli kullanılmalıdır. Gerekli olduğu takdirde uygun tedavi derhal başlatılmalıdır. Kardiyovasküler etkilerYüksek terapötik dozlarda AIRPUFF, seyrek olarak kardiyak aritmilere (örn. supraventriküler taşikardi, esktrasistoli ve atriyal fibrilasyon) ve serum potasyum seviyesinde geçici hafifazalmalara neden olabilir. Ciddi kardiyovasküler bozuklukları veya kalp ritim bozuklukları olanhastalarda ve diabetes mellitus, tirotoksikozis, tedavi edilmemiş hipokalemi veya düşük serumpotasyum seviyesine predispoze hastalarda AIRPUFF dikkatli kullanılmalıdır. HiperglisemiÇok seyrek olarak kan glukoz düzeylerinde artış rapor edilmiştir (bkz. Bölüm 4.8) ve diabetes mellitus öyküsü olan hastalara reçete edilirken bu husus göz önünde bulundurulmalıdır. Paradoksal bronkospazmDiğer inhalasyon tedavilerinde olduğu gibi, doz uygulamasından hemen sonra başlayan hırıltı artışı ve nefes darlığı ile birlikte paradoksal bronkospazm ortaya çıkabilir. Paradoksalbronkospazm, hızlı etkili bronkodilatöre yanıt verir ve hemen tedavi edilmelidir. AIRPUFFderhal kesilmeli, hasta değerlendirilmeli ve gerekli ise alternatif tedaviye başlanmalıdır. P2 agonist tedavisinin tremor, çarpıntılar ve baş ağrısı gibi farmakolojik yan etkileri bildirilmiştir fakat bunlar geçici olma ve düzenli tedaviyle birlikte azalma eğilimindedir. Sistemik kortikosteroid etkilerHerhangi bir inhale kortikosteroid özellikle yüksek dozlarda, uzun süre kullanıldığında sistemik etkiler oluşabilir. Oral kortikosteroid uygulamasına göre bu etkilerin oluşma olasılığı çok dahaazdır (bkz. 4.9 Doz Aşımı). Olası sistemik etkiler; Cushing sendromu, Cushing benzeri belirtiler,adrenal supresyon, çocukların ve adolesanların büyümesinde gecikme, kemik mineraldansitesinde azalma, katarakt ve glokom ile daha seyrek olarak psikomotor hiperaktivite, uykubozukluğu, anksiyete, depresyon ve agresyon (özellikle çocuklarda) gibi psikolojik ve davranışsaletkileri içerir. Bu nedenle, astımı olanlarda tedavinin düzenli olarak değerlendirilmesi veinhale kortikosteroid dozunun, etkili kontrolü sağlayan en düşük doza ayarlanmasıönemlidir.Hastaların yüksek dozlarda inhale kortikosteroidlerle uzun süreli tedavisi adrenal supresyon ve akut adrenal krize neden olabilir. 500 ila 1000 mikrogram flutikazon propiyonat dozlarında çokseyrek olarak adrenal supresyon ve akut adrenal krizler ile ilgili bildirimler bulunmaktadır.Potansiyel olarak akut adrenal krizi tetikleyebilecek durumlar travma, cerrahi girişim, enfeksiyonveya dozda ani azalmalardır. Gözlenen semptomlar genellikle belirsiz olmakla birlikte anoreksi,karın ağrısı, kilo kaybı, yorgunluk, baş ağrısı, bulantı, kusma, hipotansiyon, bilinç seviyesindeazalma, hipoglisemi ve nöbettir. Stres veya elektif cerrahi girişim sırasında ilave sistemikkortikosteroid tedavisi düşünülmelidir. Salmeterol ve flutikazon propiyonatın sistemik emilimi büyük ölçüde akciğerlerde gerçekleşmektedir. Bir ölçülü doz inhaler ile bir spacer cihazının kullanımı akciğerlere ilaçsalıverilmesini arttırabildiğinden bunun sistemik yan etki riskinde bir artışa neden olmapotansiyeli olduğu göz önünde bulundurulmalıdır. Tek doz farmakokinetik verileri, Volumaticspacer cihazı ile kullanımı ile kıyaslandığında, AeroChamber Plus spacer cihazı inhalasyonaerosolü ile kullanıldığında salmeterol ve flutikazon propiyonat sistemik maruziyetini iki katarttırabilme ihtimalini göstermiştir. İnhale flutikazon propiyonat tedavisinin oral steroid ihtiyacım minimize etmesi beklenir, ancak oral steroidlerden transfer edilen hastalarda önemli bir süre adrenal yetmezlik riski olabilir. Bunedenle bu tip hastaların yakından takip edilmesi ve adrenokortikol fonksiyonun izlenmesigereklidir. Geçmişinde acil durum yüksek doz kortikosteroid tedavisi gereken hastalarda da burisk mevcut olabilir. Stres yaratması muhtemel acil ve elektif durumlarda adrenal yanıt bozukluğuolasılığı daima akılda tutulmalıdır ve uygun kortikosteroid tedavisi düşünülmelidir. Adrenalyetmezliğin derecesi elektif girişimlerden önce uzman değerlendirmesi gerektirebilir. Ritonavir, plazmadaki flutikazon propiyonat konsantrasyonunu büyük ölçüde artırabilir. Bu nedenle hastaya potansiyel yararı sistemik kortikosteroid yan etkilerinden fazla olmadığı sürecebirlikte kullanımdan kaçınılmalıdır. Flutikazon propiyonat'ın diğer güçlü CYP3A inhibitörleriylebirlikte kullanımında da sistemik yan etki riski artar (bkz. Bölüm 4.5). KOAH hastalarında pnömoniKortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoni riskinde artışkanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarak gösterilmemiştir. Kortikosteroid içeren inhale ilaçların pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyla dikkatliolmalıdırlar. KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içimi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır. Plaseboya kıyasla, salmeterol+flutikazon alan ve Kronik Obstrüktif Akciğer Hastalığı (KOAH) bulunan hastalarda yapılan 3 yıllık bir çalışmada alt solunum yolu enfeksiyonları (özelliklepnömoni ve bronşit) daha sık bildirilmiştir (bkz. Bölüm 4.8). Üç yıllık KOAH çalışmasında; yaşlıhastalar, daha düşük vücut kitle endeksi olan (<25 kg/m2) hastalar ve çok şiddetli hastalığı(FEV1 beklenenin <%30'u) bulunan hastalarda tedaviden bağımsız şekilde pnömoni gelişmeriski en yüksek düzeydedir. Bu enfeksiyonların klinik özellikleri ve alevlenme sıklıkla aynı andameydana geldiğinden, hekimler KOAH hastalarında pnömoni ve diğer alt solunum yoluenfeksiyonlarının olası gelişimi konusunda dikkatli olmalıdır. Şiddetli KOAH bulunan hastadapnömoni AIRPUFF ile tedavi yeniden değerlendirilmelidir. CYP3A4 inhibitörleriyle etkileşimSistemik ketokonazol ile birlikte kullanımı salmetorol'ün sistemik maruziyetini ciddi ölçüde artırmaktadır. Bu durum sistemik etkilerin (örn. QTc aralığının uzaması ve palpitasyonlar)insidansında artışa neden olabilir. Bu nedenle hastaya olan potansiyel yararı sistemik salmeterolyan etkileri riskinden fazla olmadıkça CYP3A4 inhibitörleriyle birlikte kullanımındankaçınılmalıdır (bkz. Bölüm 4.5). Görme bozukluklarıSistemik ve topikal kortikosteroid kullanımında görme bozuklukları rapor edilebilir. Bir hastada bulanık görüş veya diğer görme bozukluğu şikayetleri varsa hasta, sistemik ve topikalkortikosteroid kullanımı sonrası bildirilen katarakt, glokom veya santral seröz korioretinopati(CSCR) gibi olası nedenlerin değerlendirilmesi için oftalmoloji uzmanına yönlendirilmelidir. Pediyatrik popülasyonYüksek doz flutikazon propiyonat (genellikle 1000 mikrogram/gün veya daha fazla) alan 16 yaşın altındaki çocuklar ve ergenler risk altında olabilir. Özellikle yüksek dozlarda uzun sürelitedavide sistemik etkiler gerçekleşebilir. Olası sistemik etkiler; Cushing sendromu, Cushingbenzeri belirtiler, adrenal supresyon, akut adrenal kriz, çocukların ve adolesanların büyümesindegecikme ile daha seyrek olarak psikomotor hiperaktivite, uyku bozukluğu, anksiyete, depresyonve agresyondur. Çocuk veya ergen hastanın pediyatrik solunum uzmanına sevk edilmesidüşünülmelidir. Uzun süre inhale kortikosteroid tedavisi alan çocukların boyunun düzenli olarak izlenmesi tavsiye edilmektedir. İnhale kortikosteroid astım kontrolünü sağlayan en düşük dozdakullanılmalıdır.4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBeta adrenerjik blokörler salmeterolün etkisini zayıflatabilir veya antagonize edebilir. Astımlı hastalarda kullanımları için gerekli nedenler olmadığı sürece hem selektif olmayan hem deselektif beta blokörlerin kullanımından kaçınılmalıdır. Beta-2 agonist tedavisiyle potansiyelolarak ciddi hipokalemi gerçekleşebilir. Akut şiddetli astımda bu etki ksantin türevleri, steroidlerve diüretikler ile eş zamanlı tedavi ile artabileceğinden özel dikkat tavsiye edilir. Diğer betaadrenerjik içeren ilaçların eşzamanlı kullanımı potansiyel aditif etkiye sahip olabilir. Flutikazon Propiyonat Normal şartlar altında, bağırsak ve karaciğerde sitokrom P450 3A4 enziminin aracılık ettiği yoğun ilk geçiş metabolizması ve yüksek sistemik klirens nedeniyle inhale dozlamdan sonraflutikazon propiyonatın düşük plazma konsantrasyonları elde edilmektedir. Bu nedenle flutikazonpropiyonat aracılı klinik açıdan anlamlı ilaç etkileşimleri muhtemel değildir. Sağlıklı deneklerde intranazal flutikazon propiyonat ile yapılan bir etkileşim çalışmasında, günde iki kez ritonavir (oldukça potent bir sitokrom P450 3A4 inibitörü) 100 mg dozu flutikazonpropiyonat plazma konsantrasyonlarını yüzlerce kat artırmış ve serum kortizolkonsantrasyonlarının belirgin şekilde azalmasına neden olmuştur. Bu etkileşime ilişkin bilgilerinhale flutikazon propiyonat için mevcut değildir, ancak flutikazon propiyonat plazma düzeyindebelirgin bir artış beklenmektedir. Cushing sendromu ve adrenal süpresyon vakaları bildirilmiştir. Yararları, artan sistemik kortikosteroid yan etkiler riskinden daha yüksek olmadığı sürece bu kombinasyondan kaçınılmalıdır. Sağlıklı gönüllülerde yapılan küçük ölçekli bir çalışmada daha düşük potense sahip bir CYP3A inhibitörü olan ketokonazol, tek inhalasyondan sonra flutikazon propiyonat maruziyetini %150artırmıştır. Bu etki tek başına flutikazon propiyonata kıyasla plazma kortizol düzeyinde dahafazla düşüşe neden olmuştur. İtrakonazol ve kobisistat içeren ilaçlar gibi diğer potent CYP3Ainhibitörleri ve eritromisin gibi orta kuvvetli CYP3A inhibitörleri ile birlikte tedavinin desistemik flutikazon propiyonat maruziyetini ve sistemik yan etki riskini artırması beklenmektedir.Hastaya olan potansiyel yararı sistemik kortikosteroid yan etkileri riskinden fazla olmadıkçabirlikte kullanımdan kaçınılmalıdır. Birlikte kullanımda hastalar sistemik kortikosteroid yanetkileri açısından takip edilmelidir. Salmeterol Kuvvetli CYP3A4 inhibitörleri 15 sağlıklı denekte 7 gün süreyle yürütülen bir ilaç etkileşim çalışmasında, eş zamanlı salmeterol (inhalasyon yoluyla günde iki kez 50 mcg) ve sistemik ketokonazol (oral yolla günde bir kez 400mg) uygulanımı, plazma salmeterol maruziyetinde anlamlı bir artışa neden olmuştur (Cmaks 1,4kat ve EAA 15 kat). Bu durum, salmeterol tedavisinin diğer sistemik etkilerinin (örneğin, QTcaralığının uzaması ve palpitasyonlar) insidansının tek başına salmeterol veya ketokonazoletedavisi ile karşılaştırıldığında artmasına neden olabilir (bkz. Bölüm 4.4) Kan basıncı, kalp hızı, kan glukoz ve kan potasyum düzeylerinde klinik açıdan anlamlı etkiler görülmemiştir. Ketokonazol ile birlikte uygulanımı, salmeterol eliminasyon yarı ömrünü veyatekrarlı dozlamla salmeterol birikimini artırmamıştır. Ketokonazol ile eşzamanlı kullanımından, tedavinin yararları salmeterolün artan sistemik yan etkiler riskinden daha yüksek olmadığı sürece kaçınılmalıdır. Diğer potent CYP3A4 inhibitörleriile benzer bir etkileşim riskinin olması muhtemeldir (örn, itrakonazol, telitromisin, ritonavir). Orta düzeyde CYP 3A4 inhibitörleri 15 sağlıklı gönüllüde 6 gün süreyle birlikte salmeterol (inhalasyon yoluyla günde iki kez 50 mcg) ve eritromisin (oral yolla günde bir kez 500 mg) uygulanımı, salmeterol maruziyetindeküçük ancak istatistiksel açıdan anlamlı olmayan bir artışa neden olmuştur (Cmaks 1,4 kat ve EAA1,2 kat). Eritromisinin birlikte uygulanımı herhangi bir ciddi yan etki ile ilişkilendirilmemiştir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlardaki etkileşimin kapsamı bilinmemektedir. Pediyatrik popülasyon:Veri bulunmamaktadır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)AIRPUFF'un doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır. Gebelik dönemiAIRPUFF'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Gebe kadınlardan elde edilen veriler (1000'den fazla gebe vakası) salmeterol ve flutikazon propiyonat için malformasyon veya feto/neonatal toksisitesi göstermemektedir. Hayvançalışmaları, beta-2 adrenoreseptör agonistleri ve glukokortikosteroidlerin uygulamasından sonraüreme toksisitesi göstermiştir (bkz. Bölüm 5.3). Gebe kadınlarda AIRPUFF kullanımı yalnızca anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir. Gebe kadınlarda flutikazon propiyonatın astım kontrolünü sağlayan etkili en düşük dozu kullanılmalıdır. Laktasyon dönemiSalmeterol ve flutikazon propiyonat/metabolitlerin insan sütüne geçip geçmediği bilinmemektedir. Çalışmalar, salmeterol ve flutikazon propiyonat ve metabolitlerinin emziren sıçanların sütüne geçtiğini göstermiştir. Emzirilen yenidoğanlarda/bebeklerde risk göz ardı edilemez. Emzirmenin çocuğa olan faydaları ile tedavinin anneye olan faydaları değerlendirilerek salmeterol+flutikazon tedavisinin veyaemzirmenin bırakılmasına karar verilmelidir. Üreme yeteneği/Fertiliteİnsanlarda kullanımına dair veri bulunmamaktadır, ancak hayvan çalışmaları salmeterol veya flutikazon propiyonat tedavisinin fertilite üzerinde etkisi olmadığını göstermiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerAIRPUFF'un araç ve makine kullanımı üzerinde etkisi yoktur veya etkisi göz ardı edilebilir düzeydedir. 4.8. İstenmeyen etkilerAIRPUFF salmeterol ve flutikazon propiyonat içerdiğinden, her iki bileşenle de ilişkili olan tipte ve şiddette advers reaksiyonlar görülebilir. Bu iki bileşenin birlikte verilmesiyle ilave advers etkibildirilmemiştir. Salmeterol/flutikazon propiyonat ile ilgili advers olaylar sistem organ sınıfınagöre aşağıdaki sıklıklarda verilmiştir: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1000 ila <1/100), seyrek (>1/10.000 ila <1/1000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Sıklıklar klinik çalışma verilerinden elde edilmiştir. Plasebo ile olan insidans gözönünde bulundurulmamıştır. Enfeksiyonlar ve enfestasyonlarYaygın1,3: Ağız ve boğazda kandidiyazis, pnömoni (KOAH hastalarında), bronşit Seyrek: Özofajiyal kandidiyaz Bağışıklık sistemi hastalıklarıYaygın olmayan: Kütanöz aşırı duyarlılık reaksiyonları, solunum semptomları (dispne) Seyrek : Anjiyoödem (temelde yüzde ve orofarenkste ödem), solunum semptomları ( bronkospazm), anafilaktik şok dahil anafilaktik reaksiyonlar Endokrin hastalıklarıSeyrek4: Cushing sendromu, Cushing benzeri özellikleri, adrenal süpresyonu, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineral yoğunluğu Metabolizma ve beslenme hastalıklarıYaygın3: Hipokalemi Yaygın olmayan4 : Hiperglisemi Psikiyatrik hastalıklarYaygın olmayan: Anksiyete, uyku bozuklukları Seyrek: Psikomotor hiperaktivite ve iritabilite dahil davranış değişiklikleri (çoğunlukla çocuklarda) Bilinmiyor: Depresyon, agresyon (çoğunlukla çocuklarda)
Kardiyak hastalıklar Yaygın olmayan: Palpitasyon, taşikardi, atriyal fibrilasyon, anjina pektoris Seyrek: Kardiyak aritmi (supraventriküler taşikardi ve ekstrasistol dahil) Solunum, göğüs bozuklukları ve mediastinal hastalıklarÇok yaygın2,3: Nazofarenjit Yaygın: Boğaz irritasyonu, ses kısıklığı/disfoni,sinüzit1,3 Seyrek: Paradoksikal bronkospazm4 Deri ve deri altı doku hastalıklarıYaygın1,3: Kontüzyonlar Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Kas krampları, travmatik kırıklar1,3, artralji,miyalji 1 Plasebo ile yaygın olarak bildirilmiştir. 2 Plasebo ile çok yaygın olarak bildirilmiştir. 3 Bir 3 yıllık KOAH çalışmasında bildirilmiştir. 4 Bkz. Bölüm 4.4. Seçilen advers olayların tanımıB2 agonist tedavisinin tremor, çarpıntı ve baş ağrısı gibi farmakolojik yan etkileri bildirilmiştir ancak bu etkiler geçici olma ve düzenli tedaviyle birlikteazalma eğilimindedir.Diğer inhalasyon tedavilerinde olduğu gibi, doz uygulamasından hemen sonra başlayan hırıltı artışı ve nefes darlığı ile birlikte paradoksal bronkospazm ortaya çıkabilir. Paradoksalbronkospazm, hızlı etkili bronkodilatöre yanıt verir ve hemen tedavi edilmelidir. AIRPUFFderhal kesilmeli, hasta değerlendirilmeli ve gerekli ise alternatif tedaviye başlanmalıdır. Flutikazon propiyonat içeriği nedeniyle , bazı hastalarda ses kısıklığı ve ağızda kandidiyaz (pamukçuk) görülebilir. Gerek ses kısıklığı gerekse ağız ve boğaz kandidiyazı insidansı ürünkullanıldıktan sonra ağız yıkanarak ve/veya dişler fırçalanarak giderilebilir. Semptomatik ağız veboğaz kandidiyazı, AIRPUFF tedavisi devam ederken , topik anti-fungal ile tedavi edilebilir. Özel popülasyonlara ilişkin ek bilgilerPediatrik popülasyon Olası sistemik etkiler Cushing sendromu, Cushing benzeri belirtiler, adrenal supresyon, çocukların ve adolesanların büyümesinde gecikmeyi içerir (bkz. Bölüm 4.4). Çocuklarda ayrıcaanksiyete, uyku bozukluğu ve hiperaktiviteyle irritabilite gibi davranışsal değişikliklergörülebilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr[email protected]. Doz aşımı ve tedavisiSemptomlar ve bulgularAIRPUFF için doz aşımına dair klinik çalışma verisi bulunmamaktadır, ancak salmeterol ve/veya flutikazon propiyonat ile ilgili doz aşımı bilgileri aşağıda verilmiştir: Salmeterol doz aşımınınbelirti ve bulguları sersemlik hali, sistolik kan basıncında artış, tremor, baş ağrısı ve taşikardidir.AIRPUFF doz aşımı için spesifik bir tedavi bulunmamaktadır. Doz aşımı durumunda hastayagerektiği şekilde uygun gözlem ile birlikte destekleyici tedavi uygulanmalıdır. Buna ek olarak,hipokalemi meydana gelebilir ve bu nedenle serum potasyum düzeyleri izlenmelidir. Potasyumreplasmanı göz önünde bulundurulmalıdır. Akut: Önerilenden yüksek flutikazon propiyonat dozlarının akut inhalasyonu adrenal fonksiyonunda geçici süpresyona neden olabilir. Adrenal fonksiyonu birkaç günde normale döndüğünden (plazma kortizol ölçümleri doğrulamaktadır) bu doz acil tedavigerektirmemektedir. İnhale flutikazon propiyonat ile kronik doz aşımı: Adrenal rezerv izlenmelidir. Sistemik kortikosteroidler ile tedavi gerekli olabilir. Stabilizasyon sağlandığında önerilen dozda inhalekortikosteroid ile tedaviye devam edilmelidir. Adrenal supresyon için bkz. Bölüm 4.4. Gerek akut gerekse kronik flutikazon propiyonat doz aşımı durumunda AIRPUFF tedavisine semptom kontrolü için uygun dozda devam edilmelidir. 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özellikler
ve diğer ilaçlar ile kombine adrenerjikler
Farmakoterapötik grup: Kortikosteroidler (Antikolinerjik Kombinasyonları Hariç) ATC Kodu: R03AK06 Etki mekanizmasıAIRPUFF farklı etki mekanizmalarına sahip salmeterol ve flutikazon propiyonat içerir. İki etkin maddenin ilgili etki mekanizmaları aşağıda tartışılmaktadır: Salmeterol Salmeterol, reseptörün sekonder bağlanma bölgesine bağlanan bir uzun yan zincire sahip, selektif uzun etkili (12 saat) bir beta2-adrenoseptör agonistidir. Salmeterol klasik kısa etkili beta2agonistlerin önerilen dozlarına kıyasla en az 12 saat süren daha uzun süreli bronkodilatasyonsağlamaktadır. Flutikazon propiyonat Önerilen dozlarda inhalasyon yoluyla verilen flutikazon propiyonat akciğerlerde bir glukokortikoid antiinflamatuvar etkiye sahiptir ve bu etki kortikosteroidler sistemik yollauygulandığında görülenden daha az yan etkiyle semptomlarda ve astım alevlenmelerinde azalmasağlamaktadır. Klinik etkililik ve güvenlilikSalmeterol/flutikazon astım klinik çalışmalarıUzun süreli astımlı 3416 erişkin ve adolesanda 12 aylık bir çalışmada (Optimal Astım Kontrolünün Sağlanması, GOAL) astım tedavisi hedeflerinin erişilebilir olup olmadığınınbelirlenmesi için,tek başına inhale kortikosteroidler (flutikazon propiyonat)ile salmeterol/flutikazon propiyonatın etkinlik ve güvenilirliği karşılaştırılmıştır. Tedavi dozu **Toplam kontrol sağlanana veya çalışma ilacının en yüksek dozuna erişilene kadar 12 haftadabir artırılmıştır. GOAL salmeterol/flutikazon propiyonat verilen daha fazla hastada, tek başınaİKS verilen hastalara kıyasla astım kontrolü sağlandığı ve bu kontrolün daha düşük kortikosteroiddozunda elde edildiğini göstermiştir. *İyi kontrollü astım tek başına İKS'ye kıyasla, salmeterol/flutikazon propiyonat ile daha hızlı şekilde elde edilmiştir. İlk bireysel iyi kontrollü haftanın elde edilmesi için deneklerin%50'sindeki tedavi süresi salmeterol/flutikazon propiyonat için 16 gün ve İKS grubunda 37gündü. Daha önce steroid tedavisi görmeyen bir hasta alt grubunda bireysel iyi kontrollü haftayakadar geçen süre salmeterol/flutikazon propionat ile 16 gün olurken, İKS ile 23 gündü.
*Yeterli düzeyde kontrol altına alınan astım; >1 semptom skoru ile < 2 gün (semptom skoru 1, gün içinde bir kısa süreli semptom şeklinde tanımlanır), <2 gün ve haftada <4 durumda SABAkullanımı, > %80 öngörülen sabah pik ekspiratuar akımı, gece uyanmalarının olmaması,alevlenmelerin olmaması ve tedavi değişikliği gerektiren yan etkilerin olmaması**Tam kontrol altına alınan astım; semptomların olmaması, SABA kullanımının olmaması, >%80 öngörülen sabah pik ekspiratuar akışı, gece uyanmalarının olmaması, alevlenmelerinolmaması ve tedavi değişikliği gerektiren yan etkilerin olmaması. Bu çalışmadaki bulgular günde iki kez salmeterol/flutikazon propiyonat 50/100 mcg dozunun, hızlı astım kontrolünün gerekli olduğu düşünülen orta şiddette dirençli astım hastalarında ilkidame tedavisi olarak değerlendirilebileceğini düşündürmektedir. >18 yaşındaki dirençli astım hastası 318 kişide yapılan bir çift kör, randomize, paralel gruplu çalışmada iki haftalık sürede günde iki kez iki inhalasyonla (çift doz) salmeterol/flutikazonpropiyonat kullanımının güvenilirlik ve tolerabilitesi değerlendirilmiştir. Bu çalışma 14 günekadar her salmeterol/flutikazon propiyonat dozu inhalasyonunun iki katına çıkarılmasının, gündeiki kez tek inhalasyona kıyasla beta agonist ile ilişkili yan etkilerde küçük bir artışa (tremor; 0'akarşı 1 hasta [%1], palpitasyon; 1 hastaya [<%1] karşı 6 [%3], kas krampları; 1 [<%1] hastayakarşı 6 [%3]) ve inhale kortikosteroid ile ilişkili yan etkilerde benzer bir insidansa nedenolduğunu göstermiştir (örn, oral kandidiyazis; 16 hastaya [%8] karşı 6 [%6], ses kısıklığı; 4hastaya [%2] karşı 2 [%2]). Salmeterol/flutikazon propiyonat dozunun ek kısa süreli (14 günekadar) inhale kortikosteroid tedavisine ihtiyaç duyulan erişkin hastalarda iki katına çıkarılmasıdüşünülürse, beta agonist ile ilişkili yan etkilerdeki küçük artış dikkate alınmalıdır. AstımÇok Merkezli Salmeterol Astım Araştırma ÇalışmasıÇok Merkezli Salmeterol Astım Araştırma Çalışması, yetişkin ve ergen gönüllülerde olağan tedaviye salmeterol veya plasebo eklenmesinin güvenliliğini karşılaştıran 28 haftalık bir ABDçalışmasıydı. Solunum ile ilişkili ölüm ve solunum ile ilişkili yaşamı tehdit eden olaylarınkombine sayısı olan primer sonlanım noktası açısından anlamlı farklılık olmasa da, çalışmasalmeterol alan hastalarda astımla ilişkili ölüm sayısında anlamlı artış göstermiştir (salmeterol iletedavi edilen 13.176 hastada 13 ölüme kıyasla plasebo alan 13.179 hastada 3 ölüm). Çalışma eşzamanlı inhale kortikosteroid kullammınm etkisini değerlendirmek için tasarlanmamıştır vegönüUülerin yalnızca %47'si başlangıçta İKS kullanımım bildirmiştir. Astımda salmeterol+flutikazon propiyonat ile tek başına flutikazon propiyonatın güvenliliği ve etkililiğiSalmeterol+flutikazon propiyonat ile tek başına flutikazon propiyonat'ın güvenliliği ve etkililiğini karşılaştırmak için biri yetişkin ve ergen gönüllülerde (AUSTRI çalışması), diğeri 411 yaşlarında pediyatrik gönüllülerde (VESTRI çalışması) olmak üzere iki tane çok merkezli 26haftalık çalışma yürütülmüştür. Her iki çalışmaya dahil edilen gönüllülerin bir önceki yıldaastımla ilişkili hastaneye yatış veya astım alevlenmesi ile birlikte orta ile şiddetli inatçı astımıvardı. İki çalışmanın da primer hedefi tek başına İKS'ye (flutikazon propiyonat) kıyasla İKStedavisine LABA eklenmesinin (salmeterol+flutikazon propiyonat) astımla ilişkili olaylar(astımla ilişkili hastaneye yatış, endotrakeyal entübasyon ve ölüm) açısından non-inferioriteyideğerlendirmekti. Çalışmanın ikincil hedefi ciddi astım alevlenmesi (astımın kötüye gitmesinedeniyle en az 3 gün sistemik kortikosteroid kullanımına gerek olması veya sistemikkortikosteroid kullanımı gerektiren astım nedenli hastaneye veya acile yatış olaraktanımlanmıştır) açısından İKS+LABA'nın (salmeterol+flutikazon propiyonat) tek başına İKStedavisine (flutikazon propiyonat) üstünlüğünü değerlendirmekti. AUSTRI ve VESTRI çalışmalarına sırasıyla 11.679 ve 6.208 hasta randomize edilmiş ve tedavi görmüştür. Primer sonlanma noktası güvenlilik için, her iki çalışmada da non-inferioritegösterilmiştir (bkz. aşağıda tablo)
İkincil etkililik sonlanma noktası için, flutikazon propiyonatla karşılaştırıldığında salmeterol+flutikazon propiyonatta ilk astım alevlenmesine kadar geçen sürede azalma her ikiçalışmada da görülmüştür, ancak yalnızca AUSTRI'de istatistiksel olarak anlamlı farksağlanmıştır:
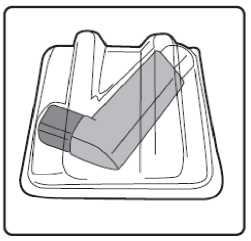
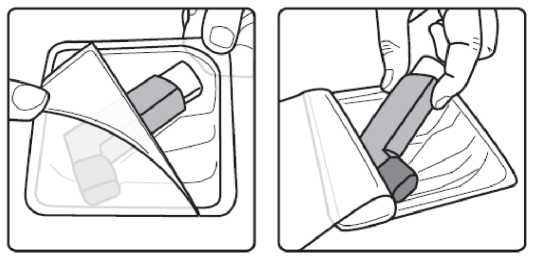
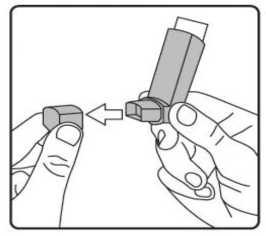
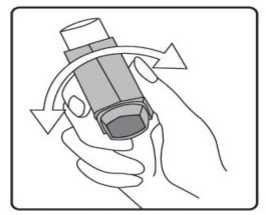
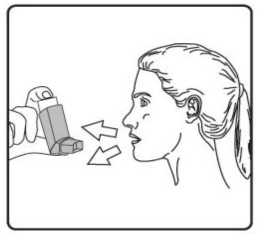
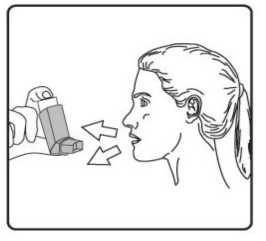
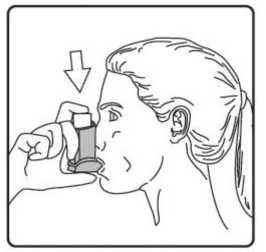
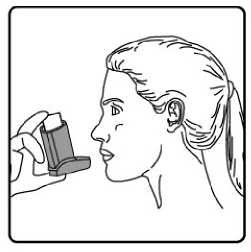
Pediyatrik popülasyon: SAM101667 çalışmasında, 6 ila 16 yaşlarında semptomatik astımı olan 158 çocukta, semptom kontrolü ve akciğer fonksiyonu açısından salmeterol/flutikazon propiyonat kombinasyonuflutikazon propiyonat dozunun ikiye katlanmasıyla eşit etkililikte bulunmuştur. Bu çalışmaalevlenme üzerine etkileri araştırmak için tasarlanmamıştır. 4 ila 11 yaşlarında çocukların (n=428) randomize edildiği bir çalışmada, salmeterol/flutikazon propiyonat DISKUS (50/100 mikrogram, günde iki kez bir inhalasyon) ile salmeterol/flutikazonpropiyonat inhaler (25/50 mikrogram, günde iki kez iki inhalasyon) 12 hafta süreylekarşılaştırılmıştır. 1-12. haftalarda, ortalama pik ekspiratuar akışta başlangıça göre ayarlanmışdeğişiklik DISKUS grubunda 37,7 L/dk ve İnhaler grubunda 38,6 L/dk olmuştur. Her iki tedavigrubunda da kurtarıcı kullanımı gerekmeyen ve semptom olmayan gün ve gecelerde artışgörülmüştür. Gebelik sırasında astımda flutikazon propiyonat içeren ilaçların kullanımı Majör konjenital malformasyon (MKM) riskini değerlendirmek için, Birleşik Krallık elektronik sağlık kayıtları kullanılarak birinci trimesterde tek başına inhale flutikazon propiyonat vesalmeterol+flutikazon propiyonat ile flutikazon propiyonat içermeyen İKS maruziyetininkarşılaştırıldığı gözlemsel retrospektif epidemiyolojik kohort çalışması yürütülmüştür. Buçalışmaya karşılaştırma amaçlı plasebo dahil edilmemiştir. Birinci trimesterde İKS-maruziyeti olan 5362 gebeden oluşan astım kohortunda, 131 tanı konmuş MKM belirlenmiştir; flutikazon propiyonat veya salmeterol+flutikazon propiyonat maruziyetiolan 1612'sinden (%30) 42'sinde MKM tanısı konulduğu belirlenmiştir. 1. yılda flutikazonpropiyonat ile flutikazon propiyonat olmayan İKS maruziyeti karşılaştırıldığında kadınlarda tanıkonulmuş MKM'ler için ayarlanmış olasılık oranı orta şiddette astımlılarda 1.1 (%95 GA: 0,5 -2,3) ve şiddetli astımlılarda 1,2 (%95 GA: 0,7 - 2,0) olmuştur. İlk trimesterde tek başınaflutikazon propiyonat ile salmeterol+flutikazon propiyonat maruziyeti karşılaştırıldığında MKMriskinde farklılık görülmemiştir. Astım şiddet basamaklarında mutlak MKM riskleri flutikazonpropiyonat maruziyeti olan 100 gebelikte 2,0 ila 2,9 arasında değişmektedir. Bu da PratisyenHekimlik Araştırma Veritabanında astım tedavisine maruziyeti olmayan 15.840 gebelikteyürütülen çalışmanın sonuçlarıyla karşılaştırılabilir olmuştur (100 gebelikte 2,8 MKM). 5.2. Farmakokinetik özelliklerGenel özelliklerSalmeterol ve flutikazon propiyonat inhalasyon yoluyla kombinasyon halinde uygulandığında her bileşenin farmakokinetiği, ilaçlar ayrı ayrı uygulandığında gözlenene benzerdi. Bu nedenlefarmakokinetik açıdan her bileşik ayrı ayrı ele alınabilir. Salmeterol: Salmeterol akciğerde lokal olarak etki eder, bu nedenle plazma düzeyleri terapötik etkinin bir belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra çok düşük plazmakonsantrasyonları gösterdiği için (yaklaşık 200 pg/ml veya daha az), plazmadaki ilaç miktarınıntayini teknik olarak zor olduğundan salmeterolün farmakokinetiği ile ilgili sadece sınırlı verilerbulunmaktadır. Flutikazon propiyonat: Emilim:Sağlıklı deneklerde inhalasyon yoluyla alınan tek doz flutikazon propiyonatın mutlak biyoyararlanımı, kullanılan inhalasyon cihazına göre nominal dozun yaklaşık %5-11'i arasındadeğişmektedir. Astımlı hastalarda inhale flutikazon propiyonata sistemik maruziyetin daha düşükbir düzeyi gözlenmiştir. Sistemik emilim temelde akciğerlerde meydana gelmekte olup, ilk başta hızlı ve sonrasında uzun sürelidir. İnhale dozun kalanı yutulabilir, ancak düşük suda çözünürlük ve presistemikmetabolizma nedeniyle sistemik maruziyete minimum katkıda bulunur ve oral biyoyararlanımının%1'den az olmasını sağlar. Dağılım:Flutikazon propiyonat kinetiği yüksek plazma klirensi (1150 mL/dak), kararlı durumda yüksek dağılım hacmi (yaklaşık 300 L) ve yaklaşık 8 saatlik terminal yarı ömürle karakterizedir. Plazma proteinine bağlanma oranı %91'dir. Biyotransformasyon:Flutikazon propiyonat başlıca sitokrom P450 enzimi CYP3A4 tarafından inaktif karboksilik asite metabolize edilerek sistemik dolaşımdan çok hızlı temizlenir. CYP3A4 inhibitörleri olarakbilinen ajanlar ile birlikte kullanıldığında flutikazon propiyonata sistemik maruziyet potansiyelolarak artacağından dikkatli olunmalıdır. Eliminasyon:Flutikazon propiyonat sistemik dolaşımdan çok hızlı temizlenir. Flutikazon propiyonatın renal klirensi önemsiz düzeydedir. Dozun %5'inden daha azı idrarda temelde metabolitler olarakatılmaktadır. Dozun büyük bir bölümü feçeste metabolitler ve değişmemiş ilaç olarakatılmaktadır. Hastalardaki karakteristik özelliklerPediyatrik popülasyon21 günlük salmeterol+flutikazon inhaler 25/50 mcg (spacer ile birlikte veya spacer olmaksızın günde iki kez 2 inhalasyon) veya salmeterol+flutikazon diskus 50/100 mikrogram (günde iki kez1 inhalasyon) tedavilerinin etkisi 4 ila 11 yaşlarında hafif astımlı 31 çocukta değerlendirilmiştir.16 Flutikazon propiyonat sistemik maruziyeti spacer ile birlikte kullanılan inhaler formda ile(107pg sa/mL [%95 GA: 45,7, 252,2]), diskus formda (138pg sa/mL [%95 GA: 69,3, 273,2])benzer olmuştur, ancak inhaler için daha düşüktür (24pg sa/mL [%95 GA: 9,6, 60,2]).Salmeterol+flutikazon inhaler, spacer ile birlikte Salmeterol+flutikazon inhaler vesalmeterol+flutikazon diskus, için salmeterol sistemik maruziyeti benzer olmuştur (sırasıyla126pg sa/mL [%95 GA: 70, 225], 103pg sa/mL [%95 GA: 54, 200] ve 110 pg sa/mL [%95 GA:55, 219]). 5.3. Klinik öncesi güvenlilik verileriHayvanlarda ayrı ayrı verilen salmeterol ksinafoat ve flutikazon propiyonat çalışmalarında görülen insanlarda kullanıma yönelik tek güvenilirlik sorunu, aşırı farmakolojik etkilerleilişkilendirilmiştir. Hayvan üreme çalışmalarında glukokortikosteroidlerin malformasyonlara (yarık damak, iskelet malformasyonları) neden olduğu gösterilmiştir. Bununla birlikte bu hayvan deneylerinin önerilendozların verildiği insanlar için anlamlı olduğu düşünülmemektedir. Salmeterol ksinafoat ileyapılan hayvan çalışmaları sadece yüksek maruziyet düzeylerinde embriyofetal toksisitegöstermiştir. Birlikte uygulanımı takiben bilinen glukokortikoid kaynaklı anomalilerleilişkilendirilen dozlarda, sıçanlarda artan transpoze umblikal arter ve ossipital kemikte eksikosifikasyon insidansı tespit edilmiştir. Kloroflorokarbon (CFC) olmayan itici norfluranın iki yıllık periyotlarda günlük maruziyet uygulanan çok çeşitli hayvan türlerinde, hastaların bulunması muhtemel düzeylerden çok dahayüksek buhar konsantrasyonlarında toksik etki sergilemediği gösterilmiştir. Salmeterol ksinafoatveya flutikazon propiyonat genetik toksisite potansiyeli göstermemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiHFA134a 6.2. GeçimsizliklerGeçimsizlik yoktur. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. Donmaktan ve doğrudan gün ışığından koruyunuz. Aerosol tüplerindeki bütün inhalasyon ilaçlarında olduğu gibi, terapötik etki aerosol tüpü soğuk olduğunda azalabilir. Aerosol tüpü delinmemeli, boş olsa bile kırılmamalı veya yakılmamalıdır. 6.5. Ambalajın niteliği ve içeriğiAIRPUFF 25 mcg /125 mcg aerosol inhalasyonu, süspansiyon 120 dozluk aerosol tüplerde, güvenlik ambalajı içerisinde, karton kutuda kullanma talimatı ile birlikte sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİNeutec İnhaler İlaç San. ve Tic. A.Ş. Arifiye/Sakarya Tel : 0850 201 23 23Faks : 0 212 481 61 11e-mail : [email protected] 8. RUHSAT NUMARASI (LARI)2018/450 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 09.08.2018 Ruhsat yenileme tarihi: İnhalerin test edilmesi:İlk kez kullanmadan önce, hastanın iki yanından hafifçe sıkarak ağızlık kapağını çıkarması, inhaleri iyice çalkalaması gerekir ve inhaleri parmakları arasında tutarak başparmağını alta,ağızlığın alt kısmına yerleştirerek püskürtmelidir. Her bir püskürtmenin ardından inhaler derhalçalkalanmalıdır. Hasta inhaleri bir haftadan veya daha uzun süreden beri kullanılmamışsa, ağızlıkkapağını çıkarmalı, inhaleri iyice çalkalamalı ve havaya iki kez püskürtmelidir .İnhalasyon spreyinizi kullanacağınız zaman oturunuz veya ayakta dik durunuz. AIRPUFF İnhaler'in kullanım talimatlarıKarton kutuda piyasaya sunulan inhalasyon için aerosol, güvenlik amaçlı koruyucu ambalaj içerisinde yer almaktadır. İnhalasyon için aerosolü kullanmadan önce şekilde gösterildiği gibi ambalajından çıkarınız. 1. Hasta kapağın iki yanından hafifçe sıkarak ağızlık kapağını çıkarmalıdır. 2. Hasta herhangi bir yabancı cisim olup olmadığını görmek üzere inhalerin içini ve dışını,ağızlık kısmı da dahil olmak üzere kontrol etmelidir. 3. Hasta gevşek yabancı cisimleri gidermek ve inhalerin içeriğinin eşit şekilde karışmasınısağlamak üzere inhaleri iyice çalkalamalıdır. 4. Hasta inhaleri parmakları ve başparmağı arasında dik olarak tutmalı, başparmağı alt kısma,ağızlığın altına gelmelidir. 5. Hasta nefesini mümkün olduğunca uzun süreli olarak vermeli, ardından ağızlığı dişlerininarasına yerleştirerek dudaklarını etrafında kapatması gerekmektedir. Hastaya ağızlığı ısırmamasısöylenmelidir. 6. Hasta ağzından nefes almaya başladığı sırada halen düzenli ve derin şekilde nefes alırhaldeyken inhalerin üst kısmına bastırarak AIRPUFF püskürtmesini sağlamalıdır. 7. Hasta nefesini tuttuğu sırada inhaleri ağzından çıkarmalı ve parmağını inhalerin üstündençekmelidir. Hasta mümkün olduğunca uzun süre nefesini tutmalıdır. 8. İkinci bir inhalasyon uygulamak için hastanın inhaleri dik konumda tutması ve 3-7. adımlarıtekrarlamadan önce yaklaşık otuz saniye kadar beklemesi gerekmektedir. 9. Hastanın kapağı hafifçe iterek ve yerine oturtarak inhalasyondan hemen sonra ağızlık kapağınıgeri takmaları gerekmektedir. Kapak için aşırı kuvvet uygulamaya gerek yoktur, yerineoturacaktır. Hastanın 5, 6 ve 7. adımlara gelmek için acele etmemesi gerekmektedir. Hastanın inhaleri kullanmadan önce mümkün olduğunca yavaş şekilde nefes almaya başlaması önemlidir. Hasta ilkseferlerde ayna karşısına geçip pratik yapmalıdır. İnhalerden veya ağız kenarlarından buharçıktığını görmesi halinde 2. adımdan tekrar başlaması gerekmektedir. Temizlemeİnhalerinizi en az haftada bir kez temizlemeniz gerekmektedir. Ağızlık başlığını çıkarın. Tüpü plastik kabından çıkarmayın. Ağızlık kısmının içini ve dışını ve plastik kabı kuru bir bez veya mendille silin. Ağızlık başlığını doğru yönde geri takın. Kapak için aşırı kuvvet uygulamaya gerek yoktur, yerine oturacaktır. METAL AEROSOL TÜPÜNÜ SUYA SOKMAYINIZ. |
İlaç BilgileriAirpuff 25 Mcg /125 Mcg Aerosol İnhalasyonu, SüspansiyonEtken Maddesi: Salmeterol Ksinafoat, Flutikazon Propiyonat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.