Flupronat 0.5 Mg/2 Ml Nebulizasyon Süspansiyonu Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERI TIBBİ ÜRÜNÜN ADIFLUPRONAT® 0,5 mg/2 mL Nebülizasyon Süspansiyonu 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her uygulamada: Flutikazon propiyonat 0,5 mg Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMNebülizasyon süspansiyonu. Alüminyum folyoya sarılmış tek kullanımlık yarı saydam düşük yoğunluklu polietilen vial içerisine doldurulmuş inhalasyon süspansiyonu. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAstımın tüm basamaklarında antienflamatuar, bronkodilatör, semptom kontrolü ve oral steroid ihtiyacını azaltmak amaçlı kullanılır. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Yetişkinler ve 16 yaşın üzerindeki adolesanlar: Günde 2 kez 500-2000 mikrogram. Hastalığın şiddetine göre, hastalara uygun nebülize FLUPRONAT başlangıç dozu verilmelidir. Daha sonra bireysel yanıtlara göre doz kontrol sağlanana kadar ayarlanmalı veya etkili en düşükdoza indirilmelidir. Akut astım alevlenmelerinin tedavisinde üst limitteki dozun alevlenmenin ardından 7 güne kadar kullanılması önerilmektedir. Daha sonra dozun azaltılması düşünülmelidir. Uygulama şekli:Hastalar inhale FLUPRONAT tedavisinin profilaktik özelliklerinden ve belirtileri olmadığında dahi düzenli kullanmaları gerektiğinden haberdar olmalıdır. FLUPRONAT nebüller, hekimin önerdiği şekilde jet nebülizer ile elde edilen aerosol şeklinde uygulanmalıdır. İlacın verilmesini çok sayıda kriter etkileyebileceğinden nebülizer cihazınınüreticisi tarafından tavsiye edilen kullanma talimatlarına dikkat edilmelidir. ebysFLUPRONAT nebüllerin ultrasonik nebülizerler i  FLUPRONAT nebüller enjekte edilmemelidir. FLUPRONAT Nebülizasyon Süspansiyonu oral inhalasyon içindir ve bir ağızlık yardımıyla uygulanması tavsiye edilir. Yüz maskesi kullanmak gerektiğinde nazal inhalasyon oluşabilir. Astımda maksimum iyileşme tedaviye başladıktan sonraki 4 - 7 gün içinde görülür. Ancak, daha önce inhale steroid almayan hastalarda FLUPRONAT'ın terapötik etkisi tedaviyebaşlamayı takiben 24 saat içinde görülmüştür. Eğer hasta, kısa etkili bronkodilatörlerin daha az etkili olmaya başladığını fark ederse veya hasta normalden fazla inhalasyona ihtiyaç duyuyorsa, doktora danışılmalıdır. Az miktardaki süspansiyonun verilmesini kolaylaştırmak için veya uzun süreli bir uygulama zamanı isteniyorsa FLUPRONAT Nebülizasyon Süspansiyonu, kullanılmadan hemen öncesodyum klorür enjeksiyon ile seyreltilebilir. Nebülizerler devamlı akış esasına göre çalıştığından nebülize ilacın lokal çevreye salınması olasıdır. Bu nedenle FLUPRONAT nebüller, özellikle aynı anda birden fazla hastanın nebülizerkullandığı hastanelerde iyi havalandırılan odalarda uygulanmalıdır. Uygulama talimatı için bölüm 6.6'dan sonraki bölüme bakınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Karaciğer veya böbrek bozukluğu olanlarda doz ayarlaması gerekli değildir. Pediyatrik popülasyon:4 - 16 yaş arası çocuklar ve adolesanlar: Günde 2 kez 1000 mikrogram. Daha sonraki idame doz uygulamaları basınçlı, ölçülü dozlu inhaler veya toz formülasyon kullanarak daha rahat yapılabilir. Geriyatrik popülasyon:Yaşlı hastalarda doz ayarlaması gerekli değildir. 4.3. Kontrendikasyonlarİlacın bileşenlerinden herhangi birine karşı aşırı duyarlılığı olanlarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriAstım tedavisinde kademeli bir program uygulanmalı ve hastanın yanıtı klinik olarak ve akciğer fonksiyon testleriyle izlenmelidir. FLUPRONAT nebüller, kısa etkili inhale bronkodilatörün (örneğin salbutamol) de gerekli olduğu durumlarda akut bronkospazm belirtilerinin iyileştirilmesinde tek başına kullanılmak için değildir. FLUPRONAT nebüller düzenli günlük tedavide ve akut astım alevlenmelerinde anti-enflamatuvar tedavi olarak kullanım içindir. Acil durumlarda (örn. yaşamı tehdit edici astım) FLUPRONAT nebüller enjektabl veya oral steroidlerin yerine kullanılmaz. Şiddetli astım, solunum fonksiyon testleri dahil, düzenli medikal takip gerektirir, çünkü hastalarda şiddetli atak ve ölüm riski bulunmaktadır. Akut astım belirtilerini kontrol etmek içinkısa etkili inhale beta 2-agonistlerin kullanımının artması, astım kontrolünün bozulduğunugösterir. Hastalara, kısa etkili rahatlatıcı bronkodilatör tedavisinin etkisinin azaldığını 3hissettiklerinde veya normalden daha fazla inhalasyona ihtiyaç duyduklarında, doktoradanışmaları gerektiği belirtilmelidir. Bu gibi durumlarda hastalar yeniden değerlendirilmeli veanti-enflamatuvar tedavinin artırılması (örn. inhale kortikosteroid dozunun artırılması veya oralkortikosteroid kürü) düşünülmelidir. Şiddetli astım alevlenmeleri normal şekilde tedaviedilmelidir.Diabetes mellitus öyküsü olan ya da olmayan hastalarda çok nadir kan glukoz düzeylerinde artış bildirilmiştir (bkz. Bölüm 4.8) ve diabetes mellitus hikayesi olan hastalara reçete edilirkenbu durum göz önünde bulundurulmalıdır. Diğer inhalasyon tedavilerinde olduğu gibi uygulamadan sonra ani ortaya çıkan hırıltılı solunumla birlikte paradoksal bronkospazm oluşabilir. Bu durum hızlı etkili inhalebronkodilatörlerle hemen tedavi edilmelidir. FLUPRONAT kullanımı hemen kesilmeli, hastakontrol edilmeli ve gerekirse alternatif tedavi uygulanmalıdır. Herhangi bir inhale kortikosteroid ile, özellikle uzun süre yüksek dozda uygulandığında, sistemik etkiler oluşabilir; bu etkilerin oluşma olasılığı oral kortikosteroidlere göre daha azdır(bkz. Bölüm 4.9). Olası sistemik etkilere Cushing sendromu, Cushingoid özellikler, adrenalsupresyon, çocuklarda ve adolesanlarda büyümede gecikme, kemik mineral dansitesindeazalma, katarakt, glokom ve santral seröz korioretinopati ile daha seyrek olarak psikomotorhiperaktivite, uyku bozuklukları, anksiyete, depresyon ya da agresyonu (özellikle çocuklarda)içeren psikolojik ya da davranışsal etkiler dahildir. Bu nedenle, inhale kortikosteroid dozununetkili kontrolün sağlandığı en düşük doza titre edilmesi önemlidir (bkz. Bölüm 4.8). Uzun süreli ve yüksek doz inhale kortikosteroid uygulaması, adrenal supresyon ve akut adrenal krize yol açabilir. Onaylı dozdan yüksek doz flutikazon propiyonat kullanan (tipik olarak>1.000 mcg/gün) 16 yaşın altındaki çocuklar özellikle risk altındadır. Akut adrenal krizitetikleme potansiyeli olan durumlar travma, cerrahi, enfeksiyon ya da dozun ani azaltılmasınıiçerir. Semptomlar tipik olarak belirgin olmayıp anoreksi, abdominal ağrı, kilo kaybı,yorgunluk, baş ağrısı, bulantı, kusma, bilinç bulanıklığı, hipoglisemi ve nöbetleri içerir. Stresya da elektif cerrahi periyotlarında ek sistemik kortikosteroid desteği düşünülmelidir. Uzun süreli inhale kortikosteroid tedavisi gören çocukların boylarının düzenli olarak izlenmesi önerilmektedir. Büyüme yavaşladığında, inhale kortikosteroid dozunun azaltılması amacıylatedavi gözden geçirilmeli ve astım kontrolünü etkili biçimde sağlayan en düşük doza
düşürülmelidir. Ek olarak, hastanın pediyatrik göğüs hastalıkları uzmanına sevk edilmesi düşünülmelidir. Bazı bireyler birçok hastaya göre inhale kortikosteroid etkilerine karşı daha fazla duyarlılık gösterebilir. İnhale flutikazon propiyonatın yararları oral steroid ihtiyacını en aza indirmelidir. Buna karşın, oral steroidlerden geçiş yapan hastalar inhale flutikazon propiyonata geçiş yaptıktan sonraönemli bir süre boyunca bozulmuş adrenal rezerv açısından risk altında olmaya devam eder.Advers etkilerin olasılığı bir süre daha devam edebilir. Bu hastalar, elektif prosedürlerden önceadrenal bozukluğun boyutunu belirlemek için özel danışmaya ihtiyaç duyabilir. Rezidüelbozulmuş adrenal yanıtın olasılığı acil durumlarda (tıbbi veya cerrahi) ve strese yol açabilecekelektif durumlarda mutlaka göz önünde bulundurulmalıdır ve uygun kortikosteroid tedavisidüşünülmelidir. Hastalara, hastalığın ciddiyetine göre uygun doz verilmelidir; tedavi, astım kontrolünü etkili biçimde sağlayan en düşük doza düşürülmelidir. Kontrol sağlanamıyorsa, sistemik steroidve/veya antibiyotik kullanımı gerekli olabilir. Benzer olarak sistemik steroid tedavisinin inhale tedavi ile yer değiştirmesi, önceden sistemik ilaç tarafından kontrol edilen, alerjik rinit veya egzema gibi alerjilerin ortaya çıkmasına nedenolabilir. Bu alerjiler antihistaminik ve/veya steroidler dahil topikal preparatlarla semptomatikolarak tedavi edilmelidir. Tüm inhale kortikosteroidlerde olduğu gibi, aktif veya pasif pulmoner tüberkülozu olan hastalara özel dikkat gösterilmelidir. Pazarlama sonrası kullanım sırasında flutikazon propiyonat ve ritonavir alan hastalarda Cushing sendromu ve adrenal supresyon dahil sistemik kortikosteroid etkilere neden olan klinikolarak önemli ilaç etkileşimleri bildirilmiştir. Bu nedenle hastaya sağlayacağı potansiyel yararısistemik kortikosteroid yan etkileri riskinden fazla değilse flutikazon propiyonat ve ritonavirinbirlikte kullanımından kaçınılmalıdır (bkz. Bölüm 4.5). FLUPRONAT ile tedavi anidenkesilmemelidir. Oral kortikosteroid ile tedavi edilen hastanın FLUPRONAT tedavisine geçirilmesi: Oral kortikosteroide bağımlı hastalarda FLUPRONAT tedavisine geçişte dikkatli olunmalıdır. Uzun süreli sistemik steroid tedavisinin neden olduğu adrenokortikal işlev bozukluğunundüzelmesi zaman alabilir. Uzun süreli ve yüksek doz sistemik steroid kullanan hastalarda adrenokortikal supresyon gelişebilir. Bu hastalarda adrenokortikal işlev düzenli izlenmeli ve sistemik steroid dozudikkatli biçimde azaltılmalıdır. Yaklaşık bir hafta sonra sistemik steroid dozu azaltılmaya başlanmalıdır. Doz azaltılması sistemik steroidin idame dozuna uygun olmalı ve haftalık aralıklarla azaltılmalıdır. Genel Belge Ddola£akicgün^fcâ0mgıveyıa3dahaaz(^M!dHi®olon (yadaıeşdegeri^â^amedıozu azaltilınkenkemyaz
haftalık aralıklarla, en fazla günde 1 mg olarak azaltılmalıdır. Günlük prednizolon idame dozunun 10 mg'ın üzerinde olduğu durumlarda haftalık aralıklarla daha fazla doz azaltılmasıuygun olabilir. Bazı hastalar tedavi kesilmesi sırasında solunum işlevlerinin düzelmesine karşın kendini iyi hissetmeyebilir. Adrenal yetmezliğe ilişkin nesnel belirti bulunmuyor ise, hastalar flutikazonpropiyonat tedavisine devam edip sistemik steroidi kesme konusunda desteklenmelidir. İnhale FLUPRONAT tedavisine başlamayı takiben sistemik tedavinin bırakılması kademeli olmalıdır ve hastalar astım ataklarının kötüleşmesi, göğüs enfeksiyonu, majör hastalık, cerrahive travma gibi stres oluştuğunda ek tedaviye ihtiyaçları olabileceğini belirten uyarıcı steroidkartı taşımaları konusunda teşvik edilmelidir. Ritonavir, plazmadaki flutikazon propiyonat konsantrasyonunu önemli miktarda artırabilir. Bu nedenle, hastaya olası yararı sistemik kortikosteroidlere bağlı yan etkilerin riskinden fazladeğilse birlikte kullanımından kaçınılmalıdır. Ek olarak, flutikazon propiyonatın diğer güçlüCYP3A inhibitörleri ile kombine edilmesi durumunda sistemik yan etkilerin riski artar (bkz.Bölüm 4.5). Nebülize flutikazon propiyonat ile tedavi gören hastalar, klinik durumları kötüleşirse dozu veya uygulama sıklığını artırmamaları, ancak tıbbi yardım almaları gerektiği konusundauyarılmalıdır. Nebülize flutikazon propiyonatın, bir yüz maskesi ile uzun süreli kullanımda meydana gelebilecek yüz derisinde atrofik değişiklik olasılığını önlemek için bir ağızlık aracılığıylauygulanması tavsiye edilir. Eğer yüz maskesi kullanılıyorsa cildin korunması için bariyer krem sürünüz veya kullanım sonrası yüzünüzü iyice yıkayınız. FLUPRONAT Nebül ile uzun süreli tedavi, tıbbi gözetim olmadan aniden kesilmemeli yavaş yavaş azaltılmalıdır. FLUPRONAT, bazı sporcular tarafından suistimal edilen ve tablet veya enjeksiyon yoluyla alınan anabolik steroidler gibi steroidlerle karıştırılmamalıdır. Görme bozukluğuSistemik ve topikal kortikosteroid kullanımı ile görme bozukluğu bildirilebilir. Eğer hasta bulanık görme veya diğer görme bozuklukları gibi semptomlarla başvurursa, sistemik vetopikal kortikosteroidlerin kullanımından sonra bildirilmiş katarakt, glokom veya santral serözkoryoretinopati (CSCR) gibi nadir hastalıkları içerebilecek olası nedenlerin değerlendirilmesiiçin hastanın bir oftalmoloji uzmanına sevki düşünülmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriKaraciğer ve bağırsakta gerçekleşen sitokrom P450 3A4 aracılı geniş ölçüdeki ilk geçiş metabolizması ve yüksek sistemik klerens nedeniyle normal şartlarda flutikazon propiyonatın,plazma konsantrasyonları inhale dozu takiben düşük olur. Bu nedenle flutikazon propiyonatınaracılık ettiği klinik olarak anlamlı ilaç etkileşimleri beklenmemektedir. Sağlıklı gönüllülerle yapılan bir ilaç etkileşim çalışmasında 100 mg b.i.d. ritonavirin (yüksek derecede güçlü sitokrom P450 3A4 inhibitörü) intranazal uygulanan flutikazon propiyonatınplazma konsantrasyonlarını büyük ölçüde arttırdığı, bunun da serum kortizolkonsantrasyonlarında belirgin derecede azalmaya neden olduğu gösterilmiştir. Pazarlamasonrası kullanım sırasında intranazal veya inhalasyon yolu ile flutikazon propiyonat ve ritonaviralan hastalarda Cushing sendromu ve adrenal supresyon dahil sistemik kortikosteroid etkilereyol açan klinik olarak önemli ilaç etkileşimleri bildirilmiştir. Bu nedenle, hastaya sağlayacağıpotansiyel fayda sistemik kortikosteroid yan etki riskinden fazla olmadıkça flutikazonpropiyonat ve ritonavirin birlikte kullanımından kaçınılmalıdır. Sağlıklı gönüllülerle yapılan küçük bir çalışmada, hafifçe daha az potent bir CYP3A inhibitörü olan ketokonazol, tek inhalasyonun ardından flutikazon propiyonatın maruziyetini %150artırmıştır. Tek başına flutikazon propiyonat uygulamasına kıyasla plazma kortizol düzeyi dahafazla düşmüştür. Itrakonazol gibi diğer güçlü CYP3A inhibitörleri ile eş zamanlı tedavinin,sistemik flutikazon propiyonat maruziyetini ve sistemik yan etki riskini artırması beklenir. Buduruma karşı dikkatli olunmalı ve bu tür ilaçlarla uzun süreli tedaviden mümkün olduğuncakaçınılmalıdır. Çalışmalar, diğer sitokrom P450 3A4 inhibitörlerinin, serum kortizol konsantrasyonlarında önemli bir düşüş olmadan flutikazon propiyonata sistemik maruziyette ihmal edilebilir(eritromisin) ve minör (ketokonazol) artışlara neden olduklarını göstermiştir. Bununla birlikte,flutikazon propiyonata sistemik olarak maruz kalma potansiyeli artacağından, güçlü P450 3A4inhibitörleri (örneğin ketokonazol) ile birlikte kullanıldığında dikkatli olunmalıdır. Tedavidenbeklenen fayda, sistemik kortikosteroid yan etki riskinden fazla olmadıkça birliktekullanımından kaçınılmalıdır; birlikte kullanım durumunda hasta sistemik kortikosteroid yanetkileri açısından takip edilmelidir. Kobisistat içeren ürünler dahil diğer güçlü CYP3A4 inhibitörleriyle birlikte kullanımının yan etki riskini artırması beklenmektedir. Özel popülasyonlara popülasyonlara ilişkin ek bilgilerVeri bulunmamaktadır.Pediyatrik popülasyon4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Flutikazon propiyonatın çocuk doğurma potansiyeli bulunan kadınlara herhangi bir etkisi veya doğum kontrolü (kontrasepsiyon) için kullanılan ilaçlarla herhangi bir etkileşimibildirilmemiştir. Gebelik dönemiFlutikazon propiyonatın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Flutikazon propiyonatın gebelik sırasında kullanımı yalnızca anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir. İnhale kortikosteroid dozunun, etkilikontrolün sürdürüldüğü en düşük doza titre edilmesi önemlidir. Flutikazon propiyonat ile tedavianiden kesilmemelidir. Retrospektif bir epidemiyolojik çalışmadan elde edilen sonuçlarda, gebeliğin ilk üç ayında diğer inhale kortikosteroidlerle karşılaştırıldığında flutikazon propiyonata maruz kalmanınardından majör konjenital malformasyon (MKM'ler) riskinde bir artış bulunmamıştır (bkz.Bölüm 5.1) Hayvanlar üzerinde yapılan çalışmalar, gebelik ve/veya embriyonal/fetal gelişim ve/veya doğum ve/veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. FLUPRONAT gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Hayvanlarda yapılan üreme çalışmaları, önerilen inhale terapötik dozda görülenlerden daha fazla sistemik maruziyetlerde sadece glukokortikosteroidlerin karakteristik etkilerinigöstermiştir. İnsan gebeliklerinde flutikazon propiyonatın güvenliliğine dair yetersiz kanıtbulunmaktadır. Gebe hayvanlara kortikosteroid uygulanması yarık damak ve intra-uterinbüyüme geriliği dahil fetal gelişim anormalliklerine neden olabilir. Çok düşük de olsa bu gibietkilerin insan fetusunda görülme riski bulunmaktadır. Ancak, hayvanlarda fetal değişikliklerinyüksek sistemik maruziyetlerde gerçekleştiği göz önünde bulundurulmalıdır. Flutikazonpropiyonat FLUPRONAT aracılığıyla solunum yoluyla direkt olarak akciğerlere iletildiğinden,kortikosteroidlerin sistemik yollardan verildiği durumlarda oluşan yüksek seviyedeki maruziyetgerçekleşmemektedir. Flutikazon propiyonatın kullanımı yalnızca anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir (bkz. Bölüm 5.3). Laktasyon dönemiFlutikazon propiyonatın anne sütü ile atılımı araştırılmamıştır. Laktasyondaki laboratuvar sıçanlarında, subkütan uygulamayı takiben ölçülebilir plazma seviyesi sağlandığında, sütteflutikazon propiyonat varlığı kanıtlanmıştır. Bununla birlikte, flutikazon propiyonatın hastalaraönerilen dozlarda inhalasyon şeklinde uygulanmasını takiben plazma seviyeleri düşüktür.
Emzirme döneminde flutikazon propiyonatın kullanımı yalnızca anneye sağlaması beklenen yararı bebeğe olan olası bir riskten fazla ise düşünülmelidir. Üreme yeteneği / Fertiliteİnsan fertilitesine dair veri bulunmamaktadır. Hayvan çalışmaları flutikazon propiyonatın erkek veya dişi fertilitesi üzerinde etkisi olmadığını göstermiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerFLUPRONAT'ın böyle bir etki oluşturması olası değildir. 4.8. İstenmeyen etkilerAşağıdaki advers etkiler sistemik organ sistemi sınıfı ve sıklığa göre verilmiştir. Sıklık sınıflandırması, çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1000 ila<1/100), seyrek (>1/10.000 ila <1/1000) ve izole raporlar dahil çok seyrek (<1/10.000),bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) şeklinde tanımlanmıştır. Çok yaygın ve yaygın ve yaygın olmayan olaylar genellikle klinik çalışma verilerinden belirlenmiştir. Seyrek ve çok seyrek olaylar genellikle spontan verilere dayanmaktadır. Enfeksiyonlar ve enfestasyonlarÇok yaygın: Ağızda ve boğazda kandidiyazis. Yaygın: Pnömoni (KOAH'lı hastalarda) Seyrek: Özofajiyal kandidiyaz Bağışıklık sistemi hastalıklarıAşağıdaki belirtilerle aşırı duyarlılık reaksiyonları bildirilmiştir: Yaygın olmayan: Deride aşırı duyarlılık reaksiyonları Çok seyrek: Anjiyoödem (başlıca yüzde ve orofarinkste ödem), solunum belirtileri (dispne ve/veya bronkospazm) ve anafilaktik reaksiyonlar Endokrin hastalıklarıOlası sistemik etkiler şunları içermektedir: Çok seyrek: Cushing sendromu, Cushingoid özellikler, adrenal supresyon, büyümede gecikme (çocuklarda ve adolesanlarda), kemik mineral yoğunluğunda azalma, katarakt, glokom Metabolizma ve beslenme hastalıklarıÇok seyrek: Hiperglisemi Psikiyatrik hastalıklarÇok seyrek: Anksiyete, uyku bozuklukları ve hiperaktivite ve irritabilite dahil davranış değişiklikleri (genelde çocuklarda) Belge DoGöz hastalıkları
Bulanık görme (bkz. Bölüm 4.4)
Bilinmiyor: Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Ses kısıklığı, dil veya boğaz ağrısı Çok seyrek: Paradoksal bronkospazm Bilinmiyor: Epistaksis Gastrointestinal hastalıklarÇok seyrek: Dispepsi Deri ve deri altı doku hastalıklarıYaygın: Kontüzyon Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıÇok seyrek: Artralji Bazı hastalarda ses kısıklığı ile ağızda ve boğazda kandidiyaz (pamukçuk) görülür. Bu tür hastalar, FLUPRONAT Nebülü kullandıktan sonra ağızlarını suyla çalkalamayı faydalıbulabilir. Semptomatik kandidiyaz, FLUPRONAT Nebül ile devam ederken topikal anti-fungalile tedavi ile tedavi edilebilir. Olası sistemik etkiler arasında Cushing sendromu, Cushingoid özellikler, adrenal supresyon, büyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt, glokom bulunur (bkz. Bölüm4.4). Diğer inhalasyon tedavilerinde olduğu gibi, paradoksal bronkospazm meydana gelebilir (bkz. Bölüm 4.4). Bu durum hızlı etkili inhale bronkodilatörler ile derhal tedavi edilmelidir.FLUPRONAT Nebül'ün kullanımı hemen kesilmeli, hasta kontrol edilmeli ve gerekirsealternatif tedavi uygulanmalıdır. Flutikazon propiyonat 500 mcg alan KOAH hastalarında yapılan çalışmalarda pnömoni bildiriminde artış olmuştur. Pnömoni ve alevlenmenin klinik özellikleri sıklıkla örtüştüğünden,hekimler KOAH'lı hastalarda olası pnömoni gelişimine karşı dikkatli olmalıdır. FLUPRONAT0,5 mg/2 mL Nebülizasyon Süspansiyonu KOAH tedavisi için endike değildir. Şüpheli advers reaksiyonların raporlanması:Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: tufam@titck,gov.tr. Tel: 0 800 314 00 08; Faks: 0 312 218 35 99) ^ ^Bu belge,^venlı eI6Ktronık imza ile imzalanmıştır.^ 4.9. Doz aşımı ve tedavisiFLUPRONAT'ın tavsiye edilen dozlarının üzerindeki dozlarda akut inhalasyonu adrenal fonksiyonların geçici supresyonuna neden olabilir. Bu durum acil önlem alınmasınıgerektirmez; bu hastalarda flutikazon propiyonat tedavisi astımı kontrol edecek düzeydesürdürülmelidir, adrenal fonksiyonların birkaç gün içinde eski haline döndüğü plazma kortizolüölçülerek saptanabilir. Önerilenin üzerindeki dozların alınmasına uzun süre devam edilirse bir miktar adrenal supresyon oluşabilir (adrenal supresyon riski için bkz. Bölüm 4.4). Adrenal rezervin izlenmesigerekebilir. FLUPRONAT aşırı doz vakalarında tedaviye semptom kontrolünü sağlayan uygundozlarda devam edilebilir. Önerilenden fazla doz alan hastalar yakından kontrol edilmeli ve doz kademeli olarak azaltılmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Glukokortikoidler ATC kodu: R03BA05 Etki mekanizmasıFlutikazon propiyonat inhalasyon yoluyla tavsiye edilen dozlarda verildiğinde akciğerlerde güçlü bir glukokortikoid anti-enflamatuvar etki göstererek astım belirtilerini ve alevlenmeleriniazaltır. Gebelik sırasında astım için flutikazon propiyonat içeren ilaçların kullanımıFlutikazon propiyonat içermeyen inhale kortikosteroidlerle karşılaştırıldığında tek başına flutikazon propiyonat ve salmeterol-flutikazon propiyonat kombinasyonunun majör konjenitalmalformasyon (MKM) riskini değerlendirmek için Birleşik Krallık'ta bulunan elektronik sağlıkkayıtlarının kullanıldığı gözlemsel retrospektif epidemiyolojik kohort çalışma yürütülmüştür.Bu çalışmaya plasebo karşılaştırıcı dahil edilmemiştir. Birinci trimesterde inhale kortikosteroid maruziyeti olan 5362 astım hastası kohortunda, tanı koyulan 131 MKM tespit edilmiştir; 1612'si (%30) flutikazon propiyonat veyasalmeterol+flutikazon propiyonata maruz kalmış olup bunlardan 42'sinde MKM tespitedilmiştir. Flutikazon propiyonat maruziyeti olan kadınlar ile flutikazon propiyonat içermeyeninhale kortikosteroid maruziyeti olan kadınlar karşılaştırıldığında, 1 yıl sonunda tespit edilenMKM'lerin ayarlanmış olasılık oranı, orta şiddette astımı olan kadınlar için 1,1 (%95 GA: 0,5- 2,3), şiddetli astımı olan kadınlar için 1,2 (%95 GA: 0,7 - 2,0) olmuştur. Birinci trimesterdetek başına flutikazon propiyonat ile salmeterol+flutikazon propiyonat maruziyetikarşılaştırıldığında MKM riskinde fark tespit edilmemiştir. Farklı astım şiddet seviyeleriarasında mutlak MKM riski her 100 flutikazon propiyonat maruziyetinde 2,0 ila 2,9 arasındadeğişmiştir. Bu sonuç, Pratisyen Hekim Araştırma Veribankası'nda (General Practice Research * *Bu belge, güvenli elektrdnık imza ile imzalanmıştır.^Belge Do
edilen sonuçlarla (100 gebelikte 2,8 MKM vakası) karşılaştırılabilir olmuştur. 5.2. Farmakokinetik özelliklerGenel özellikler:Emilim:Her bir inhaler cihazı için flutikazon propiyonatın mutlak biyoyararlanımı inhalasyon ve intravenöz farmakokinetik verilerin çalışma içerisinde ve çalışmalar arasında karşılaştırılmasıile hesaplanmıştır. Sağlıklı erişkin deneklerde mutlak biyoyararlanım flutikazon propiyonatDiskus (%7,8), flutikazon propiyonat Inhaler (%10,9) için belirlenmiştir. Astım ya da KOAHhastalarında flutikazon propiyonata sistemik maruziyetin daha az derecede olduğu görülmüştür.Sistemik absorpsiyon başlıca akciğerlerde gerçekleşir ve başlangıçta hızlı olup daha sonrayavaşlamaktadır. Kalan inhale doz yutulabilir, fakat yutulan kısım sudaki düşük çözünürlüğüve %1'den daha az oral biyoyararlanımla sonuçlanan sistemik absorpsiyon öncesimetabolizmasından dolayı sistemik maruziyete çok az katkıda bulunmaktadır. İnhale dozunartırılmasıyla sistemik maruziyette doğrusal artış olur. Dağılım:Flutikazon propiyonat kararlı durumda geniş bir dağılım hacmine (yaklaşık 300 L) sahiptir. Plazma proteinlerine bağlanma oranı yüksektir (%91). Biyotransformasyon:Flutikazon propiyonat başlıca sitokrom P450 enzimi olan CYP3A4 tarafından inaktif karboksilik asit metabolitine metabolize olarak sistemik dolaşımdan çok hızlı temizlenir.Flutikazon propiyonatın sistemik maruziyetinde artış potansiyeli olduğundan bilinen CYP3A4inhibitörleri birlikte uygulanırken dikkat edilmelidir. Eliminasyon:Flutikazon propiyonatın dispozisyonu yüksek plazma klerensi (1150 mL/dak) ve yaklaşık 8 saat olan terminal yarılanma ömrü ile karakterizedir. Flutikazon propiyonatın renal klerensi ihmaledilebilir düzeydedir (%0,2'den az) ve metabolit olarak %5'ten azdır. Doğrusallık/doğrusal olmayan durum:Veri bulunmamaktadır. 5.3. Klinik öncesi güvenlilik verileriToksikoloji, sadece güçlü kortikosteroidlerin önerilen terapötik dozlardan çok daha yüksek dozlarda uygulandıklarında gösterdikleri tipteki sınıf etkileri şeklinde görülür. Mükerrer doztoksisite çalışmalarında, üreme çalışmalarında veya teratoloji çalışmalarında yeni bir etkitanımlanmamıştır. Flutikazon propiyonatın in vitroin vivoolarak mutajenik aktivitesi yoktur ve kemirgenlerde tümorojenik etki göstermemiştir. Hayvan modelleri üzerinde iritan veya hassasiyet yaratıcıdeğildir. belge
Fare ve sıçanda sırasıyla 45 ve 100 mcg/kg'da deri altı embriyofetal gelişim çalışmaları (486 ve 710 pg/mL'lik fare ve sıçan plazma seviyeleri, yetişkinlerde önerilen maksimum günlük dozolan günde iki kez 500 mcg inhalasyon dozunun yaklaşık 4 ve 6 katına eşdeğer) maternaltoksisiteye neden olan dozlarda yarık damak ve embriyonik fetal büyüme geriliğini dahil olmaküzere içeren, güçlü bir kortikosteroidin fetal gelişimsel toksisite özelliği ile sonuçlanmıştır.Sıçanlarda bu bulgunun etkisizlik seviyesi, 310 pg/mL'lik sıçan plazma seviyesine göre enyüksek klinik maruziyetin yaklaşık 3 katı sistemik maruziyet ile ilişkilendirilmiştir. Tavşanda,fetal ağırlık azalması ve yarık damak 4 mcg/kg'lık maternal olarak toksik subkutan dozda (149pg/mL'lik tavşan plazma seviyesine göre günde iki kez önerilen maksimum 500 mcg inhaledozun 1,4 katından az) meydana gelmiştir. Bununla birlikte, sıçanlarda soluma yoluylauygulanan flutikazon propiyonat, 1890 pg/mL'lik sıçan plazma düzeyine dayalı olarak önerilenmaksimum günlük solunan doz ile ulaşılan insan maruziyetinin 17 katı maruziyetle ilişkilimaternal toksik dozlarda teratojeniteyi uyarmamıştır. Erkek ve dişi sıçanlarda 50 mcg/kg/güne kadar subkutan flutikazon propiyonat dozlarında (günde iki kez önerilen maksimum günlük 500 mcg solunan dozla ilişkili insan maruziyetininyaklaşık 6 katı (110 pg/mL), yaklaşık 650 pg/mL'lik sıçan plazma seviyelerine göre) fertiliteçalışmalarında doğurganlığın bozulduğuna dair hiçbir kanıt görülmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSodyum klorür Tween 20 Sorbitan monolaurat Monosodyum fosfat dihidratDibazik sodyum fosfat anhidrusEnjeksiyonluk su 6.2. GeçimsizliklerHerhangi bir geçimsizlik bildirilmemiştir. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. Donmaktan ve direkt gün ışığından koruyunuz. Nebüller koruyucu ambalajdan çıkarıldıktan sonra 28 gün ve açıldıktan sonra 2-8°C'de saklanmak koşulu ile 12 saat içinde kullanılmalıdır. Dik konumda muhafaza ediniz.
6.5. Ambalajın niteliği ve içeriğiFLUPRONAT Nebülizasyon Süspansiyonu, 10 adet 2 mL'lik düşük yoğunluklu polietilen tek dozluk flakon şeklinde kullanma talimatı ile beraber sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerFLUPRONAT nebüllerinin kullanma talimatları: Nebülizer kullanımı için üretici talimatlarına bakınız. Süspansiyon beyaz, opak bir görünüşe sahiptir. Kullanmadan önce nebül içeriğinin iyice karışmış olduğundan emin olmanız önemlidir. Nebülü etiketli kısmından yatay olarak tutarkendiğer ucuna birkaç kez hafifçe vurunuz ve çalkalayınız. Bu işlemi nebül içeriği tamamıylakarışıncaya kadar birkaç kez tekrar ediniz. Seyreltilmesi: Gerektiğinde Sodyum Klorür Enjeksiyon kullanılarak seyreltiniz. Nebülizer haznesindeki kullanılmayan süspansiyonu boşaltınız. Ağızlık aracılığı ile uygulanması tavsiye edilir. Eğer yüz maskesi kullanılıyorsa cildin korunması için bariyer krem sürünüz veya tedavi sonrası yüzünüzü iyice yıkayınız. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİNeutec İnhaler İlaç San. ve Tic. A.Ş. Arifiye / Sakarya Tel: 0 850 201 23 23Faks: 0212 481 61 11e-mail: [email protected] 8. RUHSAT NUMARASI2023/333 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 25.08.2023 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ
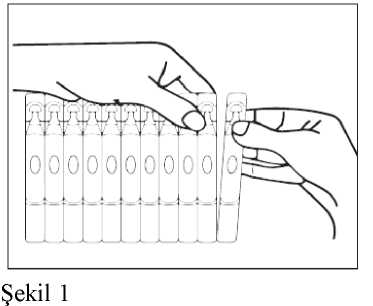
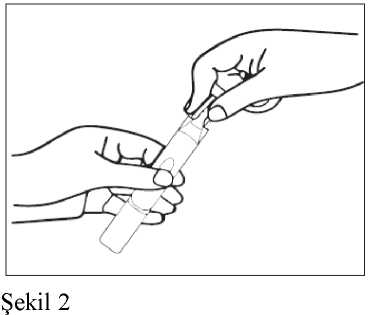
Uygulama Talimatı1. Nebülizatörü, imalatçısının ya da hekimin talimatları doğrultusunda kullanıma hazırlayınız. 2. Tek dozluk bir flakonu şeritten koparınız.
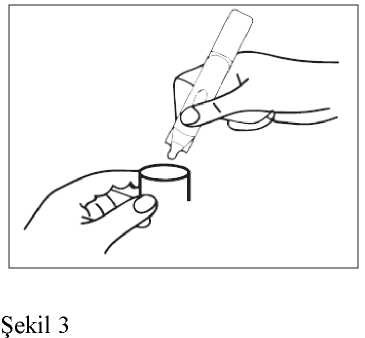
4. Tek dozluk flakonun içeriğini, nebülizatörün rezervuarına (depo kısmına) sıkarakboşaltınız. 5. Nebülizatörün parçalarını birleştirip, önerildiği şekilde inhale ediniz. 6. Kullandıktan sonra, rezervuarda kalmış olabilecek süspansiyonu atınız ve nebülizatörü,imalatçısının talimatları doğrultusunda temizleyiniz.
Tek dozluk flakonlar koruyucu madde içermediğinden, mikroplarla bulaşmayı önlemek amacıyla, flakonun açıldıktan hemen sonra kullanılması ve her uygulamada yeni bir flakonunaçılması önem taşımaktadır. Kısmen kullanılmış, açılmış veya hasar görmüş tek dozlukflakonlar atılmalıdır.
|
İlaç BilgileriFlupronat 0.5 Mg/2 Ml Nebulizasyon SüspansiyonuEtken Maddesi: Flutikazon Propiyonat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.