Rebif 66 Mcg/1,5 Ml Kartuşta Enjeksiyonluk Çözelti Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERI TIBBI URUNUN ADIREBİF 66 mikrogram/1.5 mL kartuşta enjeksiyonluk çözelti Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Herbir kullanıma hazır 1,5 mL çözelti içeren kartuş 66 mikrogram (18 MIU*) Interferon beta-1a** içerir.Yardımcı maddeler.Sodyum hidroksit/sodyum asetat.........................................pH ayarı Benzil alkol..........................................................................7,5 mg Yardımcı maddelerin tam listesi için bakınız bölüm 6.1. *Milyon Internasyonel Ünite, mevcut uluslararası NIH standardına (GB-23-902-531) dayalı kalibre edilmiş olan firma içi interferon beta-1a standardına dayalı sitopatik etki (CPE)biyoassay ile ölçülmüştür. ** rekombinant DNA teknolojisi ile çin hamster yumurtalık3. FARMASOTIK FORMKartuşta enjeksiyonluk çözelti 3,7-4,1 pH ve 250 mOsm/l - 450 mOsm/L osmolaritesi olan berrak-opak çözelti. 4. KLINIK ÖZELLIKLER4.1. Terapötik endikasyonlarREBİF multipl sklerozlu ve son iki yıl içinde 2 ya da daha fazla atak geçirmiş hastaların tedavisinde endikedir (bakınız bölüm 5.1). Relaps aktivitesi devam etmeyen Sekonder Progresif Multipl Sklerozlu hastalarda etkisi gösterilmemiştir (bakınız bölüm 5.1). 4.2. Pozoloji ve uygulama şekliTedavi bu hastalığın tedavisinde uzman bir hekim tarafından yürütülmelidir. Pozoloji/uygulama sıklığı ve süresi:REBİF'in tavsiye edilen pozolojisi, subkütan enjeksiyon ile haftada 3 kez verilen 44 mikrogramdır. Yine, subkütan enjeksiyon ile haftada 3 kez verilen REBİF 22 mikrogram,tedaviyi yürüten uzman tarafından daha yüksek dozu tolere edemediği düşünülen hastalar içinönerilir.
REBİF ile tedaviye ilk başlarken, yan etkisi olan taşiflaksiyi engellemek için doz titre edilerek artırılır. REBİF başlangıç paketi, tedavinin ilk ayı için hasta ihtiyacım karşılar. Uygulama şekli:REBİF kartuşta subkütan enjeksiyonluk çözeltisi multidoz kullanım için tasarlanmıştır ve hastanın ve/veya bakımından sorumlu kişinin yeterli eğitimi sonrası sadece RebiSmartelektronik enjeksiyon cihazı ile kullanılmalıdır. Uygulama için, kullanma talimatında yer alan talimatları ve RebiSmart ile sağlanan kullanım kılavuzu takip edilmelidir. REBİF uygulamasına eşlik eden grip benzeri semptomları azaltmak için, enjeksiyon öncesinde ve her bir enjeksiyondan sonra 24 saat boyunca antipiretik analjezik alınmasıtavsiye olunur. Halen, hastaların ne kadar süreyle tedavi edilmesi gerektiği konusunda yeterli bilgi yoktur. Dört yıldan daha uzun süre devam eden REBİF tedavisinin etkililiği ve güvenliliğine dairbilgi yoktur. Hastaların REBİF ile tedavinin başlangıcından sonraki 4 yıllık dönemde en azher 2 yılda bir hekim tarafından değerlendirilmesi ve tedavi eden hekimin uzun süreli tedaviyiher hasta için bireysel olarak değerlendirmesi önerilir. Özel popülasyonlara ilişkin ek bilgiler Böbrek/karaciğer yetmezliği:Bu hastalara interferon beta-1a uygulaması sırasında dikkatli olunmalı ve hastalar yakından takip edilmelidirler. Pediyatrik popülasyon:REBİF'in etkililiği ve güvenliliği, 12-16 yaşlarındaki gençlerde kanıtlanmamıştır. Halihazırda mevcut güvenlilik verisi bölüm 4.8'de tanımlanmıştır fakat pozoloji üzerine hiçbir öneriyapılamaz. REBİF'in etkililiği ve güvenliliği, 12 yaşın altındaki gençlerde kanıtlanmamıştır. Sadece çok sınırlı veri mevcuttur. REBİF bu yaş grubunda kullanılmamalıdır. Geriyatrik popülasyon:65 yaş grubu hastalar ile yeterince klinik çalışma yapılmamıştır ve bu yaş grubundakilerin genç hastalardan farklı yanıt verip vermediği bilinmemektedir. 4.3. Kontrendikasyonlar Doğal ya da rekombinant interferon beta'ya, veya bölüm 6.1'de listelenen yardımcımaddelerin birine karşı aşırı duyarlılık Ciddi depresif bozukluk ve/veya intihar eğilimi (bakınız bölüm 4.4 ve 4.8) 4.4. Özel kullanım uyarıları ve önlemleriGenel tavsiyelerHastalar interferon beta uygulamasında en sık karşılaşılan, grip benzeri sendrom semptomları dahil olmak üzere istenmeyen etkiler konusunda bilgilendirilmelidir (bakınız bölüm 4.8). Bu
semptomlar genellikle tedavinin başlangıcında daha sık görülür ve tedavi sürdükçe sıklık ve şiddeti azalır. Trombotik mikroanjiopati (TMA)İnterferon beta içeren ilaçların kullanımı ile ölümcül vakaları da içeren trombotik trombositopenik purpura (TTP) ya da hemolitik üremik sendrom (HUS) olarak ortaya çıkantrombotik mikroanjiopati vakaları rapor edilmiştir. Vakalar, tedavi sırasındaki çeşitli zamandilimlerinde rapor edilmiş olup, interferon beta tedavisine başladıktan haftalar sonra veyayıllar sonra ortaya çıkabilmektedir. Erken klinik bulgular, trombositopeniyi, yeni başlayanhipertansiyonu, ateşi, santral sinir sistemi semptomlarını (Örn. konfüzyon, parezi) vebozulmuş böbrek fonksiyonunu içermektedir. TMA'yı hatırlatan laboratuvar bulguları, kanyaymasında azalmış platelet sayısı, hemoliz ve şistositlerin (eritrosit fragmantasyonu) sebepolduğu artmış serum laktat dehidrogenazı (LDH)'dır. Bu sebeple, TMA'nın klinik bulgularıgözlemlenirse, kan platelet düzeyleri, serum LDH düzeyi, kan yayması ve böbrekfonksiyonları için ileri testlerin yapılması önerilir. Eğer TMA tanısı konulursa tedavinin(plazma değişimi düşünülerek) derhal uygulanması gerekmektedir ve REBİF tedavisininhemen kesilmesi önerilmektedir. Depresyon ve intihar eğilimiREBİF, özellikle geçmişinde intihar düşüncesi olduğu bilinen, daha önce ya da o anda depresif bozukluğu bulunan hastalarda dikkatle uygulanmalıdır (bakınız bölüm 4.3).Depresyon ve intihar eğiliminin multipl sklerozlu hastalarda daha sık görüldüğü ve interferonkullanımı ile ilişkili olduğu bilinmektedir. REBİF ile tedavi edilen hastaların herhangi birdepresyon semptomunu ve/veya intihar eğilimini, tedavi eden hekime bildirmeleriistenmelidir. Depresyonlu hastalar REBİF ile tedavi edilirken yakından takip edilmeli veuygun şekilde tedavi edilmelidirler. Gerektiğinde REBİF ile tedavinin kesilmesidüşünülmelidir (bakınız bölüm 4.3 ve 4.8). Nöbet bozukluklarıREBİF, epileptik nöbet hikayesi olanlarda, anti-epileptik tedavi alanlarda, özellikle epilepsileri anti-epileptiklerle kontrol edilemeyen hastalarda dikkatle uygulanmalıdır (bakınızbölüm 4.5 ve 4.8). Kalp hastalığıAnjina, konjestif kalp yetmezliği veya aritmi gibi kalp hastalığı olan hastalar interferon beta-1a ile tedaviye başlarken klinik durumlarının bozulması açısından yakından takip edilmelidirler. Kardiyak problemleri olan hastalarda interferon beta-1a tedavisiyle ilgili olarakortaya çıkan grip benzeri sendrom semptomları daha çok rahatsız edici olabilir. Enjeksiyon yeri nekrozlarıREBİF kullanan hastalarda enjeksiyon yerinde nekroz bildirilmiştir (bakınız bölüm 4.8). Enjeksiyon yerinde nekroz riskini en aza indirmek için hastalara: Aseptik enjeksiyon tekniği kullanmaları Her dozda enjeksiyon yerini değiştirmeleri önerilmelidir. Özellikle enjeksiyon yeri reaksiyonları oluşmuşsa, ilacı hastanın kendisine uygulama işlemi belli aralıklarla gözden geçirilmelidir. Eğer hastanın cildinde enjeksiyon yerinde şişlik ya da sıvı drenajının da eşlik ettiği herhangi bir açılma olursa has
ulamasına devam etmeden önce hekimine danışması Belge lakıp Adresı:https://www.turkiye.gov.tr/saglik-titcK-ebysBelge Doönerilmelidir. Eğer multipl lezyonlar oluşmuş ise iyileşene kadar REBİF tedavisine ara verilmelidir. Tek lezyonu olan hastalar, nekrozun çok yaygın olmaması durumunda tedaviyedevam edebilirler. Karaciğer bozukluğuREBİF ile yapılan klinik çalışmalarda, hepatik transaminazların düzeylerinde (özellikle alanin aminotransferaz (ALT)) asemptomatik yükselmeler yaygındır ve hastaların %1-3'ündehepatik transaminaz düzeylerinde normalin üst sınırının 5 katından fazla yükselmelergelişmiştir. Klinik semptom olmaksızın, serum ALT seviyeleri tedaviye başlanmadan önce,tedavinin 1., 3., ve 6. aylarında ve bundan sonra da periyodik olarak izlenmelidir. ALTnormalin üst sınırının 5 katından fazla yükselirse, enzim seviyeleri normale inene kadarREBİF dozunun azaltılması düşünülmelidir. Belirgin karaciğer hastalığı, aktif karaciğerhastalığı klinik bulgusu, alkolizm ya da artmış serum ALT (normalin üst sınırının 2,5 katındanfazla) hikayesi olan hastalarda, REBİF'e dikkatlice başlanmalıdır. Sarılık ya da karaciğerbozukluğunun diğer klinik semptomları görülürse REBİF ile tedavi kesilmelidir. REBİF diğer interferon beta'lar gibi, akut karaciğer yetmezliğini de içeren şiddetli karaciğer hasarına yol açma potansiyeline sahiptir (bakınız bölüm 4.8). Şiddetli karaciğer hasarı oluşanvakaların çoğu tedavinin ilk 6 ayında oluşmuştur. Seyrek görülen semptomatik karaciğerfonksiyon bozukluğunun mekanizması bilinmemektedir. Özel bir risk faktörü gösterilmişdeğildir. Böbrek ve idrar yolu bozuklukları Nefrotik sendromİnterferon beta içeren ilaçlar ile tedavi sırasında, kollapslı fokal segmental glomerüloskleroz (FSGS), minimal değişiklik hastalığı (MCD), membranoproliferatif glomerülonefrit (MPGN)ve membranöz glomerülopati (MGN) dahil olmak üzere altta yatan nefropatilerin farklıolduğu nefrotik sendrom vakaları bildirilmiştir. Vakalar, tedavi sırasındaki çeşitli zamandilimlerinde rapor edilmiş olup, interferon beta ile tedaviye başladıktan yıllar sonra ortayaçıkabilmektedir. Özellikle böbrek hastalığı riski yüksek olan hastalarda örn. ödem, proteinürive böbrek fonksiyonlarında bozulma gibi erken belirti ve semptomların periyodik olarakizlenmesi önerilmektedir. Nefrotik sendrom derhal tedavi edilmeli ve REBİF tedavisininkesilmesi düşünülmelidir. Laboratuvar anormallikleriİnterferonların kullanımı sırasında laboratuvar bulguları bozulabilir. Bu nedenle REBİF tedavisi sırasında multipl skleroz hastalarının takibinde normal olarak uygulanan laboratuvartestlerine ve karaciğer enzim takibine ek olarak, tam kan, lökosit sayımı, trombosit sayımıtestlerinin düzenli aralıklarda (1., 3., ve 6. aylarda) ve daha sonra da klinik semptomolmaksızın düzenli aralıklarda yapılması önerilmektedir. Tiroid bozukluklarıREBİF ile tedavi olan hastalarda bazen yeni ya da kötüleşen tiroid bozuklukları gelişebilir. Tiroid fonksiyon testleri başlangıçta ve eğer bozuksa tedavinin başlangıcını takiben her 6-12ayda bir yapılması tavsiye edilir. Şayet testler başlangıçta normalse rutin testlere gerekduyulmaz, fakat tiroid bozukluğunun klinik bulguları görülürse yapılmalıdır (bakınız bölüm4.8). Şiddetli böbrek ya da karaciğer yetmezliği ve şiddetli kemik iliği supresyonuŞiddetli renal ve hepatik yetmezliği olan ve ileri derecede kemik iliği supresyonu olan hastalara interferon beta-1a uygulaması sırasında dikkatli olunmalı ve hastalar yakından takip edilmelidirler. Nötralizan antikorlarİnterferon beta-1a'ya karşı serumda nötralizan antikorlar gelişebilir. Bu antikorların kesin insidansı halen tam olarak belirlenmemiştir. Klinik verilere göre REBİF 22 mikrogramın 24ile 48 ay arası kullanımından sonra hastaların yaklaşık % 24'ünde interferon beta 1a içinserum antikorları gelişebilir. Antikorların varlığı interferon beta-1a'ya farmakodinamik cevabızayıflatabilir (beta-2 mikroglobulin ve neopterin). Antikorların klinik önemi tamkesinleşmemekle beraber, klinik ve MRI değişkenliklerinde azalan etki görülebilir. HastaREBİF'le tedaviye yetersiz cevap veriyorsa ve nötralizan antikorları varsa, hekim tedaviyedevam için fayda/risk oranını değerlendirmelidir. Serum antikorlarını saptamak için kullanılan yöntemlerin çeşitliliği ve antikor pozitiflik tanımının farklılık göstermesi, farklı ürünler arasındaki antijenitenin karşılaştırılabilmesiolanağını sınırlar. Multipl sklerozun diğer şekilleriSadece yatan multipl skleroz hastalarından elde edilen güvenlilik ve etkililik verileri sınırlıdır. REBİF primer ilerleyici MS'li hastalarda henüz araştırılmamıştır, bu hastalardakullanılmamalıdır. Sodyum içeriğiREBİF her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder, yani esasında sodyum içermez. Benzil AlkolREBİF 0,5 mL doz başına 2,5 mg benzil alkol içerir. Benzil alkol alerjik reaksiyonlara neden olabilir. Solunum semptomları için 3 yaşından küçük hastaları izleyin. Hamile veya emziren hastalara, zamanla birikip metabolik asidoza neden olabilecek yardımcı madde olan benzil alkolden kaynaklanan potansiyel risk konusunda tavsiyede bulunun.Zamanla birikip metabolik asidoza neden olabilecek yardımcı madde benzil alkoldenkaynaklanan potansiyel risk nedeniyle hepatik veya renal bozukluğu olan hastalarda dikkatlikullanın. Biyoteknolojik tıbbi ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriREBİF (İnterferon beta-1a) ile insanlarda ilaç etkileşimi çalışmaları yapılmamıştır. İnterferonların insan ve hayvanlarda hepatik sitokrom P450 enzim aktivitesini azalttığı bildirilmiştir. Dar bir tedavi indeksine sahip ve atılımı büyük ölçüde hepatik sitokrom P450sistemine bağlı olan ilaçlarla (örn. antiepileptikler ve bazı antidepresanlarla) REBİF kombineolarak kullanıldığında dikkStleuygÜlanmatfdır;^^*'® imzalanmıştır.
REBİF'in kortikosteroidler veya ACTH ile etkileşimi sistematik olarak çalışılmamıştır. Klinik çalışmalar multipl skleroz hastalarının relapslar sırasında REBİF ve kortikosteroidler veyaACTH alabileceklerini göstermektedir. Özel popülasyonlara ilişkin ek bilgilerEtkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Fertil kadınlar uygun kontraseptif yöntemler uygulamalıdırlar. REBİF kullanırken gebe olan ya da gebeliği planlayan hastalara, potansiyel zararları bildirilmeli ve tedavinin kesilmesidüşünülmelidir (bakınız bölüm 5.3). Tedaviye başlamadan önce relaps oranı yüksek olanhastalarda, gebelik durumunda REBİF'in kesilmesini takiben şiddetli relaps riskinin, olasıartan düşük riskine karşı değerlendirilmesi gereklidir. Gebelik dönemiKayıtlardan ve pazarlama sonrası deneyimlerden elde edilen büyük miktarda veri (1.000'in üzerinde hamilelik sonucu), gebelik öncesi ya da gebeliğin ilk üç ayında interferon betayamaruz kalmanın ardından artan konjenital anomali riski olmadığını gösterir. Bununla birlikte,ilk trimesterde maruz kalma süresi belirsizdir. Çünkü, veriler hamilelik sırasında interferonbeta kullanımının kontrendike olduğu dönemde toplanmıştır ve hamilelik tespit edildiğindeve/ veya doğrulandığında tedavinin kesilmiş olması muhtemeldir. İkinci ve üçüncütrimesterde maruz kalma deneyimi çok sınırlıdır. Hayvan verilerine göre (bkz. Bölüm 5.3), spontan düşük için muhtemel bir artış riski vardır. İnterferon betaya maruz kalan gebe kadınlarda spontan düşük olma riski, halihazırda mevcutolan verilere dayanarak yeterince değerlendirilememektedir. Ancak, veriler şu ana kadar artanbir risk önermemektedir. Sınırlı sayıda (1.000'in üzerinde hamilelik sonucu) gebelikte maruz kalma olgularından gelen veriler, REBİF'in gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığı üzerinde adversetkileri olduğunu göstermemektedir. Bugüne kadar herhangi önemli bir epidemiyolojik verielde edilmemiştir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetalgelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımındanyetersizdir (bkz. kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. İlacın kullanımına karar verirken, anne ve çocuk üzerindeki olası riski ve yararı dikkate alınmalıdır. Laktasyon dönemiİnterferon beta-la'nın anne sütüne geçişiyle ilgili sınırlı bilgi, interferon betanın kimyasal/ edilebilir olduğunu göstermektedir. Emzirilen yenidoğan/ bebek üzerinde zararlı bir etkibeklenmemektedir. Hastanın interferon beta-1a tedavisine olan tıbbi ihtiyacı ile birlikte emzirmenin yararı ve potansiyel riski göz önünde bulundurulmalıdır. Üreme yeteneği / FertiliteMaymunlarda bir embriyo/fetal toksisite çalışmasında reprodüktif bozukluk oluşturduğuna ilişkin bir kanıt bulunmamıştır. Diğer alfa ve betalarla olan gözlemlere dayanarak düşükriskinde artış olması ihtimali göz ardı edilemez. İnterferon beta-1a'nın erkek fertilitesi üzerineetkileri konusunda herhangi bir bilgi yoktur. 4.7. Araç ve makine kullanımı üzerindeki etkilerİnterferon kullanımına bağlı merkezi sinir sistemiyle ilgili advers etkiler, (ör.sersemlik hali), hastaların sürücülük yapmalarını ve makine kullanmalarını etkileyebilir (bakınız bölüm 4.8).Bu hastalar dikkat gerektiren tehlikeli işler yapmamaları konusunda uyarılmalıdır. 4.8. İstenmeyen etkilerGüvenlilik profilinin özetiREBİF tedavisine eşlik eden advers reaksiyonların en yüksek oranı grip benzeri sendromlara aittir. Grip benzeri semptomlar tedavinin başlangıcında daha çok görülür ve devam edentedavi ile sıklığı azalır. REBİF ile tedavi edilen hastaların yaklaşık %70'inde, tedavininbaşlamasından sonraki ilk 6 ay içinde tipik interferon grip benzeri sendrom görülmesibeklenebilir. Ayrıca yaklaşık %30 hastada, daha çok hafif enflamasyon ve eritem olmak üzereenjeksiyon yeri reaksiyonu görülebilir. Karaciğer fonksiyonlarının laboratuvar değerlerindeasemptomatik artış ve lökosit sayısında azalma da sık görülmektedir. İnterferon-beta-1a ile gözlenen istenmeyen etkilerin çoğunluğu genellikle hafif ve geri dönüşlü olup, doz azaltılmasına iyi yanıt verir. Kalıcı veya şiddetli istenmeyen etkiler sözkonusu olduğunda hekimin değerlendirmeleri çerçevesinde, REBİF'in dozu geçici olarakazaltılabilir ya da tedavi kesilebilir. İstenmeyen etkiler listesiSunulan istenmeyen etkiler, klinik çalışmaların yanı sıra pazarlama-sonrası bildirimlerden tespit edilmiştir (bir yıldız [*] pazarlama-sonrası gözetim esnasında tanımlanan istenmeyenetkileri gösterir).Aşağıdaki tanımlar bundan sonra kullanılan sıklık terminolojisi içingeçerlidir.Çok yaygın (> 1/10), yaygın (> 1/100 ila < 1/10), yaygın olmayan (> 1/1000 ila < 1/100), seyrek (> 1/10000 ila < 1/1000), çok seyrek (< 1/10000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor). Kan ve lenf sistemi hastalıklarıÇok yaygın: Nötropeni, lenfopeni, lökopeni, trombositopeni, anemi Seyrek: Trombotik trombositopenik purpura/hemolitik üremik sendromu içeren trombotik mikroanjiyopati* (interferon beta ürünleri için sınıf etkisi, bakınız bölüm 4.4), pansitopeni*Bilinmiyor: Hemolitik anemi Bağışıklık sistemi hastalıklarıSeyrek: Anafılaktik reaksiyonlar* Endokrin hastalıklarYaygın olmayan: Çoğunlukla hipotiroidizm ya da hipertiroidizm olarak ortaya çıkan tiroid disfonksiyonu Psikiyatrik hastalıklarYaygın: Depresyon, uykusuzluk Seyrek: İntihar girişimi* Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısı Yaygın olmayan: Epileptik nöbetler * Bilinmiyor: Multipl skleroz alevlenmelerini taklit eden geçici nörolojik semptomlar (yani hipoestezi, kas spazmı, parestezi, yürümede zorluk, muskuloskeletal katılık)* Göz hastalıklarıYaygın olmayan: Retinal vasküler hastalıklar (örn. retinopati, pamuksu lekeler ve retinal atardamarın veya toplardamarın tıkanması)* Vasküler hastalıklarYaygın olmayan: Tromboembolik olaylar* Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Dispne* Bilinmiyor: Pulmoner arteriyel hipertansiyon* (interferon beta ürünleri için sınıf etkisi, aşağıdaki pulmoner arteriyel hipertansiyon açıklamasına bakınız) Gastrointestinal hastalıklarYaygın: Diyare, bulantı, kusma Hepato-biliyer hastalıklarıÇok yaygın: Asemptomatik transaminaz artışı Yaygın: Ciddi transaminaz yükselmeleri Yaygın olmayan: Sarılık ile veya sarılık olmaksızın hepatit* Seyrek: Karaciğer yetmezliği*(ayrıca bakınız bölüm 4.4), otoimmun hepatit* Deri ve deri altı doku hastalıklarıYaygın: Kaşıntı, döküntü, eritematöz döküntü, makülo-papüler döküntü, alopesi* Yaygın olmayan: Ürtiker* Seyrek: Quincke ödem (anjioödem)*, eritema multiforme*, eritema multiforme benzeri deri reaksiyonları*, Stevens-Johnson sendromu* Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın: Miyalji, artralji Seyrek: İlaca bağlı lupus eritematozus* Böbrek ve idrar yolu hastalıkları:httpsl//www.turkiye.gov.tr/saglik-titck-ebysGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: Enjeksiyon yerinde enflamasyon, enjeksiyon yeri reaksiyonu, grip benzeri semptomlar Yaygın: Enjeksiyon yerinde ağrı, yorgunluk, sertlik, ateş Yaygın olmayan: Enjeksiyon yerinde nekroz, enjeksiyon yerinde kitle, enjeksiyon yerinde apse, enjeksiyon yeri enfeksiyonları*, terlemede artış* Seyrek: Enjeksiyon yerinde selülit* Sıklığı bilinmiyor: Panikülit (enjeksiyon yerinde olmuştur) Pediyatrik popülasyonResmi klinik çalışma ya da farmakokinetik çalışmalar çocuklarda ve gençlerde yapılmamıştır. Yine de sınırlı sayıda yayınlanmış veriler haftada 3 kez subkütan REBİF 22 mikrogram veya44 mikrogram kullanan 12-16 yaşlarındaki gençlerde görülen güvenlilik profilininerişkinlerde görülene benzer olduğunu göstermektedir. İnterferon sınıf etkisiİnterferonların uygulanması, anoreksi, baş dönmesi, anksiyete, aritmi, vazodilasyon ve çarpıntı, menoraji ve metroraji ile ilişkilendirilmiştir. İnterferon beta ile tedavi sırasında artmış otoantikor oluşumu ortaya çıkabilir. Pulmoner arteriyel hipertansiyonİnterferon beta ürünleri ile pulmoner artiyel hipertansiyon (PAH) vakaları bildirilmiştir. Vakalar, interferon beta ile tedaviye başladıktan sonra birkaç yıla kadar olmak üzere çeşitlizaman noktalarında rapor edilmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;[email protected];4.9. Doz aşımı ve tedavisiDoz aşımı durumunda, hasta gözlem amacıyla hastaneye yatırılmalı ve uygun destek tedavisi uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Immunostimülanlar, İnterferonlar ATC kodu: L03AB07 İnterferonlar immünomodulatör, antiviral ve antiproliferatif özelliklere sahip bir endojen glikoproteinler grubudur. REBİF (interferon beta-1a) endojen insan interferon betası ile aynı aminoasit dizilişini paylaşır. Memeli hücrelerin4e(ıÇinHâfflsiejiiYuffiustaüğı)uüretilir ve bu nedenle doğal protein Belge D(gtbânglİ;kıozileo^iarŞ3S3k0Q3NRaklUQ3NRM0Fy Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysBildirilen farmakodinamik değişiklikler, dozun uygulama yoluna bakmaksızın, REBİF'in uygulanması ile ortaya çıkar. Tek doz sonrası, 2'5' OAS sentetazın serum ve intraselüleraktivitesi ve neopterin ile beta-2 mikroglobulinin serum konsantrasyonları 24 saat içerisindeartar ve 2 gün içerisinde de düşmeye başlar. İntramüsküler ve subkütan uygulamalartamamiyla eşdeğer cevaplara yol açar. 4 doz için her 48 saatte bir tekrarlanan subkütanuygulamadan sonra, bu biyolojik tepkiler, tolerans gelişiminin hiçbir belirtisi olmadan, yüksekkalır. Biyolojik yanıt göstergeleri (örn., 2'5' OAS aktivitesi, neopterin ve beta 2 mikroglobulin), sağlıklı gönüllülere ve multipl skleroz hastalarına subkütan uygulamanın ardından interferonbeta 1a tarafından düşürülür. Tek bir subkütan enjeksiyonun ardından pik konsantrasyonlarakadarki zaman neopterin, beta 2 mikroglobulin ve 2'5' OAS için 24 ila 48 saat, MX1 için 12saat ve OAS1 ve OAS2 gen ekspresyonları için 24 saat olmuştur. İlk ve altıncı uygulamanınardından bu göstergeler için benzer yükseklikte ve zamanda pikler gözlenmiştir. REBİF'in multipl sklerozdaki tam etki mekanizması halen araştırılmaktadır. Relaps-remisyon gösteren multipl sklerozREBİF'in etkililiği ve güvenliliği haftada üç kez subkütan uygulanan, 11-44 mikrogram (3-12 milyon lU) arası dozlarda relaps-remisyon gösteren MS'li hastalarda değerlendirilmiştir.Verilen dozda, REBİF 22 mikrogramın başlangıçta EDSS'si 0-5,0 olan önceki 2 yılda en az 2atak geçirmiş olan hastalarda, klinik relapsların insidansını ve şiddetini (2 yılda yaklaşık %30)azalttığı gösterilmiştir. 3 ay sonra kesinleşen EDSS'deki en az bir puan artışı ile tanımlanan,özürlülüğü ilerleyen hastaların yüzdesi, % 39'dan (plasebo) % 30'a (REBİF 22 mikrogram)azalmıştır. 2 yıl plasebo ile ve sonra 2 yıl daha ya REBİF 22 ya da REBİF 44 mikrogram iletedavi edilmiş hasta grubuyla kıyaslandığında, 4 yıldan sonra ortalama alevlenme (atak)oranında azalma, REBİF 22 mikrogram ile tedavi edilen hastalarda %22, REBİF 44mikrogram ile tedavi edilen hastalarda %29'dur. Sekonder ilerleyici multipl skleroz2 seneyi takiben klinik ilerleme bulgusu olan fakat 8 hafta boyunca relaps yaşamamış olan, sekonder ilerleyici multipl sklerozlu (EDSS 3-6,5) hastalara 3 yıllık çalışmada, REBİFözürlülüğün ilerlemesi üzerine belirgin bir etki göstermemiştir, ancak relaps oranı yaklaşık%30 azalmıştır. Şayet hasta popülasyonu 2 alt gruba bölünürse (çalışmaya başlamadan 2 yılönce relapslı olanlar ve relapssız olanlar olarak), relapssız olan hastalarda özürlülüğe etkisiyoktur, fakat relapslı hastalarda çalışmanın sonunda özürlülüğün ilerlemesi oranı %70'den(plasebo) %57'ye (REBİF 22 mikrogram ve 44 mikrogram sonuçları birlikte) azalmıştır.Hastaların alt gruplarında elde edilen bu sonuçlar dikkatle değerlendirilmelidir. Primer ilerleyici multipl sklerozREBİF henüz primer ilerleyici multipl sklerozlu hastalarda araştırılmamıştır, dolayısıyla bu hastalarda kullanılmamalıdır. 5.2. Farmakokinetik özelliklerGenel özellikler Emilim:Sağlıklı gönüllülerde intravenöz uygulamadan sonra, interferon beta-1a serum düzeyleri dozla orantılı biçimde keskin bir multi eksponansiyel bir düşüş göstermiştir.Başlangıç yarılanma ömrü dakikalar seviyesinde ve terminal yarılanma ömrü bir kaç saatdüzeyindedir. Subkütan veya intramüsküler yollarla uygulandığında, interferon beta serumseviyeleri düşük kalır, ancak uygulamadan 12-24 saate kadar ölçülebilir düzeylerdedir.REBİF'in intramüsküler veya subkütan uygulamasında eşit derecede interferon betamaruziyetine neden olur.Dağılım:REBİF'in 22 ve 44 mcg dozlarının tekrarlı subkütan enjeksiyonlarını takiben maksimum konsantrasyonlar tipik olarak 8 saat sonra gözlemlenmiştir, ancak bu yüksekderecede değişkendir.Biyotransformasyon:İnterferon beta-1a esas olarak karaciğer ve böbreklerde metabolize olur ve atılır.Eliminasyon:Sağlıklı gönüllülerde tekrarlı subkütanöz dozların ardından temelfarmakokinetik parametreler (EAAtau ve Cmaks) dozun 22 mcg'dan 44 mcg'a artması ile orantılı olarak artmıştır. Beklenen görünür yarı ömür 50 ila 60 saattir. Bu da çoklu dozlamınardından gözlenen birikim ile uyumludur. 5.3. Klinik öncesi güvenlilik verileriGeleneksel güvenlilik farmakolojisi, tekrarlanan doz toksisitesi, ve genotoksisite çalışmalarına dayanan klinik dışı veriler insanlar için özel bir tehlike ortaya koymamaktadır. REBİF karsinojenisite açısından araştırılmamıştır. Maymunlarda bir embriyo/fetal toksisite çalışmasında reprodüktif bozukluk oluşturduğuna ilişkin bir kanıt bulunmamıştır. Diğer alfa ve beta interferonların hayvan çalışmalarında artandüşük riski rapor edilmiştir. İnterferon beta-la'nın erkek fertilitesi üzerine etkileri konusundaherhangi bir bilgi yoktur. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiD-Mannitol Poloksamer 188 L-metiyonin Benzil alkol Sodyum asetat Asetik asit (pH ayarı için) Sodyum hidroksit (pH ayarı için) Enjeksiyonluk su 6.2. GeçimsizliklerGeçerli değildir. 6.3. Raf-ömrü18 ayBelge Doll,!h,gl'J&iy89âl8âoRS%:6.4. Saklamaya yönelik özel tedbirler2-8°Cde buzdolabında saklanmalıdır. Dondurulmamalıdır. Işıktan korumak için, kartuş orijinal ambalajında saklanmalıdır. Kullanıma hazır Rebif kartuşu içeren RebiSmart otoenjektör cihazı buzdolabında cihaz saklama kabında saklanmalıdır. Geçici olarak soğutucu mevcut olmadığında, REBİF hasta tarafından bir kere için 14 güne kadar 25°C'nin altında saklanabilir, sonra buzdolabına geri koyulmalı ve son kullanmatarihinden önce kullanılmalıdır. 6.5. Ambalajın niteliği ve içeriği1,5 mL enjeksiyonluk çözelti içeren piston tıpa (kauçuk) ve kıvrımlı kapak (aluminyum ve halobutil kauçuk) ile kartuş (Tip I cam). Paket 4 ya da 12 kartuş içerir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerÖnceden doldurulmuş kartuştaki enjeksiyonluk çözelti, Rebismart elektronik enjeksiyon cihazı ile kullanıma hazırdır. Çoklu doz kullanımı içindir. Sadece, bozulma belirtisi olmayan ve içinde partikül bulunmayan, berrak ve opak solüsyon kullanılmalıdır. Uygulama yolu ve metodu: REBİF deri altı enjeksiyon için tasarlanmıştır. İlk enjeksiyon uygun nitelikte bir sağlık çalışanının gözetimi altında yapılmalıdır. Yeterlieğitimi aldıktan sonra, kendiniz ya da aileden biri ya da bir arkadaşınız evde ilacıuygulamak için REBİF kartuşlarını cihazınız ile kullanabilirsiniz. Kartuş RebiSmart elektronik enjeksiyon cihazı ile kullanılır. Kullanım için talimatlar cihazınız ile sağlanır. Lütfen dikkatle takip ediniz. REBİF kartuşlarının RebiSmart cihazı ile kullanımı hakkında kısa talimatlar aşağıdaverilmiştir. Başlamadan önce: Ellerinizi su ve sabunla yıkayınız. REBİF kartuşu blister ambalajından, arkasındaki plastik kapağı açarak çıkarınız. Kartuşun RebiSmart cihazının içinde ya da ambalajında iken kazara donmuş olupolmadığını (sadece buzdolabın içinden çıkardıktan sonra) kontrol ediniz. Gözle görünürbozulma işareti ve parçacık olmayan, sadece berrak ve opak çözelti kullanılmalıdır. Cihaza kartuşu yerleştirmek ve enjeksiyonu sağlamak için, cihazınız ile sağlanankullanım talimatını takip ediniz. REBİF nereye enjekte edilir: Enjeksiyon yerini seçiniz. Doktorunuz size olası enjeksiyon yerlerini önerecektir (üst uyluklar ve alt karın uygun bölgelerarasındadır). Enjeksiyon yeri nekrozu riskini en aza indirmekamacıyla, aynı yere sıklıkla enjeksiyon yapılmaması için,enjeksiyon yerinizi düzenli olarak değiştirmeniz ve dikkatletakip etmeniz önerilir. 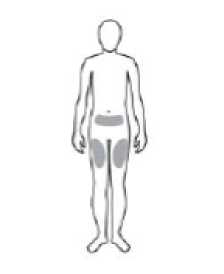 NOT: Şişlik, beze veya ağrı hissettiğiniz bölgelere enjeksiyon uygulamayınız; böyle bir bulguda doktorunuzla veya hemşirenizle konuşunuz. Enjeksiyon öncesi, enjeksiyon yerindeki deriyi temizlemek için alkollü bez kullanınız. Deriyi kurumaya bırakınız. Deridealkol kalmışsa acıma hissi duyabilirsiniz. REBİF nasıl enjekte edilir: Doktorunuz 44 mikrogramlık doğru dozu nasıl seçeceğinizi size söyleyecektir. Ayrıca lütfen alt kısımda verilen ""RebiSmart kullammi"kısmını ve RebiSmart cihazınızlasağlanan kullanma talimatlarını okuyunuz.
Enjeksiyondan önce cihazın ekranında görünen dozun, reçetelenen 44 mikrogramlık doza karşılık gelen dozolduğundan emin olunuz. Yeşil ışık sönene kadar bekleyin. Bu size enjeksiyonun tamamlandığını bildirecektir. Enjeksiyon yerinden RebiSmart'ı çekiniz. RebiSmart ile REBİF'in enjeksiyonu sonrası: RebiSmart kullanma talimatına göre iğneyi çıkarınız ve yok ediniz. Gazlı bez ya da kuru pamuk ile enjeksiyon yerini hafifçe ovalayınız.
saklama kabında
REBİF kartuşu içeren RebiSmart cihazı, buzdolabında cihazsaklanmalıdır. Kullanılmamış olan ürünler ya da atık materyaller, Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imhaedilmelidir. 7. RUHSAT SAHİBİMerck İlaç Ecza ve Kimya Tic.A.Ş. Atatürk Mh. Ertuğrul Gazi Sk. Metropol İstanbul Sit. C2 Apt. No: 2A/20, Ataşehir/İstanbul Tel: 0 216 578 66 00Fax: 0 216 469 09 22 8. RUHSAT NUMARASI2017/544 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ27.07.201710. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriRebif 66 Mcg/1,5 Ml Kartuşta Enjeksiyonluk ÇözeltiEtken Maddesi: İnterferon Beta-1a Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.
