İmatra 400 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA URUN BILGISI¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBİ ÜRÜNÜN ADIİMATRA 400 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir film kaplı tablet; İmatinib mesilat 478 mg (400 mg İmatinib'e eşdeğer) içerir. Yardımcı maddeler:Yardımcı maddeler için 6.1.'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet. Koyu sarı kahverengimsi turuncu renkli bir yüzü çentikli, oblong bikonveks film kaplı tabletlerdir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarİMATRA'nın endikasyonları: Yeni tanı konmuş Philadelphia kromozomu pozitif kronik faz kronik miyeloid lösemi(KML) hastalarında, Akselere faz Philadelphia kromozomu pozitif kronik miyeloid lösemi (KML) hastalarında, Blastik faz Philadelphia kromozomu pozitif kronik miyeloid lösemi (KML) hastalarında, Diğer tedavilere dirençli Philadelphia kromozomu pozitif kronik miyeloid lösemi (KML)hastalarında, İlk tanısı Philadelphia kromozomu pozitif kronik miyeloid lösemi (KML) olan ancak tedaviile Philadelphia kromozomu negatif hale gelen kronik/akselere/blastik faz kronik miyeloidlösemi hastalarında, Kronik miyeloid lösemili (KML) olan 3 yaş ve üzerindeki çocuklarda birinci basamaktedavide, Erişkin hastalarda rezeke edilemeyen ve/veya metastatik malign C-KIT reseptörü taşıyangastrointestinal stromal tümör (GIST) hastalarında, Opere edilmiş, C-KIT reseptörü pozitif bulunan erişkin GIST (gastrointestinal stromaltümör) hastalarında AFIP* kriterlerine göre yüksek risk** taşıyanlarda adjuvan tedavide üçyıl süre ile, Yeni tanı konulmuş Philadelphia kromozomu pozitif yetişkin ve pediyatrik akut lenfoblastiklösemi (Ph+ ALL) hastalarında klinik yararı gösterilmiş çoklu ajanlı kemoterapi şemaları ilekombine olarak remisyon indüksiyonu amacıyla, Relaps-refrakter Philadelphia kromozomu pozitif akut lenfoblastik lösemi (Ph+ALL)hastalarında klinik yararı gösterilmiş çoklu ajanlı kemoterapi şemaları ile kombine olarakremisyon indüksiyonu amacıyla, FIP1L1-PDGFRA füzyon geni laboratuvar incelemeleriyle gösterilen hipereozinofiliksendrom ve sistemik mastositoz hastalarında kullanılabilir. (* Armed Forces Institute of Pathology (AFIP) kriterleri bölüm 5.1 Farmakodinamik özellikler'de verilmiştir. **AFIP kriterlerine göre yüksek riskli grupların tanımı; 1- Mide yerleşimli alanlarda tümör büyüklüğü 6 cm'nin üzerinde olan ve mitotik indeksi 5'in üzerinde bulunanlar 2- Mide dışındaki yerleşimlerde 10 cm ve üzerinde tümör büyüklüğü olan ya da mitotik indeksi 5'in üzerindebulunanlar) 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Tedavi, hematolojik malign hastalıklar ve malign sarkomlar bulunan hastaların tedavisinde deneyimi olan bir doktor tarafından başlatılmalıdır.Tedavi, hasta yarar sağladığı sürece devam ettirilmelidir. Kronik Miyeloid Lösemi de (KML) DozajİMATRA'nın önerilen dozu, kronik fazdaki erişkin KML hastaları için 400 mg/gündür. Kronik faz KML, aşağıdaki tüm kriterlerin karşılandığı durum olarak tanımlanır: kanda ve kemik9 aşağıdakilerden herhangi birinin varlığı olarak tanımlanır: kanda ve kemik iliğinde blast > %15 fakat < %30, kanda ve kemik iliğinde blast artı promiyelosit > %30 (< %30 blasta neden olur), 9 periferik kan bazofilleri > %20, trombosit < 100 x 10 /L (tedaviden ilişkisiz olarak). İMATRA'nın önerilen dozu, blast krizindeki erişkin hastalar için 600 mg/gündür. Blast krizi,kanda veya kemik iliğinde ~ %30 blast ya da hepatosplenomegali harici bir ekstramedüllerhastalık olarak tanımlanır. İlaca bağlı oluşan ciddi advers etki ve ağır lösemiyle ilişkili nötropeni veya trombositopeni gelişmemiş olması koşuluyla, hastalığın ilerlemesi (herhangi bir zamanda), en az 3 aylıktedaviden sonra tatmin edici bir hematolojik yanıt alınamaması, 12 aylık tedaviye rağmensitogenetik cevap elde edilmemesi veya daha önce elde edilmiş olan hematolojik ve/veyasitogenetik yanıtın kaybolması gibi durumlarda; kronik fazda hastalık bulunanlarda dozun 400mg'dan 600 mg'a yükseltilmesi, ya da hızlanmış faz veya blast krizi bulunan hastalarda dadozun 600 mg'dan maksimum 800 mg günlük doza yükseltilmesi düşünülebilir. Philedelphia kromozomu pozitif, akut lenfoblastik lösemide (Ph+ ALL) dozajPh+ ALL hastalarında önerilen İMATRA dozajı, remisyon indüksiyon kemoterapi şemaları çerçevesinde belirlenir. Hipereozinofilik sendrom ve sistemik mastositozda dozajYetişkin hipereozinofilik sendrom ve sistemik mastositoz hastalarında önerilen İMATRA dozajı, günde 100 mg'dır. Yanıtsız hallerde 400 mg'a dek çıkılabilir. Bu doz aşılamaz. Gastrointestinal Stromal Tümörlerde (GIST) dozajYetişkin, rezeke edilemeyen ve/veya metastatik malign GIST hastalarında önerilen İMATRA dozajı, günde 400 mg'dır. Değerlendirmelerin tedaviye yetersiz yanıtı ortaya koymaları durumunda, advers ilaç reaksiyonları göstermeyen hastalarda dozun 400 mg'dan 600 mg veya 800 mg'a yükseltilmesidüşünülebilir. GIST rezeksiyonunu takiben yetişkin hastaların adjuvan tedavisinde önerilen İMATRA dozu 400mg/gün'dür. Önerilen tedavi süresi 36 aydır. Adjuvan tedavi ortamında, İMATRA ileoptimum tedavi süresi bilinmemektedir. Advers reaksiyonlar için doz ayarlamalarıHematolojik olmayan advers reaksiyonlarİMATRA kullanıldığında eğer ciddi hematolojik olmayan advers reaksiyon gelişirse, tedavi bu olay ortadan kalkıncaya kadar durdurulmalıdır. Daha sonra, olayın ilk ciddiyetine göredeğişecek şekilde tedavi devam ettirilir. Eğer bilirubin, normal sınırın üst limitini (NSÜL) 3 kattan fazla aşacak şekilde yükselirse ya da karaciğer transaminazlarında NSÜL değerinin 5 katından fazla artış olursa, İMATRA, bilirubindüzeyleri <1,5 x NSÜL ve transaminaz düzeyleri <2,5 x NSÜL seviyesine ininceye kadardurdurulmalı ve daha sonra da azaltılmış günlük dozlarla devam ettirilmelidir. Yetişkinlerdedoz 400 mg'dan 300 mg'a veya 600 mg'dan 400 mg'a veya 800 mg'dan600 mg'a, çocuklarda ise 260 mg/m2/gün'den 200 mg/m2/gün'e veya 340 mg/m2/gün'den260 mg/m2/gün'e düşürülmelidir. Hematolojik advers reaksiyonlarAğır nötropeni ve trombositopeni geliştiği takdirde dozun azaltılması ya da tedavinin kesilmesi aşağıdaki tabloda belirtildiği şekilde düzenlenmelidir.
1. ANC >1,5 x 109/L ve trombosit sayısı>75 x 109/L oluncaya kadar İMATRAtedavisi durdurulur. 2. İMATRA tedavisine önceki dozda (yaniciddi advers reaksiyon gerçekleşmedenönceki dozda) devam edilir. 3. ANC <1,0 x 109/L ve/veya trombositsayısının <50 x l09/L olduğu durumyinelendiği takdirde, 1.adım yenidenuygulanır ve İMATRA tedavisine doz 260mg/m1'ye düşürülerek devam edilir. ANC <1,0 x 109/L ve/veya trombosit sayısı <50 x 109/L 1. Sitopeninin lösemiye bağlı olupolmadığı kontrol edilir (kemik iliği aspiratıya da biyopsisi) 2. Eğer sitopeni lökopeniye bağlı değil iseİMATRA dozu 400 mg'a düşürülür. 3. Eğer sitopeni 2 hafta devam ederse, doz300 mg'a düşürülür. 4. Eğer sitopeni 4 hafta devam ederse vehala lösemiyle ilişkili değil ise ANC >1 x109/L ve trombositler >20 x 109/L oluncayakadar İMATRA tedavisi durdurulur ve daha sonra 300 mg ile tedaviye başlanır.a ANC <0,5 x 109/l ve/veya trombositler <10 x 109/l Hızlanmış faz KML ve blast krizi ve Ph+ALL (başlangıç dozu600 mg) ANC= mutlak nötrofil sayısı aen az 1 aylık tedaviden sonra ortaya çıkan Uygulama şekli:Reçetedeki doz, gastrointestinal etkileri en aza indirmek için yemek sırasında ve büyük bir bardak suyla yutulmalıdır. Günde 400 veya 600 miligramlık dozlar bir defada.800 miligramlık ise her birinde 400'er miligram olmak üzere sabah ve akşam iki bölümdealınmalıdır. Film kaplı tabletleri yutamayan hastalarda tablet, bir bardak suda veya elma suyunda dağıtılabilir. İhtiyaç duyulan sayıda tablet, uygun hacimde içeceğin (100 miligramlık tablet içinyaklaşık 50, 400 miligramlık tablet için yaklaşık 200 mL) içerisine konarak bir kaşıklakarıştırılır. Meydana gelen süspansiyon, tablet(ler)in tam olarak dağılmasından sonra derhaliçilmelidir. Özel popülasyonlara ilişkin ek bilgiler Karaciğer yetmezliği:İmatinib, temel olarak karaciğer yoluyla metabolize olur. Hafif, orta şiddette veya şiddetli karaciğer fonksiyon bozukluğu olan hastalara, önerilen minimal doz olan günde 400 mgverilmelidir. Bu doz, tolere edilemediği takdirde azaltılabilir (bkz. Bölüm 4.4. Özel kullanımuyarıları ve önlemleri, 4.8. İstenmeyen etkiler, 5.1. Farmakodinamik özellikler ve 5.2. Farmakokinetik özellikler). Böbrek yetmezliği:İmatinib ve metabolitleri böbrek yoluyla önemli miktarda atılmazlar. Böbrek yetmezliği olan veya diyaliz uygulanan hastalara böbrek bozukluğu başlangıç dozu olarak, önerilen minimumdoz, günlük 400 mg verilebilir. Bununla birlikte, bu hastalarda dikkatli olunması önerilir.Tolere edilememesi halinde doz azaltılabilir ya da etki görülmemesi halinde doz arttırılabilir(bkz. Bölüm 4.4. Özel kullanım uyarıları ve önlemleri). Pediyatrik popülasvon:İMATRA'nın KML endikasyonunda 2 yaşın altındaki çocuklarda ve Ph+ ALL endikasyonunda 1 yaşın altındaki çocuklarda kullanımıyla ilgili herhangi bir deneyim bulunmamaktadır.İMATRA'nın diğer endikasyonlarda çocuklarda kullanılması konusundaki deneyim çoksınırlıdır. İmatinibin 18 yaşın altındaki MDS/MPD, DFSP, GIST ve HES/CEL hastası çocuklardaki güvenliliği ve etkililiği klinik çalışmalarda belirlenmemiştir. Halihazırda mevcut yayımlanmışveriler bölüm 5.1'de özetlenmektedir fakat pozoloji ile ilişkili bir öneride bulunulamamaktadır(bkz. bölüm 5.1. Farmakodinamik özellikler). 2 Çocuklarda doz uygulaması vücut yüzey alanını (mg/m ) temel almalıdır. Kronik faz ve 1 Geriyatrik popülasyon:Yaşlılarda spesifik olarak imatinib farmakokinetiği araştırılmamıştır. Katılan hastaların %20'sinden fazlasının 65 ve daha yukarı yaşlarda olduğu klinik çalışmalarda, yetişkin hastalarda yaşla ilişkili anlamlı farmakokinetik farklılıklar gözlenmemiştir. Yaşlılarda,özel bir doz önerisi gerekli değildir. 4.3. KontrendikasyonlarAktif maddeye veya eksipiyanlardan herhangi birine karşı aşırı duyarlılık. 4.4. Özel kullanım uyarıları ve önlemleriİMATRA, başka ilaçlarla eşzamanlı olarak kullanıldığında önemli ilaç etkileşimleri görülme potansiyeli bulunmaktadır. İMATRA, proteaz inhibitörleri, azol antifungaller, belirlimakrolitler (bkz. bölüm 4.5), dar terapötik pencereye sahip CYP3A4 substratları (örn.siklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanil, alfentanil,terfenadin, bortezomib, dosetaksel, kinidin) veya varfarin ve diğer kumarin türevleri ile birlikteverildiğinde dikkatli olunmalıdır (bkz. bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğeretkileşim şekilleri). İmatinib ve CYP3A4 enzimini indükleyen tıbbi ürünlerin (örn. deksametazon, fenitoin, karbamazepin, rifampisin, fenobarbital veya Hypericum perforatum [Sarı kantaron]) eşzamanlıkullanımı, İMATRA maruziyetini önemli ölçüde azaltarak terapötik başarısızlık riskiniartırabilir. Bu nedenle kuvvetli CYP3A4 indükleyicilerinin ve imatinibin eşzamanlıuygulamasından kaçınılmalıdır (bkz. bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğeretkileşim şekilleri). Hipotiroidizm: İMATRA tedavisi sırasında levotiroksin replasmanı yapılan tiroidektomi hastalarında klinik hipotiroidizm olguları bildirilmiştir. Bu tür hastalarda tiroid stimule edici hormon (TSH)düzeyleri yakından izlenmelidir. Hepatotoksisite: İMATRA temel olarak karaciğerde metabolize olur ve atılımın yalnızca %13'ü böbrekler aracılığıyladır. Karaciğer disfonksiyonu (hafif, orta şiddette ve şiddetli) olan hastalarda,periferik kan sayımları ve karaciğer enzimleri dikkatli bir şekilde izlenmelidir (bkz. Bölüm 4.2. Pozoloji ve uygulama şekli, 4.8. İstenmeyen etkiler, 5.1. Farmakodinamik özellikler, 5.2. Farmakokinetik özellikler). GIST hastalarında karaciğer yetmezliğine sebebiyet verebilecekkaraciğer metaztazları görülmesi olasıdır. İmatinib ile karaciğer yetmezliği ve hepatik nekroz dahil karaciğer hasarı vakaları gözlenmiştir. İmatinib, yüksek doz kemoterapi rejimleri ile kombine edildiğinde ciddi hepatik reaksiyonlardabir artış bildirilmiştir. İmatinib, karaciğer fonksiyon bozukluğu potansiyeli olan kemoterapikürleriyle birlikte kullanılacaksa, karaciğer fonksiyonlarının izlenmesi tavsiye edilir (bkzBölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri, Bölüm 4.8İstenmeyen etkiler). Sıvı retansiyonu: İMATRA alan yeni tanı konulmuş KML hastalarının yaklaşık %2,5'inde ciddi sıvı retansiyonu (plevra efüzyonu, ödem, pulmoner ödem, asit, yüzeysel ödem) ortaya çıktığı bildirilmiştir. Bunedenle, hastalarda düzenli aralıklarla kilo kontrolü önerilir. Beklenmedik, ani bir kilo artışıdikkatli araştırılmalı ve gerektiğinde uygun destek tedavisi uygulanmalı ve terapötik önlemleralınmalıdır. Klinik çalışmalarda, yaşlı hastalarda ve daha önceden kardiyak hastalık hikayesibulunanlarda bu olayların insidanslarının arttığı saptanmıştır. Kardiyak disfonksiyonu olanhastalarda dikkatli olunmalıdır. Kalp hastalığı ya da böbrek yetmezliği olan hastalar: Kalp hastalığı, kalp yetmezliği açısından risk faktörleri bulunan veya böbrek yetmezliği hikayesi olan hastalar dikkatlice takip edilmeli, kalp veya böbrek yetmezliğini düşündürenbelirti ve semptomları olan her hasta değerlendirilmeli ve tedavi edilmelidir. Miyokardiyum içinde hipereozinofili sendromu (HES) hücrelerinin gizli sızdırmasının görüldüğü hastalarda izole kardiyojenik şok/sol ventrikül disfonksiyonu olguları, imatinibtedavisine başlanmasıyla beraber oluşan HES hücre degranülasyonu ile ilişkilendirilmiştir. Budurumun sistemik steroidler kullanılarak, dolaşımı destekleyen önlemler alarak ve imatinibtedavisini geçici olarak durdurarak düzeltilebileceği bildirilmiştir. Yaygın olmayan kardiyakyan etkiler bildirildiği için, İMATRA tedavisine başlamadan önce dikkatli bir yarar/zarar (risk)değerlendirmesi yapılmalıdır. Miyelodisplastik/miyeloproliferatif hastalıklar (MDS/MPD) vesistemik mastositoz yüksek eozinofil düzeyleri ile ilişkili olabilir. Bu nedenle, eozinofildüzeylerinin yüksek olduğu MDS/MPD vakalarında, sistemik mastositoz (SM) vakalarında ve HES vakalarında kardiyoloji uzmanı tarafından değerlendirme yapılmalı, ekokardiyografik inceleme yapılmalı ve serum troponin düzeyleri ölçülmelidir. Bunlardan birinde anormalliktespit edilirse kardiyoloji uzmanı ile beraber takip edilmeli ve tedavi başlangıcında imatiniblebirlikte 1-2 hafta boyunca 1-2 mg/kg dozunda sistemik steroid kullanılması düşünülmelidir. Gastrointestinal kanama: Rezeke edilemeyen ve/veya metastatik GIST'li hastalarda yürütülen bir çalışmada gerek gastrointestinal gerekse tümör içi hemorajiler bildirilmiştir (bkz. bölüm 4.8 İstenmeyen etkiler).Eldeki verilere dayanılarak, GIST'li hastaları her iki hemoraji tipi açısından daha yüksek riskaltına sokan herhangi bir predispozan faktör tanımlanmamıştır (örn. tümör büyüklüğü, tümöryeri, pıhtılaşma bozuklukları). Vaskülarite artışı ve kanamaya yatkınlıkta artış, GIST'indoğasında yer aldığından ve hastalığın klinik seyrinin parçası olduğundan, tüm hastalardahemoraji izlemi ve kontrolüne yönelik standart uygulamalar ve prosedürler uygulanmalıdır. Ayrıca, KML, ALL ve diğer hastalıkları olan hastalarda pazarlama sonrası deneyimde nadir bir gastrointestinal hemoraji nedeni olarak gastrik antral vasküler ektazi (GAVE) bildirilmiştir(bkz. Bölüm 4.8 İstenmeyen etkiler). Gerektiğinde, İMATRA tedavisinin bırakılmasıdüşünülmelidir. Tümör lizis sendromu: Tümör lizis sendromu TLS meydana gelme olasılığı nedeniyle, İMATRA başlatılmadan önce klinik açıdan anlamlı dehidrasyonun düzeltilmesi ve yüksek ürik asit düzeylerinin tedavisiönerilmektedir (bkz. Bölüm 4.8. İstenmeyen etkiler). Hepatit B reaktivasyonu: Hepatit B virüsü (HBV) kronik taşıyıcısı olan hastalarda, BCR-ABL tirozin kinaz inhibitörleri ile tedavi sonrası, Hepatit B reaktivasyonu ortaya çıkmıştır. Bazı vakalar, karaciğer nakli veyaölüme sebep olan akut karaciğer yetmezliği veya fulminan hepatit ile sonuçlanır. İMATRA tedavisine başlanmadan önce, hastalar HBV enfeksiyonu açısından test edilmelidir. Pozitif HBV serolojisine sahip (aktif hastalığı olanlar dahil) ve tedavi sırasında HBVenfeksiyonu için pozitif test sonucu veren hastalarda, tedavi başlatılmadan önce karaciğerhastalığı ve HBV tedavisi konusunda uzman hekimlere danışılmalıdır. İMATRA ile tedaviyeihtiyaç duyan HBV taşıyıcıları, tedavi boyunca ve tedavi sonlandırıldıktan sonra birkaç ayboyunca aktif HBV enfeksiyonu bulgu ve belirtileri için yakından izlenmelidir (bkz. Bölüm4.8). Fototoksisite: İMATRA tedavisi ile ilişkili fototoksisite riski nedeniyle doğrudan güneş ışığına maruziyetten kaçınılmalı ya da maruziyet en aza indirilmelidir. Hastalara, koruyucu kıyafetler ya da yüksekgüneş koruma faktörüne (SPF) sahip güneş kremlerinin kullanımı gibi önlemler almalarısöylenmelidir. Trombotik mikroanjiyopati: BCR-ABL tirozin kinaz inhibitörleri (TKI'lar), İMATRA için bireysel vaka raporları dahil olmak üzere trombotik mikroanjiyopati (TMA) ile ilişkilendirilmiştir (bkz. Bölüm 4.8). EğerİMATRA alan bir hastada TMA ile ilişkili laboratuar ya da klinik bulgular meydana gelirse,tedavi bırakılmalı ve ADAMTS13 aktivitesi ve anti-ADAMTS13-antikorunun belirlenmesidahil olmak üzere TMA için kapsamlı bir değerlendirme yapılmalıdır. Eğer düşük ADAMTS13aktivitesi ile birlikte anti-ADAMTS13-antikoru yükselmişse, İMATRA tedavisi yenidenbaşlatılmamalıdır. Laboratuvar testleri: İMATRA ile tedavi sırasında düzenli olarak tam kan sayımları yapılmalıdır. KML hastalarında İMATRA tedavisine, nötropeni ya da trombositopeni eşlik etmiştir. Bununla birlikte, busitopenilerin ortaya çıkışı, hastalığın tedavi edildiği evreye bağlıdır ve kronik fazda KMLbulunan hastalarla karşılaştırıldığında, hızlanmış fazda KML ya da blast krizinde bulunanhastalarda daha sık olmaktadır. Bölüm 4.2. Pozoloji ve uygulama şekli bölümünde önerildiğigibi İMATRA tedavisi kesilebilir ya da dozu azaltılabilir. İMATRA alan hastalarda karaciğer fonksiyonu (transaminazlar, bilirubin, alkalin fosfataz) düzenli olarak takip edilmelidir. Böbrek fonksiyonu bozuk olan hastalarda, imatinib plazma maruziyetinin, böbrek fonksiyonu normal olan hastalara kıyasla daha yüksek olduğu görülmektedir; bunun olası nedeni imatinibibağlanan bir protein olan alfa-asit glikoproteinin (AGP) plazma düzeylerinin bu hastalarda dahayüksek olmasıdır. Böbrek bozukluğu olan hastalarda en düşük başlangıç dozu verilmelidir. Şiddetli böbrek bozukluğu olan hastalar dikkatle tedavi edilmelidir. Doz, tolere edilmiyorsa azaltılabilir (bkz. bölüm 4.2 ve 5.2). Uzun süreli imatinib tedavi, böbrek fonksiyonunda klinik olarak anlamlı azalma ile ilişkili olabilir. Bu nedenle imatinib tedavisine başlanmadan önce böbrek fonksiyonu değerlendirilmelive tedavi sırasında yakından izlenmeli, böbrek fonksiyon bozukluğu açısından risk faktörlerigösteren hastalara özellikle dikkat edilmelidir. Böbrek fonksiyon bozukluğu gözlenirse,standart tedavi kılavuzları uyarınca uygun kontrol ve tedavi reçete edilmelidir. Pediatrik popülasyonİmatinib alan çocuklarda ve ergenlik öncesi çocuklarda görülen büyüme geriliğine ilişkin vaka raporları alınmıştır. KML pediatrik popülasyonundaki gözlemsel bir çalışmada iki küçük altkümede pubertal durum veya cinsiyet fark etmeksizin medyan boy standart sapma skorlarında12 ve 24 ay sonra istatistiksel olarak anlamlı (fakat klinik anlamlılığı belirsiz) bir azalmabildirilmiştir. İmatinib tedavisi görmekte olan çocuklarda büyümenin yakından izlenmesiönerilir (bkz. Bölüm 4.8). 4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriİmatinibin plazma konsantrasyonlarını değiştiren ilaçlar İmatinibin plazma konsantrasyonlarını arttırabilen ilaçlar: Sitokrom P450 izoenzimlerinden CYP3A4 aktivitesini inhibe eden maddeler (örn. indinavir, lopinavir/ritonavir, ritonavir, sakinavir, telaprevir, nelfinavir ve boseprevir gibi proteazinhibitörleri; ketokonazol, itrakonazol, posakonazol ve varikonazol gibi azol antifungal ajanlar;eritromisin, klaritromisin ve telitromisin gibi belirli makrolidler) metabolizmayı azaltabilir veimatinib konsantrasyonlarını arttırabilirler. Sağlıklı deneklere tek doz ketokonazol (birCYP3A4 inhibitörü) ile birlikte uygulandığında, imatinibe maruz kalma durumunda anlamlı birartış ortaya çıkmıştır (imatinibin ortalama Cmaks ve EAA değerleri sırasıyla %26 ve %40artmıştır). İMATRA, CYP3A4 izoziminin inhibitörleri ile birlikte verilirken dikkatliolunmalıdır. İmatinibin plazma konsantrasyonlarını azaltabilen ilaçlar: CYP3A4 aktivitesini indükleyen maddeler (örn. deksametazon, fenitoin, karbamazepin, rifampisin, fenobarbital, fosfenitoin, pirimidon ya da St. John's Worth olarak da bilinen Hypericum perforatum)ile eşzamanlı uygulama İMATRA'ya maruz kalmayı belirgin şekilde azaltabilir ve bu durum tedavinin başarısız olma riskini arttırabilir. Tedavi öncesi verilen birdenfazla 600 mg rifampisin dozunun ardından tek bir 400 mg İMATRA dozunun uygulanması,Cmaks ve EAA(G-ro) değerlerinde, rifampisin tedavisinin olmadığı durumdaki ilgili değerlerinen az %54 ve %74'ü oranında düşüşe neden olmuştur. İMATRA ile tedavi edilen maligngliomalı hastalarda karbamazepin, okskarbazepin ve fenitoin gibi enzim indükleyiciantiepileptik ilaçlar (EIAED'ler) alırken benzer sonuçlar gözlenmiştir. İmatinib için plazmaEAA, EIAED kullanmayan hastalara kıyasla %73 azalmıştır. Rifampisin veya diğer güçlüCYP3A4 indükleyicileri ile imatinibin birlikte kullanımından kaçınılmalıdır.İmatinib ile plazma konsantrasyonu değişebilen ilaçlar: İmatinib, simvastatinin (CYP3A4 substratı) ortalama Cmaks ve EAA değerlerini sırasıyla 2 ve 3,5 kat arttırmaktadır ve bu durum CYP3A4'ün imatinib tarafından inhibe edildiğinigöstermektedir. Bu nedenle İMATRA, dar bir terapötik pencereye sahip CYP3A4substratlarıyla (örn. siklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin,fentanil, alfentanil, terfenadin, bortezomib, dosetaksel, kinidin) birlikte uygulandığında dikkatliolunmalıdır. İMATRA, CYP3A4 tarafından metabolize edilen diğer ilaçların da plazmakonsantrasyonunu arttırabilir (örn. triazolo-benzodiazepinler, dihidropiridin kalsiyum kanalblokörleri, bazı HMG-KoA redüktaz inhibitörleri, örn. statinler, vs.). İmatinib kullanımı ile birlikte bilinen artmış kanama riski nedeniyle (örn. hemoraji), anti-koagülasyon gerektiren hastalar varfarin gibi kumarin türevleri yerine düşük molekül ağırlıklı ya da standart heparin ile tedavi edilmelidir. In vitroortamda imatinib, CYP3A4 aktivitesini etkileyen konsantrasyonların benzeri konsantrasyonlarda sitokrom P450 izoenzimlerinden CYP2D6 aktivitesini de inhibeetmektedir. Günde iki kez 400 mg dozda uygulanan imatinibin CYP2D6-aracılı metoprololmetabolizması üzerinde zayıf bir inhibitör etkisi vardır; metoprolol Cmaks ve EAA değerleriyaklaşık %23 kadar artar (%90 GA [1.16-1.30]). İmatinib, CYP2D6 substratları ile bir aradauygulandığında doz ayarlamalarının gerekli olmadığı görülmektedir ancak metoprolol gibi darterapötik pencereye sahip CYP2D6 substratları ile dikkatli olunması tavsiye edilir. Metoprololile tedavi edilen hastalarda klinik izlem göz önünde bulundurulmalıdır.İmatinib in vitroin vivokoşullarda, 400 mg imatinib ve 1000 mg parasetamoluygulamasının ardından görülmemiştir. Daha yüksek imatinib ve parasetamol dozlarıçalışılmamıştır. Bu nedenle yüksek dozda İMATRA ve parasetamol eşzamanlı uygulanırkendikkatli olunmalıdır.Levotiroksin kullanan tiroidektomi hastalarında İMATRA eşzamanlı kullanıldığında levotiroksine plazma maruziyeti azalabilir (bkz. bölüm 4.4 Özel kullanım uyarıları veönlemleri). Bu nedenle dikkat önerilir. Bununla birlikte gözlenen etkileşimin mekanizmasıhalen bilinmemektedir. Tüm Ph+ ALL hastalarında kemoterapiyle eşzamanlı olarak imatinib uygulanmasıyla ilgili klinik deneyim vardır (bkz. Bölüm 5.1. Farmakodinamik özellikler), ancak imatinib vekemoterapi rejimleri arasındaki ilaç-ilaç etkileşimleri iyi tanımlanmamıştır. İmatinibin adversetkileri, örn. hepatotoksisite, miyelosupresyon ya da diğerleri artış gösterebilir veL-asparaginaz ile eşzamanlı kullanımın hepatatoksite artışıyla ilişkili olabileceği bildirilmiştir(bkz. Bölüm 4.8. İstenmeyen etkiler). Bu nedenle, İMATRA'nın kombinasyonda kullanımı özeldikkat gerektirmektedir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin klinik etkileşim çalışması yürütülmemiştir. Pediyatrik popülasyonPediyatrik popülasyona ilişkin klinik etkileşim çalışması yürütülmemiştir. 4.6. Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi: D Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon):Çocuk doğurma potansiyeli bulunan kadınlara tedavi sırasında ve tedavi durdurulduktan sonra en az 15 gün boyunca etkili bir kontrasepsiyon uygulamaları önerilmelidir. Gebelik dönemi:İmatinibin gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. İMATRA, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Hayvanlarüzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3.Klinik öncesi güvenlilik verileri). İmatinibin gebe kadınlarda kullanımına ilişkin klinikçalışmalar mevcut değildir. İMATRA alan kadınlarda spontan düşükler ve bebekte konjenitalanomalilerle ilgili pazarlama sonrası raporlar mevcuttur. İMATRA, beklenen fayda potansiyelriske ağır basmadığı sürece gebelik sırasında kullanılmamalıdır. Gebelik sırasında kullanılmasıdurumunda, hastaya fötüs üzerindeki potansiyel riskleri hakkında bilgi verilmelidir. Laktasyon dönemi:İmatinibin insan sütüne geçişi hakkında sınırlı bilgi vardır. Emziren iki kadında yapılan çalışmalar hem imatinibin hem de aktif metabolitinin anne sütüne geçebileceğini ortayakoymuştur. Tek bir hastada incelenen süt plazma oranı, imatinib için 0,5 ve metabolit için 0,9olarak belirlenerek metabolitin süte daha fazla geçtiğini düşündürmüştür. İmatinib vemetabolitinin toplam konsantrasyonu ve bebeklerin maksimum günlük süt alımıdüşünüldüğünde, toplam maruziyetin düşük olması beklenir (bir terapötik dozun ~%10'u).Bununla birlikte, bebeğin imatinibe düşük dozlarda maruz kalmasının etkileri bilinmediğinden,anneler İMATRA tedavisi sırasında ve tedavi durdurulduktan sonra en az 15 gün boyuncabebeklerini emzirmemelidir. Üreme yeteneği / Fertilite:Yapılan klinik dışı çalışmalarda, üreme parametreleri üzerinde etkiler gözlenmiş olsa da dişi ve erkek farelerin fertiliteleri etkilenmemiştir. (bkz. Bölüm 5.3) İMATRA alan hastalarda ilacınfertilite ve gametogenez üzerindeki etkileri ile ilgili çalışmalar yapılmamıştır. İMATRAtedavisi gören ve fertilite konusunda endişe duyan hastalar hekimlerine danışmalıdır. 4.7. Araç ve makine kullanımı üzerindeki etkileriHastalara imatinib ile tedavi sırasında baş dönmesi, somnolans ya da bulanık görme gibi istenmeyen etkiler yaşayabilecekleri bildirilmelidir. Bu nedenle, araba ya da araç kullanırkendikkatli olunması önerilmelidir. 4.8. İstenmeyen etkilerİleri aşamalarda maligniteleri olan hastalarda, altta yatan hastalık, progresyon ve sayısız tıbbi ürünün eşzamanlı uygulanması ile bağlantılı çeşitli semptomlar nedeniyle advers reaksiyonlarınnedensellik ilişkisinin değerlendirilmesini zorlaştıran sayısız karmaşıklaştırıcı tıbbi durummevcut olabilir. KML klinik çalışmalarında ilaçla ilişkili advers reaksiyonlar nedeniyle ilacın kesilmesi durumu, yeni tanı konan hastaların %2,4'ünde, interferon tedavisinin başarısız olmasından sonra geçkronik fazdaki hastaların %4'ünde, interferon tedavisinin başarısız olmasından sonra hızlanmışfazdaki hastaların %4'ünde ve interferon tedavisinin başarısız olmasından sonra blastkrizindeki hastaların %5'inde gözlenmiştir. GIST çalışmasında ilaç, hastaların %4'üne ilaçlailişkili advers reaksiyonlar nedeniyle kesilmiştir. İki istisna haricinde advers reaksiyonlar tüm endikasyonlarda benzer olmuştur. GIST ile karşılaştırıldığında KML hastalarında daha fazla miyelosüpresyon görülmüştür, bu durumolasılıkla altta yatan hastalık ile ilişkilidir. Rezekte edilemeyen ve/veya metastatik GIST'lihastalarda yürütülen bir çalışmada 7 (%5) hasta CTC derece 3/4 GI kanamalar (3 hasta), tümöriçi kanamalar (3 hasta) ya da ikisini birden (1 hasta) yaşamıştır. GI tümör bölgeleri GIkanamaların kaynağı olmuş olabilir (bkz. bölüm 4.4). GI ve tümör kanamaları ciddi ve bazenölümcül olabilmektedir. Her iki endikasyonda en sık bildirilen (>%10) ilaçla ilişkili adversreaksiyonlar hafif bulantı, kusma, ishal, abdominal ağrı, yorgunluk, kas ağrısı, kas krampları vedöküntü olmuştur. Yüzeysel ödemler tüm çalışmalarda yaygın bir bulgu olmuş ve temeldeperiorbital ya da alt uzuv ödemleri şeklinde tarif edilmiştir. Bununla birlikte, bu ödemlernadiren şiddetli olmuş ve diüretiklerle, diğer destekleyici önlemlerle veya İMATRA dozuazaltılarak kontrol edilebilmiştir. İmatinib Ph+ ALL hastalarında yüksek doz kemoterapi ile kombine edildiğine transaminaz yükselmesi ve hiperbilirubinemi formunda geçici karaciğer toksisitesi gözlenmiştir. Sınırlıgüvenlilik veritabanı göz önünde bulundurulduğunda, çocuklarda şu ana kadar bildirilen adversolaylar, erişkin Ph+ ALL hastalarında bilinen güvenlilik profili ile uyumludur. Ph+ ALL hastasıçocuklardaki güvenlilik veritabanı çok sınırlı olmakla birlikte herhangi bir yeni güvenlilikendişesi tanımlanmamıştır. Plevral efüzyon, assit, pulmoner ödem ve yüzeysel ödemin eşlik ettiği ya da etmediği hızlı kilo artışı gibi çeşitli advers reaksiyonlar kolektif olarak sıvı tutulumu şeklinde tarif edilebilir. Bureaksiyonlar genellikle imatinib tedavi geçici olarak durdurularak ve diüretiklerle ya da diğeruygun destekleyici bakım önlemleriyle kontrol edilebilmektedir. Diğer yandan, bureaksiyonların bazıları şiddetli ya da yaşamı tehdit edici olabilmektedir ve blast krizi olan çeşitlihastalar plevral efüzyon, konjestif kalp yetmezliği ve böbrek yetmezliğinden oluşan kompleksbir klinik öykü ile yaşamlarını kaybetmiştir. Pediatrik klinik çalışmalarda özel bir güvenlilikbulgusu söz konusu olmamıştır. İstenmeyen etkiler MedDRA sistem organ sınıfına göre listelidir. Sıklıklar şu şekilde tanımlanmıştır: Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila< 1/100); seyrek (> 1/10.000, ila < 1/1.000); çok seyrek (< 1/10.000), bilinmiyor (eldekiverilerden hareketle tahmin edilemiyor). Aşağıda bildirilen advers reaksiyonlar ve sıklıkları,KML ve GIST için yürütülen çalışmalara dayanmaktadır. Enfeksiyonlar ve enfestasyonlarYaygın olmayan: Herpes zoster, herpes simplex, nazofarenjit, pnömoni1, sinüzit, selülit, üst solunum yolu enfeksiyonu, influenza, idrar yolu enfeksiyonu, gastroenteritis, sepsis. Seyrek: Fungal enfeksiyon Bilinmiyor: Hepatit B reaktivasyonu* (Kist ve polipler de dahil olmak üzere) iyi huylu ve kötü huylu neoplazmalarSeyrek: Tümör lizis sendromu Bilinmiyor: Tümör kanaması/tümör nekrozu* Kan ve lenf sistemi hastalıklarıÇok yaygın: Nötropeni, trombositopeni, anemi. Yaygın: Pansitopeni, febril nötropeni. Yaygın olmayan: Trombositemi, lenfopeni, kemik iliği depresyonu, eozinofili, lenfadenopati. Seyrek: Hemolitik anemi, trombotik mikroanjiyopati Bağışıklık sistemi hastalıkları:Bilinmiyor: Anafilaktik şok* Metabolizma ve beslenme hastalıklarıYaygın: Anoreksi.Yaygın olmayan: Hipokalemi, iştah artışı, hipofosfatemi, iştah azalması, dehidrasyon, gut, hiperürisemi, hiperkalsemi, hiperglisemi, hiponatremiSeyrek: Hiperkalemi, hipomagnezemi. Psikiyatrik hastalıklarYaygın: Uykusuzluk.Yaygın olmayan: Depresyon, libido azalması, anksiyete. Seyrek: Konfüzyon. Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısı2.Yaygın: Baş dönmesi-sersemlik, parestezi, tat duyusu bozuklukları, hipoestezi. Yaygın olmayan: Migren, somnolans, senkop, periferik nöropati, bellek bozukluğu, siyatik, huzursuz ayak sendromu, tremor, beyin kanaması. Seyrek: Kafa-içi basıncının artması, konvülziyon, optik nörit. Bilinmiyor: Serebral ödem* Göz hastalıklarıYaygın: Göz kapağı ödemi, lakrimasyon artışı, konjunktiva kanaması, konjunktivit, göz kuruması, bulanık görme.Yaygın olmayan: Göz tahrişi, göz ağrısı, orbita ödemi, sklera kanaması, retina kanaması, blefarit, maküla ödemi. Seyrek: Katarakt, glokom, papilödem. Bilinmiyor: Vitröz kanama* Kulak ve iç kulak hastalıklarıYaygın olmayan: Vertigo, kulak çınlaması, işitme kaybı. Kardiyak hastalıklarYaygın olmayan: Palpitasyonlar, taşikardi, konjestif kalp yetmezliği3, pulmoner ödem.Seyrek: Aritmi, atriyal fibrilasyon, kardiyak arest, miyokart enfarktüsü, angina pektoris, perikardiyal efüzyon. Bilinmiyor: Perikardit*, kalp tamponadı* Vasküler hastalıklar4Yaygın: Al basması, kanama. Yaygın olmayan: Hipertansiyon, hematom, subdural hematom, periferik soğukluk, hipotansiyon, Raynaud fenomeni. Bilinmiyor: Tromboz/emboli* Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Dispne, burun kanaması, öksürük. Yaygın olmayan: Plevral efüzyon5, faringolaringeal ağrı, farenjit. Seyrek: Plevra ağrısı, pulmoner fibroz, pulmoner hipertansiyon, pulmoner kanama.
11* Bilinmiyor: Akut respiratuvar yetmezlik , interstisyal akciğer hastalığı* Gastrointestinal hastalıklarÇok yaygın: Bulantı, ishal, kusma, dispepsi, karın ağrısı6. Yaygın: Aşırı miktarda bağırsak gazları, karında gerilme, gastro-özofageal reflü, kabızlık, ağız kuruması, gastrit. Yaygın olmayan: Stomatit, ağız ülserasyonu, gastrointestinal kanama7, geğirme, melena, özofajit, asit, gastrik ülseri, kan kusma, dudak iltihabı, disfaji, pankreatit. Seyrek: Kolit, ileus, enflamatuar barsak hastalığı. Bilinmiyor: İleus/intestinal obstrüksiyon*, gastrointestinal perforasyon*, divertikülit*, gastrik antral vasküler ektazi (GAVE)* Hepato-bilier hastalıklarYaygın: Karaciğer enzimlerinde artış. Yaygın olmayan: Hiperbilirübinemi, hepatit, sarılık. Seyrek: Karaciğer yetmezliği8, hepatik nekroz. Deri ve deri altı doku hastalıklarıÇok yaygın: Periorbital ödem, dermatit/egzama/deri döküntüsü. Yaygın: Kaşıntı, yüz ödemi, deride kuruma, eritem, alopesi, gece terlemeleri, ışığa duyarlılık reaksiyonu. Yaygın olmayan: Püstüler döküntü, kontüzyon, terlemede artış, ürtiker, ekimoz, çürük eğiliminde artış, hipotrikoz, deride hipopigmentasyon, eksfoliyatif dermatit, tırnak kırılması,folikülit, peteşiler, psoriazis, purpura, deride hiperpigmentasyon, büllöz erupsiyonlar. Seyrek: Akut febril nötrofilik dermatoz (Sweet's hastalığı), tırnakta renk kaybı, anjiyonörotik ödem, veziküler döküntü, eritem multiform, lökositoklastik vaskülit, Stevens-Johnsonsendromu, akut jeneralize ekzantematöz püstülozis (AGEP). Bilinmiyor: Palmar-plantar eritrodisestezi sendromu (el-ayak sendromu)*, likenoid keratoz*, liken planuz*, toksik epidermal nekroliz*, eozinofili ve sistemik semptomlarla ilaç döküntüsü(DRESS sendromu)*, psödoporfiri* Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıÇok yaygın: Kas spazmları ve krampları, miyalji 9, artralji, kemik ağrısı10 da dahil olmak üzere kas-iskelet ağrıları. Yaygın: Eklemlerde şişme. Yaygın olmayan: Kaslarda ve eklemlerde sertlik. Seyrek: Kas zayıflığı, artrit, rabdomiyoliz/miyopati Bilinmiyor: Avasküler nekroz/kalça osteonekrozu*, çocuklarda büyüme geriliği* Böbrek ve idrar yolu hastalıklarıYaygın olmayan: Böbrek ağrısı, hematüri, akut böbrek yetmezliği, idrar sıklığında artış. Bilinmiyor: Kronik böbrek yetmezliği Üreme sistemi ve meme hastalıklarıYaygın olmayan: Jinekomasti, erektil disfonksiyon, menoraji, düzensiz menstrüasyon, cinsel disfonksiyon, meme başında ağrı, memelerde büyüme, skrotum ödemi. Çok seyrek: Hemorajik korpus luteum, hemorajik over kisti Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: Sıvı retansiyonu ve ödem, yorgunluk. Yaygın: Güçsüzlük, pireksi, anazarka, titreme nöbetleri, kaslarda sertlikler. Yaygın olmayan: Göğüs ağrısı, keyifsizlik. Laboratuvar bulgularıÇok yaygın: Vücut ağırlığı artışı. Yaygın: Vücut ağırlığı azalması. Yaygın olmayan: Kanda kreatinin düzeyinin yükselmesi, kandaki kreatin fosfokinaz düzeyinin yükselmesi, kandaki laktat dehidrojenaz düzeyinin yükselmesi, kanda alkalin fosfatazdüzeyinin yükselmesi. Seyrek: Kanda amilaz düzeyinin yükselmesi. * Bu tür reaksiyonlar, esas olarak imatinib ile edinilen pazarlama sonrası deneyimlerden rapor edilmiştir. Bu veriler, spontan vaka raporlarının yanı sıra devam eden çalışmalardan alınan ciddi advers olayları, genişletilmişerişim programlarını, klinik farmakoloji çalışmalarını ve onaylanmamış endikasyonlarda keşif çalışmalarınıiçermektedir. Bu reaksiyonlar belirsiz büyüklükteki bir popülasyondan bildirildiğinden, sıklıklarını güvenilir birşekilde tahmin etmek veya imatinib maruziyetiyle nedensel bir ilişki kurmak her zaman mümkün değildir. 1 Transforme KML hastalarında ve GIST hastalarında en sık pnömoni bildirilmiştir. 2 GIST hastalarında en sık baş ağrısı görülmüştür. 3 Bir hasta yılı esasında, konjestif kalp yetmezliği de dahil olmak üzere kardiyak olaylar transforme KML hastalarında kronik KML hastalarından daha sık gözlemlenmiştir. 4 GIST hastalarında en sık kızarma görülmüştür; GIST ve transforme KML (KML-AF ve KML-BK) hastalarında en sık görülen ise kanamadır (hematom, hemoraji). 5 Plevral efüzyon GIST hastalarında ve transforme KML (KML- AF ve KML- BK) hastalarında kronik KML hastalarından daha yaygın olarak bildirilmiştir. 6/7 Abdominal ağrı ve gastrointestinal kanama en sık GIST hastalarında görülmüştür. 8 Bazı ölümcül hepatik yetmezlik ve hepatik nekroz vakaları bildirilmiştir. 9 Pazarlama sonrasında, imatinib ile tedavi sırasında veya bırakılmasından sonra müsküloskeletal ağrı gözlenmiştir. 10 KML hastalarında kas iskelet ağrısı ve ilişkili olaylar GIST hastalarından çok daha sık gözlemlenmiştir. 11 İleri evrede hastalığı, ağır enfeksiyonları, şiddetli nötropenisi ve diğer ciddi eşlik eden rahatsızlıkları olan hastalarda fatal vakalar bildirilmiştir. Laboratuvar testi anormallikleri HematolojiKML'de başta nötropeni ve trombositopeni olmak üzere sitopeniler tüm çalışmaların devamlı bir bulgusu olmuş, >750 mg gibi daha yüksek dozlarda daha sık oldukları düşünülmüştür(faz I çalışma). Bununla birlikte, sitopenilerin ortaya çıkışı, aynı zamanda açıkça hastalığınevresine de bağlı olmuştur. Sitopeniler, yeni tanı konulan KML vakalarında, diğer vakalarakıyasla daha seyrektir. Evre 3 veya 4 nötropenilerin (ANC <1,0 x 109/L) ve trombositopenilerin(trombosit sayısı <50 x 109/L) blast krizindeki ve hızlanmış fazdaki sıklığı, yeni tanı konulankronik faz KML vakaları ndakinin 4-6 katıdır. Yeni tanı kronik faz KML vakalarında %16,7nötropeni ve %8,9 trombositopeni görülürken, bu oranlar hızlanmış ve blastik fazda sırasıyla,%59-64 ve %44-63 olarak bildirilmiştir. Yeni tanı konulmuş olan kronik faz KML vakalarındaevre 4 nötropeni (ANC <0,5 x 109/L) ve trombositopeni (trombosit sayısı <10 x 109/L), sırasıylayalnızca %3,6 ve <%1 oranında görülmüştür. Nötropenik ve trombositopenik periyotlarınortalama süresi genellikle sırasıyla 2 ve 3. haftalar arasında ve 3 ve 4. haftalar arasında yeralmıştır. Bu olaylar, genellikle İMATRA ile tedavinin dozu azaltılarak ya da tedavi kesilerekkontrol edilebilir, ancak bazı nadir vakalarda kalıcı olarak tedavinin bırakılmasına nedenolabilir. Pediyatrik KML hastalarında en sık gözlenen toksisiteler; nötropeni, trombositopenive anemi dahil olmak üzere 3 ya da 4. derece sitopeniler olmuştur. Bunlar genellikle ilk birkaçay içerisinde gerçekleşmektedir. Rezeke edilemeyen ya da metastatik malign GIST (çalışma B2222) bulunan hastalarda, sırasıyla hastaların % 5.4 ve % 0.7'sinde evre 3 ve 4 anemi bildirilmiştir ve bu durum en azındanbazı hastalarda gastrointestinal ya da intra-tümöral kanamayla ilişkili olabilir. Sırasıylahastaların % 7.5 ve %2.7'sinde evre 3 ve 4 nötropeni ve hastaların % 0.7'sinde evre 3trombositopeni görülmüştür. Hiçbir hastada evre 4 trombositopeni gelişmemiştir. Özellikletedavinin ilk 6 haftasında beyaz kan hücresi ve nötrofil sayılarında azalmalar ortaya çıkmış, budeğerler daha sonra nispeten sabit kalmıştır. BiyokimyaKML hastalarında transaminazlarda (< % 5) ya da bilirubinde (< %1) ciddi artışlar olmuştur ve genellikle doz azaltılarak ya da kesilerek (bu epizodların ortalama süresi yaklaşık 1 haftaolmuştur) kontrol altına alınmıştır. KML hastaların % 1'inden azında karaciğer laboratuaranormallikleri nedeniyle tedavi sürekli olarak kesilmiştir. GIST hastalarının (çalışma B2222)%6.8'inde 3. veya 4. evre SGPT (serum glutamik piruvik transferaz); %4.8'inde 3. veya 4. evreSGOT (serum glutamik oksaloasetik transferaz) yükselmeleri kaydedilmiş; bilirübin düzeyiyükselen hastaların oranı %3'ün altında kalmıştır. Nadir sitolitik ve kolestatik hepatit ve karaciğer yetmezliği olguları söz konusu olmuştur; yüksek doz parasetamol kullanan bir hasta dahil olmak üzere bunların bazıları ölümlesonuçlanmıştır. Seçili advers reaksiyonların tanımlanmasıHepatit B reaktivasyonuBCR-ABL TKI'lerle ilişkili olarak hepatit B reaktivasyonu bildirilmiştir. Bazı vakalarda, karaciğer nakliyle veya ölümle sonuçlanan akut karaciğer yetmezliği veya fulminan hepatitortaya çıkmıştır (bkz. Bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr4.9. Doz aşımı ve tedavisiTerapötik dozlardan daha yüksek dozlarla deneyim sınırlıdır. İmatinib doz aşımı ile ilgili bireysel vakalar spontan olarak ve literatürde bildirilmiştir. Genellikle, bu vakalarda bildirilensonuçlar düzelme ya da iyileşme şeklinde olmuştur. Doz aşımı halinde, hasta gözlem altındatutulmalı ve uygun semptomatik tedavi uygulanmalıdır. Farklı doz aralıklarında bildirilen olaylar aşağıda verilmiştir: Erişkinlerde doz aşımı: 1200 ila 1600 mg (1 ila 10 gün arasında değişen sürelerle): Bulantı, kusma, diyare, döküntü, eritem, ödem, şişme, yorgunluk, kas spazmları, trombositopeni, pansitopeni, karın ağrısı, başağrısı, iştahta azalma. 1800 ila 3200 mg (6 gün boyunca günde 3.200 mg'a kadar dozlar): Güçsüzlük, miyalji, CPK düzeyinde yükselme, bilirubin düzeyinde yükselme, gastrointestinal ağrı. 6400 mg (tek doz): Literatürde yer alan bir vakada, bulantı, kusma, karın ağrısı, pireksi, yüzde şişme, nötrofil sayısında azalma, transaminaz düzeylerinde yükselme görülen bir hastabildirilmiştir. 8 ila 10 g (tek doz): Kusma ve gastrointestinal ağrı bildirilmiştir. Pediyatrik doz aşımı: 400 mg'lık tek doza maruz kalan 3 yaşındaki bir erkek çocukta kusma, diyare ve anoreksi; 980 mg'lık tek doza maruz kalan 3 yaşındaki diğer bir erkek çocukta ise lökosit sayısında azalmave diyare görülmüştür. Doz aşımı durumunda hasta gözlemlenmeli ve uygun destek tedavisi verilmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ajan, protein-tirozin kinaz inhibitörü, BCR-ABL tirozin kinaz inhibitörleriATC kodu:L01EA01 Etki mekanizması: İmatinib küçük bir molekül yapısına sahip bir protein-tirozin kinaz inhibitörüdür; Bcr-Abl tirozin kinaz (TK) aktivitesini ve birçok reseptör TK'yı kuvvetli bir şekilde inhibe etmektedir:KIT, c-KIT proto-onkogen tarafından kodlanan kök hücre faktörü (Stem cell factor - SCF)reseptörü, diskoidin etki bölgesine ait reseptörler (DDR1 ve DDR2), koloni uyarıcı faktörreseptörü (CSF-1R), trombosit kökenli büyüme faktörü (Platelet derived growth factor - PDGF)reseptörleri alfa ve beta (PDGFR-alfa ve PDGFR-beta). İmatinib aynı zamanda bu reseptörkinazların aktivasyonunun aracılık ettiği hücresel olayları da inhibe edebilmektedir. Farmakodinamik etkiler: İmatinib, in vitre,i^ vivodüzeylerde kırılma noktalarının yoğunlaştığı bölge-Abelson (Bcr-Abl) tirozin kinazı güçlü bir şekilde inhibe eden bir protein-tirozin kinaz inhibitörüdür. Bileşik, Bcr-Abl pozitif hücre dizilerinde, Philadelphia kromozom pozitif KMLve ALL hastalarının yeni lösemi hücrelerinde selektif olarak proliferasyonu inhibe etmekte veapopitozisi uyarmaktadır.Bileşik, in vivoolarak, Bcr-Abl pozitif tümör hücreleri kullanılan hayvan modellerinde tek ajan olarak anti-tümör aktivite gösterir.İmatinib, aynı zamanda trombosit türevi büyüme faktörü (Platelet derived growth factor -PDGF) ve kök hücre faktörü (Stem cell factor - SCF), c-KIT için reseptör tirozin kinazların bir inhibitörüdür ve PDGF- ve SCF- tarafından yönlendirilen hücresel olayları inhibe eder. In vitroolarak, imatinib, aktive edici bir KIT mutasyonunu ekspres eden GIST hücrelerindeproliferasyonu inhibe eder ve apopitozu uyarır. PDGF reseptörünün veya Abl protein tirozinkinazların çeşitli ortak proteinlere füzyonunun veya yapısal PDGF üretiminin bir sonucu olanyapısal aktivasyonun, MDS/MPD, HES ve DFSP'nin patojenezinde rol oynadığı önesürülmüştür. Ayrıca, c-KIT ya da PDGFR'nin konstitütif aktivasyonu SM'nin patojenezinderol oynayan muhtemel nedendir. İmatinib, düzensizleşen PDGFR veya ABL kinaz aktivitesininneden olduğu sinyalizasyonu ve hücre proliferasyonunu inhibe eder.Kronik Miyeloid Lösemide Klinik Çalışmalarİmatinibin etkinliği, bir bütün olarak elde edilen hematolojik ve sitogenetik yanıt oranlarını ve hastalıksız sağkalım süresini temel alır. Yeni tanı almış KML harici, hastalık ilişkilisemptomların iyileşmesi veya sağkalım süresinin artması gibi klinik faydaların olduğunugösteren kontrollü çalışma yoktur. İleri evre, blast veya hızlandırılmış faz hastalıkta Philadelphia kromozomu pozitif (Ph +) KML, diğer Ph + lösemiler veya kronik fazda KML'si olan fakat daha önce interferon-alfa (IFN)tedavide başarısız olunan hastalarda üç büyük, uluslararası, açık etiketli, kontrollü olmayan FazII çalışma yapılmıştır. Yeni tanı almış Ph + KML hastalarında büyük, açık etiketli, çokmerkezli, uluslararası, randomize bir Faz III çalışma yürütülmüştür. Ek olarak, iki Faz Içalışmada ve bir Faz II çalışmada çocuklar tedavi edilmiştir. Bütün klinik çalışmalarda hastaların %38-40'ının en az 60, %10-12'sinin en az 70 yaşında olduğu bildirilmiştir. Kronik faz, yeni tanı konulmuş:Bu faz III çalışmasında, imatinib monoterapisi, interferon-alfa (IFN) + sitarabin (ARA-C) kombinasyonuyla karşılaştırılmıştır. Yanıtsızlık (6 ayda tamhematolojik yanıt (CHR) olmaması, artan WBC, 24 ayda majör sitogenetik yanıt (MCyR)olmaması), yanıt kaybı (CHR veya MCyR kaybı) veya tedaviye şiddetli intolerans gösterenhastaların alternatif tedavi koluna geçmelerine izin verilmiştir. İmatinib grubundaki hastalardagünde 400 miligramlık doz kullanılmıştır. IFN grubunda, hastalar 10 gün / ay boyunca subkutanAra-C 20 mg / m2 / gün ile kombinasyon halinde subkutan olarak 5 MIU / m2 / gün hedef IFNdozu ile tedavi edilmiştir.Toplam 1106 (her grupta 553) hasta, randomize edilmiştir. İki kol arasında çalışma başlangıcı özellikleri iyi düzeyde dengelenmiştir. Medyan yaş 51 yıl (aralık 18-70 yıl) olup, hastaların %21,9'u 60 yaşında veya üzerindedir. % 59'u erkek ve % 41'i kadın; % 89,9'u beyaz ve % 4,7'sisiyah hastalardan oluşmuştur. Son hastanın çalışmaya alınmasından yedi yıl sonra, İmatinib veIFN kollarında medyan birinci basamak tedavi süresi sırasıyla 82 ve 8 ay olmuştur. İmatinib ileikinci basamak tedavinin medyan süresi 64 aydır. Genel olarak, birinci basamak olarak imatinibalan hastalarda verilen ortalama günlük doz 406±76 mg'dır. Çalışmanın primer etkililiksonlanım noktası progresyonsuz sağkalımdır. Progresyon, aşağıdaki olaylardan herhangi biriolarak tanımlanmıştır: hızlanmış faz veya blast krizine progresyon, ölüm, CHR veya MCyRkaybı ya da uygun terapötik tedaviye rağmen bir CHR'ye ulaşamayan hastalarda WBC artışı.Ana sitogenetik yanıt, hematolojik yanıt, moleküler yanıt (minimal rezidüel hastalığındeğerlendirilmesi), hızlandırılmış faza kadar geçen süre veya blast krizi ve hayatta kalma, anasekonder sonlanım noktalardır. Yanıt verileri Tablo 2'de gösterilmektedir.
Birinci basamak tedavide tam hematolojik yanıt, majör sitogenetik yanıt ve tam sitogenetik yanıt oranları, son muayene tarihinde yanıtsızlıkların sansürlendiği Kaplan-Meier yaklaşımıkullanılarak hesaplanmıştır. Bu yaklaşım kullanıldığında, İmatinib ile birinci basamak tedaviiçin hesaplanan kümülatif yanıt oranları 12 aylık tedaviden 84 aylık tedaviye şu şekilde düzelmegöstermiştir: THY %96,4'ten %98,4'e ve TSY %69,5'ten %87,2'ye. 7 yıllık takipte, İmatinib grubunda 93 (%16,8) olay olmuştur: 37 (%6,7) hızlanmış faz/blastik kriz (AF/BK) ilerleme, 31 (%5,6) major sitogenetik yanıt (MSY) kaybı, 15 (%2,7) tamhematolojik yanıt (THY) kaybı ya da white blood cell (beyaz kan hücresi) (WBC) artışı ve 10(%1,8) KML ile ilişkisiz ölüm. Buna karşılık IFN+Ara-C grubunda 165 (%29,8) olay olmuş vebunların 130'u birinci seçenek IFN+Ara-C tedavisi sırasında meydana gelmiştir. Tedavide geçen süre ile birlikte hızlandırılmış faza veya blast krizine yıllık progresyon oranı azalmış ve dördüncü ve beşinci yıllarda yıllık % 1'den az olmuştur. 84 ayda progresyonsuzsağkalım tahmini oranı İmatinib grubunda % 81,2 ve kontrol grubunda % 60,6 bulunmuştur (p<0,001). İmatinib için herhangi bir türdeki yıllık progresyon oranları da zamanla azalmıştır. İmatinib ve IFN+Ara-C gruplarında, sırasıyla, toplam 71 (%12,8) ve 85 (%15,4) hasta ölmüştür. 84 ayda randomize İmatinib ve IFN+Ara-C gruplarında tahmin edilen genel sağkalım, sırasıyla%86,4 (83, 90) ve %83,3 (80, 87) düzeyindedir (p=0,073, log-rank testi). Bu olaya kadar geçenzaman sonlanım noktası, IFN + Ara-C'den İmatinibe yüksek geçiş oranından büyük ölçüdeetkilenir. İmatinib tedavisinin kronik fazdaki, yeni tanı konulmuş KML'deki sağkalım etkisi, aynı rejimde IFN+Ara-C (n=325) kullanılan başka bir Faz III çalışmadan elde edilen birincilverilerle birlikte yukarıda belirtilen İmatinib verilerinin retrospektif analizinde ayrıntılı olarakincelenmiştir. Bu yayında, genel sağkalım bakımından İmatinibin IFN+Ara-C karşısındakiüstünlüğü kanıtlanmıştır (p<0,001); 42 ay içinde 47 (%8,5) İmatinib hastası ve 63 (%19,4)IFN+Ara-C hastası ölmüştür. İmatinib tedavisindeki hastalarda sitogenetik yanıt ve moleküler yanıt derecesi, uzun dönem sonuçlar üzerinde açık bir etkiye sahip olmuştur. 12 ayda TSY' si (KSY) olan hastaların tahmini%96'sında (%93) akselere faza/blast krizine progresyon olmazken 12 ayda MSY'si olmayanhastaların sadece %81'inde 84 ayda ilerlemiş KML'ye progresyon olmadığı görülmüştür (genelp<0,001, TSY ile KSY arasında p=0,25). 12 ayda Bcr-Abl transkriptlerinde en az 3 logaritmalıkazalması olan hastalarda akselere faza/blast krizine progresyonsuz kalma olasılığı 84 ayda %99bulunmuştur. 18 aylık dönüm noktası analizine dayanılarak benzer bulgular tespit edilmiştir. Bu çalışmada günde 400 mg'dan 600 mg'a, ardından günde 600 mg'dan 800 mg'a doz artırımlarına izin verilmiştir. 42 aylık izlem sonrasında 11 hasta sitogenetik yanıtlarındadoğrulanmış bir kayıp (4 hafta içinde) deneyimlemiştir. Bu 11 hastanın 4'ünde doz günde 800mg'a artırılmış olup hastaların 2'si sitogenetik yanıtı tekrar elde etmiş (1'inde kısmi, 1'indetam; tam yanıt elde eden ayrıca moleküler yanıta da ulaşmıştır), diğer yandan dozlarıartırılmayan 7 hastanın sadece biri tam sitogenetik yanıtı tekrar elde etmiştir. Doz artırımıöncesindeki hasta popülasyonu (n=551) ile karşılaştırıldığında, dozun günde 800 mg'ayükseltildiği 40 hastada bazı advers reaksiyonların yüzdesi daha yüksek olmuştur. Daha sıkgörülen advers reaksiyonlar gastrointestinal hemorajileri, konjonktivit ve transaminazlar veyabilirubinde yükselmeyi içermiştir. Diğer advers olaylar daha düşük ya da eşit sıklıklabildirilmiştir. Kronik faz, interferon tedavisi^^^ başarısız kaldığı hastalar:532 hasta, 400 miligramlık başlangıç dozuyla tedavi edilmiştir. Bu hastalar; hematolojik başarısızlık (%29), sitogenetikbaşarısızlık (%35) veya interferon intoleransı (%36) olmak üzere başlıca 3 gruba ayrılmıştır. 6 Hastalar daha önce medyan 14 ay boyunca >25 x 10 lU/hafta dozlarda IFN tedavisi görmüştür ve hepsi de geç kronik fazdadır; tanıdan itibaren geçen medyan süre 32 aydır. Çalışmanınbirincil etkililik değişkeni majör sitogenetik yanıt oranıdır (tam yanıt artı kısmı yanıt, kemikiliğinde %0 ila %35 Ph+ metafaz). Bu çalışmada hastaların %65'i bir majör sitogenetik yanıta ulaşmıştır; hastaların %53'ünde (doğrulanmış %43) yanıt tamdır (Tablo 3). Hastaların %95'inde tam hematolojik yanıtaulaşılmıştır. Hızlanmış faz:Bu fazdaki 235 KML vakasanın ilk 77'sinde tedaviye günde 400 mg ile başlanmıştır; daha sonra çalışma protokolü, daha yüksek İmatinib dozlarının kullanılmasınaolanak tanıyacak şekilde tadil edilmiştir ve geriye kalan 158 hasta, başlangıçta 600 mg İmatinibkullanmıştır.Tam hematolojik yanıt, hiçbir lösemi kanıtının mevcut olmaması (kemik iliğindeki ve kandaki blast hücrelerinin kaybolması, ancak periferik kan tablosunda, tam yanıt için gerekendüzelmenin gerçekleşmemesi) veya kronik faz kronik miyeloid lösemiye dönüş olaraktanımlanan tam hematolojik yanıt ede edilme oranı, bu çalışmanın etkililik konusundakideğerlendirilen primer parametresi olmuştur. Doğrulanmış hematolojik yanıt, hastaların %71,5'inde elde edilmiştir. Bu hastalardan % 27,7'sinde ayrıca majör sitogenetik yanıt ( %20,4'ünde tam sitogenetik yanıt) alınmış olması önemlidir. 600 mg İmatinib kullanan hastalardabugünkü saptamalara göre tahmini ortanca medyan hastalıksız sağkalım ve genel sağkalımoranları, sırasıyla 22,9 ay ve 42,5 ay olarak hesaplanmıştır. Miyeloid blast krizi:Bu çalışma, blast krizi gelişmiş olan 260 hasta üzerinde yapılmıştır. Bu hastaların 95'i (%37'si), hızlanmış faz veya yine blast krizi nedeniyle daha önce de kemoterapigörmüştür (önceden tedavi edilmiş olan hastalar), 165 (%63) hastada ise daha öncekemoterapi uygulanmamıştır (önceden tedavi edilmemiş olan hastalar). Başlangıç dozu, ilk37 hastada 400 miligramdı; daha sonra yapılan protokol tadilatı, daha yüksek dozlarınkullanılmasına olanak verdiğinden, diğer 223 hasta, başlangıçta 600 mg İmatinib kullanmıştır.Primer etkililik parametresi, hızlanmış faz çalışmasında olduğu gibi yine tam hematolojik yanıt, lösemi kanıtının mevcut olmaması veya kronik faza dönüş olarak tanımlanan, hematolojik yanıtoranı olmuştur. Hastaların %31'inde hematolojik yanıt elde edilmiştir (daha önce tedavigörmemiş hastalarda %36, daha önce tedavi görmüş hastalarda %22). 600 mg İmatinib kullananhastalardaki hematolojik yanıt oranı, 400 mg İmatinib kullanmış olanlara kıyasla daha yüksektir(%16'ya karşılık %33, p=0,0220). Daha önceden tedavi edilmemiş ve tedavi edilmiş hastalarınmevcut tahmini ortalama sağkalımı sırasıyla 7,7 ve 4,7 aydır. Lenfoid blast krizi:Faz I çalışmalara sınırlı sayıda hasta kaydedilmiştir (n=10). Hematolojik yanıt oranı, 2-3 aylık süre ile %70 bulunmuştur.Tablo 3 KML vakalarında elde edilen yanıtlarÇalışma 0109 40.5 aylık veriHızlanmış faz Çalışma 0102 38 aylık veriMiyeloid blast krizi
THY : çalışma 0110 [kandaki WBC <10 x 109/lt, trombosit sayısı <450 x 109/lt, miyelosit + metamiyelosit <5%; kanda blast veya promiyelosit yok; bazofiller <%20, kemik iliği dışında hastalık yok] ve çalışma 0102 ve 0109 [ANC >1,5 x 109/lt, trombosit sayısı >100 x 109/lt, kanda blast hücresi yok, BM blasthücresi oranı <%5 ve BM dışında hastalık yok]. NEL : THY ile aynı kriterler; yalnızca ANC >1 x 109/lt ve trombosit sayısı >20 x 109/lt (çalışma 0102 ve 0109'da). RTC : BM ve PB blast hücresi oranı <%15; PM ve PB blast hücresi + promiyelosit oranı <%30, PB bazofil oranı <%20, dalak ve karaciğer hariç BM dışında hastalık yok (çalışma 0102 ve 0109'da). 2 Sitogenetik yanıt kriterleri:Majör yanıt= tam (%0 Ph+ metafaz) + kısmi (%1-35) yanıt 3İlk kemik iliği çalışmasından en az bir ay sonra gerçekleştirilen ikinci kemik iliği sitogenetik değerlendirmesiyle doğrulanan tam sitogenetik yanıt.Pediyatrikhastalar:Kronik faz KML'si (n=11) veya blast krizi aşamasında KML'si ya da Ph+ akut lösemileri (n=15) olan, 18 yaş altı toplam 26 pediatrik hasta bir faz I doz yükseltmeçalışmasına kaydedilmiştir. Bu, yoğun ön tedavi görmüş hastalardan oluşan bir popülasyondur:hastaların %46'sı önceden BMT ve %73'ü önceden çoklu ajanlı kemoterapi görmüştür. 2 2 2 2 Hastalar 260 mg/m /gün (n=5), 340 mg/m /gün (n=9), 440 mg/m /gün (n=7) ve 570 mg/m /gün (n=5) İmatinib dozları ile tedavi edilmiştir. Sitogenetik verileri mevcut olan 9 kronik faz KML hastasının 4'ünde (%44) ve 3'ünde (%33) sırasıyla tam ve kısmi sitojenik yanıt elde edilmiş olup bu oranlar %77 MCyR değeri ile sonuçlanmıştır. Yeni tanı almış ve tedavi edilmemiş, kronik fazda KML'si olan toplam 51 pediatrik hasta açık-etiketli, çok merkezli, tek kollu bir faz II çalışmaya kaydedilmiştir. Hastalar 340 mg/m2/gün İmatinib ile tedavi edilmiş, doz sınırlayıcı toksisitesi hariç ara verilmemiştir. İmatinib tedavisiyeni tanı konmuş pediatrik KML hastalarında, 8 haftalık tedavi sonrasında %78 CHR oranı ilehızlı yanıt sağlamaktadır. Yüksek CHR oranına, hastaların %65'inde tam sitojenik yanıt(CCyR) gelişimi eşlik etmiş olup bu oran, erişkinlerde gözlenen sonuç ile karşılaştırılabilirniteliktedir. Ek olarak, hastaların % 16'sında kısmı sitojenik yanıt (PCyR) gözlenmiş, bu da %81MCyR değerini vermiştir. CCyR'ye ulaşan hastaların büyük çoğunluğu, Kaplan-Meier tahminedayalı 5,6 aylık yanıta kadar geçen medyan süre ile CCyR'ye 3 ila 10'uncu aylar arasındaulaşmıştır. Avrupa İlaç Ajansı, Philadelphia kromozomu (bcr-abl translokasyon) pozitif kronik faz kronik miyeloid lösemide pediatrik popülasyonun tüm alt kümelerinde İmatinib ile çalışmalarınsonuçları sunma zorunluluğunu iptal etmiştir (pediatrik kullanım ile ilgili bilgi için bkz. bölüm4.2). Ph+ ALL için klinik çalışmalar Yeni teşhis edilen Ph+ ALL:Kontrol grubuna yer vererek yapılan ve imatinibin, 55 yaş ve üzeri yeni tanı almış 55 hastada kemoterapi indüksiyonuyla karşılaştırıldığı bir çalışmada (ADE10), tek ajan olarak kullanılanimatinib, kemoterapiye kıyasla anlamlı derecede daha yüksek tam hematolojik yanıt oranı ilesonuçlanmıştır (%50'ye karşılık %96,3, p=0.0001). Kemoterapiye yanıt vermeyen veya zayıfyanıt veren hastalarda imatinib kurtarma tedavisi olarak kullanıldığında, 11 hastanın 9'unda(%81,8) tam hematolojik yanıt elde edilmiştir. Bu klinik etki, 2 haftalık tedaviden sonra,kemoterapi kolu ile karşılaştırıldığında imatinib ile tedavi edilen hastalarda, bcr-abltranskriptlerinde daha büyük bir azalmayla ilişkilendirilmiştir (p=0,02). Tüm hastalarindüksiyon sonrasında imatinib ve konsolidasyon kemoterapisi almış (bkz. Tablo 4) ve bcr-abltranskriptlerinin düzeyleri sekizinci haftada iki kolda aynı olmuştur. Çalışma tasarımıdoğrultusunda beklendiği üzere, iki grup arasında remisyon süresi, hastalıksız sağkalım veyagenel sağkalım açısından herhangi bir fark gözlenmemiş, ancak tam moleküler yanıt elde edilenve minimal rezidüel hastalık düzeyinde kalan hastalarda gerek remisyon süresi (p=0,01)gerekse hastalıksız sağkalım (p=0,02) bakımından sonuçlar daha iyi olmuştur. Kontrol gruplarına yer verilmeyen dört klinik çalışmada (AAU02, ADE04, AJP01 ve AUS01) yeni tanı almış 211 Ph+ ALL hastasından oluşan bir popülasyonda gözlenen sonuçlar, yukarıdatarif edilen sonuçlar ile uyumludur. Kemoterapi indüksiyonu ile kombinasyon halindekiimatinib (bkz. Tablo 4) %93'lük bir tam hematolojik yanıt oranı (değerlendirilebilir 158hastanın 147'si) ve %90'lık bir majör sitogenetik yanıt oranı (değerlendirilebilir 21 hastanın19'u) sonuçlarını vermiştir. Tam moleküler yanıt oranı %48 bulunmuştur (değerlendirilebilir102 hastanın 49'u). Hastalıksız sağkalım (DFS) ve genel sağkalım (OS) her durumda 1 yılıgeçmiştir ve iki çalışmadaki (AJP01 ve AUS01) geçmiş kontrolden üstün olmuştur (DFSp<0,001; OS p<0,0001). Tablo 4 Imatinible kombinasyon halinde kullanılan kemoterapi rejimi
Pediyatrik hastalar:I2301 çalışmasında, Ph+ ALL'si olan toplam 93 pediyatrik, ergen ve genç yetişkin hasta (18 ila 22 yaşları arasındaki 4 hasta dahil) açık etiketli, çok merkezli, sıralı gruplu,randomize olmayan bir faz III çalışmaya kaydedilmiş ve indüksiyon tedavisinden sonra yoğun 2 kemoterapi ile kombinasyon halinde Imatinib (340 mg/m /gün) ile tedavi edilmiştir. Imatinib 1. gruptan 5. gruba doğru artan süre ve daha erken İmatinib tedavisi olacak şeklilde aralıklıolarak uygulanmıştır; en düşük İmatinib yoğunluğu grup 1'de ve en yüksek İmatinib yoğunluğugrup 5'tedir (ilk kemoterapi tedavi kürleri sırasında sürekli günlük İmatinib doz uygulaması ilegün olarak en uzun süre). Grup 5 hastalarında (n=50) kemoterapi ile kombinasyon halindetedavi kürünün erken dönemlerinde İmatinibi sürekli günlük maruziyet, İmatinibsiz standartkemoterapinin uygulandığı tarihsel kontrollerle (n=120) karşılaştırıldığında 4 yıllık olaysızsağkalımı (EFS) artırmıştır (sırasıyla %69,6'ya karşılık %31,6). Grup 5 hastalarında tahmini 4yıllık GS, tarihsel kontrollerdeki %44.8 değeri ile karşılaştırıldığında %83.6 olmuştur. Kohort 5'teki 50 hastadan 20'si (% 40) hematopoietik kök hücre nakli almıştır. Tablo 5 Çalışma I2301'de imatinib ile kombinasyon halinde kullanılan kemoterapi rejimi
6-MP (75 mg/m2/gün, PO): 1-56. günler Metotreksat (20 mg/m2/hafta, PO): 1, 8, 15, 22, 29, 36, 43, 50. günlerG-CSF = granülosit koloni uyarıcı faktör, VP-16 = etoposid, MTX = metotreksat, IV = intravenöz, SC = subkutan, IT = intratekal, PO = oral, IM = intramüsküler, ARA-C = sitarabin, CPM = siklofosfamid, VCR = vinkristin, DEX= deksametazon, DAUN = daunorubisin, 6-MP = 6-merkaptopurin, E.Coli L-ASP = L-asparaginaz, PEG-ASP =PEG asparaginaz, MESNA = 2-merkaptoetan sülfonat sodyum, iii = veya MTX düzeyi <0,1 pM olana kadar, 6saatte bir = her 6 saatte bir, Gy = Gray Çalışma AIT07, kemoterapi ile kombinasyon halinde imatinib ile tedavi edilen 128 hastayı (1 ila <18 yaş) içeren çok merkezli, açık etiketli, randomize, Faz II / III bir çalışmadır. Buçalışmadan elde edilen güvenlilik verilerinin, imatinibin Ph + ALL hastalarında güvenlilikprofili ile uyumlu olduğu görülmektedir. Nüksetmiş/tedaviye dirençli Ph+ ALLİmatinib, yineleyen/refraktör Ph+ ALL hastalarında tek ajan olarak kullanıldığında, 411 hastanın 53'ünde yanıt değerlendirilebilmiş, hematolojik yanıt oranı %30 (%9'u tam) ve majörsitogenetik yanıt oranı ise %23 olarak bulunmuştur (Not: 411 hastanın 353'ü, primer yanıtverileri toplanmaksızın genişletilmiş erişim çalışmasında tedavi edilmiştir). 411yineleyen/refraktör Ph+ ALL hastasından oluşan toplam popülasyonda progresyona kadargeçen medyan süre 2,6 ile 3,1 ay aralığında olurken, değerlendirilebilir 401 hastada medyangenel sağkalım 4,9 ile 9 ay aralığında bulunmuştur. Bu veriler, sadece 55 yaş ve üzeri hastalardahil edilecek şekilde yeniden analiz yapıldığında da benzer olmuştur. SM ile İlgili Klinik ÇalışmalarABL, KIT ya da PDGFR protein tirozin kinazlarla ilişkili yaşamı tehdit edici hastalıkları olan farklı hasta popülasyonlarında İmatinibin test edildiği açık-etiketli, çok merkezli bir faz II klinikçalışma (çalışma B2225) yürütülmüştür. Bu çalışmada tedavi edilen ve 45'inde hematolojikhastalıklar, 140'ında da çeşitli solid tümörler bulunan 185 hastadan 5'inde SM saptanmıştır.SM hastaları günlük 100 mg ila 400 mg İmatinib ile tedavi edilmiştir. Yayınlanmış 10 vakaraporu ve vaka serisinde, yaşları 26 ila 85 arasında değişen 25 SM hastası daha bildirilmiştir.Bu hastalara da günlük 100 mg ila 400 mg dozda İmatinib uygulanmıştır. SM için tedavi edilentoplam popülasyonun (30 hasta) 10'unda (%33) tam hematolojik yanıt, 9'unda (%30) kısmihematolojik yanıt elde edilmiştir (toplam yanıt oranı %63). Sitogenetik anormallikleryayınlanmış raporlarda ve çalışma B2225'te tedavi edilen 30 hastanın 21'indedeğerlendirilmiştir. Bu 21 hastanın sekizinde FIP1L1-PDGFR-alfa füzyon kinaz saptanmıştır. Çalışma B2225'te tedavi edilen hastalarda ortanca medyan tedavi süresi 13 ay olmuş (aralık: 1,4-22,3 ay), yayınlanmış literatürde yanıt veren hastalarda ise aralık 1 ay ila 30 ayın üzerindebir süre arasında değişmiştir. HES/CEL ile İlgili Klinik ÇalışmalarABL, KIT ya da PDGFR protein tirozin kinazlarla ilişkili yaşamı tehdit edici hastalıkları olan farklı hasta popülasyonlarında İmatinibin test edildiği açık-etiketli, çok merkezli bir faz II klinikçalışma (çalışma B2225) yürütülmüştür. Bu çalışmada HES'i olan 14 hasta günde 100 mg ila1000 mg dozda İmatinib ile tedavi edilmiştir. Yayınlanmış 35 vaka raporu ve vaka serisindebildirilen HES/CEL'li 162 hasta daha günlük 75 mg ila 800 mg dozlarında İmatinib almıştır.176 hastadan oluşan toplam popülasyonun 117'sinde sitogenetik anormalliklerdeğerlendirilmiştir. Bu 117 hastanın 61'inde FIP1L1-PDGFRa füzyon kinaz tanımlanmıştır.Diğer 3 yayınlanmış raporda dört HES hastasının daha FIP1L1-PDGFRa pozitif olduğubulunmuştur. 65 FIP1L1-PDGFRa füzyon kinaz pozitif hastanın tümü, aylarca sürdürülen birCHR elde etmiştir (raporlama sırasında sansürlenen 1+ ila 44+ ay arasında). Yakın tarihli biryayında bildirildiği gibi, bu 65 hastadan 21'i, 28 aylık (aralık 13-67 ay) ortalama bir takipsüresiyle tam moleküler remisyona ulaşmıştır. Bu hastaların yaşları 25 ile 72 aralığındaolmuştur. Ek olarak, olgu raporlarında araştırmacılar tarafından semptomatolojide ve diğerorgan disfonksiyon anormalliklerindeki gelişmeler bildirilmiştir. Kalp, sinir, deri/deri altı doku,solunum/göğüs/mediastinal, kas-iskelet/bağ dokusu/vasküler ve gastrointestinal organsistemlerinde gelişmeler bildirilmiştir. HES/CEL'li pediyatrik hastalarda kontrollü çalışma yoktur. 3 yayında PDGFR gen yeniden düzenlemeleri ile ilişkili HES ve CEL'li üç (3) hasta bildirilmiştir. Bu hastaların yaşları 2 ila 16yıl arasında değişmiştir ve imatinib günde 300 mg / m2 veya günlük 200 ila 400 mg arasındadeğişen dozlarda verilmiştir. Tüm hastalar tam hematolojik yanıt, tam sitogenetik yanıt ve/veyatam moleküler yanıt elde etmiştir. Rezeke edilemeyen ya da metastatik GIST'de yapılan klinik çalışmalarRezektabl olmayan veya metastatik malign gastrointestinal stromal tümörleri (GIST) olan hastalarda faz II, açık etiketli, randomize, kontrolsüz çok uluslu bir çalışma yürütülmüştür. Buçalışmaya 147 hasta kaydedilmiş ve 36 ay boyunca günde bir kez oral olarak 400 mg veya 600mg kullanımına randomize edilmiştir. Bu hastalar 18 ila 63 yaşında olup, rezektabl olmayanve/veya metastatik Kit-pozitif malign GIST patolojik tanısına sahiptir. İmmünohistokimya Kitantikoru ile (A-4502, tavşan poliklonal antiserumu, 1:100; DAKO Corporation, Carpinteria, CA) antijen geri kazanımı sonrası avidin-biotin-peroksidaz kompleksi yöntemi ile analize göre rutin olarak yürütülmüştür. Birincil etkililik kanıtı objektif yanıt oranlarını temel almıştır. Tümörlerin en az bir hastalık bölgesinde ölçülebilir olması gerekmiş olup, yanıt karakterizasyonu Güneybatı Onkoloji Grubu(SWOG) kriterlerini temel almıştır. Bulgular Tablo 6'da sunulmaktadır. Tablo 6STIB2222 kodlu GIST çalışmasında en iyi tümör yanıtı
İki doz grubu arasında yanıt oranları bakımından farklılıklar söz konusu olmamıştır. Ara analiz tarihinde önemli sayıda stabil hastalığa sahip hasta, daha uzun süreli tedavi ile kısmi yanıtaulaşmıştır (medyan takip süresi 31 ay). Yanıta kadar geçen medyan süre 13 hafta olmuştur (%95GA 12-23). Yanıt veren olgularda tedavi başarısızlığına kadar geçen medyan süre 122 hafta(%95 GA 106-147), genel çalışma popülasyonunda ise 84 hafta (%95 GA 71-109) bulunmuştur.Medyan genel sağkalım noktasına ulaşılamamıştır. 36 aylık izlem sonrasında Kaplan-Meiersağkalım tahmini %68'dir. İki klinik çalışmada (çalışma B2222 ve gruplar arası çalışma S0033), günlük İmatinib dozu, 400 mg veya 600 mg daha düşük günlük dozlarında progrese olan hastalarda 800 mg'ayükseltilmiştir. Doz, toplam 103 hastada 800 mg'a çıkarılmıştır; doz yükseltildikten sonra 6hasta kısmi yanıta ve 21 hasta hastalık stabilizasyonuna ulaşarak %26'lık genel klinik yanıtsonucunu vermiştir. Eldeki güvenlilik verilerinden yola çıkılarak, 400 mg veya 600 mg dahadüşük günlük dozlarında progrese olan hastalarda dozun günde 800 mg'a çıkarılmasının,İmatinibin güvenlilik profilini etkilemediği görülmektedir. Adjuvan GIST için klinik çalışmalarAdjuvan tedavi koşullarında İmatinib, 773 hasta ile yürütülen çok merkezli, çift kör, uzun süreli, plasebo kontrollü bir faz III çalışmada (Z9001) araştırılmıştır. Bu hastaların yaşları 1891 aralığında olmuştur. İmmünhistokimya ile KIT proteini eksprese eden primer GIST yönündehistolojik tanısı bulunan ve en geniş yerinde >3 cm tümör büyüklüğüne sahip olan, çalışmayakayıt öncesindeki 14-70 gün içerisinde primer GIST'i tam gross rezeksiyon ile alınan hastalardahil edilmiştir. Primer GIST rezeke edildikten sonra hastalar şu iki koldan birine randomizeedilmiştir: bir yıl süreyle İmatinib 400 mg/gün veya plasebo. Çalışmanın birincil sonlanma noktası, randomizasyon tarihinden rekürense ya da herhangi bir nedene bağlı ölüme kadar geçen süre şeklinde tanımlanan rekürenssiz sağkalım (RFS)olmuştur. İmatinib RFS'de anlamlı uzama sağlamış, İmatinib grubunda hastaların %75'i 38. ayda rekürenssiz iken plasebo grubundaki hastaların %75'i 20. ayda rekürenssiz kalmıştır (sırasıyla%95 GA [30-hesaplanamaz]; [14-hesaplanamaz]); (tehlike oranı = 0.398 [0.259-0.610],p<0.0001). Bir yıl sonunda genel RFS, plasebo (%82.3) karşısında İmatinib için anlamlıdüzeyde daha iyi bulunmuştur (%97.7) (p<0.0001). Bu şekilde rekürens riski plaseboya oranla%89 azaltılmıştır (tehlike oranı = 0.113 [0.049-0.264]). Primer GIST'lerine yönelik ameliyatları sonrasında hastalardaki rekürens riski, şu prognoz faktörleri esas alınarak retrospektif şekilde değerlendirilmiştir: tümör büyüklüğü, mitotikindeks, tümör yeri. Mitotik indeks verileri, tedavi amaçlı (ITT) popülasyonu oluşturan 713hastanın 556'sı için mevcut idi. Birleşik Devletler Ulusal Sağlık Enstitüleri (NIH) ve SilahlıKuvvetler Patoloji Enstitüsü (AFIP) risk sınıflandırmalarına göre yapılan alt grup analizlerininsonuçları Tablo 7'de gösterilmektedir. Düşük ve çok düşük risk gruplarında herhangi bir faydagözlenmemiştir. Genel bir sağkalım faydası gözlenmemiştir.
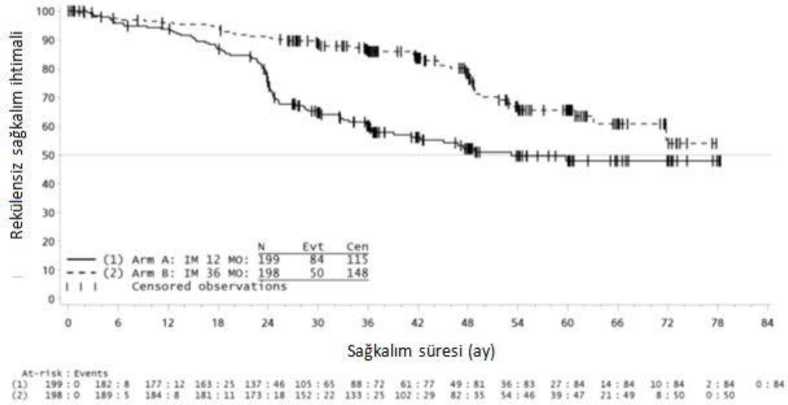
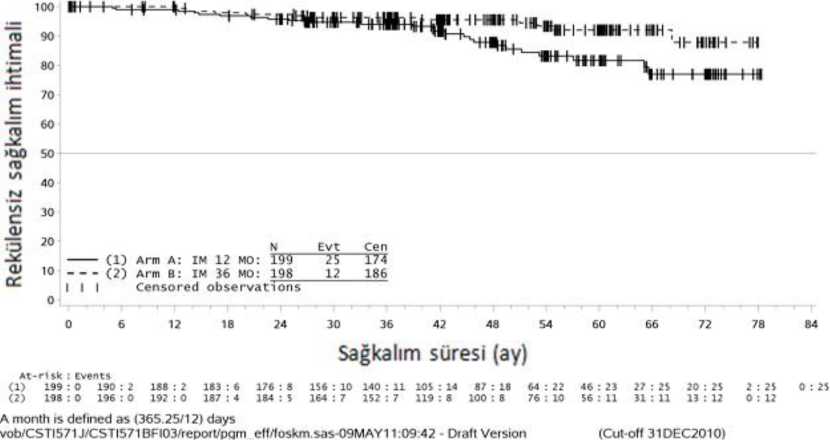
İkinci bir çok merkezli, açık etiketli faz III çalışmada (SSG XVi n/AIO), cerrahi GIST rezeksiyonu sonrasında olan ve aşağıdaki durumlardan birinin bulunduğu hastalarda 400mg/gün İmatinib ile 36 ay karşısında 12 aylık tedavi karşılaştırılmıştır: tümör çapı > 5 cm vemitotik sayım > 5/50 yüksek güç alanı (HPF); veya tümör çapı > 10 cm ve herhangi bir mitotiksayım veya mitotik sayımı > 10/50 HPF olan herhangi bir büyüklükteki tümör ya da peritonboşluğuna doğru rüptüre olan tümörler. Toplam 397 hastadan olur alınmış ve bu hastalarçalışmaya randomize edilmiştir (199 hasta 12 ay kolunda ve 198 hasta 36 ay kolunda) medyanyaş 61 idi [aralık 22 ila 84 yaş]). Medyan takip süresi 54 ay olup (randomizasyondan veri kesmetarihine kadar) ilk hastanın randomize edilişinden veri kesme tarihine kadar geçen medyan süre83 aydır.Çalışmanın birincil sonlanma noktası, randomizasyon tarihinden nükse ya da herhangi bir nedene bağlı ölüme kadar geçen süre şeklinde tanımlanan nükssüz sağkalım (RFS) olmuştur. 36 aylık İmatinib tedavisi, 12 aylık İmatinib tedavisi ile karşılaştırıldığında RFS'de anlamlı ölçüde uzama sağlamıştır (genel tehlike oranı (HR) = 0.46 [0.32, 0.65], p<0.0001) (Tablo 8,Şekil 1). Buna ek olarak, 36 aylık İmatinib tedavisi, 12 aylık İmatinib tedavisi ile karşılaştırıldığında genel sağkalım (OS) süresini anlamlı ölçüde uzatmıştır (HR = 0.45 [0.22, 0.89], p=0.0187)(Tablo 8, şekil 2). Daha uzun süreli tedavi (> 36 ay) yeni rekürenslerin oluşumunu geciktirebilmektedir; ancak, bu bulgunun genel sağkalım üzerindeki etkisi halen bilinmemektedir. Toplam ölüm sayısı 12 aylık tedavi kolu için 25 ve 36 aylık tedavi kolu için 12 şeklinde olmuştur. İmatinib ile 36 ay süreli tedavi, ITT analizinde, yani tüm çalışma popülasyonun dahil edildiği analizde, 12 aylık tedaviden daha üstün bulunmuştur. Mutasyon tipine göre yapılan planlı biralt grup analizinde, ekson 11 mutasyonları olan hastalarda 36 aylık tedavide RFS için tehlikeoranı 0.35 olmuştur [%95 GA: 0.22, 0.56]. Gözlemlenen olay sayısının düşük olması sebebiyle, daha az yaygın olan mutasyon alt grupları için herhangi bir sonuç çıkartılamamaktadır.
Şekil 1 Primer rekürenssiz sağkalım sonlanım noktası için Kaplan-Meier tahminleri (ITT popülasyonu) Şekil 2 Genel sağkalım için Kaplan-Meier tahminleri (ITT popülasyonu) C-Kit pozitif GIST olan pediyatrik hastalarda kontrollü çalışma yoktur. 7 yayında GIST'li (Kit ve PDGFR mutasyonları olan veya olmayan) onyedi (17) hasta bildirilmiştir. Bu hastaların yaşı8 ila 18 aralığında olmuştur ve imatinib, hem adjuvan hem de metastatik koşullarda günde 300ila 800 mg arasında değişen dozlarda verilmiştir. GIST tedavisi gören pediyatrik hastalarınçoğunda c-kit veya PDGFR mutasyonlarını doğrulayan veriler bulunmamakta olup bu durumkarışık klinik sonuçlara yol açmış olabilir. 5.2. Farmakokinetik özelliklerGenel özelliklerİMATRA'nın farmakokinetiği 25-1000 mg'lık bir doz aralığında değerlendirilmiştir. Plazma farmakokinetik profilleri 1. günde ve plazmada kararlı düzeylerin elde edildiği 7. ya da 28.günde analiz edilmiştir. Emilim:Tablet formülünün ortalama mutlak biyoyararlanımı % 98'dir. Bir oral dozu takiben plazma imatinib eğri altında kalan alan (EAA) değerlerinde, yüksek oranda hastalar arası değişkenlikgörülmüştür. Yüksek yağ içeren bir gıda ile birlikte verildiğinde, imatinibin emilim oranıminimal düzeyde azalmış (Cmaks'da % 11 azalma ve tmaks'da 1,5 saatlik uzama), açlıkkoşullarına göre EAA değerinde küçük bir azalma (% 7,4) olmuştur. Geçirilmiş gastrointestinalcerrahinin ilaç absorpsiyonu üzerindeki etkisi araştırılmamıştır. Dağılım:Klinik açıdan uygun konsantrasyonlarda kullanılan imatinibin plazma proteinlerine bağlanması yaklaşık %95 olmuş, in vitrodeneyler temelinde, daha çok albümin vealfa-asit-glikoproteine, az miktarda da lipoproteine bağlanmıştır.Biyotransformasvon:İnsanlarda, dolaşımdaki temel metaboliti ana ilaç ile in vitrobenzer etki gücünde (potens) olduğu gösterilmiş N-demetillenmiş piperazin (CGP71588) türevidir. Bu metabolitin plazmaEAA değerinin imatinibin EAA değerinin sadece %16'sı olduğu bulunmuştur. N-demetilemetabolitin plazma proteinlerine bağlanması, asıl bileşiğinkine benzerdir.İmatinib ve N-demetil metaboliti birlikte, dolaşımdaki radyoaktivitenin yaklaşık %65'ini oluşturmuştur (EAA (0-48saat)). Dolaşımdaki radyoaktivitenin kalan kısmı bir dizi minörmetabolitten oluşmuştur. İn vitro sonuçlar CYP3A4'ün, imatinib biyotransformasyonunu katalize eden başlıca P450 enzimi olduğunu göstermiştir. Potansiyel eşzamanlı ilaçlardan (asetaminofen, asiklovir,allopurinol, amfoterisin, sitarabin, eritromisin, flulonazol, hidroksiüre, norfloksasin, penisilinV) oluşan bir panelde sadece eritromisin (IC50 50 mikromolar) ve flukonazol (IC50 118mikromol) imatinib metabolizmasında klinik açıdan anlamlı olabilecek inhibisyon göstermiştir.İn vitro koşullarda imatinibin CYP2C9, CYP2D6 ve CYP3A4/5'in markör substratlarmınkompetitif bir inhibitörü olduğu gösterilmiştir. İnsan karaciğeri mikrozomlarında Ki değerlerisırasıyla 27, 7.5 ve 7.9 mikromol /l bulunmuştur. Hastalarda imatinibin maksimal plazmakonsantrasyonları 2-4 mikromol /l'dir, dolayısıyla bir arada uygulanan ilaçların CYP2D6ve/veya CYP3A4/5 aracılı metabolizmasında inhibisyon olasıdır. İmatinib, 5-fluorourasilbiyotransformasyonuna müdahale etmemiştir fakat kompetitif CYP2C8 inhibisyonu (Ki = 34.7mikromol) sonucu paklitaksel metabolizmasını inhibe etmiştir. Bu Ki değeri, hastalardabeklenen imatinib plazma düzeylerinin çok üzerindedir, dolayısıyla 5-fluorourasil ya dapaklitakselin imatinib ile bir arada uygulanması sonucu herhangi bir etkileşimbeklenmemektedir. Eliminasyon:İmatinibin 14C-işaretli tek oral dozundan sonra, dozun yaklaşık %81'i 7 gün içinde feçesle (dozun %68'i) ve idrarla (dozun %13'ü) itrah edilmiştir. Değişmemiş durumdaki imatinib,dozun %25'ini (%5 idrar, %20 feçes) oluşturmuştur, geriye kalan kısım metabolitlerdir. Doğrusallık / doğrusal olmayan durum:Sağlıklı gönüllülerde oral uygulamanın ardından, imatinibin t1/2 değeri yaklaşık 18 saat olması günde tek doz şeklindeki pozolojinin uygun olduğu izlenimini vermektedir. Oral olarak25-1000 mg imatinib uygulandıktan sonra artan dozla birlikte ortalama EAA artışı doğrusal birseyir izlemiştir. Tekrarlanan dozlarda imatinib kinetiğinde değişiklik olmamış ve günde bir kezuygulandığında birikim, kararlı ilaç konsantrasyonunun 1,5-2,5 katı olmuştur. Farmakokinetik / farmakodinamik ilişkiler:Popülasyon farmakokinetiğiKML hastalarındaki popülasyon farmakokinetiği analizlerine göre yaşın dağılım hacmi üzerinde küçük bir etkisi olmuştur (> 65 yaşındaki hastalarda % 12 artış). Bu değişimin klinikaçıdan anlamlı olmadığı düşünülmüştür. Vücut ağırlığının imatinib klerensi üzerindeki etkisinebakıldığında, 50 kg ağırlığındaki bir kişide klerensin 8.5 l/s, olması beklenirken, 100 kgağırlığındaki bir kişideki klerens 11.8 l/s'e yükselmektedir. Bu değişiklikler vücut ağırlığınagöre bir doz ayarlaması yapılması için yeterli olarak kabul edilmemiştir. Cinsiyetin imatinibkinetiği üzerinde etkisi olmamıştır. GIST hastalarında farmakokinetikGIST hastalarında kararlı durum maruziyeti, aynı dozajda (400 mg/gün) KML hastaları için gözlenenden 1.5 kat daha yüksek olmuştur. GIST hastalarındaki ön popülasyon farmakokinetiğianalizine dayalı olarak, üç değişkenin (albümin, WBC ve bilirubin) imatinib farmakokinetiğiile anlamlı ilişkiye sahip olduğu bulunmuştur. Daha düşük albümin değerleri daha düşükklirense (CL/f) sebep olmuş ve daha yüksek WBC düzeyleri CL/f azalmasına neden olmuştur.Ancak bu ilişkiler, doz ayarlamasını gerektirecek ölçüde anlamlı şekilde ön plana çıkmamıştır.Bu hasta popülasyonunda hepatik metastazların varlığı potansiyel olarak karaciğeryetmezliğine ve azalmış metabolizmaya yol açabilir. Çocuklarda farmakokinetikBir Faz I ve Faz II çalışmasında oral imatinib, pediatrik hastalarda da, erişkin hastalardaki gibi hızla emilmiştir. Çocuklarda 260 ve 340 mg/m2 imatinible elde edilen EAA değerleri,erişkinlerde sırasıyla 400 ve 600 mg imatinible elde edilenler gibidir. 340 mg/m2 imatinibinbirinci ve sekizinci günlerdeki EAA(0-24 saat) değerleri bu ilacın, tekrarlanan dozlardan sonra 1.7kat biriktiğini göstermiştir. Hematolojik bozuklukları (KML, Ph+ALL ya da imatinib ile tedavi edilen diğer hematolojik bozukluklar) olan pediyatrik hastalarda birleştirilmiş popülasyon farmakokinetiği analizinedayalı olarak imatinib klerensi vücut yüzey alanının (VYA) artmasına paralel olarakyükselmektedir. VYA etkisi için düzeltme yapıldıktan sonra, yaş, vücut ağırlığı ve vücut kitle indeksi gibi diğer demografik faktörler imatinib maruziyeti üzerinde klinik açıdan anlamlı 2 etkiler yapmamıştır. Yapılan analiz, günde bir kere 260 mg/m (günde 400 mg'ı geçmemek Organ fonksiyonu bozukluğuİmatinib ve metabolitleri böbrek yoluyla anlamlı miktarda atılmazlar. Böbrek fonksiyonlarında hafif ve orta şiddette bozukluk olan hastalar, böbrek fonksiyonları normal hastalardan dahayüksek plazma değerlerine sahip görünmektedir. Artış yaklaşık olarak1,5-2 kattır ve imatinibin güçlü bir biçimde bağlandığı plazma alfa asit glikoprotein (AGP)değerinde 1,5 katlık bir artışa karşılık gelir. Böbrek bozukluğu olan hastalarda imatinibinserbest ilaç klerensi muhtemelen böbrek fonksiyonları normal hastalardakinin bir benzeridirçünkü böbrekler yoluyla atılım imatinib için minör bir eliminasyon yolunu oluşturmaktadır(bkz. 4.2. Pozoloji ve uygulama şekli, 4.4. Özel kullanım uyarıları ve önlemleri). Farmakokinetik analiz sonuçlarının kişiden kişiye değişikliklerin söz konusu olduğunu göstermesine rağmen, değişik derecelerde karaciğer yetersizliği olan hastalardaki imatinibeortalama maruz kalım, karaciğer fonksiyonları normal olan hastalara kıyasla yükselmemiştir(bkz. 4.2. Pozoloji ve uygulama şekli, 4.4. Özel kullanım uyarıları ve önlemleri,4.8. İstenmeyen Etkiler). 5.3. Klinik öncesi güvenlilik verileriİmatinibin klinik öncesi güvenliliği sıçanlarda, köpeklerde, maymunlarda ve tavşanlarda değerlendirilmiştir. Çoklu doz toksisite çalışmaları sıçanlarda, köpeklerde ve maymunlarda hafif ile orta dereceli hematolojik değişiklikler ortaya koymuş, sıçanlarda ve köpeklerde bu değişikliklere kemik iliğideğişiklikleri eşlik etmiştir. Karaciğer, sıçanlarda ve köpeklerde hedef organ olmuştur. İki türde de transaminazlarda hafif ila orta dereceli artışlar ve kolesterol, trigliseritler, total protein ve albümin düzeylerinde hafifdüşüşler gözlenmiştir. Sıçan karaciğerinde herhangi bir değişiklik görülmemiştir. İki haftasüreyle tedavi edilen köpeklerde yükselmiş karaciğer enzimleri, hepatoselüler nekroz, safrakanalı nekrozu ve safra kanalı hiperplazisi ile şiddetli karaciğer toksisitesi gözlenmiştir. İki hafta süreyle tedavi edilen maymunlarda fokal mineralizasyon ve renal tübüllerin dilatasyonu ve tübüler nekroz ile renal toksisite gözlenmiştir. Bu hayvanların birkaçında kanüre azotunda (BUN) ve kreatininde artış gözlenmiştir. 13 haftalık çalışmada sıçanlarda > 6mg/kg dozlarda serum veya idrar parametrelerinde değişiklikler olmaksızın mesane ve renalpapilla transisyonel epitelyum hiperplazisi gözlenmiştir. Kronik imatinib tedavisi ile fırsatçıenfeksiyonların oranında artış gözlenmiştir. 39 haftalık maymun çalışmasında NOAEL (advers etkinin görülmediği düzey), 15 mg/kg olan en düşük dozda saptanmış olup bu doz, beden yüzeyi bazında 800 mg'lık maksimum insandozunun yaklaşık üçte biridir. Tedavi, bu hayvanlarda normalde baskılanmış olan malaryalenfeksiyonlarda kötüleşme ile sonuçlanmıştır. İmatinib, bir in vitro bakteriyel hücre testinde (Ames test), bir in vitro memeli hücre testinde (fare lenfoması) ve bir in vivo sıçan mikronükleus testinde test edildiğinde genotoksik etkigöstermemiştir. Metabolik aktivasyon varlığında klastojenisiteye (kromozom aberasyonu)yönelik bir in vitro memeli hücre testinde (Çin hamsterı overi) imatinib için pozitif genotoksiketkiler elde edilmiştir. Üretim prosesinin, son üründe de bulunan iki ara ürünü Ames testindemutajenisite açısından pozitiftir. Bu ara ürünlerden biri ayrıca fare lenfoma testinde de pozitifsonuç vermiştir. Bir fertilite çalışmasında çiftleşmeden önce 70 gün süreyle dozlar uygulanan erkek sıçanlarda testiküler ve epididimal ağırlıklar ve hareketli sperm yüzdesi, beden yüzey alanı bazında 800mg/gün maksimum klinik dozu ile yaklaşık olarak eşit olan 60 mg/kg dozunda azalmıştır. Buetki < 20 mg/kg dozlarda görülmemiştir. Köpekte > 30 mg/kg oral dozlarda spermatogenezdede hafif ila orta dereceli bir azalma gözlenmiştir. Dişi sıçanlar çiftleşmeden önce 14 gün süreyleve 6. gestasyon gününe kadar dozlar uygulandığında çiftleşme ya da gebe hayvan sayısındaherhangi bir etki söz konusu olmamıştır. 60 mg/kg dozunda dişi sıçanlarda önemli ölçüdeimplantasyon sonrası fetal kayıp ve canlı fetüs sayısında azalma olmuştur. Bu etki < 20 mg/kgdozlarda görülmemiştir. Sıçanlarla yürütülen bir oral prenatal ve postnatal gelişim çalışmasında 45 mg/kg/gün grubunda gestasyonun 14 ya da 15. gününde kırmızı vajinal akıntı kaydedilmiştir. Aynı dozda ölü doğanyavru sayısı ve ayrıca doğum sonrası 0-4 günler arasında ölen yavru sayısı da artmıştır. F1yavrularda aynı doz düzeyinde ortalama vücut ağırlıkları doğumdan öldürülene kadar geçensürede azalmıştır ve prepusyal ayrılma kriterine ulaşan yavru sayısı da hafif azalmıştır. 45mg/kg/gün dozunda F1 fertilitesi etkilenmemiş, diğer yandan rezorpsiyon sayısında artış vecanlı fetüs sayısında azalma tespit edilmiştir. Gerek anne hayvanlar gerekse F1 nesil için etkiningözlenmediği düzey (NOEL) 15 mg/kg/gün (800 mg'lık maksimum insan dozunun dörtte biri)olmuştur. İmatinib organogenez sırasında, vücut yüzey alanı bazında 800 mg/gün maksimum klinik doz ile yaklaşık olarak eşit olan >100 mg/kg dozlarda sıçanlara uygulandığında teratojen etkigöstermiştir. Teratojenik etkiler eksensefali veya ensefalosel, frontal kemiklerinolmaması/eksik olması ve parietal kemiklerin olmamasını içermiştir. Bu etkiler < 30 mg/kgdozlarda görülmemiştir. Sıçanlarda juvenil gelişim toksikolojisi çalışmasında yeni hedef organ belirlenmemiştir (doğum sonrası 10 ila 70. gün). Juvenil toksikoloji çalışmasında, ortalama pediyatrik maruziyet olarak 2 önerilen en yüksek doz olan 340 mg/m düzeyinin yaklaşık 0,3 ila 2 katı düzeylerde, büyüme üzerinde geçici etkiler ve vaginal açılma ve prepusyal ayrılmada gecikme gözlenmiştir. Ayrıca, 2 ortalama pediyatrik maruziyet olarak önerilen en yüksek doz olan 340 mg/m düzeyinin yaklaşık 2 katı düzeylerde, juvenil hayvanlarda (yaklaşık olarak sütten kesilme döneminde)mortalite gözlemlenmiştir. 2 yıllık sıçan karsinojenisite çalışmasında 15, 30 ve 60 mg/kg/gün olarak imatinib uygulanması, erkeklerde 60 mg/kg/gün dozunda ve dişilerde > 30 mg/kg/gün dozunda yaşam süresi üzerindeistatistiksel açıdan anlamlı azalmaya neden olmuştur. Ölenlerde yapılan histopatolojikinceleme, ölümün temel nedeni ya da öldürülme nedeni olarak kardiyomiyopati (her ikicinsiyet), kronik ilerleyici nefropati (dişiler) ve prepusyal bez papillomunu ortaya koymuştur.Neoplastik değişiklikler açısından hedef organlar böbrekler, mesane, üretra, prepusyal veklitoral bez, ince bağırsak, paratiroid bezleri, adrenal bezler ve glandüler-olmayan mideolmuştur. Prepusyal/klitoral bezde papilloma/karsinoma sırasıyla 400 mg/gün veya 800 mg/gün dozlarında insan günlük maruziyetinin 0.5 veya 0.3 katına (EAA bazında) ya da çocuklarda 340 2 mg/m /gün dozunda günlük maruziyetin 0.4 katına karşılık gelen (EAA bazında) 30 mg/kg/gün dozundan itibaren gözlenmiştir. Etki gözlenmeyen düzey (NOEL) 15 mg/kg/gün olmuştur. 400 mg/gün veya 800 mg/gün dozlarında insan günlük maruziyetinin sırasıyla 1,7 veya 1 katına 2 (EAA bazında) ya da çocuklarda 340 mg/m /gün dozunda günlük maruziyetin 1,2 katına karşılık gelen (EAA bazında) 60 mg/kg/gün dozunda renal adenoma/karsinoma, mesane veüretra papilloması, ince bağırsak adenokarsinomaları, paratiroit bezleri adenomaları, adrenalbezlerde benign ve malign medüller tümörler ve glandüler olmayan midepapillomaları/karsinomaları görülmüştür. Etki gözlenmeyen düzey (NOEL) 30 mg/kg/günolmuştur. Sıçan karsinojenisite çalışmalarından elde edilen bu bulguların insanlar için anlamı bilinmemektedir. Erken dönem klinik çalışmalarda tanımlanmayan non-neoplastik lezyonlar kardiyovasküler sistem, pankreas, endokrin organlar ve dişlerle ilgili olmuştur. En önemli değişiklikler bazıhayvanlarda kalp yetmezliği belirtilerine yol açan kardiyak hipertrofi ve dilatasyonu içermiştir.Etkin madde imatinib, tortul tabaka organizmaları için çevresel risk oluştur. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiMikrokristalin selüloz Tip 101 Mikrokristalin selüloz Tip 102Krospovidon Hidroksipropil metil selüloz Kolloidal silikon dioksitMagnezyum stearatOpadry II turuncu 85F230022 - Polivinil alkol - Polietilen glikol/Makrogol - Sarı demir oksit (E172) - Talk - Titanyum dioksit (E171) - Kırmızı demir oksit (E172) 6.2. GeçimsizliklerGeçerli değildir. 6.3. Raf ömrü60 ay. 6.4. Saklamaya yönelik özel uyarılar25°C'nin altındaki oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriğiHer karton kutu, PVC/PE/PVDC-Alu blisterler içerisinde 30 film kaplı tablet ve kullanma talimatı içerir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİTRPHARM İlaç Sanayi Ticaret AŞ. Esentepe Mah., Büyükdere Cad. Kanyon Ofis Bloğu. No:185 K:14 Levent-Şişli/İSTANBUL Tel: 0 212 386 31 30 Faks: 0 212 355 13 80 8. RUHSAT NUMARASI2023/344 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi : 31.08.2023 Ruhsat yenileme tarihi : 10. KÜB'ÜN YENİLENME TARİHİ1
ilerlemiş faz KML'si ve Ph+ ALL'si olan çocuklar için 340 mg/m günlük doz önerilmektedir (toplam doz günde 600 mg'ı geçmemelidir). Tedavi KML ve Ph+ ALL'de günde bir kere dozuygulaması yoluyla verilebilir. KML'de alternatif olarak günlük doz iki uygulamayabölünebilir - sabah bir ve akşam bir (bkz. bölüm 5.1. Farmakodinamik özellikler).
üzere) ya da günde bir kere 340 mg/m alan (günde 600 mg'ı geçmemek üzere) pediyatrik hastalarda imatinib maruziyetinin, günde bir kere 400 mg ya da 600 mg imatinib alan yetişkinhastalardakine benzer olduğunu doğrulamıştır. |
İlaç Bilgileriİmatra 400 Mg Film Kaplı TabletEtken Maddesi: İmatinib Mesilat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.