Tisseel 4 Ml Çözelti İçeren Kullanıma Hazır Enjektör Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERI TIBBI URUNUN ADITİSSEEL 4 mL Çözelti İçeren Kullanıma Hazır Enjektör Steril 2. KALITATIF VE KANTITATIF BILEŞIMEtkin madde:Bileşen 1 : Yapıştırıcı protein çözeltisi
91 mg(1) /mL 3000 KIU(2)/mL
İnsan fibrinojeni (pıhtılaşabilir protein) Aprotinin (sentetik) Bileşen 2 : Trombin çözeltisi İnsan trombini 500 IU(3)/mL Kalsiyum klorür dihidrat 40 gmol/mL (1) 96-125 mg/mL toplam konsantrasyondaki protein içinde(2) 1 EPU (Avrupa Farmakope Ünitesi), 1800 KIU (Kallidinogenaz İnaktivatör Ünitesi) ne karşılık gelir.(3) Trombin aktivitesi, trombin için geçerli WHO Uluslararası Standardı kullanılarak hesaplanmıştır.Çift bölmeli enjektör, bölmelerden birinde derin dondurulmuş 2 mL yapıştırıcı protein çözeltisi (sentetik aprotininli), dierinde ise derin dondurulmuş 2 mL trombin çözeltisi(kalsiyum klorür dihidratlı) içerir. Bölmeler içerisindeki çözeltiler karıştırıldıında 4 mLkullanıma hazır çözelti oluşur. Kullanıma hazır 4 mL çözeltinin bileşimi aşaıdaki şekildedir: İnsan fibrinojeni(pıhtılaşabilir protein)182 mg Sentetik aprotinin6000 KIU İnsan trombini1000 lU Kalsiyum klorürdihidrat80 pmol TİSSEEL 0.6-5 lU/mL kadar insan fıbrinojeni ile birlikte saflaştırılmış insan faktör XIII'ü içerir. ' Yardımcı madde(ler):0.6-1.9 mg/mL Polisorbat 80 (Tween 80) Yardımcı maddeler için, bkz. 6.1. 3. FARMASOTIK FORMFibrin doku yapıştırıcılar Derin dondurulmuş Derin dondurulmuş durumdaki görünümü:Renksiz ya da soluk sarı renkli ve donmuş opak çözeltilerÇözünmüş durumdaki görünümü:Renksiz ya da soluk sarı renkli berrak çözeltiler4. KLİNIK ÖZELLIKLERBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys4 1 Teranötik endikasvoniar®'®®'güvenli elektronik imza ile imzalanmıştır. Belge Do Standart cerrahi tekniklerin yetersiz kaldıı şu durumların destekleyici tedavisinde endikedir (Bkz. Bölüm 5.1): Hemostazın iyileştirilmesinde. Vasküler cerrahide, gastrointestinal anastomozlarda, beyin omurilik sıvısı veya duramater ile temasın oluşabilecei beyin cerrahisinde doku yapıştırıcısı olarak, yaraiyileşmesini güçlendirmek ya da sütürleri desteklemekte. Ayrılmış dokuların (örn., doku flepleri, greftler, kısmi deri greftleri, fıtık onarımındakullanılan meş greftler) yapışmasını güçlendirmek için doku yapıştırmada. Tam heparinize (heparinle tedavi edilmiş) hastalarda etkinlii kanıtlanmıştır. 4.2. Pozoloji ve uygulama şekliTİSSEEL sadece epilezyonel (topikal) kullanım içindir, enjekte edilmemelidir. TİSSEEL damar içine uygulanmamalıdır. TİSSEEL, yalnızca TİSSEEL kullanımı konusunda eitim almış deneyimli cerrahlar tarafından kullanılmalıdır. Pozoloji / Uygulama sıklıı ve süresi:Uygulanacak TİSSEEL miktarı ve uygulama sıklıı hastanın klinik gereksinimine göre bireysel olarak belirlenmelidir. Uygulanacak doz, cerrahi girişim türü, etkilenen bölge boyutu, tasarlanan uygulama modu ve uygulamaların sayısı gibi birtakım deişkenlere balıdır. Ürünün uygulanma şekli, tedaviyi uygulayan hekim tarafından hastaya göre, bireysel olarak belirlenmelidir. Klinik çalışmalarda bireysel dozlar genellikle 4 ile 20 mL arasındadeişmektedir. Bazı prosedürler (örn., karacier travması ya da geniş yanık alanlarınınörtülmesi) için daha büyük hacimler gerekebilir. Seçilen anatomik alana veya hedef yüzeye uygulanacak ürünün başlangıç miktarı, belirlenen uygulama alanını tamamen kaplamaya yetmelidir. Gerekirse uygulama tekrarlanabilir. AncakTİSSEEL polimerize olmuş bir tabakaya yapışmayacaından, daha önceden polimerizeolmuş bir TİSSEEL tabakası üzerine yeniden uygulanmasından kaçınılmalıdır. Yüzeylerin yapıştırılmasına yönelik bir kılavuz olarak, 2 mL'lik 1 paket TİSSEEL (1 mL TİSSEEL solüsyonu artı 1 mL trombin çözeltisi) en az 10 cm2'lik bir alan için yeterliolacaktır. TİSSEEL spreyleme (püskürtme) yöntemi ile uygulandıında, bu miktarlar olgunun bireysel özelliklerine ve spesifik endikasyonlara göre çok daha geniş yüzeyleri kaplamak için yeterliolacaktır. Aşırı granülasyon dokusunun oluşmasından kaçınmak ve katılaşmış fibrin yapıştırıcının kademeli absorpsiyonunu salanmak için, TİSSEEL'in olabildiince ince bir katman olarakuygulanması önerilir. Doku yapıştırıcı olarak kullanılıyorsa, ilk uygulamanın amaçlanan tüm uygulama alanını kapsaması önerilir. TİSSEEL, meş fiksasyonu için kullanıldıında, cerrahın tercihine balı olarak, damlatma yöntemiyle ve/veya bir sprey teknii ile uygulanabilir. Cerrahlar genellikle TİSSEEL'idamlatma yöntemiyle rutin olarak meşin fikse olduu zımba tellerinin üzerine Bu belg^ güvenil elektromk imza ile ımz^lanmışlnfr ı ı ı ı ı Belge Do Yalnızca epilezyonel kullanım içindir. Sprey uygulama yoluyla TİSSEEL'in optimal güvenli kullanımını salamak için, aşaıdaki önerilere uyulmalıdır: Açık yara cerrahisinde - en fazla 2.0 bar (28.5 psi) basınç uygulayan bir basınç düzenleyici cihaz kullanılmalıdır. Minimal invaziv/laparoskopik prosedürlerde; en fazla 1.5 bar (22 psi) basınç uygulayan ve yalnızca karbondioksit gazı kullanılan bir basınç düzenleyici cihaz kullanılmalıdır. TİSSEEL uygulanmadan önce, yaranın yüzey alanı standart teknikler kullanılarak (örn. aralıklı olarak kompres, gazlı bez uygulaması, aspirasyon cihazları kullanımı)kurutulmalıdır. Alanı kurutmak için basınçlı hava veya gaz kullanılmamalıdır. TİSSEEL sadece görünen uygulama alanlarına püskürtülmelidir. TİSSEEL, bu ürün için önerilen (bkz. bölüm 6.6) cihazlarla ve talimatlara uygun olarak çözülmeli ve uygulanmalıdır. Sprey uygulaması için, cerrahi prosedüre göre dokuya olan mesafe ve basınç ile uygulayıcı ucu uzunluuna dair özel önerilere yönelik bölüm 4.4 ve 6.6'ya bakınız. Amaçlanan alan dışında uygulamadan kaçınılmalıdır. Uygulamaya ara verilirse kanülde hemen tıkanma meydana gelir. Uygulama kanülünü yalnızca uygulamaya devam etmeden hemen önce yenisiyle deiştirin. Balantı parçasının(Y konektörü) kanüle bakan açıklıı tıkalıysa, pakette verilen yedek balantı parçasınıkullanın. Minimal hacimde fibrin doku yapıştırıcı kullanımının yeterli olduu cerrahi girişimlerde, ilk birkaç damla TİSSEEL'i kullanmayın. Yapıştırıcı protein bileşeni ve trombin bileşenininyeterli miktarda karışmasını salamak için, kullanımdan hemen önce uygulama kanülündenürünün ilk birkaç damlası çıkarılmalı ve atılmalıdır.  Alkol, iyodin veya aır metal iyonu içeren çözeltiler (dezenfektanlar veya antiseptikler) yapıştıncı protein ve trombin solüsyonunu denatüre edebilir. Bu maddelerden herhangi bir^ yara bölgesini temizlemek için kullanılmışsa, TİSSEEL uygulamasından önce uygulanacak bölge iyice durulanmalıdır. TİSSEEL uygulandıktan sonra, yeterli polimerizasyon elde etmek için en az 2 dakika bekleyin. Bu süre içerisinde kullanım şekline balı olarak sızdırmaz kısımların sabitlenmesiveya istenilen pozisyonda tutulması gerekebilir. Oksitlenmiş selüloz içeren müstahzarlar, TİSSEEL'in etkinliini azaltabilir bu yüzden taşıyıcı materyal olarak kullanılmamalıdır (bkz. Bölüm 6.2). TİSSEEL hastaya her uygulandıında, hasta ile ürün partisi arasında bir balantı salamak için ürünün adının ve parti numarasının kaydedilmesi şiddetle tavsiye edilmektedir. Daha ayrıntılı talimatlar için (bkz. Bölüm 6.6). Özel popülasyonlara ilişkin ek bilgiler:Böbrek / Karacier yetmezlii:Lokal olarak etki göstermek amacıyla geliştirilmiştir. Böbrek veya karacier yetmezlii olan hastalarda dozaj ayarlamasına yönelik bir çalışma bulunmamaktadır. Pediyatrik popülasyon:Ürünün güvenlilik ve etkililii pediyatrik hastalarda deerlendirilmemiştir. Geriyatrik popülasyon:Yaşlılarda doz erişkinlerdeki gibi cerrahi girişimin şekli, alanın büyüklüü, uygulama tipi ve sayısına göre uygulamayı yapacak hekim tarafından belirlenmelidir. 4.3. Kontrendikasyonlar TİSSEEL masif ve aktif arteriyel veya venöz kanamalarda tek başına endike deildir. TİSSEEL, cerrahi yara kapamaya yönelik cilt sütürlerinin yerine kullanılmak üzeretasarlanmamıştır. TİSSEEL, asla intravasküler olarak uygulanmamalıdır. İntravasküler uygulama, yaşamıtehdit edebilecek boyutta tromboembolik olaylarla sonuçlanabilir. TİSSEEL etkin maddelerine veya yardımcı maddelerinden herhangi birine karşı aşırıduyarlılık durumunda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriSadece epilezyonel kullanım içindir. İntravasküler uygulamayınız. TİSSEEL'i dokuya enjekte etmek, lokal doku hasarı riski taşımaktadır. Preparatın kazayla intravasküler olarak uygulanması durumunda yaşamı tehdit eden tromboembolik olaylar gelişebilir. İntravasküler uygulama, intravasküler pıhtılaşmaya yol açabilir ve yaşamı tehdit eden tromboembolik olaylara neden olabilir ve duyarlı hastalarda aşırı duyarlılık reaksiyonlarınıngörülme riskini ve şiddetini arttırabilir.  TİSSEEL, örnein koroner^aypasüeerrahiisinienolduuıig^^itintravasküler uygulama riskini en nazal mukoza gibi yüksek derecede vaskülarize dokulara da enjekte edilmemelidir. Koroner arter bypass cerrahisine yönelik randomize olmayan iki retrospektif çalışmada, fibrin yapıştırıcı uygulanan hastalarda istatistiksel olarak anlamlı artmış mortalite riskigözlenmiştir. Bu çalışmalarda her ne kadar belirli bir neden-sonuç ilişkisi gösterilememişolsa da, TİSSEEL kullanımı ile artmış risk göz ardı edilememektedir. Bu nedenle ürününkazayla intravasküler uygulanmaması için azami çaba gösterilmelidir. Yapıştırıcı protein ve/veya trombin çözeltisinin enjeksiyonu, anafilaktoid reaksiyon riski taşır. İntravasküler ve intraventriküler uygulama, ek bir tromboembolik komplikasyon riskitaşır. Her iki komplikasyon da yaşamı tehdit edebilir. Bu nedenle yapıştırıcı protein ve/veyatrombin çözeltisinin sadece topikal olarak uygulanmasına özen gösterilmelidir. Fibrin yapıştırıcıları basınçlı gaz ile kullanırken dikkatli olunmalıdır. Basınçlı gaz kullanılarak yapılan herhangi bir uygulamada yaşamı tehdit edebilecek boyutlarda hava veya gaz embolisi, doku yırtılması veya kompresyona neden olan gazsıkışması riski bulunmaktadır. Virüs güvenlii TİSSEEL, insan plazmasından elde edilmektedir. İnsan plazmasından elde edilen ilaçlar, virüsler ve teorik olarak Varyant Creutzfeldt-Jacob (v-CJD) gibi, çeşitli hastalıklara yol açabilenenfeksiyon yapıcı ajanlar içerebilirler. TİSSEEL'de Varyant Creutzfeldt-Jacob hastalıınınbulaşma riski teorik olarak minimumken, klasik Creutzfeldt-Jacob hastalıının bulaşma riskihiçbir kanıtla desteklenmez. Alınan önlemlere ramen, bu tür ürünler halen potansiyel olarakhastalık bulaştırabilir. Bu tip ürünlerin enfeksiyon yapıcı ajanları bulaştırma riski, plazma verenlerin belirli virüslere önceden maruz kalıp kalmadıının izlenmesi, belirli virüs enfeksiyonlarının halihazırdavarlıının test edilmesi ve belirli virüslerin yok edilmesi ve/veya inaktivasyonu ile azaltılmıştır.Bütün bu önlemlere ramen, bu ürünler hala potansiyel olarak hastalık bulaştırabilirler. Ayrıca,henüz bilinmeyen enfeksiyon yapıcı ajanların bu ürünlerin içerisinde bulunma ihtimalimevcuttur. HIV, HBV, HCV gibi zarflı virüsler ve HAV gibi zarflı olmayan virüsler için etkili önlemlerin alınmasına dikkat edilmelidir. Parvovirüs B19 gibi zarflı olmayan virüslere karşı alınan tedbirlersınırlı sayıda olabilir. Parvovirüs B19 enfeksiyonu, gebelikte (fetal infeksiyon) ve immünyetmezlik ya da kırmızı kan hücre üretiminde artış olan hastalarda tehlikeli olabilir (hemolitikanemi gibi). Doktor, bu ilacı hastaya reçete etmeden veya uygulamadan önce hastası ile risk ve yararlarını tartışmalıdır. Ayrıca; TİSSEEL kullanılması gerekiyorsa hekim tarafından, hastalık yapıcı etkenlerin hastaya bulaşmasını önlemek için uygun aşıların (Hepatit A, Hepatit B vb.) yaptırılması önerilebilir. Hastalar açısından TİSSEEL her uygulandıında, hastayla ürünün seri numarası arasındaki balantının korunabilmesi için, ürünün adı ve seri numarası kaydedilmelidir.TİSSEEL'i ince bir tabaka oluşturacak şekilde uygulayınız. Fazla pıhtı kalınlıı ürünün etkinliini ve yara iyileşme sürecini olumsuz etkileyebilir.üu belge, güvenil eıeKironiK imza ne imzalanmıştır.D°FibHtf°yatf!ŞtırıcnarM^tfygtifanm^âsı^iÇin basınç'gdüzenfeyiCfpiÇefen^'^sprey-t'Cihazlaritetta kullanımı ile yasamı tehdit edici/ölümcül hava veya2az embolisi meydana2elmistir. Biolay, sprey cihazının önerilen basınçların çok üzerinde ve/veya doku yüzeyine yakın mesafede kullanımıyla ilişkili görünmektedir. Bu riskin fibrin vapıstırıcılann CO2yerine hava ile spreylendiinde daha yüksek olduu düşünülmektedir, DolayısıylaTİSSEEL açık yara cerrahisinde spreyleme yöntemi ile uygulandıında bu risk göz ardıedilemez.TİSSEEL'i sprey cihazı kullanarak uygularken, kullanılacak basınç düzeyi sprey cihazı üreticisi tarafından önerilen basınç aralıı dahilindeki olmalıdır (basınç ve mesafeleriçin Bölüm 6.6'daki tabloya bakınız).TİSSEEL sprey uygulaması sadece, üreticinin önerdii sprey mesafesini tam olarak belirlemek mümkünse kullanılmalıdır. Sprey tavsiye edilenden daha yakın mesafelerdekullanılmamalıdır.TİSSEEL'i spreyle uygularken, kan basıncı, nabız, oksijen satürasyonu ve soluk sonu karbondiaoksit (end tidal CO2) deerlerindeki deişimler, muhtemel hava veya gazembolisi yönünden (ayrıca Bkz. Bölüm 4.2) takip edilmelidir.TİSSEEL kapalı vücut boşlukları içinde Easy Sprey/Sprey Seti sistemleri ile kullanılmamalıdır. TİSSEEL'in uygulanmasından önce, istenmeyen bölgelerde doku yapışmasını önlenmek için belirlenen uygulama alanı dışında kalan vücut bölgelerinin yeteri şekilde korunmasına /örtülmesine dikkat edilmelidir. Fibrin yapıştırıcıların beyin ve omurilik gibi kapalı alanların içinde uygulandıı durumlarda basınca balı komplikasyon riski dikkate alınmalıdır. Protein içeren dier ürünlerde de olduu gibi, alerjik tipte aşırı duyarlılık reaksiyonları mümkündür. TİSSEEL kullanımıyla aşırı duyarlılık ve anaflaktik reaksiyonlar (ve ayrıca anafilaktik şok dahil ölümcül reaksiyonlar) bildirilmiştir. Aşırı duyarlılık reaksiyonlarının belirtileriarasında kurdeşen, yaygın ürtiker, göüste sıkışma hissi, hırıltılı solunum ve hipotansiyonbulunur. Bu semptomlar ortaya çıkarsa uygulama derhal durdurulmalı ve şok tedavisi içingeçerli mevcut standart önlemler alınmalıdır. Uygulama alanında kalan ürüntemizlenmelidir. İntravasküler uygulama, duyarlı hastalarda aşırı akut duyarlılık reaksiyonlarının olasılıını ve şiddetini arttırabilir. TİSSEEL'e karşı gözlemlenen aşırı duyarlılık reaksiyonlarınınbelirtileri arasında şunlar yer alır:Bradikardi, taşikardi, hipotansiyon, kızarma, bronkospazm, hırıltılı solunum, dispne, bulantı, ürtiker, anjiyoödem, kaşıntı, eritem, parestezi. TİSSEEL ile anafilaktik şok da dahil olmak üzere ölümcül anafilaktik reaksiyonlarda bildirilmiştir (bkz. Bölüm 4.8). Aşırı duyarlılık reaksiyonunun ilk belirtisi veya semptomunda, TİSSEEL uygulaması durdurulmalı ve tıbbi müdahale yapılmalıdır. Kalan ürün uygulama bölgesindenkaldırılmalıdır. Oftalmik arter bölgesinde tromboembolik komplikasyonlara neden olabileceinden nazal mukozaya enj eksiyonundanJ,kaç|^||^allı^=ıJronik imza ile imzalanmıştır. TİSSEEL sentetik protein (aprotinin) içermektedir. Aprotinin varlıına balı olarak lokal uygulamada dahi anaflaktik reaksiyon riski vardır. Daha önceki uygulamalarda iyi tolereedilmiş olsa bile tekrarlayan uygulamalarda risk daha yüksektir. Bu nedenle, aprotinin veyaaprotinin içeren ürün uygulamaları hastanın dosyasına (kayıtlarına) işlenmelidir. Sentetik aprotinin yapısal olarak bovin (sıır) aprotinin ile aynı olduundan, TİSSEEL'in bovin proteinlerine alerjisi olan hastalarda kullanımı dikkatle deerlendirilmelidir. Şok durumunda, şok için standart tıbbi müdahale yapılmalıdır. Fibrin yapıştırıcılar kapalı alanlarda uygulanıyorsa, kompresif komplikasyon riski dikkate alınmalıdır. TİSSEEL sadece ince bir tabaka olarak uygulanmalıdır. Fazla pıhtı kalınlıı ürünün etkinliini ve yara iyileşmesi sürecini olumsuz etkileyebilir. İnsan kanı veya plazmasından üretilen tıbbi ürünlerin kullanımından kaynaklanan enfeksiyonları önlemeye yönelik standart tedbirler, donör seçimini, enfeksiyonun özgül(spesifik) belirteçlerine karşı plazma havuzlarının ve bireysel baışların incelenmesi ilevirüslerin inaktivasyonuna/yok edilmesine yönelik etkin üretim adımlarının dâhil edilmesiniiçermektedir. Bu tedbirlere ramen, insan kanı veya plazmasından hazırlanan tıbbi ürünlerverildiinde, enfeksiyöz ajanların bulaşması ihtimali tamamen ortadan kaldırılamaz. Bu,bilinmeyen veya yeni ortaya çıkan virüsler ve dier patojenler için de geçerlidir. Alınan tedbirlerin, insan immün yetmezlii virüsü (HIV), hepatit B virüsü (HBV) ve hepatit C virüsü (HCV) gibi zarflı virüsler ve zarfsız hepatit A virüsü (HAV) için etkili olduudüşünülmektedir. Alınan tedbirler, parvovirüs B19 gibi zarfsız virüslere karşı sınırlı deerde olabilir. Gebe kadınlar (fötal enfeksiyon) için ve immün sistemi zayıflayan ya da artmış eritropoeze sahip(ör. hemolitik anemi) sahip olan kişiler için Parvovirüs B19 enfeksiyonu ciddi olabilir. İnsan plazması türevli fibrin yapıştırıcıyı düzenli olarak/tekrarlayan şekilde alan hastalar için uygun aşılama (hepatit A ve B) düşünülmelidir. TİSSEEL hastaya her uygulandıında, hasta ile ürün partisi arasında bir balantı oluşturabilmek amacıyla ürünün adı ve üretim partisi numarasının kaydedilmesi kesinlikleönerilmektedir. Polisorbat 80 dermatiti gibi lokal olarak sınırlı cilt tahrişlerine neden olabilir. Okside selüloz içeren preparatlar TİSSEEL ile birlikte kullanılmamalıdır(Bkz. Bölüm 6.2). Kanama tedavisi veya damar cerrahisi için esnek bir endoskop aracılııyla uygulamada buürünün kullanımını desteklemek için yeterli veri mevcut deildir. 4.5. Dier tıbbi ürünler ile etkileşimler ve dier etkileşim şekilleriEtkileşim çalışmaları yapılmamıştır. Karşılaştırılabilir ürünler veya trombin çözeltilerine benzer olarak ürün alkol, iyot, ya da aır metal iyonları içeren çözeltilerle (örn. antiseptikçözeltilerle) denatüre olabilir. Bu tür maddeler, ürün uygulanmadan önce mümkünolduunca temizlenmelidir. Belge Doica(Bkz\\Bölümi 6.2.)ÖFyYnUyMOFyZlAxZlAx Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys Özel popülasyonlara ilişkin ek bilgiler Pediatrik popülasyon:Pediatrik popülasyonda hiçbir etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: C Çocuk dourma potansiyeli bulunan kadınlar/Doum kontrolü (Kontrasepsiyon)TİSSEEL'in çocuk dourma potansiyeli bulunan kadınlarda kullanımına ilişkin yeterli veri mevcut deildir. Gebelik dönemiTİSSEEL'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut deildir. Hayvanlar üzerinde yapılan çalışmalar gebelik / ve-veya / embriyonal / fötal gelişim / ve-veya / doum / ve-veya / doum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlarayönelik potansiyel risk bilinmemektedir. TİSSEEL gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Fibrin yapıştırıcıların/hemostatiklerin insan gebelii esnasında kullanımına ilişkin güvenlilii, kontrollü klinik çalışmalarda ortaya konulmamıştır. Deneysel hayvan çalışmaları, üreme,embriyo veya fötüs gelişimi, gebeliin ilerleyişi ve doum öncesi ve sonrası gelişim bakımındangüvenlilii deerlendirmek için yeterli deildir. İnsanlara yönelik potansiyel riskbilinmemektedir. Bu nedenle ürün, hamile ve emziren kadınlarda sadece çok açık şekilde gerekliyse uygulanmalıdır. Parvovirüs B19 enfeksiyonu açısından bölüm 4.4'e bakınız. Laktasyon dönemiFibrin yapıştırıcıların/hemostatiklerin emzirme esnasında kullanımına ilişkin güvenlilii, kontrollü klinik çalışmalarda ortaya konulmamıştır. Deneysel hayvan çalışmaları, üreme,embriyo veya fötüs gelişimi, gebeliin ilerleyişi ve doum öncesi ve sonrası gelişimbakımından güvenlilii deerlendirmek için yeterli deildir. Bu nedenle ürün, emziren kadınlarda sadece çok açık şekilde gerekliyse uygulanmalıdır. Üreme yetenei/FertiliteHayvan üreme çalışmaları yürütülmemiştir. İnsanlardaki üreme yetenei / fertiliteyi etkileyip etkilemedii bilinmemektedir. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerinde bilinen bir etkisi bulunmamaktadır. 4.8. İstenmeyen etkilerFibrin yapıştırıcılar/hemostatiklerle tedavi edilen hastalarda seyrek olarak aşırı duyarlılık veya alerjik reaksiyonlar (bunlarla sınırlı kalmamak kaydıyla anjiyoödem, uygulama yerindeyanma ve sızı, bradikardi, feröftkospazmkititrfeme, iidi®pö©mg®çici eritem (flushing (kızarma)), taşikardi, göüste sıkışma, karıncalanma, kusma, hırıltılı solunum (wheezing) dahil) ortaya çıkabilir, anaflaktik reaksiyonlar ve anaflaktik şok ölümcül sonuçları da içermiştir. İzole olgularda bu reaksiyonlar ciddi anafilaksiye dönmüştür. Bu reaksiyonlar preparat ile tekrarlanan uygulamalarda ya da aprotinine (bkz. bölüm 4.4) veya dier herhangi birbileşenine aşırı duyarlılık gösterdii bilinen hastalara uygulanıyorsa görülebilir. TİSSEEL'in tekrar eden uygulaması iyi tolere edilmiş olsa bile, TİSSEEL'in sonraki bir uygulanması ya da sistemik aprotinin uygulanması şiddetli bir anafilaktik reaksiyonlasonuçlanabilir. Aşırı duyarlılık reaksiyonları durumunda, uygulama derhal durdurulmalıdır. Seyrek olarak vakalarda fibrin yapıştırıcı/hemostatik ürünlerin bileşenlerine karşı antikor gelişebilir. Kazayla intravasküler enjeksiyon, tromboembolik olaylara ve dissemine /yaygın intravasküler koagülasyona (DIC) neden olabilir. Dahası anaflaktik reaksiyon riskibulunmaktadır (Bkz. Bölüm 4.4). Hipersensitivite reaksiyonları olması halinde uygulamaya derhal son verilmelidir. Bulaşıcı (geçiş gösteren) ajanlar ile ilgili güvenlilik için bölüm 4.4'e bakınız. Bu bölümde sunulan advers reaksiyonlar, TİSSEEL'in güvenliliini ve etkililiini araştıran klinik çalışmalardan ve (aşaıdaki advers olay tablosunda p ile belirtilen) Baxter FıbrinYapıştırıcılar ile olan pazarlama sonrası deneyimden elde edilmiştir. Klinik çalışmalarda,TİSSEEL kardiyak, vasküler ve total kalça replasman cerrahilerinde hemostaza ek olarakuygulanmış ya da karacier ve dalak cerrahisinde kullanılmıştır. Dier klinik çalışmalararasında aksiller lenf düümü diseksiyonu uygulanan hastalarda lenf damarlarınınsızdırmazlıının salanması, kolon anastomozlarında sızdırmazlıın salanması ve posteriorfossa girişimlerinde duramater sızdırmazlıının salanması yer almaktadır. Pazarlama sonrası deneyimde gözlemlenen advers olayların sıklıı hesaplanamadıından, %95 güven aralıının üst limiti, "üç kuralı" kullanılarak aşaıdaki şekilde hesaplanmıştır:3/1146=0.0026 veya %0.26; Yaygın Olmayan (buradaki 1146, KÜB'e dâhil edilenverilerin alındıı klinik çalışmalarda TİSSEEL uygulanan olguların toplam sayısıdır) Sıklık aşaıdaki kriterlere göre deerlendirilmiştir. Çok yaygın (>1/10), Yaygın (>1/100 ila <1/10), Yaygın olmayan (>l/l.000 ila <1/100), Seyrek (>l/l0.000 ila <1/1.000), Çok seyrek (<1/10.000) Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Sınıf ReaksiyonlarıFibrin yapıştırıcı/hemostatik sınıf ile ilişkili dier advers reaksiyonlar şunları içerir: Basınçlı hava veya gazlı cihazları kullanırken hava veya gaz embolisi; bu olay, sprey cihazının önerilenden daha yüksek basınçlarda ve doku yüzeyine yakın bir yerdekullanılmasıyla ilgili görülmektedir. Uygulama yeri tahrişi, göüste sıkıntı, üşüme, baş arısı, letarji, huzursuzluk ve kusma olarak ortaya çıkabilecek aşırı duyarlılık reaksiyonlarının belirginleşmesi.
** Süperior petrosal sinüse intravasküler uygulamanın bir sonucu olarak. *** Dier fibrin yapıştırıcılarda olduu gibi basınçlı hava veya gazlı cihazlar kullanırken oluşan yaşamı tehdit edici/ölümcül hava veya gaz embolisi; bu durum, sprey cihazının uygun olmayan(ör. Önerilenden daha yüksek bir basınçta ve doku yüzeyine yakın bir mesafeden) kullanımıylailişkili görünmektedir. ^Pazarlama sonrası deneyimde gözlemlenen advers olaylar. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarmm raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak salar. Salık meslei mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9. Doz aşımı ve tedavisiHerhangi bir doz aşımı yakası bildirimi bulunmamaktadır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik Grubu: lokal hemostatikler, kombinasyonlar ATC kodu: B02BC30 Fibrin adezyon sistemi, fizyolojik kan pıhtılaşmasının son dönemini taklit eder. Fibrinojenin fibrin monomerleri ve fıbrinopeptidlere parçalanmasıyla fibrinojenin fıbrine dönüşümügerçekleşir. Fibrin monomerleri biraraya toplanır ve bir fıbrin pıhtısı oluşur. Trombinin vekalsiyum iyonlarının birlikte etkisiyle faktör XIII'den oluşan faktör XIIIa, fibrin liflerininçapraz balanmasıyla pıhtıyı stabilize eder. Yarada iyileşme süreci ilerlerken, plazmin uyarısıyla fıbrinolitik aktivite artar ve fibrinin fıbrin yıkım ürünlerine dönüşümü başlar. Fibrinin proteolitik yıkımı anti-fibrinolitiklerceinhibe edilir. TİSSEEL bileşiminde bulunan aprotinin bir anti-fibrinolitik olarak pıhtınınprematür yıkımını önler. Etkinlii kanıtlamak için gerçekleştirilen in vivoçalışmalarda hastaların durumunu mümkün olduunca yansıtan dört hayvan modeli seçilmiştir. Çalışmalarda TİSSEEL yaraiyileşmesinde olduu kadar primer ve sekonder hemostazın salanmasında da etkili olarakbulunmuştur.Hemostazdaki etkinlik kardiyopulmoner cerrahi, dalak cerrahisi ve beyin cerrahisinde gösterilmiştir. Yapışmayı/sızdırmazlıı salamak için doku yapıştırıcısı olarak veya sütür destei olarak kullanın: Gastrointestinal anastomozlar ve beyin omurilik sıvısı veya dura mater ile temasınmeydana gelebilecei beyin cerrahisi prosedürleri dahil olmak üzere ameliyatlarda etkinlikgösterilmiştir. En az 4.706 hastada hemostaz, sızdırmazlık ve doku yapışmasını gösteren klinik çalışmalar yapılmıştır. Bu çalışmalar, hemostaz (n=1300), gastrointestinal anastomozlar (n=1,114),beyin cerrahisi (n=511) dahil ancak bunlarla sınırlı olmamak üzere çok sayıda cerrahiuzmanlık, cerrahi prosedür ve uygulama tekniinde gerçekleştirilmiştir. Çeşitli açık ve laparoskopik tekniklerle inguinal, femoral ve insizyonel herni onarımı sırasında TİSSEEL'in meş fiksasyonunda kullanımını göstermek için 2625 hastada 21 açık vekarşılaştırmalı klinik çalışma da yapılmıştır. TİSSEEL, şu anda tercih edilen tüm cerrahiteknikleri kullanarak inguinal veya femoral herni onarımı sırasında meş fiksasyonunda en azzımba teli, tutturucu veya dikiş kadar etkili olmuştur. TİSSEEL, nüks oranlarına göredeerlendirildiinde en az insizyonel hernilerin onarımında etkili olmuştur. Ek olarak,kanıtlar, meş sabitleme yöntemleri arasında postoperatif komplikasyonlar açısından hiçbir fark olmadıını göstermiştiTi >Sirköç>çal¥şmadâ?^TİS8EEL'gfubunda postoperatif arı dü: ırulamaıKo.du: l.^]W56O4NRZ|lAxM0FyYnU'vM0FyZlAxZIAx . . Belge Takip Xaresi:https://www.turkiye.gov.tr/sagTık-titck-(önemli ölçüde daha düşük olarak gerçekleşmiştir. Belge Dodüzeyi ' ' ebys
Çocuklarda kalp cerrahisi sırasında sınırlı deneyim vardır (yaş 4-134 ay: n=14). TİSSEEL, paralel olarak dizayn edilmiş, prospektif randomize, çift kör, çok merkezli bir klinik çalışmada, kardiyopulmoner baypas ve medyan sternotomi uygulanması gereken 317kardiyak cerrahi hastasında, ürünün tek virüs inaktivasyon yapılmış eski formülasyonu ilekarşılaştırılarak deerlendirilmiştir. Hastalar, yalnızca konvansiyonel yöntemlerle hemostazsalanamadıı durumlarda, TİSSEEL ile ya da kontrol preparatıyla tedavi edilmiştir.Sonlanım noktası olarak hemostazın ilk 5 dakika içinde salanması ve yara yerinin cerrahiolarak kapatılmasına kadar devam etmesi alınmıştır. Tek taraflı %97.5 güvenlik aralıı kullanılarak ölçülen sonuçlara göre, başarıyla tedavi edilenlerde TİSSEEL (çift virüs inaktivasyonu yapılmış), önceki formülasyondan (tek virüsinaktivasyonu yapılmış) daha başarısız bulunmamıştır.
TİSSEEL'in kalça eklem replasmanında postoperatif kan kaybı için kullanıldıı bir çalışma ile aksiller bölge lenf düümü diseksiyonunda aksiller drenaj süresini kısaltmak içinkullanıldıı bir çalışmada, TİSSEEL almayan kontrol grubuyla arasında bir farkbulunamamıştır. 5.2. Farmakokinetik özelliklerGenel özelliklerTİSSEEL sadece epilezyonel kullanıma yöneliktir. İntravasküler uygulanması kontrendikedir. Dolayısıyla insanda intravasküler farmakokinetik çalışmalar yapılmamıştır. Deişik tür laboratuvar hayvanlarında farmakokinetik çalışmalar gerçekleştirilmemiştir. Fibrin yapıştırıcılar/hemostatikler endojen fibrin ile aynı yolla fibrinoliz ve fagositoz aracılııyla metabolize olurlar. TİSSEEL'den sistemik yararlanım yoktur. Emilim:Yerel olarak TİSSEEL uygulanan vücut bölgelerinden vücut sıvı ve dokularına emilim olmaz. Daılım:Vücutta karacierden doal olarak üretilen fıbrinojen en youn olarak plazmada bulunur. Kan plazmasının yaklaşık %5'i fıbrinojendir. Plazmadaki fibrinojen miktarı yaklaşık olarak5 g/litre'dir. Fibrinojen sadece kan plazmasında deil, aynı zamanda çeşitli vücut sıvılarındada (lenf sıvısı, iltihabi sıvı birikintileri vb) bulunur. Belge Dorulama Kodu: lZW56Q3NRZlAxM0FyYnUyM0FyZlAxZlAx Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys
Kanı pıhtılaştıran bir protein olan trombin normalde vücut sıvılarında bulunmaz. İhtiyaç halinde karacierde üretilen protrombinin enzimatik yıkımıyla oluşur ve fibrinojeni fibrineyani suda erimeyen haline dönüştürür. Aprotinin vücutta doal olarak üretilmez ve bulunmaz. Sıır kaynaklı aprotinin intravenöz yoldan uygulandıında plazma yarılanma süresinin yaklaşık 150 dakika olduu ve terminalyarılanma süresinin ise yaklaşık 10 saat olduu bilinmektedir. Biyotransformasyon:Trombinin etkisiyle fibrinojenin fıbrine dönüşümü sonucu oluşmuş fıbrin monomerleri bir araya toplanır ve fibrin pıhtısı oluşur. Fibrin liflerinin çapraz balanmasıyla sabitleşenpıhtıdaki fibrin ise daha sonra yani pıhtıya artık gerek kalmadıı zaman fibrin yıkımürünlerine dönüşür. Karacierde metabolize edilen fibrin yıkım ürünleri ise böbreklerdenatılır. Vücuda dışarıdan uygulanan aprotinin lizozomal emzimler tarafindan yavaş bir yıkıma urarlar. Eliminasyon:Fibrin yıkım ürünleri böbreklerden elimine olmaktadır. Tek bir intravenöz doz radyoaktif işaretli aprotinin uygulanması sonrası, radyoaktivitenin yaklaşık %25-40 kadarı idrarla elimine edilmiştir. Bir milyon KIU aprotininin 30 dakikadainfiizyonu sonrası yaklaşık %2'si, 2 milyon KIU'luk daha yüksek bir doz aprotininin 30dakikada infüzyonu sonrası ise yaklaşık %9'u idrarla deişmeden atılmaktadır. Dorusallık / Dorusal olmayan durum:Veri bulunmamaktadır. 5.3. Klinik öncesi güvenlilik verileriÖzel uygulama yöntemi (genellikle tek, sadece istisnai durumlarda birkaç ml'lik tekrar eden uygulama) ve etki mekanizmasının (dier organ ve dokulara sistemik etki ya da daılımolmaksızın lokal etki) yanı sıra doası gerei, TİISSEEL'in kronik toksisite, karsinojenite,üreme ve gelişim toksisitesi veya immün stimülasyonu üzerine klinik öncesi güvenlilik verisibulunmamaktadır. Sıçan ve tavşanlarda yapılan tek doz toksisite çalışmalarında TİSSEEL akut toksisiteye neden olmamıştır. Ayrıca, uygun in vitro testlerde hiçbir mutajenisite kanıtı görülmemiştir.Yapıştırıcı protein çözeltisi de mükemmel hücresel uygunluk ve non-sitotoksisite göstererekin vitro insan fibroblast kültürlerinde iyi tolere edilmiştir. Detaylı literatür incelemesi temelalındıında, çözücü/deterjan kalıntılarının TİSSEEL üzerindeki negatif etkisinin veyatoksisitesinin ihmal edilebilir düzeylerde olduu kabul edilmektedir. 6. FARMASOTIK ÖZELLİKLER6.1. Yardımcı maddelerin listesi
in 1: Yapıştırıcı Protein Çgzelffsi*:^ Kodu: lZW5öQ3NRZlAxM0FyYnOyM0FyZlAxAlbumini: ^3NRZlAxMuFyYnÜyMuFyZlAxZlAx Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysBileşen Belge Dorulama ^İnsan
L-Histidin  Niyasinamid Polisorbat 80 (Tween 80) Sodyum Sitrat Dihidrat Enjeksiyonluk Su Bileşen 2: Trombin Çözeltisi:İnsan Albumini Sodyum KlorürEnjeksiyonluk Su 6.2. GeçimsizliklerDüşük pH trombin aktivitesini etkileyebileceinden, okside selüloz içeren preparatlar TİSSEEL ile birlikte kullamlmamalıdır. Yapıştırıcı protein ve trombin çözeltisi alkol, iyot veya aır metaller içeren çözeltilerle temas ederse denatüre olabilir. Bu tıbbi ürün bölüm 6.6'da bahsedilenlerin dışındaki dier ilaçlarla karıştırılmamalıdır. 6.3. Raf ömrü24 ay. 6.4. Saklamaya yönelik özel tedbirlerÇocukların göremeyecei ve erişemeyecei yerlerde saklayınız. Dondurucuda ( -20°C) saklayınız. Kullanılıncaya kadar souk zincir kırılmamalıdır. Işıktan korumak için TİSSEEL'i kutusu içinde saklayınız. Bir kez çözüldükten sonra ürün 25°C geçmeyen sıcaklıklarda 72 saat içinde saklanabilir ve bu süre içinde kullanılmalıdır. Bir kez çözüldükten sonra yeniden dondurmayınız ya dabuzdolabında saklamayınız. 6.5. Ambalajın nitelii ve içeriiHem Yapıştırıcı Protein Çözeltisi, hem de Trombin Çözeltisi tek kullanımlık çift hazneli polipropilen enjektör içinde yer alır. TİSSEEL ambalajı içinde şu bileşenler bulunmaktadır: - Bir adet tek kullanımlık çift hazneli polipropilen enjektör (bölmelerden birinde 2 mLderin dondurulmuş Yapıştırıcı Protein Çözeltisi, dierinde 2 mL derin dondurulmuşTrombin Çözeltisi). - Bir uygulama cihazı: 2 birleştirme parçası, 4 uygulama kanülü (künt uçlu). 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve dier özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmelii ve Ambalaj Atıkları Kontrolü Yönetmeliine uygun olarak imha edilmelidir. GenelTİSSEEL uygulanmasından önce, uygulama istenen alan dışındaki vücut alanının korunarak istenmeyen adezyonların oluşması önlenmelidir. TİSSEEL'in eldiven ve aletlere yapışmasını önlemek için buralar %0.9'luk sodyum klorür çöze]tisi i]e U^İAtllmaJldrr elektronik imza ile imzalanmıştır.
Yapıştırılacak yüzeyler için bir rehber olmak üzere 1 kutu TİSSEEL 2 mL (1 mL yapıştırıcı protein çözeltisi artı 1 mL trombin çözeltisi) en az 10 cm2 lik bir alan için yeterli olacaktır. Kullanılacak doz uygulama alanının genişliine göre deişir. TİSSEEL'in iki bileşenini (yapıştırıcı protein çözeltisi ve trombin çözeltisi) ayrı ayrı UYGULAMAYIN. Her iki bileşen birlikte uygulanmalıdır. TİSSEEL'i, 37°C'nin üzerindeki sıcaklıklara MA^UZ BIRAKMAYIN. Çözme/ısıtma için mikrodalga fırın KULLANMAYIN. Ürünü elleriniz arasında tutarak çözmeye ÇALIŞMAYIN. Kullanıma hazırlamaHem yapıştırıcı protein çözeltisi hem de trombin çözeltisi, tek kullanımlık çift hazneli bir enjektörde bulunur. Önceden doldurulmuş çift hazneli enjektörün aızlıkları bir uç kapaı ile veenjektörün her bir ucu bir silikon kauçuk tıpa ile kapalıdır. Tüm bileşenler, aseptik koşullaraltında iki adet steril torba içine, hava geçirmez şekilde yerleştirilir. Dış ambalaj hazargörmedii sürece, iç torba ve içerii steril kalır. Steril teknik kullanarak steril iç torba ve içindekiler steril alana alınmalıdır. Kullanıma hazır enjektör, aşaıdaki yöntemlerden biri kullanılarak çözülebilir ve ısıtılabilir:1. Hızlı çözme/ısıtma (steril su banyosu) - Önerilen yöntem2. Steril olmayan bir su banyosunda çözme/ısıtma 3. Bir inkübatörde çözme/ısıtma 4. Kullanıma hazır enjektör ayrıca oda sıcaklıında (25°C'yi geçmeden) çözülebilir ve 72 saatekadar saklanabilir. Kullanmadan önce ısıtmak gereklidir. 1. Hızlı çözme/ısıtma (steril su banyosunda) - Önerilen yöntemİki bileşenli yapıştırıcının çözülmesi ve ısıtılması işleminin 33 - 37°C arası sıcaklıkta steril su banyosuyda yapılması önerilir. - Su banyosunun sıcaklıı 37°C'yi geçmemelidir. (Su banyosunun sıcaklıının bu sıcaklıklararasında tutulması için bir termometre aracılııyla izlenmeli ve gerektiinde içindeki sudeiştirilmelidir). - Çözme ve ısıtma için steril su banyosu kullanılırken, önceden doldurulmuş enjektör steril subanyosuna koymadan önce torbalardan çıkarılmalıdır. Talimatlarİç torbayı steril ortama getiriniz. Kullanıma hazır enjektörü iç torbasından çıkararak dorudan steril su banyosuna koyunuz. Kullanıma hazır enjektör içeriinin tümüyle su içinde kaldıındanemin olunuz. 
2. Steril olmayan bir su banyosunda çözme/ısıtmaTalimatlarKullanıma hazır enjektörü iç ve dış torbası içinde kalacak şekilde steril olmayan alanda yer alan su banyosunda belirtilen uygun sürelerle tutunuz (Bkz. Tablo 2). Çözme işlemi boyuncatorbaların su içinde kaldıından emin olunuz. Çözüldükten sonra torbayı su banyosundançıkararak dışını kurulayınız ve kullanıma hazır enjektörün bulunduu iç torbayı steril alanagötürünüz.
3. Bir inkübatörde çözme/ısıtmaTalimatlarKullanıma hazır enjektörü iç ve dış torbası içinde kalacak şekilde steril olmayan alanda yer alan bir inkübatörde belirtilen uygun sürelerle tutunuz (Bkz. Tablo 3). Çözme/ısıtma sonrasındatorbayı inkübatörden çıkarın, dış torbayı çıkarıp, kullanıma hazır enjektörün bulunduu içtorbayı steril alana götürünüz.
4. Isıtmadan ÖNCE oda sıcaklıında çözme (+25°C'yi aşmayan):TalimatlarKullanıma hazır enjektörü iç ve dış torbası içinde kalacak şekilde uygun süre boyunca (Bkz. Tablo 4) steril olmayan alanda oda sıcaklıında tutun. Ürün oda sıcaklıında çözüldükten sonra, kullanımdan hemen önce dış torbası içerisinde inkübatörde ısıtılmalıdır. , Bu hel^e . .Üsüffi KdflPdurucudagı Açı,karılöiktanyzv.ezo.öa sıcakiıııflfia Açözüldüktentuı$onra.tr72iis-%ftt-ei,çindeflPdurucudagı Açı,karılöiktanyzv.ezo.öa sıcakiıııflfia Açözüldüktentuı$onra.tr72iis-%ftt-ei,çindeBelge Do
kullanılmalıdır. 
Çözüldükten sonra stabiliteÇözme ve ısıtmayapıldıktan sonra (yani 33 - 37°C arasındaki sıcaklıklarda, 1, 2 ve 3 numaraları yöntemler kullanıldıında) 33 - 37°C'de arasında en fazla 12 saat boyunca kimyasalve fiziksel olarak stabildir.TİSSEEL'in açılmamış torbada oda sıcaklıında çözülmesi durumunda (4 numaralı yöntem), 25°C'den fazla olmayan sıcaklıklarda 72 saat boyunca kimyasal ve fiziksel olarak stabildir.Kullanmadan hemen önce 33°C ila 37°C arası sıcaklıa ısıtılmalıdır. Mikrobiyolojik açıdan, açma/çözme yöntemi mikrobiyal kontaminasyon risklerini ortadan kaldırmıyorsa, ürün 33°C ila 37°C'ye ısıtıldıktan hemen sonra kullanılmalıdır. Hemen kullanılmadıı takdirde, kullanımdaki saklama süreleri ve koşulları kullanıcının sorumluluundadır. Çözme işlemi başladıktan sonra tekrar dondurmayın veya soutmayın. İki çözeltinin optimal karışımını ve fibrin yapıştırıcının optimal katılaşmasını salamak için, iki yapıştırıcı bileşenini uygulamaya kadar 33°C - 37°C'de tutun. Uygulamaİki çözeltinin en uygun şekilde karıştırılması için , her iki bileşenin de kullanımdan hemen önce 33 - 37 °C arası sıcaklıa ısıtılmasıgerekmektedir. Yapıştırıcı protein ve trombinçözeltileri berrak ya da hafif opelasan olmalıdır. Bulanık olan ya da partikül içeren çözeltilerikullanmayınız. Çözülmüş ürünlerin kullanmadan önce partikül içerip içermedii, renk deiştiripdeiştirmedii ya da görünümünde herhangi bir deişiklik olup olmadıı kontrol edilmelidir.Bunlardan herhangi biri görüldüünde ürün kullanılmadan atılmalıdır.Çözülmüş yapıştırıcı protein çözeltisi hafif visköz sıvı halde olmalıdır. Çözeltinin kıvamı katılaşmış jöle gibiyse, denatüre olduu varsayılmalıdır (örnein souk zincirde olan birkırılmaya balı olarak veya ısıtma sırasında aşırı sıcaklıa maruz kalma sonucu). Bu durumdaTİSSEEL kullanılmamalıdır. - Enjektörü, kullanımdan kısa bir süre önce her iki torbadan çıkarın. - TİSSEEL'i yalnızca tamamen çözülüp ve ısıtıldıında (sıvı kıvamında) kullanın. - Koruyucu kapaı, uygulamadan hemen önce enjektörden çıkarın. Uç kapaının enjektörden çıkarılmasını kolaylaştırmak için kapaı ileri-geri hareket ettirerek sallayın, ardından koruyucu kapaı enjektörden çekip çıkarın. TİSSEEL uygulaması için kullanıma hazır çift bölmeli enjektörü ürünle birlikte verilen aksesuar cihazları ile kullanın. Uygulama talimatlarıUygulama için ürünle birlikte verilen cihaz seti içindeki birleştirme parçası ve uygulama kanülü, yapıştırıcı protein çözeltisi ve trombin çözeltisi içeren çift hazneli kullanıma hazır enjektöretakılır. Çift hazneli enjektörün ortak pistonu, iki çözeltinin eşit hacimlerinin birleştirme parçası vasıtasıyla uygulama kanülüne girmesini, burada karıştırılmalarını ve ardından uygulanmalarınısalar. Belge Dorulama Kodu: lZW56Q3NRZlAxM0FyYnUyM0FyZlAxZlAx Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys
Herhangi bir uygulama cihazını takmadan önce enjektördeki tüm havayı boşaltın. Balantı parçasını ve ipi enjektörün kenarına balama kayışı delii ile hizalayın. Balantı şeridi çift hazneli enjektöre iliştirilerek, birleştirme parçası sabitlenir. o Balantı parçasını çift hazneli kullanıma hazır enjektöre balayarak sabitleyin. o Şeridin kopması durumunda yedek birleştirme parçası kullanılır.o Yedek parçadaki şeridin de kopması durumunda ürün yine de kullanılabilir amasızıntı olmaması için balantının salamlıı iyice kontrol edilmelidir.o Birleştirme parçasının içinde kalan havayı ÇIKARMAYIN. Birleştirme parçasına bir uygulama kanülü yerleştirin. o Uygulama kanülünün tıkanmaması için birleştirme parçası ve uygulama kanülü içindeki havayı uygulamaya başlamadan hemen öncesine kadar çıkarmayınız. TİSSEEL uygulanmadan önce yara yüzeyi standart tekniklerle (örn. aralıklı kompres, sürüntü uygulaması, aspirasyon cihazlarının kullanımı) kurutulmalıdır. Alanı kurutmak için basınçlı havaveya gaz kullanmayınız. Karıştırılmış yapıştırıcı protein - trombin çözeltisini uygulanacak yüzeye veya yapıştırılacakparçaların yüzeylerine ortak pistonun arkasına yavaşça bastırarak uygulayın. Minimal hacimde fibrin yapıştırıcı kullanımı gerektiren cerrahi prosedürlerde, ürünün ilkbirkaç damlasının dışarı atılması önerilir. TİSSEEL uygulandıktan sonra yeterli polimerizasyonun salanması için en az 2 dakikabekleyin. Sprey uygulamasıTİSSEEL'i sprey cihazı kullanarak uygularken, sadece aşaıda belirtildii şekilde cihazın üreticisi tarafından önerilen basınç ve dokuya olan uzaklık aralıkları dahilindekullandıınıza emin olunuz.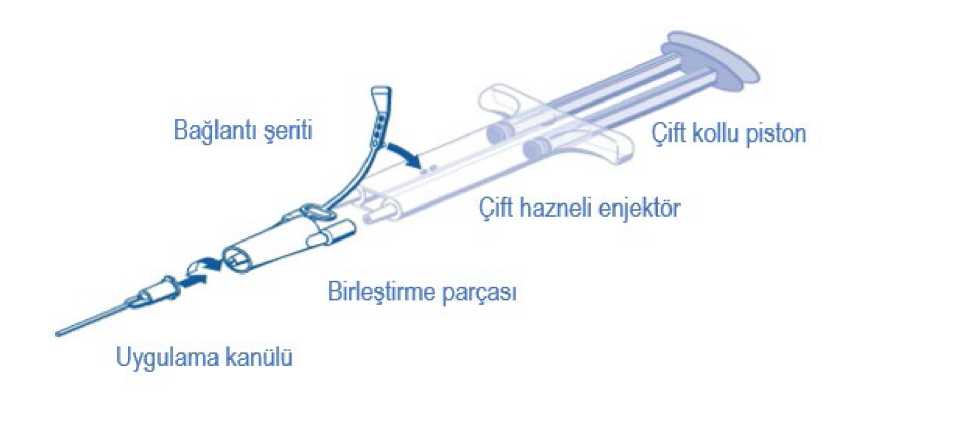 
TİSSEEL'i sprey cihazı kullanarak uygularken, hava veya gaz embolisi oluşma ihtimali nedeniyle kan basıncı, nabız, oksijen saturasyonu ve solunum sonu (end-tidal) CO2düzeylerindeki deişimler izlenmelidir (Bkz bölüm 4.2 ve 4.4). Artan ürünün atılması
ve
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmelii" Ambalaj Atıkların Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHIBIBaxter Turkey Renal Hizmetler A.Ş. Sarıyer/İstanbul 8. RUHSAT NUMARASI:2020/85 9. İLK RUHSAT TARIHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 16.04.2020 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLEME TARİHİBelge Dorulama Kodu: lZW56Q3NRZlAxM0FyYnUyM0FyZlAxZlAx Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys |
İlaç BilgileriTisseel 4 Ml Çözelti İçeren Kullanıma Hazır EnjektörEtken Maddesi: İnsan Fibrinojeni, Aprotinin, Insan Trombini, Kalsiyum Klorür Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.



