Foster Nexthaler 200/6 Mcg Kuru Toz İnhaler Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERI TIBBI URUNUN ADIFOSTER NEXTHALER 200/6 mcg kuru toz inhaler 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeler:10 mg'lık her bir ölçülü dozda: Anhidröz beklometazon dipropiyonat (BDP)..................200 mikrogram (158,8 mikrogram aktarılan doz) Formoterol fumarat dihidrat......................................6 mikrogram (4,9 mikrogram aktarılan doz) Yardımcı madde:Laktoz monohidrat (sığırdan elde edilen peynir mayasından üretilmiştir)....................9,8 mg Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon tozu. Çoklu ölçülü doz beyaz/beyazımsı kuru toz içeren inhaler 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarUzun etkili beta 2-agonist+inhale kortikosteroid kombinasyonları ile tedavilerde olduğu üzere FOSTER, astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır.Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren endikedir. 4.2 Pozoloji ve uygulama şekliFOSTER NEXTHALER sadece inhalasyon yolu ile uygulanır. Pozoloji:FOSTER NEXTHALER ile tedavi bireyseldir ve tedavi dozu, hastalığın bireydeki şiddetine göre ayarlanmalıdır. Bu uygulama sadece kombinasyon tedavisi başlangıcında değil, doz ayarlamasısırasında da uygulanmalıdır. Eğer hasta, bu kombinasyon inhalerindeki dozlardan daha farklıtedavi dozlarına ihtiyaç gösteriyorsa, hastaya beta 2-agonistler ve/veya kortikosteroidlerin uygundozunu içeren bireysel inhalerler reçetelenmelidir.Ekstra ince olmayan partikül dağılımına sahip bir formülasyondan, FOSTER NEXTHALER tedavisine geçildiğinde, Nexthaler'ın ekstra ince partikül büyüklüğü dağılımından dolayıhastalarda doz ayarlaması yapılması gereklidir. Hastaların daha önce almakta olduğu tedavideğiştirildiğinde, FOSTER NEXTHALER için önerilen günlük toplam beklometazondipropiyonat dozunun beklometazon dipropiyonat içeren ve ekstra ince olmayan mevcut ürüniçin verilen dozun altında olmasına ve dozun her bir hastanın ihtiyacına göre ayarlanmasınadikkat edilmelidir. Uygulama sıklığı ve süresi:18 yaş ve üstü erişkinler için doz önerileriAstım:Günde iki kez iki inhalasyon halinde uygulanır. Maksimum günlük doz dört inhalasyondur. Hastalar, tedavinin etkililiği açısından doktor tarafından düzenli olarak değerlendirilmelidir. Böylece kullanılan FOSTER NEXTHALER dozu en uygun doz olarak devam eder ve yalnızcadoktor tavsiyesiyle değiştirilir. Tedavi dozu, semptomların etkili bir şekilde kontrol edildiği endüşük doza ayarlanmalıdır. Semptomlar tavsiye edilen en düşük dozla kontrol edildiğinde, birsonraki adım inhale kortikosteroidin tek başına kullanılması olabilir. Tedaviye daha düşük bir dozla devam edilmesi gerektiğinde, aynı Nexthaler cihazında daha düşük dozda beklometazon dipropiyonat içeren Foster Nexthaler 100 mcg/6 mcg Kuru Tozİnhaler kullanılabilir. Hastalara, asemptomatik olduklarında dahi düzenli olarak önerilen dozdaki FOSTER NEXTHALER'ı kullanmaları tavsiye edilmelidir. Uygulama şekli:FOSTER NEXTHALER, inspirasyon ile aktive edilen bir kuru toz inhalerdir. Orta ve ağır şiddetli astım hastalarının, Nexthaler'dan dozun serbest bırakılmasını tetikleyecek yeterliinspiratuar akımı sağlayabildikleri gösterilmiştir (bkz. Bölüm 5.1). FOSTER NEXTHALER'dandoz alımı için gerekli hava akımı oluşumu, ilgili hasta popülasyonlarının inspiratuvar hava akımıoluşturabilme yeteneklerinden bağımsızdır. Tedavinin başarılı olması için Nexthaler inhalerinin doğru kullanılması gerekir. Hastalara Kullanma Talimatını dikkatli bir şekilde okumaları ve kullanım talimatlarına uymaları tavsiyeedilmelidir. FOSTER NEXTHALER'm doğru bir şekilde kullamlmasma yönelik açıklamalarkolaylık olması bakımından kullanım talimatları, Bölüm 6.6'da bulunmaktadır. Hastalar, inhaler cihazdan ilacı solurken mümkünse dik vücut pozisyonunda ayakta durmalı veya oturdukları durumda sırtlarını dik pozisyonda tutmalıdırlar. FOSTER NEXTHALER'dan doz alımı, kapalı olan kapağın tamamen açılması ile mümkündür ve soluma ağızlığından olabildiğince hızlı ve derin inspirasyon ile gerçekleşir. Doz solunduktanve kapak kapatıldıktan sonra doz sayacı penceresindeki kadranda sayısal eksilme görülecektir.Ardışık olarak alınacak dozlarda, tekrar dozunun alınabilmesi için kapak tekrar açılmalı, solumaağızlığından doz inspire edilmeli ve kapak kapatılmalıdır. Hastanın, inspirasyon sonrasındakapağı her zaman tamamen kapatması gerektiğine dair bilgilendirilmesi gereklidir. Eğer kapakaçılır, inhaler ağızlığından soluma yapılmaz ve kapak kapatılırsa, solunacak doz rezervuara geriçekilecek ve doz sayacı penceresinde sayısal azalma olmayacaktır. Kapak tekrar tamamenaçıldığında doz güvenle solunabilir konuma gelecektir. Hastalar, kapağın sadece gerekli durumdaaçılması konusunda uyarılmalıdır. Akciğerlere optimum doz ulaşmasını sağlayabilmek için doz ağızlığından hızlı ve derin bir nefes çekilmelidir. Doz solunduktan sonra nefesin 5-10 saniye veya hastanın kendini rahat hissettiğisüre boyunca tutulması ve sonrasında yavaşça burnundan nefes vermesi önerilmelidir. Hastalar, soluma öncesinde veya sonrasında Nexthaler cihazı içine nefes vermemeleri konusunda -cihaz performansı etkileneceğinden- uyarılmalıdırlar. Doz alımı sonrasında hastaların su ile ağızlarını çalkalamaları veya dişlerini fırçalamaları hatırlatılmalıdır (bkz. Bölüm 4.4). Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Böbrek ve karaciğer yetmezliği olan hastalarda FOSTER NEXTHALER kullanımına ilişkin veri bulunmamaktadır (bkz. Bölüm 5.2). Pediyatrik popülasyon:FOSTER NEXTHALER çocuklar ve 18 yaş altındaki ergenlerde kullanılmamalıdır. Geriyatrik popülasyon:Yaşlılarda doz ayarlanması gerekli değildir. 4.3 KontrendikasyonlarBeklometazon dipropiyonat, formoterol fumarat dihidrat ve/veya ürün içeriğindeki maddelerden herhangi birine (bkz. Bölüm 6.1) karşı bilinen aşırı duyarlılık halinde FOSTER NEXTHALERkontrendikedir. 4.4 Özel kullanım uyarıları ve önlemleriTedavi sonlandırılacaksa, tedavi dozunun tedrici olarak azaltılarak sonlandırılması tavsiye edilir. Tedavi ani olarak sonlandırılmamalıdır. Astım tedavisi, basamaklı bir tedavi programım takip etmelidir ve belli aralıklarla hastanın tedaviye verdiği yanıt, akciğer fonksiyon testleri ile klinik açıdan değerlendirilmelidir. Hasta tedaviyi etkisiz bulursa sağlık kurumuna başvurmalıdır. Kurtarıcı bronkodilatörlerin kullanımmın artması altta yatan hastalığın kötüleştiğine işaret eder ve bu durumda astımtedavisinin yeniden değerlendirilmesi gerekir. Astım kontrolünde ani ve ilerleyici bir bozulmapotansiyel olarak hayatı tehdit eder niteliktedir ve bu durumda hasta acil olarak tıbbideğerlendirmeden geçirilmeli, gerek inhale gerekse oral kortikosteroidler ile tedavininarttırılması gerekliliği veya enfeksiyon varsa antibiyotik ihtiyacı değerlendirilmelidir. Hastalığın alevlenme dönemlerinde veya astımın akut olarak kötüleştiği durumlarda FOSTER NEXTHALER tedavisine başlanmamalıdır. FOSTER NEXTHALER ile yapılan tedavi esnasındaastımla ilişkili ciddi advers olaylar ve alevlenmeler ortaya çıkabilir. Hastalardan tedaviye devametmeleri ancak FOSTER NEXTHALER başlandıktan sonra astım semptomları hala kontroledilemiyor veya kötüleşiyorsa doktora başvurmaları istenmelidir. Diğer inhalasyon tedavilerinde olduğu gibi, doz alımı sonrasında hırıltılı solunum, öksürük ve nefes darlığında ani bir artışla beraber paradoksal bronkospazm gelişebilir. Bu durumda, hızlıetkili bir inhale bronkodilatör uygulanmalıdır. FOSTER NEXTHALER alımı hemen kesilmeli,hasta değerlendirilmeli ve gerekirse alternatif bir tedaviye başlanmalıdır. FOSTER NEXTHALER, astımın başlangıç tedavisi için uygun değildir. Akut astım ataklarının tedavisi için hastalara her zaman kısa etki süreli kurtarıcı bronkodilatörlerini yanlarında bulundurmaları tavsiye edilmelidir. Hastalara, asemptomatik oldukları durumda dahi reçete edildiği şekilde düzenli olarak FOSTER NEXTHALER'ı kullanmaları gerektiği hatırlatılmalıdır. Astım semptomları kontrol altına alındığında, FOSTER NEXTHALER dozu kademeli olarak azaltılmalıdır. Tedavide alt basamaklara doğru inildikçe hastaların düzenli olarak kontroledilmeleri önem kazanır. Bu dönemde FOSTER NEXTHALER'ın en düşük etkin dozukullanılmalıdır (bkz. Bölüm 4.2). KOAH hastalarında pnömoniKortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoniriskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarakgösterilmemiştir. Kortikosteroid içeren inhale ilaçlar arasında pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık bakımından kesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyla dikkatliolmalıdır. KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içilmesi, ileri yaş, düşük vücut kitle indeksi ve ağır KOAH bulunmaktadır. İnhale kortikosteroidlerin, özellikle uzun süre ile reçete edilen yüksek dozlarında, sistemik etkileri ortaya çıkabilir. Bu etkilerin ortaya çıkma olasılığı oral kortikosteroidlere göre dahaazdır. Olası sistemik etkiler; Cushing sendromu, Cushingoid belirtiler, adrenal supresyon,çocuklarda ve ergenlerde büyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt,glokom ve daha nadiren psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon veyaagresyon (özellikle çocuklarda) dahil bir dizi psikolojik bozukluk veya davranış bozukluklarıdır.Bu nedenle inhale kortikosteroid dozunun, astımın etkili bir şekilde kontrol edildiği en düşükdoza ayarlanması önemlidir. Hastaların inhale kortikosteroidlerle uzun süre ile tedavi edilmeleri adrenal supresyon ve akut adrenal krizle sonuçlanabilir. Tavsiye edilen beklometazon dipropiyonat dozundan daha yüksekdozları inhale eden çocuklar ve 16 yaşından küçük hastalar potansiyel risk altında olabilirler.Potansiyel olarak akut adrenal krizi tetikleyen durumlar; travma, ameliyat, enfeksiyon veyadozun herhangi bir nedenle hızla azaltılması olabilir. Ortaya çıkan semptomlar genelliklebelirsizdir ve anoreksiya, abdominal ağrı, kilo kaybı, yorgunluk, baş ağrısı, mide bulantısı,kusma, hipotansiyon, azalmış bilinç düzeyi, hipoglisemi ve nöbetler halinde görülebilir. Stresdönemlerinde veya elektif cerrahi esnasında tedaviye ilave kortikosteroid eklenmesidüşünülmelidir. Oral kortikosteroidlerden, inhale kortikosteroidlere geçirilen hastalar kayda değer bir süre boyunca bozulmuş adrenal rezerv yönünden risk altında olabilirler. Geçmişte yüksek doz acilkortikosteroid tedavisi görmüş veya uzun süreli yüksek doz inhale kortikosteroid tedavisi alanhastalar da risk altında olabilirler. Stres yaratması muhtemel acil ve elektif durumlarda, ilgilirezidüel bozukluk olasılığı daima akılda tutulmalı ve uygun kortikosteroid tedavisidüşünülmelidir. Elektif prosedürlerden önce adrenal bozukluk derecesinin tespiti için ilgiliuzmana danışılmalıdır. FOSTER NEXTHALER aktif veya latent akciğer tüberkülozu, hava yollarında fungal veya viral enfeksiyon izlenen hastalarda dikkatle uygulanmalıdır. FOSTER NEXTHALER; kardiyak aritmi, özellikle üçüncü derece atriyoventriküler blok ve taşiaritmiler, idiyopatik subvalvular aortik stenoz, hipertrofik obstrüktif kardiyomiyopati,iskemik kalp hastalığı, ağır kalp yetersizliği, şiddetli arteriyel hipertansiyon ve anevrizmageçirmiş hastalarda dikkatle kullanılmalı, hasta monitorize edilmelidir. Konjenital veya ilaçla indüklenen, bilinen veya şüpheli QTc aralığı uzaması (QTc > 0,44 saniye) izlenen hastalar tedavi edilirken dikkatli olunmalıdır. Formoterol, QTc aralığının uzamasınıindükleyebilir. FOSTER NEXTHALER; tirotoksikoz, diabetes mellitus, feokromositoma ve tedavi edilmemiş hipokalemi izlenen hastalarda dikkatli kullanılmalıdır. Ciddi hipokalemi, potansiyel olarak beta 2-agonisti tedavisinden ileri gelebilir. Hipokalemi şiddeti hipoksi ile artabileceğinden ağır astımda bu duruma özel olarak dikkat edilmesi tavsiye edilir.Hipokaleminin şiddeti; hipokalemiyi indükleyen ksantin türevleri, steroidler ve diüretikler gibidiğer ilaçlarla yapılan eşzamanlı tedavi ile de artabilir (Bkz. Bölüm 4.5). Birden fazla sayıdakurtarıcı bronkodilatörün tüketilebildiği stabil olmayan astımda da dikkatli olunması tavsiyeedilir. Bu gibi durumlarda hastanın serum potasyum düzeyleri düzenli olarak izlenmelidir.Formoterol inhalasyonu kan şekeri düzeylerinde yükselmeye neden olabilir. Bu nedenle diyabet hastalarında kan glukozu yakından izlenmelidir. Halojenli anestezikler ile anestezi planlandığında, kardiyak aritmi riski nedeniyle anestezi başlamadan en az 12 saat öncesinde FOSTER NEXTHALER kullanılmamış olmasıgerekmektedir. Hastalara, orofarengeal fungal enfeksiyon ve disfoni riskini azaltmak için inhaler kullanımından sonra ağızlarını su ile çalkalamaları veya gargara yapmaları veya dişlerini fırçalamaları gerektiğihatırlatılmalıdır. Uzun etkili beta 2-agonisti preparatlarına bağlı olarak nadiren de olsa, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri görülebilir.Uzun etkili beta 2-agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolü sağlandığında eğer mümkünse kullanımları durdurulmalıdır.Sonrasında hastaların kontrol edici düzenli bir tedaviyle idame edilmesi sağlanmalıdır.İnhale kortikosteroide ek olarak uzun etkili beta 2-agonist kullanan pediyatrik ve ergen hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hemde uzun etkili betaagonist içeren bir kombinasyon preparatı kullanılması önerilir.Hastalar alevlenme dönemlerinde ise ya da önemli veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta 2-agonistlerle tedaviye başlanmamalıdır.Sistemik ve topikal kortikosteroid kullanımına bağlı görme bozuklukları bildirilebilir. Eğer hastada bulanık görme veya diğer görme bozuklukları meydana gelirse hasta; katarakt, glokomveya sistemik ve topikal kortikosteroid kullanımdan sonra bildirilen santral seröz korioretinopati(SSKR) gibi nadir hastalıkları da içerebilen olası nedenleri değerlendirmek üzere bir gözdoktoruna yönlendirilmelidir. FOSTER NEXTHALER laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glikoz-galaktoz malabsorbsiyon problemi olan hastaların bu ilacıkullanmamaları gerekir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriFarmakokinetik etkileşimler Beklometazon dipropiyonat, sitokrom P-450 sisteminin katkısı olmaksızın esteraz enzimleri aracılığı ile hızla metabolize olarak aktif metaboliti olan beklometazon monopropiyonatadönüşür. Beklometazon diğer bazı kortikosteroidlere göre CYP3A metabolizmasına daha az bağımlıdır ve genel olarak etkileşimler olası değildir; ancak güçlü CYP3A inhibitörlerinin (örneğin ritonavir,kobisistat) birlikte kullanımı ile sistemik etkilerin olma ihtimali göz ardı edilemez ve bu nedenlebu tür ajanlar kullanılması durumunda dikkatli olunması ve hastanın uygun bir şekildegözlemlenmesi önerilir. Farmakodinamik etkileşimler Beta-adrenerjik blokörler, formoterolün etkisini zayıflatabilir veya inhibe edebilir. Bu nedenle FOSTER NEXTHALER zorunlu olmadıkça beta-adrenerjik blokörlerle (göz damlası dahil)birlikte verilmemelidir. Diğer beta-adrenerjik ilaçların kullanımı potansiyel olarak aditif etkiler oluşturabilir, bu nedenle teofilin veya diğer beta-adrenerjik ilaçlar formoterol ile eşzamanlı olarak reçete edileceksedikkatli olunmalıdır. Kinidin, disopiramid, prokainamid, fenotiyazinler, belli antihistaminikler (örn., terfenadin), monoaminoksidaz inhibitörleri ve trisiklik antidepresanlar ile yapılan eşzamanlı tedavi, QTcaralığını uzatabilir ve ventriküler aritmi riskini artırabilir. Ayrıca L-dopa, L-tiroksin, oksitosin ve alkol; beta 2-sempatomimetiklere karşı, kardiyak toleransı azaltabilir.Furazolidon ve prokarbazin gibi benzer özellikler gösteren monoaminoksidaz inhibitörleri (MAOİ) ile eş zamanlı tedavi, hipertansif reaksiyonları başlatabilir. Halojenli hidrokarbonlarla eşzamanlı anestezi alan hastalarda aritmi riski artabilir. Ksantin türevleri, steroidler veya diüretiklerle yapılan eşzamanlı tedavi beta 2Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği halinde FOSTER NEXTHALER ile yapılmış etkileşim çalışması bulunmamaktadır. Pediyatrik popülasyon:18 yaşın altındaki astım ve KOAH hastalarında FOSTER NEXTHALER ile yapılmış etkileşim çalışması bulunmamaktadır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):FOSTER NEXTHALER'ın çocuk doğurma potansiyeli olan kadınlarda ve doğum kontrolünde kullanımına ilişkin yeterli veri bulunmamaktadır. Gebelik dönemiFOSTER NEXTHALER'm gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz.Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Gebe hayvanlara uygulanan yüksek kortikosteroid dozlarının, yarık damak ve rahim içi büyüme geriliği gibi fötal gelişim anomalilerine neden olduğu bilinmektedir. Beta 2-sempatomimetikajanların tokolitik etkisinden dolayı doğumun yaklaşmasında gerekli önlemler alınmalıdır.Belirlenmiş farklı ve daha güvenli tedavi alternatifi varsa, formoterolün gebelik esnasında veözellikle gebeliğin sonunda veya doğum esnasında kullanımı tavsiye edilmemektedir.FOSTER NEXTHALER'ın gebelik esnasında uygulanması yalnızca beklenen faydalar potansiyel risklerden fazla ise düşünülmelidir. Laktasyon dönemiFOSTER NEXTHALER'ın insanlarda emzirme esnasında kullanımına dair klinik veriler bulunmamaktadır. Hayvan deneylerinden herhangi bir veri elde edilmemiş de olsa, beklometazon dipropiyonatın diğer kortikosteroidler gibi anne sütüne geçtiğinin varsayılması anlamlıdır. Formoterolün insanda anne sütüne geçip geçmediğinin bilinmemesine karşın, emziren hayvanların sütünde formoterol tespit edilmiştir. FOSTER NEXTHALER'ın emziren kadınlara uygulanması yalnızca beklenen faydalar potansiyel risklerden fazla ise düşünülmelidir. Çocuk için emzirmenin ve anne için tedavininfaydası dikkate alınarak, emzirmenin veya FOSTER NEXTHALER ile tedavinin kesilipkesilmemesi konusunda bir karar verilmelidir. Üreme yeteneği/Fertiliteİnsanlarda hiçbir veri bulunmamaktadır. Hayvanlar üzerinde yapılan çalışmalarda, sıçanlarda, beklometazon dipropiyonatın yüksek dozlarda kombinasyon halinde bulunması azalmış dişiüreme yeteneği ve embriyotoksisite ile ilişkilendirilmiştir (Bkz. Bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkilerFOSTER NEXTHALER'ın araç ve makine kullanma yeteneği üzerine etkisi yoktur veya ihmal edilebilir düzeydedir. 4.8 İstenmeyen etkilerTremor, en yaygın görülen advers reaksiyondur. FOSTER NEXTHALER'ın daha düşük beklometazon içeren formu (100 mcg/6 mcg) ile yapılan 12 haftalık bir klinik çalışmada; tremor,yalnızca maksimum doz uygulamasında (günlük 400/24 mcg) görülmüş, sıklıkla da tedavininbaşlangıcında ortaya çıkmış ve hafif seyirli olarak gözlenmiştir. Hiçbir hasta, tremorun birsonucu olarak çalışmadan çekilmemiştir. Astım Hastalarında Klinik Çalışmalar FOSTER NEXTHALER'm daha düşük beklometazon içeren formunun (100 mcg/6 mcg) güvenliliği, değişen şiddette astımı olan 12 yaş ve üzeri 719 hastanın ilaca maruz bırakıldığı aktifve plasebo kontrollü klinik çalışmalarda değerlendirilmiştir. Aşağıda bulunan advers reaksiyoninsidansı, 12 yaş ve üzeri astımlı hastalarla ilişkilidir ve FOSTER NEXTHALER 100 mcg / 6mcg Kuru Toz İnhaler'in tavsiye edilen dozlarında, 8-12 haftalık bir süre boyunca uygulandığıiki pivotal klinik çalışmanın güvenlilik bulgularına dayanmaktadır. FOSTER NEXTHALER'ındaha düşük beklometazon içeren formu (100 mcg/6 mcg) ile yapılan klinik çalışmalardapsikiyatrik bozukluklar gözlenmemiştir ancak inhale kortikosteroidlerin potansiyel bir sınıf etkisiolarak eklenmişlerdir. Klinik çalışmalardan elde edilen istenmeyen etki görülme sıklıkları MedDRA sistemine göre sınıflandırılmıştır: Çok yaygın: > 1/10 ; Yaygın: > 1/100 ila < 1/10 ; Yaygın olmayan: > 1/1000 ila < 1/100 ;Seyrek: > 1/10.000 ila <1/1000 ; Çok seyrek: < 1/10.000 ; Bilinmiyor (mevcut verilerden tahmin edilemiyor). Plasebo insidansları dikkate alınmamıştır. Enfeksiyon ve enfestasyonlarYaygın :Pnömoni (KOAH'lı hastalarda) Yaygın olmayan :Nazofarenjit, oral kandidiyazis Metabolizma ve beslenme hastalıklarıYaygın olmayan :Hipertrigliseridemi Psikiyatrik hastalıklarBilinmiyor :Psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon, agresyon, davranış değişiklikleri (daha çok çocuklarda) Göz hastalıklarıBilinmiyor : Bulanık görme (bkz. Bölüm 4.4) Sinir sistemi hastalıklarıYaygın : Tremor Yaygın olmayan : Baş ağrısı Kardiyak hastalıklarYaygın olmayan : Taşikardi, sinus bradikardisi, angina pektoris, miyokardiyal iskemi Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan : Boğazda tahriş, astımın alevlenmesi, dispne, orofarengeal ağrı, disfoni, öksürük Gastrointestinal hastalıklar
Bulantı
Yaygın olmayan Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın olmayan : Yorgunluk, sinirlilik AraştırmalarYaygın olmayan : Elektrokardiyogramda QT uzaması, kortizol içermeyen idrarda azalma, azalmış kan kortizolü, artmış kan potasyumu, artmış kanglukozu, zayıf r-dalga ilerlemeli elektrokardiyogram Formoterol ile ilişkili gözlemlenen advers olaylar şunlardır: Tremor, baş ağrısı, taşikardi, sinüs bradikardisi, angina pektoris, miyokardiyal iskemi ve QTc aralığı uzaması. Beklometazon dipropiyonat ile ilişkilendirilen advers reaksiyonlar genellikle şunlardır: Nazofarenjit, oral kandidiazis, disfoni, boğazda tahriş, huzursuzluk, kortizol içermeyen idrardaazalma, azalmış kan kortizolü, artmış kan glukozu. FOSTER NEXTHALER ile yapılan klinik deneyimlerde gözlenmeyen ancak genellikle beklometazon dipropiyonatın inhalasyon yoluyla uygulanmasıyla ilişkilendirilen ilave adversreaksiyonlar, diğer oral fungal enfeksiyonlar ve pnömonidir. İnhale kortikosteroid tedavisiesnasında bazen tat bozuklukları bildirilmiştir. Oral fungal enfeksiyonlar, oral kandidiyazis ve disfoniyi azaltmaya yönelik önlemler için Bölüm 4.4'e bakınız. İnhale kortikosteroidlerin (örn., beklometazon dipropiyonat) sistemik etkileri özellikle uzun süreli kullanım için reçetelenen yüksek doz uygulamalarında ortaya çıkabilir. Bunlar; CushingSendromu, Cushingoid belirtiler, adrenal supresyon, kemik mineral yoğunluğunda azalma,ergenlerde büyüme geriliği, katarakt ve glokom olarak görülebilir (bkz. Bölüm 4.4). FOSTER NEXTHALER'ın daha düşük beklometazon içeren (100 mcg / 6 mcg) dozlarıyla elde edilen klinik deneyimlerde gözlenmeyen ancak genellikle formoterol gibi uzun etkili beta 2-agonistinin uygulanmasıyla ilişkilendirilen ilave advers reaksiyonlar; palpitasyon, atriyalfibrilasyon, ventriküler ekstrasistol, taşiaritmi, potansiyel olarak ciddi hipokalemi veartmış/azalmış kan basıncıdır. İnhale formoterol tedavisi esnasında bazen uykusuzluk, başdönmesi, huzursuzluk ve anksiyete bildirilmiştir. Formoterol kas kramplarını, miyaljiyi deartırabilir.Döküntü, ürtiker, pruritus ve eritem; göz, yüz, dudak ve boğazda ödem (anjiyoödem) dahil aşırı duyarlılık reaksiyonları bildirilmiştir. Diğer inhaler tedavilerde olduğu gibi doz alımı sonrasında hırıltılı solunum, öksürük ve nefes darlığında ani bir artışla beraber paradoksal bronkospazm oluşabilir (ayrıca bkz. Bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr4.9 Doz aşımı ve tedavisiFOSTER NEXTHALER'ın tek bir uygulama için tavsiye edilen en yüksek dozu 2 inhalasyondur. Astım hastalarında FOSTER NEXTHALER'ın kümülatif 4 inhalasyonu (tek birdoz şeklinde verilen toplam beklometazon dipropiyonat 800 mikrogram, formoterol 24mikrogram) çalışılmıştır. Kümülatif tedavi uygulaması, hayati belirtiler üzerinde anormal kliniketkilere neden olmamış ve ciddi veya şiddetli advers reaksiyonlar gözlenmemiştir (ayrıca bkz.Bölüm 4.8). Beklometazon dipropiyonat/formoterol kombinasyonu basınçlı ölçülü doz inhaler formülasyonunda, astım hastalarında 12 inhale doza kadar kümülatif inhalasyon araştırılmıştır(toplam beklometazon dipropiyonat 1200 mikrogram, formoterol 72 mikrogram). Kümülatiftedaviler hayati belirtiler üzerinde anormal etkiye neden olmamış ve ciddi veya şiddetli adversolaylar gözlenmemiştir. Aşırı formoterol dozları beta 2-adrenerjik agonistler için tipik olan advers etkilerden; bulantı, kusma, baş ağrısı, tremor, uyku hali, çarpıntı, taşikardi, ventrikül aritmiler, QTc aralığınınuzaması, metabolik asidoz, hipokalemi, hiperglisemiye neden olabilir.Formoterol ile doz aşımı durumunda destekleyici ve semptomatik tedavi endikedir. Ciddi vakalar hastaneye yatırılmalıdır. Kardiyoselektif beta-adrenerjik blokerlerin uygulamasıdüşünülebilir ancak beta-adrenerjik bloker ilaç kullanımının bronkospazma neden olabileceğigöz önünde bulundurulmalı, dikkatli olunmalı, hastaların serum potasyum düzeyleri izlenmelidir. Önerilenden fazla akut beklometazon dipropiyonat dozlarının inhalasyonu, adrenal fonksiyonun geçici olarak baskılanmasına neden olabilir. Bu durum, plazma kortizol ölçümleri iledoğrulandığı üzere, baskılanma birkaç gün içinde ortadan kalkacağı için acil önlem gerektirmez.Bu hastalarda tedavi, astımın kontrol altına alınabildiği en uygun dozda sürdürülmelidir. Kronik bir şekilde önerilenden fazla beklometazon dipropiyonat dozlarının inhalasyonu durumunda (bkz Bölüm 4.4), adrenal rezervin monitorizasyonu gerekebilir. Bu grup hastalardada tedavi, astımın kontrol altına alınabildiği en uygun dozda sürdürülmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Obstrüktif hava yolu hastalıkları için kullanılan ilaçlar; Kortikosteroidler veya diğer ilaçlar ile kombine adrenerjikler (antikolinerjik kombinasyonları hariç). ATC Kodu: R03AK08 Etki mekanizması FOSTER NEXTHALER; 1,4-1,7 mikrometrelik ortalama kütle medyan aerodinamik çapa (MMAD) sahip ekstra ince bir toz bulutunda; beklometazon dipropiyonat ve formoterol etkinmaddelerinin kombinasyon halinde bulunduğu çoklu doz kuru toz inhalerdir. FOSTERNEXTHALER'ın bulut partikülleri, ortalamada, ekstra ince olmayan formülasyonlarda serbestbırakılan partikül boyutlarından çok daha küçük çaptadır. Astım hastalarında radyoaktif olarak işaretlenmiş ilacın akciğer erişimi ile ilgili yapılan bir çalışmada; FOSTER NEXTHALER'ın daha düşük beklometazon içeren formunun (100 mcg/6mcg), hava yollarında homojen olarak, yüksek oranda (nominal dozun tahminen %42'si)akciğerlere eriştiği gösterilmiştir. FOSTER NEXTHALER'ın, basınçlı ölçülü doz inhaler (bÖDİ)karşılığı olan ekstra ince beklometazon dipropiyonat/formoterol fumarat dihidrat (BDP/FF)formülasyonu ile eşit olduğu gösterilen bu iletim özellikleri, artmış lokal farmakodinamiketkilere sahip düşük kortikosteroid dozunun kullanımını desteklemektedir (Bkz. Klinik çalışmadeneyimleri).FOSTER NEXTHALER'ın iki etkin maddesi farklı etki mekanizmalarına sahiptir. İnhale kortikosteroid ve beta2-agonisti kombinasyonlarıyla ortak olduğu üzere, ilgili bileşenlerle deastım alevlenmelerinde azalmaya dair aditif etkiler görülmektedir. Bu bileşenler: Beklometazon dipropiyonat İnhalasyon yolu ile önerilen dozlarda uygulanan beklometazon dipropiyonat, akciğerlerde glukokortikoidlere özgü lokal antiinflamatuvar etki gösterir ve bu etki, astım belirtileri vealevlenmelerinde azalma sağlarken, sistemik olarak uygulanan kortikosteroidlere nazaranpotansiyel olarak daha az advers etki gösterir. Formoterol Formoterol, reversibl solunum yolu obstrüksiyonu izlenen hastalarda bronş düz kaslarının gevşemesini sağlayan uzun etki süreli selektif bir beta2-adrenerjik agonistidir. Bronş genişleticietki hızlı bir şekilde, inhalasyondan 1-3 dakika sonra etkisini gösterir ve 12 saat sürer. Klinik deneyim Orta-ağır şiddetli persistan astım hastalarında FOSTER NEXTHALER'ın daha düşük beklometazon içeren formu (100 mcg/6 mcg) ve beklometazon dipropiyonat/formoterolkombinasyonu 100/6 mikrogram basınçlı ölçülü doz inhaler çözeltisinde bulunan iki bileşeninetkililiği; üç ayrı çalışmada karşılaştırılarak değerlendirilmiştir. Genellikle, klinik uygulamadaiki inhalerin 1 ve 2 inhalasyon halinde günde iki kez dozundaki etkililiklerinin eşdeğer olmasıbeklenmiştir. Birinci çalışmada; primer amaç, bronkodilatasyonla ölçülen inhale kortikosteroid bileşeninin etkililiğinin değerlendirilmesidir (doz öncesi FEV1). Her iki formülasyon günde iki kez 1 ve 2inhalasyon şeklinde uygulandığında; 3 aylık tedavi süresinin sonunda, orta-ağır şiddetlisemptomatik astımlı 696 hastanın FEV1 değerlerinde, başlangıç FEV1 değerlerine göre klinikaçıdan belirgin olarak anlamlı bir iyileşme görülmüştür. FEV1'de, başlangıç değerlerine göre enaz 250 ml'lik bir ortalama artış gözlenmiştir. Her iki doz uygulamasında da, FOSTER® kuru tozinhaler ve basınçlı inhalasyon çözeltisi formülasyonlarının doz öncesi FEV1 değerleri arasındaklinik açıdan belirgin bir fark bulunmamıştır. Sabah tepe ekspiratuar akımı (PEF'i) için anlamlıbir doz-yanıt ilişkisi gözlenmiştir. Doz öncesi FEV1'de doz-yanıt ilişkisi için istatistiksel biranlamlılık bulunmamıştır. Astım kontrolü ölçümlerinde; her iki formülasyonun yüksekdozlarında başlangıçtan itibaren tedavi dönemi boyunca sabah ve akşam astım semptom skoru vesemptomsuz günlerin yüzdeleri belirgin olarak düzelmiştir. İkinci çalışmada primer amaç, FOSTER'in kuru toz ve basınçlı ölçülü doz inhaler (bÖDİ) formülasyonlarındaki uzun etkili beta2-agonist bileşeninin etkililik değerlendirmesidir. Buçalışmada, başlangıçtaki bronkodilatasyon ve tek doz uygulamasından sonraki 12 saate kadarolan bronkodilatasyon, FEVı'in bir dizi spirometrik değerlendirmesiyle ölçülmüştür(formoterolün etki süresinin en az %80'ine göre FEVı EAA). Her iki FOSTER formülasyonu da,bir ve dört dozluk inhalasyonlarında, FEVı EAAo-i2.'yi plaseboya göre anlamlı derecededüzeltmiştir. FOSTER NEXTHALER kuru toz inhalerin 1 ve 4 dozluk uygulamalarındakibronkodilatasyon, basınçlı ölçülü doz inhaler formülasyonundaki bronkodilatör etkinlik ileeşdeğerdedir. Her iki formülasyonun düşük ve yüksek dozları arasındaki doz-yanıt ilişkisiistatistiksel olarak anlamlı bulunmuştur. Üçüncü çalışmada; beklometazon dipropiyonat/formoterol basınçlı ölçülü doz inhalasyon çözeltisi (günde 2 defa 1 inhalasyon) ile yapılan 4 haftalık bir hazırlık döneminden sonra kontrolaltına alınan 755 astım hastasının tamamı, günde iki kez 1 inhalasyon şeklinde verilen aynıinhaler (bÖDİ), FOSTER NEXTHALER kuru toz inhaler veya doz başına 100 mikrogrambeklometazon dipropiyonat inhalasyon tozu tedavi gruplarına 8 haftalık tedavi için randomizeedilmişlerdir. Birincil hedef, başlangıçtan itibaren tüm tedavi süresince sabah tepe ekspiratuarakımında (PEF) tedavi başlangıcına göre görülen değişikliğin tespitidir. 8 haftalık tedavidensonra, her iki FOSTER formülasyonu (bÖDİ ve kuru toz inhaler), beklometazon dipropiyonatkuru toz monoterapisine göre belirgin olarak sabah tepe ekspiratuar akımında (PEF) daha iyiiyileşme sağlamış ve her iki kombinasyon inhalerinin birincil sonlanım noktaları arasında hiçbirfark bulunmamıştır. Her iki kombinasyon inhaleri arasında, astım kontrol anketi skoru vekurtarıcı ilaçsız geçen gün sayısı gibi semptom ölçümleri değerlendirmelerinde herhangi birfarklılık bulunmamaktadır. FOSTER NEXTHALER'la oluşturulabilecek inspiratuvar akımın hastanın yaşı, hastalık ve hastalığın şiddetinden bağımsız olduğu, dolayısıyla tüm hastaların doz aktivasyonunu ve dozsolumasını başarabileceğinin doğrulanması yönünde yapılan açık-etiketli plasebo çalışmada;çalışmanın birincil sonlanım noktası, her yaş ve hastalık şiddeti grubunda inhalerietkinleştirebilen hastaların yüzdesi tespitidir. Orta-ağır şiddetli astımı olan hastalar (sırasıyla,FEV1 > %60 ve < %60 öngörülen) ve orta ve ağır şiddetli KOAH izlenen hastalar (sırasıyla,FEV1 > %50 ve < %50 öngörülen) dahil 5-84 yaş aralığındaki seksen dokuz hasta çalışmayakatılmıştır. Yaş, hastalık ve hastalık şiddetinden bağımsız olarak tüm hastalar, FOSTERNEXTHALER'ı aktive etmek için yeterli olan inspiratuvar akımı oluşturabilmişlerdir. FOSTER NEXTHALER 100 mcg/6 mcg ve FOSTER NEXTHALER 200 mcg/6 mcg kuru toz inhalerin, veya plasebonun, iki farklı tekli dozu (1 veya 4 inhalasyon) ile kısmen kontrollü veyakontrol altına alınmamış 60 yetişkin astım hastasında çift-kör, randomize, 5-yönlü çapraz,plasebo kontrollü bir çalışmada, bronkodilatatör etki (zamanla normalize edilen FEV1 EAA0-12h)araştırılmıştır. FOSTER NEXTHALER 200 mcg/6 mcg ile FOSTER NEXTHALER 100 mcg/6mcg arasındaki ayarlanmış ortalama fark (% 95 güven aralığı), düşük formoterol doz seviyesi (1inhalasyon - 6 mcg) için 0,029 (-0,018; 0,076) L ve yüksek formoterol doz seviyesi (4 inhalasyon- 24 mcg) için 0,027 (-0,020; 0,073) L olarak bulunmuştur. Sonuçlar, tedaviler arasında çiftyönlü %95 güven aralıklarının alt sınırının ayarlanmış ortalama fark için önceden belirlenmiş eşitetkinlik limitinin (-0,12 L) çok üzerinde olduğunu göstermiştir. Böylece FOSTER NEXTHALER 200 mcg/6 mcg'ın zamanla normalize edilen FEV ıo-i2h5.2 Farmakokinetik özelliklerBeklometazon dipropiyonat Emilim:İnhale edilen beklometazon dipropiyonat akciğerlerden hızlı bir şekilde emilir; absorpsiyondan önce, çoğu dokuda bulunan esteraz enzimleri aracılığıyla yoğun bir şekilde aktif metaboliteolan beklometazon-17-monopropiyonata hidrolize olur ve glukokortikoid reseptörüne güçlü birşekilde bağlanır. Aktif metabolit olan beklometazon-17-monopropiyonat sistemik yararlanımıakciğerler ve yutulan dozun gastrointestinal absorpsiyonundan kaynaklanır. Yutulanbeklometazon dipropiyonatın biyoyararlanımı önemsizdir. Bununla beraber, sistemik dolaşımöncesi beklometazon-17-monopropiyonata dönüşüm aktif metabolitin absorpsiyonu ileneticelenir. Basınçlı bir ölçülü doz inhalerden inhalasyon sonrası mutlak biyoyararlanım, değişmemiş beklometazon dipropiyonat ve beklometazon-17-monopropiyonat için nominal dozun yaklaşıkolarak, sırasıyla, %2'si ve %62'sidir. Dağılım:Dozun intravenöz olarak verilmesinden sonra, beklometazon dipropiyonat için kararlı durumda az dağılım hacmi (20 L) ve aktif metaboliti için daha fazla doku dağılımına (424 L) karşın,beklometazon dipropiyonat ve aktif metabolitinin dağılımı yüksek plazma klirensi (sırasıyla 150ve 120 litre/saat) ile tanımlanır. Beklometazon dipropiyonatın metabolik olarak dağılımı esasen (%82) aktif metabolit olan beklometazon-17-monopropiyonatla sonuçlanır. Plazma proteinlerine bağlanma kısmen yüksektir (%87). Biyotransformasyon:Ön ilaç olarak glukokortikoid reseptör afinitesi zayıf olan beklometazon dipropiyonat, esteraz enzimleriyle hidrolize olarak, güçlü bir lokal antiinflamatuvar etkinliğe sahip aktif metabolitiolan beklometazon-17-monopropiyonata dönüşür. Eliminasyon:Beklometazon dipropiyonatın başlıca atılım şekli polar metabolitler şeklinde feçesle atılımdır. Beklometazon dipropiyonat ve metabolitlerinin idrarla atılımı önemsizdir. Beklometazondipropiyonat ve beklometazon-17-monopropiyonat için terminal eliminasyon yarılanma ömrüsırasıyla 0,5 ve 2,7 saattir. Doğrusallık/ Doğrusal Olmayan Durum:İnhalasyon tozunun iki farklı yitiliği (FOSTER NEXTHALER 100 mcg/6 mcg ve FOSTER NEXTHALER 200 mcg/6 mcg) üzerinden iki bileşenin akciğer biyoyararlanımı ve toplamsistemik maruz kalımını değerlendirmek için bir klinik farmakoloji çalışması yapıldı. Buparametreler, hem aktif kömür ile hem de aktif kömür olmadan, her formülasyonun tek birdozundan (4 inhalasyon) sonra değerlendirildi. Açık etiketli, 6 yönlü çapraz, tek dozlu dizayna sahip çalışmaya, tahmin edilen değerleri >%70 FEV ı2makst'nin biyoeşdeğerlik sınırı %80'nin altında kaldığından tam olarak gösterilemedi. Sistemiketkilerde (glukoz, potasyum vekardiyovasküler parametreler dahil) hiçbir farkgözlenmediğinden, bu azalmış sistemik maruziyet (C makstmakstiçin sırasıyla % 20ve% 22 olarak bulunmuştur. İki yitiliğin (100/6 mikrogram ve 200/6 mikrogram)bronkodilatasyon açısından eşdeğer etkinliği, spesifik bir farmakodinamik çalışmadagösterilmiştir (bkz. Bölüm 5.1).Hastalardaki karakteristik özellikler:Beklometazon dipropiyonatın böbrek veya karaciğer yetmezliği izlenen hastalardaki farmakokinetikleri araştırılmamıştır. Bununla birlikte; beklometazon dipropiyonat, daha polarmetabolitler olan beklometazon-21-monopropiyonat, beklometazon-17-monopropiyonat vebeklametazonu meydana getirmek üzere bağırsak sıvısı, serum, akciğer ve karaciğerde bulunanesteraz enzimleriyle çok hızlı bir şekilde metabolize olduğundan, karaciğer yetmezliğininbeklometazon dipropiyonatın farmakokinetiğini ve güvenlilik profilini değiştirmesi beklenmez.Beklometazon dipropiyonat veya metabolitlerinin idrarda izi bulunmadığından, böbrekyetmezliği izlenen hastalarda sistemik maruz kalımda bir artış öngörülememiştir. Formoterol Emilim:Formoterol inhalasyonundan sonra, hem akciğerden hem de gastrointestinal kanaldan emilir. Ölçülü doz inhalerle (ÖDİ) uygulama sonrası yutulan solunan doz fraksiyonu %60 ile %90arasında değişebilir. Yutulan kısmın en az %65'i gastrointestinal kanaldan emilir. Değişmemişilacın pik plazma konsantrasyonları oral uygulamadan sonraki 0,5 ila 1 saat içerisinde ortayaçıkar. Dağılım:Formoterolün plazma proteinlerine bağlanma oranı %61-64'tür. %34'ü albümine bağlanır. Terapötik dozlarla ulaşılan konsantrasyon aralığında, bağlanmada bir doygunlukbulunmamaktadır. Oral uygulama sonrası belirlenen eliminasyon yarılanma ömrü 2-3 saattir. Biyotransformasyon:Formoterol büyük ölçüde metabolize olur ve en önemli metabolizma yolağı fenolik hidroksil grubunun doğrudan konjugasyonunu gerektirir. Glukuronik asit konjugatı inaktiftir. İkinciönemli yolak, O-demetilasyonu takiben fenolik 2'-hidroksil grubundaki konjugasyonunugerektirir. Sitokrom P450 izoenzimleri CYP2D6, CYP2C19 ve CYP2C9, formoterolün O-demetilasyonunda yer alır. Karaciğerin başlıca metabolizma yeri olduğu anlaşılmaktadır.Formoterol, terapötik açıdan ilgili konsantrasyonlarda CYP450 enzimlerini inhibe etmez. Eliminasyon:Kuru toz inhalerden tek bir inhalasyon sonrası formoterolün kümülatif idrar atılımı 12 - 96 ^g doz aralığında doğrusal olarak artmıştır. Ortalamada, dozun %8'i ve %25'i sırasıyla değişmemişve toplam formoterol şeklinde atılmıştır. 12 sağlıklı gönüllünün inhale ettiği 120 ^g'lık tek birdozu takiben ölçülen plazma konsantrasyonlarına dayanarak, ortalama terminal eliminasyonyarılanma ömrü 10 saat olarak belirlenmiştir. (R,R)- ve (S,S)-enansiyomerler idrarla atılandeğişmemiş ilacın, sırasıyla, yaklaşık %40 ve %60'ını temsil etmiştir. İki enantiyomerin bağıloranı araştırılan doz aralığı üzerinde sabit kalmıştır ve tekrarlanan dozlamadan sonra birenantiyomerin diğerine göre bağıl birikme belirtisi bulunmamaktadır. Oral uygulamadan sonra (40 ila 80 ^g), dozun %6 ila %10'u sağlıklı gönüllülerde değimemiş ilaç olarak idrardan geri kazanılmıştır; dozun %8'e kadarı glukuronid şeklinde geri kazanılmıştır.Formoterolün oral dozunun toplamda %67'si idrarla (başlıca metabolitleri şeklinde), ve gerikalanı feçesle atılır. Formoterolün renal klirensi 150 ml/dk.'dır. Doğrusallık/ Doğrusal Olmayan Durum:Formoterolün absorpsiyonu, 12 ila 96 ^g formoterol fumaratın solunmasını takiben doğrusaldır. Hastalardaki karakteristik özellikler:Karaciğer/Böbrek yetmezliği: karaciğer veya böbrek yetmezliği izlenen hastalarda formoterolün farmakokinetiği araştırılmamıştır. Ancak, formoterol esas olarak hepatik metabolizma yoluylaelimine edildiğinden şiddetli karaciğer sirozu olan hastalarda artmış maruziyet beklenebilir. Klinik deneyim Kombinasyon halindeki beklometazon dipropiyonat ve formoterole sistemik maruz kalım, tek başına bileşenlerle karşılaştırılmıştır. Beklometazon dipropiyonat ve formoterol arasındafarmakokinetik ve farmakodinamik (sistemik) etkileşimler olduğuna dair hiçbir bulgu yoktur. FOSTER NEXTHALER 100/6 mikrogram inhalasyon tozunun farmakokinetiği, karşılık gelen basınçlı inhalasyon çözelti formülasyonun farmakokinetiğiyle karşılaştırılmıştır. Steroidbileşenin analizi, beklometazon dipropiyonat'ın başlıca aktif metaboliti olan beklometazon-17-monopropiyonat'a odaklanmıştır. Beklometazon dipropiyonat'ın sistemik absorpsiyonu ve metabolizması hızlıdır ve her iki tedavide C maksmaksmakstmakst) iki tedavide benzerdir.Çalışmalardan birinde bağıl akciğer erişimi, ilacın gastrointestinal kanaldan absorpsiyonunun dahil edilmemesi için kömür blokajı ve referans ürün (basınçlı inhalasyon çözeltisi) için onaylıbir spacer olan AeroChamber Plus® kullanılarak araştırılmıştır. Bu düzende, Nexthaler vebasınçlı inhalasyon çözeltisinin hem beklometazon-17-monopropiyonat hem de formoterol'ünEAA tmaks5.3 Klinik öncesi güvenlilik verileriFOSTER NEXTHALER'da ayrı ayrı bulunan bileşenlerin klinik olmayan verileriyle, geleneksel güvenlilik farmakolojisi ve tekrarlanan doz toksisitesi çalışmalarına dayanarak insanlara yöneliközel bir risk olmadığı ortaya konmuştur. Kombinasyonun toksisite profili, toksisite vebeklenmeyen bulgularda artış olmamasıyla birlikte tek başına bileşenlerin toksisite profiliniyansıtmıştır. Karsinojenite Önerilen kombinasyonla karsinojenisite çalışmaları gerçekleştirilmemiştir. Bununla birlikte, ayrı ayrı bileşenler için bildirilen hayvanlardan elde edilen veriler, insanlarda herhangi bir potansiyelkarsinojenisite riskini akla getirmemektedir. Mutajenite
gerçekleştirilen genotoksisite
Beklometazon dipropiyonat/formoterol kombinasyonuyla çalışmaları mutajenik bir potansiyele işaret etmemektedir. Üreme toksisitesi Sıçanlarda yapılan üreme çalışmaları doza bağlı etkileri göstermiştir. Beklometazon dipropiyonatın yüksek dozlarda bulunması dişilerde azalmış doğurganlık, implantasyonsayısında azalma ve embriyofetal toksisite ile ilişkilendirilmiştir. Gebe hayvanlara göre yüksekkortikosteroid dozlarının, damak yarığı ve rahim içi büyüme geriliği dahil fetal gelişimanomalilerine neden olduğu bilinmektedir ve beklometazon dipropiyonat/formoterolkombinasyonuyla görülen etkiler muhtemelen beklometazon dipropiyonattan ötürüdür. Buetkiler yalnızca, aktif metabolit olan beklometazon-17-monopropiyonata yüksek sistemik maruzkalımla fark edilmiştir (hastalarda beklenen plazma düzeylerinin 200 katından daha fazla).Ayrıca, hayvanlarda yapılan çalışmalarda, beta 26. FARMASÖTIK ÖZELLİKLER6.1 Yardımcı maddelerin listesiLaktoz monohidrat (sığırdan elde edilen peynir mayasından üretilmiştir ve az miktarda süt proteinleri içerir) Magnezyum stearat 6.2 GeçimsizliklerBilinen bir geçimsizliği yoktur. 6.3 Raf ömrü36 ay Poşet ilk defa açıldıktan sonra ürün 6 ay içerisinde kullanılmalıdır. 6.4 Saklamaya yönelik özel tedbirlerNemden korumak için orijinal ambalajında saklayınız. İnhaleri yalnızca ilk kullanımdan hemen önce folyo ambalajından çıkarınız. Poşet ilk defa açılmadan önce:25°C'nin altındaki sıcaklıkta saklanmalıdır. Poşet ilk defa açıldıktan sonra:25°C'nin altındaki sıcaklıkta saklanmalıdır. 6.5 Ambalajın niteliği ve içeriğiHer kutu, 120 inhalasyon sağlayan 1 Nexthaler inhaler içerir. Her bir inhaler, PET/Al/PE'den (Polietilen Tereftalat/Alüminyum/Polietilen) yapılmış ısı ile mühürlenmiş koruyucu bir poşet(folyo ambalaj) içerisinde bulunmaktadır. FOSTER NEXTHALER çoklu doz inhalasyon cihazıdır. Cihaz, kalan doz sayısını gösteren bir pencereye sahip olan bir alt iskelet ve tamamlayıcı bir kapaktan oluşur. Doz sayaçmekanizmasını da çalıştıran kapak açıldığında, ilacın solunduğu bir ağızlık meydana çıkar. Altiskelet ve ağızlık akrilonitril bütadien stirenden, kapak ise polipropilenden yapılmıştır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller, Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. Sağlık çalışanlarına faydası olması bakımından, FOSTER NEXTHALER'ın kullanım talimatları aşağıda sunulmuştur. NEXTHALER İnhaler'in Kullanma TalimatlarıA. Ambalaj İçeriğiBu ambalajda aşağıdakiler bulunmaktadır: 1 adet hasta kullanım kılavuzu Mühürlü koruyucu poşet içerisinde 1 adet Nexthaler inhaler. Ambalaj içeriği bununla aynı değilse, inhalerinizi onu tedarik eden kişiye iade ediniz ve yenisini alınız. B. Genel Uyarılar ve Önlemler Hemen kullanmayı planlamıyorsanız inhaleri poşetten çıkarmayınız. İnhalerinizi yalnızca belirtildiği şekilde kullanınız. Doz sayacının inhalasyondan sonra bir aşağı gittiğinden emin değilseniz, bir sonrakiprogramlı dozunuza dek bekleyiniz ve bunu normal şekilde alınız. Fazladan dozalmayınız. İnhalerinizden bir doz almanız gerekene dek kapağı kapalı tutunuz. İnhalerinizi kullanmıyorken onu temiz ve kuru bir yerde saklayınız. Ne sebepten olursa olsun Nexthaler inhalerinizi parçalara ayırmayınız Aşağıdaki durumlarda Nexthaler inhalerinizi kullanmayınız: o son kullanma tarihinden sonra o poşeti açmanızın üzerinden 6 aydan daha fazla bir süre geçtiyse o kırıksa o doz sayacının penceresi 0'ı gösteriyorsa o doz sayacının penceresini okuyamıyorsanız. C. Nexthaler inhalerinizin ana özellikleri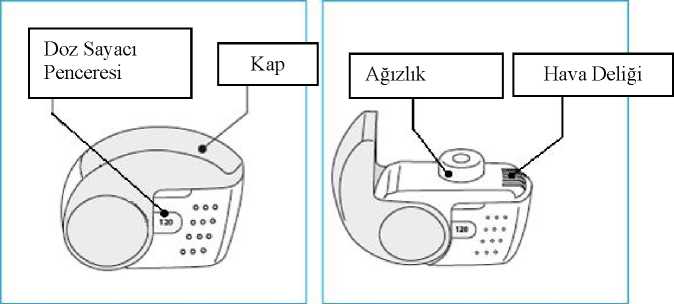
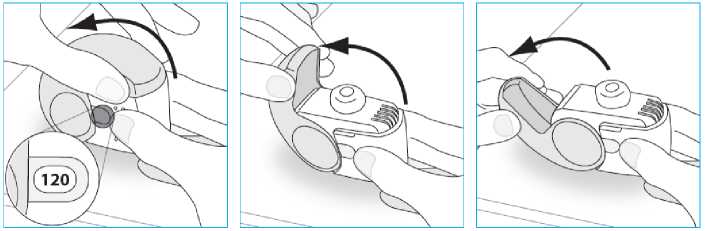
Nexthaler inhalerinizden bir dozu almanız için üç basit adım gereklidir: Aç, Solu, Kapat. D. Yeni bir Nexthaler inhaler kullanmadan önce1. Poşeti açınız ve inhalerinizi çıkarınız. o Poşet mühürlü değilse ya da hasarlıysa inhalerinizi kullanmayınız - onu tedarik eden kişiye iade ediniz ve yenisini alınız. 2. İnhalerinizi inceleyiniz. o İnhaleriniz kırık ya da hasarlı gibi görünüyorsa, onu tedarik eden kişiye iade ediniz ve yenisini alınız. 3. Doz Sayacı Penceresini kontrol ediniz. İnhaleriniz yeniyse Doz Sayacı Penceresinde120 göreceksiniz. o Görülen rakam 120'den az ise yeni inhaleri kullanmayınız - onu tedarik 1. Kalan doz sayısını kontrol edin. 1 ve 120 arasındaki herhangi bir rakam kalan dozolduğunu gösterir. o Doz Sayacı Penceresi 0'ı gösteriyorsa hiç doz kalmamıştır - inhalerinizi imha ediniz ve yenisini alınız. 2. Kullanmadan önce kapağın tamamen kapalı olduğundan emin olunuz. E.2. Aç 1. İnhalerinizi dik bir şekilde sıkıca tutunuz. 2. Kapağı tamamen açınız.
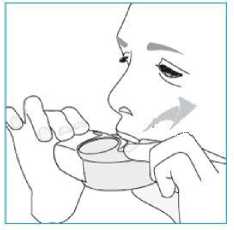
E.3. Soluma 1. İnhalerinizi ağzınıza kadar kaldırın ve dudaklarınızı ağızlığın etrafına yerleştiriniz.o İnhalerinizi tutarken hava deliğini kapatmayınız. o Hava deliğinden solumayınız. 2. Ağzınızdan hızlı ve derin bir nefes alınız. o Dozunuzu aldığınızda bir tat fark edebilirsiniz. o Dozunuzu aldığınızda bir tık sesi duyabilir ya da hissedebilirsiniz.o Burnunuzdan solumayınız. 3. İnhalerinizi ağzınızdan uzaklaştırınız. 4. 5 ila 10 saniye boyunca ya da rahat edebildiğiniz sürece nefesinizi tutunuz. 5. Yavaşça burnunuzdan nefesinizi veriniz. o Nefesinizi hiçbir şekilde inhalerinizin içine vermeyiniz. E.4. Kapatma 1. İnhalerinizi dik konumuna geri getiriniz ve kapağı tamamen kapatınız. 2. Doz sayacının bir sayı aşağı indiğini kontrol ediniz. 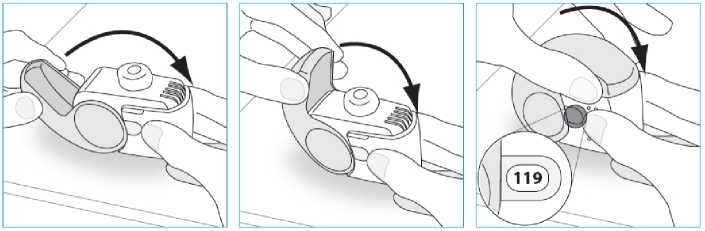 3. Başka bir doz daha almanız gerekirse, E.1 ila E.4 arasındaki adımları tekrarlayınız. F. Temizlik Normalde inhalerinizin temizlenmesi gerekmez. Gerekirse inhalerinizi kullanımdan sonra kuru bir bez ya da kağıt mendil iletemizleyebilirsiniz. o İnhalerinizi su veya diğer sıvılarla temizlemeyiniz. Kuru tutunuz. G. Saklama İnhalerinizi kullanmıyorken onu temiz ve kuru bir yerde saklayın. Kullanımdan sonraonu poşete geri koyabilirsiniz. o İnhalerinizi ısı ya da doğrudan güneş ışığına maruz bırakmayınız. o İnhalerinizi nemli ya da ıslak ortama maruz bırakmayınız. Çocukların göremeyeceği ve erişemeyeceği yerlerde saklayınız. İnhaleriniz poşet açıldıktan sonra 6 aydan fazla bir süredir saklanıyorsa, onu imhaediniz ve yenisini alınız. H. imha Doz sayacı penceresinde gösterilen rakam 0 ise Nexthaler inhalerinizi imha ediniz. Bitirdiğiniz ya da ihtiyaç duymadığınız ilaçları ne yapmak gerektiğini eczacınızadanışınız. o İlaçları normal ev atıklarınızla birlikte imha etmeyiniz. 7. RUHSAT SAHIBIChiesi İlaç Ticaret A.Ş Büyükdere Cad. No: 122 Özsezen İş Merkezi C Blok Kat:3 Esentepe-Şişli İstanbul Tel: 0212 370 9100Fax: 0212 370 9127 8. RUHSAT NUMARASI2019/119 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 26.02.2019 Ruhsat yenileme tarihi: - 10.KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriFoster Nexthaler 200/6 Mcg Kuru Toz İnhalerEtken Maddesi: Beklametazon Dipropiyonat Anhidr / Formoterol Fumarat Dihidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.