Agliko Plus 85 Mcg/43 Mcg İnhalasyon Tozu, Sert Kapsül Kısa Ürün BilgisiKISA ÜRÜN BILGISI¡1- BEŞERI TIBBİ ÜRÜNÜN ADIAGLİKO PLUS 85 mcg / 43 mcg İnhalasyon Tozu, Sert Kapsül 2- KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeler:Her kapsül 110 mikrogram indakaterole eşdeğer 143 mikrogram indakaterol maleat ve 50 mikrogram glikopironyuma eşdeğer 63 mikrogram glikopironyum bromür içerir. Alınan her doz (inhalerin ağızlığından çıkan doz), 85 mikrogram indakaterole eşdeğer 110 mikrogram indakaterol maleat ve 43 mikrogram glikopironyuma eşdeğer 54 mikrogramglikopironyum bromür içerir. Yardımcı madde:Yardımcı maddeler için 6.1'e bakınız. 3- FARMASÖTİK FORMİnhalasyon tozu, sert kapsül Beyaz yada beyazımsı toz içeren kapsüller. 4- KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarAGLİKO PLUS, kronik obstrüktif akciğer hastalığı (KOAH) olan yetişkin hastalarda semptomları hafifletmek için bir idame bronkodilatör tedavisi olarak endikedir. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Önerilen doz, bir kapsül içeriğinin günde bir kez, AGLİKO PLUS inhaler kullanılarak solunmasıdır. AGLİKO PLUS'ın her gün aynı saatte uygulanması önerilir. Bir doz kaçırılırsa, aynı gün mümkün olan en kısa sürede alınmalıdır. Hastalara günde birden fazla doz almamaları konusundabilgilendirilmelidir. Uygulama şekli:Sadece inhalasyon yoluyla kullanım içindir. Kapsüller yutulmamalıdır. Kapsüller sadece AGLİKO PLUS inhaleri kullanılarak uygulanmalıdır (bkz. Bölüm 6.6). Her
yeni reçete ile birlikte verilen inhaler kullanılmalıdır. Hastalar beşeri tıbbi ürünün doğru şekilde nasıl uygulanacağı konusunda bilgilendirilmelidir. Solunumda iyileşme yaşamamış olan hastalara, beşeri tıbbi ürünü solumak yerine yutupyutmadıkları sorulmalıdır. Beşeri tıbbi ürünü uygulamadan önce, kullanma talimatları için bölüm 6.6'ya bakınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliğiAGLİKO PLUS, hafif ila orta derecede böbrek yetmezliği olan hastalarda önerilen dozda kullanılabilir. Şiddetli böbrek yetmezliği veya diyaliz gerektiren son dönem böbrek yetmezliği olanhastalarda, yalnızca beklenen fayda, potansiyel riskten daha önemli ise kullanılmalıdır (bkz. Bölüm4.4 ve 5.2). Karaciğer yetmezliğiAGLİKO PLUS, hafif ve orta şiddette karaciğer yetmezliği olan hastalarda önerilen dozda kullanılabilir. Şiddetli karaciğer yetmezliği olan hastalarda AGLİKO PLUS kullanımına ilişkin veriyoktur, bu nedenle bu hastalarda temkinli olunmalıdır (bkz. Bölüm 5.2). Pediyatrik popülasyonAGLİKO PLUS'ın pediatrik popülasyonda (18 yaş altı) KOAH endikasyonuyla ilgili bir kullanımı yoktur. AGLİKO PLUS'ın çocuklarda güvenliği ve etkinliği belirlenmemiştir. Mevcut veribulunmamaktadır. Geriyatrik popülasyonAGLİKO PLUS yaşlı hastalarda (75 yaş ve üstü) önerilen dozda kullanılabilir. 4.3 Kontrendikasyonlarİndakaterol maleat, glikopironyum bromür ve/veya ürün içeriğindeki yabancı maddelerden herhangi maddelerden birine (bkz. Bölüm 6.1) karşı bilinen aşırı duyarlılık halinde AGLİKO PLUSkontrendikedir. 4.4 Özel kullanım uyarıları ve önlemleriAGLİKO PLUS, diğer uzun etkili beta-adrenerjik agonistler veya uzun etkili muskarinik antagonistler olan AGLİKO PLUS bileşenlerinin ait olduğu farmakoterapötik grupları içeren beşeritıbbi ürünlerle birlikte uygulanmamalıdır (bkz. Bölüm 4.5). AstımAGLİKO PLUS, bu endikasyonda veri olmaması nedeniyle, astım tedavisinde kullanılmamalıdır. Uzun etkili beta2-adrenerjik agonistler, astım tedavisi için kullanıldığında astımla ilişkili ölümlerde dahil olmak üzere, astıma bağlı ciddi advers olay riskini artırabilir. Akut kullanım için değildirAGLİKO PLUS, akut bronkospazm ataklarının tedavisi için endike değildir. Aşırı duyarlılıkcAŞLİKoft : P.LU^SH?, ^(kiiL^r^İ!i3İ?Ü;5«dakaİ^
|,al
ından sonra ^ V.^ j.;ps^7www.turKiye.goV.wsagliK-ııtcK-eDysaniden ortaya çıkan aşırı duyarlılık reaksiyonları bildirilmiştir. Alerjik reaksiyonları düşü^^iren belirtiler, özellikle anjiyoödem (nefes alma veya yutmada güçlük, dil, dudak ve yüzün şişmesi) ürtiker veya deri döküntüsü ortaya çıkarsa, tedavi derhal kesilmeli ve alternatif tedavibaşlatılmalıdır. Paradoksal bronkospazmAGLİKO PLUS uygulaması yaşamı tehdit edebilecek paradoksal bronkospazm ile sonuçlanabilir. Böyle bir durum oluşursa, tedavi derhal kesilmeli ve alternatif tedavi uygulanmalıdır. Glikopironyum ile ilgili antikolinerjik etkilerDar açılı glokomDar açılı glokomu olan hastalara dair veri yoktur, bu nedenle bu hastalarda AGLİKO PLUS dikkatli kullanılmalıdır. Hastalar akut dar açılı glokom belirtileri ve semptomları hakkında bilgilendirilmeli ve bu belirti veya semptomlardan herhangi biri gelişirse AGLİKO PLUS kullanmayı bırakmaları konusundabilgilendirilmelidir. Üriner retansiyonÜriner retansiyonu olan hastalara dair veri yoktur, bu nedenle bu hastalarda AGLİKO PLUS dikkatli kullanılmalıdır. Şiddetli böbrek yetmezliği olan hastalarHafif ve orta derecede böbrek yetmezliği olan hastalarda, 1,4 kata kadar olan toplam sistem glikopironyum maruziyetinde (EAAson), şiddetli ve son dönem böbrek yetmezliği olan hastalarda2,2 kata kadar olan toplam sistem glikopironyum maruziyetinde (EAAson) ılımlı ortalama artışgörülmüştür. Diyaliz gerektiren son dönem böbrek yetmezliği olanlar da dahil olmak üzere, şiddetliböbrek yetmezliği olan hastalarda (tahmini glomerüler filtrasyon hızı 30 ml/dak /1,73 m2'ninaltında), İndakaterol/Glikopironyum, sadece beklenen fayda potansiyel riskten daha önemli isekullanılmalıdır (bkz. Bölüm 5.2). Bu hastalar potansiyel advers reaksiyonlar açısından yakındanizlenmelidir. Kardiyovasküler etkilerAGLİKO PLUS, kardiyovasküler bozuklukları (koroner arter hastalık, akut miyokard enfarktüsü, kardiyak aritmiler, hipertansiyon) olan hastalarda dikkatle kullanılmalıdır. Beta2-adrenerjik agonistler, bazı hastalarda nabız, kan basıncı ve/veya semptomlardaki artışlarla ölçülen, klinik olarak anlamlı bir kardiyovasküler etki üretebilir. Bu beşeri tıbbi ürünle bu türetkilerin ortaya çıkması durumunda, tedavinin kesilmesi gerekebilir. Ek olarak, beta-adrenerjikagonistlerin, her ne kadar bu gözlemlerin klinik önemi bilinmese de, T dalgasının düzleşmesi, QTaralığının uzaması ve ST segment depresyonu gibi elektrokardiyografik (EKG) değişikliklerürettikleri bildirilmiştir. Bu nedenle, QT aralığında bilinen veya şüphelenilen uzaması olanhastalarda veya QT aralığını etkileyen beşeri tıbbi ürünlerle tedavi edilen hastalarda uzun etkilibeta2-adrenerjik agonistler, dikkatle kullanılmalıdır. Stabil olmayan iskemik kalp hastalığı, sol ventrikül yetmezliği, miyokard enfarktüsü öyküsü, aritmi (kronik stabil atriyal fibrilasyon hariç), uzun QT sendromu öyküsü olan veya QTc (Fridericiayöntemi) uzamış (> 450 ms) hastalar klinik çalışmalarda çalışma dışı bırakılmıştır, dolayısıyla buhasta gruplarında deneyim yoktur. Bu hasta gruplarında AGLİKO PLUS dikkatli kullanılmalıdır. HipokalemiBeta2-adrenerjik agonistler, bazı hastalarda olumsuz kardiyovasküler etkilere sebep olma potansiyeline sahip, beligin hipokalemiye sebep olabilir. Serum potasyumundaki azalma genelliklegeçicidir, takviye gerektirmözlge^ddetHekK0ıAHaiba®tai®rı®da, hipokalemi hipoksi ve eşlik eden Belge aıitmiÇg^
AGLİKO PLUS 'ın önerilen terapötik dozunda yapılan klinik çalışmalarında, hipokaleminin klinik olarak anlamlı etkileri gözlenmemiştir (bkz. Bölüm 5.1). HiperglisemiYüksek dozda beta2-adrenerjik agonistlerin solunması, plazma glikozunda artışlara neden olabilir. Diyabetik hastalarda AGLİKO PLUS ile tedaviye başlandıktan sonra plazma glikozu daha yakındanizlenmelidir. Uzun süreli klinik çalışmalar sırasında, önerilen dozda AGLİKO PLUS kullanan daha fazla hasta, plaseboya (%2,7) kıyasla, kan şekerinde klinik olarak kayda değer değişiklikler (%4,9) yaşamıştır.AGLİKO PLUS, diyabetes mellitus'un iyi kontrol edilmediği hastalarda araştırılmamıştır, bunedenle bu tür hastalarda dikkatli ve uygun izleme önerilmektedir. Genel rahatsızlıklarAGLİKO PLUS, konvulsif rahatsızlıkları veya tirotoksikozu olan hastalarda ve beta2-adrenerjik agonistlere alışılmadık derecede duyarlı olan hastalarda dikkatle kullanılmalıdır. Yardımcı maddelerBu beşeri tıbbi ürün laktoz içerir. Galaktoz intoleransı, toplam laktaz yetmezliği veya glikoz-galaktoz malabsorpsiyonu gibi nadir kalıtsal problemleri olan hastalar bu beşeri tıbbi ürünü kullanmamalıdır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriHer ikisi de etkin madde olan ve kararlı durum şartları altında oral yolla uygulanan inhale indakaterol ve glikopironyumun birlikte uygulanması, her iki etkin maddenin de farmakokinetiğinietkilememiştir. AGLİKO PLUS ile spesifik bir etkileşim çalışması yapılmamıştır. Etkileşim potansiyeli hakkında bilgi, iki etkin maddenin her birinin potansiyeline dayanmaktadır. Aşağıdakilerle birlikte kullanımı önerilmemektedirBeta-adrenerjik blokerlerBeta-adrenerjik blokerler, beta2-adrenerjik agonistlerin etkisini zayıflatabilir veya antagonize edebilir. Bu nedenle, AGLİKO PLUS, kullanımları için zorlayıcı nedenler olmadıkça, beta-adrenerjik blokerlerle (göz damlaları dahil) birlikte verilmemelidir. Gerektiğinde, kardiyoselektifbeta-adrenerjik blokerler tercih edilmeli, ancak dikkatle uygulanmalıdır. AntikolinerjiklerAGLİKO PLUS'ın antikolinerjik içeren diğer beşeri tıbbi ürünlerle birlikte uygulanması araştırılmamıştır ve bu nedenle önerilmemektedir (bkz. Bölüm 4.4). SempatomimetiklerDiğer sempatomimetiklerin (tek başına veya kombinasyon terapisinin bir parçası olarak) birlikte uygulanması, indakaterolün advers etkilerini güçlendirebilir (bkz. Bölüm 4.4). Aşağıdakilerle birlikte kullanımda dikkat edilmesi gerekmektedirHipokalemi tedavisiEşlik eden ve metilksantin türevleri, steroidler veya potasyum tutucu olmayan diüretiklerle yapılan hipokalemik tedavi, beta2-adrenerjik agonistlerin olası hipokalemik etkisini güçlendirebilir, bunedenle dikkatli kullanılmalıdır (bkz. Bölüm 4.4). Belge D02://www.turkiye.gov.tr/saglik-titck-ebys Metabolik ve taşıyıcı tabanlı etkileşimlerİndakaterol klerensi, CYP3A4 ve P-glikoproteinin (P-gp) önemli katkı maddelerinin inhibisyonu, indakaterolün sistemik maruziyetini iki katına kadar çıkarır. Maruziyetin büyüklüğündekietkileşimlere bağlı artış, önerilen maksimum indakaterol dozunun iki katına kadar olan dozlarda biryıla kadar klinik çalışmalarda indakaterol ile yapılan güvenlilik deneyimi göz önüne alındığında,herhangi bir güvenlilik endişesi yaratmaz. Simetidin veya diğer organik katyon taşıyıcı inhibitörlerSağlıklı gönüllülerde yapılan bir klinik çalışmada, glikopironyumun renal atılımına katkıda bulunduğu düşünülen organik katyon taşınmasının bir inhibitörü olan simetidin, glikopironyumatoplam maruz kalmayı (EAA) %22 oranında arttırmış ve renal klerensi %23 oranında azaltmıştır.Bu değişikliklerin büyüklüğüne bağlı olarak, glikopironyum, simetidin veya organik katyontaşıyıcının diğer inhibitörleri ile birlikte uygulandığında, klinik olarak anlamlı ilaç etkileşimibeklenmez. 4.6 Gebelik ve laktasyonGenel Tavsiye:Gebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon) uygulayanlarda kullanımına ilişkin herhangi bir veri yoktur. Gebelik dönemi:Hamile kadınlarda AGLİKO PLUS kullanımıyla ilgili mevcut veri bulunmamaktadır. Hayvan çalışmaları, klinik olarak anlamlı maruziyetlerde üreme toksisitesi ile ilgili doğrudan veya dolaylızararlı etkiler olduğunu göstermemektedir (bkz. Bölüm 5.3). İndakaterol, uterus düz kasında gevşetici bir etki nedeniyle doğumu engelleyebilir. Bu nedenle, AGLİKO PLUS sadece hasta için beklenen fayda, fetusun potansiyel riski için gerekçeoluşturuyorsa, hamilelik sırasında kullanılmalıdır. Laktasyon dönemi:İndakaterol, glikopironyum ve metabolitlerinin anne sütüne geçip geçmediği bilinmemektedir. Mevcut farmakokinetik/toksikolojik veriler, indakaterol, glikopironyum ve metabolitlerinin emzirensıçanların sütüyle atılımını göstermiştir. AGLİKO PLUS'ın emziren kadınlar tarafındankullanılması, ancak anne için beklenen faydanın, bebek için olası herhangi bir riskten daha fazlaolması durumunda düşünülmelidir (bkz. Bölüm 5.3). Üreme yeteneği /FertiliteÜreme çalışmaları ve hayvanlardaki diğer veriler, hem erkeklerde hem de kadınlarda doğurganlıkla ilgili bir endişeye işaret etmemektedir. 4.7 Araç ve makine kullanımı üzerindeki etkilerAGLİKO PLUS'ın araç ve makine kullanma yeteneği üzerinde hiçbir etkisi yoktur. Bununla birlikte, baş dönmesini de içeren sersemlik hali ortaya çıkması, araç ve makine kullanma yeteneğinietkileyebilir (bkz.Bölüm 4.8).
4.8 İstenmeyen etkilerGüvenlilik profilinin sunumu, AGLİKO PLUS ve etkin maddelerin her biriyle ilgili deneyime dayanmaktadır. Güvenlilik profilinin özetiİndakaterol / Glikopironyum ile güvenlilik deneyimi, 15 aya kadar önerilen terapötik dozda maruziyetten oluşmaktaydı. İndakaterol / Glikopironyum, her bir bileşene benzer advers reaksiyonlar göstermiştir. indakaterol ve glikopironyum içerdiğinden, bu bileşenlerin her biriyle ilişkili advers reaksiyonların türü veşiddeti, kombinasyonda beklenebilir. Güvenlilik profili, kombinasyonun her bir bileşeni ile ilişkili tipik antikolinerjik ve beta- adrenerjik semptomlarla karakterizedir. Beşeri tıbbi ürünle ilgili diğer en yaygın advers reaksiyonlar(İndakaterol / Glikopironyum için hastaların en az %3'ü ve ayrıca plasebodan daha büyük) öksürük,nazofarenjit ve baş ağrısı idi. Advers reaksiyonların tablo halinde özetiKlinik çalışmalar sırasında ve pazarlama sonrası kaynaklardan tespit edilen advers reaksiyonlar MedDRA sistem organ sınıfı tarafından listelenmiştir (Tablo 1). Advers reaksiyonlar, her sistemorgan sınıfı içinde, en sık görülen reaksiyonlar önce olmak üzere, sıklığa göre sıralanır. Her birsıklık grubunda, advers reaksiyonlar azalan ciddiyet sırasına göre sunulmaktadır. Ek olarak, heradvers reaksiyon için karşılık gelen sıklık sınıflandırması aşağıdaki düzene dayanmaktadır: çokyaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek(>1/10.000,<1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle belirlenemiyor). Tablo 1 Advers reaksiyonlar
Belge ]

1 İndakaterol/glikopironyum ile gözlenen, ancak tek tek bileşenlerle görülmeyen adversreaksiyon. 2 Pazarlama sonrası deneyimden elde edilen raporlar; sıklıklar klinik araştırma verilerinedayanarak hesaplanmıştır. Seçilen advers reaksiyonların tanımıÖksürük yaygın, ancak genellikle hafif şiddette. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanaksağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;4.9 Doz aşımı ve tedavisiAGLİKO PLUS ile klinik olarak anlamlı doz aşımı hakkında bilgi yoktur. Aşırı doz, taşikardi, titreme, çarpıntı, baş ağrısı, bulantı, kusma, uyuşukluk, ventriküler aritmiler, metabolik asidoz, hipokalemi ve hiperglisemi gibi beta2-adrenerjik uyarıcıların tipik etkilerininabartılı olarak ortaya çıkmasına yol açabilir veya artmış intraoküler basınç (ağrı, görmebozuklukları veya gözün kızarmasına neden olur), obstipasyon veya işeme zorlukları gibiantikoinerjik etkileri indükleyebilir. Destekleyici ve semptomatik tedavi endikedir. Ciddi vakalardahastalar hastaneye yatırılmalıdır. Beta2-adrenerjik etkilerin tedavisi için kardiyoselektif betablokerlerin kullanımı düşünülebilir, ancak beta-adrenerjik blokerlerin kullanımı bronkospazmıprovoke edebileceğinden, yalnızca doktor gözetimi altında, çok dikkatlişekilde kullanılmalıdır.
5- FARMAKOLOJIK ÖZELLIKLER5.1 Farmakodinamik özellikler
havayolu hastalıkları için ilaçlar, antikolinerjiklerle
Farmakoterapötik grup: Obstrüktif kombinasyon halinde adrenerjikler, ATC kodu: R03AL04 Etki mekanizmasıİndakaterol/Glikopironyumİndakaterol ve glikopironyum birlikte uygulandığında, düz kas gevşemesini sağlamak için farklı reseptörleri ve yolları hedefleyen farklı etki biçimleri nedeniyle, ek etkililik sağlarlar. Merkeziyekarşı periferik hava yollarındaki beta2-adrenoseptörlerin ve M3-reseptörlerinin diferansiyelyoğunluğu nedeniyle, beta2-agonistleri periferik hava yollarının gevşetilmesinde daha etkiliolmalıdır, ancak bir antikolinerjik bileşik merkezi hava yollarında daha etkili olabilir. Bu nedenle,insan akciğerinin hem periferik hem de merkezi solunum yollarında bronkodilasyon için beta2-adrenerjik agonist ve muskarinik antagonistin bir kombinasyonu faydalı olabilir. indakaterolİndakaterol, günde bir kez uygulama için uzun etkili bir beta2-adrenerjik agonisttir. İndakaterol de dahil olmak üzere beta2-adrenoseptör agonistlerinin farmakolojik etkileri, en azından kısmen,adenosin trifosfatın (ATP) siklik-3 ', 5'-adenosin monofosfata (siklik AMP) dönüşümünü katalizeeden enzim olan intraselüler adenil siklazın stimülasyonuna dayandırılabilir. Artmış siklik AMPseviyeleri bronşiyal düz kasın gevşemesine neden olur. In vitro çalışmalar, indakaterolün beta2-reseptörlerinde beta1 ve beta3-reseptörlerine kıyasla kat kat daha fazla agonist aktiviteye sahipolduğunu göstermiştir. Solunduğunda, indakaterol lokal olarak akciğerde bronkodilatör olarak hareket eder. İndakaterol, nanomolar potansiyeli olan insan beta2-adrenerjik reseptöründe kısmi bir agonisttir. Her ne kadar beta2-adrenerjik reseptörler bronşiyal düz kasta ve beta1-adrenerjik reseptörlerinsan kalbinde baskın reseptörler olsa da, kalpte toplam adrenerjik reseptörlerin %10 ila %50'sinioluşturan beta2-adrenerjik reseptörler de vardır. Kalpteki varlığı, oldukça seçici beta2- adrenerjikagonistlerin bile kardiyak etkilere sahip olma olasılığını artırır. GlikopironyumGlikopirronyum, KOAH'ın günde bir kez idame bronkodilatör tedavisi için inhale uzun etkili muskarinik reseptör antagonistidir (antikolinerjik). Parasempatik sinirler, solunum yollarındaki anabronkokonstriktif sinir yoludur ve kolinerjik ton, KOAH'ta hava akışı tıkanıklığının önemli geridönüşümlü bileşenidir. Glikopironyum, asetilkolinin hava yolu düz kas hücreleri üzerindekibronkokonstriktör etkisini bloke eder, böylece hava yollarını genişletir. Glikopironyum bromür, yüksek duyarlılıklı bir muskarinik reseptör antagonistidir. İnsan M2 reseptöründen fazla M3 reseptörleri için 4 kattan fazla seçicilik, radyoligand bağlanma çalışmalarıkullanılarak gösterilmiştir. Farmakodinamik etkilerİndakaterol ve glikopironyum kombinasyonu, dozlamadan sonraki 5 dakika içinde hızlı bir etki başlangıcı göstermiştir. Etki, 24 saatlik doz aralığı boyunca sabit kalır.  Belge Dosio26/shaf^^aliike>tBdaviden sonra 320 mİ idi. Etki, tek başına indakaterol, glikopironyum veya tiotropiy|| karşılaştırıldığında, İndakaterol/Glikopironyum için anlamlı olarak daha yüksekti (her karşılaştırma için 110 ml'lik fark). Plasebo veya monoterapi bileşenleriyle karşılaştırıldığında, İndakaterol/Glikopironyum etkisi ile ilgili zaman içinde taşifilaksiye dair kanıt yoktu. Kalp atış hızı üzerindeki etkilerSağlıklı gönüllülerdeki kalp atış hızı etkileri, her biri İndakaterol/Glikopironyum 'un önerilen terapötik dozundan 4 kat fazla olan dozların birer saat aralıklarla dört sefer uygulanmasınınardından, plasebo, indakaterol, glikopironyum ve salmeterolün etkileriyle kıyaslanarak araştırıldı. Plaseboya kıyasla en büyük zaman uyumlu kalp atış hızı artışı +5,69 bpm (% 90 CI [2,71, 8,66]), en büyük azalma -2,51 bpm (% 90 CI [-5,48, 0,47]) idi. Genel olarak zaman içindeki kalp atış hızıüzerindeki etkisi, İndakaterol/Glikopironyum'un tutarlı bir farmakodinamik etkisini göstermedi. Supraoterapötik doz düzeylerinde KOAH hastalarında kalp atış hızı araştırıldı. İndakaterol/Glikopironyum 'un 24 saat boyunca ortalama kalp atış hızı ve 30 dakika, 4 saat ve 24saat sonra değerlendirilen kalp atış hızı üzerinde hiçbir ilgili etkisi olmamıştır. QT aralığıİndakaterol/Glikopironyum bileşenlerinin klinik doz seviyelerinde QT uzama potansiyeline sahip olduğu bilinmemektedir. Yüksek doz inhale indakaterol (önerilen maksimum terapötik dozun ikikatına kadar) ile sağlıklı gönüllülerde yapılan bir kapsamlı QT (TQT) çalışması, QT aralığı üzerindeklinik olarak anlamlı bir etki göstermemiştir. Benzer şekilde, yapılan bir TQT çalışmasında,glikopironyum için, önerilen terapötik dozun 8 katının solunmasının ardından QT uzamasıgözlenmemiştir. İndakaterol/Glikopironyum 'un QTc aralığı üzerindeki etkileri, sağlıklı gönüllülerde, İndakaterol/Glikopironyum 'un önerilen terapötik dozunun 4 katı fazlasının birer saat aralıklarla dört defada inhalasyonundan sonra araştırıldı. Plaseboya karşı en büyük zaman uyumlu fark 4,62 ms(% 90 CI 0,40, 8,85 ms), en büyük zaman uyumlu azalma -2,71 ms (% 90CI -6,97, 1,54 ms) idi vebu da İndakaterol/Glikopironyum 'un, QT aralığı üzerine, bileşenlerinin özelliklerinden beklendiğigibi, ilgili bir etkisinin olmadığını gösterdi. KOAH hastalarında, 116 mikrogram/86 mikrogram ve 464 mikrogram/86 mikrogram arasındaki İndakaterol/Glikopironyum supraoterapötik dozları, QTcF'li hastaların başlangıç değerine göre 30ms ve 60 ms arasında daha yüksek bir oran gösterdi (plasebo için %16,0 ila %21,6 ve 1,9 arasındadeğişiyor), ancak başlangıç değerden >60 ms QTcF artışı yoktu. Ayrıca 464 mikrogram/86mikrogramlık en yüksek doz İndakaterol/Glikopironyum seviyesi, daha yüksek oranda mutlak QTcFdeğerleri > 450 ms (plasebo için %12,2'ye karşı % 5,7) gösterdi. Serum potasyum ve kan şekeriSağlıklı gönüllülerde, tavsiye edilen terapötik İndakaterol/Glikopironyum dozunun 4 katının uygulanmasından sonra, serum potasyum üzerindeki etki çok küçüktü (plaseboya kıyaslamaksimumfark -0,14 mmol/l). Kan şekeri üzerindeki maksimum etki 0,67 mmol/ l idi. Klinik etkililik ve güvenlilikİndakaterol/Glikopironyum klinik Faz III geliştirme programı, 8.000'den fazla hastanın kaydolduğu altı çalışmayı içermiştir: 1) 26 haftalık plasebo ve aktif kontrollü (günde bir kez indakaterol, gündebir kez glikopironyum, günde bir kez açık etiketli tiotropiyum); 2) 26 haftalık aktif kontrollü(flutikazon/salmeterol günde iki kez) çalışma; 3) 64 haftalık aktif kontrollü (günde bir kezglikopironyum, günde bir feeziaçgkeeiikietlinitiotröpiyum^nçalışma; 4) 52 haftalık plasebo kontrollüBelgekontrSifö  çalışması; ve 6) 52 haftalık aktif kontrollü (günde iki kez flutikazon/salmeterol) çalışma. 10 / 23 Bu çalışmaların dördünde, orta ila şiddetli KOAH klinik tanısı olan hastalar çalışmaya alındı. 64 haftalık çalışmaya, bir önceki yıl >1 orta veya şiddetli KOAH alevlenmesi öyküsü olan şiddetli ilaçok şiddetli KOAH tanısı almış hastalar dahil edildi. 52 haftalık aktif kontrollü çalışmada, birönceki yılda >1 orta veya şiddetli KOAH alevlenmesi öyküsü olan orta ila çok şiddetli KOAH'lıhastalar çalışmaya alındı. Akciğer fonksiyonu üzerindeki etkilerİndakaterol/Glikopironyum, bir dizi klinik çalışmada akciğer fonksiyonunda (bir saniyede zorlanan ekspiratuar hacim ile ölçülen şekliyle, FEVı) klinik olarak anlamlı iyileşmeler gösterdi. Faz IIIçalışmalarında, ilk dozdan sonraki 5 dakika içinde bronkodilatör etkileri görüldü ve bu etki ilkdozdan itibaren 24 saatlik dozlama aralığı boyunca korundu. Bronkodilatör etkisinde zamanlazayıflama gözlenmedi. Etkinin büyüklüğü, referans değerde hava akışı sınırlamasının geri çevrilebilirlik derecesine bağlıydı (kısa etkili muskarinik antagonist bronkodilatör ve kısa etkili beta2-agonistbronkodilatörün uygulanmasıyla test edilmiştir): Başlangıçta en düşük düzelebilirlik derecesinesahip hastalar (<%5), genellikle başlangıçta düzelebilirlik derecesi daha yüksek olan hastalardan(>%5) daha düşük bronkodilatör yanıtı göstermiştir. 26 haftada (primer sonlanım noktası)İndakaterol/Glikopironyum, en düşük düzelebilirlik dereceli (<%5) (p = 0,053) en düşük FEV1'i 80ml arttırmıştır (İndakaterol/Glikopironyum n = 82; plasebo n = 42) ve başlangıçta düzelebilirlikderecesi (>%5) plaseboya kıyasla (p <0,001) daha yüksek olan hastalarda 220 ml arttırmıştır(İndakaterol/Glikopironyum n = 392, plasebo n = 190). En düşük ve en yüksek FEV1: İndakaterol/Glikopironyum, 26 haftalık primer sonlanım noktasında (p <0,001) plaseboya kıyasla doz sonrası en düşük FEV1'i 200 ml arttırdı ve her monoterapi bileşeni tedavi kolu (indakaterol veglikopironyum) ile tiotropiyum tedavi koluna kıyasla, aşağıdaki tabloda gösterildiği gibi,istatistiksel olarak anlamlı artışlar gösterdi. Doz sonrası en düşük F(en küçük ortalama kareler), 1. Gün ve 26. hafta (primer sonlanım noktası)
a Kodu: JZJE56SHY3ZW56ZmxXaklUS3k0Q3NRZlAK , , .-Relga Takip Adresi:l)ttps://www,turkiye.gC|V.tr/sagliKititck-ebys, «,aJcaterof/Glıkopıronyum tenine istatistiksel olarak anlamlıydı. 26. haftadaBelge D(wu]Ortalama doz öncesi FEV1 (çalışma ilacı sabah dozundan 45 ve 15 dakika önce alınan değerlerin ortalaması), 26. haftada flutikazon/salmeterol (en küçük kareler [LS]ortalama tedavifarkı 100 ml, p<0,001) ile karşılaştırıldığında, 52. haftada plasebo (LS ortalama tedavi farkı 189 ml, p <0,001)ile karşılaştırıldığında ve 64. haftaya kadar yapılan tüm vizitlerde glikopironyum (LS ortalamatedavi farkı 70-80 ml, p <0,001) ve tiotropiyum (LS ortalama tedavi farkı 60-80 ml, p <0,001) ilekarşılaştırıldığında İndakaterol/Glikopironyum lehineistatistiksel olarak anlamlıydı. 52 haftalık aktifkontrollü çalışmada, flutikazon/salmeterol (LS ortalama tedavi farkı 62-86 ml, p <0,001) ilekarşılaştırıldığında, 52. fia^ayaüvkadfeftroıolaff aitümaiaıvizitlerde ortalama doz öncesi FEV1, İndakaterol/Glikopironyum, dozdan sonraki ilk 4 saatte plasebo ile karşılaştırıldığında, FEVı en yüksek değerinde istatistiksel olarak anlamlı iyileşme gösterdi(LS ortalama tedavi farkı 330 ml)(p <0,001). FEVı EAA: İndakaterol/Glikopironyum, 26 haftada flutikazon/salmeterol ile karşılaştırıldığında, dozsonrası FEVı EAAo-i2'yi (primer sonlanım noktası) 140 ml arttırdı (p <0,001). Semptomatik sonuçlarNefes darlığı:İndakaterol/Glikopironyum, Geçiş Dispne İndeksi (TDI) ile değerlendirilen nefes darlığını istatistiksel olarak önemli ölçüde azalttı; plasebo (LS ortalama tedavi farkı 1,09, p <0,001),tiotropiyum (LS ortalama tedavi farkı 0,51, p = 0,007) ve flutikazon/salmeterol (LS ortalama tedavifarkı 0,76, p = 0,003) ile karşılaştırıldığında 26. haftadaki TDI odak skorunda istatistiksel olarakanlamlı bir iyileşme gösterdi. İndakaterol ve glikopironyumdaki iyileşmeler sırasıyla 0,26 ve 0,21idi. İndakaterol/Glikopironyum alan hastaların istatistiksel olarak anlamlı derecede yüksek bir yüzdesi, 26. haftada TDI odak skorunda plaseboya kıyasla 1 puan veya daha fazla iyileşme ile yanıt verdi(sırasıyla %68,1 ve %57,5, p = 0,004). Hastaların daha yüksek bir oranı, 26. haftadaİndakaterol/Glikopironyum ile tiotropiyum (%68,1 İndakaterol/Glikopironyum 'a karşı %59,2tiotropiyum, p = 0,016) ve flutikazon/salmeterol (%65,1 İndakaterol/Glikopironyum 'a karşı %55,5flutikazon/salmeterol, p = 0,088) ile karşılaştırıldığında klinik olarak anlamlı yanıt sergilemiştir. Sağlıkla ilişkili yaşam kalitesi: İndakaterol/Glikopironyum, ayrıca plasebo (LS ortalama tedavi farkı -3,01, p = 0,002) ve tiotropiyum (LS ortalama tedavi farkı -2,13, p = 0,009) ile karşılaştırıldığında 26 haftada SGRQtoplam skorunda bir azalma ve indakaterol ve glikopironuma karşı sırasıyla -1,09 ve - 1,18azalmalar ile belirtildiği gibi, St. George Solunum Anketi (SGRQ) kullanılarak ölçülen sağlıklailişkili yaşam kalitesi üzerinde istatistiksel olarak anlamlı bir etki göstermiştir. 64. haftada,tiotropiyum ile karşılaştırıldığında azalma istatistiksel olarak anlamlıydı (LS ortalama tedavi farkı -2,69, p <0,001). 52. haftada flutikazon/salmeterol ile karşılaştırıldığında azalma istatistiksel olarakanlamlıydı (LS ortalama tedavi farkı -1,3, p = 0,003). İndakaterol/Glikopironyum alan hastaların daha yüksek bir yüzdesi, 26. haftada plasebo (sırasıyla %63,7 ve%56,6, p = 0,088)ve tiotropiyum ile karşılaştırıldığında (%63,7 İndakaterol/Glikopironyum karşı %56,4 tiotropiyum, p = 0,047), 64. haftada glikopironyum ve tiotropiyum ile karşılaştırıldığında(sırasıyla %57,8 İndakaterol/Glikopironyum, %51,8 glikopironyum, p = 0,055; % 50,8 tiotropiyum, p = 0,051), 52. haftada flutikazon/salmeterol ile karşılaştırıldığında (% 49,2 İndakaterol/Glikopironyum, % 43,7 flutikazon/salmeterol, olasılıkoranı: 1,30, p <0,001) SGRQ skorunda (başlangıçtan en az 4 birim azalma olarak tanımlanmıştır)klinik olarak anlamlı bir iyileşme ile cevap vermiştir. Günlük aktivitelerİndakaterol/Glikopironyum, 26 hafta boyunca "olağan günlük aktivitelerin gerçekleştirilebildiği günler yüzdesinde, tiotropiyum karşısında istatistiksel olarak üstün bir iyileşme gösterdi (LSortalama tedavi farkı %8,45, p <0,001). 64. haftada, İndakaterol/Glikopironyum glikopironyumkarşısında sayısal iyileşme (LS ortalama tedavi farkı %1,95; p = 0,175) ve tiotropiyum karşısındaistatistiksel iyileşme (LS ortalama tedavi farkı %4,96; p = 0,001) gösterdi. ATJ 1 1/¦belgeBelge W56ZmxXaklUS3kOQ3NRZlAxBelge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys İndakaterol/Glikopironyum (n=729), glikopironyum (n=739) ve tiotropiyumun karşılaştırıldığı 64 haftalık çalışmada, İndakaterol/Glikopironyum, orta veya şiddetli KOAH alevlenmelerinin yıllık oranını glikopironyum ile karşılaştırıldığında %12 oranında (p = 0,038) vetiotropiyum ile karşılaştırıldığında %10 oranında (p = 0,096) düşürdü. Orta veya şiddetli KOAHalevlenmesi/hasta-yıl sayısı, İndakaterol/Glikopironyum için 0,94 (812 vaka), glikopironyum için1,07 (900 vaka) ve tiotropyum için 1,06 (898 vaka) idi İndakaterol/Glikopironyum ayrıca, tümKOAH alevlenmelerinin (hafif, orta veya şiddetli) yıllık oranını glikopironyum (p = 0.001) ilekarşılaştırıldığında %15 ve tiotropiyum ile karşılaştırıldığında %14 oranında istatistiksel olarakanlamlı ölçüde azaltmıştır (p = 0,002). Tüm KOAH alevlenmelerinin/hasta-yıl sayısıİndakaterol/Glikopironyum için 3,34 (2.893 vaka), glikopironyum için 3,92 (3.294 vaka) vetiotropyum için 3,89 (3.301 vaka) idi. İndakaterol/Glikopironyum (n = 1.675) ve flutikazon/salmeterolun (n = 1.679) karşılaştırıldığı 52 haftalık çalışmada, İndakaterol/Glikopironyum, eşit etkililik primer çalışma hedefini,flutikazon/salmeterol ile karşılaştırdığında, tüm KOAH alevlenmeleri (hafif, orta veya şiddetli)oranında karşılamıştır. Tüm KOAH alevlenmelerinin/hasta-yıl sayısı İndakaterol / Glikopironyumiçin 3,59(4.531 vaka) ve flutikazon/salmeterol için 4,03(4.969 vaka) idi. İndakaterol/Glikopironyum ayrıca alevlenmelerin yıllık oranında %11 azaltma sağlayarak, flutikazon/salmeterol'e karşı üstünlük gösterdi (p = 0,003). Flutikazon/salmeterol ile karşılaştırıldığında, İndakaterol/Glikopironyum hem orta hem de şiddetli alevlenmelerin yıllık oranını %17 (p <0,001) ve şiddetli alevlenmelerin yıllık oranını (hastaneyeyatmayı gerektiren) %13 (istatistiksel olarak anlamlı değil, p = 0,231) azalttı. Orta veya şiddetliKOAH alevlenmesi/hasta-yıl sayısı İndakaterol/Glikopironyum için 0,98 (1.265 vaka) veflutikazon/salmeterol için 1,19 (1.452 vaka) idi. İndakaterol/Glikopironyum, alevlenme riskinde%22 azalma (p <0,001) ile ilk orta şiddetli alevlenmeye kadar olan süreyi uzattı ve alevlenmeriskinde %19 azalma ile ilk şiddetli alevlenmeye kadar olan süreyi uzattı (p = 0,046). İndakaterol/Glikopironyum kolunda pnömoni insidansı %3,2 idi ve bu oran flutikazon/salmeterol kolunda %4,8 idi (p = 0,017). İlk pnömoniye kadar geçen süre, flutikazon/salmeterol ilekarşılaştırıldığında, İndakaterol/Glikopironyum ile uzatıldı (p = 0,013). İndakaterol/Glikopironyum (n = 258) ve flutikazon/salmeterol'ü (n = 264) 26 hafta boyunca karşılaştıran başka bir çalışmada, orta veya şiddetli KOAH alevlenmesi/hasta-yıl sayısı sırasıyla0,15'e karşı 0,18 (22 vakaya karşı 18 vaka) idi (p = 0,512) ve tüm KOAH alevlenmesi/hasta-yılsayısı (hafif, orta veya şiddetli) sırasıyla 0,72'ye karşı 0,94 (86 vakaya karşı 113 vaka) idi (p =0,098). Kurtarma ilaç tedavisi kullanımı26 hafta boyunca, İndakaterol/Glikopironyum, kurtarma ilacı (salbutamol) kullanımını plaseboya kıyasla günde 0,96 puf (p <0,001), tiotropiyuma kıyasla günde 0,54 puf (p <0,001) veflutikazon/salmeterola kıyasla günde 0,39 puf (p = 0,019) olarak, istatistiksel olarak anlamlıderecede azaltmıştır. 64 hafta boyunca bu azalma, tiotropiyum ile karşılaştırıldığında günde 0,76puf(p <0,001) idi. 52 hafta boyunca, İndakaterol/Glikopironyum kurtarma ilacı kullanımını,flutikazon/salmeterol ile karşılaştırıldığında günde 0,25 puf azalttı (p <0,001). Egzersiz toleransıSabahları alınan İndakaterol/Glikopironyum, dinamik hiperinflasyonu azalttı ve ilk dozdan itibaren sürdürülebilen egzersiz süresini iyileştirdi. Tedavinin ilk gününde, egzersiz altındaki inspiratuarkapasite plaseboya kıyasla anlamlı derecede iyileşti (LS ortalama tedavi farkı 250 ml, p <0,001).Üç haftalık tedaviden sonra, İndakaterol/Glikopironyum ile inspiratuar kapasitedeki iyileşmeplaseboya kıyasla daha da büyüktü (LS ortalama tedavi farkı 320 ml, p ^r\ r\r\^\* jBu helecv güvenli elektronik İmza İle imzalanmıatır.^ \j. a*121cr\ cBeigeDo<0,°Pa1)dvezegzeisiz\\dıyaBiilıllllo(!üresiAPlaseboy|ekiMaslcaesarttıs :/(LS.tsrtalama/satgedaivcic-efarkı 59,5  saniye, p = 0,006). Pediyatrik popülasyonAvrupa İlaç Ajansı, kronik obstrüktif akciğer hastalığında (KOAH) pediyatrik popülasyonuntüm alt kümelerinde İndakaterol/Glikopironyum ile yapılan çalışmaların sonuçlarını göndermezorunluluğundan vazgeçmiştir (pediatrik kullanım hakkında bilgi için bölüm 4.2'ye bakınız). 5.2 Farmakokinetik özelliklerGenel özellikler:Emilimİndakaterol/Glikopironyumİndakaterol/Glikopironyum solunduktan sonra, indakaterol ve glikopironyumun pik plazma konsantrasyonlarına ulaşmak için ortalama süre sırasıyla yaklaşık 15 dakika ve 5 dakikadır. In vitro performans verilerine dayanarak, akciğere verilen indakaterol dozunun İndakaterol/Glikopironyum ve indakaterol monoterapi ürünü için benzer olması beklenir.İndakaterol/Glikopironyum inhalasyonundan sonra indakaterole kararlı durum maruziyeti,indakaterol monoterapi ürünü inhalasyonundan sonra sistemik maruziyete benzer veya biraz dahadüşüktü. İndakaterol/Glikopironyum inhalasyonunun ardından indakaterolün mutlak biyoyararlanımının, verilen dozun %61 ila 85'i arasında olduğu ve glikopironyumun, verilen dozun yaklaşık%47'si arasında olduğu hesaplanmıştır. İndakaterol/Glikopironyum inhalasyonundan sonra glikopironuma kararlı durum maruziyeti, glikopironyum monoterapi ürünü inhalasyonundan sonraki sistemik maruziyete benzerdi. İndakaterolİndakaterolün kararlı durum konsantrasyonlarına, günde bir kez uygulandıktan sonraki 12 ila 15 gün içinde ulaşılmıştır. İndakaterol, yani EAA'nın 1. güne kıyasla 14. günde veya 15.günde 24saatlik dozlama aralığı boyunca ortalama birikme oranı, 60 mikrogram ile 480 mikrogram (verilendoz) aralığındaki günde bir kez solunan dozlar için 2,9 ila 3,8 arasındaydı. GlikopironyumKOAH'lı hastalarda, tedavinin başlamasından sonraki bir hafta içinde glikopironyumfarmakokinetik kararlı durumuna ulaşıldı. Önerilen günde-bir kez uygulanan dozlama rejiminde glikopironyumunkararlı durum ortalama en yüksek ve en düşük plazmakonsantrasyonları sırasıyla 166 pikogram/mlve 8 pikogram/ml idi. Glikopironyuma (24 saatlik dozlama aralığı boyunca EAA) kararlı durummaruziyeti, ilk dozdan sonra yaklaşık 1,4 ila 1,7 kat daha yüksekti. Dağılımİndakaterolİntravenöz infüzyondan sonra terminal eliminasyon fazı sırasında indakaterolün dağılım hacmi, geniş bir dağılımı gösterir şekilde 2.557 litredir. In vitroinsan serumu ve plazma proteinlerinebağlanma yaklaşık %95 idi.Glikopironyumİntravenöz dozlamadan sonra, glikopironyumun kararlı durum dağılım hacmi 83 litredir ve
terminal fazdaki dağılım hacmi 376 litredir. İnhalasyondan sonra terminal fazdaki görünür dağılım hacmi neredeyse 20 kat daha büyüktü, bu da inhalasyondan sonra daha yavaş eliminasyonu yansıtır.Glikopironyumun in vitroinsan plazma proteinlerine bağlanması, 1 ila 10 nanogram/mlkonsantrasyonlarda %38 ila %41 idi.BiyotransformasyonindakaterolBir insan ADME (emilim, dağılım, metabolizma, atılım) çalışmasında radyoaktif etiketli indakaterolün oral uygulamasından sonra, değişmemiş indakaterol ana bileşendir ve 24 saat içindeserumda toplam ilaçla ilgili EAA'nın yaklaşık üçte birini oluşturur. Hidroksillenmiş bir türev,serumdaki en önemli metabolittir. İndakaterol ve hidroksile indakaterolün fenolik O- glukuronidleri,daha da belirgin metabolitlerdir. Hidroksillenmiş türevin bir diastereomeri, indakaterolün N-glukuronidi ve C- ve N-dealkilatlı ürünler, ayrıca tanımlanan metabolitlerdir. In vitroUGT1A1 izoformu, indakaterolün metabolik klerensine önemli bir katkıda bulunur. Bununla birlikte, farklı UGT1A1 genotiplerine sahip popülasyonlarda yapılan bir klinik çalışmadagösterildiği gibi, indakaterole sistemik maruziyet UGT1A1-genotipinden önemli ölçüdeetkilenmemektedir.Rekombinant CYP1A1, CYP2D6 ve CYP3A4 ile inkübasyonlarda oksidatif metabolitler bulunmuştur. CYP3A4'ün, indakaterolün hidroksilasyonundan sorumlu baskın izoenzim olduğusonucuna varılmıştır. In vitroaraştırmalar ayrıca indakaterolün, P-gp atım pompası için düşükafiniteli bir substrat olduğunu göstermiştir.GlikopironyumIn vitroin vivoolarak M9 oluşmuştur.Glikopironyumun glukuronid ve/veya sülfat konjugatları, tekrarlanan inhalasyondan sonra insanidrarında bulunmuştur ve verilen dozun yaklaşık %3'ünüoluşturmaktadır.Çoklu CYP izoenzimleri, glikopironyumun oksidatif biyotransformasyonuna katkıda bulunur. Glikopironyum metabolizmasının inhibisyonu veya indüklenmesi, etkin maddeye sistemikmaruziyette ilgili bir değişikliğe yol açmaz. In vitroIn vitroenzim indüksiyon çalışmaları, test edilen sitokrom P450 izoenzimlerindenherhangi biri veya UGT1A1 ve MDR1 ve MRP2 taşıyıcıları için glikopironyum bromür ile klinikolarak anlamlı bir indüksiyon göstermedi.EliminasyonindakaterolKlinik çalışmalarda, idrar yoluyla değişmeden atılan indakaterol miktarı genellikle verilen dozun %2,5'inden daha düşük olmuştur. İndakaterolün renal klerensi ortalama olarak 0,46 ila 1,2 litre/saat arasındadır. 23,3 ütrg/saafl^ eiftdâfeat§£8lüiftzsejumr.klerensiyle karşılaştırıldığında. renal  klerensin sistemik olarak mevcut indakaterolün ortadan kaldırılmasında küçük bir rol oynadığı (sistemik klerensin yaklaşık %2 ila 5'i) açıktır. Bir insan ADME çalışmasında, oral yoldan verilen indakaterol, esas olarak değişmemiş ana madde (dozun %54'ü) ve daha az ölçüde hidroksillenmiş indakaterol metabolitleri (dozun %23'ü)olarak insan dışkısıyla atılmaktadır. İndakaterol serum konsantrasyonları, ortalama terminal yarı ömrü 45,5 ila 126 saat arasında değişen çok fazlı bir şekilde azalmıştır. Tekrarlanan dozlamadan sonra indakaterol birikimindenhesaplanan etkili yarılanma ömrü, yaklaşık 12-15 günlük gözlemlenen zaman- kararlı durum iletutarlı olarak 40 ila 52 saat arasında değişmiştir. Glikopironyum[3H] etiketli glikopironyum bromürün intravenöz uygulamasından sonra, 48 saat içinde ortalama idrar yoluyla radyoaktivite atılımı dozun %85'ini oluşturmuştur. Dozun %5'lik bir kısmı da safradabulunmuştur. Ana ilacın renal eliminasyonu, sistemik olarak mevcut glikopironyumun toplam klerensinin yaklaşık %60 ila 70'ini oluştururken, böbrek dışı klerens yaklaşık %30 ila 40'tır. Biliyer klerensrenal olmayan klerense katkıda bulunur, ancak renal olmayan klerensin çoğunun metabolizmayabağlı olduğu düşünülmektedir. İnhalasyonu takiben glikopironyumun ortalama renal klerensi 17,4 ila 24,4 litre/saat aralığındaydı. Aktif tübüler sekresyon, glikopironyumun renal eliminasyonuna katkıda bulunur. Verilen dozun%23'üne kadarı idrarda ana ilaç olarak bulunmuştur. Glikopironyum plazma konsantrasyonları çok fazlı bir şekilde azaldı. Ortalama terminal eliminasyon yarılanma ömrü, inhalasyondan sonra (33-57 saat) intravenöz (6,2 saat) ve oral (2,8saat) uygulamadan çok daha uzundu. Eliminasyon paterni, inhalasyondan sürekli akciğer emilimive/veya glikopironyumun sistemik dolaşıma 24 saat sonra ve sonrasında aktarılmasınıdüşündürmektedir. Doğrusallık/ Doğrusal Olmayan Durum:İndakaterolİndakaterole sistemik maruziyet, dozla orantılı bir şekilde, artan (verilen) dozla (120mikrogram ila 480 mikrogram) artmıştır. GlikopironyumKOAH hastalarında, hem sistemik maruziyet hem de glikopironyumun farmakokinetik kararlı durumda toplam üriner atılımı, 44 ila 176 mikrogram (verilen) doz aralığında dozla orantılı olarakartmıştır. Özel popülasyonlarİndakaterol/GlikopironyumKOAH'lı hastalarda İndakaterol/Glikopironyum solunduktan sonra elde edilen verilerin popülasyon farmakokinetik analizi, yaş, cinsiyet ve (yağsız vücut) ağırlığının indakaterol veglikopironyumun sistemik maruziyeti üzerinde anlamlı bir etkisi olmadığını göstermiştir. Yağsızvücut ağırlığı (kilonun ve boyun bir fonksiyonudur) orta değişken olarak tanımlanmıştır. Sistemikmaruziyet ile yağsız vücut ağırlığı (veya vücut ağırlığı) arasındanegatif bir korelasyon gözlenmiştir;bununla birlikte, değişikliğin büyüklüğü veya yağsız vücutağırlığının tahmini hassasiyeti nedeniyle j .....Bu belge, güventı elektroııik İTnzâile İmzalanmıştırdoz ayarlaması önerilmemiştir.  Sigara içme durumu ve başlangıç FEVı'in, İndakaterol/Glikopironyum inhalasyonunda®^ 16/23 indakaterol ve glikopironyumun sistemik maruziyeti üzerinde belirgin bir etkisi olmamıştır. indakaterolBir popülasyon farmakokinetik analizi, yaşın (88 yaşına kadar yetişkinler), cinsiyet, ağırlık (32-168 kg) veya ırkın indakaterol farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi olmadığınıgöstermiştir. Bu, popülasyondaki etnik alt gruplar arasında herhangi bir fark ortayaçıkmamıştır. GlikopironyumKOAH'lı hastalardaki verilerin popülasyon farmakokinetik analizi, vücut ağırlığını ve yaşı, sistemik maruziyette hastalar arası değişkenliğe katkıda bulunan faktörler olarak tanımlamıştır. Önerilendozda glikopironyum tüm yaş ve vücut ağırlığı gruplarında güvenle kullanılabilir. Cinsiyet, sigara içme durumu ve başlangıç FEVı'in sistemik maruziyet üzerinde belirgin bir etkisi olmamıştır. Karaciğer yetmezliği olan hastalar indakaterol/Glikopironyum:Monoterapi bileşenlerinin klinik farmakokinetik özelliklerine dayanarak, İndakaterol/Glikopironyum hafif ve orta şiddette karaciğer yetmezliği olan hastalarda önerilendozdakullanılabilir. Şiddetli karaciğer yetmezliği olan hastalar için mevcut veri bulunmamaktadır. İndakaterol: Hafif ve orta şiddette karaciğer yetmezliği olan hastalar, indakaterolün Cmax veya EAA'sında anlamlı bir değişiklik göstermemiştir veya protein bağlanması, hafif ve orta şiddette karaciğer yetmezliğiolan denekler ile bunların sağlıklı kontrolleri arasında farklılık göstermemiştir. Şiddetli karaciğeryetmezliği olan kişilerde çalışma yapılmamıştır. Glikopironyum: Karaciğer yetmezliği olan hastalarda klinik çalışmalar yapılmamıştır. Glikopironyum ağırlıklı olarak renal atılım ile sistemik dolaşımdan temizlenir. Glikopironyumun hepatik metabolizmasınınbozulmasının, klinik olarak anlamlı bir sistemik maruziyet artışı ile sonuçlandığıdüşünülmemektedir. Böbrek yetmezliği olan hastalar indakaterol/Glikopironyum:Monoterapi bileşenlerinin klinik farmakokinetik özelliklerine dayanarak,İndakaterol/Glikopironyum hafif ila orta derecede böbrek yetmezliği olan hastalarda önerilen dozda kullanılabilir. Şiddetliböbrek yetmezliği veya diyaliz gerektiren son dönem böbrek yetmezliği olan hastalarda,İndakaterol/Glikopironyum sadece beklenen fayda potansiyel riskten önemli ise kullanılmalıdır. İndakaterol: İdrar yolunun indakaterol maleatın toplam vücut eliminasyonuna çok düşük katkısı nedeniyle, böbrek yetmezliği olan hastalarda bir çalışma yapılmamıştır. Glikopironyum: Böbrek yetmezliğinin sistemik glikopironyum bromür maruziyeti üzerinde etkisi vardır. Hafif ve orta derecede böbrek yetmezliği olanlarda toplam sistemik maruziyet (EAAson) orta dereceliortalama 1,4 kata kadar, şiddetli böbrek yetmezliği ve son dönem böbrek yetmezliği olanlarda ise Belge Dc2,2laiâJ^adar5§sifftştır6H9İfıvİioftFİIrlfiede''böbfıeİİifmizliığiP/lanKOAHhasialiEiadfl>(tahmini glomerüler fıltrasyon hızı, eGFR >30 ml/dak/1,73 m^) glikopironyum bromür öneriler|g^^^a kullamlabilir. Etnik kökenİndakaterol/Glikopironyum:Japon ve Kafkas denekler arasında her iki bileşik için toplam sistemik maruziyette (EAA) önemli bir fark yoktur. Diğer etnik kökenler veya ırklar için mevcut farmakokinetik verileryetersizdir. İndakaterol: Etnik alt gruplar arasında fark tespit edilmemiştir. Siyah popülasyon için sınırlı tedavi deneyimi mevcuttur. Glikopironyum: Japon ve Kafkas denekler arasında toplam sistemik maruziyet (EAA) arasında büyük fark yoktur. Diğer etnik kökenler veya ırklar için mevcut farmakokinetik veriler yetersizdir. 5.3 Klinik öncesi güvenlilik verileriİndakaterol/glikopironyumKlinik öncesi çalışmalar, in vitroin vivogüvenlilik farmakolojisi değerlendirmelerini, sıçanlarda ve köpeklerde tekrarlanan dozlu inhalasyon toksisite çalışmalarını ve sıçanlarda inhalasyonembriyo-fetal gelişim çalışmasını içermektedir.İndakaterol/Glikopironyum ve her monoterapi bileşeninin tüm dozlarında köpeklerde artan kalp atış hızları belirgindi. İndakaterol/Glikopironyum için kalp atış hızı üzerindeki etkiler, bir ek yanıt iletutarlı olarak tek başına her bileşen için gözlenen değişikliklerle karşılaştırıldığında, büyüklük vesüre bakımından artmıştır. Elektrokardiyografi aralıklarının kısalması, azalmış sistolik ve diyastolikkan basıncı da belirgindir. Tek başına veya İndakaterol/Glikopironyum ile köpeklere uygulananindakaterol, miyokard lezyonlarının benzer bir insidansı ve şiddeti ile ilişkili bulunmuştur.Miyokardiyal lezyonlar için gözlemlenmeyen advers etki düzeyindeki (NOAEL) sistemikmaruziyetler (EAA), her bileşen için, insanlardan sırasıyla 64 ve 59 kat daha yüksekti. Sıçanlarda yapılan bir embriyo-fetalgelişim çalışması sırasında herhangi bir İndakaterol/Glikopironyum doz seviyesinde embriyo veya fetus üzerinde herhangi bir etki görülmemiştir. İndakaterol ve glikopironyum için, gözlemlenmeyen advers etki düzeyinde(NOAEL) sistemik maruziyetler (EAA) insanlardan 79-126 kat daha yüksektir. İndakaterol İndakaterol'ün beta2-agonistik özelliklerine atfedilebilen kardiyovasküler sistem üzerindeki etkiler, köpeklerde taşikardi, aritmiler ve miyokardiyal lezyonları içermektedir. Kemirgenlerdeburun boşluğu ve gırtlakta hafif tahriş gözlenmiştir. Tüm bu bulgular, insanlarda beklenenden fazlamaruziyette meydana gelmiştir. İndakaterol, bir sıçan fertilite çalışmasında genel üreme performansını etkilemese de, peri- ve post-gelişimsel sıçan çalışmasında, indakaterol ile tedavi edilen insanlardan 14 kat daha yüksek bir maruziyette, gebe F1 yavrularında bir azalma gözlenmiştir. İndakaterol ve metabolitleri, emzirensıçanların sütüne hızla transfer olmuştur. İndakaterol, sıçanlarda veya tavşanlarda embriyotoksikveya teratojenik değildir.
değerlendirilmiştir. Sıçanlarda iyi huy »ğnıiiraa Kodu: lZW5^HY3Z,\J06ZmxXaklUS3kpQ3>fokal niperplazisi, diğer beta2-adrenBelge DoNRZlAx . Belge'Takip ¦Adresi:https//www.turkiye.goY.tr/saglik-titçk-ebyslerjik agonıstler için bildirilen benzer bulgularla tutarlıdır. Genotoksisite çalışmaları herhangi bir mutajenik veya klastojenik potansiyel ortaya koymamıştır. Kanserojenite iki yıllık bir sıçan çalışmasında ve altı aylık bir transgenik fare çalışmasındair. .Sıçanlard.aiyi .®uylu¥Smfeftal'ık ieyoffiy&m.u insidansı ve yumurtalık düz kasının  renerjik agonist 18 / 23 Farelerde kanserojenite kanıtı görülmemiştir. Bu çalışmalarda gözlemlenmeyen advers etki seviyelerinde sıçanlarda ve farelerde sistemik maruz kalma (EAA), önerilen maksimum terapötikdozda günde bir kez indakaterol ile tedavi edilen insanlara göre sırasıyla en az 7 ve 49 kat dahayüksektir. Glikopironyum Klinik olmayan veriler, geleneksel güvenlilik farmakolojisi, tekrarlanan doz toksisitesi, genotoksisite, kanserojen potansiyel, üreme ve gelişme toksisitesi çalışmalarına dayanarak, insanlariçin özel bir tehlike ortaya koymaz. Glikopironyum bromürün muskarinik reseptör antagonist özelliklerine atfedilebilen etkiler, köpeklerde kalp hızında hafif ila orta dereceli artışlarla, sıçanlarda lens opasiteleri ve sıçanlarda veköpeklerde glandüler sekresyonların azalmasıyla ilişkili geri dönüşümlü değişiklikleri içermiştir.Sıçanlarda hafif tahriş veya solunum yollarında adaptif değişiklikler görülmüştür. Tüm bu bulgular,insanlarda beklenenden fazla maruziyette meydana gelmiştir. Glikopironyum, inhalasyon uygulamasını takiben, sıçanlarda veya tavşanlarda teratojenik değildir. Sıçanlarda doğurganlık ve doğum öncesi ve sonrası gelişim etkilenmemiştir. Glikopironyum bromürve metabolitleri, hamile farelerin, tavşanların ve köpeklerin plasenta bariyerini önemli ölçüdegeçmemiştir. Glikopironyum bromür (metabolitleri dahil) emziren sıçanların sütüyle atılmıştır vesütte, dam kanından 10 kat daha yüksek konsantrasyonlaraulaşmıştır. Genotoksisite çalışmaları, glikopironyum bromür için herhangi bir mutajenik veya klastojenik potansiyel ortaya koymamıştır. Oral uygulama kullanan transgenik farelerde ve inhalasyonuygulaması kullanan sıçanlarda kanserojenite çalışmaları, sistemik maruziyetlerde (EAA), insanlariçin günde bir kez önerilen maksimum dozdan farelerde yaklaşık 53 kat daha yüksek ve sıçanlarda75 kat daha yüksek dozlarda kanserojenite kanıtı göstermemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiLaktoz monohidrat (inek sütü kaynaklıdır) 6.2 GeçimsizliklerGeçerli değildir. 6.3 Raf ömrü24 ay Her paketteki inhaler, bu paketteki tüm kapsüller kullanıldıktan sonra atılmalıdır. 6.4 Saklamaya yönelik özel tedbirler25 °C altında oda sıcaklığında saklayınız. Kapsüller, nemden korumak için daima orijinal ambalajında saklanmalı ve sadece kullanımdan hemen önce çıkarılmalıdır. 6.5 Ambalajın niteliği ve içeriğiKutuda, AGLİKO PLUS İnhalasyon Tozu Sert Kapsül desikant kapaklı HDPE şişe 30 kapsül + 1 adet inhalasyon cihazı.
.
6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamışolan ürünler ya da atık mdteryall^ii e"Tıbb:iimAtıfclıar^iBmKtontrolü Yönetmeliği ve "Ambalaj veBelge ue uyi?^®".........
AGLİKO PLUS uygulaması esnasında aşağıdaki talimatlara uyulmalıdır: Kapsülleri yutmayınız.kutunun içerisinde yer alan inhalasyon cihazıilebirlikte kullanılmalıdır. Bu cihaz, özel olarak AGLİKO PLUS kapsülleri ile birlikte kullanılmak üzere tasarlanmıştır. Kapsüllerin içerisindeki toz yalnızca teneffüs edilerek (nefes yoluyla) kullanılacaktır. Kapsülleri kullanmadan hemen önce paketinden çıkarınız. kapsüllerin ıslanmaması için parmaklarınızın kuru olduğundan emin olunuz. İlacınızı kullandıktan sonra ağzınızı su ile iyice çalkalayınız ve çalkaladıktan sonra ağzınızdaki suyu tükürünüz. Bunu yapmak, ağzınızda mantar enfeksiyonu (pamukçuk) gelişmesi riskiniazaltır. Kapsülleri inhalasyon cihazı dışında başka bir cihaz ile kullanmayınız. AGLİKO PLUS'ı her gün aynı saatlerde kullanmanız ilacınızı ne zaman kullanacağınızı hatırlamanıza yardımcı olacaktır. AGLİKO PLUS'ı doktorunuzun talimatına göre, düzenli olarak kullanmanız önemlidir. Astım belirtileriniz olmasa bile AGLİKO PLUS'ı kullanmaya devam etmelisiniz çünkü bu astımnöbetlerinin oluşmamasına yardımcı olur. Eğer ne kadar süre AGLİKO PLUS kullanacağınız hakkında sorularınız varsa, doktorunuza ya da eczacınıza danışınız. Hastaların jelatin kapsülün parçalanabileceğini ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir.Hastaya jelatinin zararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazla delmemek suretiyle parçalanma olasılığı asgari düzeyeindirilebilir.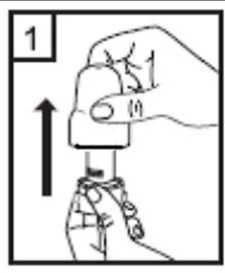
1-Kapağı çekip çıkarınız. 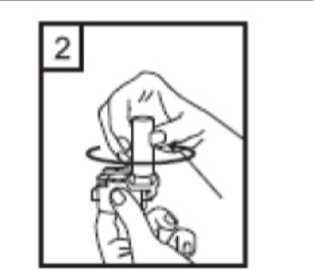 2-Kapsül bölmesini açınız. İnhalerin tabanını sıkıca tutup, açmak için ağızlığı üzerinde yer alan ok işareti yönündedöndürünüz.  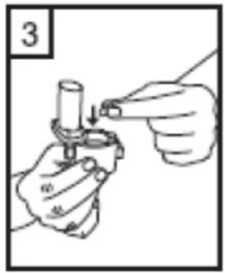 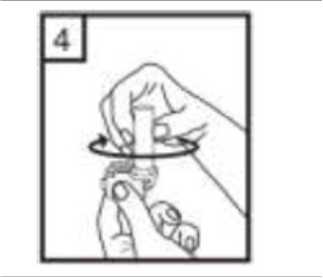 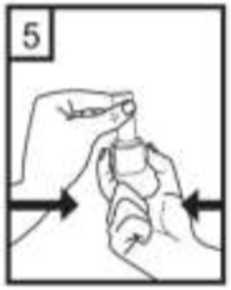 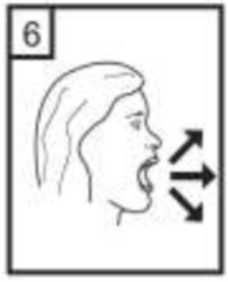 3-Parmaklanmzm tamamen kuru olduğundan emin olunuz. Ambalajından birkapsül çıkarınız ve bu kapsülü cihazıntabanındaki kapsül bölmesine yatık olarakyerleştiriniz. Kapsülleri, kullanımdan hemenönce ambalajından çıkarmanız önemlidir. ÖNEMLİ: Kapsülü ağızlığın içerisine yerleştirmeyiniz!4-Ağızlığı klik sesi duyana kadar geri çevirerek kapalı duruma getiriniz. 5-Tozu kapsülden serbestlemek için: Cihazı ağızlık yukarı doğru bakacakşekilde dik olarak tutunuz. Kenarlardaki iki kulakçığa (düğmelere) aynı andasadece bir kezsıkıca basarakkapsülü deliniz.Not:Kapsül bu aşamada parçalanabilir ve küçük jelatin parçacıkları ağzınıza ya daboğazınıza gelebilir. Fakat jelatin yenebilirnitelikte olduğu için zararlı değildir.
6-Nefesinizi olabildiğince dışarıya veriniz.  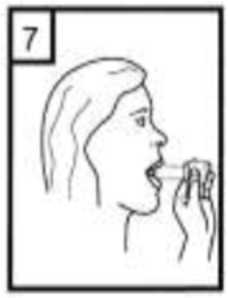
7-İlacı derin bir şekilde hava yollarımza çekmek için: Ağızlığı ağzınıza yerleştiriniz ve başınızı hafifçe geriye doğru eğiniz. Dudaklarınızla ağızlığın etrafını sıkıca sarınız. Hızlı, duraksamadan ve alabildiğiniz kadar derin bir nefes alınız. Not:Kapsülün, kapsül bölmesininüzerindeki alanda dönmesine bağlı olarak bir vızıldama sesi duymalısınız. Eğer buvızıldama sesini duymazsanız, kapsülbölmesini açınız ve kapsülün, kapsülbölmesinde sıkışıp sıkışmadığını kontrolediniz. Daha sonra 7. basamağıtekrarlayınız. Kapsülü sıkıştığı yerdenkurtarmak için düğmelere tekrarBASMAYINIZ. 8- Cihazın içerisinden nefes aldıktan sonra, nefesinizi olabildiğince tutunuz ve cihazı ağzınızdan çıkarınız. Sonra burnunuzdan nefes veriniz. Kapsül bölmesini açınız vekapsülde toz kalıp kalmadığını kontrol ediniz. Eğer kalmış ise 6, 7 ve 8 no' lu işlemleri tekrarlayınız._9- Tüm tozu kullandıktan sonra kapsül bölmesini açınız (Bkz. basamak 2). Boş kapsülü çıkarınız. doktorunuzun önerisi doğrultusunda aynı işlemleri diğer kapsüller için de
tekrarlayınız. 10- İçeride kalan tozları temizlemek için kuru bir kağıt mendil ya da fırça kullanınız. Not: İnhalasyon cihazını temizlemek için SU KULLANMAYINIZ.Önce ağızlığı, ardından kapağı kapatınız._İlacınızı kullandıktan sonra ağzınızı su ile iyice çalkalayınız ve çalkaladıktan sonra ağzınızdaki suyu tükürünüz. Bunu yapmak, ağzınızda mantar enfeksiyonu (pamukçuk) gelişmesi riskini azaltır. Uygulamaya ilişkin sorular ve cevapları1. Kapsüllerin küçük parçaçıklara ayrılmasını nasıl önlerim? Cihazın yanındaki kırmızı kulakçıklıklara (düğmelere) bastığınızda (5.basamak), kapsüller kırılabilir ve nefes alırken ağzınıza ya da boğazınıza küçük parçalar kaçabilir. Bunu aşağıdakileriuygulayarak önleyebilirsiniz: Kırmızı kulakcıklara (düğmelere) yalnızca bir kerebasarak. Kapsülleri kullanmadan önce orjinal ambalajında tutarak. Kapsülleri 25 oC'nin altındaki oda sıcaklığında saklayarak. Kapsülleri nemden koruyarak. 2. Kapsül parçacıkları zararlı mıdır? Hayır. Kapsül, zararlı olmayan yenilebilir nitelikte jelatinden yapılmıştır. Ağzınıza ya da boğazınıza kaçan jelatin parçacıkları yutulabilir. 3. Kapsül bölmesinde sıkışan kapsülü naşıl çıkartacağım? ^ İnhalasyon cihazını açın, baş aşağı çevirin ve yavaşça dibine vurun.  4. Eğer kırmızı kulakçıklar (düğmeler) sıkışırsa ne yapmalıyım? Kulakçıkları (düğmeleri) yavaşça kanatçıkların yardımıyla ilk konumuna geri çekin. 5. Dozu gerçekten alıp almadığımı nasıl bileceğim? İnhalasyon cihazınızın içerisinden nefes aldığınızda bir vızıldama sesi duyacaksınız. Ağzınızda laktozdan kaynaklanan 'şeker tadı' hissedeceksiniz. Boğazınızın arka kısmında tozhissedebilirsiniz. Bu normaldir. Doz alındığında kapsül boşalmış olacaktır. 6. İnhalasyon cihazının içerisindeki tozu nasıl temizlerim? Kuru bir kâğıt mendil ya da yumuşak bir fırça kullanınız. İnhalasyon cihazını asla yıkamamanız gerektiğini unutmamalısınız. 7. RUHSAT SAHIBIGrandi İlaç San. ve Tic. Ltd. Şti. Kağıthane/İstanbul 8. RUHSAT NUMARASI2023/429 9. İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 01.11.2023 Ruhsat yenileme tarihi: 10.KUB'UN YENILENME TARIHI
|
İlaç BilgileriAgliko Plus 85 Mcg/43 Mcg İnhalasyon Tozu, Sert KapsülEtken Maddesi: Indakaterol Maleat, Glikopironyum Bromür Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.







