Agliko 50 Mcg İnhalasyon Tozu, Sert Kapsül Kısa Ürün BilgisiKISA ÜRÜN BILGISI¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'a bildirmeleribeklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBİ ÜRÜNÜN ADIAGLİKO 50 mcg inhalasyon tozu, sert kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Glikopironyum bromür 63 mikrogram (50 mikrogram glikopironyuma eşdeğer) İnhalasyon cihazından serbest bırakılan doz (AGLİKO cihazının ağız parçasından çıkan doz) 44 mikrogram glikopironyumdur. Yardımcı madde(ler):Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon için toz içeren kapsül Beyaz ya da beyazımsı toz içeren kapsüller. 4. KLİNİK OZELLİKLER4.1 Terapötik endikasyonlarAGLİKO, orta ve ağır KOAH (kronik obstruktif akciğer hastalığı) olgularında düzenli kullanıldığında atak sıklığını azaltmakta, semptomları ve yaşam kalitesini düzeltebilmekte, ancakuzun dönemdeki FEVı düşüşünü değiştirmemektedir. 4.2 Pozoloji ve uygulama şekliErişkinlerPozoloji/uygulama sıklığı ve süresi:Önerilen doz, AGLİKO inhalasyon cihazı kullanılarak bir adet 50 mikrogramlık kapsül içeriğinin günde bir kere inhalasyonudur. Uygulama sekli:AGLİKO kapsülleri sadece AGLİKO inhalasyon cihazı kullanılarak oral inhalasyon yolu ile uygulanmalıdır. AGLİKO kapsüller yutulmamalıdır (Bkz. Bölüm 4.9). AGLİKO her gün aynı saatte olmak üzere günde bir kez uygulanması önerilmektedir. Bir dozun atlanması durumunda, bir sonraki doz mümkün olan en kısa sürede alınmalıdır. Hastalara günde birdozdan fazla kullanmamaları söylenmelidir. İmza ile imzalanmıştır.
AGLİKO kapsülleri nemden korumak için her zaman blister ambalajında saklanmalı ve KULLANMADAN HEMEN ÖNCE blisterden çıkarılmalıdır. AGLİKO reçete edilirken, hastalara doğru inhalasyon cihazı kullanımı öğretilmelidir. Nefes alıp vermesinde iyileşme görülmeyen hastalara, ilacı inhale etmek yerine; yutup yutmadıklarısorulmalıdır. Kullanıma ilişkin talimatlar: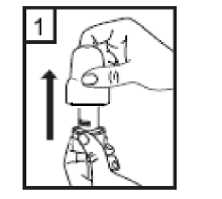
1-Kapağı çekip çıkarınız. 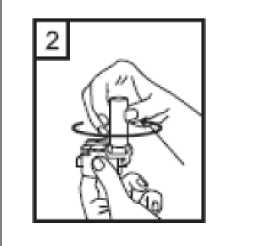 2-Kapsül bölmesini açınız. Cihazın tabanını sıkıca tutup, açmak için ağızlığı üst tarafında bulunan ok yönünde çeviriniz. 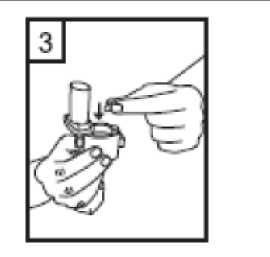 3-Parmaklarınızın tamamen kuru olduğundan emin olunuz. Ambalajından bir kapsül çıkarınız ve bu kapsülücihazın tabanındaki kapsül bölmesine yatık olarakyerleştiriniz. Kapsülleri, kullanımdan hemen önceambalajından çıkarmanız önemlidir. ÖNEMLİ: Kapsülü ağızlığın içerisine yerleştirmeyiniz!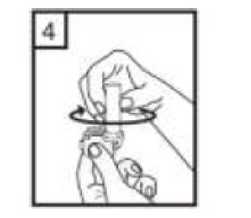 4-Ağızlığı klik sesi duyana kadar geri çevirerek kapalı duruma getiriniz. Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebysBelge Do 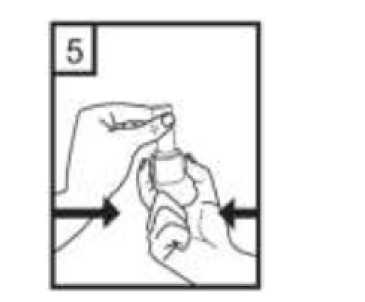 5-Tozu kapsülden serbest bırakmak için: Cihazı dik tutun (ağızlık yukarıda olacak şekilde) Kenarlardaki iki kulakçığa (düğmelere) AYNIANDA ve SADECE BİR KEZ basıp bırakınız.Böylelikle cihazdaki kapsülü delmiş oldunuz. Lütfen dikkat: Bu aşamada jelatin kapsül parçalanabilir ve soluma sırasında küçük jelatin parçaları ağzınıza veyaboğazınıza gelebilir. Fakat jelatin yenilebilir nitelikteolduğundan zararsızdır. 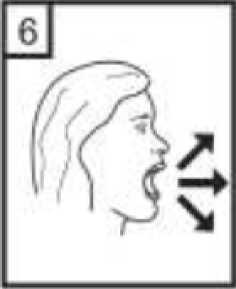 6-Nefesinizi kuvvetlice dışarı verin. Asla ağızlığın içine üflemeyin. 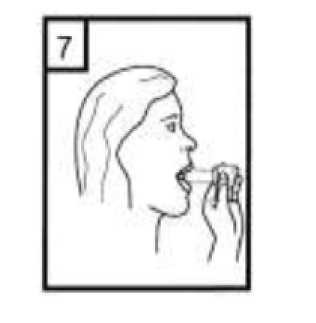 7-Ağızlığı ağzınıza yerleştirin ve başınızı hafifçe geriye doğru eğiniz. Dudaklarınız ile ağızlığı sıkıca sarınız.Olabildiğince hızlı, duraksamadan ve alabildiğiniz kadarderin nefes alınız. Lütfen dikkat: Nefes alma sırasında, kapsül, kapsül haznesinde titreşir ve bir ses (vızıltı) oluşur. Bu sesiduymadıysanız kapsülün, kapsül bölmesinde sıkışıpsıkışmadığını kontrol ediniz. Bu durumda cihazı açınızve kapsülü bölmesinde oynatarak gevşetiniz. Daha sonra7. basamağı tekrarlayınız. Kapsülü sıkıştığı yerdenkurtarmak için düğmelere tekrar tekrar BASMAYINIZ. 
İlave Bilgiler:Hastaların jelatin kapsülün parçalanabileceğini ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir. Hastaya jelatinin zararsız olduğu,ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazla delmemek suretiyleparçalanma olasılığı asgari düzeye indirilebilir. Temizleme:Temizleme talimatları için hastalara Kullanma Talimatını dikkatlice okumaları önerilmelidir. Toz kalıntılarını temizlemek için ağız parçasını ve kapsül haznesini kuru, pamuksuz ve temiz bir bez ile silin. Temiz yumuşak bir fırça da bu amaçla kullanılabilir. Cihazı temizlemek için SU KULLANMAYIN. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:AGLİKO hafif ila orta şiddette böbrek yetmezliği olan hastalarda önerilen dozda kullanılabilir. Şiddetli böbrek yetmezliği veya diyaliz gerektiren son evre böbrek hastalığı olan hastalardaglikopironyuma sistemik maruziyet artabileceğinden AGLİKO sadece beklenen faydalar potansiyelriske ağır bastığında kullanılmalıdır (Bkz. Bölüm 4.4 ve Bölüm 5). Karaciğer yetmezliği:Hepatik bozukluğu olan hastalarda spesifik çalışmalar yürütülmemiştir. AGLİKO başlıca renal yolla atıldığından, karaciğer yetmezliği olan hastalarda maruziyet açısından bir artışbeklenmemektedir. Karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmez. Pediyatrik popülasyon:AGLİKO 18 yaşın altındaki hastalarda kullanılmamalıdır. Geriyatrik popülasyon:AGLİKO, 75 yaş ve üzerindeki yaşlı hastalarda önerilen dozda kullanılabilir. 4.3 KontrendikasyonlarAGLİKO içeriğindeki aktif maddeye veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılık reaksiyonu söz konusu olan kişilerde kontrendikedir 4.4 Özel kullanım uyarıları ve önlemleriAkut kullanıma yönelik değildir: AGLİKO günde bir kez uygulanan uzun vadeli bir idame tedavisi olup, akut bronkospazm epizodlarının acil tedavisi için (yani bir kurtarıcı tedavi olarak) endike değildir. Aşırı duyarlılık reaksiyonları (Hipersensitivite): AGLİKO uygulandıktan sonra, hızla ortaya çıkan aşırı duyarlılık reaksiyonları bildirilmiştir. Başta anjiyoödem (nefes alıp vermede veya yutmada güçlükler, dilde, dudaklarda ve yüzde şişlik dahil),ürtiker veya deri döküntüsü olmak üzere, alerjik reaksiyonu düşündüren belirtiler ortaya çıkarsaAGLİKO tedavisi derhal durdurulmalı ve alternatif tedaviye başlanmalıdır. Paradoksal bronkospazm: AGLİKO'nun kullanıldığı klinik araştırmalarda, paradoksal bronkospazm gözlenmemiştir. Fakat diğer inhalasyon tedavilerinde olduğu gibi AGLİKO uygulaması da yaşamı tehdit edebilenparadoksal bronkospazm ile sonuçlanabilir. Paradoksal bronkospazm oluşursa, AGLİKO hemenkesilmeli ve alternatif tedavi başlanmalıdır. Antikolinerjik etki: Diğer antikolinerjik ilaçlar gibi, AGLİKO da dar açılı glokom veya idrar retansiyonu olan hastalarda dikkatle kullanılmalıdır. Hastalara akut dar açılı glokomun belirti ve semptomları açıklanmalı ve bu belirti ve semptomların gelişmesi halinde AGLİKO kullanmayı bırakarak, derhal doktorlarını aramaları söylenmelidir. Şiddetli renal bozukluğu olan hastalar: Toplam sistemik maruziyette (EAAson); hafif ve orta şiddetli böbrek yetmezliği olan hastalarda 1,4 kat; şiddetli böbrek yetmezliği ve son evre böbrek rahatsızlığı olan hastalarda 2,2 kat orta şiddetlibir ortalama artış gözlenmiştir. Diyaliz gerektiren son evre renal hastalık dahil şiddetli renal bozukluğu olan hastalar için (hesaplanmış glomerüler filtrasyon hızı <30 ml/dak/1,73 m2), AGLİKO sadece beklenen faydapotansiyel riske ağır bastığında kullanılmalıdır (Bkz. Bölüm 5.2). Bu hastalar potansiyel istenmeyenetkiler açısından yakından takip edilmelidir. Kardiyovasküler hastalık öyküsü olan hastalar: Stabil olmayan iskemik kalp hastalığı, sol ventrikül yetmezliği, miyokard enfarktüsü öyküsü, aritmi (kronik stabil atrial fibrilasyon hariç), uzun QT sendromu öyküsü olan veya QTc'si (Fridericiayöntemi) uzamış (erkekler için >450 msn veya kadınlar için >470 msn) hastalar klinik çalışmalaradahil edilmediği için, bu hasta gruplarında deneyim kısıtlıdır. AGLİKO bu hasta gruplarındadikkatle kullanılmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriAGLİKO'nun inhale antikolinerjik içeren ilaçlarla eş zamanlı uygulaması araştırılmamıştır ve bu nedenle diğer antikolinerjiklerde olduğu gibi önerilmemektedir. Resmi ilaç etkileşim çalışmaları gerçekleştirilmemiş olmasına rağmen, AGLİKO çoğunlukla KOAH tedavisinde kullanı^4iğerviibbkÖ£Önlerieeeşzzamıaal.ı olarak klinik ilaç etkileşim belirtisi Belge Do Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys olmaksızın kullanılmıştır. Bu tıbbi ürünler sempatomimetik bronkodilatörler, metilksantinler ve oral veya inhale steroidlerdir. Her iki ilaç için de kararlı durum koşulları altında, AGLİKO ve bir beta2-adrenerjik agonisti olan oral yolla uygulanan inhale indakaterolün eş zamanlı olarak uygulanması, iki ilacın dafarmakokinetiğini etkilememiştir. Sağlıklı gönüllülerde yapılan bir klinik çalışmada, glikopironyumun renal atılımına katkıda bulunduğu düşünülen bir organik katyon taşıyıcısı inhibitörü olan simetidin, glikopironyuma toplammaruziyeti (EAA) %22 artırırken, renal klirensi %23 azaltmıştır. Bu değişikliklerin boyutuna bağlıolarak, AGLİKO simetidin ya da diğer organik katyon taşıyıcısı inhibitörleri ile eş zamanlı olarakuygulandığında, klinik olarak belirgin bir ilaç etkileşimi beklenmemektedir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek ve karaciğer yetmezliği olan hastalarla ilgili bir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyonPediyatrik hastalarla ilgili bir etkileşim çalışması yapılmamıştır. 4.6 Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):Çocuk sahibi olma potansiyeline sahip kadınlar için özel öneriler bulunmamaktadır. Gebelik dönemi:Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. kısım 5.3).İnsanlara yönelik potansiyel risk bilinmemektedir. AGLİKO gerekli olmadıkça gebelik dönemindekullanılmamalıdır. KOAH hastalarında, maruziyet yaşanan gebeliklerle ilgili klinik çalışmalar mevcut değildir. Glikopironyum bromürün tavşanlar veya sıçanlarda inhalasyonla uygulamayı takiben teratojenikbulunmamıştır (Bkz. Bölüm 5.3). Sezaryen doğum yapan insanlarda 0.006 mg/kg tekliintramüsküler glikopironyum bromür enjeksiyonundan 86 dakika sonraki umbilikal plazmakonsantrasyonları düşüktür. Gebe kadınlarda yeterli deneyim olmadığından, AGLİKO gebeliksırasında sadece hasta için faydalar fetüs için potansiyel riske gerekçe sağladığında kullanılmalıdır. Laktasyon dönemi:Glikopironyum bromürün insan sütü ile atılıp atılmadığı bilinmemektedir. Hayvanlar üzerinde yapılan çalışmalar, glikopironyum bromürün sütle atıldığını göstermektedir. Emziren kadınlar tarafından AGLİKO kullanımı, sadece kadın için beklenen fayda bebek için olası risklerden fazla olduğunda düşünülmelidir (Bkz. Bölüm 5.3). Üreme yeteneği/Fertilite:Üreme çalışmaları ve hayvanlarda elde edilen diğer veriler erkekler veya dişilerde fertilite açısından bir endişeye işaret etmemektedjre(Bkzı i Bölüm âı3)ie imzalanmıştır. Belge Do Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys4.7 Araç ve makine kullanımı üzerindeki etkilerAGLİKO'nun araç ve makine kullanımı üzerine etkisi yoktur veya ihmal edilebilir düzeydedir. 4.8 İstenmeyen etkilerGüvenlilik profili özetiEn yaygın antikolinerjik advers reaksiyon ağız kuruluğu (% 2,4)'dur. Ağız kuruluğu bildirimlerinin çoğunun ürünle ilişkili olduğu düşünülmüş ve bildirimlerden hiçbirinin şiddetli olmadığı, hafifşiddetli olduğu görülmüştür. Güvenlilik profili yaygın görülmeyen idrar retansiyonu belirtilerini de içeren antikolinerjik etkiyle ilişkili diğer semptomlarla karakterizedir. Gastroenterit ve dispepsi dahil gastrointestinal etkiler degözlenmiştir. Lokal tolerabilite ile ilişkili advers etkiler; boğaz tahrişi, nazofarenjit, rinit ve sinüzitiiçermektedir. Önerilen dozda AGLİKO kan basıncı ve kalp hızı üzerinde etkilere sahip değildir. Klinik çalışmalarda gözlenen istenmeyen etkilerin özeti: 6 ve 12 aylık birleştirilmiş iki pivotal Faz III çalışmanın ilk 6 ayı sırasında bildirilen advers ilaç reaksiyonları MedDRA sistem organ sınıfına göre aşağıda sıralanmıştır. Her bir sistem organ sınıfıiçinde advers ilaç reaksiyonları, en sık görülen ilk sırada yer alacak şekilde sıklığa göre sıralanmıştır.Her bir sıklık gruplandırmasında advers ilaç reaksiyonları azalan ciddiyetlerine göre sıralanmıştır.Ayrıca her bir advers ilaç reaksiyonu için ilgili sıklık kategorisi şu dönüşümü temel almaktadır(CIOMS III):
Çok yaygın Yaygın
Yaygın olmayan Seyrek Çok seyrek > 1/10 > 1/100 ilâ < 1/10 > 1/1.000 ilâ < 1/100 > 1/10.000 ilâ < 1/1.000< 1/10.000 Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) Enfeksiyonlar ve enfestasyonlarYaygın: Nazofarenjit1 Yaygın olmayan: Rinit, sistit Bağışıklık sistemi hastalıklarıYaygın olmayan: Hipersensitivite, anjiyoödem2 Metabolizma ve beslenme hastalıklarıYaygın olmayan: Hiperglisemi Psikiyatrik hastalıklarYaygın: Uykusuzluk Sinir sistemi hastalıklarıYaygın: Başağrısı3 Yaygın olmayan: Hipoestezi  Kardiyak hastalıklarYaygın olmayan: Atriyal fibrilasyon, çarpıntı. Solunum, göğüs hastalıkları ve mediyastinal hastalıklarYaygın olmayan: Sinüs tıkanıklığı, balgamlı öksürük, boğaz tahrişi, burun kanaması, disfoni. Bilinmiyor: Paradoksal bronkospazm2 Gastrointestinal hastalıklarYaygın: Ağız kuruluğu, gastroenterit. Yaygın olmayan: Dispepsi, diş çürükleri, bulantı2, kusma1,2 Deri ve derialtı doku hastalıklarıYaygın olmayan: Döküntü, prürit2 Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıklarıYaygın: Kas-iskelet ağrısı1,2 Yaygın olmayan: Ekstremite ağrısı, göğüste kas-iskelet ağrısı. Böbrek ve idrar yolu hastalıkları3 Yaygın: idrar yolu enfeksiyonu Yaygın olmayan: Dizüri, üriner retansiyon Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın olmayan: Yorgunluk, asteni. 1 12 aylık çalışmada Glikopironyum'da plasebodan daha sık görülmüştür. 2 Glikopironyum kullanımı ile ilgili olarak onay sonrası pazarlama deneyimleri ile bildirimleralınmıştır. Bu bildirimler kesin olmayan ölçekte bir popülasyon tarafından gönüllü olarakbildirildiğinden, sıklığını güvenilir şekilde değerlendirmek ve ilaca maruziyetle nedensel bir ilişkikurmak her zaman mümkün değildir. Bu nedenle sıklık klinik araştırma tecrübelerindenhesaplanmıştır. 3 Yalnızca 75 yaş üzerindeki yaşlı hastalarda Glikopironyum'da plasebodan daha yüksektir. Seçilmiş advers reaksiyonların açıklamasıBirleştirilmiş 6 aylık çalışmada glikopironyum ve plasebo için ağız kuruluğu sıklığı sırasıyla %2,2 ve %1,1; uykusuzluk %1,0 ve %0,8; gastroenterit %1,4 ve %0,9 olarak belirlenmiştir. Ağız kuruluğu, genellikle tedavinin ilk 4 haftasında bildirilmiş olup, hastaların çoğunda ortalama süre dört hafta olarak belirlenmiştir. Ancak vakaların %40'ında semptomlar 6 aylık sürenin tamamıboyunca devam etmiştir. 7 ile 12. aylar arasında yeni ağız kuruluğu vakaları bildirilmemiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlıkmesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi(TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 3599) güvenli elektronik imza ile imzalanmıştır. Belge Do 4.9 Doz aşımı ve tedavisiÇok yüksek dozlarda antikolinerjik belirti ve semptomlara neden olabilir. AGLİKO kapsüllerin kazayla yutulması sonucu akut intoksikasyon, düşük oral biyoyararlanımdan ötürü (yaklaşık %5) olası değildir. Sağlıklı gönüllülerde 150 mikrogram glikopironyum bromürün (120 mikrogram glikopironyuma eşdeğer) i.v. uygulanmasını takiben pik plazma düzeyleri ve toplam sistemik maruziyet, önerilenAGLİKO dozu (günde bir kez 50 mikrogram) ile elde edilen kararlı durumdaki pik ve toplammaruziyetten sırasıyla yaklaşık 50 kat ve 6 kat daha yüksek olup, iyi tolere edilmiştir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özellikler
Farmakoterapötik grup:
ATC kodu:
Obstruktif Solunum Yolu Hastalıklarında Kullanılan İlaçlar; Antikolinerjikler R03BB06 Etki mekanizması: Glikopironyum KOAH'ın günde bir kez uygulanan bronkodilatör idame tedavisine yönelik inhale uzun etkili muskarinik reseptör antagonistidir (antikolinerjik). Parasempatik sinirler solunumyollarındaki önemli bronkokonstriktif nöral yolak olup, kolinerjik tonüs KOAH'ta solunum yolutıkanıklığının kritik geri dönüşümlü bileşenidir. Glikopironyum bromür, asetilkolinin solunum yoludüz kas hücreleri üzerindeki bronkokonstriktör etkisini bloke ederek ve böylece solunum yollarınıgenişleterek iş görür. Glikopironyum bromür yüksek afiniteli bir muskarinik reseptör antagonistidir. Yarışmalı bağlanma çalışmalarında insan M2 reseptörlerine kıyasla insan M3 reseptörleri için seçiciliği >4 kat daha fazlaolmuştur. Klinik çalışmalarda inhalasyondan sonra etki başlangıcı ve gözlenen reseptörebağlanma/reseptörden ayrılma kinetik parametreleri ile kanıtlandığı üzere hızlı bir etki başlangıcınasahiptir. Uzun etki süresi kısmen, i.v. uygulamadan sonraki yarılanma ömrünün tersine, AGLİKO inhalasyon cihazı ile inhalasyondan sonra glikopironyum için uzamış terminal eliminasyon yarılanma ömrü ilegösterildiği üzere akciğerlerde kalıcı ilaç konsantrasyonlarına bağlanabilir (bkz., Bölüm 5.2). Farmakodinamik etkiler Klinik Faz III geliştirme programı iki faz III çalışmayı içermiştir: her ikisi de orta- ağır KOAH klinik tanılı hastalar ile gerçekleştirilen biri plasebo kontrollü 6 aylık çalışma ve diğeri plasebo veaktif kontrollü 12 aylık çalışma (günde bir kez açık etiketli tiotropium 18 mikrogram). Akciğer fonksiyonu üzerindeki etkilerGünde bir kez Glikopironyum 50 mikrogram bir dizi klinik çalışmada akciğer fonksiyonunda istikrarlı ve istatistiksel olarak anlamlı düzelme sağlamıştır (birinci saniyedeki zorlu ekspiratuvarhacim FEVı, zorlu vital kapısiteFVCnveıiaspiiEatuarekapa&itetIC). Faz III çalışmalarda bronkodilatör Belge Do Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys etkiler ilk dozdan sonraki 5 dakika içinde görülmüştür ve ilk dozdan itibaren 24 saatlik zaman aralığında korunmuştur. 6 ve 12 aylık çalışmalarda bronkodilatör etkide zaman içinde bir azalmaolmamıştır. Etkinin büyüklüğü, başlangıçta hava yolundaki kısıtlanmanın geri dönüşlülük(reversibilite) derecesine (geri dönüşlülük, kısa etkili muskarinik antagonist grubu bronkodilatörkullanılarak ölçülmüştür ) bağlı olmuştur: başlangıçta en düşük derecede geri dönüşlülüğe (<%5)sahip hastalar genellikle başlangıçta daha yüksek derecede geri dönüşlülüğü (>%5) olan hastalardandaha düşük bronkodilatör yanıt sergilemiştir. 12. haftada (birincil sonlanım noktası),Glikopironyum, plaseboya göre, çukur FEVı değerini, başlangıçta en düşük derecede geridönüşlülüğe (<%5) sahip hastalarda 72 ml ve başlangıçta daha yüksek derecede geri dönüşlülüğe(>%5) sahip hastalarda 113 ml yükseltmiştir (her ikisi için p<0,05).Uzun dönem klinik çalışmalar (6 ay ve 1 yıl)6 aylık çalışmada Glikopironyum, plaseboya göre, FEVı değerini birinci dozdan sonraki 5 dakika içerisinde 93 ml ve dozdan sonraki 15 dakika içerisinde 144 mL yükseltmiştir (her ikisi için p<0,001).12 aylık çalışmada düzelmeler dakikada 87 mL ve 15 dakikada 143 mL şeklinde olmuştur (her ikisi için p<0,001).12 aylık çalışmada, Glikopironyum, 1. günde ve 26. haftada tiotropium ilekarşılaştırıldığında FEVı değerinde istatistiksel olarak anlamlı düzelmeler ve 12. hafta ve 52.haftada dozdan 4 saat sonra tiotropiuma kıyasla FEVı değerinde sayısal olarak daha büyük değerlersağlamıştır.İlk dozda ve 1 yıl sonunda görülen doz aralığının sonundaki (24. saat) FEVı değerleri benzer olmuştur. 12. haftada (birincil sonlanım noktası), Glikopironyum, çukur FEVı değerini plaseboyagöre, 6 aylık çalışmada 108 ml ve 12 aylık çalışmada 97 mL artırmıştır (her ikisi için p<0,001).(p<0,001).Semptomatik sonuçlarGünde bir kez 50 mikrogram dozunda uygulanan glikopironyum, Geçiş Dispne İndeksi (TDI) ile değerlendirilen nefes darlığını anlamlı düzeyde azaltmıştır. 6 ve 12 aylık pivot çalışmalarınbirleştirilmiş bir analizinde, plasebo ile karşılaştırıldığında Glikopiroyum ile tedavi edilen hastalarınistatistiksel olarak daha yüksek bir yüzdesi, 26. haftada TDI fokal skorunda 1 puan veya dahayüksek bir düzelme ile yanıt vermiştir (sırasıyla %46,4 ve %58,4, p<0,001).Bu bulgular Tiotropium kullanan hastalara benzerdir; hastaların %53,4'ünde 1 puan veya daha yüksek bir düzelme ile yanıt vermiştir (plasebo ile karşılaştırmada, p<0,009).p<0,001).p=0,004).
KOAH alevlenmelerinde azalma6 ve 12 aylık pivot çalışmalarında KOAH alevlenme verileri toplanmıştır. İki çalışmada da orta veya ağır bir alevlenme (sistemik kortikosteroidlerle ve/veya antibiyotiklerle tedavi ya da hastaneye yatışgerektiren şeklinde tanımlanır) geçiren hastaların yüzdesi azalmıştır. 6 aylık çalışmada orta veyaağır bir alevlenme yaşayan hastaların yüzdesi Glikopironyum ile %17,5 ve plasebo ile %24,2olmuştur (Risk oranı: 0,69, p=0,023);p=0,001).p<0,001).p=0,003).Diğer etkilerGünde bir kez Glikopironyum kurtarıcı ilaç (salbutamol) kullanımını, plaseboya göre sırasıyla 6 ve 12 aylık çalışmalarda 26 haftada 0,46 puf/gün (p=0,005)(p=0,039)azaltmıştır.Egzersiz toleransının, maksimum altı (%80) iş yükünde bisiklet ergometresi (maksimum altı egzersiz tolerans testi) ile test edildiği 3 haftalık bir çalışmada, sabah uygulanan Glikopironyum, ilkdozdan itibaren dinamik hiperinflasyonu azaltmış ve egzersiz dayanıklılık süresini uzatmıştır.Tedavinin ilk gününde egzersiz sırasında plaseboya göre inspiratuar kapasite 230 mL yükselmiş veegzersiz dayanıklılık süresi 43 saniye artmıştır (%10 artış). Üç haftalık tedavi sonrasında plaseboyagöre Glikopironyum ile inspiratuar kapasitede elde edilen düzelme, ilk güne benzer olmuş (200 ml),ancak egzersiz dayanıklılık süresi ilk günden farklı olarak 89 saniye artmıştır (%21 artış). Borgölçekleri kullanılarak, Glikopironyum'ın egzersiz sırasında dispne ve bacak rahatsızlığını azalttığıbulunmuştur. Glikopironyum ayrıca Geçiş Dispne İndeksi ile ölçülen istirahat sırasındaki dispneyiazaltmıştır. Sekonder farmakodinamik etkilerKOAH hastalarında 176 mikrograma varan dozlarda Glikopironyum ile ortalama kalp atım hızında ya da QTc aralığında bir değişiklik gözlenmemiştir. 73 sağlıklı gönüllü ile gerçekleştirilen detaylıbir QT çalışmasında, tek bir inhale 352 mikrogram glikopironyum dozu (terapötik dozun 8 katı),plasebo ile karşılaştırıldığında, QTc aralığını uzatmamış ve kalp atım hızını biraz azaltmıştır(maksimal etki -5,9 bpm; 24 saatte ortalama etki -2,8 bpm). İntravenöz yolla uygulanan 150mikrogram glikopironyum bromürün (120 mikrogram glikopironyuma eşdeğer) kalp atım hızı veQTc aralığı üzerindeki etkisi genç sağlıklı erişkinlerde araştırılmıştır. Kararlı durumda cihazın ağızparçasından çıkan doz olan 44 mikrogram glikopironyumun inhalasyonundan sonra yaklaşık 50 katdaha yüksek pik maruziyetler (Cmaks) elde edilmiştir ve taşikardi ya da QTc uzamasına nedenolmamıştır. Genç sağlıklı gönüllülerde antikolinerjik bileşiklere düşük maruziyetlerin bilinen biretkisi olan kalp atım hızında hafif bir azalma gözlenmiştir (plasebo ile karşılaştırıldığında ortalamafark 24 saatte 2 bpm) Pediyatrik popülasyonAvrupa İlaç Ajansı, KOAH'ta pediyatrik popülasyonun tüm alt kümelerinde Glikopironyum ile çalışma sonuçlarının sunulması zorunluluğundan vazgeçmiştir (pediyatrik kullanım ile ilgili bilgiiçin bkz. bölüm 4.2). 5.2 Farmakokinetik özelliklerEmilim:Glikopironyum inhalasyon cihazı kullanılarak oral inhalasyonu takiben, glikopironyum hızla emilmiş ve doz sonrası 5. dakikada pik plazma düzeylerine erişmiştir. Glikopironyum inhalasyon cihazı aracılığıyla solunan glikopironyumun mutlak biyoyararlanımının ağız parçasından çıkan doz olan 44 mikrogram üzerinden yaklaşık % 45 olduğu hesaplanmıştır.İnhalasyonu takiben sistemik maruziyetin yaklaşık %90'ı akciğer emiliminden ve %10'ugastrointestinal emilimden kaynaklanmaktadır. Oral yolla uygulanan glikopironyumun mutlakbiyoyararlanımının yaklaşık %5 olduğu hesaplanmıştır. KOAH'lı hastalarda tekrarlanan günde bir kez inhalasyonu takiben, glikopironyumun kararlı durum farmakokinetiğine tedaviden sonraki bir hafta içinde erişilmiştir. 50 mikrogram günde bir kez dozuygulama rejimi için glikopironyumun kararlı durum ortalama piki ve çukur plazmakonsantrasyonları sırasıyla 166 pikogram /mL ve 8 pikogram /mL'dir. Günde bir kez uygulanan 100ve 200 mikrogram'lık dozlarla glikopironyumun kararlı durum maruziyeti (doz uygulama aralığındaEAA) ilk dozdan sonra yaklaşık 1,4 ila 1,7 kat daha yüksektir. Dağılım:i.v. uygulamadan sonra, glikopironyumun kararlı durum dağılım hacmi (Vss) 83 L ve terminal fazdaki dağılım hacmi (Vz) 376 L'dir. İnhalasyonu takiben terminal fazdaki belirgin dağılım hacmiyaklaşık 20 kat daha yüksek olup, bu değer inhalasyondan sonra çok daha yavaş eliminasyonuyansıtmaktadır. Glikopironyumun in vitroinsan plazma proteinine bağlanması 1 ila 10 ng/mL'likkonsantrasyonlarda %38 ila %41'dir.Biyotransformasyon:İn vitroIn vivoortamda M9, inhale glikopironyum bromürün yutulan doz fraksiyonundan oluşmaktadır.Tekrarlanan inhalasyondan sonra insanların idrarında glikopironyumun glukuronid ve/veya sülfatkonjugatları bulunmuş olup, bunlar dozun yaklaşık %3'ünü oluşturmaktadır.İn vitroaraştırmalar çoklu CYP izoenzimlerinin glikopironyumun oksidatif biyotransformasyonuna katkıda bulunduğunu göstermiştir. Glikopironyum metabolizmasının inhibisyonu veyaindüksiyonunun etkin maddeye sistemik maruziyette belirgin bir değişikliğe neden olmasıbeklenmez.İn vitroİnvitroenzim indüksiyonu çalışmaljarfenteatkfdilefizhâçfeiraisitokrom P450 izoenzimi ve UGT1A1 veBelge Do Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys
taşıyıcı MDR1 ve MRP2'de glikopironyum bromür tarafından klinik açıdan ilgili bir indüksiyon göstermemiştir. Eliminasyon:İnsanlara [3H]-işaretli glikopironyum bromürün i.v. yolla uygulanmasından sonra, 48. saatte radyoaktivite için ortalama üriner atılım dozun %85'ini oluşturmuştur. Safrada dozun ilave %5'itespit edilmiştir. Bu nedenle kütle denkliği neredeyse tamdır. Ana ilacın renal eliminasyonu sistemik olarak mevcut glikopironyumun toplam klirensinin yaklaşık %60 ila 70'ini oluştururken, renal dışı klirens prosesleri yaklaşık %30 ila 40'ını oluşturur. Safraklirens renal dışı klirense katkıda bulunur ancak renal dışı klirensin büyük çoğunluklametabolizmadan kaynaklandığı düşünülmektedir. Glikopironyum dozu inhalasyonunu takiben, glikopironyumun ortalama renal klirensi 17,4 ve 24,4 L/s aralığındadır. Aktif tübüler sekresyon glikopironyumun renal eliminasyonuna katkıda bulunur.50 mikrogram dozun %23'üne kadarı idrarda ana ilaç olarak tespit edilmiştir. Glikopironyum plazma konsantrasyonları çok fazlı bir şekilde azalmıştır. Ortalama terminal eliminasyon yarılanma ömrü intravenöz (6,2 saat) ve oral (2,8 saat) uygulamadan sonrakine kıyaslainhalasyondan sonra (33 ila 57 saat) çok daha uzun sürmüştür. Eliminasyon paterni inhalasyondansonra 24. saatte ve sonrasında sürekli akciğer emilimi ve/veya sistemik dolaşıma glikopironyumtransferini düşündürmektedir. Doğrusallık/doğrusal olmayan durum:KOAH'da farmakokinetik kararlı durumda hastaların sistemik maruziyetinin yanı sıra glikopironyumun toplam üriner atılımı da ağız parçasından çıkan doz olan 44 mikrogram üzerindendeğerlendirildiğinde 44 mikrogram ila 176 mikrogram'lık doz aralığında neredeyse dozla orantılıolarak artmıştır. Hastalardaki karakteristik özelliklerKaraciğer yetmezliği:Karaciğer bozukluğu olan hastalarda klinik çalışmalar yapılmamıştır. Glikopironyum başlıca renal atılım yoluyla sistemik dolaşımdan temizlenir (bkz., Bölüm 5.2). Glikopironyumun karaciğermetabolizmasındaki bozukluğun, sistemik maruziyette klinik olarak belirgin bir artışla sonuçlandığıdüşünülmemektedir. Böbrek yetmezliği:Böbrek bozukluğu glikopironyum bromüre sistemik maruziyet üzerinde bir etkiye sahiptir. Hafif ve orta şiddette böbrek bozukluğu olan gönüllülerde toplam sistemik maruziyette (EAAson) 1,4 katavaran ve şiddetli renal bozukluğu ve son evre böbrek hastalığı olan gönüllülerde 2,2 kata varanortalama bir artış gözlenmiştir Bir popülasyon farmakokinetiği analizi kullanıldığında, hafif ve orta derecede böbrek bozukluğu olan (hesaplanmış glomerüler filtrasyon hızı eGFR>30 mL/dak/1,73m2) KOAH hastalarında,Glikopironyum'un önerilen dozda kullanılabileceği sonucuna varılmıştır. Diyaliz gerektiren son evre renal hastalık dahil şiddetli renal bozukluğu olan hastalar için (hesaplanmış glomerüler filtrasyon hızı eGFR<30 ml/dak/1,73 m2), Glikopironyum sadecebeklenen fayda potansiyel riske ağır bastığında kullanılmalıdır (Bkz. Bölüm 4.4). Pediyatrik popülasyon:KOAH sadece yetişkinlere ilişkin bir endikasyon olduğundan, AGLİKO 18 yaşın altındaki hastalarda kullanılmamalıdır. Geriyatrik popülasyon:KOAH hastaları verilerinin popülasyon farmakokinetik analizi yaş ve vücut ağırlığının, sistemik maruziyetin hastalar arası değişkenliğine neden olabileceğini belirlemiştir. Yaş, cinsiyet, kilo, ırk:KOAH hastalarında verilere ilişkin bir popülasyon farmakokinetiği analizinde, vücut ağırlığı ve yaş sistemik maruziyette hasta bazında çeşitliliğe katkıda bulunan faktörler olarak belirlenmiştir. Gündebir kez Glikopironyum tüm yaş ve vücut ağırlığı gruplarında güvenli bir şekilde kullanılabilir.Cinsiyet, sigara kullanma durumu ve başlangıç FEVı değeri sistemik maruziyet üzerinde belirginbir etkiye sahip değildir. Japon ve Beyaz ırktan olan gönüllüler arasında glikopironyum bromürün inhalasyonunu takiben toplam sistemik maruziyet (EAA) açısından önemli farklılıklar gözlenmemiştir. Diğer etnik kökenve ırklar açısından yeterli farmakokinetik verisi mevcut değildir. 5.3 Klinik öncesi güvenlilik verileriKlinik dışı veriler, geleneksel güvenlilik farmakolojisi, tekrarlı doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üreme ve gelişim toksisitesi çalışmalarına dayalı olan insanlara yöneliközel bir tehlike ortaya koymamaktadır. Tekrarlanan doz inhalasyonu toksisitesi çalışmaları sırasında gözlenen etkiler, hafif lokal iritasyon veya glikopironyum bromürün beklenen farmakolojik etkisindeki alevlenmelere bağlanmıştır.Bunlar arasında köpeklerde kalp hızındaki hafif ila orta dereceli artışlar ve sıçanlar ve köpeklerdesalya, gözyaşı ve Harder bezleri ile farenkste azalmış sekresyonla ilişkili bir dizi geri dönüşümlüdeğişiklik yer almaktadır. Sıçanlarda kronik çalışmalar sırasında gözlenen lens opasiteleri diğermuskarinik antagonistler için tanımlanmış olup, hastalarda terapötik kullanımı açısından kısıtlıöneme sahip türe özgü değişiklikler oldukları düşünülmüştür. Sıçanların solunum yolundakibulgular nazal kavitede ve larenkste, hafif lokal iritasyonla tutarlı enflamasyon iledejeneratif/rejeneratif değişiklikleri içermiştir. Sıçanlarda akciğerde bronşiyoloalveolar bağlantıda minimum epitel değişiklikleri de gözlenmiş olup, bunlar hafif adaptif yanıt olarak kabul edilmiştir. Bu bulguların tümü maksimum insanmaruziyetinden fazla olduğu kabul edilen maruziyetlerde gözlenmiş olduğundan, klinik kullanımsırasında kısıtlı ilgiye sahiptir. Genotoksisite çalışmaları glikopironyum bromür için mutajenik veya klastojenik potansiyel ortaya koymamıştır. Transgenik farelerde oral uygulama ve sıçanlarda inhalasyon uygulaması ile yapılankarsinojenisite çalışmaları farelerde insanlar için günde bir kez 50 mikrogramlık önerilen
maksimum dozdan yaklaşık 53 kat ve sıçanlarda 75 kat daha yüksek sistemik maruziyetlerde (EAA) karsinojenisite kanıtı olmadığını ortaya koymuştur. Glikopironyum bromür için yayınlanmış veriler hiçbir üreme toksisitesi problemine işaret etmemektedir. Glikopironyum sıçanlarda veya tavşanlarda inhalasyon uygulamasını takibenteratojenik bulunmamıştır. Sıçanlarda yapılan üreme çalışmaları ve hayvanlarda elde edilen diğerveriler ne erkek ne de dişi pre ve post natal gelişiminde fertiliteye ilişkin bir endişeye yol açmamıştır. Gebe fareler, tavşanlar ve köpeklerin plasental bariyerinden önemli ölçüde glikopironyum bromür ve metabolitleri geçişi görülmemiştir. Glikopironyum bromür (metabolitleri dahil) emzirensıçanların sütüne geçmiş olup, sütte annenin kanındakinden 10 kat daha yüksek konsantrasyonlaraulaşmıştır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiLaktoz (inek sütü kaynaklıdır) Jelatin (bitkisel kaynaklıdır) 6.2 GeçimsizliklerGeçerli değil. 6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel tedbirler25oC altında oda sıcaklığında saklanmalıdır. Kapsüller dondurulmamalıdır. Nemden koruyunuz. 6.5 Ambalajın niteliği ve içeriğiKutuda, OPA/Alu/PVC folyo-Alu folyo blister ambalajda, 1 adet monodoz inhaler cihazı ile birlikte 30 adet kapsül. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Ambalaj ve
Kullanılmamış olan ürün ya da atık materyaller, Tıbbi Atıkların Kontrolü ve Ambalaj Atıklarının Kontrolü yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİGrandi İlaç San. ve Tic. Ltd. Şti. Kağıthane/İstanbul 8. RUHSAT NUMARASI2023/428 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 01.11.2023  10. KÜB' ÜN YENILEME TARİHİ |
İlaç BilgileriAgliko 50 Mcg İnhalasyon Tozu, Sert KapsülEtken Maddesi: Glikopironyum Bromür Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.






