İmnovid 1 Mg Sert Kapsül Kısa Ürün BilgisiKISA URUN BILGISIBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBİ ÜRÜNÜN ADIIMNOVID 1 mg sert kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Pomalidomid 1 mg Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMSert kapsül IMNOVID 1 mg sert kapsül: Opak koyu mavi kılıflı ve opak sarı gövdeli, üzeri beyaz renkte POML ve siyah renkte 1 mg baskılı, büyüklüğü 3 olan, sert jelatin kapsül. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarIMNOVID, bortezomib ve deksametazon ile kombinasyon halinde, daha önce lenalidomid de dahil olmak üzere en az bir tedavi rejimi alan, bu tedavilere dirençli veya nüks eden multiplmiyelomlu erişkin hastaların tedavisinde endikedir. IMNOVID, deksametazonla kombinasyon halinde, aşağıda belirtilen koşulları taşıyan multipl miyelom tanılı yetişkin hastaların tedavisinde endikedir: 1. Otolog kök hücre nakline uygun olmayan hastalarda bortezomib ve lenalidomid dahil en aziki dizi tedavi sonrası nüks eden veya bu tedavilere dirençli hastalık varlığında endikedir. 1 Klinik veya laboratuvar bulgularına göre doza devam edilebilir veya doz ayarlaması yapılabilir (bkz. Bölüm 4.4). Pomalidomidin bortezomib ve dekzametazon ile kombinasyonuÖnerilen başlangıç dozu, tekrarlanan 21 günlük sikluslar halinde 1 ve 14. günler arası gündebir defa ağızdan alınan 4 mg IMNOVID'dir.Pomalidomid, Tablo 1'de gösterildiği gibi bortezomib ve deksametazon ile kombinasyon halinde uygulanır. Bortezomibin önerilen başlangıç dozu Tablo 1'de gösterilen günlerde gündebir kez intravenöz veya subkütan olarak 1,3 mg/m1'dir. Önerilen deksametazon dozu, Tablo1'de gösterilen günlerde günde bir kez oral olarak alınan 20 mg'dır Bortezomib ve deksametazon ile kombine edilen pomalidomid tedavisi, hastalığın ilerlemesi veya kabul edilemez toksisite oluşana kadar verilmelidir. Tablo 1. Bortezomib ve deksametazon ile kombinasyon halinde Pomalidomid için önerilen dozaj şeması
Pomalidomid doz ayarlaması veya ara verilmesiYeni bir pomalidomid siklusunu başlatmak için, nötrofil sayısının >1x109/L ve trombosit sayısının >50x 109/L olması gerekmektedir. Advers reaksiyonlarla ilgili olarak pomalidomid tedavisine ara verilmesi veya dozunun azaltılması ile ilgili bilgiler, Tablo 2'de ve doz seviyeleri Tablo 3'de belirtilmiştir:
Dozun 1 mg'a düşürülmesi sonrasında advers reaksiyonlar ortaya çıkarsa, tedavi kesilmelidir. Güçlü CYP1A2 inhibitörleriGüçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) pomalidomid ile birlikte uygulanırsa pomalidomid dozu %50 azaltılmalıdır. Bortezomib doz modifikasyonu veya kesilmesiBortezomibe bağlı advers reaksiyonlar için doz kesilmesi veya azaltmaları ile ilgili talimatlar için hekimler bortezomib KÜB'ne başvurmalıdır. Deksametazon doz modifikasyonu veya kesilmesiDüşük doz deksametazona bağlı advers reaksiyonlar için doz kesilmesi veya azaltması ile ilgili talimatlar Tablo 4 ve Tablo 5'te özetlenmiştir.
Eğer toksisitelerin düzelmesi 14 günden fazla sürerse, deksametazon dozu bir önceki dozdan daha düşük bir doz seviyesinde devam edecektir.
Eğer 75 yaş ve altındaki hasta 8 mg'ı veya 75 yaş üstü hasta 4 mg'ı tolere edemezse deksametazon kesilmelidir. Tedavi rejiminin herhangi bir bileşeninin kalıcı olarak kesilmesi durumunda, kalan diğer tıbbi ürünlerin devamlılığı doktorun takdirine bağlıdır. Pomalidomid'in dekzametazon ile kombinasyonuPomalidomid'in önerilen başlangıç dozu, her 28 günlük sikluslar halinde 1 ve 21. günler arası günde bir defa ağızdan alınan 4 mg'dır. Deksametazon için önerilen doz, her 28 günlük siklusunun 1, 8, 15 ve 22. günlerinde günde bir defa ağızdan alınan 40 mg'dır. Deksametazon ile kombine edilen pomalidomid tedavisi, hastalığın ilerlemesi veya kabul edilemez toksisite oluşana kadar verilmelidir. Pomalidomid doz azaltma veya kesilmesiAdvers reaksiyonlarla ilgili olarak pomalidomid tedavisine ara verilmesi veya dozunun azaltılması ile ilgili bilgiler, Tablo 2 ve Tablo3'te özetlenmiştir. Deksametazona bağlı advers reaksiyonlar için doz azaltması ile ilgili talimatlar aşağıda Tablo 4 ve Tablo 6'de özetlenmiştir. Bununla birlikte, doz kesintisi / yeniden başlama kararları, güncelKÜB'ne göre hekimin takdirine bağlıdır.
Eğer 75 yaş ve altındaki hasta 8 mg'ı veya 75 yaş üstü hasta 4 mg'ı tolere edemezse deksametazon kesilmelidir. Uygulama şekli:Oral yolla kullanım IMNOVID sert kapsül, her gün aynı saatte alınmalıdır. Kapsüller açılmamalı, kırılmamalı veya çiğnenmemelidir. Bu kapsüller bir bütün halinde, tercihen suyla birlikte, gıda ile veya yalnızbaşına yutulmalıdır. Hasta bir gün pomalidomid almayı unutursa, ertesi gün reçete edilmiş olannormal dozu planlandığı şekilde kullanmalıdır. Hastalar, daha önceki günlerde unutulan dozutelafi etmek için dozu ayarlamamalıdır. Blisterden çıkarmak için kapsülün yalnızca bir ucuna bastırmanız önerilmektedir; bu şekilde kapsül deformasyonu ya da kırılma riski azalacaktır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalar için pomalidomid dozunda ayarlama gerekli değildir. Hemodiyaliz günlerinde, hastalar pomalidomid dozunu hemodiyalizi takiben almalıdır. Karaciğer yetmezliği:Serum total bilirubin değerleri > 1,5 x NAÜS (normal aralığın üst sınırı) olan hastalar, klinik çalışmalara dahil edilmemiştir. Karaciğer yetmezliğinin, pomalidomidin farmakokinetiğiüzerinde hafif bir etkisi vardır (bkz. Bölüm 5.2). Child-Pugh kriterine göre tanımlanan karaciğeryetmezliği olan hastalarda pomalidomid başlangıç dozunda ayarlama gerekli değildir. Bununlabirlikte, karaciğer yetmezliği olan hastaların, advers reaksiyonlar açısından dikkatle takipedilmeleri gerekir ve gerekiyorsa pomalidomidin dozu azaltılmalı ya da pomalidomide araverilmelidir. Pediyatrik popülasyon:Multipl Miyelom endikasyonu için 0-17 yaş arası çocuklarda pomalidomidin uygun bir kullanımı yoktur. Onaylanmış endikasyonları dışında, pomalidomid, tekrarlayan veya ilerleyen beyin tümörleri olan 4 ila 18 yaş arası çocuklarda incelenmiştir, ancak çalışmaların sonuçları, bu tür bir 6 kullanımın yararlarının risklerden daha ağır bastığı sonucuna varılmasına izin vermemiştir. Mevcut veriler Bölüm 4.8, 5.1 ve 5.2'de açıklanmaktadır. Geriyatrik popülasyon:Pomalidomid için herhangi bir doz ayarlaması gerekmemektedir. Pomalidomidin bortezomib ve dekzametazon ile kombinasyonu 75 yaş üzeri hastalar için deksametazon başlangıç dozu: o Siklus 1-8 için: 21 günlük siklusun 1, 2, 4, 5, 8, 9,11 ve 12. günlerinde günlük 10 mg o Siklus 9 ve sonrası için: 21 günlük siklusun 1, 2, 8 ve 9. günlerinde günlük 10 mg Pomalidomidin deksametazon ile kombinasyonu75 yaş üzeri hastalar için, deksametazonun başlangıç dozu Her 28 günlük tedavi siklusunun 1, 8, 15 ve 22. günlerinde günde bir defa 20 mg'dır. 4.3. Kontrendikasyonlar Gebelik, Gebelik önleme programının tüm koşullarına uymadığı takdirde, çocuk doğurma potansiyeliolan kadınlar (bkz. Bölüm 4.4 ve 4.6), Gerekli doğum kontrol önlemlerini takip edemeyen veya önlemlerine uyamayan erkekhastalar (bkz. Bölüm 4.4), Etkin maddeye veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılık (bkz. Bölüm6.1). 4.4. Özel kullanım uyarıları ve önlemleriTeratojenisitePomalidomid ile teratojenik bir etki beklendiğinden gebelik sırasında alınmamalıdır. Pomalidomid yapısal olarak talidomide benzerdir. Talidomid, insanlarda yaşamı tehdit ediciciddi doğumsal kusurlara neden olduğu bilinen bir teratojendir. Pomalidomidin, sıçanlarda vetavşanlarda majör organogenez döneminde kullanıldığında teratojenik olduğu bulunmuştur (bkz.Bölüm 5.3). Hastanın çocuk doğurma potansiyeline sahip olmadığına dair güvenilir kanıtlar olmadığı sürece, Gebelik Önleme Programının koşulları tüm hastalar için yerine getirilmelidir. Çocuk doğurma potansiyeli olmayan kadınlar için kriterlerAşağıdaki kriterlerden en az biri bulunduğunda, bir kadın hastanın ya da bir erkek hastanın eşinin çocuk doğurma potansiyelinin olmadığı düşünülür: Yaş > 50 ve doğal olarak > 1 yıl amenore durumunda (Kanser tedavisini takip eden veyalaktasyon sürecindeki amenore, çocuk doğurma potansiyelini ekarte ettirmez.) Uzman bir jinekolog tarafından onaylanan prematüre over yetmezliği Bilateral salpingo-ooferektomi veya histerektomi hikayesi XY genotipi, Turner Sendromu, uterus agenezi DanışmanlıkÇocuk doğurma potansiyeli olan kadınlar için aşağıdakilerin tümü sağlanmadıkça pomalidomid kullanımı kontrendikedir: Doğmamış çocuk için beklenen teratojenik riski anlaması, Tedaviye başlamadan en az 4 hafta önce, tüm tedavi boyunca (doza ara vermeler dedahil olmak üzere) ve tedavinin sonlanmasından en az 4 hafta sonrasına kadar, etkili birdoğum kontrol yönteminin kesintisiz olarak uygulanması gerektiğini anlaması, Çocuk doğurma potansiyeli bulunan bir kadın amenore olsa dahi, etkili doğum kontrolükonusundaki tüm önerileri izlemelidir, Etkili doğum kontrol yöntemlerine uyabilme kapasitesinde olması, Gebeliğin potansiyel sonuçlarını ve gebelik riski bulunuyorsa hemen doktorunadanışmasının gerekliliği konusunda bilgi verilmesi ve bunu anlaması, Negatif bir gebelik testini takiben pomalidomid reçete edilir edilmez tedaviye başlamasıgerektiğini anlaması, Teyit edilmiş tubal sterilizasyon haricinde, en az her 4 haftada bir gebelik testi yapılmasıgereğini anlaması ve kabul etmesi, Pomalidomid kullanımı ile ilgili tehlikeleri ve gerekli önlemleri anladığını belirtmesi. İlacı reçeteleyen doktorlar, çocuk doğurma potansiyeli olan kadınlar için aşağıdakileri sağlamalıdır: Hastanın Gebelik Önleme Programının koşullarını yeterli derecede anlama kapasitesinesahip olduğundan ve bu koşullara uygun davranacağından emin olması, Hastanın önceden bahsedilen bu koşulları onaylamış olması. Pomalidomid kullanan erkek hastalar için farmakokinetik veriler, pomalidomidin tedavi süresince insan semenine geçebildiğini göstermiştir. Önlem olarak ve karaciğer yetmezliği gibiuzamış eliminasyon zamanına sahip özel popülasyonlar dikkate alınarak, pomalidomidkullanan tüm erkek hastalar aşağıdaki koşulları sağlamalıdır: Gebe veya çocuk doğurma potansiyeli olan bir kadınla cinsel ilişkiye girmesidurumunda beklenen teratojenik riski anlamalıdır, Tedavi süresi boyunca, tedavi kesildikten sonra ve dozlara ara verildikten ve/veya tedavikesildikten sonraki 7 gün süreyle gebe bir kadınla veya etkili bir doğum kontrol yöntemikullanmayan çocuk doğurma potansiyeli olan bir kadınla cinsel ilişkiye girmesidurumunda prezervatif kullanması gerektiğini anlamalıdır. Sperm olmasa dahi seminalsıvı pomalidomid içerebileceğinden, vazektomi geçirmiş erkek hastalar da dahil olmaküzere gebe bir kadın veya çocuk doğurma potansiyeli olan bir kadın ile cinsel ilişkiyegirmesi durumunda prezervatif kullanmalıdır. Pomalidomid kullandığı süre içerisinde ya da pomalidomid kullanmayı bıraktıktan 7gün sonra eğer eşi gebe kalırsa, derhal tedaviden sorumlu hekime haber vermesigerektiğini ve eşi için, değerlendirme ve tavsiye amacıyla teratoloji konusunda uzmanya da deneyimli bir hekime başvurması gerektiğini anlamalıdır. Doğum KontrolüÇocuk doğurma potansiyeli olan kadınlar tedavinin en az 4 hafta öncesinden başlayarak, tedavi sırasında ve pomalidomid tedavisinden en az 4 hafta sonrasına kadar ve doza ara verildiğindedahi; hasta cinsel ilişkiden bütünüyle ve sürekli olarak uzak duracağını her ay taahhütetmedikçe, etkili bir doğum kontrol yöntemlerinden en az birini kullanmalıdır. Etkili bir yöntembelirlenmediyse, hasta etkili bir korunmanın başlatılması için uygun şekilde eğitim almış birsağlık profesyoneline yönlendirilmelidir. Aşağıdakiler uygun doğum kontrol yöntemlerine örnek olarak değerlendirilebilir: İmplant, Levonorgestrel salan rahim içi araçlar (RİA) Medroksiprogesteron asetat deposu Tubal sterilizasyon Sadece vazektomi uygulanmış erkek partner ile cinsel ilişki; vazektomi iki negatifsemen analiziyle doğrulanmalıdır Sadece progesteron içeren ovülasyon inhibitörü haplar (örneğin, desogestrel). Pomalidomid ve deksametazon kullanan multipl miyelomlu hastalarda venöz tromboembolizm riskinin artması nedeniyle kombine oral kontraseptif haplar önerilmez (bkz.Bölüm 4.5). Eğerhasta kombine bir oral kontraseptif kullanıyorsa, yukarıda listelenen etkili yöntemlerden birinegeçmelidir. Venöz tromboembolizm riski kombine oral kontrasepsiyonun kesilmesi sonrası 46 hafta boyunca sürer. Deksametazon ile birlikte kullanılması kontraseptif steroidlerinetkililiğini azaltabilir (bkz. Bölüm 4.5). İmplantlar ve levonorgestrel salan rahim içi sistemler, düzensiz vajinal kanama ve yerleştirme anında artmış enfeksiyon riski ile ilişkilidir. Özellikle nötropenili hastalarda profilaktikantibiyotiklerin kullanılması düşünülmelidir. Bakır salan rahim içi araçların, ciddi derecede nötropeni veya ciddi derecede trombositopenili hastalarda hastaları tehlikeye sokabilecek menstrüel kan kaybı ve yerleştirme sırasında olasıenfeksiyon riski gibi potansiyel riskleri yüzünden önerilmemektedir. Gebelik testleri Yerel uygulamaya göre, çocuk doğurma potansiyeli olan kadınlar için sensitivitesi minimum 25 mIU/mL olan ve tıbbi olarak denetlenmiş gebelik testleri aşağıda belirtildiği şekildeuygulanmalıdır. Bu gereklilik, bütünüyle ve sürekli olarak cinsel ilişkiden uzak duracağınıtaahhüt eden çocuk doğurma potansiyelindeki kadınları da kapsar. İdeal olarak gebelik testi,reçetenin yazılması ve ilacın verilmesi aynı gün içinde olmalıdır. Çocuk doğurmapotansiyelinde olan kadınlara pomalidomid temin edilmesi, reçete tarihinden itibaren 7 güniçinde gerçekleşmelidir. Tedaviye başlanmadan önceTıbbi olarak doğrulanmış gebelik testi, pomalidomid reçetelendiği konsültasyon sırasında uygulanmalı veya en az 4 hafta boyunca etkili bir korunma yöntemi kullanan hastanın reçeteyiyazacak doktoru ziyaret etmesinden önceki 3 gün içinde uygulanmalıdır. Bu test, hastapomalidomid ile tedaviye başladığında gebelik olmadığını göstermelidir. İzleme ve tedavinin sona ermesiOnaylanmış tubal sterilizasyon durumu hariç, tıbbi olarak doğrulanmış gebelik testi, tedavinin sona ermesinden sonraki 4 hafta dahil en az her 4 haftada bir tekrarlanmalıdır. Bu gebeliktestleri ilacın reçetelendiği gün veya reçeteyi yazacak doktoru ziyaretten önceki 3 gün içindeuygulanmış olmalıdır. Ek önlemlerHastalar, bu ilacı başka bir kişiye vermemeleri gerektiği ve kullanılmayan kapsüllerin tedavi sonunda eczacılara teslim edilmesi gerektiği konusunda bilgilendirilmelidir. Hastalar tedavi sırasında (doza ara vermeler de dahil) ve pomalidomidin kesilmesini takip eden 7 gün boyunca kan, semen veya sperm bağışında bulunmamalıdır. Sağlık profesyonelleri ve bakıcılar blister veya kapsülü tutarken tek kullanımlık eldiven giymelidir. Hamile olan veya hamile olabileceğinden şüphelenen kadınlar blister veya kapsüledokunmamalıdır (bkz. Bölüm 6.6) Eğitim malzemeleri, reçeteleme ve dağıtma kısıtlamalarıPomalidomidin fetal maruziyetini önlemede hastalara yardımcı olmak amacıyla, Ruhsat Sahibi, pomalidomidin beklenen teratojenisitesi konusundaki uyarıları vurgulamak, tedaviyebaşlanmadan önce doğum kontrolü konusunda tavsiye ve gebelik testinin gerekliliği konusundarehberlik sağlamak için sağlık profesyonellerine eğitim malzemesi temin edecektir. İlacı reçeteeden hekim, hastayı hastayı beklenen teratoj enik risk ve Gebelik Önleme Programında belirtilensıkı gebelik önleme tedbirleri hakkında bilgilendirmeli ve hastalara her bir Ulusal YetkiliOtorite ile mutabık kalındığı şekilde uygun hasta eğitim broşürü sağlamalıdır. Her bir UlusalYetkili Otorite ile işbirliği içerisinde ulusal kontrollü dağıtım programı uygulamayakonulmuştur. Kontrollü dağıtım sistemi, reçetelenme ve/veya dağıtım kontrolleri için hasta kartıve/veya eşdeğer materyalin kullanımı ve ulusal olarak endikasyon dışı kullanımı izlemekamacıyla endikasyona ilişkin ayrıntılı verilerin toplanmasını içermektedir. Tercihen gebeliktesti ve reçete yazma ile ilaç dağıtım işlemleri aynı gün olmalıdır. Çocuk doğurma potansiyeliolan bir kadına pomalidomid tıbbi olarak doğrulanmış, negatif hamilelik testi sonrası reçeteedildikten itibaren 7 gün içinde sağlanmalıdır. Çocuk doğurma potansiyeli olan kadınlara verilenreçeteler, onaylanmış endikasyonlara göre dozaj rejimleri maksimum 4 haftalık bir tedavi süresive diğer tüm hastalar için verilen reçeteler maksimum 12 hafta süresi için olabilir. (bkz. Bölüm4.2). Hematolojik olaylarNötropeni, nüks/dirençli multipl miyelom hastalarında en sık bildirilen 3. veya 4. derece hematolojik advers reaksiyondur, nötropeniyi anemi ve trombositopeni takip etmektedir.Hastalar, hematolojik advers reaksiyonlar, özellikle de nötropeni açısından izlenmelidir.Hastalara febril nöbetlerini derhal bildirmeleri konusunda tavsiyede bulunulmalıdır. Hekimlerburun kanamaları dahil kanama belirtileri açısından, özellikle de kanama riskini artırdığı bilinenilaçların eşzamanlı kullanımı sırasında, hastaları gözlemelidir (bkz. Bölüm 4.8). Tam kansayımları tedaviye başlamadan, tedavinin ilk 8 haftası boyunca her hafta, İlk 8 haftadan sonra kullanım süresi boyunca en az ayda bir gerçekleştirilir. Doz ayarlaması gerekli olabilir (bkz. Bölüm 4.2). Hastaların, kan ürünü desteği ve/veya büyüme faktörleri kullanması gerekli olabilir. Tromboembolik olaylarBortezomib ve deksametazon ile veya deksametazon ile kombinasyon halinde pomalidomid kullanan hastalarda venöz tromboembolik olaylar (başlıca derin ven trombozu ve pulmonerembolizm) ve arteriyel trombotik olaylar (miyokard enfarktüsü ve serebrovasküler olay)gelişmiştir. (bkz. bölüm 4.8). Tromboembolizm için bilinen risk faktörleri bulunan hastalar -daha önce tromboz geçiren hastalar dahil - yakından izlenmelidir. Tüm değiştirilebilir riskfaktörlerini (örn., sigara kullanmak, hipertansiyon ve hiperlipidemi) en aza indirmek için gerekliişlemler yapılmalıdır. Hastalara ve hekimlere tromboembolizm belirti ve semptomlarına karşıdikkatli olmaları konusunda tavsiyede bulunulmalıdır. Hastalara, nefes darlığı, göğüs ağrısı, kolveya bacakta şişme gibi semptomlar görülmesi halinde tıbbi yardım istemeleri konusunda bilgiverilmelidir. Antikoagülan tedavi (kontrendike olmadıkça) (asetilsalisilik asit, varfarin, heparinveya klopidogrel gibi) özellikle ilave trombotik risk faktörleri bulunan hastalar içinönerilmektedir. Profilaktik önlem alma kararı, bireysel olarak hastanın altta yatan riskfaktörlerinin dikkatle değerlendirilmesi sonrasında alınmalıdır. Klinik çalışmalarda, hastalarprofilaktik asetilsalisilik asit veya alternatif antitrombotik tedavi almışlardır. Eritropoietikilaçların kullanılması, tromboembolizm dahil trombotik olaylar için bir risk taşır. Bu nedenle,eritropoietik ilaçların yanı sıra tromboembolik olayların riskini artırabilecek olan diğer ilaçlardikkatle kullanılmalıdır. Tiroid bozukluklarıHipotiroidizm vakaları bildirilmiştir. Tedaviye başlamadan önce tiroid fonksiyonunu etkileyen komorbid durumların optimum kontrolü önerilir. Tiroid fonksiyonunun başlangıç ve devameden durumunun izlenmesi önerilir. Periferik nöropatiDevam eden 2. derece veya daha yüksek periferik nöropatisi olan hastalar, pomalidomid ile yapılan klinik çalışmalara dahil edilmemiştir. Bu tür hastaların pomalidomid ile tedavisidüşünüldüğünde gerekli dikkat gösterilmelidir. Belirgin kardiyak disfonksiyonBelirgin kardiyak disfonksiyonu olan hastalar (konjestif kalp yetmezliği [New York Kalp Derneği Sınıf III veya IV]; tedaviye başlamadan önceki 12 ay içinde miyokard enfarktüsü;stabil olmayan veya yeterince kontrol altına alınmamış olan anjina pektoris) pomalidomid ileyapılan klinik çalışmaların dışında bırakılmışlardır. Özellikle önceden kardiyak hastalığı veyakardiyak risk faktörleri olan hastalarda konjestif kalp yetmezliği, pulmoner ödem ve artriyalfibrasyonu içeren kardiyak olaylar (bkz. Bölüm 4.8) bildirilmiştir. Pomalidomid alan buhastaların tedavisi düşünüldüğünde, kardiyak olayların belirti veya bulgularının periyodiktakibini içeren uygun önlemler alınmalıdır. Tümör lizis sendromuTümör lizis sendromu için en yüksek risk altında olan hastalar tedavi öncesinde yüksek tümör yükü olan hastalardır. Bu hastalar yakından takip edilmeli ve uygun önlemler alınmalıdır. İkinci primer malignitelerPomalidomid kullanan hastalarda melanom harici deri kanseri gibi ikinci primer maligniteler bildirilmiştir (bkz. Bölüm 4.8). Hekimler, hastaları tedavi öncesinde ve tedavi sırasında ikinciprimer malignitelerin ortaya çıkması açısından standart kanser taramaları kullanarak dikkatledeğerlendirmeli ve endike olduğu şekilde bu hastalıkların tedavisini başlatmalıdır. Alerjik reaksiyon ve ciddi deri reaksiyonlarıPomalidomid kullanımı ile anjioödem, anaflaktik reaksiyon ve SJS, TEN ve DRESS'i içeren ciddi dermatolojik reaksiyonlar bildirilmiştir (bkz. Bölüm 4.8). Hastalar reçete eden doktortarafından bu reaksiyonların belirti ve semptomları hakkında bilgilendirilmeli ve eğer busemptomlar gelişirse derhal tıbbi yardım almaları hastalara anlatılmalıdır. Eksfolyatif veyabüllöz döküntü durumunda veya SJS, TEN ya da DRESS şüphesi olduğunda pomalidomidkullanımı bırakılmalı ve bu reaksiyonların düzelmesinin ardından tekrar başlatılmamalıdır.Daha öncesinde talidomid veya lenalidomid kullanımı ile ilişkili ciddi alerjik reaksiyon öyküsüolan hastalar, klinik çalışmalara dahil edilmemişlerdir. Bu tür hastalar aşırı duyarlılıkreaksiyonları için daha yüksek risk altında olabilirler ve bu hastalar pomalidomidkullanmamalıdır. İkinci veya üçüncü derece deri döküntüsü durumunda pomalidomide araverilmesi veya pomalidomidin kesilmesi düşünülmelidir. Anjiyoödem ve anaflaktik reaksiyondurumunda pomalidomid kalıcı olarak kesilmelidir. Baş dönmesi ve konfüzyonPomalidomid ile baş dönmesi ve konfüzyon bildirilmiştir. Hastalar, baş dönmesi veya konfüzyonun bir sorun oluşturabileceği durumlardan ve tıbbi tavsiye almaksızın baş dönmesive konfüzyona neden olabilecek diğer ürünleri almaktan kaçınmalıdırlar. İnterstisyel akciğer hastalığı (İAH)Pomalidomid ile, pnömonit vakaları dahil interstisyel akciğer hastalığı ve ilişkili olaylar gözlenmiştir. Pulmoner semptomlarda akut başlangıçlı veya açıklanamayan kötüleşme görülenhastalar interstisyel akciğer hastalığını elemek üzere dikkatlice değerlendirilmelidir.Pomalidomid bu semptomlar araştırılırken kesilmeli ve interstisyel akciğer hastalığıdoğrulanırsa uygun tedavi başlatılmalıdır. Pomalidomid sadece kapsamlı bir yarar ve riskdeğerlendirmesi sonrasında yeniden başlatılmalıdır. Karaciğer bozukluklarıPomalidomid ile tedavi edilen hastalarda belirgin olarak artmış alanin aminotransferaz ve bilirubin düzeyleri gözlenmiştir (bkz. Bölüm 4.8). Ayrıca pomalidomidin kesilmesi ilesonuçlanan birkaç hepatit vakası da gözlenmiştir. Pomalidomid ile tedavinin ilk 6 ayı boyuncave ardından klinik olarak endike olduğunda düzenli karaciğer fonksiyonu takibi önerilmektedir. EnfeksiyonlarÖnceden hepatit B virüsü (HBV) ile enfekte olan hastalarda deksametazon ile kombinasyon halinde pomalidomid kullanımı sırasında nadir olarak hepatit B reaktivasyonu bildirilmiştir.Bazı hastalarda akut viral hepatit sebebiyle gelişen yetmezliğe bağlı pomalidomid tedavisininkesilmesi gerekebilir. Pomalidomid tedavisi başlatılmadan önce hepatit B virüsü durumubelirlenmelidir. HBV enfeksiyonu bakımından pozitif olan hastalarda, hepatit B tedavisindeuzman bir hekim ile konsültasyon önerilmektedir. Pomalidomidin deksametazon ilekombinasyon halinde kullanılacağı önceden HBV ile enfekte olmuş hastalarda, Anti-HBc'sipozitif ancak HBsAg'si negatif olanlar da dahil olmak üzere, dikkatli olunmalıdır. Bu hastalartedavi boyunca aktif HBV enfeksiyonu belirti ve semptomları açısından yakından izlenmelidir. Progresif multifokal lökoensefalopati (PML)Pomalidomid ile ölümcül vakaları içeren progresif multifokal lökoensefalopati vakaları bildirilmiştir. PML, pomalidomid ile tedaviye başladıktan birkaç ay ila birkaç yıl sonra raporedilmiştir. Vakalar genellikle eşzamanlı deksametazon alan veya diğer immünosupresifkemoterapi ile daha önce tedavi alan hastalarda bildirilmiştir. Hekimler hastaları düzenliaralıklarla izlemeli ve yeni veya kötüleşen nörolojik semptomları, bilişsel veya davranışsalbelirti veya semptomları olan hastalarda ayırıcı teşhis koyarak PML'yi dikkate almalıdır.Hastanın farkında olmadığı semptomları fark edebileceklerinden, hastalara ayrıca eşlerini veyabakıcılarını tedavileri hakkında bilgilendirmeleri tavsiye edilmelidir. PML değerlendirmesi; nörolojik muayeneye, beynin manyetik rezonans görüntülemesine ve polimeraz zincir reaksiyonu (PCR) ile JC virüsü (JCV) DNA için beyin omurilik sıvısı analizineveya JCV testi ile beyin biyopsisine dayanmalıdır. Negatif bir JCV PCR, PML'yi hariçtutmamaktadır. Alternatif tanı konulamazsa ek bir takip ve değerlendirme gerekebilir. PML'den şüpheleniliyorsa, PML hariç tutulana kadar daha fazla dozlama yapılmamalıdır. PML doğrulanırsa, pomalidomid kalıcı olarak kesilmelidir. Kullanılmamış kapsüller Hastalara, bu tıbbi ürünü kesinlikle başka bir kişiye vermemeleri ve varsa kullanılmamış kapsülleri tedavi sonunda eczacılarına iade etmeleri söylenmelidir. IMNOVID kapsüller açılmamalı veya ezilmemelidir. Pomalidomid tozu deriye temas ederse, deri derhal ve sabunlu su ile iyice yıkanmalıdır. Pomalidomid mukoz membranlarla temasederse, bunlar su ile iyice yıkanmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer tıbbi ürünlere pomalidomidin etkisiPomalidomidin, P450 izoenzimlerinin substratları veya taşıyıcıları ile birlikte uygulanmasının, P450 izoenzim inhibisyonu veya indüksiyonu veya taşıyıcı inhibisyonuna bağlı klinik olarakanlamlı farmakokinetik etkileşmelerine neden olması beklenmemektedir. Bu tür etkileşimpotansiyeli, pomalidomidin kombine oral kontraseptiflerin farmakokinetiği üzerine potansiyeletkisi dahil olmak üzere, klinik olarak değerlendirilmemiştir (bkz. Bölüm 4.4). ğer tıbbi ürünlerin pomalidomide etkisiPomalidomid, CYP1A2 ve CYP3A4/5 tarafından kısmi olarak metabolize edilir. Ayrıca P-glikoproteinin de bir substratıdır. Pomalidomidin güçlü CYP3A4/5 ve P-gp inhibitörü olan ketokonazol ile veya güçlü CYP3A4/5 indükleyicisi olan karbamazepin ile eşzamanlıuygulanmasının, pomalidomide maruziyet üzerinde klinik olarak anlamlı etkisibulunmamaktadır. Güçlü CYP1A2 inhibitörü olan fluvoksaminin pomalidomid ile ketokonazolvarlığında eşzamanlı olarak uygulanması, pomalidomid ve ketokonazole kıyasla,pomalidomide ortalama maruziyeti %90 güven aralığı ile [%91 ila %124] %107 oranındaartırmıştır. Tek başına bir CYP1A2 inhibitörünün metabolizma değişikliklerine katkısınıdeğerlendirmek üzere yapılan ikinci bir çalışmada, pomalidomid ile tek başına fluvoksaminineşzamanlı olarak uygulanması pomalidomide ortalama maruziyeti, tek başına pomalidomidekıyasla %90 güven aralığı ile [%98 ila %157) %125 artırmıştır. Güçlü CYP1A2 inhibitörleri(örn., siprofloksasin, enoksasin ve fluvoksamin) pomalidomid ile eşzamanlı olarak uygulanırsa,pomalidomid dozu %50 azaltılmalıdır. Pomalidomidin güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) ile eşzamanlı uygulanması halinde, hastalar advers reaksiyonlar açısından yakından takipedilmelidir. DeksametazonMultipl miyelom hastalarında 4 mg'a kadar olan çoklu pomalidomid dozlarıyla, 20 mg ila 40 mg arasında deksametazonun (CYP3A dahil çeşitli CYP enzimlerinin hafif ila orta derecedeindükleyicisi) eşzamanlı olarak uygulanmasının, pomalidomidin tek başına uygulanmasınakıyasla, pomalidomidin farmakokinetiği üzerine herhangi bir etkisi olmamıştır. Deksametazonun, varfarin üzerine olan etkisi bilinmemektedir. Tedavi sırasında varfarin konsantrasyonunun yakından takip edilmesi tavsiye edilir. Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:Multipl Miyelom endikasyonu için 0-17 yaş arası çocuklarda pomalidomidin uygun bir kullanımı yoktur. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: X Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadınlar etkili doğum kontrol yöntemi kullanmalıdır. Pomalidomid insan semeninde bulunmaktadır. Önlem olarak pomalidomid kullanmakta olantüm erkek hastalar, eşleri gebe ise ya da eşlerin çocuk doğurma potansiyelinin olması veherhangi bir doğum kontrol yöntemi kullanmaması durumunda tedavi süresince, tedaviye araverilmesi sırasında ve tedavi kesildikten sonra 7 gün süreyle prezervatif kullanmalıdır (bkz.Bölüm 4.3 ve 4.4). Çocuk doğurma potansiyeli olan kadınlar tedaviye başlamadan 4 hafta önce ve süresince (ve tedavinin ardından 4 haftaya kadar) etkili doğum kontrolü uygulamak zorundadırlar (bkz.Bölüm 4.3 ve 4.4). Pomalidomid gebelik boyunca ve gebeliği önlemek için tüm koşullara uyulmadıkça, çocuk doğurma potansiyeli olan kadınlarda kontrendikedir (bkz. Bölüm 4.3 ve 4.4). Gebelik dönemiIMNOVID gebelik döneminde kontrendikedir (bkz. Bölüm 4.3). Pomalidomidin insanlarda teratojenik etkisi olması beklenmektedir. Pomalidomid ile tedavi edilen kadınlarda gebelik ortaya çıkması halinde, tedavi durdurulmalıdır ve hasta değerlendirme ve tavsiye için teratoloji konusunda uzman veyadeneyimli bir hekime sevk edilmelidir. Pomalidomid kullanmakta olan bir erkeğin eşindegebelik ortaya çıkması halinde, erkeğin eşinin değerlendirme ve tavsiye için teratolojikonusunda uzman veya deneyimli bir hekime sevk edilmesi önerilir. Laktasyon dönemiPomalidomidin insan sütüyle atılıp atılmadığı bilinmemektedir. Pomalidomid anneye uygulandıktan sonra, emziren sıçanların sütünde tespit edilmiştir. Anne sütü alan bebeklerdepomalidomide bağlı advers reaksiyon görülme olasılığı nedeniyle, çocuk için emzirmenin vekadın için terapinin faydalarını dikkate alarak, emzirmenin mi yoksa tedavinin mi kesileceğinedair bir karar verilmelidir. Üreme yeteneği/FertilitePomalidomidin hayvanlarda fertiliteyi olumsuz olarak etkilediği ve hayvanlarda teratojenik olduğu gösterilmiştir. Gebe tavşanlara uygulandıktan sonra, pomalidomid plasentayageçmiştir ve fetal kanda tespit edilmiştir (bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerPomalidomidin araç ve makine kullanma yeteneği üzerine hafif veya orta derecede bir etkisi bulunmaktadır. Pomalidomid kullanımı ile yorgunluk, depresif bilinç düzeyi, konfüzyon ve baş dönmesi bildirilmiştir. Hastalar pomalidomid ile tedavi edilirken araç, makine kullanmamaları veyatehlikeli işler yapmamaları konusunda uyarılmalıdır. 4.8. İstenmeyen etkilerGüvenlilik profili özeti Pomalidomidin bortezomib ve dekzametazon ile kombinasyonuEn sık bildirilen kan ve lenf sistemi hastalıkları nötropeni (%54,0), trombositopeni (%39,9) veanemidir (%32,0). En sık bildirilen diğer advers reaksiyonlar periferik duyusal nöropati(%48,2), yorgunluk (%38,8), diyare (%38,1), kabızlık (%38,1) ve periferik ödemdir (%36,3).En sık bildirilen 3. veya 4. derece advers reaksiyonlar, nötropeni (%47,1), trombositopeni(%28,1) ve anemi (15,1) gibi kan ve lenf sistemi hastalıklarıdır. En sık bildirilen ciddi adversreaksiyon pnömonidir (%12,2). Bildirilen diğer ciddi advers reaksiyonlar arasında pireksi (%4,3), alt solunum yolu enfeksiyonu (%3,6), influenza (%3,6), pulmoner emboli (%3,2),atriyal fibrilasyon (%3,2) ve akut böbrek hasarı (%2,9) yer almaktadır. Pomalidomidin dekzametazon ile kombinasyonuKlinik çalışmalarda en yaygın olarak bildirilen advers reaksiyonlar, anemi (%45,7), nötropeni(%45,3) ve trombositopeniyi (%27) içeren kan ve lenf sistemi hastalıkları; yorgunluk (%28,3),pireksi (%21) ve periferik ödemi (%13) içeren genel bozukluklar ve uygulama bölgesi ile ilişkilidurumlar; pnömoniyi (%10,7) içeren enfeksiyonlar ve enfestasyonlar olmuştur. Periferiknöropati advers reaksiyonu hastaların %12,3'ünde ve venöz embolik veya trombotik (VTE)advers reaksiyonlar hastaların %3,3'ünde bildirilmiştir. En yaygın olarak bildirilen 3 veya 4.derece advers reaksiyonlar, nötropeni (%41,7), anemi (%27) ve trombositopeniyi (%20,7)içeren kan ve lenf sistemi hastalıkları; pnömoniyi (%9) içeren enfeksiyonlar ve enfestasyonlar;yorgunluk (%4,7), pireksi (%3) ve periferik ödemi (%1,3) içeren genel bozukluklar veuygulama bölgesi ile ilişkili durumlar olmuştur. Bildirilen en yaygın ciddi advers reaksiyonpnömonidir (%9,3). Bildirilen diğer ciddi advers reaksiyonlar febril nötropeni (%4,0),nötropeni (%2,0), trombositopeni (%1,7) ve VTE advers reaksiyonlarıdır (%1,7).Advers reaksiyonlar daha sık olarak pomalidomid ile tedavinin ilk 2 siklusu sırasında ortaya çıkma eğilimi göstermektedir. Advers reaksiyonların tablolaştırılmış listesiPomalidomidin bortezomib ve deksametazon kombinasyonu ve pomalidomidin deksametazon ile kombinasyonu ile tedavi edilen hastalarda gözlenen ve pazarlama sonrası gözlenen adversreaksiyonlar, sistem organ sınıfına (SOS) ve tüm advers reaksiyonların sıklığına ve 3. veya 4.derece advers reaksiyonlara göre aşağıda Tablo 7'de listelenmiştir. Her SOS ve sıklık gruplamasında, advers reaksiyonlar azalan ciddiyet sırasıyla sunulmaktadır. Sıklıklar şu şekilde tanımlanmaktadır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygınolmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000),bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Tablo 7. Klinik çalışmalarda ve pazarlama sonrası bildirilen advers reaksiyonlar (Advers Reaksiyonlar)
Seçili advers reaksiyonların tanımıBu bölümdeki sıklıklar, bortezomib ve deksametazon (Pom+Btz+Dex) veya deksametazon (Pom+Dex) ile kombinasyon halinde pomalidomid tedavisi alan hastalarda yapılan klinikçalışmalardan alınmıştır. TeratojenisitePomalidomid yapısal olarak talidomid ile benzerdir. Talidomid insanlarda teratojenik etkisi oluğu bilinen ve yaşamı tehdit edici ciddi doğumsal kusurlara neden olan etkin bir maddedir.Pomalidomidin, majör organogenez dönemi sırasında uygulandığında, sıçanlarda ve tavşanlardateratojenik etki gösterdiği bulunmuştur. Eğer gebelik sırasında alınırsa, pomalidomidininsanlarda teratojenik bir etki göstermesi beklenir (bkz. Bölüm 4.4). Nötropeni ve trombositopeniNötropeni hastaların %54,0'üne (Pom+Btz+Dex) kadarında (%47,1'i (Pom+Btz+Dex) 3. veya 4. derece) ortaya çıkmıştır. Nötropeni, seyrek olarak ciddidir ve hastaların %0,7'sindepomalidomid tedavisinin kesilmesine yol açmıştır. . Febril nötropeni (FN) hastaların %3,2 (Pom+Btz+Dex) ila %6,7'sinde (Pom+Dex) bildirilmiştir ve hastaların %1,8 (Pom+Btz+Dex) ila %4,0'ında (Pom+Dex) ciddidir (bkz. Bölüm 4.2 ve 4.4). Trombositopeni hastaların %39.9'u (Pom+Btz+Dex) ila %27.0'sinde (Pom+Dex) meydana gelmiştir. Trombositopeni hastaların %28,1 (Pom+Btz+Dex) ila %20,7'sinde (Pom+Dex) 3.derece veya 4. derecedir, hastaların %0,7'si % (Pom+Btz+Dex) ila %1.7'sinde (Pom+Dex)ciddidir ve hastaların %0,7'sinde (Pom+Dex) pomalidomid tedavisinin kesilmesine yol açmıştır(bkz. Bölüm 4.2 ve 4.4). Nötropeni ve trombositopeni, bortezomib ve deksametazon veya deksametazon ile kombinasyon halinde pomalidomid ile tedavinin ilk 2 döngüsünde daha sık ortaya çıkmaeğilimindedir. EnfeksiyonEnfeksiyon en sık görülen hematolojik olmayan toksisitedir. Hastaların %55,0 (Pom+Dex) ila %83,1'inde (Pom+Btz+Dex) (%34,9 (Pom+Btz+Dex) ila %24,0'u (Pom+Dex) 3 veya 4. derecedir) enfeksiyon meydana gelmiştir. Üst solunum yoluenfeksiyonu ve pnömoni en sık görülen enfeksiyonlardır. Ölümcül enfeksiyonlar (5. derece)hastaların %2,7'si (Pom+Dex) ila %4,0'ında (Pom+Btz+Dex) gerçekleşmiştir. Enfeksiyonlar,hastaların %3,6'sı (Pom+Btz+Dex) ila %2,0'sinde (Pom+Dex) pomalidomid tedavisininkesilmesine yol açmıştır. Tromboembolik olaylarKlinik çalışmalardaki tüm hastalar için asetilsalisilik asit (ve yüksek riskli bireylerde diğer antikoagülanlar) ile profilaksi, zorunlu tutulmuştur. Antikoagülan tedavi (kontrendikeolmadıkça) önerilmektedir (bkz. Bölüm 4.4). Hastaların %3,3'ü ila %12,2'sinde (Pom+Btz+Dex) (%1,3 (Pom+Dex) ila 5,8'i (Pom+Btz+Dex) 3. veya 4. derecedir) venöz tromboembolik olaylar (VTE) meydana gelmiştir.Hastaların % 1,7'si (Pom+Dex) ila %4,7'sinde (Pom+Btz+Dex) VTE ciddi olarak rapor edilmiş,ölümcül reaksiyon bildirilmemiş ve hastaların %2,2'sine (Pom+Btz+Dex) kadarında VTEpomalidomid kesilmesi ile ilişkiliydi. Periferik nöropati Pomalidomidin bortezomib ve deksametazon ile kombinasyon tedavisindeRandomizasyondan 14 gün öncesine kadar ağrı ve >2. derece periferik nöropatisi olan hastalarklinik çalışmalara dahil edilmemiştir. Periferik nöropati hastaların %55,4'ünde (%10,8'i 3.derece; %0,7'si 4. derece) meydana gelmiştir. Tedavi kollarmda maruz kalma ayarlanmışoranları karşılaştırılabilirdir. Periferik nöropati yaşayan hastaların yaklaşık %30'undabaşlangıçta nöropati öyküsü vardı. Periferik nöropati, Pom+Btz+Dex kolundaki hastalarınyaklaşık %14,4'ünda bortezomib, hastaların %1,8'inde pomalidomid ve %1,8'i ve Btz+Dexkolundaki hastaların %8,9'unda deksametazon tedavisinin kesilmesine yol açmıştır. Pomalidomidin deksametazon ile kombinasyon tedavisindeDevam etmekte olan >2. derece periferik nöropatisi olan hastalar, klinik çalışmalara dahil edilmemiştir. Periferik nöropati, hastaların %12,3'ünde ortaya çıkmıştır (%1 3. veya 4. derece).Hiçbir periferik nöropati reaksiyonu ciddi olarak bildirilmemiştir ve periferik nöropatihastaların %0,3'ünde tedavinin kesilmesine yol açmıştır (bkz. Bölüm 4.4). HemorajiPomalidomid ile hemorajik bozukluklar özellikle risk faktörü taşıyan ve kanamaya eğilimi artıran tıbbi ürünleri eş zamanlı kullanan hastalarda bildirilmiştir. Hemorajik olaylar burunkanaması, intrakranial kanama ve gastrointestinal kanamaları içerir. Alerjik reaksiyonlar ve ciddi deri reaksiyonlarıPomalidomid kullanımı ile anjioödem, anaflaktik reaksiyon ve Stevens-Johnson sendromu, toksik epidermal nekroliz ve DRESS'i içeren ciddi kutanöz reaksiyonlar bildirilmiştir.Lenalidomid veya talidomid tedavisi ile ilişkili şiddetli döküntü öyküsü olan hastalarpomalidomid kullanmamalıdır (bkz. bölüm 4.4). Pediyatrik popülasyon:Tekrarlayan veya ilerleyen beyin tümörleri olan pediyatrik hastalarda (4 ila 18 yaş arası) bildirilen advers reaksiyonlar, yetişkin hastalarda bilinen pomalidomid güvenlilik profiliyleuyumludur (bkz. Bölüm 5.1). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir ( Sağlıklı gönüllülerde tek doz olarak 50 mg'a kadar yüksek pomalidomid dozları incelenmiş ve aşırı doza bağlı ciddi advers reaksiyonlar bildirilmemiştir. Multipl miyelom hastalarında gündebir kez 10 mg'a kadar yüksek çoklu dozlar incelenmiş ve aşırı doza bağlı ciddi adversreaksiyonlar bildirilmemiştir. Doz sınırlayıcı toksisite miyelosupresyon olmuştur.Çalışmalarda, pomalidomidin hemodiyaliz ile uzaklaştırılabildiği bulunmuştur. Doz aşımı durumunda, destek tedavisi tavsiye edilmektedir. Farmakoterapötik grup: İmmünosupresanlar, diğer immünosupresanlar ATC kodu: Pomalidomid direkt antimiyelom tümorisidal ve immünomodülatör aktiviteye sahiptir ve multipl miyelom tümör hücrelerinin çoğalmasında rol oynayan stromal hücre desteğini inhibeeder. Pomalidomid spesifik olarak hematopoietik tümör hücrelerinin proliferasyonunu inhibeeder ve apopitozisi indükler. Ek olarak, pomalidomid lenalidomide dirençli multipl miyelomhücre dizilerinin proliferasyonunu inhibe eder ve lenalidomide duyarlı ve lenalidomide dirençlihücre dizilerinin her ikisinde de tümör hücrelerinin apopitozisi indüklemede deksametazon ilesinerjistik etki gösterir. Pomalidomid T hücreleri ve Doğal Öldürücü (Natural Killer, NK)hücrelerinin düzenlediği bağışıklığı güçlendirir ve monositler tarafından pro-enflamatuvarsitokinlerin (örn., TNF-a ve IL-6) üretilmesini inhibe eder. Pomalidomid, endotel hücreleriningöçü ve adhezyonunu engelleyerek, anjiyogenezi de inhibe eder. Pomalidomid, deoksiribonükleik asit (DNA) hasar bağlayıcı protein 1 (DDB1), cullin 4(CUL4) ve cullins-1 regülatörünü (Roc1) içeren bir E3 ligaz kompleksinin bir parçası olan proteinsereblonuna (CRBN) doğrudan bağlanır ve kompleks içinde CRBN'nin otomatikubikütinasyonunu inhibe edebilir. E3 ubikütin ligazları, çeşitli substrat proteinlerininpoliubikütinasyonundan sorumludur ve pomalidomid tedavisi ile gözlenen pleyiotropikhücresel etkileri kısmen açıklayabilir. Pomalidomid Pom+Btz+DD-deks kolundaki hastalara uygulanmıştır. Her 21 günlük siklusun 1 ila 14. günlerinde oral olarak 4 mg pomalidomid uygulanmıştır. Her iki çalışma kolundaki hastalara,1 ila 8 siklusları için 21 günlük bir siklusun 1, 4, 8 ve 11. günlerinde ve 9 ve sonrası sikluslariçin 21 günlük bir siklusun 1 ve 8. günlerinde bortezomib (1,3 mg/m2/doz) uygulanmıştır. Heriki çalışma kolundaki hastalara 1 ila 8 arasındaki sikluslar için 21 günlük bir siklusun 1, 2, 4, 5,8, 9, 11 ve 12. günlerinde ve 9. siklustan itibaren sonraki 21 günlük döngünün 1, 2, 8 ve 9günlerinde düşük doz deksametazon (20 mg/gün [< 75 yaşında] veya 10 mg/gün [> 75 yaşında])uygulanmıştır. Toksisiteyi yönetmek için gerektiğinde dozlar azaltılmış ve tedavi geçici olarakkesilmiş veya durdurulmuştur. (bkz. Bölüm 4.2). Tedavi amaçlı popülasyon (ITT) için birincil etkililik sonlanım noktası, IMWG kriterlerine dayalı olarak Bağımsız Değerlendirme Kararlaştırma Kurulunun (IRAC) değerlendirmesinegöre progresyonsuz sağkalım (Progression Free Survival - PFS)'dır. Ortalama 15,9 aylıktakipten sonra, Pom+Btz+DD-deks kolunda medyan PFS süresi 11,20 aydır (%95 GA: 9,66;13,73). Btz + DD-deks kolunda, medyan PFS süresi 7,1 aydır (%95 GA: 5,88; 8,48). 26 Ekim 2017 tarihli veri kesme tarihi kullanılarak genel etkililik veri özeti Tablo 10'da sunulmuştur. ITT popülasyonunda PFS için Kaplan-Meier eğrisi Şekil 1'de gösterilmektedir.
Btz = bortezomib; GA = Güven aralığı; CR = Tam yanıt; DoR = Yanıt süresi; HR = Tehlike oranı; DD-Deks = düşük doz deksametazon; OR = Olasılık oranı; ORR = Genel yanıt oranı;PFS = progresyonsuz sağkalım; POM = pomalidomid; PR = Kısmi yanıt; sCR = Kati tam yanıtVGPR = Çok iyi kısmi yanıt.a Medyan Kaplan-Meier tahminine dayanmaktadır.b Medyan için % 95 GA.c Cox orantısal tehlike modeline dayanmaktadır.d P-değeri sınıflandırılmamış log sıra testine dayanmaktadır.e Pom+Btz+DD-Deks : Btz+DD-Deks için olasılık oranı. f P-değeri, yaş ile sınırlandırılmış (<=75'e karşı >75), antimiyelom tedavi rejimlerinin önceki sayısına (1'e karşı >1), ve gözlemde beta-2 mikroglobulin (< 3,5 mg/L'ye karşı > 3,5 mg/L < 5,5 mg/L'ye karşı> 5,5 mg/L) ile CMH testine bağlıdır. Pom+Btz+DD-deks kolunda medyan tedavi süresi 8,8 ay (12 tedavi siklusu) ve Btz+DD-deks kolunda 4,9 aydır (7 tedavi siklusu). PFS avantajı, yalnızca bir önceki tedavi rejimini alan hastalarda daha belirgindir. Önceden bir antimiyelom tedavisi alan hastalarda ortalama PFS süresi Pom+Btz+DD-deks kolunda 20,73ay (% 95 GA: 15,11; 27,99) ve Btz+DD-deks kolunda 11,63 aydır (%95 GA: 7,52, 15,74).Pom+Btz+DD-deks tedavisi ile %46 risk azalması gözlendi (HR = 0,54; %95 GA: 0,36; 0,82).
Genel sağkalım (OS) için 13 Mayıs 2022 tarihli veri kesimi noktası kullanılarak (64,5 aylık medyan takip süresi) final analize göre, Kaplan-Meier tahminleri ile medyan OS zamanıPom+Btz+DDdeks kolu için 35,6 ay ve Btz +DDdeks kolu için 31,6 aydır (Genel olay oranı%70,0 ile birlikte HR = 0,94, %95 GA: -0,77; 1,15). Genel sağkalım (OS) analizi, alınanmüteakip tedavileri hesaba katmak için ayarlanmamıştır. Pomalidomidin deksametazon ile kombinasyon tedavisindePomalidomidin deksametazon ile kombinasyonunun etkililiği ve güvenliliği, lenalidomid vebortezomib dahil olmak üzere, daha önce en az iki tedavi almış ve son tedavi altındaykenhastalık progresyonu gösteren, nüks ve dirençli multipl miyelomu olan, yetişkin hastalardapomalidomid ve düşük doz deksametazon tedavisinin (Pom + DD-Deks ) tek başına yüksek dozdeksametazon (YD-Deks) ile karşılaştırıldığı çok merkezli, randomize, açık etiketli bir Faz IIIçalışmada (CC-4047-MM-003) değerlendirilmiştir. Çalışmaya toplam 455 hasta dahiledilmiştir: bunlardan 302 hasta Pom + DD-Deks koluna ve 153 hasta YD-Deks kolunaalınmıştır. Hastaların çoğunluğu erkek (%59) ve beyazdır (%79); genel popülasyon içinmedyan yaş 64'tür (min, maks: 35, 87 yaş).Pom + DD-Deks kolundaki hastalara 28 günlük her siklusun 1 ila 21. günlerinde oral yolla 4 mg pomalidomid verilmiştir. DD-Deks (40 mg) 28 günlük her bir siklusun 1, 8, 15 ve 22.günlerinde günde bir defa uygulanmıştır. YD-Deks kolu için, deksametazon (40 mg) 28 günlük(her bir) siklusun 1 ila 4, 9 ila 12 ve 17 ila 20. günleri arasında günde bir defa verilmiştir. 75yaş üstü hastalara, 20 mg deksametazon dozu ile tedaviye başlanmıştır. Tedavi, hastalardahastalık progresyonu gözlenene kadar devam ettirilmiştir. Birincil etkililik sonlanım noktası Uluslararası Miyelom Çalışma Grubu (International Myeloma Working Group -IMWG) kriterlerine göre progresyonsuz sağkalım (Progression FreeSurvival - PFS)'dır. Tedavi amaçlı popülasyon (ITT) için, IMWG kriterlerine dayalı olarak Bağımsız Değerlendirme Kararlaştırma Kurulunun (IRAC) değerlendirmesinde medyan PFS süresi Pom + DD-Deks kolunda 15,7 hafta (%95 GA: 13,0; 20,1); tahmin edilen 26 haftalıkolaysız sağkalım oranı %35,99 (± %3,46) olmuştur. YD-Deks kolunda medyan PFS süresi 8,0hafta (%95 GA: 7,0; 9,0); tahmin edilen 26 haftalık olaysız sağkalım oranı %12,15 (± %3,63)olmuştur. Progresyonsuz sağkalım çeşitli alt gruplarda incelenmiştir: cinsiyet, ırk, Doğu Kooperatif Onkoloji Grubu (ECOG) performans durumu, sınıflara ayırma faktörleri (yaş, hastalıkpopülasyonu, daha önceki antimiyelom tedavileri [2, >2], seçilmiş prognostik anlamlılıkparametreleri (başlangıç beta-2 mikroglobülin düzeyi, başlangıç albümin düzeyleri, başlangıçböbrek bozukluğu ve sitogenetik risk) ve daha önceki antimiyelom tedavilere maruziyet vedirenç. Değerlendirilen alt gruptan bağımsız olarak, PFS genel olarak her iki tedavi grubu içinITT popülasyonda gözlenen ile tutarlı bulunmuştur. ITT popülasyonu için PFS Tablo 11'de özetlenmiştir. ITT popülasyonunda PFS için Kaplan-Meier eğrisi Şekil 2'de gösterilmektedir. Tablo 9: IMWG Kriterlerine Dayalı olarak IRAC Değerlendirmesi ile Progresyonsuz Sağkalım (Sınıflandırılmış Log Sıra Testi) (ITT Popülasyonu)
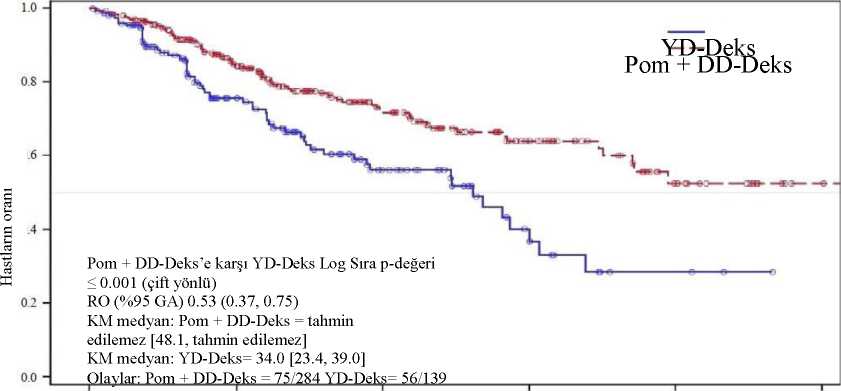
Not: GA=Güven aralığı; IRAC=Bağımsız Değerlendirme Kararlaştırma Kurulu a Medyan, Kaplan-Meier tahminine dayanmaktadır.b Medyan progresyonsuz sağkalım süresi için %95 güven aralığı. c Tedavi grupları ile ilişkili tehlike fonksiyonlarını karşılaştıran Cox orantısal risk modeline dayalı olarak, yaş (< 75 ila >75), hastalık popülasyonu (lenalidomid ve bortezomibin her ikisinede dirençli ya da her iki etken maddeye de dirençli olmayan), ve daha önceki antimiyelom tedavisayısına (= 2 ile >2) göre sınıflandırılmıştır. d P-değeri, yukarıdaki Cox modeli ile aynı sınıfta yer alan faktörler ile sınıflandırılmış log sıra testine dayanmaktadır. Veri kesim tarihi: 07 Eylül 2012 Veri kesim tarihi: 07 Eylül 2012 Genel sağkalım, çalışmanın temel ikincil sonlanım noktasıdır. Pom + DD-Deks kullanan hastaların toplam 226'sı (%74,8) ve YD-Deks kullanan hastaların 95'i (%62,1) veri kesimtarihinde (07 Eylül 2012) yaşamını sürdürmektedir. Pom+DD-Deks kolu için Kaplan-Meiertahminlerinden elde edilen medyan genel sağkalım süresine erişilememiştir, ancak en az 48 haftaolması beklenmektedir ki, bu da %95 güven aralığının alt sınırıdır. YD-Deks kolu için medyangenel sağkalım süresi 34 haftadır (%95 GA: 23,4; 39,9). 1 yıl içinde olaysız sağ kalım oranıPom + DD-Deks kolu için %52,6 (± %5,72) ve YD-Deks kolu için %28,4 (± %7,51)'dür.Genel sağkalımda görülen fark iki tedavi kolu arasında istatistiksel olarak anlamlıdır (p <0.001). ITT popülasyonu için genel sağkalım Tablo 12'de özetlenmiştir. ITT popülasyonunda genel sağkalım için Kaplan-Meier eğrisi Şekil 3'de gösterilmektedir. PFS ve genel sağkalım sonlanım noktalarının sonuçlarına dayalı olarak, bu çalışma için oluşturulmuş olan Veri Takip Kurulu çalışmanın tamamlanmasını ve YD-Deks kolundakihastaların Pom + DD-Deks koluna aktarılmasını önermiştir.
Medyan, Kaplan-Meier tahminine dayanmaktadır. Medyan genel sağkalım süresi için %95 güven aralığı cTedavi grupları ile ilişkili risk fonksiyonlarını karşılaştıran Cox orantısal risk modeline dayalı olarak, dP-değeri sınıflandırılmamış log sıra testine dayanmaktadır. Veri kesim tarihi: 07 Eylül 2012 Şekil 3: Genel Sağkalım için Kaplan-Meier Eğrisi (ITT Popülasyonu)
Genel Sağkalım (hafta) Veri kesim tarihi: 07 Eylül 2012 Pediyatrik popülasyonFaz 1 tek kollu, açık etiketli, doz artırma çalışmasında, pediyatrik hastalarda pomalidomidin maksimum tolere edilen dozu (MTD) ve / veya önerilen Faz 2 dozu (RP2D), 28 günlük birdöngünün 1. gününden 21. gününe kadar, oral yolla 2.6 mg / m2 / gün olarak belirlenmiştir. Tekrarlayan veya progresif yüksek dereceli glioma, medulloblastom, ependimoma veya merkezi sinir sisteminde (CNS) birincil yerleşimli diffüz intrinsik pontin glioması (DIPG) olan,pomalidomid ile tedavi edilen, 4 ila 18 yaşları arasındaki 52 pediyatrik hastada yürütülen Faz2 çok merkezli, açık etiketli, paralel grup çalışmasında etkililiği ispat edilememiştir. Faz 2 çalışmasında, yüksek dereceli glioma grubundaki (N = 19) iki hasta, protokol tarafından tanımlanan bir yanıta ulaşmış; bu hastalardan biri kısmi bir yanıt (PR) elde etmiş ve diğer hastauzun süreli stabil durumda (SD) kalmıştır, bu da objektif bir yanıt (OR) ve %10,5'lik uzun sürelistabil durum (SD) oranıyla (%95GA: 1,3, 33,1) sonuçlanmıştır. Ependimoma grubundaki (N =9) bir hasta uzun süreli bir stabil durum (SD) elde etmiş ve bu da OR ve %11,1'lik uzun sürelistabil durum (SD) oranı (%95 CI: 0,3, 48,2) ile sonuçlanmıştır. Diffüz intrinsik pontin glioma(DIPG) grubundaki (N = 9) veya medulloblastoma grubundaki (N = 9) değerlendirilebilirhastaların hiçbirinde doğrulanmış OR veya uzun süreli stabil durum (SD) gözlenmemiştir. BuFaz 2 çalışmasında değerlendirilen 4 paralel grubun hiçbiri, nesnel yanıt veya uzun süreli stabildurum oranının birincil son noktasını karşılamamıştır. Pediyatrik hastalarda pomalidomidin genel güvenlilik profili, yetişkinlerdeki bilinen güvenlilik profili ile tutarlıdır. Farmakokinetik (PK) parametreler, Faz 1 ve Faz 2 çalışmalarının EntegrePK Analizinde değerlendirilmiş ve yetişkin hastalarda gözlemlenenlerden anlamlı bir farkolmadığı bulunmuştur (Bkz. Bölüm 5.2). 5.2. Farmakokinetik özelliklerGenel ÖzelliklerEmilimPomalidomid, maksimum plazma konsantrasyonuna (Cmaks) doz uygulamasından sonraki 2 ila 3 saat içerisinde ulaşacak şekilde, tek oral doz olarak uygulamayı takiben en az%73 oranında emilir. Pomalidomidin sistemik maruziyeti (EAA) yaklaşık olarak doğrusal vedozla orantılı bir şekilde artar. Çoklu dozları takiben, EAA'da pomalidomid %27 ila %31 arasıbir birikim oranına sahiptir. Yüksek yağlı ve yüksek kalorili öğünle birlikte uygulanması ortalama plazma Cmaks'ını yaklaşık %27'ye kadar azaltarak emilim hızını yavaşlatır, ancak ortalama EAA'da %8'lik bir azalmaylagenel emilim miktarı üzerinde minimal bir etkiye sahiptir. Pomalidomid yemeklerle birlikte veyayemeklerden ayrı olarak alınabilir. DağılımPomalidomid kararlı durumda 62 ve 138 L arasında bir ortalama sanal dağılım hacmine (Vd/F) sahiptir. Pomalidomid, günde bir defa 2 mg dozunda 4 gün boyunca uygulandıktan sonra, dozsonrası 4. saatte (yaklaşık olarak Tmaks) sağlıklı bireylerin semenine, plazma düzeyinin %67'sikadar bir konsantrasyonda dağılır. İn vitropomalidomid enantiyomerlerinin insan plazmasındakiproteinlere bağlanma oranı %12 ila %44 arasında değişmektedir ve konsantrasyona bağımlıdeğildir.BiyotransformasyonPomalidomid, tek bir oral doz [14C]-pomalidomid (2 mg) uygulanmış sağlıklı bireylerde in vivoortamda dolaşımdaki majör bileşendir (yaklaşık olarak plazma radyoaktivitesinin %70'i). Anaveya plazma toplam radyoaktivitesine göre >%10 oranında herhangi bir metabolit bulunmamıştır.Atılan radyoaktivitenin baskın metabolik yolları, sonraki glukuronidasyon ile hidroksilasyon veya hidrolizdir. İn vitro,CYP1A2 ve CYP3A4 pomalidomidin CYP-aracılıhidroksilasyonunda yer alan birincil enzimler olarak belirlenirken, CYP2C19 ve CYP2D6'nın küçük ek katkılarının olduğu saptanmıştır. Pomalidomid aynı zamanda in vitrobir P-glikoprotein substratıdır. Pomalidomidin güçlü CYP3A4/5 ve P-gp inhibitörü ketokonazol ileveya güçlü CYP3A4/5 indükleyicisi karbamazepin ile eşzamanlı uygulanmasının, pomalidomidmaruziyeti üzerine klinik olarak anlamlı bir etkisi olmamıştır. Güçlü CYP1A2 inhibitörüfluvoksaminin ketokonazol varlığında pomalidomid ile birlikte uygulanması pomalidomid ileketokonazole kıyasla pomalidomide ortalama maruziyeti %90 güven aralığı ile [%91 ila %124]%107'ye kadar artırmıştır. Tek başına bir CYP1A2 inhibitörünün metabolizma değişikliklerineetkisini değerlendirmek üzere yapılan ikinci bir çalışmada, pomalidomid ile tek başınafluvoksaminin eşzamanlı olarak uygulanması pomalidomide ortalama maruziyeti, tek başınapomalidomide kıyasla %90 güven aralığı ile [%98 ila %157) %125 artırmıştır. Güçlü CYP1A2inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) pomalidomid ile eşzamanlı olarakuygulanırsa, pomalidomid dozu %50 azaltılmalıdır. CYP1A2 izoformunun tütün ileindüklendiği göz önünde bulundurularak, sigara içenlere pomalidomid uygulamasının,pomalidomidin sigara içmeyenlerdeki maruziyeti ile karşılaştırıldığında maruziyet ile ilgiliolarak klinik etkisi olmamıştır.İn vitroverilere dayalı olarak pomalidomid sitokrom P-450 izoenzimlerinin bir inhibitörü veya indükleyicisi değildir ve çalışılmış herhangi bir ilaç taşıyıcısını inhibe etmemiştir. Pomalidomidbu yolakların substratları ile eşzamanlı uygulandığında, klinik olarak anlamlı etkileşmeleribeklenmez.EliminasyonPomalidomid, sağlıklı gönüllülerde yaklaşık 9,5 saatlik ve multipl miyelomu olan hastalarda yaklaşık 7,5 saatlik medyan plazma yarılanma ömrü ile elimine edilir. Pomalidomid, yaklaşık7-10 L/s'lik ortalama toplam vücut klerensine (CL/F) sahiptir. Sağlıklı bireylere tek doz oral [14C]-pomalidomid (2 mg) uygulanmasını takiben radyoaktif dozun %73 ve %15'i sırasıyla idrar ve feçes ile atılırken, uygulanan radyoaktif karbon dozunun%2 ve %8'i idrar ve feçeste pomalidomid şeklinde atılmıştır. Pomalidomid atılmadan önce büyük ölçüde metabolize edilir, ortaya çıkan metabolitler başlıca idrarla atılır. İdrardaki baskın 3 metabolit (hidroliz veya hidroksilasyon ve ardındanglukuronidasyon ile oluşan), idrara geçen dozun sırasıyla yaklaşık %23, %17 ve %12'sinioluşturur. CYP-bağımlı metabolitler, toplam atılan radyoaktivitenin yaklaşık %43'ünü oluştururken, CYP-bağımlı-olmayan hidrolitik metabolitler %25'ini ve değişmeden atılan pomalidomid de%10'unu oluşturur (%2 idrarla ve %8 feçes ile). Popülasyon Farmakokinetikleriİki kompartmanlı bir modelin kullanıldığı popülasyon farmakokinetik analizine göre, sağlıklı gönüllüler ve MM hastaları benzer görünür klerense (CL/F) ve sanal santral dağılım hacmine(V 2Hastalardaki karakteristik özelliklerBöbrek yetmezliğiBu popülasyonda yapılan farmakokinetik analizler böbrek yetmezliği olan hastalarda (kreatinin klerensi veya hesaplanmış glomerüler filtrasyon hızı [eGFR] ile tanımlanan) pomalidomidfarmakokinetik parametrelerinin normal böbrek fonksiyonuna (CrCl >60 mL/dakika) sahiphastalarla önemli düzeyde farklılık göstermediği görülmüştür. Pomalidomide ortalamanormalize EAA maruziyeti, normal böbrek fonksiyonuna sahip hastalara kıyasla orta şiddetteböbrek yetmezliği olan hastalarda (eGFR >30 ila <45 mL/dakika/1,73 m2) %90 güven aralığıile [%77,4 ila %120,6] %98,2'dir. Pomalidomide ortalama normalize EAA maruziyeti normalböbrek fonksiyonuna sahip hastalara kıyasla diyaliz gerektirmeyen ciddi böbrek yetmezliğiolan hastalarda (CrCl <30 mL/dakika veya eGFR <30 mL/dakika/1,73 m2) %90 güven aralığıile [%79,7 ila %127,0] %100,2'dir. Pomalidomide ortalama normalize EAA maruziyeti normalböbrek fonksiyonuna sahip hastalara kıyasla diyaliz gerektiren ciddi böbrek yetmezliği olanhastalarda (CrCl <30 mL/dakika, diyaliz gerektiren) %90 güven aralığı ile [%7,5 ila %70,0]%35,8 artmıştır. Bu böbrek yetmezliği gruplarının her birinde pomalidomide maruziyetteortalama değişiklikler doz ayarlaması gerektirecek bir boyutta değildir. Karaciğer yetmezliğiFarmakokinetik parametreler sağlıklı gönüllülere kıyasla karaciğer yetmezliği olan hastalarda (Child-Pugh kriterleri ile tanımlanan) çok hafif düzeyde değişiklik göstermiştir. Pomalidomideortalama maruziyet sağlıklı gönüllülere kıyasla hafif düzeyde karaciğer yetmezliği olanhastalarda %90 güven aralığı ile [%9 ila %110] %51 artmıştır. Pomalidomide ortalamamaruziyet sağlıklı gönüllülere kıyasla orta düzeyde karaciğer yetmezliği olan hastalarda %90güven aralığı ile [%13 ila %119] %58 artmıştır. Pomalidomide maruziyet sağlıklı gönüllülerekıyasla ağır karaciğer yetmezliği olan hastalarda %90 güven aralığı ile [%24 ila %138] %72artmıştır. Bu yetmezlik gruplarının her birinde pomalidomide maruziyetteki ortalama artışlardoz şeması veya doz ayarlaması gerektirecek boyutta değildir (bkz. Bölüm 4.2). Pediyatrik popülasyonNükseden veya progresif primer beyin tümörü olan çocuklarda ve genç erişkinlerde tek bir oral pomalidomid dozunu takiben, ortalama Tmaks değeri dozdan 2 ila 4 saat sonrasıdır ve 74,8(%59,4), 79,2 (%51.7) ve 104 (%18,3) ng/mL geometrik ortalama Cmaks (%CV) değerlerisırasıyla 1,9, 2,6 ve 3,4 mg/m2 doz seviyelerine karşılık gelmektedir. EAA0-24 ve EAA0-inf,düşük 2 dozda yaklaşık 700 ila 800 saatng/mL aralığında ve yüksek dozda yaklaşık 1200saatng/mL aralığında toplam maruziyetle benzer eğilimleri izlemiştir. Tahmini yarı ömürleri,yaklaşık 5 ila 7 saat aralığındadır. MTD'de yaşa ve steroid kullanımına göre tabakalaşmaya atfedilebilecek net bir eğilim yoktur. Genel olarak veriler, EAA'nın pomalidomid dozundaki artışla neredeyse orantılı olarakarttığını, Cmaks'taki artışın ise genellikle orantılı olandan daha az olduğunu göstermektedir. 1.9 mg/m2/gün ila 3.4 mg/m2/gün oral uygulama doz seviyelerini takiben pomalidomidin farmakokinetiği, tekrarlayan veya progresif pediyatrik beyin tümörlerinde bir Faz 1 ve Faz 2çalışmasının entegre bir analizinde 4 ila 20 yaş arası 70 hastada belirlenmiştir. Pomalidomidkonsantrasyon-zaman profilleri, birinci dereceden absorpsiyonlu ve eliminasyonlu tek bölmelibir PK modeli ile uygun bir şekilde tanımlanmıştır. Pomalidomid, orta derecede değişkenlikledoğrusal ve zamanla değişmeyen bir farmakokinetik (PK) sergilemiştir. CL/F, Vc/F, Ka,pomalidomidin gecikme süresinin tipik değerleri sırasıyla 3.94 L/saat, 43.0 L, 1.45 saat-1 ve0.454 saattir. Pomalidomidin terminal eliminasyon yarı ömrü 7.33 saattir. Vücut yüzey alanı(BSA) dışında, yaş ve cinsiyet dahil olmak üzere test edilen ortak değişkenlerin hiçbiripomalidomid farmakokinetiği (PK) üzerinde etkiye sahip değildir. BSA, pomalidomid CL/F veVc/F'nin istatistiksel olarak anlamlı bir ortak değişkeni olarak tanımlanmış olmasına rağmen,BSA'nın maruziyet parametreleri üzerindeki etkisi klinik olarak anlamlı kabul edilmemiştir. Genel olarak, çocuklar ve yetişkin hastalar arasında pomalidomid farmakokinetiği (PK) açısından önemli bir fark yoktur. Geriyatrik hastalarda:Sağlıklı gönüllülerde ve multipl miyelomlu hastalarda yapılan farmakokinetik analizlerde, hasta yaşının (19-83 yaş) pomalidomidin oral klerensi üzerinde anlamlı bir etkisi olmadığıgözlenmiştir. Klinik çalışmalarda, pomalidomid kullanan yaşlı (>65 yaş) hastalarda dozayarlaması gerekmemiştir (bkz. Bölüm 4.2). 5.3. Klinik öncesi güvenlilik verileriTekrarlanan doz toksisite çalışmalarıSıçanlarda, pomalidomid 50, 250 ve 1.000 mg/kg/gün dozunda 6 ay süreyle kronik olarak uygulandığında iyi tolere edilmiştir. 1.000 mg/kg/güne kadar herhangi bir advers bulgu tespitedilmemiştir (4 mg klinik doza göre 175 kat maruziyet). Pomalidomid, maymunlarda, 9 ay kadar süreyle tekrarlanan doz çalışmalarında incelenmiştir. Bu çalışmalarda maymunlar, pomalidomidin etkilerine sıçanlardan daha yüksek duyarlılıkgöstermiştir. Maymunlarda gözlenen başlıca toksisiteler, hematopoietik/lenforetiküler sistemleilişkilendirilmiştir. Maymunlarda 0,05, 0,1 ve 1 mg/kg/gün dozları ile yapılan 9 aylık çalışmada,1 mg/kg/gün dozunda 6 hayvanda morbidite ve erken ötenazi bildirilmiştir ve bu pomalidomideyüksek maruziyetteki (4 mg klinik doza göre 15 kat maruziyet oranı) immünosupresif etkilere(stafilokok enfeksiyonu, azalmış periferik kan lenfositleri, kalın bağırsakta kronik enflamasyon,histolojik lenfoid azalması ve kemik iliğinde hiposellülerite) bağlanmıştır. 4 maymunun erkenötenazisine neden olan bu immünosüpresif etkiler kötü sağlık koşulları (sulu dışkı, iştahsızlık,besin alımının azalması ve kilo kaybı) yüzündendir; bu hayvanların histopatolojik incelemeleri,kalın bağırsaklarda kronik enflamasyon ve ince bağırsaklarda villöz atrofi olduğunu göstermiştir.Stafilokok enfeksiyonu 4 maymunda görülmüştür; bu hayvanlardan 3'ü antibiyotik tedavisineyanıt vermiştir ve 1 hayvan tedavi edilmeden ölmüştür. Ayrıca, akut miyelojenöz lösemi ileuyumlu bulgular bir maymunun ötenazisine yol açmıştır; bu hayvanda gözlenen klinik gözlemlerve klinik patoloji ve/veya kemik iliği değişiklikleri immünosupresyon ile tutarlı olmuştur. ALPve GGT düzeyindeki yükselmeler ile ilişkili minimum veya hafif safra kanalı proliferasyonu da1 mg/kg/gün dozunda gözlenmiştir. İyileşen hayvanlar değerlendirildiğinde, 1 mg/kg/güngrubundaki 1 hayvanda görülen intrahepatik safra kanallarının proliferasyonu haricindeki, tümtedaviyle ilişkili bulguların dozun kesilmesinden 8 hafta sonrasında geriye döndüğügörülmüştür. Advers Etkinin Gözlenmediği En Düşük Doz 0,1 mg/kg/gün olmuştur (4 mg klinikdoza göre 0,5 kat maruziyet oranı). Genotoksisite/karsinoj enisitePomalidomid, bakteri ve memeli mutasyon deneylerinde, mutajenik olarak bildirilmemiştir ve insan periferik kan lenfositlerinde kromozomal sapmaları veya 2000 mg/kg/güne kadar olandozların uygulandığı sıçanların kemik iliklerinde polikromatik eritrositlerde mikroçekirdekoluşmasını indüklememiştir. Karsinojenisite çalışmaları gerçekleştirilmemiştir. Fertilite ve erken embriyonik gelişimSıçanlardaki fertilite ve erken embriyonik gelişim çalışmasında, pomalidomid erkek ve dişi sıçanlara 25, 250 ve 1000 mg/kg/gün dozlarında uygulanmıştır. Gebeliğin 13. günündeki uterus muayenesinde ortalama canlı embriyo sayısında azalma ve tüm doz düzeylerindeimplantasyon sonrası canlı embriyo kayıplarında artma görülmüştür. Bu nedenle, bu gözlenenetkiler için Advers Etkinin Gözlenmediği En Düşük Doz <25 mg/kg/gündür (Bu test edilenen düşük dozda EAA 24s 39.960 ng.s/mL (nanogram*saat/mililitre) ve maruziyet oranı 4 mgklinik doza göre 99 kattır). Bu çalışmada tedavi edilen erkekler, tedavi edilmemiş dişilerleçiftleştirildiklerinde, tüm uterus parametreleri kontroller ile benzer olmuştur. Bu sonuçlaradayalı olarak, gözlenen etkiler dişilerin tedavi edilmelerine bağlanmıştır.Embriyo-fetal gelişimPomalidomidin, sıçanlar ve tavşanlara majör organogenez sırasında uygulandığında teratojenik olduğu bulunmuştur. Sıçan embriyofetal gelişim toksisite çalışmasında, idrar torbasının yokluğu,tiroit bezinin yokluğu ve lumbal ve torasik vertebral unsurların (merkezi ve/veya nöral kemerler)birleşmesi ve yanlış dizilmesi şeklindeki malformasyonlar tüm doz düzeylerinde (25, 250 ve1000 mg/kg/gün) gözlenmiştir. Bu çalışmada herhangi bir maternal toksisite gözlenmemiştir. Bu nedenle, maternal Advers Etkinin Gözlenmediği En Düşük Doz 1000 mg/kg/gün ve gelişimsel toksisite için AdversEtkinin Gözlenmediği En Düşük Doz <25 mg/kg/gündür (EAÂ 24246. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiMannitol (E421) Prejelatinize nişasta Sodyum stearil fumaratJelatin (sığırdan elde edilmiştir) Titanyum dioksit (E171) İndigo karmin (E132) Sarı demir oksit (E172)
Simetikon, Propilen glikol (E1520) ve
Beyaz mürekkep [Şellak, Titanyum dioksit (E171), Amonyum hidroksit (E527)] Siyah mürekkep [Şellak, Siyah demir oksit (E172), Propilen glikol (E1520) ve Amonyum hidroksit (E527)] 6.2. GeçimsizliklerYeterli veri yoktur. 6.3. Raf ömrü48 ay 6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriği21 kapsül içeren ambalajda kapsüller Polivinil klorür (PVC)/poliklorotrifloroetilen (PCTFE) blisterlerde, bastırarak açılan alüminyum folyo içerisinde paketlenmiştir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKapsüller açılmamalı veya ezilmemelidir. Pomalidomid tozu cilt ile temas ederse, cilt hemen ve iyice sabun ve su ile yıkanmalıdır. Pomalidomid mukoz membranlarla temas ederse bol suile yıkanmalıdır. Sağlık uzmanları ve bakıcılar, blister veya kapsülü tutarken tek kullanımlık eldivenler giymelidir. Eldivenler cildin maruz kalmasını önlemek için işi bittikten sonra dikkatliceçıkarılmalı, sızdırmaz plastik polietilen torbaya konulmalı ve bölgesel gerekliliklere uygunolarak atılmalıdır. Daha sonra eller su ve sabunla iyice yıkanmalıdır. Hamile olan veya hamileolabileceğinden şüphelenen kadınlar, blister veya kapsülü tutmamalıdır (bkz. Bölüm 4.4). Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİEr-Kim İlaç Sanayi ve Ticaret A.Ş. Beşiktaş-İstanbul Tel: 0212 275 39 68Faks: 0212 211 29 77e-mail: 2018/718 İlk ruhsat tarihi: 18/12/2018 Ruhsat yenileme tarihi: 07/08/2020 Otolog kök hücre nakline uygun hastalarda bortezomib, lenalidomid ve otolog nakil destekliyüksek doz kemoterapi dahil en az iki dizi tedavi sonrası nüks eden veya bu tedavileredirençli hastalık varlığında endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Tedavi, multipl miyelom tedavisinde deneyimli bir hekimin denetiminde başlatılmalı ve izlenmelidir. |
İlaç Bilgileriİmnovid 1 Mg Sert KapsülEtken Maddesi: Pomalidomid Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.