Yulareb 50 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA URUN BILGISIBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBİ ÜRÜNÜN ADIYULAREB® 50 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir film kaplı tablet 50 mg abemasiklib içerir. Yardımcı maddeler:Her bir film kaplı tablet 14 mg sığır kaynaklı laktoz monohidrat içerir. Yardımcı maddelerin tamamı için 6.1'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet (tablet).Bir tarafında Lilly, diğer tarafında 50 baskısı bulunan, 5.2 x 9.5 mm boyutunda bej, modifiye oval tablet. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarErken evre meme kanseri YULAREB, endokrin tedavi ile kombinasyon halinde, hormon reseptörü (HR) pozitif, insan epidermal büyüme faktörü reseptörü 2 (HER2) negatif, nüks riski yüksek erken evre memekanseri olan yetişkin hastaların adjuvan tedavisinde endikedir (bkz. Bölüm 5.1) YULAREB, ikiyıl boyunca veya hastalığın nüksüne dek veya kabul edilemez toksisite gelişene dek sürekliolarak alınmalıdır. Rekürrens riski yüksek olan hastalarda aşağıdaki klinik ve patolojik özelliklerin bulunması gerekmektedir: - 4 veya daha üzeri aksiller LN metastazı olan veya - 1 -3 LN pozitifliği olan hastalarda tümörü > 5 cm veya Ki-67 > %20 veya tümörün grade3 olması gerekmektedir. Premenopozal veya perimenopozal kadınlarda, aromataz inhibitörü endokrin tedavi, bir luteinize edici hormon salgılatan hormon (LHRH) agonisti ile kombine edilmelidir. İleri evre veya metastatik meme kanseri YULAREB, - Letrozol veya anastrozol ile kombinasyon halinde, en az % 10 östrojen reseptörü pozitif veinsan epidermal büyüme faktörü reseptörü 2 (HER2) negatif postmenopozal metastatik memekanseri olan, adjuvan tedavinin tamamlanmasından 12 ay sonra relaps yapmış ya da ileri evrememe kanseri için daha önce hiç bir endokrin tedavi almamış hastalarda endikedir. - Fulvestrant ile kombinasyon halinde, en az % 10 östrojen reseptörü pozitif ve insan epidermalbüyüme faktörü reseptörü 2 (HER) negatif postmenopozal metastatik meme kanseri olan,fulvestrant ile tedavi edilmemiş hastalarda endikedir, 1- Metastatik hastalığın tedavisi için en az 6 ay boyunca ve en az bir basamak aromatazinhibitörü aldıktan sonra klinik ve/veya radyolojik hastalık progresyonu varlığında fulvestrantile kombinasyon halinde, 2- En az 12 ay boyunca adjuvan aromataz inhibitörü tedavisi aldıktan sonra veya adjuvanaromataz inhibitörü tedavisini tamamladıktan sonraki 12 ay içinde relaps gösteren hastalardafulvestrant ile kombinasyon halinde kullanılır. a) Adjuvan aromataz inhibitörü tedavisinin ilk 12 ayı içinde relaps yapan hastalardakullanılmaz. b) Metastatik hastalık için bir sıradan daha fazla aromataz inhibitörü almış hastalardakullanılmaz. 4.2 Pozoloji ve uygulama şekliYULAREB tedavisi anti-kanser tedavilerinin kullanımı konusunda deneyimli hekimler tarafından başlatılmalı ve bu hekimlerin gözetimi altında uygulanmalıdır. Pozoloji/uygulama sıklığı ve süresi:Endokrin tedavimle kombinasyon halinde YULAREBEndokrin tedaviyle kombinasyon halinde uygulandığında, önerilen abemasiklib dozu günde iki kez 150 mg'dır. Birlikte kullanılacağı diğer ürünün önerilen pozolojisi için ilgili ürünün KısaÜrün Bilgisine bakınız. Tedavi süresiErken evre meme kanseriYULAREB, iki yıl boyunca veya hastalığın nüksüne dek veya kabul edilemez toksisite gelişene dek sürekli olarak alınmalıdır. heri evre veya metastatik meme kanseriYULAREB, hasta tedaviden klinik yarar sağladığı sürece veya kabul edilemez toksisite gelişene dek sürekli olarak kullanılmalıdır. Eğer hasta kusarsa veya bir YULAREB dozunu atlarsa, bir sonraki dozu planlanan zamanda alması gerektiği konusunda bilgilendirilmelidir; ek doz alınmamalıdır. Doz ayarlamalarıBazı advers reaksiyonların yönetilmesi için Tablo 1-7'de gösterilen şekilde doza ara verme ve/veya doz azaltımı gerekebilir. Tablo 1. Advers reaksiyonlar için doz ayarlama önerileri
Tablo 2. Hematolojik toksisiteler için yönetim önerileriYULAREB tedavisi başlatılmadan önce, tedavinin ilk iki ayı boyunca iki haftada bir, sonraki iki ay boyunca ayda bir ve klinik olarak endike olduğu şekilde tam kan sayımı kontroledilmelidir. Tedavi başlatılmadan önce mutlak nötrofil sayısı (ANC) >1500/mm3, plateletdüzeyi >100.000/mm3 ve hemoglobin düzeyi >8 g/dL olması önerilmektedir.
Tablo 3. Diyare için yönetim önerileri
Tablo 4. Aminotransferazlarm yükselmesi için yönetim önerileriYULAREB tedavisi başlatılmadan önce, tedavinin ilk iki ayı boyunca iki haftada bir, sonraki iki ay boyunca ayda bir ve klinik olarak uygulandığı şekilde alanin aminotransferaz (ALT) veaspartat aminotransferaz (AST) kontrol edilmelidir.
Tablo 5. İnterstisyel Akciğer Hastalığı/Pnömonit için yönetim önerileri
Tablo 7. Hematolojik olmayan toksisiteler (diyare, artmış aminotransferazlar ve
* Diyare, hematolojik toksisite, hepatotoksisite ve interstisyel akciğer hastalığı/pnömonit hariç CYP3A4 i-nhibit^^leriGüçlü CYP3A4 inhibitörlerinin eş zamanlı kullanımından kaçınılmalıdır. Eğer güçlü CYP3A4 inhibitörü kullanımından kaçınılamazsa, abemasiklib dozu günde iki kez 100 mg'adüşürülmelidir. Abemasiklib dozu günde iki kez 100 mg abemasiklibe düşürülmüş ve güçlü bir CYP3A4 inhibitörünün eş zamanlı kullanımından kaçınılamayan hastalarda, abemasiklib dozu günde ikikez 50 mg'a düşürülmelidir. Dozu günde iki kez 50 mg abemasiklibe düşürülmüş ve güçlü bir CYP3A4 inhibitörünün eş zamanlı kullanımından kaçınılamayan hastalarda, toksisite belirtileri yakından izlenerekabemasiklib dozu sürdürülebilmektedir. Alternatif olarak, abemasiklib dozu günde bir kez 50mg'a düşürülebilir veya kesilebilir. CYP3A4 inhibitörü kesilirse, abemasiklib dozu, CYP3A4 inhibitörünün başlatılmasından önce kullanılan doza yükseltilmelidir (CYP3A4 inhibitörünün 3 ila 5 yarı ömründen sonra). Uygulama şekli:YULAREB oral kullanım içindir. Doz aç veya tok karnına alınabilir. Abemasiklib greyfurt veya greyfurt suyu ile birlikte alınmamalıdır (bkz. Bölüm 4.5). Hastalar dozları her gün yaklaşık olarak aynı saatlerde almalıdır. Tablet bütün olarak yutulmalıdır (tabletler yutulmadan önce çiğnenmemeli, ezilmemeli veya bölünmemelidir). Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Hafif veya orta derece böbrek yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli böbrek yetmezliği, son dönem böbrek hastalığı olan veya diyaliz uygulanan hastalardaabemasiklib uygulaması ile ilgili veri yoktur (bkz. Bölüm 5.2). Şiddetli böbrek yetmezliği olanhastalarda, abemasiklib toksisite belirtileri yakından izlenerek dikkatli bir şekildeuygulanmalıdır. Karaciğer yetmezliği:Hafif (Child Pugh A) veya orta derece (Child Pugh B) karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer yetmezliği (Child Pugh C) olan hastalardadozlama sıklığının günde bir defaya düşürülmesi önerilmektedir (bkz. Bölüm 5.2). Pediyatrik popülasyon:18 yaş altı çocuklarda abemasiklibin güvenliliği ve etkililiği belirlenmemiştir. Bu konuda veri yoktur. Geriyatrik popülasyon:Yaşa göre doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). 4.3 KontrendikasyonlarEtkin maddeye veya bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşırı duyarlılık. 4.4 Özel kullanım uyarıları ve önlemleriNötropeniAbemasiklib kullanan hastalarda nötropeni bildirilmiştir. GRADE 3 veya 4 nötropeni gelişen hastalarda doz modifikasyonu önerilmektedir (bkz. Bölüm 4.2). Nötropenik sepsis ölümcülolayları, metastatik meme kanseri hastalarının <% 1'inde meydana gelmiştir. Hastalar herhangibir ateş epizodunu sağlık uzmanlarına bildirmeleri konusunda bilgilendirilmelidir. Enfeksiyonlar / enfestasyonlarAbemasiklib artı endokrin tedavi alan hastalarda, endokrin tedavi alan hastalardan daha yüksek oranda enfeksiyon bildirilmiştir. Eş zamanlı nötropenisi olmayan abemasiklib alan hastalardaakciğer enfeksiyonu bildirilmiştir. Ölümcül olaylar, metastatik meme kanseri hastalarının <%1'inde meydana gelmiştir. Hastalar enfeksiyonun belirtileri ve semptomları açısından izlenmelive tıbbi açıdan uygun olan şekilde tedavi edilmelidir. Venöz TromboembolizmVenöz tromboembolik olaylar abemasiklib artı endokrin tedavi ile tedavi edilen hastalarda bildirilmiştir. Hastalar derin ven trombozu ve pulmoner embolizm belirti ve semptomlarıaçısından izlenmeli ve tıbbi açıdan uygun olan şekilde tedavi edilmelidir. VTE GRADE'inebağlı olarak, abemasiklib doz ayarlaması gerekebilir (bkz. Bölüm 4.2). Artmış AminotransferazlarAbemasiklib kullanan hastalarda ALT ve AST yükselmesi bildirilmiştir. ALT ve AST artış düzeyine bağlı olarak, abemasiklib dozunun değiştirilmesi gerekebilir (bkz. Bölüm 4.2). DiyareDiyare en yaygın advers reaksiyondur. Klinik çalışmalarda, ilk diyare olayının başlangıcına kadar geçen medyan süre yaklaşık 6-8 gün, medyan diyare süresi 7-12 gün (GRADE 2) ve 5-8gün (GRADE 3) olarak belirlenmiştir. Diyare dehidrasyon ile ilişkili olabilir. Hastalar ilk suludışkı bulgusu tespit ettiğinde loperamid gibi bir antidiyareik tedavisine başlamalı, oral sıvıalımını artırmalı ve doktorunu bilgilendirmelidir. > GRADE 2 diyare gelişen hastalarda dozmodifikasyonu önerilmektedir (bkz. Bölüm 4.2). CYP3A4 indükleyicileri ile eşzamanlı kullanımAbemasiklib etkililiğinde azalma riski nedeniyle CYP3A4 indükleyicilerinin eş zamanlı kullanımından kaçınılmalıdır (bkz. Bölüm 4.5). Viseral krizViseral kriz gelişen hastalarda abemasiklibin etkililiği ve güvenliliği hakkında veri yoktur. İnterstisyel akciğer hastalığı/pnömonitYULAREB ve diğer CDK4/6 inhibitörleri ile tedavi edilen hastalarda ciddi, hayatı tehdit edici veya ölümcül interstisyel akciğer hastalığı ve/veya pnömonit oluşabilir. Klinik çalışmalarda(MONARCH 1, MONARCH 2 ve MONARCH 3), YULAREB ile tedavi edilen hastaların%3,3'ü herhangi bir GRADE, %0,6'sı GRADE 3 veya 4, ve %0,4'ü ölümcül sonuçlara sahipinterstisyel akciğer hastalığı/pnömonit yaşamıştır. Pazarlama sonrası ortamda, bildirilen ölümlerle birlikte ilave interstisyel akciğer hastalığı/pnömonit vakaları gözlemlenmiştir (bkz. Bölüm 4.8). Hastaları interstisyel akciğer hastalığı/pnömoniti işaret eden pulmoner semptomlar açısından izleyiniz. Semptomlar hipoksi, öksürük, nefes darlığı veya radyolojik incelemelerdekiinterstisyel infiltratları içerebilir. Enfeksiyöz, neoplastik ve bu gibi semptomların diğernedenleri uygun araştırmalarla dışlanmalıdır. İnterstisyel akciğer hastalığı/pnömonit derecesine bağlı olarak abemasiklib doz modifikasyonu gerekebilir. Kalıcı veya tekrarlayan GRADE 2 interstisyel akciğer hastalığı/pnömonit gelişen hastalarda doz kesilmesi veya doz azaltılması önerilmektedir. GRADE 3 veya 4 interstisyel akciğerhastalığı veya pnömoniti olan tüm hastalarda YULAREB'i kalıcı olarak sonlandırınız (bkz.Bölüm 4.2). LaktozNadir kalıtımsal galaktoz intoleransı, total laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. SodyumBu tıbbi ürün her tablette 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında sodyum içermez. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer tıbbi ürünlerin abemasiklib farmakokinetikleri üzerindeki etkileriAbemasiklib primer olarak CYP3A4 tarafından metabolize edilir.CYP3A4 i-nhibit^^leriAbemasiklibin bazı CYP3A4 inhibitörleriyle birlikte uygulanması abemasiklib plazma konsantrasyonlarını artırabilir. İleri evre ve/veya metastatik kanser hastalarında bir CYP3A4inhibitörü olan klaritromisin ile birlikte uygulama, abemasiklibin plazma maruziyetinde 3,4 katartış, abemasiklib ve aktif metabolitlerinin kombine bağlı olmayan potansiyel plazmamaruziyetinde ise 2,5 kat artışa yol açmıştır. Abemasiklib ile birlikte güçlü CYP3A4 inhibitörlerinin kullanılmasından kaçınılmalıdır. Eğer güçlü CYP3A4 inhibitörlerinin birlikte uygulanması gerekiyorsa, abemasiklib dozuazaltılmalıdır (bkz bölüm 4.2), ardından toksisitenin dikkatlice izlenmesi gerekir. GüçlüCYP3A4 inhibitörlerinin örnekleri bunlarla birlikte ama bunlarla sınırlı olmayan: klaritromisin,itrakonazol, ketokonazol, lopinavir/ritonavir, posakonazol veya vorikonazolu içermektedir.Greyfurt veya greyfurt suyundan kaçınılmalıdır. Orta veya zayıf CYP3A4 inhibitörleri ile tedavi edilen hastalar için doz ayarlaması gerekmez. Bununla birlikte, toksisite belirtileri için yakın izleme yapılmalıdır. CYP3A4 indükleyicileriAbemasiklibin güçlü CYP3A4 indükleyicisi rifampisin ile birlikte uygulanması, abemasiklibin plazma konsantrasyonunu %95 ve bağlı olmayan potansiyel abemasiklibin konsantrasyonunuve aktif metabolitlerini EAA0-ro değerine göre %77 oranında azaltmıştır. Güçlü CYP3A4indükleyicilerinin birlikte kullanımından (karbamazepin, fenitoin, rifampisin ve St. John's wortdahil, ancak bunlarla sınırlı olmamak üzere), abemasiklibin etkililiğinin azaltılması riskinedeniyle kaçınılmalıdır. Abemasiklibin diğer tıbbi ürünlerin farmakokinetikleri üzerindeki etkileriTaşıyıcı substratı olan tıbbi ürünlerAbemasiklib ve majör aktif metabolitleri renal taşıyıcılar olan organik katyon taşıyıcı 2 (OCT2), çoklu ilaç ve toksin ekstrüzyon proteini (MATE1) ve MATE2-K'yi inhibe eder. Butaşıyıcıların dofetilid veya kreatinin gibi klinik olarak anlamlı substratları ile abemasiklibarasında in vivoetkileşimler gerçekleşebilir (bkz. Bölüm 4.8). Abemasiklib 400 mg vemetforminin (OCT2, MATE1 ve 2 substratı) birlikte uygulandığı bir klinik ilaç etkileşimiçalışmasında, metformin plazma maruziyetinde küçük ancak klinik açıdan anlamlı olmayan birartış (%37) gözlemlenmiştir. Bu artışın, glomerüler filtrasyondan etkilenmediği renal sekresyonazalmasına bağlı olduğu tespit edilmiştir.Sağlıklı bireylerde abemasiklib ile bir P-glikoprotein (P-gp) substratı olan loperamidin birlikte uygulanması, loperamid plazma maruziyetinde EAA0-® değerine göre %9, Cmaks değerine göre%35 artışa yol açmıştır. Bu artış klinik açıdan anlamlı bulunmamıştır. Bununla birlikte,abemasiklib ile gözlemlenen in vitroi^ vivoetkileşim gerçekleşebilir.Meme kanseri hastalarının yer aldığı bir klinik çalışmada, abemasiklib ile anastrozol, fulvestrant, eksemestan, letrozol veya tamoksifen arasında klinik açıdan anlamlıfarmakokinetik ilaç etkileşimi gözlenmemiştir. Abemasiklibin sistemik etki gösteren hormonal kontraseptiflerin etkinliğini azaltıp azaltmadığı henüz bilinmemektedir. Özel popülasyonlara ilişkin ek bilgiler:Geriyatrik popülasyon:Yaşa bağlı olarak doz ayarlamasına gerek yoktur (bkz. Bölüm 5.2). Böbrek yetmezliği:Hafif ila orta dereceli böbrek yetmezliği bulunan hastalarda doz ayarlaması yapılması gerekmemektedir. Şiddetli böbrek yetmezliği, son dönem böbrek hastalığı veya diyalizhastalarında YULAREB uygulamasına ilişkin veri bulunmamaktadır (bkz. bölüm 5.2).YULAREB, şiddetli böbrek yetmezliği bulunan hastalarda toksisite belirtileri açısındanyakından izlenmeli ve dikkatli uygulanmalıdır. Karaciğer yetmezliği:Hafif (Child Pugh A) ila orta derecede (Child Pugh B) karaciğer yetmezliği bulunan hastalarda doz ayarlaması yapılması gerekmemektedir. Şiddetli (Child Pugh C) karaciğer yetmezliğibulunan hastalarda doz sıklığının günde bir defaya düşürülmesi önerilmektedir (bkz. bölüm5.2). Pediyatrik popülasyon:4.6 YULAREB'in 18 yaşından küçük çocuklarda ve adolesanlarda güvenliği ve etkililiğihenüz belirlenmemiştir. Veri mevcut değildir.Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadınlar tedavi sırasında ve tedavi tamamlandıktan sonra en az 3 hafta boyunca yüksek oranda etkili kontrasepsiyon yöntemleri (ör. çift bariyerkontrasepsiyon) kullanmalıdır (bkz. Bölüm 4.5). Gebelik dönemiGebe kadınlarda abemasiklib kullanımıyla ilgili veri yoktur. Hayvanlarda yapılan çalışmalarda üreme toksisitesi gösterilmiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel riskbilinmemektedir. YULAREB, gebelik sırasında ve kontrasepsiyon kullanmayan çocukdoğurma potansiyeli olan kadınlarda önerilmemektedir. Laktasyon dönemiAbemasiklibin anne sütüne geçip geçmediği bilinmemektedir. Yenidoğana/bebeğe yönelik risk dışlanamaz. Abemasiklib kullanan hastalar emzirmemelidir. Üreme yeteneği /FertiliteAbemasiklibin insanlarda fertilite üzerindeki etkisi bilinmemektedir. Sıçanlarda erkek fertilitesi üzerine hiçbir etki kaydedilmezken; farelerde, sıçanlarda ve köpeklerde erkek üremesistemindeki sitotoksik etkiler abemasiklibin erkeklerde fertilite bozukluğuna nedenolabileceğine işaret etmektedir. Farelerde, sıçanlarda veya köpeklerde dişi üreme organlarıüzerine herhangi bir advers etki gözlenmemiştir, veya sıçanlarda dişi fertilitesi ve erkenembriyonik gelişim üzerine hiçbir etki gözlenmemiştir (bkz. Bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkilerYULAREB'in araç ve makine kullanımı üzerindeki etkisi çok azdır. YULAREB ile tedavi sırasında hastalara yorgunluk veya baş dönmesi yaşamaları durumunda araba sürerken veyakullanırken dikkatli olmaları önerilmelidir (bkz. Bölüm 4.8). 4.8 İstenmeyen etkilerGüvenlilik profili özetiEn sık gelişen advers reaksiyonlar diyare, enfeksiyonlar, nötropeni, lökopeni, anemi, yorgunluk, bulantı, kusma, alopesi ve iştah kaybıdır. En yaygın advers reaksiyonlardan, nötropeni, lökopeni ve diyare haricindeki GRADE > 3 olaylar %5'ten azdır. Advers reaksiyonların tablo halinde listesiAşağıdaki tabloda, advers reaksiyonlar MedDRA vücut sistem organ sınıfı ve sıklık derecesine göre listelenmiştir. Sıklık dereceleri: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygınolmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000),bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her sıklık grubunda, adversreaksiyonlar azalan sıklıkta sunulmaktadır. Tablo 8. Endokrin tedavisia ile kombinasyon halinde abemasiklibin faz 3 çalışmalarında bildirilen advers reaksiyonlar (N = 3559) ile kombinasyon halinde abemasiklibin faz 3 çalışmalarında bildirilen advers reaksiyonlar (N = 3559)
a Anastrozol, letrozol, eksemestan, tamoksifen veya fulvestrant ile kombinasyon halinde abemasiklib. b Enfeksiyonlar, Sistem Organ Sınıfı Enfeksiyonlar ve Enfestasyonlar kapsamında olan tüm rapor edilmiş Tercih Edilen Terim'leri içermektedir.c Venöz tromboembolik olaylar arasında derin ven trombozu (DVT), pulmoner embolizm,serebral venöz sinüs trombozu, subklavyen, aksiller ven trombozu, inferior vena kava DVTve pelvik venöz tromboz yer alır. d Erken evre meme kanseri için interstisyel akciğer hastalığı/pnömonit, Standart MedDRA Terimleri interstisyel akciğer hastalığının kapsamında olan tüm bildirilen Tercih EdilenTerim'leri içermektedir. Metastatik meme kanseri için Tercih Edilen Terimler arasındainterstisyel akciğer hastalığı, pnömonit, organize pnömonit, pulmoner fibroz ve bronşiyolitisobliterans yer alır. h Metastatik meme kanserinde (MONARCH 2 ve MONARCH 3) yaygın, erken evre meme kanserinde (monarchE) çok yaygındır. Seçili advers reaksiyonların tanımıNötropeniÇalışmalarda nötropeni sıklıkla bildirilmiştir. MonarchE çalışmasında, hastaların % 45,8'inde nötropeni bildirilmiştir. Endokrin tedavi ile kombinasyon halinde abemasiklib alan hastaların% 19,1'inde nötrofil sayılarında GRADE 3 veya 4 azalma (laboratuvar bulgularına göre),başlamasına kadar geçen medyan süre 30 gün ve iyileşmeye kadar geçen medyan süre 16 günolarak bildirilmiştir. Hastaların % 0,3'ünde febril nötropeni bildirilmiştir MONARCH 2 veMONARCH 3 çalışmalarında hastaların % 45,1'inde nötropeni bildirilmiştir. Aromatazinhibitörleri veya fulvestrant ile kombinasyon halinde abemasiklib alan hastaların % 28,2'sindenötrofil sayısında GRADE 3 veya 4 azalma (laboratuvar bulgularına göre) bildirilmektedir.GRADE 3 veya 4 nötropeni başlangıcına kadar geçen medyan süre 29-33 gün, iyileşmeye kadargeçen medyan süre 11-15 gün olarak belirlenmiştir. Hastaların % 0,9'unda febril nötropenibildirilmiştir. GRADE 3 veya 4 nötropeni gelişen hastalarda doz modifikasyonu önerilmektedir (bkz. Bölüm 4.2). DiyareDiyare en sık bildirilen advers reaksiyondur (bkz. Tablo 8). Abemasiklib tedavisinin ilk ayı içinde en yüksek düzeyde kaydedilen insidans daha sonra düşmüştür. MonarchE çalışmasında,herhangi bir GRADE'de ilk diyare olayının başlangıcına kadar geçen medyan süre 8 günolmuştur. Medyan diyare süresi GRADE 2 için 7 gün ve GRADE 3 için 5 gün olmuştur.MONARCH 2 and MONARCH 3 çalışmalarında, herhangi bir GRADE'de ilk diyare olayınınbaşlangıcına kadar geçen medyan süre yaklaşık 6-8 gün olmuştur. Medyan diyare süresiGRADE 2 için 9-12 gün ve GRADE 3 için 6-8 gün olmuştur. Diyare, loperamid gibidestekleyici tedaviler ve/veya doz ayarlaması sonucunda başlangıca veya daha düşükGRADE'e gerilemiştir (bkz. Bölüm 4.2). Artmış AminotransferazlarMonarchE çalışmasında, endokrin tedavi ile kombinasyon halinde abemasiklib alan hastalarda ALT ve AST yükselmeleri sık bildirilmiştir (sırasıyla % 12,3 ve % 11,8). GRADE 3 veya 4,ALT veya AST yükselmeleri (laboratuvar bulgularına göre) hastaların % 2,6 ve % 1,6'sındabildirilmiştir. GRADE 3 veya 4 ALT yükselmesinin başlamasına kadar geçen medyan süre 118gün ve iyileşmeye kadar geçen medyan süre 14,5 gün olmuştur. GRADE 3 veya 4 ASTyükselmesinin başlamasına kadar geçen medyan süre 90,5 gün ve iyileşmeye kadar geçenmedyan süre 11 gün olmuştur. MONARCH 2 ve MONARCH 3 çalışmalarında, aromatazinhibitörleri veya fulvestrant ile kombinasyon halinde abemasiklib alan hastalarda ALT ve ASTartışı sık bildirilmiştir (sırasıyla %15,1 ve %14,2). GRADE 3 veya 4 ALT veya AST artışları(laboratuvar bulgularına göre) hastaların %6,1 ve %4,2'sinde bildirilmiştir. GRADE 3 veya 4 ALT artışı başlangıcına kadar geçen medyan süre 57-61 gün, iyileşmeye kadar geçen medyan süre 14 gün olmuştur. Grade 3 veya 4 AST artışı başlangıcına kadar geçen medyan süre 71 ila185 gündür ve normale dönmesi için geçen medyan süre 13 ila 15 gündür. GRADE 3 veya 4ALT veya AST artışı gelişen hastalarda doz modifikasyonu önerilmektedir (bkz. Bölüm 4.2). KreatininAdvers reaksiyon olarak kabul edilmese de, abemasiklibin serum kreatinin artışına yol açtığı gösterilmiştir. MonarchE çalışmasında, hastaların % 99,3'ünde serum kreatinin artışı(laboratuvar bulgularına göre) kaydedilmiştir ve bunların % 0,5'inde GRADE 3 veya 4 artışlarolmuştur. Yalnızca endokrin tedavi alan hastaların % 91,0'ında serum kreatininde artışbildirmiştir (tüm laboratuvar GRADE'leri). MONARCH 2 ve MONARCH 3 çalışmalarında,hastaların % 98,3'ünde serum kreatinin artışı kaydedilmiştir (laboratuvar bulgularına göre) vebu hastaların % 1,9'unda GRADE 3 veya 4 artış kaydedilmiştir. Tek başına aromataz inhibitörüveya fulvestrant alan hastaların % 78,4'ünde serum kreatinin artışı bildirilmiştir (tümlaboratuvar derecelerinde). Abemasiklibin, renal tübüler sekresyon taşıyıcılarının inhibisyonuaracılığıyla glomerüler fonksiyonu etkilemeden (ioheksol klerensine göre ölçülen) serumkreatinin düzeyini artırdığı gösterilmiştir (bkz. Bölüm 4.5). Klinik çalışmalarda, serumkreatinin artışları abemasiklib dozlamasının ilk ayında ortaya çıkmış, tedavi dönemi boyuncayüksek ancak stabil kalmış, tedavi bırakıldıktan sonra geri dönüşümlü seyir izlemiş ve buna kanüre azotu (BUN), sistatin C veya sistatin C baz alınarak hesaplanan glomerüler filtrasyon hızıgibi böbrek fonksiyonu belirteçlerinde değişiklikler eşlik etmemiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlanma yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9 Doz aşımı ve tedavisiAbemasiklib doz aşımı durumunda, yorgunluk ve diyare gelişebilir. Genel destekleyici tedavi uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ajanlar, Protein kinaz inhibitörleri, Siklin bağımlı kinaz inhibitörleri ATC kodu: L01EF03 Etki mekanizmasıAbemasiklib, siklin bağımlı kinaz 4 ve 6'nın (CDK4 ve CDK6) potent ve seçici bir inhibitörü olup, enzimatik testlerde en çok Siklin D1/CDK4'e karşı aktif olduğu bulunmuştur.Abemasiklib retinoblastom proteininin (Rb) fosforilasyonunu önleyerek hücre döngüsününGl'den hücre bölünmesi S fazına ilerlemesini bloke eder ve böylece tümör büyümesininbaskılanmasını sağlar. Östrojen reseptörü pozitif meme kanseri hücre soylarında abemasiklibile sağlanan uzun süreli hedef inhibisyonu Rb fosforilasyonunun geri dönüşünü önleyerek hücreyaşlanmasına ve apoptoza yol açmıştır. İn vitro, Rb-negatif ve Rb-depleted kanser hücreserileri, genellikle abemasiklibe karşı daha az hassastır. Meme kanseri ksenogreft modellerinde,klinik açıdan anlamlı konsantrasyonlarda tek başına veya anti-östrojenlerle kombinasyonhalinde kesintisiz olarak her gün dozlama yapılarak uygulanan abemasiklib tümör boyutundaküçülme sağlamıştır. Farmakodinamik etkilerG1 restriksiyon noktasından önce hücre döngüsü inhibisyonuyla sonuçlanan Rb fosforilasyonu ve topoizomeraz II alfa inhibisyonundan anlaşıldığı üzere, abemasiklib kanser hastalarındaCDK4 ve CDK6'yı inhibe eder. Kardiyak elektrofizyolojiAbemasiklibin QTcF aralığı üzerindeki etkisi 144 ileri evre kanser hastasında değerlendirilmiştir. Terapötik dozlama programının ardından gözlemlenen ortalama maksimumkararlı durum abemasiklib konsantrasyonunda QTcF aralığında büyük bir değişiklik (>20 ms)saptanmamıştır. Sağlıklı bireylerde günde iki kez 200 mg dozuna benzer maruziyet düzeylerinde yapılan maruziyet-yanıt analizinde, abemasiklibin QTcF aralığını klinik açıdan anlamlı derecedeuzatmadığı belirlenmiştir. Klinik etkililik ve güvenlilikErken evre meme kanseriRandomize Faz 3 Çalışma monarchE: Endokrin tedavi ile kombinasyon halinde abemasiklibAdjuvan endokrin tedavi ile kombinasyon halinde abemasiklib'in etkililiği ve güvenliği, HR pozitif, HER2 negatif, nod pozitif, nüks riski yüksek erken evre meme kanseri olan kadın veerkeklerde, randomize, açık etiketli, iki kohortlu bir faz 3 çalışma olan monarchE çalışmasındadeğerlendirilmiştir. Yüksek nüks riski, şu klinik ve patolojik özelliklerle tanımlanmıştır: >4pALN (pozitif aksiller lenf düğümleri) veya 1-3 pALN ve takip eden kriterlerden en az biri:tümör boyutu >5 cm veya histolojik grade 3 veya yüksek Ki-67 indeksi (>%20). Toplam 5637 hasta, 2 yıl günde iki kez abemasiklib 150 mg artı doktor seçimi standart endokrin tedavi veya tek başına standart endokrin tedavi alacak şekilde 1:1 oranında randomizeedilmiştir. Randomizasyon, önceki kemoterapi, menopoz durumu ve bölgeye göregerçekleştirilmiştir. Erkekler postmenopozal olarak sınıflandırılmıştır. Hastalar definitiflokorejyonal tedaviyi (neoadjuvan veya adjuvan kemoterapi olsun veya olmasın)tamamlamıştır. Hastalar, önceki herhangi bir kemoterapi veya radyoterapinin akut yanetkilerinden kurtulmuş olmalıdır. Randomizasyondan önce, kemoterapiden sonra 21 gün veradyoterapiden sonra 14 günlük bir arınma periyodu gerekli olmuştur. Randomizasyondan öncehastaların 12 haftaya kadar adjuvan endokrin tedavisi almalarına izin verilmiştir. Standartendokrin tedavisi olarak fulvestrant ile adjuvan tedaviye izin verilmemiştir. Doğu KooperatifiOnkoloji Grubu (Eastern Cooperative Oncology Group - ECOG) Performans Durumu 0 veya 1olan hastalar dahil edilmiştir. VTE öyküsü olan hastalar çalışmaya dahil edilmemiştir. Çalışmatedavi periyodunun bitiminden sonra, her iki tedavi kolunda hastalar, kümülatif en az 5 yıl vetıbbi olarak uygunsa 10 yıla kadar adjuvan endokrin tedavisi almaya devam etmiştir. LHRH agonistleri, erkekler ve premenopozal ve perimenopozal kadınlar için klinik olarak endike olduğunda verilmiştir. Randomize popülasyon, sadece yüksek risk klinik ve patolojik özelliklerine göre çalışmaya alınan 5120 (%91) hastayı ve 1-3 pALN ve yüksek Ki-67 indeksine dayalı olarak çalışmayaalınan 517 (%9) hastayı içermektedir. Hasta demografikleri ve başlangıçtaki tümör özellikleri tedavi kolları arasında dengelidir. Çalışmaya alınan hastaların medyan yaşı yaklaşık 51'dir (aralık, 22-89 yıl); hastaların %15'i 65yaş veya üzeri, %99'u kadın, %71'i beyaz ırk, %24'ü asyalı ve %5'i diğerdir. Hastaların %44'üpremenopozal veya perimenopozaldır. Hastaların çoğu öncesinde kemoterapi (%37neoadjuvan, %62 adjuvan) ve radyoterapi (%95) almıştır. Hastaların aldığı başlangıç endokrintedavi letrozol (%38), tamoksifen (%31), anastrozol (%22) veya eksemestanı (%8)içermektedir. Hastaların %60'ında 4 veya daha fazla pozitif lenf nodu, %38'inde GRADE 3tümör, %22'sinde ameliyatta patolojik tümör boyutu >5 cm ve %44'ü tedavisi amaçlananpopülasyonda (ITT) yüksek Ki-67 indeksine sahiptir. Birincil sonlanım noktası randomizasyondan itibaren; ipsilateral invaziv meme tümörü nüksü, bölgesel invaziv meme kanseri nüksü, uzak nüks, kontralateral invaziv meme kanseri, primerimeme olmayan ikinci bir invazif kanserin ilk oluşumuna kadar geçen süre veya herhangi birnedene bağlanabilecek ölüm olarak tanımlanan İnvazif Hastalıksız Sağkalım (Invasive Disease-Free Survival - IDFS)'dır. Anahtar ikincil sonlanım noktası, randomizasyondan ilk uzak nüksoluşumuna veya herhangi bir nedene atfedilebilen ölüme kadar geçen süre olarak tanımlananUzak Nükssüz Sağkalım (Distant Relapse Free Survival - DRFS)'dır. Çalışmanın birincil amacına, önceden planlanmış interim analizde (veri kesim tarihi 16 Mart 2020), medyan 15,5 aylık takip süresiyle ulaşılmıştır. Abemasiklib artı endokrin tedavi alan hastalarda tek başına endokrin tedavi alanlara kıyasla IDFS'de istatistiksel olarak anlamlı bir iyileşme gözlenmiştir (HR = 0,747, %95 CI [0,598,0,932], p = 0,0096).Daha ileri bir analizde (01 Nisan 2021 veri kesim tarihli), hastaların %90'ı2 yıllık çalışma tedavi süresinden uzaktır ve medyan takip süresi 27,1 aydır. Etkililik sonuçları Tablo 9 ve Şekil 1'de özetlenmiştir. Tablo 9. monarchE: Etkililik verilerinin özeti (Tedavisi amaçlanan popülasyon)
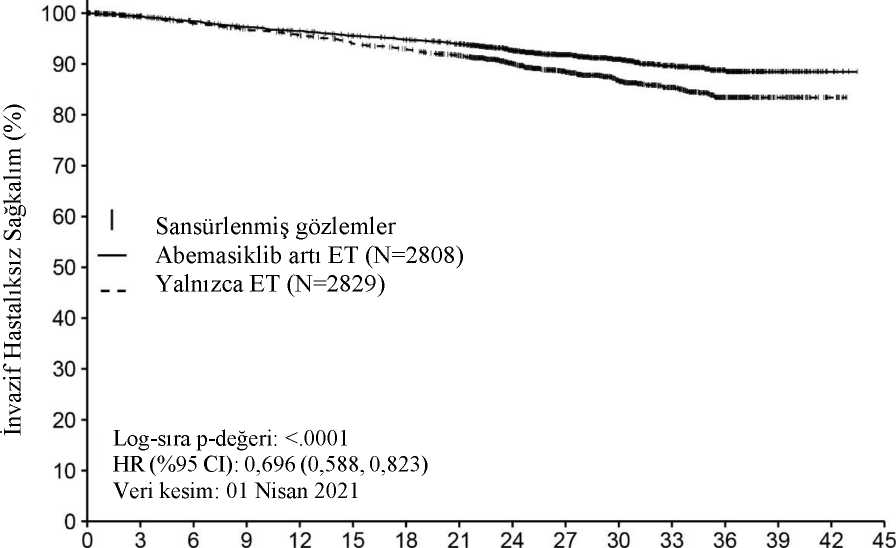
Şekil 1. monarchE: IDFS'ye ilişkin Kaplan-Meier grafiği (Araştırmacı değerlendirmesi, tedavisi amaçlanan popülasyon)
8280826802621257925472508247724301970128791952227567Yalnızca ET 28292700265226082572251324722400193012619065282816410Kısaltmalar: CI = güven aralığı; ET = endokrin tedavi; HR = tehlike oranı; IDFS = invazif hastalıksız sağkalım; N = popülasyondaki hasta sayısı Veri kesim tarihi 01 Nisan 2021 Coğrafi bölge, menopoz durumu ve önceki kemoterapi ile tanımlanan hasta alt gruplarında fayda gözlemlenmiştir.İleri evre veya metastatik meme kanseriRandomize Faz 3 Çalışma MONARCH 3: Aromataz inhibitörleriyle kombinasyon halinde abemasiklibBir aromataz inhibitörü (anastrozol veya letrozol) ile kombinasyon halinde abemasiklib'in etkililiği ve güvenliliği, bu hastalık koşullarında önceden sistemik tedavi uygulanmamış HRpozitif, HER2 negatif, lokal olarak ilerlemiş veya metastatik meme kanseri olan kadınların yeraldığı randomize, çift kör, plasebo kontrollü bir faz 3 çalışma olan MONARCH 3 çalışmasındadeğerlendirilmiştir. Hastalar, günde iki kez 150 mg abemasiklib artı aynı programa göre plaseboartı nonsteroid aromataz inhibitörüne karşı önerilen dozda günlük olarak uygulanan nonsteroidaromataz inhibitörü almak üzere 2:1 oranında randomize edilmiştir. Primer sonlanım noktasıRECIST 1.1 uyarınca araştırmacı tarafından değerlendirilen progresyonsuz sağkalım (PFS),temel sekonder etkililik sonlanım noktaları ise objektif yanıt oranı (ORR), klinik yarar oranı(KYO) ve genel sağkalım (GS) olarak belirlenmiştir. Çalışmaya alınan hastaların medyan yaşı 63 (aralık: 32-88) olarak kaydedilmiştir. Neo (adjuvan) koşullarda hastaların yaklaşık %39'u kemoterapi ve %44'ü antihormonal tedavialmıştır. Önceden (neo) adjuvan endokrin tedavi alan hastalar, bu tedaviyi çalışmarandomizasyonundan en az 12 ay önce tamamlamış olmalıdır. Hastaların büyük bölümünde(%96) başlangıçta metastatik hastalık tespit edilmiştir. Hastaların yaklaşık %22'sinde yalnızcakemikte hastalık gözlenirken, %53'ünde viseral metastazlar belirlenmiştir. Çalışma, PFS'nin iyileştirilmesi olarak belirlenen primer sonlanım noktasını karşılamıştır. Primer etkililik bulguları Tablo 10 ve Şekil 2'de özetlenmektedir. Tablo 10. MONARCH 3: Etkililik verilerinin özeti (Araştırmacı değerlendirmesi, tedavisi
56
66 Progresyonsuz sağkalım (PFS) abemasiklib artı aromataz inhibitörü (Aİ) kolunda anlamlı ölçüde uzamıştır (HR 0,540 [%95 CI, 0,418, 0,698]); medyan PFS abemasiklib artı Aİ kolunda28,18 ay, plasebo artı Aİ kolunda 14,76 ay olarak belirlenmiştir. Bu bulgular, abemasiklib artıaromataz inhibitörü ile tedavi edilen hastalarda hastalık progresyonu veya ölüm riskinde %46oranında klinik açıdan anlamlı bir azalmaya karşılık gelmektedir. Son PFS analizi sırasında genel sağkalım verileri olgunlaşmamıştır (iki kolda 93 olay gözlemlenmiştir). HR 1,057 (%95 CI: 0,683, 1,633), p=0,8017 olarak bildirilmiştir. Önceden belirlenmiş bir dizi alt grup PFS analizi göstermiştir ki, yaş (<65 veya >65 yıl), hastalık bölgesi, hastalık durumu (de novo metastatik veya rekürren metastatik ya da lokalolarak ilerlemiş rekürren), ölçülebilir hastalığın varlığı, progesteron reseptörü durumu dahilolmak üzere hasta alt grupları arasında ve temel ECOG performans durumu parametrelerindesonuçlar tutarlıdır. Hastalık progresyonu veya ölüm riskinde azalma viseral hastalık bulunanhastalar (HR 0,567 [%95 CI: 0,407, 0,789], medyan PFS 21,6 ay ve 14,0 ay), yalnızca kemiktehastalık bulunan hastalar (HR 0,565, [%95 CI: 0,306, 1,044]) ve ölçülebilir hastalık bulunanhastalarda (HR 0,517, [%95 CI 0,392, 0,681]) gözlenmiştir. İkinci OS interim analizinde, her iki kolda 255 olay gözlemlenmiştir. Medyan OS, abemasiklib artı Aİ kolunda 67,1 ay ve plasebo artı Aİ kolunda 54,5 aydır. 0,754 (%95 CI: 0,584, 0,974)olarak gözlemlenen HR, istatistiksel anlamlılığa ulaşmadığından (Şekil 3), çalışma genelsağkalımı tam olarak karakterize etmeye devam etmektedir. Şekil 3. MONARCH 3: Genel sağkalıma ilişkin Kaplan-Meier grafiği (Tedavisi amaçlanan popülasyon)
328 310 300 281 268 258 248 236 226 211 202 196 187 177 170 157 150 120 52 20Plasebo artı aromataz inhibitörü165 158 151 148 142 133 126 122 114 104 97 918476696259451810Randomize Faz 3 Çalışma MONARCH 2: Fulvestrant ile kombinasyon halinde abemasiklibFulvestrant ile kombinasyon halinde abemasiklib'in etkililiği ve güvenliliği HR pozitif, HER2 negatif, lokal olarak ilerlemiş veya metastatik meme kanseri olan kadınların yer aldığırandomize, çift kör, plasebo kontrollü bir faz 3 çalışma olan MONARCH 2 çalışmasındadeğerlendirilmiştir. Hastalar, günde iki kez 150 mg abemasiklib artı ilk dozdan iki hafta sonrauygulanan ek 500 mg dozla birlikte bir aylık aralıklarla 500 mg fulvestrant ve plasebo artı aynıprograma göre tek başına fulvestrant almak üzere 2:1 oranında randomize edilmiştir. Primersonlanım noktası RECIST 1.1 uyarınca araştırmacı tarafından değerlendirilen PFS, temelsekonder etkililik sonlanım noktaları ise objektif yanıt oranı (ORR), klinik yarar oranı (KYO)ve genel sağkalım (GS) olarak belirlenmiştir. Çalışmaya alınan hastaların medyan yaşı 60 (aralık: 32-91) olarak kaydedilmiştir. Her tedavi kolunda hastaların büyük bölümü beyaz ırktandır ve daha önce metastatik hastalık için kemoterapi almamıştır. GnRH agonisti ile overi baskılanan hastaların %17'si pre/perimenopozal dönemdedir. Hastaların yaklaşık %56'ında viseral Hastaların yaklaşık %25'i primer endokrin direncine sahiptir (adjuvan endokrin tedavinin ilk 2 yılında endokrinterapisinde ilerleme veya metastatik meme kanseri için ilk sıradaki endokrin tedavinin ilk 6ayında) ve çoğunluğunda endokrin direnci daha sonra gelişmiştir. Hastaların %59'u (neo)adjuvan basamakta ve %38'i metastatik basamakta en son endokrin tedaviyi almıştır. Çalışma, PFS'de primer sonlanım noktasını karşılamıştır. Primer etkililik bulguları Tablo 11 ve Şekil 4'te özetlenmektedir.
2231651231038061321340Medyan PFS abemasiklib artı fulvestrant kolunda anlamlı ölçüde uzamış (HR 0,553 [%95 CI 0,449, 0,681]) ve abemasiklib artı fulvestrant kolunda medyan PFS 16,4 ay, plasebo artıfulvestrant 9,3 ay olarak belirlenmiştir. Bu bulgular, abemasiklib artı fulvestrant ile tedaviedilen hastalarda hastalık progresyonu veya ölüm riskinde klinik açıdan anlamlı olan %44,7azalmaya ve medyan PFS'de 7,2 aylık artışa karşılık gelmektedir. Abemasiklib artı fulvestrantsağlıkla ilgili yaşam kalitesinde klinik açıdan anlamlı veya önemli bir zarara yol açmadanprogresyonsuz sağkalımı uzatmıştır. Önceden belirlenmiş bir dizi alt grup PFS analiziyapılmıştır, yaş (<65 veya >65 yıl), ırk, coğrafi bölge, hastalık bölgesi, endokrin tedavi direnci, ölçülebilir hastalık varlığı, progesteronreseptörü durumu ve menopozal durum dahil olmak üzere hasta alt grupları arasında tutarlısonuçlar göstermiştir. Hastalık progresyonu veya ölüm riskinde azalma viseral hastalık bulunanhastalar (HR 0,481 [%95 CI: 0,369, 0,627], medyan PFS 6,5 aya karşılık 14,7 ay ), yalnızcakemikte hastalık bulunan hastalar (HR 0,543, [%95 CI: 0,355, 0,833]) ve ölçülebilir hastalıkbulunan hastalarda (HR 0,523, [%95 CI: 0,412, 0,644]) gözlemlenmiştir. Tehlike oranı,pre/perimenopozal dönemdeki hastalarda 0,415 (%95 CI: 0,246, 0,698), progesteron reseptörü PFS, lokal olarak ilerlemiş veya metastatik hastalığı olan ve önceden endokrin tedavi almayan alt popülasyonda da tutarlıdır. Önceden belirlenmiş ara genel sağkalım analizinde (20 Haziran 2019 kapanış) ITT popülasyonu plasebo artı fulvestrant alanlara kıyasla abemasiklib artı fulvestrant alan hastalarda istatistikselolarak anlamlı bir iyileşme göstermiştir. Genel sağkalım sonuçları Tablo 12'de özetlenmiştir. Tablo 12. MONARCH 2: Genel sağkalım verilerinin özeti (Tedavisi amaçlanan popülasyon)
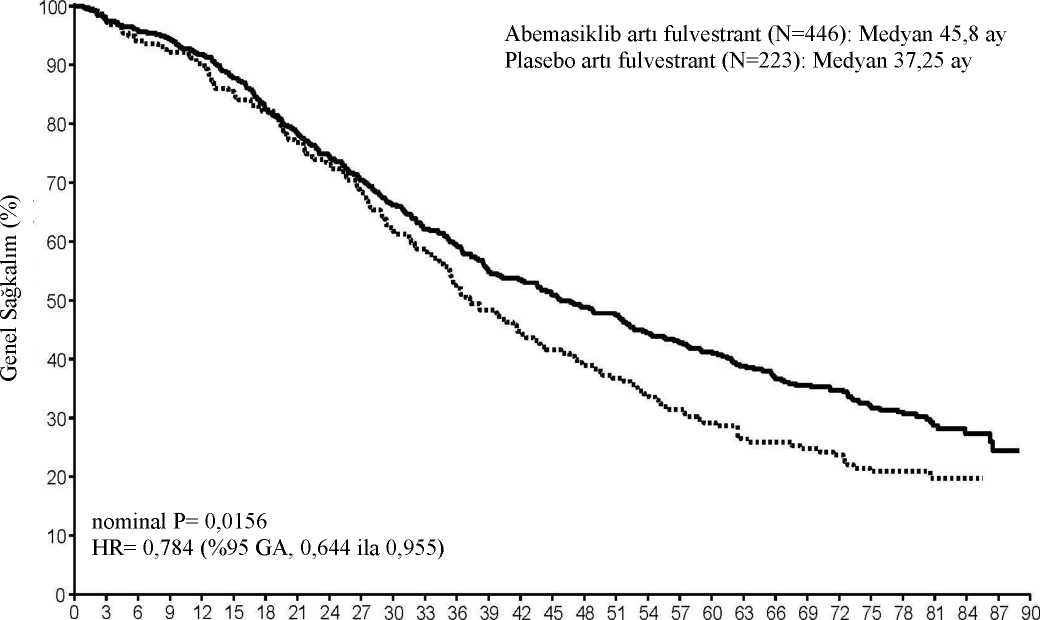
Sınıflandırma faktörlerine göre OS analizleri, viseral hastalığı olan hastalarda OS HR'nin 0,675 (%95 CI: 0,511, 0,891) ve primer endokrin direnci olan hastalarda 0,686 (%95 CI: 0,451, 1,043)olduğunu göstermiştir. Önceden belirlenmiş final OS analizinde (18 Mart 2022 kapanış), 2 kolda 440 olay gözlemlenmiştir. Daha önce ara OS analizinde (20 Haziran 2019 kapanış) gözlemlenen OS'dekiiyileşme, plasebo artı fulvestrant koluna kıyasla abemasiklib artı fulvestrant kolunda 0,784'lükbir HR (%95 CI 0,644, 0,955) ile korunmuştur. Medyan OS, abemasiklib artı fulvestrantkolunda 45,8 aydır ve plasebo artı fulvestrant kolunda 37,25 aydır. Genel hayatta kalmasonuçları Şekil 5'te sunulmuştur.
5.2 Farmakokinetik özelliklerGenel özelliklerEmilim:Abemasiklib, Tmaks değeri 8 saat ve ortalama mutlak biyoyararlanımı yaklaşık %45 olan yavaş emilimli bir ilaçtır. 50-200 mg terapötik doz aralığında, plazma maruziyeti (EAA) ve Cmaksdeğerindeki artış dozla yaklaşık olarak orantılıdır. Tekrarlanan günde iki kez dozlamadan sonrakararlı duruma 5 gün içinde ulaşılırken, abemasiklibin Cmaks ve EAA'ya göre sırasıyla 3,7 (%58CV) ve 5,8 (%65 CV) geometrik ortalama birikim oranıyla biriktiği belirlenmiştir. Yüksek yağiçerikli öğün abemasiklib ve aktif metabolitlerinin kombine EAA değerini %9, Cmaks değerini%26 artırmıştır. Bu değişiklikler klinik açıdan anlamlı bulunmamıştır. Dolayısıyla, abemasiklibaç veya tok karnına alınabilir. Dağılım:Abemasiklib insanlarda plazma proteinlerine yüksek oranda bağlanır (ortalama bağlı fraksiyon Abemasiklib ve aktif metabolitlerinin beyin-omurilik sıvısındaki konsantrasyonları bağlanmamış plazma konsantrasyonlarına benzerdir. Biyotransformasyon:Abemasiklibin temel klerens yolu hepatik metabolizmadır. Abemasiklib, ağırlıklı olarak sitokrom P450 (CYP) 3A4 tarafından çeşitli metabolitlere metabolize edilir. Primerbiyotransformasyon, ana ilacın % 77'si olan bir EAA ile sirküle olan bir metabolitehidroksilasyondur. Ek olarak, N-desetil ve N-desetilhidroksi metabolitleri, ana ilacın % 39 ve% 15'i olan EAA'larda sirküle olmaktadır. Bu sirküle olan metabolitler, abemasiklibe benzerbir potansiyele sahiptir. Eliminasyon:Abemasiklibin geometrik ortalama hepatik klerensi (CL) 21,8 L/sa. (%39,8 CV) olarak hesaplanırken, hastalardaki ortalama plazma eliminasyon yarılanma ömrü 24,8 saat (%52,1CV) olarak belirlenmiştir. [14C]-abemasiklibin tek oral dozundan sonra dozun yaklaşık %81'ifeçes ve %3,4'ü idrar ile atılır. Feçeste elimine edilen dozun büyük kısmı metabolitlerdir. Doğrusallık/doğrusal olmayan durum:Veri bulunmamaktadır. Hastalardaki karekteristik özelliklerÖzel popülasyonlar:Yaş, cinsiyet ve vücut ağırlığı:Kanser hastalarına ilişkin popülasyon farmakokinetiği analizinde (135 erkek, 859 kadın; yaş aralığı 24-91 yaş, vücut ağırlığı aralığı 36-175 kg) yaş, cinsiyet ve vücut ağırlığının abemasiklibmaruziyeti üzerinde etki göstermediği saptanmıştır. Karaciğer yetmezliği:Abemasiklib karaciğerde metabolize edilir. Hafif (Child Pugh A) ve orta derece (Child Pugh B) karaciğer yetmezliğinin abemasiklib maruziyeti üzerinde etkisi olmadığı belirlenmiştir.Şiddetli karaciğer yetmezliği (Child Pugh C) bulunan hastalarda bağlanmamış abemasiklib artıaktif metabolitleri sırasıyla 2,1 kat ve 2,4 kat artmıştır. Abemasiklibin yarı ömrü 24 saatten 55saate yükselmiştir (Bkz. Bölüm 4.2). Böbrek yetmezliği:Abemasiklib ve metabolitlerinin renal klerensi minör düzeydedir. Hafif ve orta derece böbrek yetmezliğinin abemasiklib maruziyeti üzerinde etkisi olmadığı belirlenmiştir. Şiddetli böbrekyetmezliği, son dönem böbrek hastalığı olan veya diyaliz uygulanan hastalarla ilgili veri yoktur. 5.3 Klinik öncesi güvenlilik verileriİnsanlarla potansiyel olarak ilgili olan primer hedef organ bulguları, 13 haftaya kadar sürdürülen çalışmalarda fare, sıçan ve köpeklerde görülen gastrointestinal kanal, hematolenfopoetik organlar ve erkek üreme sisteminde görülmüştür. Gözlerdeki ve kalp kapakçıklarındaki etkiler, klinik olarak ilişkili maruziyet seviyelerinde yalnızca kemirgenlerdemeydana gelmiştir. Akciğer ve iskelet kası üzerindeki etkiler, yalnızca kemirgenlerde insanmaruziyet seviyelerinden en az 2 kat daha yüksek maruziyet seviyelerinde ve böbreklerdekietkiler, yalnızca kemirgenlerde insan maruziyet seviyelerinden en az 6 kat daha yüksekmaruziyet seviyelerinde meydana gelmiştir. 28 günlük iyileşme süresinin sonunda, erkek üremesistemindeki etkiler istisnası dışında tüm hedef organ bulgularında tam veya kısmi iyileşmegözlenmiştir. GenotoksisiteAbemasiklib bakteriyel ters mutasyon (Ames) testinde mutajenik, insan periferik kan lenfositlerindeki in vitro kromozomal aberasyon testinde klastojenik ve in vivo sıçan kemikiliği mikronükleus testinde klastojenik bulunmamıştır. KarsinojenisiteAbemasiklib, sıçanlarda ve farelerde yapılan 2 yıllık çalışmalarda kanserojenisite açısından değerlendirilmiştir. Erkek sıçanlarda abemasiklibin günlük oral uygulaması, insan klinikmaruziyetinin yaklaşık 1,5 katı maruziyetlerde benign testiküler interstisyel hücre adenomlarıile sonuçlanmıştır. İlave olarak, insan klinik maruziyetinin yaklaşık 0,1 katı maruziyetlerdeinterstisyel hücre hiperplazisi gözlemlenmiştir. Bu etkilerin insanlardaki yansımasıbilinmemektedir. Farelerde veya dişi sıçanlarda abemasiklib uygulamasına bağlı neoplastikbulguya rastlanmamıştır. Fertilite bozukluğuAbemasiklib, üreme potansiyeli olan erkeklerde fertilite bozukluğuna neden olabilir. 3 aya kadar tekrarlanan doz toksisite çalışmalarında abemasiklib ile ilişkili bulgular, testis,epididimis, prostat ve seminal veziküldeki azalmış organ ağırlıkları, intratubüler hücreseldebris, hipospermi, tübüler dilatasyon, atrofi ve dejenerasyon/nekrozu içermektedir. Bu etkiler,sıçanlarda ve köpeklerde insan klinik maruziyetinin sırasıyla yaklaşık 2 ve 0,02 katımaruziyetlerde meydana gelmiştir. Bir sıçan erkek fertilite çalışmasında, abemasiklibin üremeperformansı üzerinde herhangi bir etkisi olmamıştır. Bir sıçan dişi fertilite ve erken embriyonik gelişim çalışmasında ve tekrarlanan doz toksisite çalışmalarında, abemasiklibin üreme performansı üzerinde herhangi bir etkisi olmamıştır veyadişilerde fertilitenin bozulma riskinin göstergesi olan, dişi üreme sistemi üzerinde herhangi birönemli etkisi olmamıştır. Gelişim toksisitesiAbemasiklib, insanlar için önerilen doza benzer maternal maruziyetlerde teratojenik bulunmuş ve fetus ağırlığında azalmaya neden olmuştur. 6. FARMASOTIK ÖZELLİKLER6.1 Yardımcı maddelerin listesiTablet çekirdeğiKroskarmelloz sodyumLaktoz monohidrat; Laktoz Hidrat (sığır kaynaklı) Mikrokristalin selüloz 101 Mikrokristalin selüloz 102 Silikon Dioksit; Silika, Sulu Kolloidal; Sulu Silikon Dioksit Sodyum stearil fumarat Film kaplamaPolivinil alkol - Kısmen Hidrolize Edilmiş (E1203) Titanyum dioksit (E171) Makrogol 4000 / PEG MW 3350 (E1521) Talk (E553b) Sarı demir oksit (E172) Kırmızı demir oksit (E172) 6.2 GeçimsizliklerGeçerli değildir. 6.3 Raf ömrü36 ay 6.4 Saklamaya yönelik özel uyarılar30°C altındaki oda sıcaklığında saklayınız. 6.5 Ambalajın niteliği ve içeriğiAlüminyum folyo ile kapatılmış PCTFE/PE/PVC blisterlerde 28, 42 veya 56 film kaplı tabletlik ambalajlarda Tüm ambalaj boyutlarında pazarlanmayabilir. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİLilly İlaç Ticaret Ltd ŞtiAcıbadem Mah. Çeçen SokakAkasya Acıbadem Kent EtabıA Blok Kat: 334660 Üsküdar / İstanbul Tel : 0 216 554 00 00 Faks : 0 216 474 71 99 8. RUHSAT NUMARASI(LARI)2019/124 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 28.02.2019 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriYulareb 50 Mg Film Kaplı TabletEtken Maddesi: Abemasiklib Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.