Miranova 100 Mcg/20 Mcg Kaplı Tablet Kısa Ürün BilgisiKISA ÜRÜN BILGISI1. BEŞERI TIBBİ ÜRÜNÜN ADIMIRANOVA® 100 mcg/20 mcg kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her tablet etkin madde olarak, 0,1 mg levonorgestrel ve 0,02 mg etinilestradiol içerir.Yardımcı madde(ler):Her tablet 35,190 mg laktoz monohidrat (sığır kaynaklı) ve 19,374 mg sukroz içerir.Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMTablet Pembe kaplı tabletler 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarOral kontrasepsiyon (doğum kontrolü) MIRANOVA reçete etme kararı, venöz tromboembolizmi (VTE) olan kadınlar başta olmak üzere her kadının mevcut risk faktörleri ve MIRANOVA ile ortaya çıkan VTE riskinin diğerkombine hormonal kontraseptifler (KHK) ile karşılaştırması (Bkz. Bölüm 4.3 ve Bölüm 4.4)dikkate alınarak verilmelidir. 4.2. Pozoloji ve uygulama şekliPozoloji / uygulama sıklığı ve süresi:
doğru şekilde kullanıldıklarında yılda yaklaşık % 1
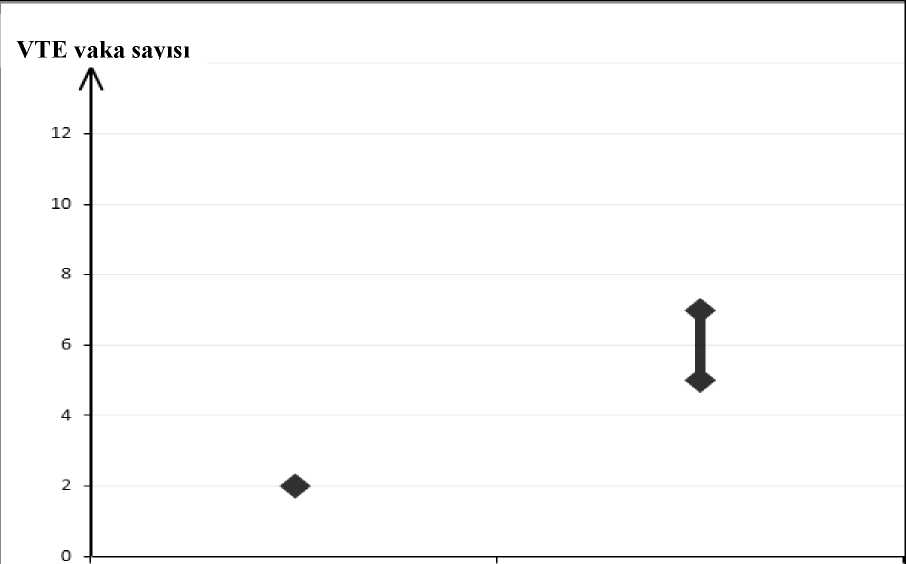
Kombine oral kontraseptifler (KOK), başarısızlık oranına sahiptir. ilaç unutulduğunda ya da yanlış kullanıldığında başarısızlık oranı artabilir. Tabletler, paketin üstünde gösterildiği sırayla, her gün yaklaşık aynı zamanda bir miktar suyla alınmalıdır. Birbirini izleyen 21 gün boyunca her gün bir tablet alınır. Her bir sonraki pakete 7günlük, sıklıkla çekilme kanamasının izlendiği, tablet alınmayan dönemi takiben geçilir. Bukanama genellikle son tabletin alınmasını takiben 2.-3. gün başlar ve bir sonraki paketebaşlandığında kesilmemiş olabilir. Uygulama şekli:Oral kullanım MIRANOVA'ya başlangıç: Bir önceki ay hormonal kontraseptif kullanımı yoksa: Tablet alımına kadının normal siklusunun ilk günü (kanamasının ilk günü) başlanmalıdır. Tabletlere 2. ile 5. günler arasında başlanması da kabul edilebilir, ancak bu durumda ilk siklusiçin tablet alınmaya başlanmasından itibaren 7 gün boyunca ilave olarak bir bariyerkontrasepsiyon yöntemi kullanılmalıdır. Bir KHK'dan geçiş (KOK, vajinal halka, transdermal flaster): Kullanıcı tercihen, bir önceki oral kontraseptifin son tabletini (hormon içeren son tablet) aldığı günü izleyen günde MIRANOVA'ya başlamalıdır. En geç, önceki KOK'un tabletsizdöneminin veya hormon içermeyen tablet döneminin ertesi gününde başlayabilir. Vajinalhalka ya da transdermal flaster kullanılması durumunda, kullanıcı döngü paketindeki sonhalkanın ya da flasterin çıkarıldığı gün ya da en geç bir sonraki uygulamanın yapılmasıgereken gün MIRANOVA'ya başlamalıdır. Yalnız progestojen içeren bir yöntemden (minipil, enjeksiyon, implant) ya da progesteron salımlı rahim içi sistemden (RİS) geçiş: Minipilden herhangi bir günde, (implant veya RİS'in çıkarıldığı gün, enjeksiyonda ise bir sonraki enjeksiyonun yapılması gereken gün) geçiş yapılabilir. Ancak tüm bu koşullardatablet alımının ilk 7 günü ek bir bariyer yöntemi kullanılması önerilir. İlk trimestr düşüğünü takiben: Hemen başlanabilir. Ek kontraseptif önlemler alınmasına ihtiyaç duyulmaz. Doğumu veya ikinci trimestr düşüğünü takiben: Doğumu veya ikinci trimestr düşüğünü takiben 21-28. günlerde başlanması önerilir. Daha sonra başlandığı takdirde tablet alımının ilk 7 günü ek bir bariyer yöntemi kullanılmalıdır.Eğer o zamana kadar ilişki gerçekleştiyse, KOK kullanımı başlamadan önce gebelik ekarteedilmeli veya ilk menstruel kanama beklenmelidir. Emziren kadınlar için Bkz. Bölüm 4.6 Tablet alımı unutulduğunda: Eğer kullanıcı tabletini almakta, 12 saatten daha az geç kalmışsa kontraseptif koruyuculuk azalmaz. Hatırlanır hatırlanmaz tablet alınmalı ve sonraki tabletler de her zamanki gibialınmaya devam edilmelidir. Eğer 12 saatten daha fazla gecikme olmuşsa kontraseptif koruyuculuk azalmış olabilir. Bu durumda 2 temel kural uygulanır. 1. Tablet alımına hiçbir zaman 7 günden fazla ara verilmez. 2. Hipotalamus-hipofiz-over aksının uygun şekilde baskılanması için 7 gün boyunca aralıkvermeden tablet alınması gereklidir. Buna bağlı olarak günlük uygulamada şu öneriler verilebilir: 1. Hafta: Aynı zamanda iki tablet almak anlamına gelse de, kullanıcı unuttuğu tableti hatırlar hatırlamaz içmelidir. Kalan tabletlerini normal zamanında kullanmaya devametmelidir. Takip eden 7 gün boyunca kondom gibi ek bir bariyer yöntemikullanmalıdır. Tablet alımının unutulduğu günden önceki 7 gün içinde cinsel birleşmeolmuşsa gebelik olasılığı göz önüne alınmalıdır. Ne kadar çok tablet unutulursa ve butabletlerin unutulduğu gün tabletsiz döneme ne kadar yakınsa gebelik riski o kadaryüksektir. 2. Hafta: Aynı zamanda iki tablet almak anlamına gelse de, kullanıcı son unuttuğu tabletihatırlar hatırlamaz içmelidir. Kalan tabletlerini normal zamanında kullanmaya devametmelidir. Eğer ilk unutulan tablete kadar 7 gün boyunca tabletler doğru olarak alınmışsa ekkorunma yöntemi kullanmaya gerek yoktur. Aksi takdirde ya da kadın birden fazla tabletunutmuşsa sonraki 7 gün boyunca ek önlemler alınmalıdır. 3. Hafta: Tabletsiz dönemin yaklaşıyor olması nedeni ile güvenilirlikte azalma riski yüksektir.Yine de, tablet alımında ayarlamalar yapılarak kontraseptif korumada azalma önlenebilir.Eğer unutulan tabletten önceki 7 gün boyunca tabletler doğru olarak alındıysa, aşağıdaki ikiseçenekten birinin uygulamasıyla ek bir kontraseptif yönteme gerek kalmaz. Aksi takdirde buseçeneklerden ilki seçilip, ayrıca 7 gün boyunca ek önlemler almak gerekir. 1. Aynı zamanda iki tablet almak anlamına gelse de kullanıcı son unuttuğu tableti hatırlarhatırlamaz içmelidir. Kalan tabletlerini normal zamanda kullanmaya devam etmelidir. Birsonraki kutuya 7 gün ara vermeden mevcut kutu biter bitmez başlanmalıdır. Kullanıcıda ikincikutunun sonuna kadar bir çekilme kanaması beklenmez. Ancak tablet alındığı günlerdelekelenme veya kırılma kanaması görülebilir. 2. Kullanmakta olduğu kutuyu bırakması önerilebilir. 7 günlük (tableti unuttuğu günler dahil)aradan sonra yeni kutuya başlanır. Tablet almayı unutan kullanıcıda ilk tabletsiz dönemde beklenen çekilme kanaması görülmezse gebelik olasılığı göz önüne alınmalıdır. Gastrointestinal rahatsızlıklar durumunda öneriler: Şiddetli mide-bağırsak bozukluklarının olması durumunda emilim tam olmayabilir ve ek kontraseptif önlemler alınmalıdır. Eğer tablet alımını takiben 3-4 saat içinde kusma olursa unutulan tabletler için verilen öneriler (Bkz. Tablet alımı unutulduğunda) geçerlidir. Eğer kadın normal tablet alma programınıdeğiştirmek istemezse, gereken ekstra tabletleri başka bir kutudan almalıdır. Menstruasyonun öne alınması ya da ertelenmesi: Menstruasyonun ertelemek için MIRANOVA almaya 7 günlük ara verilmeden, yeni bir paket ile devam edilir. Bu uzatma istenildiği sürece, 2. paketin sonuna dek sürdürülebilir. Bu süreiçinde, kırılma kanaması ya da lekelenme meydana gelebilir. Daha sonra olağan 7 günlükaradan sonra, MIRANOVA alımına normal şekilde devam edilir. Menstruasyonu haftanın başka bir gününe kaydırmak için tabletsiz dönem istenildiği kadar kısaltılabilir. Aralık kısaldıkça, ikinci paket kullanılırken kırılma kanaması ya da lekelenmeolması riski artar (menstruasyonu ertelemede olduğu gibi). Özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği: MIRANOVA şiddetli karaciğer hastalıkları olan kadınlarda kontrendikedir. Ayrıca '4.3 Kontrendikasyonlar' bölümüne bakınız.Böbrek yetmezliği:MIRANOVA böbrek yetmezliği olan hastalarda özel olarak araştırılmamıştır. Mevcut veriler bu hasta popülasyonun tedavisinde bir değişiklik yapılmasınıgerektirmemektedir.Pediyatrik popülasyon:MIRANOVA yalnızca menarştan sonra endikedir.Geriyatrik popülasyon:4.3. KontrendikasyonlarKOK'lar aşağıda belirtilen durumlarda kullanılmamalıdır. KOK kullanırken aşağıdaki durumlardan herhangi birinin ilk kez görülmesi halinde kullanım derhal durdurulmalıdır. VTE varlığı veya riski o Venöz tromboembolizm - mevcut VTE (antikoagülanlar üzerinde) veya öyküsü (örn. derin ven trombozu [DVT] veya pulmoner embolizm [PE]) o APC direnci (Faktör V Leiden dahil), antitrombin III eksikliği, protein C eksikliği, protein S eksikliği gibi VTE için bilinen kalıtımsal veya kazanılmış yatkınlık o Uzun süreli hareketsizliğe neden olan majör cerrahi müdahale (Bkz. Bölüm 4.4) o Çoklu risk faktörlerinin varlığından kaynaklanan yüksek VTE riski (Bkz. Bölüm 4.4) Arteriyel tromboembolizm (ATE) varlığı veya riski o Arteriyel tromboembolizmi - mevcut ATE, ATE öyküsü (örn. miyokard infarktüsü) veya prodromal durum (örn. anjina pektoris) o Serebrovasküler hastalık - mevcut inme, inme veya prodromal durum öyküsü (örn. geçici iskemik atak, TIA) o Hiperhomosisteinemi ve antifosfolipid antikorlar (antikardiyolipin antikorlar, lupus antikoagülanı) gibi ATE için bilinen kalıtımsal veya kazanılmış yatkınlık o Fokal nörolojik semptomlu migren öyküsü. o Çoklu risk faktörlerinden kaynaklanan yüksek ATE riski (Bkz. Bölüm 4.4) veya aşağıdaki gibi bir ciddi risk faktörü varlığı: vasküler semptomlu diabetes mellitus şiddetli hipertansiyon şiddetli dislipoproteinemi Ağır karaciğer hastalığı veya sarılık (karaciğer fonksiyon değerleri normal değerlerinedönmediği sürece) Karaciğer tümörü varlığı ya da öyküsü (iyi veya kötü huylu) Seks steroidlerinden etkileniyorsa genital organların veya memenin bilinen ya da şüpheli malign hastalıklarıTanı konulmamış vajinal kanamaBilinen gebelik ya da gebelik şüphesi Etkin ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılık Sebebi bilinmeyen amenore (adet görememe) MIRANOVA, ombitasvir/paritaprevir/ritonavir ve dasabuvir, glekaprevir/pibrentasvir veya sofosbuvir/velpatasvir/voxilaprevir içeren tıbbi ürünlerle eş zamanlı kullanım içinkontrendikedir (Bkz. Bölüm 4.5). 4.4. Özel kullanım uyarıları ve önlemleriUyarılar Aşağıda belirtilen durum veya risk faktörlerinden herhangi biri varsa, MIRANOVA'mn uygun olup olmadığı kadın ile tartışılmalıdır. Bu durumlardan veya risk faktörlerinden herhangi birinin şiddetlenmesi veya ilk defa ortaya çıkması halinde, kadının MIRANOVA kullanımının sonlandırılmasının gerekli olupolmadığının belirlenmesi için doktoru ile iletişime geçmesi tavsiye edilmelidir. Dolaşım bozuklukları Dolaşım bozuklıkları ile ilgili advers etkilerin ortaya çıkma riski özellikle 35 yaş üzeri ve sigara içen kadınlarda yüksektir. VTE riskiKHK kullanan kadınlarda VTE riski kullanmayanlara göre artar. En düşük VTE riskine sahip olduğu bilinenlerden farklı bir ürünün kullanılması kararı, ancak kadınınKHK'lerle ilişkili VTE riskini, mevcut risk faktörlerinin bu riski nasıl etkilediğini veVTE riskinin kullanımınım ilk yılında en yüksek olduğunu anladığından emin olduktansonra alınmalıdır. Ayrıca KHK kullanımına 4 hafta veya daha uzun süre araverildikten sonra tekrar başlandığında riskin arttığını gösteren bazı kanıtlar vardır.KHK kullanmayan ve gebe olmayan kadınlarda, 10.000 kişiden yaklaşık 2'si bir yıllık süre içinde VTE geliştirir. Bununla birlikte, herhangi bir kadında altta yatan risk faktörlerine bağlıolarak söz konusu risk çok daha yüksek olabilir (Bkz. Şekil-1). Levonorgestrel içeren bir KHK kullanan 10.000 kadından yaklaşık 6'sinın bir yıl içinde VTE geliştireceği tahmin edilmektedir. Düşük dozlu KHK'ler ile bir yıldaki VTE sayısı gebelikte veya postpartum dönemde kadınlarda beklenen sayıdan düşüktür. VTE, bu vakaların %1-2'sinde ölümcül olabilir.
Şekil-1: Bir yıl içinde her 10.000 kadında görülen VTE vakası sayısıSon derece nadir olarak, KHK kullamcılarmda diğer kan damarlarında (örn. hepatik, mesenter, böbrek veya retinal toplardamarlar ve atardamarlar) tromboz meydana geldiği raporedilmiştir. VTE risk faktörleriVenöz tromboembolik komplikasyon riski KHK kullamcılarmda özellikle çoklu risk faktörleri olduğunda, ilave risk faktörleri olan kadınlarda ciddi ölçüde artabilir (Bkz. Tablo-1: VTERisk faktörleri). Yüksek venöz tromboz riski oluşturan çoklu risk faktörleri mevcut olan kadında MIRANOVA kullanımı kontrendikedir (Bkz. Bölüm 4.3). Bir kadın birden fazla risk faktörüne sahipse riskartışı tüm faktörlerin ayrı ayrı toplamından fazla olabilir ve bu durumda toplam VTE riskidikkate alınmalıdır. Fayda ve risk dengesinin negatif olduğu düşünülüyorsa KHK reçeteedilmemelidir (Bkz. Bölüm 4.3).
Variköz venlerin ve yüzeysel tromboflebitin venöz tromboembolideki olası rolü konusunda görüş birliği yoktur. Gebelikte ve özellikle 6 haftalık puerperium periyodunda tromboemboli riskindeki artış dikkate alınmalıdır (Bkz. Bölüm 4.6). VTE semptomları (DVT ve PE)Semptomlar olması halinde, kadınlara acil tıbbi yardım almaları ve sağlık çalışanlarını KHK aldıkları konusunda bilgilendirmeleri tavsiye edilmelidir. DVT semptomları aşağıdakileri kapsayabilir: - bacakta/ayakta tek taraflı ya da bacaktaki bir damar boyunca şişme; - bacakta yalnızca ayakta dururken ya da yürürken hissedilebilen ağrı ya da hassasiyet, - etkilenen bacakta sıcaklık artışı; bacakta ciltte kırmızılık ya da renk değişmesi. Pulmoner embolizm (PE) semptomları aşağıdakileri kapsayabilir: - aniden ortaya çıkan, açıklanamayan nefes darlığı ya da hızlı soluma; - kanın söz konusu olabileceği ani öksürük; - keskin göğüs ağrısı; - şiddetli dengesizlik ya da baş dönmesi; - hızlı veya düzensiz kalp atışı. Bu semptomlardan bazıları (ör, nefes darlığı, öksürük) özgün değildir ve daha yaygın ya da daha az şiddetli olaylar (ör, solunum yolu enfeksiyonları) şeklinde yanlış yorumlanabilir.Vasküler oklüzyona ilişkin diğer belirtiler; bir ekstremitedeki ani ağrı, şişme ya da mavi tondahafif renk değişikliği olabilir. Gözde tıkanma meydan geldiği takdirde, semptomlar ağrısız bulanık görme ile başlayıp görme kaybına kadar ilerleyebilir. Bazen, görme kaybı aniden meydana gelebilir. ATE riski
veya
Epidemiyolojik çalışmalarda, KHK kullanımı ATE (miyokard enfarktüsü) serebrovasküler olay (ör. geçici iskemik atak, inme) riskinde artışla ilişkilendirilmiştir.ATE ölümcül olabilir. ATE risk faktörleriArteriyel tromboembolik komplikasyon veya serebrovaksüler olay riski, risk faktörleri olan KHK kullanıcılarında artar (Bkz. Tablo-2: ATE Risk faktörleri). Yüksek arteriyel tromboz riskine maruz bırakan ciddi ya da çoklu ATE risk faktörleri mevcut olan kadında MIRANOVA kullanımı kontrendikedir (Bkz. Bölüm 4.3). Bir kadında birdenfazla risk faktörü varsa, riskteki artışın ayrı ayrı faktörlerin toplamından daha yüksek olmasıolasılığı vardır. Bu durumda VTE toplam riski dikkate alınmalıdır. Fayda ve risk dengesininnegatif olduğu düşünülüyorsa, KHK reçete edilmemelidir (Bkz. Bölüm 4.3).
ATE semptomlarıSemptomlar görüldüğünde, en kısa sürede tıbbi yardıma başvurmaları ve KHK kullandıklarım sağlık uzmanına bildirmek konusunda kadınlar bilgilendirilmelidir. Serebrovasküler bir olaya ilişkin semptomlar şunlardır: - yüzde, bacak veya kolda, özellikle vücudun bir tarafında ani hissizlik ya da güçsüzlük; - ani yürümede güçlük, baş dönmesi, denge ya da koordinasyon kaybı; - ani konfüzyon, konuşma ya da kavramada güçlük; - bir ya da her iki gözde ani görme güçlüğü; ani yürüme güçlüğü, - bilinen nedeni olmayan ani, şiddetli veya uzun süren baş ağrısı; - bilinç kaybı ya da nöbetin eşlik ettiği ya da tek başına bayılma. Geçici belirtiler olayın geçici iskemik atak olduğunu göstermektedir. Miyokard enfarktüsü (MI) semptomları şunları kapsayabilir: - göğüs, kol ya da göğüs kemiği altında ağrı, rahatsızlık, basınç, ağırlık, sıkışma ya dadolgunluk hissi; - sırt, çene, boğaz, kol ve mideye yayılan rahatsızlık; - dolgunluk, hazımsızlık ya da sıkıştırma hissi; - terleme, bulantı, kusma ya da baş dönmesi; - aşırı güçsüzlük, anksiyete, nefes darlığı; - hızlı veya düzensiz kalp atışı. Antikoagülan tedavinin (kumarinler) teratojenisitesi nedeniyle uygun alternatif kontrasepsiyona başlanmalıdır. Tümörler Bazı epidemiyolojik çalışmalarda uzun vadeli KOK kullanıcılarında artmış bir servikal kanser riski bildirilmiş olmakla birlikte bu bulgunun cinsel davranış ve insan papilloma virüsü (HPV)gibi diğer etkenlerin karışıklık yaratan etkilerine ne ölçüde atfedilebileceği konusundatartışmalar vardır. 54 epidemiyolojik çalışmanın meta analizi sonucu halen KOK kullanan kadınlarda tanı konan meme kanseri bağıl riskinde hafif bir artış saptanmıştır (Bağıl risk =1,24). Bu artmış riskKOK'un kesilmesini takiben on yıl içinde azalarak kaybolmaktadır. Meme kanseri 40 yaşınaltındaki kadınlarda nadir olduğundan, halen KOK kullanan ya da kullanmış olanlardakonulan meme kanseri tanılarındaki artış, tüm meme kanseri riski ile karşılaştırıldığındadüşüktür. Anılan çalışmalar nedensellik ilişkisi konusunda kanıtlar getirmemektedir.Gözlenen artmış risk paterni, KOK kullanıcılarında meme kanserinin daha erken tanınmasına,KOK'ların biyolojik etkilerine veya ikisinin kombinasyonuna bağlı olabilir. KOK kullanmışolanlarda tanı konan meme kanserleri hiç kullanmamış olanlara göre klinik olarak daha azilerlemiş olma eğilimi gösterir. KOK kullanıcılarında nadir olgularda iyi huylu, çok nadiren de malign karaciğer tümörleri gözlemlenmiştir. Sınırlı olguda bu tümörler yaşamı tehdit eden batın içi kanamalara yol açar.KOK kullanan kadınlarda şiddetli üst batın ağrısı, karaciğerde büyüme veya batın içi kanamabulgularının ortaya çıkması durumunda ayırıcı tanıda bir karaciğer tümörü göz önünealınmalıdır. Maligniteler hayatı tehdit edebilir ya da ölümcül seyredebilir. Diğer durumlar Hipertrigliseridemi varlığı ya da aile öyküsü KOK kullanımında artmış pankreatit riskine neden olabilir. KOK kullanan birçok kadında kan basıncında küçük artışlar bildirilmişse de klinik açıdan önemli artışlar nadirdir. Ancak KOK kullanımı sırasında, klinik olarak anlamlı veantihipertansif tedaviye yanıt vermeyen hipertansiyon gelişmesi durumunda hekimin KOK'ukesmesi ve hipertansiyonu tedavi etmesi uygun olur. Eğer normotansif değerler antihipertansiftedavi ile sağlanabiliyorsa ve uygun bulunursa KOK kullanımına tekrar başlanabilir. Aşağıdaki koşulların hem gebelikte hem de KOK kullanımı ile meydana geldiği veya kötüleştiği bildirilmiştir, ancak KOK kullanımı ile ilişkili kanıtlar yetersizdir: Kolestaza bağlısarılık ve/veya kaşıntı; safra taşı oluşumu; porfiri; sistemik lupus eritematozus; hemolitiküremik sendrom; Sydenham koresi; herpes gestationis; otoskleroza bağlı duyma kaybı,depresif durum. Herediter anjiyoödemi olan kadınlarda, ekzojen östrojen anjiyoödem semptomlarını uyarabilir ya da şiddetlendirebilir. Karaciğer fonksiyonlarının akut veya kronik olarak bozukluklarında, karaciğer fonksiyon testlerinin normale dönmesine kadar KOK kullanımını kesilmelidir. İlk kez gebelikte ya dadaha önce seks steroidlerinin kullanımı sırasında oluşmuş olan kolestatik sarılığıntekrarlaması KOK kullanımının sonlandırılmasını gerektirir. KOK'lar periferik insülin direnci ve glukoz toleransı üzerinde etkili olabiliyorsa da, düşük dozlu KOK kullanan bir diyabetik hastada tedavi rejiminde değişiklikler yapma gerekliliğinigösteren bir kanıt yoktur. Ancak, KOK kullanımının ilk zamanlarında diyabetik kadınlardikkatle gözlenmelidir. Crohn hastalığı, ülseratif kolit, epilepsi ve endojen depresyonunun kötüleşmesi KOK kullanımı ile ilişkilendirilmiştir. Depresif duygudurumu ve depresyon, hormonal kontraseptif kullanımıyla sık görülen istenmeyen etkilerdir (Bkz. Bölüm 4.8). Depresyon ciddi olabilir ve intihar davranışı veintihar için iyi bilinen bir risk faktörüdür. Duygudurum dalgalanmaları ve depresifsemptomlar olması halinde, bu semptomlar tedavinin başlamasından kısa bir süre sonra ortayaçıksa dahi kadınlara doktorlarına başvurmaları önerilmelidir. Kloazma, özellikle kloazma gravidarum öyküsü olan kadınlarda bazen gelişebilir. Kloazmaya eğilimi olan kadınlar KOK kullandıkları sürece güneşe veya ultraviyole ışınlarına maruzkalmaktan kaçınmalıdırlar. Tıbbi muayene/konsültasyon: Hastanın oral kontraseptif kullanmaya başlamadan önce ve sonrasında düzenli aralıklarla tıbbi öyküsü (aile öyküsünü de içerecek şekilde) değerlendirilmelidir ve gebelik ekarte edilmelidir.Kan basıncı ölçülmeli ve fiziksel muayene kontrendikasyonlar (Bkz. Bölüm 4.3) ile uyarılar(Bkz. Bölüm 4.4) doğrultusunda gerçekleştirilmelidir. VTE ve ATE semptomları, bilinen riskfaktörleri ve şüpheli tromboz durumunda ne yapılacağı, MIRANOVA'nm diğer KHK'larakıyasla riski de dahil olmak üzere venöz ve arteriyel tromboz bilgilerine kadının dikkatiniçekmek önemlidir. Ayrıca kadın, kullanma talimatını dikkatle okuması ve yapılan tavsiyelere uyması gerektiği konusunda bilgilendirilmelidir. Bu değerlendirmelerin içeriği ve sıklığı ilgili kılavuzlardoğrultusunda olmalı ve kadına özgü şekilde uyarlanmalıdır. Kullanıcılar hormonal kontraseptiflerin HIV enfeksiyonları (AIDS) ve diğer cinsel yolla bulaşan hastalıklara karşı koruyucu olmadığı konusunda bilgilendirilmelidir. Azalmış etkinlik:
mide-bağırsak
KOK'ların etkinliği tablet alımı unutulduğunda, kusma, diyare gibi bozuklukları olması halinde, ya da eş zamanlı ilaç tedavilerinde azalabilir. Azalmış siklus kontrolü: Tüm KOK'larda, özellikle kullanımın ilk aylarında düzensiz kanamalar (lekelenme veya kırılma kanaması) gelişebilir. Bu nedenle herhangi bir düzensiz kanamanın değerlendirilmesiyaklaşık 3 siklusluk bir adaptasyon süresinden sonra anlamlıdır.İlk 6 ayda MIRANOVAkullanıcılarının % 50'den fazlasında kanama (lekelenme ve / veya ara kanama) raporedilmiştir. Eğer kanama düzensizliği devam eder veya kanamalar düzenliyken ortaya çıkarsa hormonal olmayan etkenler göz önüne alınmalı ve malignite veya gebeliğin ekarte edilmesi için kürtajında dahil olabileceği uygun tanısal girişimlerde bulunulmalıdır. Bazı kadınlarda tablet alınmayan dönemde çekilme kanaması oluşmayabilir. Eğer KOK, 4.2 Pozoloji ve uygulama şekli bölümünde belirtilen şekilde kullanıldıysa kadının gebe olmasıbeklenmemektedir. Ancak KOK, ilk gerçekleşmeyen çekilme kanamasından önce kullanımkurallarına uygun kullanılmadıysa ya da çekilme kanaması iki kez gerçekleşmediyse KOKkullanımına devam etmeden önce gebelik bertaraf edilmelidir. Laktoz: Her bir tablet 35,190 mg laktoz monohidrat (sığır kaynaklı) içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz galaktoz malabsorpsiyon problemi olanhastaların bu ilacı kullanmaması gerekir. Sukroz: Her bir tablet 19,374 mg sukroz içerir. Nadir kalıtımsal fruktoz intoleransı, glikoz-galaktoz malabsorpsiyon veya sükraz-izomaltaz yetmezliği problemi olan hastaların bu ilacıkullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer tıbbi ürünlerin MIRANOVA ile etkileşimleri: Mikromozal enzimleri indükleyen ilaçlar ile arasındaki etkileşimler seks hormonu klirensinde artışa neden olabilir, bu durum da ara kanamaya ve/veya kontraseptif başarısızlığa yolaçabilirler. Birkaç günlük tedavinin ardından enzim indüksiyonu gözlemlenebilir. En fazla enzim indüksiyonu genellikle birkaç hafta içinde görülür. Enzim indüksiyonu, ilaç tedavisininkesilmesinin ardından 4 hafta kadar sürebilir. Belirtilen ilaçlardan herhangi biri ile tedavi edilmekte olan kadınlar, KOK'a ek olarak bir bariyer yöntemi kullanmalı ya da başka bir kontrasepsiyon yöntemi seçmelidirler. İlaçlar ilebirlikte kullanımları süresince ve tedavinin kesilmesini takiben 28 gün boyunca bariyeryöntemi kullanmalıdırlar. Eğer bariyer yöntemi kullanılan dönem KOK kutusundakitabletlerin bitiminden sonra devam ediyorsa, bir sonraki kutuya ara vermeden devamedilmelidir. Uzun süreli tedavi Karaciğer enzimini indükleyici etkin maddeler ile uzun süreli tedavi gören kadınlarda, başka bir güvenilir, hormonal olmayan kontrasepsiyon yöntemi önerilmektedir. Azalmış absorbsiyon: Metoklopramid gibi gastrointestinal motiliteyi artıran ilaçlar KOK'un absorbsiyonunu azaltabilir. KOK klirensini artıran maddeler (enzimlerin uyarılmasıyla KOK etkililiğinin azalması), örn.: Fenitoin, barbitüratlar, primidon, bosentan, karbamazepin, rifampisin ve ritonavir, nevirapinve efavirenz gibi HIV ilaçları ve muhtemelen oksakarbazepin, topiramat, felbamat,griseofulvin ve sarı kantaron (St John's wort) içeren ürünler. KOK klirensi üzerine değişken etkilere sahip maddeler; örn; KOK ile birlikte uygulandığında birçok HIV/HCV proteaz inhibitörü ve nükleozid olmayan ters transkriptaz inhibitörleri plazma östrojen veya progesteron konsantrasyonlarınıazaltabilmekte ya da artırabilmektedir. Bu değişiklikler bazı olgularda klinik açıdan anlamlıolabilir. Bu durumda ilave bir bariyer kontraseptif kullanılmalıdır. KOK klirensini azaltan maddeler (enzim inhibitörleri) Enzim inhibitörleriyle potansiyel etkileşimlerin klinik önemi bilinmemektedir. Güçlü CYP3A4 inhibitörlerinin birlikte uygulanması, östrojen veya progestinin plazma konsantrasyonlarını veya her ikisini de artırabilir. Azol antifungaller (ör. itrakonazol, vorikonazol, flukonazol), verapamil, makrolidler (ör.klaritromisin, eritromisin), diltiazem ve greyfurt suyu gibi kuvvetli ve orta düzeydeCYP3A4 inhibitörleri östrojen veya progestin veya her ikisinin de plazma konsantrasyonunuartırabilir. 60 - 120 mg/gün etorikoksib dozlarının 0,035 mg etinilestradiol içeren KHK ile eş zamanlı olarak alındığı takdirde etinilestradiolün plazma konsantrasyonlarını sırasıyla 1,4 - 1,6 katarttırdığı görülmüştür. KOK'lerin diğer tıbbi ürünler üzerine etkisi: Oral kontraseptifler diğer bazı ilaçların metabolizmasını etkileyebilir. Buna bağlı olarak plazma ve doku konsantrasyonları artabilir (örn. siklosporin) veya azalabilir (örn. lamotrigin). İn vitroetinilestradiol hem CYP2C19, CYP1A1 ve CYP1A2'nin geri döndürülebilirinhibitörü, hem de CYP3A4/5, CYP2C8, ve CYP2J2'nin mekanizma temelli inhibitörüdür.Klinik çalışmalarda etinilestradiol içeren hormonal kontraseptifin uygulanması CYP3A4substratlarının (ör. midazolam) plazma konsantrasyonlarında herhangi bir artışa yol açmaz yada sadece zayıf bir artışa yol açarken, CYP1A2 substratlarının plazma konsantrasyonları hafif(ör. teofilin) veya orta düzeyde (ör. melatonin ve tizanidin) artabilmektedir.Troleandomisin ile KOK'ların birlikte kullanımı intrahepatik kolestaz riskini artırabilir. Farmakodinamik etkileşimler Hepatit C virüsü enfeksiyonları (HCV) için tedavi gören hastalarda, ribavirinli veya ribavirinsiz, ombitasvir/paritaprevir/ritonavir ve dasabuvir içeren tıbbi ürünlerle yapılan klinikçalışmalar sırasında, normalin üst sınırının (ULN) 5 katından fazla transaminaz (ALT)yükselmeleri, kombine hormonal kontraseptifler (KHK'lar) gibi etinilestradiol içeren ilaçlarkullanan kadınlarda önemli ölçüde daha sık meydana gelmiştir. Ek olarak,glekaprevir/pibrentasvir veya sofosbuvir/velpatasvir/voxilaprevir ile tedavi edilen hastalardada, KHK gibi etinilestradiol içeren ilaçlar kullanan kadınlarda ALT yükselmeleri gözlenmiştir(Bkz. Bölüm 4.3) Ombitasvir, paritaprevir, ritonavir ve dasabuvir ve bunların ribavirinle veya ribavirinsiz kombinasyonlarını içeren doğrudan etkili antiviral (DEA) tıbbi ürünlerin etinilestradiol içerentıbbi ürünlerle birlikte uygulanmasının, ALT seviyelerinde sağlıklı kadın deneklerdeki veHCV ile enfekte kadınlardaki normal değerin üst sınırının 20 katından daha yüksek artışlarlailişkili olduğu gösterilmiştir (Bkz. Bölüm 4.3). Bu nedenle, MIRANOVA kullanıcıları, bu kombinasyona sahip ilaç rejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örneğin, sadece progestajenlekontrasepsiyon veya hormonal olmayan yöntemler) geçmelidir. MIRANOVA, bukombinasyona sahip ilaç rejimi ile tedaviyi tamamladıktan 2 hafta sonra yeniden başlatılabilir. Diğer etkileşim şekilleri: Laboratuvar testleri: Kontraseptif steroidlerin kullanılması, karaciğer, tiroid, adrenal ve renal fonksiyonların biyokimyasal parametrelerini, kortikosteroid bağlayıcı globulin ve lipid/lipoproteinfraksiyonları gibi (taşıyıcı) proteinlerin plazma düzeylerini ve karbonhidrat metabolizması,koagulasyon ve fibrinoliz parametrelerini içeren bir grup laboratuvar testinin sonuçlarınıetkileyebilir. Değişiklikler genellikle normal laboratuvar değerleri sınırları içinde kalır. Not: Olası etkileşmeleri belirlemek amacıyla eş zamanlı kullanılacak ilacın prospektüsüne (kullanma talimatına) başvurulmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği:MIRANOVA şiddetli karaciğer hastalıkları olan kadınlarda kontrendikedir. Ayrıca '4.3 Kontrendikasyonlar' bölümüne bakınız.Böbrek yetmezliği:MİRANOVA böbrek yetmezliği olan hastalarda özel olarakaraştırılmamıştır. Mevcut veriler bu hasta popülasyonun tedavisinde bir değişiklik yapılmasını gerektirmemektedir. Pediyatrik popülasyon:MİRANOVA yalnızca menarştan sonra endikedir.Geriyatrik popülasyon:4.6. Gebelik ve laktasyonGenel tavsiye:Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):MIRANOVA gebelik sırasında endike değildir. Kadının MIRANOVA kullandığı sırada hamile kalması halinde, ilacı kullanmaya devam etmemesi gerekmektedir. Gebelik dönemi:MIRANOVA'nın gebelikte kullanımı kontrendikedir. MIRANOVA kullanımı sırasında gebelik meydana gelmesi durumunda kullanım durdurulmalıdır. Ancak, yaygınepidemiyolojik çalışmalar gebeliğinden önce KOK kullanmış olan kadınların çocuklarındadoğumsal kusur riskinde herhangi bir artışı ya da gebeliğin erken döneminde yanlışlıkla KOKkullanıldığında oluşan bir teratojenik etkiyi göstermemiştir. MIRANOVA kullanımına yeniden başlarken postpartum dönem sırasında artan VTE riski dikkate alınmalıdır (Bkz. Bölüm 4.2 ve Bölüm 4.4). Laktasyon dönemi:KOK'ların kullanımı süt miktarında azalmaya ve sütün bileşiminde değişikliğe yol açabileceğinden dolayı laktasyon etkilenebilir. Bu yüzden emziren anne bebeğini süttenkesinceye kadar KOK kullanımı genellikle önerilmemelidir. Kontraseptif steroidler vemetabolitleri küçük miktarlarda süte geçebilir. Üreme yeteneği / Fertilite:MIRANOVA bir oral kontraseptiftir. Kullanıldığı sürece fertiliteyi engeller. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma becerileri üzerinde etkisi ile ilgili herhangi bir çalışma yapılmamıştır. KOK kullanımının araç ve makine kullanma becerileri üzerinde herhangi biretkisi yoktur veya ihmal edilebilir düzeydedir. 4.8. İstenmeyen etkilerAşağıdaki yan etkiler KOK kullanıcılarında bildirilmiş ve ilişkileri ne doğrulanmış ne de yanlışlığı kanıtlanmıştır. Advers reaksiyonlar, aşağıda sistem-organ sınıfı (MedDRA) ve sıklık derecesine göre listelenmektedir. Sıklık dereceleri şu şekilde tanımlanmaktadır: Çok yaygın (>1/10); yaygın(>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000);çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). MIRANOVA ile en yaygın olarak bildirilen advers reaksiyonlar mide bulantısı, abdominal ağrı, kilo artışı, baş ağrısı, depresif ruh hali, duygu durum bozukluğu, meme ağrısı, memehassasiyetidir. Kullanıcıların > %1 ila < %10'unda meydana gelir. Ciddi advers reaksiyonlar ATE ve VTE'dir Bağışıklık sistemi hastalıklarıSeyrek: Aşırı duyarlılık Metabolizma ve beslenme hastalıklarıYaygın olmayan: Sıvı tutulumu Psikiyatrik hastalıklarYaygın: Depresif duygu durumu, duygu durum değişiklikleri Yaygın olmayan: Libido azalmasıSeyrek: Libido artışı Sinir sistemi hastalıklarıYaygın: Baş ağrısı Yaygın olmayan: Migren Göz hastalıklarıSeyrek: Kontak lense toleranssızlık Vasküler hastalıklarıSeyrek: Venöz tromboembolik bozukluklar1, arteryel tromboembolik bozukluklar1 Gastrointestinal sistem hastalıklarıYaygın: Bulantı, karın ağrısı Yaygın olmayan: Kusma, diyare Deri ve deri altı doku hastalıklarıYaygın olmayan: Döküntü, ürtikerSeyrek: Eritema nodozum, eritema multiforme Üreme sistemi ve meme hastalıklarıYaygın: Meme ağrısı, meme hassasiyeti Yaygın olmayan: Memede hipertrofiSeyrek: Vajinal akıntı, memede akıntı AraştırmalarYaygın: Kiloda artış Seyrek: Kiloda azalma Çok düşük frekanslı advers reaksiyonlar ya da KOK grubuna bağlı olduğu düşünülen gecikmeli başlayan belirtiler aşağıda verilmiştir (Ayrıca Bkz. Bölümler 4.3 ve 4.4): TümörlerMeme kanseri tanı sıklığı oral kontraseptif kullananlarda çok hafif düzeyde artmıştır.Meme kanseri 40 yaşın altındaki kadınlarda nadir görüldüğünden, bu artış genel memekanseri riskiyle ilişkili olarak küçüktür. KOK kullanımıyla neden sonuç ilişkisibilinmemektedir. Karaciğer tümörleri (benign ve malign) Diğer koşullarHipertrigliseridemili kadınlar (KOK'ları kullanılırken pankreatit riski artışı) Hipertansiyon Aşağıdaki durumların ortaya çıkışı veya kötüleşmesinde KOK kullanımının ilişkisisonuçlanmamıştır: kolestazla ilgili sarılık ve/veya kaşıntı; safra taşı oluşumu; porfiri;sistemik lupus eritematozus; hemolitik üremik sendrom; Sydenham koresi; herpesgestasyonis; duyma kaybıyla ilişkili otoskleroz Kalıtımsal anjiyoödem izlenen kadınlarda ekzojen östrojenler anjiyoödem semptomlarınıuyarabilmekte veya şiddetlendirebilmektedir. Karaciğer fonksiyonu bozuklukları Glikoz toleransında değişiklik veya periferik insülin direnci üzerindeki etkisi Crohn hastalığı, ülseratif kolit Kloazma EtkileşimlerDiğer ilaçlarla (enzim indükleyici ilaçlar) oral kontraseptiflerin etkileşimi ara kanamalar ve/veya kontrasepsiyon başarısızlığı ile sonuçlanabilir (Bkz. Bölüm 4.5). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr[email protected]. Doz aşımı ve tedavisiDoz aşımına bağlı bildirilen ciddi yan etki yoktur. Görülebilecek belirtiler, bulantı, kusma ve çekilme kanamasıdır. Çekilme kanaması, ilacı yanlışlıkla almaları halinde kız çocuklarındamenarştan önce bile görülebilir. Antidotu yoktur ve tedavisi semptomatik olmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Östrojenler ve progestojenler, fiks kombinasyonlar ATC kodu: G03AA07 Etki mekanizması KOK'ların etkisi, başlıca ovülasyon inhibisyonu ve servikal salgılamadaki değişiklikler gibi faktörlerin etkileşimine dayanmaktadır. Ruhsatlandırma sonrası güvenlilik çalışması (PASS) VTE tanısı sıklığının düşük östrojen dozlu (<50 ^g etinilestradiol) KOK kullanıcılarmda yılda 7 ila 10/10000 aralığında olduğugösterilmiştir. En yeni veriler VTE tanısı sıklığının gebe olmayan KOK kullanmayan kişilerdeyılda yaklaşık 4/10000, gebe kadınlarda ya da postpartum süreçte ise 20 ila 30/10 000olduğunu ileri sürmektedir. KOK'lar gebelikten korumalarının yanı sıra, sahip oldukları bazı olumsuz özellikler dışında (Bkz. Bölüm 4.4 ve 4.8) doğum kontrol yöntemi seçmede yönlendirici olabilecek ek yararlarsunabilmektedir. Sikluslar daha düzenli, kanamalar sıklıkla daha az ağrılı ve daha hafiftir.Kanamaların daha hafif olması demir yetmezliği görülme olasılığını azaltır. Bunların dışında,endometriyum ile ovaryum kanserlerinde azalma gösterilmiştir. Ayrıca, daha yüksek dozluKOK'ların (0,05 mg etinilestradiol), ovaryum kistlerinde, pelvik inflamatuvar hastalık, benignmeme hastalığı ve ektopik gebelik görülme sıklıklarında azalma sağladığı gösterilmiştir.Bunların düşük doz KOK'lar için de geçerli olduğu henüz gösterilmemiştir. 5.2. Farmakokinetik özelliklerLevonorgestrelGenel ÖzelliklerEmilim:Ağızdan alınan levonorgestrel hızla ve tamamen emilir. MIRANOVA'nın alımını takiben yaklaşık 1,3 saat sonra 2,3 ng/ml olan en yüksek etkin madde düzeyine ulaşılmıştır. Oraluygulama sonrasında levonorgestrel'in biyoyararlılığı hemen hemen % 100'dür. Dağılım:Levonorgestrel serum albuminine ve SHBG'e (seks hormonu bağlayıcı globulin) bağlanır. Yaklaşık % 65'i spesifik olarak SHBG'e ve yaklaşık % 34'ü non-spesifik olarak albuminebağlanırken, toplam konsantrasyonun yalnızca % 1,1'i bağlanmamış halde bulunur. SHBG'deetinilestradiolle uyarılmış artış serum proteinlerine bağlı levonorgestrel oranını etkiler,SHBG'e bağlı fraksiyonda artışa, albumine bağlı fraksiyonda azalmaya yol açar.Levonorgestrelin dağılım hacmi yaklaşık 129 L'dir. Biyotransformasyon:Levonorgestrel büyük ölçüde metabolize olur. Plazmadaki ana metabolitler konjüge ve konjüge olmayan 3a, 5P-tetrahidrolevonorgestrelin formlarıdır. İn vitroin vivoçalışmalaragöre CYP3A4, levonorgestrel metabolizmasına dahil olan ana enzimdir.Plazmadan klerens hızı yaklaşık 1,0 mL/dak/kg'dır. Eliminasyon:Levonorgestrel serum seviyeleri 2 fazda azalır. Terminal dispozisyon fazı yaklaşık 25 saatlik bir yarılanma ömrüyle karakterizedir. Levonorgestrel değişmemiş olarak atılmaz. Yaklaşık 1 günlük yarılanma ömrü olan metabolitler halinde böbrek ile safradan hemen hemen eşit miktarlarda atılır. Doğrusallık / doğrusal olmayan durum:Günlük alımı takiben ilaç serum seviyeleri, 3 kat artar, tedavi siklusunun ikinci yarısında sabit durum koşullarına ulaşır. Levonorgestrel farmakokinetiği, etinilestradiolle birlikteuygulandığında 1,5-1,6 kat artan SHBG seviyelerinden etkilenir. Sabit durumda, klerens oranıve dağılım hacmi, sırasıyla 0,7 mL/dak/kg ve yaklaşık 100 L olarak hafifçe azalır. Etinilestradiol Genel ÖzelliklerEmilim:Oral olarak alınan etinilestradiol hızla ve tamamen emilir. 1-2 saat sonra en yüksek plazma düzeyi olan yaklaşık 50 pg/mL'ye ulaşılır. Emilim ve karaciğerden ilk geçiş esnasındaetinilestradiol yoğun bir metabolizasyona uğrar ve yaklaşık % 20-65 gibi kayda değer bir ferdideğişkenlikle yaklaşık % 45 ortalama oral biyoyararlılık ile sonuçlanır. Dağılım:Etinilestradiol serum albuminine yüksek oranda fakat non-spesifik olarak (yaklaşık % 98) bağlanır ve SHBG serum konsantrasyonlarında bir artışa neden olur. Dağılım hacmi yaklaşık2,8-8,6 L/kg olarak bildirilmiştir. Biyotransformasyon:Etinilestradiol ince bağırsak ve karaciğerde presistemik konjugasyona uğrar. Etinilestradiol esas olarak aromatik hidroksilasyon ile metabolize olur ancak, pek çok hidroksillenmiş vemetillenmiş metabolitler oluşur ve bunlar serbest metabolit veya glukronid ve sülfatkonjugatları olarak bulunurlar. Metabolik klerens hızı 2,3 - 7 mL/dak/kg olarak bildirilmiştir. Eliminasyon:Etinilestradiol serum seviyeleri yarı ömürleri sırasıyla 1 saat ve 10-20 saat ile karakterize olan 2 dispozisyon fazında azalır. Etinilestradiol değişmemiş olarak atılmaz. Yaklaşık 1 günlükyarılanma ömrü olan metabolitler halinde böbrek ve safradan 4:6 oranında atılır. Doğrusallık / doğrusal olmayan durum:Etinilestradiol serum konsantrasyonları, MIRANOVA'nın günlük oral uygulamasından sonra yaklaşık 2 kat artar. Serumdan terminal dispozisyon fazının değişik yarılanma ömürlerine vegünlük alıma göre, etinilestradiolün sabit durum serum seviyelerine yaklaşık 1 hafta sonraulaşılır. 5.3. Klinik öncesi güvenlilik verileriTekrarlanan doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üreme toksisitesi üzerine yapılan geleneksel çalışmalara dayanan preklinik veriler, insanda özel bir risk olduğunugöstermemiştir. Ancak, yine de, seksüel steroidlerin hormona bağlı dokuların ve tümörlerinbüyümesini uyarabileceği akıldan çıkarılmamalıdır. 6. FARMASÖTİK ÖZELLİKLER6.1.Yardımcı maddelerin listesiLaktoz monohidrat (sığır kaynaklı) Magnezyum stearat Mısır nişastasıPovidon 25Nişasta prejelatinizeKalsiyum karbonatDemir oksit kırmızıDemir oksit sarıGliserol %85Glikol montanatMakrogol 6000Povidon 90 Sukroz Talk Titanyum dioksit 6.2. GeçimsizliklerYoktur. 6.3. Raf ömrü36 ay 6.4. Saklamaya yönelik özel uyarılar30°C altında oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriğiBir kutuda 1 x 21 tablet içeren takvimli blister ambalajda sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTakvimli ambalajın haftanın o gününe tekabül eden (örneğin, Pazartesi = Pt) tableti, aluminyum foli'ye bastırılarak çıkarılıp ve çiğnemeden bir miktar sıvı ile yutulur. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBayer Türk Kimya San. Ltd. Şti. Fatih Sultan Mehmet Mah. Balkan Cad. No: 53 34770 Ümraniye/İstanbulTel: 0216 528 36 00Faks: 0216 645 39 50 8. RUHSAT NUMARASI108/33 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 16.08.2000 Ruhsat yenileme tarihi: 10. KÜB'ün YENİLENME TARİHİ.../.../.... Bir grup KOK'u kapsayan epidemiyolojik çalışmalardan gelen tahmini sıklık. 'Venöz ve arteriyel tromboembolik olaylar' aşağıda belirtilen tıbbi kayıtları özetler: Periferik derin venöz oklüzyonu, tromboz ve embolizm/Pulmoner vasküler oklüzyon, tromboz, embolizm ve enfarktüs/Miyokard enfarktüsü/Serebral enfarktüs ve hemorajik olarakbelirtilmeyen inme Seçilmiş advers reaksiyonların tanımıKHK kullanan kadınlarda 4.4 Özel kullanım uyarıları ve önlemleri bölümünde daha ayrıntılı olarak ele alınmış miyokard infarktüsü, inme, geçici iskemik ataklar, venöz tromboz vepulmoner emboli dahil olmak üzere arteriyel ve venöz trombotik ve tromboembolik olaylardaartış riski gözlemlenmiştir. |
İlaç BilgileriMiranova 100 Mcg/20 Mcg Kaplı TabletEtken Maddesi: Levonorgestrel + Etinilestradiol Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.