Jardiance 10 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA URUN BILGISI1. BEŞERI TIBBİ ÜRÜNÜN ADIJARDIANCE 10 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir film kaplı tablet, 10 mg empagliflozin içerir. Yardımcı maddeler:Her bir film kaplı tablette, 154,3 mg laktoz anhidre eşdeğer laktoz monohidrat (inek sütünden elde edilir) bulunur. Yardımcı maddeler için Bölüm 6.1.'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tablet.Yuvarlak, açık sarı renkte, bikonveks, eğimli kenarlı film tablettir. Bir yüzünde S10 ve diğer yüzünde Boehringer Ingelheim logosu basılıdır (tablet çapı: 9,1 mm). 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarTip-2 diyabetes mellitusJARDIANCE, erişkinlerde, yeterli kontrol sağlanamayan Tip-2 diyabetes mellitus tedavisinde, diyet ve egzersizle birlikte; - İntolerans nedeniyle metformin kullanımının uygun bulunmadığı durumlarda monoterapiolarak - Diyabet tedavisi için kullanılan ilaçlara ek olarakKullanılmak üzere endikedir. Tedavi kombinasyonlarıyla ilgili çalışma sonuçları, glisemik kontrol, kardiyovasküler ve renal olaylar üzerindeki etkileri ve çalışılan popülasyonlar için Bölüm 4.4, 4.5 ve 5.1'e bakınız. Kalp yetersizliğiJARDIANCE yetişkinlerde semptomatik kronik kalp yetersizliğinin tedavisinde endikedir. Kronik böbrek hastalığıJARDIANCE yetişkinlerde kronik böbrek hastalığının tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Tip-2 diyabetes mellitusDiyabet tedavisinde, monoterapi şeklinde veya diğer ilaçlarla kombinasyonu şeklinde ekleme tedavisi olarak önerilen başlangıç dozu, günde bir kez 10 mg empagliflozindir. Günde bir kezempagliflozin 10 mg dozu tolere eden, eGFR değerleri >60 mL/dk/1,73 m2 olan ve daha sıkıbir glisemik kontrole ihtiyaç duyan hastalarda, doz, günde bir kez 25 mg'a yükseltilebilir.Maksimum günlük doz 25 mg'dır (Bkz. Aşağıdaki bilgiler ve Bölüm 4.4). Kalp yetersizliğiÖnerilen doz günde bir kez 10 mg empagliflozindir. Kronik böbrek hastalığıÖnerilen doz günde bir kez 10 mg empagliflozindir. Tüm endikasyonlarEmpagliflozin, bir sülfonilüre veya insülinle kombine şekilde kullanıldığında, hipoglisemi riskini azaltmak için sülfonilüre veya insülin dozunun düşürülmesi düşünülebilir (Bkz. Bölüm4.5 ve Bölüm 4.8). Eğer bir doz unutulursa, hasta hatırlar hatırlamaz alınmalıdır, ancak aynı gün içinde iki doz alınmamalıdır. Uygulama şekli:Tabletler yiyeceklerle birlikte veya yiyeceklerden ayrı olarak alınabilir. Bütün olarak su ile yutulmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Sınırlı deneyim nedeniyle, eGFR <20 mL/dk/1,73m2 olan hastalarda empagliflozin tedavisine başlanması önerilmez. eGFR'si <60 mL/dk/1,73m2 olan hastalarda günlük empagliflozin dozu 10 mg'dır. Tip 2 diyabetes mellitusu olan hastalarda empagliflozinin glikoz düşürücü etkisi, eGFR'si <45 mL/dk/1,73 m2 olan hastalarda azalır ve eGFR'si <30 mL/dk/1,73 m2 olan hastalardamuhtemelen bulunmamaktadır. Bu nedenle, eğer eGFR 45 mL/dk/1,73 m2'nin altına düşerse,gerekliyse ilave glikoz düşürücü tedavi düşünülmelidir (Bkz. Bölüm 4.4, 4.8, 5.1 ve 5.2). Karaciğer yetmezliği:Hepatik yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli hepatik yetmezliği olan hastalarda empagliflozin maruziyeti artar. Şiddetli karaciğer yetmezliği olan hastalardaterapötik deneyim sınırlıdır, bu nedenle bu hastalarda kullanımı önerilmez (Bkz. Bölüm 5.2). Pediyatrik popülasyon:Empagliflozinin çocuklarda ve ergenlerde etkililiği ve güvenliliği belirlenmemiştir. Veri bulunmamaktadır. Geriyatrik popülasyon:Yaş nedeniyle herhangi bir doz ayarlaması gerekli değildir. 75 yaş ve üzerindeki hastalarda hacim deplesyonu riskinin arttığı dikkate alınmalıdır (Bkz. Bölüm 4.4 ve 4.8). 4.3. KontrendikasyonlarEtkin maddeye veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılık (hipersensitivite) durumlarında kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriKetoasidozEmpagliflozin dahil, SGLT-2 inhibitörleri ile tedavi edilen diyabet hastalarında, hayati tehlike oluşturan ve fatal vakaları da içeren ketoasidoz vakaları bildirilmiştir. Bazı hastalardaketoasidoz, kan glikoz değerlerinde sadece orta düzeyde (14 mmol/L'nin (250 mg/dL) altında)bir yükselme şeklinde ortaya çıkan atipik bir tablo şeklinde görülmüştür. Ketoasidozvakalarının ortaya çıkma olasılığının, daha yüksek empagliflozinin dozlarıyla artıp artmadığıbilinmemektedir. Ketoasidozun diyabetes mellitusu olmayan hastalarda ortaya çıkma olasılığıdüşük olmasına rağmen, bu hastalarda da vakalar bildirilmiştir. Bulantı, kusma, anoreksi, abdominal ağrı, aşırı susama, nefes almakta güçlük, konfüzyon, olağandışı yorgunluk veya uyku hali gibi spesifik olmayan semptomların görülmesi halinde,ketoasidoz riski düşünülmelidir. Bu semptomlar ortaya çıkarsa, hasta, kan şekeri düzeyi neolursa olsun, derhal ketoasidoz açısından değerlendirilmelidir. Ketoasidoz şüphesi bulunan veya ketoasidoz tanısı konan hastalarda, empagliflozin tedavisi derhal sonlandırılmalıdır. Majör cerrahi işlemler veya akut ciddi hastalıklar nedeniyle hastaneye yatırılmış hastalarda tedaviye ara verilmelidir. Bu hastalarda ketonların izlenmesi önerilmektedir. Kan ketondüzeylerinin ölçülmesi idrar ölçümlerine tercih edilmelidir. Keton düzeyleri normaledöndükten ve hastanın durumu stabilize edildikten sonra empagliflozin tedavisi yenidenbaşlatılabilir. Empagliflozin tedavisine başlamadan önce, hastanın geçmişindeki ketoasidoza yatkınlık yaratan faktörler dikkate alınmalıdır. Ketoasidoz riski daha yüksek olan hastalar arasında, beta hücre fonksiyonu rezervi düşük olan hastalar (Örneğin, C-peptid düzeyi düşük tip-2 diyabet hastaları veya erişkinlerde latentotoimmün diyabeti olanlar veya pankreatit öyküsü olan hastalar), besin alımının kısıtlanmasınaveya şiddetli dehidratasyona neden olan durumlara sahip hastalar, insülin dozları azaltılmışhastalar ve akut hastalık, cerrahi veya alkol bağımlılığına bağlı olarak insülin gereksinimleriartmış hastalar bulunur. Bu hastalarda, SGLT-2 inhibitörleri dikkatli bir şekilde kullanılmalıdır.Daha önce SGLT-2 inhibitör tedavisi uygulanırken ketoasidoz görülen hastalarda, başka birtetikleyici faktör net olarak tanımlanıp çözümlenmedikçe, SGLT-2 inhibitör tedavisine yenidenbaşlanması önerilmez. JARDIANCE, Tip 1 diyabet hastalarında kullanılmamalıdır. Klinik çalışmalardan elde edilen veriler, insülin tedavisine ek olarak 10 mg ve 25 mg empagliflozin ile tedavi edilen Tip Idiyabet hastalarında, plaseboya göre ketoasidozun ortaya çıkma sıklığının arttığınıgöstermiştir. Böbrek YetmezliğiSınırlı deneyim nedeniyle eGFR'si <20 mL/dk/1,73 m2 olan hastalarda empagliflozin ile tedaviye başlanması önerilmemektedir. eGFR'si <60 mL/dk/1,73 m2 olan hastalarda günlük empagliflozin dozu 10 mg'dır (bkz. bölüm 4.2). Empagliflozinin glikoz düşürücü etkililiği böbrek fonksiyonuna bağlıdır ve eGFR'si <45 mL/dk/1,73 m2 olan hastalarda azalır ve eGFR'si <30 mL/dk/1,73 m2 olan hastalardamuhtemelen bulunmamaktadır (bkz. bölüm 4.2, 5.1 ve 5.2). Renal fonksiyonların izlenmesi Renal fonksiyonların aşağıdaki şekilde değerlendirilmesi önerilir: - Empagliflozin tedavisine başlamadan önce ve tedavi sırasında periyodik olarak, yani en azyılda bir kez (Bkz. Bölüm 4.2, 4.8, 5.1 ve 5.2). - Renal fonksiyonlar üzerinde negatif etkisi olabilecek ilaçlarla eş zamanlı herhangi birtedaviye başlamadan önce. Hacim deplesyonu riskiSGLT-2 inhibitörlerinin etki mekanizmasına dayanarak, glikozüriye eşlik eden osmotik diürez, kan basıncında orta dereceli bir düşüşe yol açabilir (Bkz. Bölüm 5.1). Bu nedenle, bilinenkardiyovasküler hastalığı olan, geçmişinde hipotansiyon öyküsü olup antihipertansif tedavi alanhastalar veya 75 yaş ve üzerindeki hastalar gibi, empagliflozine bağlı kan basıncı düşüşününrisk oluşturabileceği hastalarda dikkatli olunmalıdır. Empagliflozin tedavisi alan hastalarda, sıvı kaybına yol açan durumlar varsa (örneğin, gastrointestinal hastalıklar), hacim durumunun (örneğin, fiziksel muayene, kan basıncıölçümleri, hematokrit dahil laboratuvar testleri) ve elektrolitlerin dikkatle izlenmesi gerekir.Sıvı kaybı düzeltilinceye kadar, empagliflozin tedavisinin geçici olarak durdurulmasıdüşünülmelidir. Yaşlı hastalarEmpagliflozinin idrarda glikoz atılımı üzerindeki etkileri osmotik diürez ile ilişkilidir, bu durum hidrasyon durumunu etkileyebilir. 75 yaş ve üzerindeki hastalar, hacim deplesyonuaçısından daha büyük risk altında olabilirler. Hacim deplesyonu ile ilgili advers etkiler, plaseboile karşılaştırıldığında, empagliflozin ile tedavi edilen bu grup hastalarda daha fazlabildirilmiştir (Bkz. Bölüm 4.8). Bu nedenle, sıvı deplesyonuna yol açabilecek ilaçlarla (örneğin,diüretikler, ACE inhibitörleri) birlikte kullanılması halinde, bu hastaların sıvı alımlarına özelbir dikkat gösterilmelidir. Komplike idrar yolu enfeksiyonlarıEmpagliflozin ile tedavi edilen hastalarda, piyelonefrit ve ürosepsis içeren komplike idrar yolu enfeksiyonu vakaları raporlanmıştır (Bkz. Bölüm 4.8). Komplike idrar yolu enfeksiyonları olanhastalarda empagliflozin tedavisinin geçici olarak durdurulması düşünülmelidir. Perineumda nekrotizan fasiit (Fournier gangreni)SGLT2 inhibitörü kullanan diyabeti olan kadın ve erkek hastalarda, perineumda nekrotizan fasiit (Fournier gangreni olarak da bilinir) vakaları bildirilmiştir. Bu durum, seyrek ama ciddive potansiyel olarak hayatı tehdit eden bir olaydır ve acil cerrahi girişim ve antibiyotiktedavisini gerektirir. Hastalar, genital veya perineal bölgelerde ağrı, hassasiyet, eritem veya şişlik ile birlikte ateş veya kırıklık semptomlarından bazılarını birlikte hissetmeleri halinde doktora başvurmalarıkonusunda uyarılmalıdır. Ürogenital enfeksiyon veya perineal absenin, nekrotizan fasiittenönce ortaya çıkabileceği akılda tutulmalıdır. Eğer Fournier gangreninden şüphe edilirse,JARDIANCE tedavisi kesilmeli ve derhal tedavi (antibiyotikler ve cerrahi debridman dahil)başlanmalıdır. Alt ekstremite ampütasyonlarıBaşka bir SGLT2 inhibitörü ile devam eden uzun dönemli klinik çalışmalarda alt ekstremite amputasyon (başlıca, ayak parmağı) vakalarında artış gözlenmiştir. Bu durumun sınıf etkisiolup olmadığı bilinmemektedir. Tüm diyabet hastalarında olduğu gibi, hastalar rutin olarakkoruyucu ayak bakımı üzerine konsülte edilmelidir. Hepatik hasarKlinik çalışmalarda empagliflozin ile hepatik hasar vakaları bildirilmiştir. Empagliflozin ile hepatik hasar arasında bir nedensellik ilişkisi tespit edilmemiştir. Hematokrit yükselmesiEmpagliflozin tedavisi ile hematokritte yükselme gözlemlenmiştir (Bkz. Bölüm 4.8). Kronik böbrek hastalığıAlbüminürisi olan hastalar empagliflozin tedavisinden daha fazla yarar görebilir. İnfiltratif hastalık veya Takotsubo kardiyomiyopatisiİnfiltratif hastalığı veya Takotsubo kardiyomiyopatisi olan hastalar özel olarak çalışılmamıştır. Bu nedenle, bu hastalarda etkinlik belirlenmemiştir. İdrar laboratuvar değerlendirmeleriEtki mekanizmasına bağlı olarak, JARDIANCE alan hastalarda idrarda glikoz testi pozitif çıkacaktır. 1,5-anhidroglusitol (1,5-AG) testi ile etkileşimSGLT2 inhibitörleri alan hastalarda glisemik kontrolün değerlendirilmesinde, 1,5-AG ölçümlerinin güvenilir olmaması nedeniyle, glisemik kontrolün 1,5-AG testi ile izlenmesiönerilmez. Glisemik kontrolü izlemek için alternatif yöntemlerin kullanılması tavsiye edilir. LaktozTabletler laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glikoz- galaktoz malabsorbsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. SodyumJARDIANCE her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında sodyum içermez. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriFarmakodinamik etkileşimler:Diüretikler:Empagliflozin, tiyazid ve loop diüretiklerin diüretik etkisine ek etki yapabilir ve dehidratasyon ve hipotansiyon riskini arttırabilir (Bkz. Bölüm 4.4). İnsülin ve insülin salgılatıcılar:İnsülin ve sülfonilüreler gibi insülin salgılatıcılar hipoglisemi riskini arttırabilir. Bu nedenle, hipoglisemi riskini azaltmak için, empagliflozin ile kombine olarak kullanıldığında insülin veyainsülin salgılatıcıların daha düşük dozda kullanılması gerekebilir (Bkz. Bölüm 4.2, Bölüm 4.8). Farmakokinetik etkileşimler:Diğer ilaçların empagliflozin üzerindeki etkileri:In vitroveriler, insanlarda empagliflozinin primer metabolizma yolunun, üridin 5'-difosfoglukuronoziltransferazlar olan UGT1A3, UGT1A8, UGT1A9 ve UGT2B7 aracılığı ile glukuronidasyon olduğunu düşündürmektedir. Empagliflozin bir insan uptake taşıyıcısı olanOAT3, OATP1B1 ve OATP1B3 substratıdır, ancak OAT1 ve OCT2'nin substratı değildir.Empagliflozin, P-glikoprotein (P-gp) ve meme kanseri direnç proteininin (BCRP) birsubstratıdır.Empagliflozinin, UGT enzimleri ve OAT3'ün bir inhibitörü olan probenesid ile eş zamanlı uygulanması, empagliflozinin pik plazma konsantrasyonlarında (Cmaks) %26 oranında artışla vekonsantrasyon zaman eğrisi altında kalan alanda (EAA) %53 oranında yükselmeylesonuçlanmıştır. Bu değişiklikler, klinik olarak anlamlı kabul edilmemiştir. UGT indüksiyonunun (örneğin rifampisin veya fenitoin ile indüksiyon) empagliflozin üzerindeki etkisi çalışılmamıştır. Etkililikte muhtemel bir azalma riski nedeniyle, UGTenzimlerinin bilinen indükleyicileriyle eş zamanlı uygulanması önerilmez. Bu UGTenzimlerinin bir indükleyicisinin birlikte uygulanması gerekiyorsa, JARDIANCE'a yanıtıdeğerlendirmek için glisemik kontrolün izlenmesi uygundur. Gemfibrozil (OAT3 ve OATP1B1/B3 taşıyıcılarının bir in vitroinhibitörü) ile yapılan bir etkileşim çalışması, eş zamanlı kullanımı takiben, empagliflozin Cmaks değerinin %15 ve EAAdeğerinin %59 oranında arttığını göstermiştir. Bu değişiklikler klinik olarak anlamlı kabuledilmemiştir.Eş zamanlı rifampisin uygulanması ile OATP1B1/1B3 taşıyıcılarının inhibe edilmesi, empagliflozinin Cmaks değerinde %75 ve EAA değerinde %35 oranında artışla sonuçlanmıştır.Bu değişiklikler klinik olarak anlamlı kabul edilmemiştir. Bir P-gp inhibitörü olan verapamil ile birlikte veya verapamil olmaksızın uygulanması halinde, empagliflozin maruziyeti benzerdir. Bu durum, P-gp inhibisyonunun empagliflozin üzerindeklinik olarak anlamlı bir etkisinin olmadığını göstermiştir. Etkileşim çalışmaları, metformin, glimepirid, pioglitazon, sitagliptin, linagliptin, varfarin, verapamil, ramipril, simvastatin, torasemid ve hidroklorotiyazid ile eş zamanlı kullammlarmm,empagliflozinin farmakokinetiği üzerinde bir etkisinin olmadığını düşündürmektedir. Empagliflozinin diğer ilaçlar üzerindeki etkileri:Empagliflozin renal lityum atılımını artırabilir ve kan lityum seviyeleri düşebilir. Serum lityum konsantrasyonu, empagliflozin başlangıcından ve doz değişikliklerinden sonra daha sıkizlenmelidir. Lityum serum konsantrasyonunu izlemek için lütfen hastayı lityum reçete edendoktora sevk ediniz. In-vitroçalışmalara dayanarak, empagliflozin, CYP450 izoformlarını inhibe etmez, inaktive etmez veya indüklemez. Empagliflozin UGT1A1, UGT1A3, UGT1A8, UGT1A9 veyaUGT2B7'yi inhibe etmez. Bu nedenle, majör CYP450 veya UGT izoformlarının empagliflozinile ve bu enzimlerin substratları ile eş zamanlı uygulanması sonucunda ilaç-ilaç etkileşmesibeklenmez.Empagliflozin terapötik dozlarda P-gp'yi inhibe etmez. In-vitroçalışmalara dayanarak, empagliflozinin P-gp substratları ile etkileşmesi beklenmez. Bir P-gp substratı olan digoksininempagliflozin ile eş zamanlı kullanılması, digoksinin Cmaks değerinde %14 ve EAA değerinde%6 oranında artışa yol açmıştır. Bu değişikliklerin klinik olarak anlamlı olmadığıdüşünülmüştür.Empagliflozin, in vitrokoşullarda, klinik olarak anlamlı plazma konsantrasyonlarında, OAT3, OATP1B1 ve OATP1B3 gibi insan uptake taşıyıcılarını inhibe etmez ve bu uptaketaşıyıcılarının substratları ile ilaç-ilaç etkileşmesi beklenmez.Sağlıklı gönüllülerde yürütülen etkileşim çalışmaları, empagliflozinin, metformin, glimepirid, pioglitazon, sitagliptin, linagliptin, simvastatin, varfarin, ramipril, digoksin, diüretikler ve oralkontraseptiflerin farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi olmadığınıdüşündürmektedir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyona ilişkin bir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Veri mevcut değildir. 4.6. Gebelik ve laktasyonGebelik kategorisi:Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)JARDIANCE tedavisi sırasında uygun bir doğum kontrol yöntemi kullanılabilir. Bölüm 4.5'te açıklandığı gibi empagliflozinin, oral kontraseptiflerin farmakokinetiği üzerinde anlamlı birklinik etkisi olmadığı düşünülmektedir. Gebelik dönemiJARDIANCE'ın gebe kadınlarda kullanımına ilişkin yeterli veri yoktur. Hayvanlar üzerinde yapılan çalışmalar, gebelik / ve-veya / embriyonal / fetal gelişim / ve-veya / doğum / ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. Hayvan çalışmaları empagliflozinin geç gestasyon döneminde çok sınırlı bir oranda plasentaya geçtiğini göstermektedir. Ancak bu çalışmalar, erken embriyonik gelişim dönemi açısındandirekt veya indirekt zararlı bir etkiyi işaret etmemektedir. Bununla birlikte, hayvan çalışmaları,postnatal gelişim üzerinde advers etkiler göstermiştir (Bkz. Bölüm 5.3). Bir önlem olarak,gebelik döneminde JARDIANCE kullanımından kaçınılmalıdır. İnsanlara yönelik potansiyel risk bilinmemektedir. JARDIANCE gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiİnsanlarda empagliflozinin süte geçişi ile ilgili bir veri bulunmamaktadır. Hayvan çalışmalarından elde edilen mevcut toksikolojik veriler, empagliflozinin süte geçtiğinigöstermiştir. Yenidoğan/infant açısından bir risk göz ardı edilemez. JARDIANCE emzirmedöneminde kullanılmamalıdır. Üreme yeteneği/ FertiliteJARDIANCE için insan fertilitesi ile ilgili bir çalışma yürütülmemiştir. Hayvan çalışmaları, fertilite ile ilgili direkt veya indirekt zararlı bir etki göstermemiştir (Bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerJARDIANCE'ın araç ve makine kullanımı üzerindeki etkisi düşüktür. Hastalar, araç ve makine kullanımı sırasında, özellikle JARDIANCE'ı bir sülfonilüre ve/veya insülin ile kombine olarakalıyorlarsa, ortaya çıkabilecek hipoglisemiden kaçınmak için gerekli önlemleri almalarıkonusunda uyarılmalıdırlar. 4.8. İstenmeyen etkilerGüvenlilik profili özetiTip-2 diyabetes mellitusEmpagliflozinin güvenliliğini değerlendirmek üzere tip-2 diyabeti olan toplam 15.582 hasta klinik çalışmalara dahil edilmiştir. Bu hastalardan 10.004 kişi monoterapi olarak ya dametformin, bir sülfonilüre, pioglitazon, DPP-4 inhibitörleri veya insülin ile kombine şekildeempagliflozin almıştır. 18-24 hafta süreli, 3.534 hastanın dahil edildiği 6 plasebo kontrollü çalışmada, 1.183 hasta plasebo ile, 2.351 hasta ise empagliflozin ile tedavi edilmiştir. Empagliflozin ile tedavi edilenhastalardaki genel advers olay insidansı plasebo ile benzer bulunmuştur. En sık bildirilen adversreaksiyon, sülfonilüre veya insülin ile birlikte kullanıldığında, hipoglisemidir (seçilmiş adversreaksiyonların açıklaması bölümüne bakınız). Kalp yetersizliğiEMPEROR çalışmalarına 10 mg empagliflozin veya plasebo ile tedavi edilen, düşük ejeksiyon fraksiyonlu (N=3.726) veya korunmuş ejeksiyon fraksiyonlu (N=5.985) kalp yetersizliğihastaları dahil edilmiştir. Hastaların yaklaşık yarısının tip 2 diyabet hastası olduğu saptanmıştır.EMPEROR-Reduced ve EMPEROR-Preserved çalışmalarının havuz analizinde en sık görülenadvers reaksiyon hacim deplesyonu (empagliflozin 10 mg: %11,4, plasebo: %9,7) olmuştur. Kronik böbrek hastalığıEMP A-K TDNEY çalışmasına 10 mg empagliflozin veya plasebo ile tedavi edilen kronik böbrek hastaları (N = 6.609)dahil edilmiştir. Hastaların yaklaşık %44'ünde tip 2 diyabetes mellitusvardır. EMPA-KIDNEY çalışmasında, en sık görülen advers olaylar; gut (empagliflozin %7,0- plasebo %8,0) ve akut böbrek hasarı (empagliflozin %2,8 - plasebo %3,5) olup, plasebo alanhastalarda daha sık raporlanmıştır.Empagliflozinin genel güvenlilik profili genel olarak incelenen endikasyonlarda tutarlı olmuştur. Advers reaksiyonların çizelgeli listesiPlasebo kontrollü çalışmalarda empagliflozin alan hastalarda bildirilen ve sistem-organ sınıfına ve MedDRA tercih edilen terimlerine göre sınıflandırılan advers reaksiyonlar aşağıdaki tablodasunulmuştur (Tablo 1). Advers reaksiyonlar mutlak sıklık dikkate alınarak listelenmiştir. Sıklık dereceleri şu şekilde tanımlanır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila<1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor). Tablo 1: Plasebo kontrollü çalışmalarda ve pazarlama sonrası deneyimde bildirilen advers reaksiyonların çizelgeli listesi (MedDRA)
Seçilmiş advers etkilerin açıklamasıHipoglisemiHipoglisemi sıklığı, ilgili çalışmalardaki arka plan tedavisine bağlıdır ve empagliflozin ve plasebo için, monoterapi, metformine ekleme tedavisi, metformin ile birlikte veya birlikteolmayan pioglitazona ekleme tedavisi, linagliptin ve metformine ekleme tedavisi ve standartbakım tedavisine ekleme tedavisinde benzer bulunmuştur. Hipoglisemi sıklığı, daha önce ilaçlatedavi edilmemiş hastalarda, empagliflozinin metforminle kombinasyonu ile empagliflozin vemetformin bileşenlerinden her birinin ayrı ayrı uygulanması karşılaştırıldığında da benzerbulunmuştur. Metformin ve bir sülfonilüre tedavisine ekleme tedavisi (empagliflozin 10 mg: %16,1, empagliflozin 25 mg: %11,5, plasebo: %8,4), metformin ile birlikte veya birlikte olmayan vebir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi(insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde empagliflozin 10 mg: %19,5,empagliflozin 25 mg: %28,4, plasebo: %20,6; 78 hafta süreli çalışma boyunca, empagliflozin10 mg ve empagliflozin 25 mg: %36,1, plasebo: %35,3) ve metforminle birlikte veya birlikteolmayan MDI (çoklu doz enjeksiyon) insülin tedavisine ekleme tedavisi olarak kullanıldığında(insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde empagliflozin 10 mg: %39,8,empagliflozin 25 mg: %41,3, plasebo: %37,2; 52 hafta süreli çalışma boyunca, empagliflozin10 mg: %51,1, empagliflozin 25 mg: %57,7, plasebo: %58) sıklıklarda artış kaydedilmiştir. EMPEROR kalp yetersizliği çalışmalarında, sülfonilüre ya da insüline ek olarak kullanıldığında benzer hipoglisemi sıklığı belirtilmiştir (empagliflozin 10 mg: %6,5, plasebo: %6,7). Majör hipoglisemi (yardım gerektiren hipoglisemi)Plasebo ile karşılaştırıldığında, monoterapi, metformin tedavisine ekleme tedavisi, metformin ve bir sülfonilüre tedavisine ekleme tedavisi ve metformin ile birlikte veya birlikte olmayanpioglitazon tedavisine ekleme tedavisi, linagliptin ve metfomin tedavisine ekleme tedavisi,standart bakım tedavisine ilave olarak ve daha önce ilaçla tedavi edilmemiş hastalarda,metformin ile empagliflozin kombinasyonu tedavisi, empagliflozin ve metforminbileşenlerinden her birinin ayrı ayrı uygulanmasıyla yapılan tedavi ile karşılaştırıldığında,majör hipoglisemide bir artış gözlenmemiştir. Metforminle birlikte olan veya birlikte olmayanve bir sülfonilüre ile birlikte olan veya birlikte olmayan bazal insülin tedavisine ekleme tedavisiolarak kullanıldığında (insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde,empagliflozin 10 mg: %0, empagliflozin 25 mg: %1,3, plasebo: %0; 78 hafta süreli çalışmaboyunca, empagliflozin 10 mg: %0, empagliflozin 25 mg: %1,3, plasebo: %0) ve metforminlebirlikte veya birlikte olmayan MDI insüline ekleme tedavisi olarak kullanıldığında (insülininayarlanamadığı ilk 18 haftalık tedavi döneminde empagliflozin 10 mg: %0,5, empagliflozin 25 mg: %0,5, plasebo: %0,5 ve 52 hafta süreli çalışma boyunca empagliflozin 10 mg: %1,6, empagliflozin 25 mg: %0,5, plasebo: %1,6) sıklıkta artış kaydedilmiştir. EMPEROR kalp yetersizliği çalışmalarında, diyabeti olan hastalar sülfonilüre veya insüline ek olarak empagliflozin ve plasebo (empagliflozin 10 mg: %2,2, plasebo: %1,9) ile tedaviedildiğinde benzer sıklıkta majör hipoglisemi gözlenmiştir. Vajinal moniliazis, vulvovaünit, balanit ve diğer genital enfeksiyonlarVajinal moniliazis, vulvovajinit, balanit ve diğer genital enfeksiyonlar, empagliflozin (empagliflozin 10 mg: %4, empagliflozin 25 mg: %3,9) ile tedavi edilen hastalarda plaseboya(%1) göre daha sık bildirilmiştir. Bu enfeksiyonlar, plasebo ile karşılaştırıldığında,empagliflozin ile tedavi edilen kadınlarda daha sık bildirilmiştir. Sıklıktaki farklılıklarerkeklerde daha az belirgindir. Genital sistem enfeksiyonları hafif veya orta şiddettedir. EMPEROR kalp yetersizliği çalışmalarında, plasebo uygulananlarla karşılaştırıldığında, empagliflozin tedavisi uygulananlarda bu enfeksiyonların sıklığı, diyabeti olmayan hastalaragöre (empagliflozin 10 mg: %1,7, plasebo: %0,7) diyabeti olan hastalarda daha yüksektir(empagliflozin 10 mg: %2,3, plasebo: %0,8). Ürinasyonda artışÜrinasyonda artış (önceden tanımlanmış terimler olan pollaküri, poliüri ve noktüri dahil), plaseboya (%1,4) göre, empagliflozin (empagliflozin 10 mg: %3,5, empagliflozin 25 mg: %3,3)ile tedavi edilen hastalarda daha yüksek sıklıkta gözlenmiştir. Artmış ürinasyon genellikle hafifveya orta şiddettedir. Bildirilen noktüri sıklığı, empagliflozin ve plasebo için benzerdir (<%1). EMPEROR kalp yetersizliği çalışmalarında, empagliflozin ve plasebo ile tedavi edilmiş hastalarda benzer sıklıklarda artmış idrara çıkma gözlenmiştir (empagliflozin 10 mg: %0,9,plasebo: %0,5). İdrar yolu enfeksiyonuAdvers olay olarak bildirilen idrar yolu enfeksiyonunun genel sıklığı, empagliflozin 25 mg ve plasebo grubunda benzer (%7 ve %7,2) ve empagliflozin 10 mg grubunda daha yüksekbulunmuştur (%8,8). Plaseboya benzer şekilde, empagliflozin grubunda da idrar yoluenfeksiyonları, kronik veya tekrarlayan idrar yolu enfeksiyonu öyküsü bulunan hastalarda dahasık bildirilmiştir. İdrar yolu enfeksiyonlarının şiddeti (hafif, orta, şiddetli), empagliflozin veplasebo grubundaki hastalarda benzer olmuştur. İdrar yolu enfeksiyonları kadınlarda,empagliflozin ile tedavi edilen grupta plaseboya göre daha sık bildirilirken, erkeklerde birfarklılık gözlenmemiştir. Hacim deplesyonuHacim deplesyonunun (önceden tanımlanmış terimler olan kan basıncında (ambulatuvar) düşüş, sistolik kan basıncında düşüş, dehidratasyon, hipotansiyon, hipovolemi, ortostatikhipotansiyon ve senkop dahil) genel sıklığı, empagliflozin (empagliflozin 10 mg: %0,6,empagliflozin 25 mg: %0,4) ve plasebo (%0,3) ile tedavi edilen hastalar arasında benzerbulunmuştur. Hacim deplesyonu olaylarının sıklığı, empagliflozin 10mg (%2,3) veya 25 mg(%4,3) ile tedavi edilen 75 yaş ve üzerindeki hastalarda, plasebo (%2,1) ile tedavi edilenleregöre artmıştır. Kan kreatinin düzeyinde yükselme/glomerüler filtrasyon hızında azalmaKan kreatinin düzeyinde yükselme ve glomerüler filtrasyon hızında azalma olan hastaların genel sıklığı, empagliflozin ve plasebo ile tedavi edilen hastalar arasında benzer bulunmuştur(kan kreatininde yükselme: Empagliflozin 10 mg %0,6, empagliflozin 25 mg %0,1, plasebo%0,5; glomerüler filtrasyon hızında azalma: Empagliflozin 10 mg %0,1, empagliflozin 25 mg%0, plasebo %0,3). Empagliflozin ile tedavi edilen hastalarda, kreatinin düzeyinde başlangıçtaki yükselmeler ve tahmin edilen glomerüler filtrasyon hızında başlangıçtaki azalmalar, tedavinin devamı sırasındagenellikle geçici özellikte veya ilaç tedavisinin kesilmesinden sonra geri dönüşümlü olmuştur. Bunlarla tutarlı olarak, EMPA-REG OUTCOME çalışmasında, empagliflozin ile tedavi edilen hastalarda başlangıçta eGFR düzeyinde bir düşüş (ortalama 3 mL/dk/1,73 m2) yaşanmıştır.Sonrasında, devam eden tedavi sırasında eGFR korunmuştur. Tedavinin kesilmesinden sonraortalama eGFR başlangıç düzeylerine dönmüştür, bu durum, bu böbrek fonksiyondeğişikliklerinde akut hemodinamik değişikliklerin rol oynayabileceğini düşündürür. Bu olayayrıca EMPEROR kalp yetersizliği çalışmalarında ve EMPA-KIDNEY çalışmasında dagözlenmektedir. Serum lipidlerinde artışPlasebo karşısında empagliflozin 10 mg ve 25 mg için başlangıca göre ortalama yüzde artışlar sırasıyla şu şekildedir: total kolesterol, %3,5'e karşı %4,9 ve %5,7; HDL-kolesterol, %0,4'ekarşı %3,3 ve %3,6; LDL-kolesterol, %7,5'e karşı %9,5 ve %10,0; trigliseritler, %10,5'e karşı%9,2 ve %9,9. Hematokrit artışıHematokritte başlangıca göre ortalama değişimler, plasebo için %0,1 karşısında empagliflozin 10 mg ve 25 mg için sırasıyla %3,4 ve %3,6 olmuştur. EMPA-REG OUTCOME çalışmasında,tedavi durdurulduktan sonra 30 günlük bir takip dönemini takiben hematokrit değerleribaşlangıç değerlerine dönmüştür. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiSemptomlarKontrollü klinik çalışmalarda, sağlıklı gönüllülerde empagliflozin 800 mg'a kadar tek doz uygulaması ve tip-2 diyabeti olan hastalarda günde 100 mg'a kadar çoklu doz uygulaması,herhangi bir toksisite göstermemiştir. Empagliflozin, idrarla glikoz atılımını arttırarak idrarhacminde artışa yol açmıştır. İdrar hacminde gözlenen artış, doza bağımlı değildir ve klinikolarak anlamlı bulunmamıştır. İnsanlarda 800 mg'ın üstündeki dozlarda bir deneyim yoktur. TedaviDoz aşımı halinde, hastanın klinik durumuna uygun bir tedavi başlanmalıdır. Empagliflozinin hemodiyaliz ile uzaklaştırılması çalışılmamıştır. 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diyabet Tedavisinde Kullanılan İlaçlar, Kan Glikozunu Düşüren İlaçlar, İnsülinler Hariç, Sodyum-Glikoz Ko-Transporter 2 (SGLT2) İnhibitörleriATC kodu: A10BK03 Etki mekanizması:Empagliflozin, geri dönüşlü, oldukça potent (ICR50 1,3 nmol) ve selektif kompetetif bir sodyum- glikoz ko-transporter 2 (SGLT-2) inhibitörüdür. Empagliflozin, glikozun periferikdokulara taşınması için önemli olan diğer glikoz taşıyıcılarını inhibe etmez ve bağırsakta glikozabsorpsiyonundan sorumlu majör taşıyıcı olan SGLT-2 için SGLT-l'e göre 5000 kat dahaseçicidir. SGLT-2 böbrekte oldukça fazla eksprese edilir, diğer dokulardaki ekspresyonu ise yayoktur ya da çok düşüktür. Asıl taşıyıcı olarak, glikozun glomerüler filtrattan, dolaşıma geriemiliminden sorumludur. Tip-2 diyabeti ve hiperglisemisi olan hastalarda daha yüksekmiktarda glikoz filtre edilir ve geri emilir. Empagliflozin, tip 2 diyabet hastalarında renal glikoz geri emilimini azaltarak glisemik kontrolü iyileştirir. Böbreklerden bu glikuretik mekanizma aracılığı ile uzaklaştırılan glikoz miktarı, kanglikoz konsantrasyonuna ve GFR'ye bağımlıdır. Tip-2 diyabeti ve hiperglisemisi olanhastalarda SGLT-2 inhibisyonu, idrarda aşırı glikoz atılımına yol açar. Ayrıca, empagliflozinkullanımına başlanması, sodyum atılımını arttırır ve bu durum da osmotik diürez veintravasküler hacmin azalması ile sonuçlanır. Tip-2 diyabeti olan hastalarda, empagliflozinin ilk dozundan hemen sonra idrarda glikoz atılımı artar ve 24 saat süreli doz aralığı boyunca devam eder. 4 haftalık tedavi döneminin sonunda,idrarda glikoz atılımda artış sağlanmıştır ve bu miktar, ortalama yaklaşık 78 g/gün olmuştur.Tip-2 diyabetli hastalarda idrarda glikoz atılımının artması, plazma glikoz düzeylerinin anidüşüşü ile sonuçlanmıştır. Empagliflozin hem açlık hem de tokluk plazma glikoz düzeylerini iyileştirir. Empagliflozinin etki mekanizması beta hücrelerinin fonksiyonundan ve insülin yolağından bağımsızdır ve budurum hipoglisemi riskinin düşük olmasına katkıda bulunur. Homeostaz ModelDeğerlendirmesi-P (HOMA- P) dahil, beta hücre fonskiyonunun yerini tutan göstergelerde deiyileşme kaydedilmiştir. Ayrıca, idrar glikoz atılımı, vücut yağ kaybı ve vücut ağırlığınınazalması ile bağlantılı olarak kalori kaybını tetikler. Empagliflozin ile gözlenen glikozüri,diürez ile seyreder, bu da kan basıncının sürekli bir şekilde orta derecede düşüşüne katkıdabulunabilir. Empagliflozin ayrıca sodyum geri emilimini azaltır ve distal tübüle ulaşan sodyum miktarını artırır. Bu durum, tübüloglomerüler geri beslemesinin artırılması ve intraglomerüler basıncınazaltılması, düşük NT-proBNP değerleri ile kanıtlandığı üzere kardiyak yeniden modellenme,dolum basınçları ve diyastolik fonksiyon üzerine faydalı olabilecek kalbin hem ön hem de ardyükünün düşürülmesi, sempatik aktivitenin azaltılması ve sol ventrikül duvar stresininazaltılması, bunların yanı sıra böbrek yapısını ve fonksiyonunu koruma dahil ancak bunlarlasınırlı olmamak üzere birçok fizyolojik işlevi etkileyebilir. Hematokritte artış, vücut ağırlığındave kan basıncında azalma gibi diğer etkiler, faydalı kardiyak ve böbrek etkilerine ilave katkısağlayabilir. Klinik etkililik ve güvenlilik Tip-2 diyabetes mellitusGlisemik kontrolün iyileşmesi ve kardiyovasküler morbidite ve mortalitenin azalması, Tip 2 diyabet tedavisinin ayrılmaz bir parçasıdır. 12 çift kör, plasebo ve aktif kontrollü klinik çalışmada, Tip 2 diyabeti olan toplam 14.663 hastada glisemik etkililik ve kardiyovasküler sonuçlar değerlendirilmiştir. Bu çalışmalarda9.295 hasta empagliflozin kullanmıştır (empagliflozin 10 mg: 4.165 hasta, empagliflozin 25mg: 5.130 hasta). 5 çalışmanın süresi 24 haftadır. Bu çalışmaların uzatmalarında ve diğerçalışmalarda hastalar, 102 haftaya kadar sürelerle empagliflozin kullanmıştır. Empagliflozinin monoterapi ve metformin, pioglitazon, bir sülfonilüre, DPP-4 inhibitörleri ve insülin ile kombine olarak kullanılması, HbA1c, açlık plazma glikozu (APG), vücut ağırlığı,sistolik ve diyastolik kan basıncında klinik olarak anlamlı iyileşmelere yol açmıştır.Empagliflozin 25 mg grubunda, empagliflozin 10 mg ve plasebo gruplarına göre, %7'den dahadüşük HbA1c düzeyi hedefine ulaşan hasta oranı daha yüksektir ve daha az sayıda hastaglisemik kurtarma tedavisine ihtiyaç duymuştur. Başlangıç HbA1c düzeyinin daha yüksekolması HbA1c düzeyinde daha fazla düşüş ile ilişkili bulunmuştur. Ayrıca, standart bakımtedavisine ilave olarak uygulanan empagliflozin, Tip 2 diyabeti ve tanımlanmış kardiyovaskülerhastalığı olanlarda kardiyovasküler mortaliteyi azaltmıştır. MonoterapiEmpagliflozinin monoterapi olarak etkililiği ve güvenliliği, daha önce tedavi edilmemiş hastalarda, çift kör, plasebo kontrollü ve aktif kontrollü 24 hafta süreli bir çalışmadadeğerlendirilmiştir. Empagliflozin ile tedavi, plasebo ile karşılaştırıldığında, HbA1c düzeyindeistatistiksel olarak anlamlı (p<0,0001) bir düşüşe (Tablo 2) ve APG değerlerinde klinik olarakönemli bir azalmaya yol açmıştır. Başlangıç HbA1c değeri >%8,5 olan hastaların (N=201) önceden belirlenmiş bir analizinde, HbA1c düzeyinde başlangıca göre azalma oranı, empagliflozin 10 mg için %-1,44, 25 mg için%-1,43, sitagliptin için %-1,04'dür ve plasebo grubunda %0,01 oranında artış olmuştur. Bu çalışmanın çift kör, plasebo kontrollü uzatmasında, HbA1c değerinde azalma, kilo kaybı ve kan basıncında düşüş 76 haftaya kadar devam etmiştir. Tablo 2: 24 hafta süreli plasebo kontrollü empagliflozin monoterapisi çalışmasının etkililik sonuçları^
Kombinasyon tedavisi Metformin, sülfonilüre, pioglitazon tedavisine ekleme tedavisi olarak empagliflozinMetformin ve bir sülfonilüre veya metformin ile birlikte olan veya birlikte olmayan pioglitazontedavisine ekleme tedavisi olarak empagliflozin kullanılması, HbA1c düzeylerinde ve vücutağırlığında, plaseboya göre, istatistiksel olarak anlamlı (p<0,0001) azalmalarla sonuçlanmıştır(Tablo 3). Ayrıca, APG değerlerinde, sistolik ve diyastolik kan basıncında da, plaseboya göre,klinik olarak anlamlı azalmalar görülmüştür.Bu çalışmaların çift kör, plasebo kontrollü uzatmalarında, HbA1c, vücut ağırlığı ve kan basıncındaki azalmalar 76. haftaya kadar devam etmiştir. Tablo 3: 24 hafta süreli plasebo kontrollü çalışmaların etkililik sonuçları^
Daha önce ilaç tedavisi almamış hastalarda metformin ile kombinasyonDaha önce ilaç tedavisi almamış hastalarda empagliflozinin etkililiğini ve güvenliliğinideğerlendirmek için 24 hafta süreli faktöriyel tasarımlı bir çalışma yürütülmüştür. Metforminile kombine empagliflozin tedavisi (günde iki kez verilen 5 mg ve 500 mg; 5 mg ve 1000 mg;12,5 mg ve 500 mg, 12,5 mg ve 1000 mg), HbA1c değerlerinde istatistiksel olarak anlamlıiyileşmeler sağlamış (Tablo 4) ve APG değerleri (bileşenlerin her biri ile tek tekkarşılaştırıldığında) ve vücut ağırlığında (metforminle karşılaştırıldığında) daha fazla azalmayaneden olmuştur.Tablo 4: Metformin ve empagliflozin kombinasyonunu her bir bileşen ile karşılaştıran 24. haftadaki etkililik sonuçlarıa
Metformin ve linagliptin tedavisi ile yeterli kontrol sağlanamayan hastalarda empagliflozinMetformin ve 5 mg linagliptin tedavisi ile yeterli kontrol sağlanamayan hastalarda, gerekempagliflozin 10 mg, gerekse empagliflozin 25 mg ile uygulanan tedavi, plaseboylakarşılaştırıldığında, HbA1c düzeylerinde ve vücut ağırlığında istatistiksel olarak anlamlı(p<0,0001) düşüşle sonuçlanmıştır (Tablo 5). Ek olarak, APG, sistolik ve diyastolik kanbasıncında da, plaseboya göre klinik olarak anlamlı düşüş sağlamıştır.Tablo 5: Metformin ve linagliptin 5 mg tedavisi ile yeterli kontrol sağlanamayan hastalarda 24 hafta süreli plasebo kontrollü bir çalışmanın etkililik sonuçları
Başlangıç HbA1c değeri %8,5 veya daha yüksek olan önceden belirlenmiş bir hasta alt grubunda, HbA1c değerinde 24. haftada başlangıca göre düşüş oranı, plaseboya göre,empagliflozin 10 mg ve empagliflozin 25 mg ile -%1,3 olmuştur (p<0,0001). Metformine ekleme tedavisi olarak empagliflozin için 24 aylık veri - Glimepirid ile karşılaştırmaTek başına metformin ile yeterli glisemik kontrolün sağlanamadığı hastalarda, empagliflozin 25 mg'ın etkililik ve güvenliliğini glimepirid (günde 4 mg'a kadar) ile karşılaştıran birçalışmada, günlük empagliflozin tedavisi, glimeprid ile karşılaştırıldığında, HbA1c değerindedaha üstün bir azalma (Tablo 6) ve APG değerinde klinik olarak anlamlı bir azalma ilesonuçlanmıştır. Günlük empagliflozin tedavisi, glimepirid ile karşılaştırıldığında, vücutağırlığında, sistolik ve diyastolik kan basıncında istatistiksel olarak anlamlı bir azalma sağlamışve istatistiksel olarak anlamlı oranda daha az hastada hipoglisemik olaylar ortaya çıkmıştır(empagliflozin için %2,5, glimepirid için %24,2, p<0,0001). Tablo 6: Metformine ekleme tedavisi olarak empagliflozin ile glimepiridi karşılaştıran bir aktif kontrollü çalışmanın 104. haftada etkililik sonuçları^
İnsüline ekleme tedavisi Çoklu günlük dozda insülin tedavisine ekleme tedavisi olarak empagliflozinMetformin tedavisi ile birlikte olan veya olmayan çoklu günlük dozdaki insülin tedavisineekleme tedavisi olarak kullanılan empagliflozinin etkililiği ve güvenliliği, çift kör, plasebokontrollü, 52 hafta süreli bir çalışmada değerlendirilmiştir. İlk 18 hafta ve son 12 hafta boyunca,insülin dozu sabit tutulmuş ancak 19-40. haftalar arasında açlık glikoz düzeyleri <100 mg/dL'ye[5,5 mmol/L] ve tokluk glikoz düzeyleri <140 mg/dL'ye [7,8 mmol/L] ulaşmak üzereayarlanmıştır.18. haftada empagliflozin, plaseboya göre, HbA1c düzeylerinde istatistiksel olarak anlamlı iyileşme sağlamıştır (Tablo 7). 52. haftada empagliflozin tedavisi, plaseboya göre, HbA1c düzeylerinde ve insülin kullanımında anlamlı bir azalma sağlamış ve APG değerinde düşüş ve kilo kaybı ilesonuçlanmıştır. Tablo 7: Metformin ile birlikte veya birlikte olmayan çoklu günlük dozlardaki insüline ekleme tedavisi olarak kullanılan empagliflozin için yürütülen plasebo kontrollü bir çalışmada 18. ve52. haftadaki etkililik sonuçları
Bazal insülin tedavisine ekleme tedavisi olarak empagliflozinMetformin ve/veya bir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi olarak empagliflozinin etkililiği ve güvenliliği, 78 hafta süreli bir çift kör,plasebo kontrollü çalışmada değerlendirilmiştir. İlk 18 haftada insülin dozu sabit tutulmuş,ancak sonraki 60 hafta süresince APG <110 mg/dL düzeylerini sağlamak üzere ayarlanmıştır. 18. haftada empagliflozin, HbA1c düzeylerini istatistiksel olarak anlamlı oranda iyileştirmiştir (Tablo 8). 78. haftada empagliflozin, plasebo ile karşılaştırıldığında, HbA1c değerinde ve insülin kullanımında istatistiksel olarak anlamlı bir azalma oluşturmuştur. Ayrıca empagliflozin, APG,vücut ağırlığı ve kan basıncında da düşüş sağlamıştır. Tablo 8: Metformin veya bir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi olarak kullanılan empagliflozin için yürütülen bir plasebo kontrollüçalışmanın 18. ve 78. haftalardaki etkililik sonuçları^
Renalyetmezliği olan hastalar, 52 hafta süreli plasebo kontrollü verilerRenal yetmezliği olan hastalarda antidiyabetik tedaviye ekleme tedavisi olarak empagliflozininetkililiği ve güvenliliği, 52 hafta süreli, çift kör plasebo kontrollü bir çalışmadadeğerlendirilmiştir. Empagliflozin tedavisi, plasebo ile karşılaştırıldığında, 24. haftada, HbA1cdüzeylerinde istatistiksel olarak anlamlı bir azalma (Tablo 9) ve APG değerlerinde klinik olarakanlamlı bir iyileşme ile sonuçlanmıştır. HbA1c, vücut ağırlığı ve kan basıncındaki iyileşmeler52. haftaya kadar devam etmiştir.
Kardiyovasküler sonuçlarÇift kör, plasebo kontrollü EMPA-REG OUTCOME çalışması, tip 2 diyabeti ve tanımlanmış kardiyovasküler hastalığı olan hastalarda, standart bakım tedavisine ek olarak uygulananempagliflozin 10 mg ve empagliflozin 25 mg dozlarını alan hasta havuzu plasebo ilekarşılaştırmıştır. Toplam 7.020 hasta tedavi edilmiş (empagliflozin 10 mg: 2.345, empagliflozin25 mg: 2.342, plasebo: 2.333) ve medyan 3,1 yıl süreyle takip edilmiştir. Ortalama yaş 63,ortalama HbA1c %8,1'dir ve hastaların %71,5'i erkektir. Başlangıçta hastaların %74'ümetformin, %48'i insülin ve %43'ü bir sülfonilüre ile tedavi edilmiştir. Hastaların yaklaşıkyarısının (%52,2) eGFR değeri 60-90 mL/dk/1,73 m2, %17,8'nin 45-60 mL/dk/1,73 m2 ve%7,7'sinin 30-45 mL/dk/1,73 m2 olarak tespit edilmiştir. 12. haftada HbA1c'de uyarlanmış ortalamadaki (SE) iyileşme, plasebo grubu için başlangıçtaki %0,11 (0,02) değeri ile karşılaştırıldığında, empagliflozin 10 mg grubunda %0,65 (0,02) veempagliflozin 25 mg grubunda %0,71 (0,02) olarak gözlenmiştir. İlk 12 haftadan sonra glisemikkontrol, araştırmacı tedaviden bağımsız olarak optimize edilmiştir. Bu nedenle etki 94. haftadaazaltılmış, HbA1c değerindeki uyarlanmış ortalama iyileşme, plasebo grubunda %0,08 (0,02),empagliflozin 10 mg grubunda %0,5 (0,02) ve empagliflozin 25 mg grubunda %0,55 (0,02)bulunmuştur. Empagliflozin, primer kombine sonlanım noktası olan kardiyovasküler ölüm, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmenin önlenmesinde, plaseboya göre üstünbulunmuştur. Tedavi etkisi, kardiyovasküler ölümde anlamlı bir azalma ile sağlanmış, fatalolmayan miyokard enfarktüsü veya fatal olmayan inmede anlamlı bir değişiklik olmamıştır.Kardiyovasküler ölümdeki azalma, empagliflozin 10 mg ve empagliflozin 25 mg içinkarşılaştırılabilir bulunmuştur (Şekil 1) ve genel yaşam süresindeki iyileşme ile dedoğrulanmıştır (Tablo 10). EMPA-REG OUTCOME çalışmasında empagliflozininkardiyovasküler ölüm, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmede bileşikprimer sonlanım noktası üzerindeki etkisi, glisemik kontrolden veya renal fonksiyonundan (eGFR) büyük ölçüde bağımsız olmuştur ve genel olarak 30 mL/dakika/1,73m1 eGFR değerine kadar inen eGFR kategorileri arasında tutarlı olmuştur. Kardiyovasküler mortaliteyi önlemedeki etkililiği, empagliflozin ile birlikte DPP-4 inhibitörü kullanan hastalarda veya siyah ırktan olanlarda tam olarak belirlenmemiştir, çünkü bu gruplarınEMPA-REG OUTCOME çalışmasındaki temsilleri sınırlıdır. Tablo 10: Bileşik primer sonlanım noktası için tedavi etkisi, bileşenleri ve mortalitea
Şekil 1 - EMPA-REG OUTCOME çalışmasında kardiyovasküler ölüme kadar geçen zaman Her bir empagliflozin dozuna karşılık plasebo
9 -|8-T65 HPlaseboaaEMPAGLİFLOZİN ^10 mg25 mgorjnÖ,___
Hastaneye yatış gerektiren kalp yetersizliğiEMPA-REG OUTCOME çalışmasında, empagliflozin, plasebo ile karşılaştırıldığında, hastaneye yatış gerektiren kalp yetersizliği riskini düşürmüştür (empagliflozin %2,7, plasebo%4,1; HR (Tehlike Oranı) 0,65, %95 GA = 0,5, 0,85). NefropatiEMPA-REG OUTCOME çalışmasında, ilk nefropati olayına kadar olan süre boyunca, empagliflozine (%12,7) kıyasla plasebo (18,8) için HR 0,61 (%95 GA 0,53, 0,7) olmuştur. Ayrıca, empagliflozin (%49,7) plaseboya kıyasla (%28,8), başlangıçta makroalbüminürisi olan hastalarda, daha yüksek (HR 1,82, %95 GA 1,40, 2,37) sürekli normo- veya mikro-albüminürioluşumu göstermiştir. Açlıkpplazma glikozu4 adet plasebo kontrollü çalışmada, empagliflozin monoterapisi veya metformin, pioglitazon veya metformin + bir sülfonilüre tedavisine ekleme tedavisi, APG değerinde başlangıca göre,plasebo (7,4 mg/dL [0,41 mmol/L]) ile karşılaştırıldığında, empagliflozin 10 mg için -20,5mg/dL [-1,14 mmol/L], empagliflozin 25 mg için -23,2 mg/dL [-1,29 mmol/L] ortalamadeğişiklikle sonuçlanmıştır. Bu etki 24 haftadan sonra gözlenmiştir ve 76 hafta süresince devametmiştir. 1 mg/dL, empagliflozin 10 mg: -35,7 mg/dL, empagliflozin 25 mg: -36,6 mg/dL). Başlangıç HbA1c>%10 (yüksek) olan hastalar3 Faz III çalışmasının önceden belirlenmiş havuz analizinde, şiddetli hiperglisemisi olan (N=184, ortalama başlangıç HbA1c %11,15) hastalarda, açık etiketli empagliflozin 25 mgtedavisi, 24. haftada, HbAlc değerinde, başlangıca göre %3,27 oranındaki klinik olarak anlamlıbir azalma ile sonuçlanmıştır. Bu çalışmalara plasebo veya empagliflozin 10 mg kolları dahiledilmemiştir. Vücut ağırlığıPlasebo-kontrollü dört çalışmanın önceden belirlenmiş havuzanalizinde, empagliflozin tedavisi, 24. haftada vücut ağırlığında azalma ile sonuçlanmış (plasebo için -0,24 kg,empagliflozin 10 mg için -2,04 kg ve empagliflozin 25 mg için -2,26 kg) ve 52. haftaya kadar(plasebo için -0,16 kg, empagliflozin 10 mg için -1,96 kg ve empagliflozin 25 mg için -2,25 kg)devam etmiştir. Kan basıncıEmpagliflozinin etkililiği ve güvenliliği, çeşitli antidiyabetik tedavi alan ve en fazla 2 antihipertansif ilacı kullanan kan basıncı yüksek tip-2 diyabetli hastalarda 12 hafta süreyleyürütülen çift kör, plasebo kontrollü bir çalışmada değerlendirilmiştir. Empagliflozinin gündebir kez uygulanması ile yapılan tedavi, HbA1c değerinde ve ambulatuvar kan basıncı izlenmesiile tespit edilen 24 saatlik ortalama sistolik ve diyastolik kan basıncında istatistiksel olarakanlamlı bir iyileşme ile sonuçlanmıştır (Tablo 11). Empagliflozin tedavisi, otururken ölçülenSBP (Sistolik Kan Basıncı) ve DBP (Diyastolik Kan Basıncı)'de azalmalar sağlamıştır. Tablo 11 : Kan basıncı kontrol altında olmayan tip-2 diyabetli hastalarda, empagliflozinin plasebo kontrollü bir çalışmasında 12. haftadaki etkililik sonuçları^
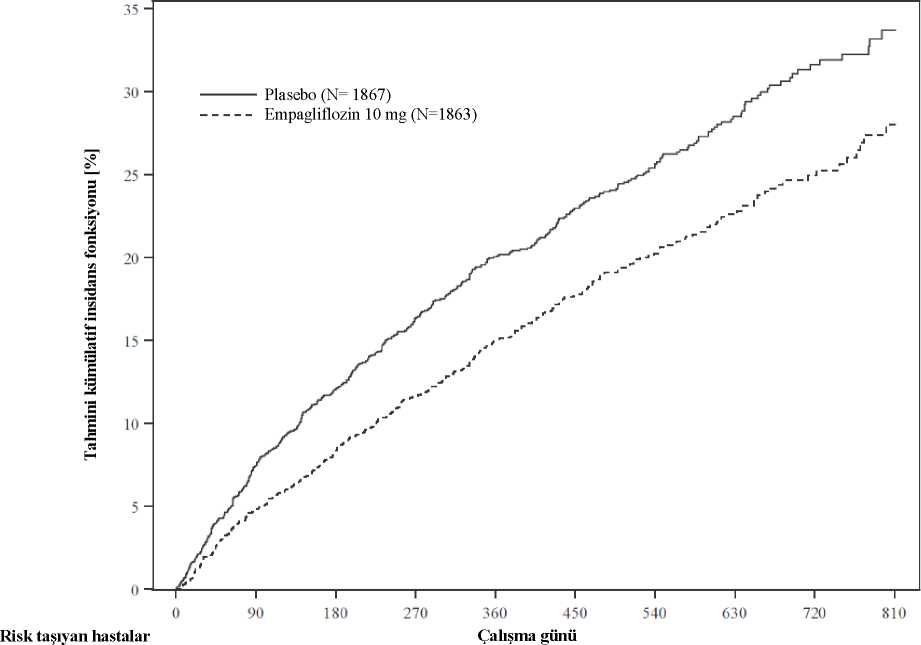
5 Başlangıç DBP, başlangıç HbAlc, başlangıç eGFR, coğrafi bölge ve antihipertansif ilaç sayısı için uyarlanmış ortalama* p-değeri <0,0001 ** p-değer i<0,001Plasebo kontrollü 4 çalışmanın önceden belirlenmiş havuz analizinde, empagliflozin tedavisi, 24. haftada, plasebo (-0,5 mmHg) ile karşılaştırıldığında, sistolik kan basıncında (empagliflozin10 mg: -3,9 mmHg; empagliflozin 25 mg: -4,3 mmHg) ve diyastolik kan basıncında (plasebo:-0,5 mmHg; empagliflozin 10 mg: -1,8 mmHg; empagliflozin 25 mg: -2 mmHg) azalma ilesonuçlanmış ve bu etki 52. haftaya kadar devam ettirilmiştir. Kalp yetersizliğiDüşük ejeksiyon _fraksiyonlu kalp yetersizliği hastalarında empagliflozinKalp yetersizliği bakım standardı tedavisine ek olarak günde bir kez 10 mg empagliflozininetkililiğinin ve güvenliliğinin değerlendirilmesi amacıyla, kronik kalp yetersizliği (New YorkKalp Derneği [NYHA] II-IV) ve düşük ejeksiyon fraksiyonlu (LVEF (Sol Venrikül EjeksiyonFraksiyonu) <%40) 3.730 hastada randomize, çift kör, plasebo kontrollü bir çalışma(EMPEROR-Reduced)yürütülmüştür. Primer sonlanım noktası, onaylanmış ilkkardiyovasküler (KV) ölüm veya kalp yetersizliği nedeniyle hastane yatışına kadar geçen süre olmuştur. Onaylanmış kalp yetersizliği nedeniyle hastane yatışı (ilk ve rekürren) ve başlangıcagöre eGFR(CKD-EPI)cr değişim eğimi, doğrulama testine dahil edilmiştir. Başlangıçta kalpyetersizliği tedavisi, ACE inhibitörlerini / anjiyotensin reseptör blokerlerini / anjiyotensinreseptör-neprilisin inhibitörünü (%88,3), beta blokerleri (%94,7), mineralokortikoid reseptörantagonistleri (%71,3) ve diüretikleri (%95) içermiştir. Toplam 1.863 hasta 10 mg empagliflozine (plasebo: 1.867) randomize edilmiştir ve medyan 15,7 ay boyunca izlenmiştir. Çalışma popülasyonu, ortalama yaşı 66,8 yıl (aralık: 25-94 yıl) ile%76,1 erkek hastalardan ve %23,9 kadın hastalardan oluşmuştur. Hastaların %26,8'i 75 yaş veüzerinde olmuştur. Çalışma popülasyonunun %70,5'i Beyaz ırktan, %18'i Asyalı ve %6,9'uSiyah/Afrikalı Amerikalı olmuştur. Randomizasyonda hastaların %75,1'i NYHA sınıf II,%24,4'ü sınıf III ve %0,5'i sınıf IV olarak kategorize edilmiştir. Ortalama LVEF %27,5olmuştur. Başlangıçta, ortalama eGFR 62 mL/dk/1,73 m2 ve medyan üriner albümin / kreatininoranı (UACR) 22 mg/g olmuştur. Hastaların yaklaşık yarısında (%51,7) eGFR >60 mL/dk/1,73m2 değerleri, % 24,1'inde 45 - <60 mL/dk/1,73 m2 değerleri, %18,6'sında 30 - <45 mL/dk/1,73m2 ve %5,3'ünde 20 - <30 mL/dk/1,73 m2 değerleri saptanmıştır. Empagliflozin, plaseboya kıyasla kardiyovasküler ölüm veya kalp yetersizliği nedeniyle hastaneye yatıştan oluşan bileşik primer sonlanım noktasında risk azaltmada üstün olmuştur.Ek olarak, empagliflozin, kalp yetersizliği nedeniyle hastaneye yatış (ilk ve rekürren) riskinianlamlı ölçüde azaltmıştır ve eGFR düşüş oranını anlamlı ölçüde yavaşlatmıştır (Tablo 12;Şekil 2 ve 3). Tablo 12: Bileşik primer sonlanım noktası, bileşenleri ve önceden belirlenmiş doğrulama testine dahil edilen iki önemli ikincil sonlanım noktası için tedavi etkisi
KV = kardiyovasküler, HHF = kalp yetersizliği nedeniyle hastaneye yatış, eGFR = Tahmini glomerüler filtrasyon hızı, CKD EPI = Kronik böbrek hastalığı epidemiyoloji işbirliği denklemi*KV ölüm ve HHF olayları, bağımsız bir klinik olay komitesi tarafından karara bağlanmıştır ve randomize set temel alınarak analiz edilmiştir.**eGFR eğimi, tedavi edilen sete dayalı olarak analiz edilmiştir. Kesişim noktası plasebo için -0,95 mL/dk/1,73 m2 ve empagliflozin için -3,02 mL/dk/1,73 m2'dir. Eğim, uzun süreli etkiyi temsil ederken; kesişim noktası,eGFR üzerindeki akut etkiyi temsil etmektedir.Şekil 2: Onaylanmış ilk kardiyovasküler (KV) ölüm veya kalp yetersizliği nedeniyle hastane yatışına kadar geçen süre
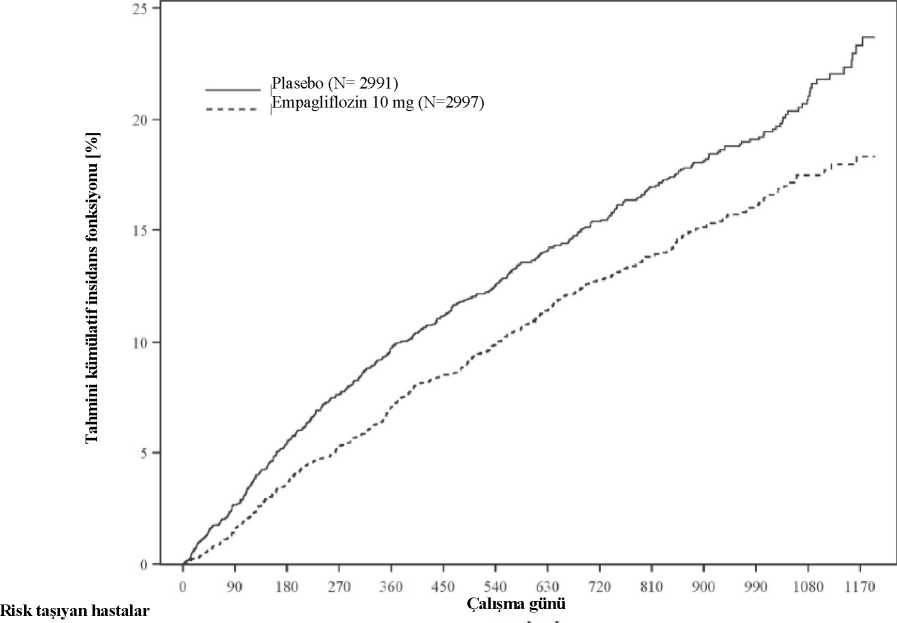
Bileşik primer sonlanım noktasının sonuçları; tip 2 diyabeti olan ve olmayan ve böbrek yetmezliği olan (20 mL/dk/1,73 m2 eGFR değerine kadar) ve olmayan hastalar dahil olmaküzere, önceden belirlenmiş alt gruplarda 1'in altında bir tehlike oranı (HR) ile genel olaraktutarlıdır. Korunmuş ejeksiyon fraksiyonlu kalp yetersizliği olan hastalarda empagliflozinStandart tedaviye ek olarak günde bir kez 10 mg empagliflozinin etkililiğinin ve güvenliliğinindeğerlendirilmesi amacıyla, kronik kalp yetersizliği (NYHA II-IV) ve korunmuş ejeksiyonfraksiyonu (LVEF > %40) olan 5.988 hastada randomize, çift kör, plasebo kontrollü bir çalışma(EMPEROR-Preserved)yürütülmüştür. Primer sonlanımnoktası, onaylanmış ilkkardiyovasküler (KV) ölüm veya kalp yetersizliği nedeniyle hastane yatışına kadar geçen süre olmuştur. Onaylanmış kalp yetersizliği nedeniyle hastaneye yatışın (ilk ve rekürren) yapılmasıve eGFR(CKD-EPI)cr başlangıca göre değişim eğimi, doğrulama testine dahil edilmiştir.Başlangıç tedavisi, ACE inhibitörlerini/anjiyotensin reseptör blokerlerini/anjiyotensin reseptör-neprilisin inhibitörünü (%80,7), beta blokerleri (%86,3), mineralokortikoid reseptörantagonistleri (%37,5) ve diüretikleri (%86,2) içermiştir. Toplam 2.997 hasta, 10 mg empagliflozin (plasebo: 2.991) için randomize edilmiştir ve medyan 26,2 ay boyunca izlenmiştir. Çalışma popülasyonu, ortalama yaşı 71,9 (aralık: 22-100 yıl) olan %55,3erkek ve %44,7 kadından oluşmuştur. Hastaların %43'ü 75 yaş ve üzerindeydi. Çalışmapopülasyonunun %75,9'u Beyaz, %13,8'i Asyalı ve %4,3'ü Siyah/Afrikalı Amerikalı ırkındanoluşmuştur. Randomizasyonda, hastaların %81,5'i NYHA sınıf II, %18,1'i sınıf III ve %0,3'ü sınıfIV olarak kategorize edilmiştir. EMPEROR- Preserved çalışma popülasyonuna, LVEF'si <%50(%33,1), LVEF'si %50 ila <%60 (%34,4) ve LVEF'si >%60 (%32,5) olan hastalar dahil edilmiştir.Başlangıçta, ortalama eGFR 60,6 mL/dk/1,73 m2 ve medyan üriner albümin/kreatinin oranı (UACR)21 mg/g olmuştur. Hastaların yaklaşık yarısında (%50,1) eGFR >60 mL/dk/1,73 m2 değeri,%26,1'inde 45 ila <60 mL/dk/1,73 m2 değerleri arasında, %18,6'sında 30 ila <45 mL/dk/1,73 m2değerleri arasında ve %4,9'unda 20 ila <30 mL/dk/1,73 m2 değerleri arasındadır. Empagliflozin, plaseboya kıyasla kardiyovasküler ölüm veya kalp yetersizliği nedeniyle hastaneye yatış bileşik primer sonlanım noktasında riski azaltmada üstün olmuştur. Ek olarak,empagliflozin, kalp yetersizliği nedeniylehastaneye yatışın (ilk ve rekürren) meydana gelmesiriskini anlamlı ölçüde azaltmıştır ve eGFR düşüş oranını anlamlı ölçüde yavaşlatmıştır (Tablo13; Şekil 3). Tablo 13: Bileşik primer sonlanım noktası, bileşenleri ve önceden belirlenmiş doğrulama testine dahil edilen iki önemli ikincil sonlanım noktası için tedavi etkisi
Şekil 3 Onaylanmış ilk kardiyovasküler (KV) ölüm veya kalp yetersizliği nedeniyle hastane yatışma kadar geçen süre
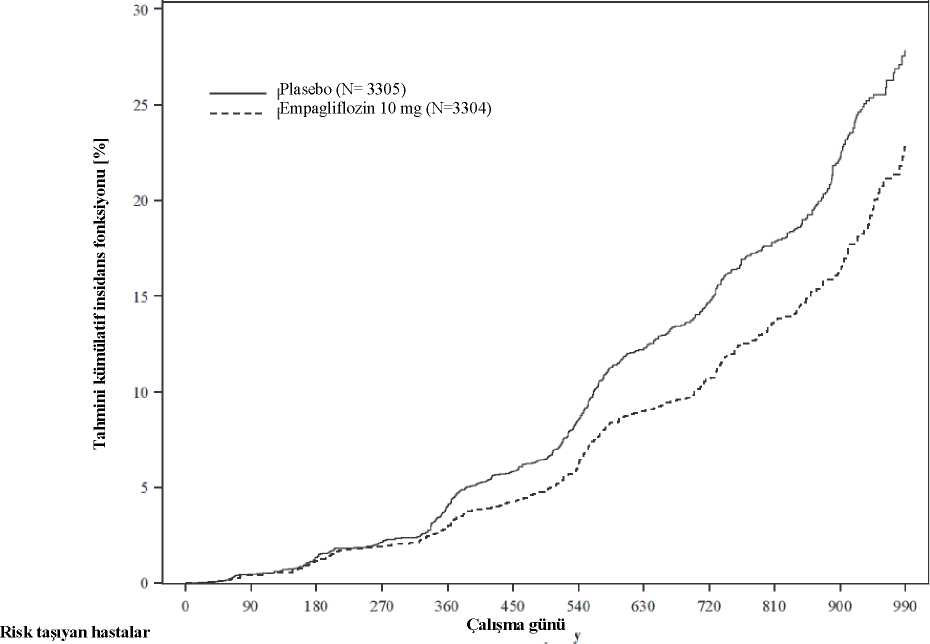
Bileşik primer sonlanım noktasının sonuçları, örn., LVEF, diyabet durumu veya böbrek fonksiyonu (20 mL/dk/1,73 m2'lik bir eGFR'ye kadar) olarak kategorize edilen öncedenbelirlenmiş alt grupların her biri arasında tutarlı çıkmıştır. Kronik böbrek hastalığı Standart tedaviye ek olarak kardiyo-renal sonuçları değerlendirmek için günde bir kez empagliflozin 10 mg'ın kronik böbrek hastalığı olan (eGFR >20 - <45 mL/dk/1,73 m2; veyaeGFR >45 - <90 mL/dk/1,73 m2 ve üriner albüminin kreatinine oranı (UACR) >200 mg/g)6.609 hastada randomize, çift kör, plasebo kontrollü bir çalışma (EMPA-KIDNEY)gerçekleştirilmiştir. Primer sonlanım noktası, ilk böbrek hastalığı progresyonuna(randomizasyondan itibaren kalıcı >%40 eGFR düşüşü, kalıcı eGFR <10 mL/dk/1,73 m2, sondönem böbrek hastalığı veya renal ölüm) veya KV ölüme kadar geçen süre olarak belirlenmiştir.Kalp yetersizliği veya KV ölüm nedeniyle hastaneye ilk yatış, tüm nedenlere bağlı hastaneyeyatış (ilk ve rekürren) ve tüm nedenlere bağlı mortalite doğrulayıcı testlere dahil edilmiştir. Başlangıç tedavisi, uygun bir RAS inhibitörünün (%85,2 ACE inhibitörü veya anjiyotensin reseptör blokeri) kullanımım içermiştir. Toplam 3.304 hasta empagliflozin 10 mg (plasebo: 3.305) alacak şekilde randomize edilmiş ve medyan 24,3 ay boyunca takip edilmiştir. Çalışma popülasyonunun %66,8'i erkek, %33,2'sikadın olup yaş ortalaması 63,3'tür (aralık: 18-94 yaş), %23'ü 75 yaş ve üzeridir. Çalışmapopülasyonunun % 58,4'ü Beyaz, % 36,2'si Asyalı ve % 4'ü Siyah/Afrikalı Amerikalıdır. Başlangıçta ortalama eGFR 37,3 mL/dk/1,73 m2, hastaların %21,2'sinde eGFR >45 mL/dk/1,73 m2, %44,3'ünde 30 ila <45 mL/dk/1,73 m2 ve %34,5'inde <30 mL/dk/1,73 m2 olmak üzere 254hastada <20 mL/dk/1,73 m2 olmuştur. Medyan UACR 329 mg/g, hastaların % 20,1'inde UACR<30 mg/g, % 28,2'sinde UACR 30 ila <300 mg/g ve % 51,7'sinde UACR >300 mg/g; hastaların%41,1 'inde UACR <200 mg/g olmuştur. Kronik böbrek hastalığının başlıca nedenleri diyabetiknefropati/diyabetik böbrek hastalığı (%31), glomerüler hastalık (%25), hipertansif/renovaskülerhastalık (%22) ve diğer/bilinmeyen (%22) olarak kaydedilmiştir. Empagliflozin, plaseboya kıyasla böbrek hastalığı progresyonu veya KV ölüm olan bileşik primer sonlanım noktası riskini azaltmada üstün olmuştur (Bkz. Tablo 14). Ek olarak,empagliflozin tüm nedenlere bağlı hastaneye yatış riskini (ilk ve rekürren) anlamlı olarakazaltmıştır. Tablo 14: Bileşik primer sonlanım noktası, bileşenleri ve önceden belirlenmiş doğrulama testine dahil edilen önemli ikincil sonlanım noktası için tedavi etkisi
Şekil 4 İlk böbrek hastalığı progresyonu veya onaylanmış kardiyovasküler (KV) ölüme kadar geçen süre, tahmini kümülatif insidans fonksiyonu
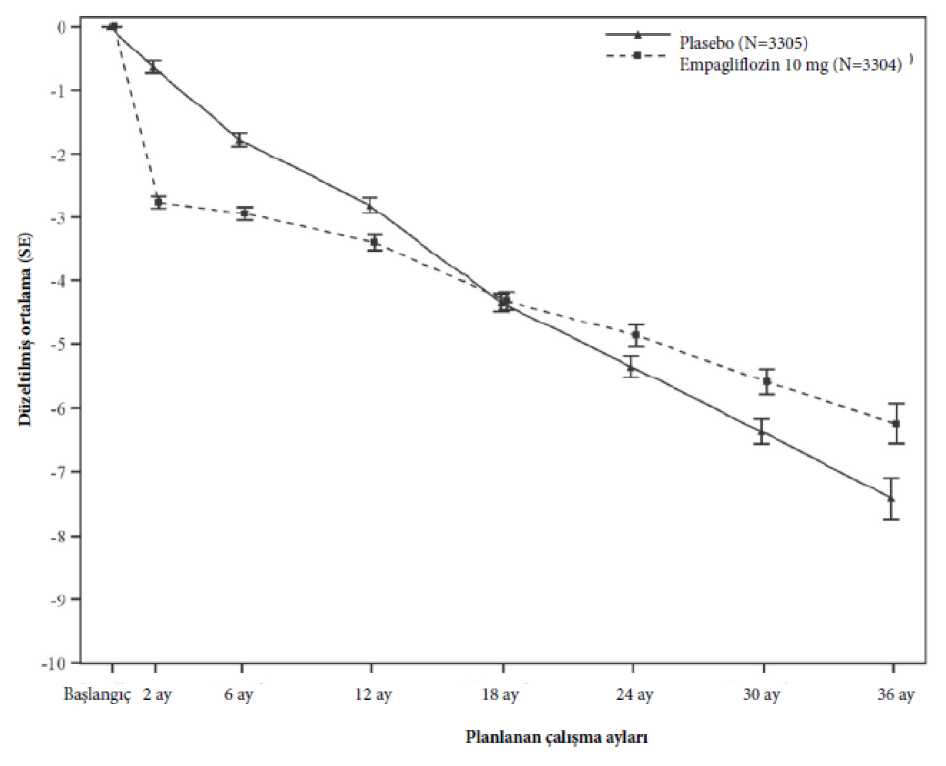
Birincil bileşik son noktanın sonuçları, genellikle eGFR kategorileri, böbrek hastalığının altında yatan nedenler, diyabet durumu veya başlangıç RAS inhibitörleri kullanımı dahil öncedenbelirlenmiş alt gruplarda tutarlıdır. Tedavinin yararları, daha yüksek albüminüri seviyeleri olanhastalarda daha belirgindir. Tedavi sırasında, empagliflozin grubunda zamanla eGFR düşüşü, plasebo grubuna kıyasla daha yavaş olmuştur (Şekil 5). Empagliflozin, 2 aylık ziyaretten son takip ziyaretine kadar alınantüm eGFR ölçümlerinin önceden belirlenmiş bir analizine göre, plaseboya kıyasla yıllık eGFRdüşüş oranını 1,37 mL/dk/1,73 m2/yıl (% 95 GA 1,16, 1,59) kadar yavaşlatmıştır. Empagliflozinile tedavi edilen hastalar, eGFR'de başlangıçta düşüş yaşamıştır ve tedavininsonlandırılmasından sonra başlangıca geri dönmüştür ve bu durum empagliflozinin eGFRüzerindeki etkilerinde akut hemodinamik değişikliklerin rol oynadığını desteklemektedir.
Pediyatrik popülasyonAvrupa İlaç Ajansı (European Medicine Agency-EMA), JARDIANCE ile tip-2 diyabeti olan pediyatrik popülasyonun bir veya daha fazla alt grubunda yapılan çalışmaların sonuçlarınısunma zorunluluğunu ertelemiştir (pediyatrik kullanım ile ilgili bilgiler için bkz. Bölüm 4.2). Avrupa İlaç Ajansı, kalp yetersizliği olan pediatrik popülasyonun tüm alt kümelerinde JARDIANCE ile yapılan çalışmaların sonuçlarını sunma yükümlülüğünden feragat etmiştir(pediyatrik kullanım ile ilgili bilgiler için bkz. Bölüm 4.2). Avrupa İlaç Ajansı, kronik böbrek hastalığı olan pediyatrik popülasyonun tüm alt kümelerinde JARDIANCE ile yapılan çalışmaların sonuçlarını sunma yükümlülüğünden feragat etmiştir(pediyatrik kullanım hakkında bilgi için bkz. Bölüm 4.2). 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:Empagliflozinin farmakokinetiği, sağlıklı gönüllülerde ve tip-2 diyabetli hastalarda ayrıntılı olarak tanımlanmıştır. Oral uygulamadan sonra, empagliflozin, ortalama tmaks 1,5 saatte meydana gelen pik plazma konsantrasyonları ile hızlı bir şekilde emilir. Sonrasında, plazma konsantrasyonları hızlı bir dağılım fazı ile bifazik tarzda azalır ve terminal fazı göreceli olarakyavaştır. Kararlı durum ortalama plazma EAA ve Cmaks değerleri, günde bir kez empagliflozin10 mg için 1870 nmol.saat/L ve 259 nmol/L ve empagliflozin 25 mg için 4740 nmol.saat/L ve687 nmol/L'dir. Empagliflozinin sistemik maruziyeti dozla orantılı şekilde artar.Empagliflozinin tek doz ve kararlı durum farmakokinetik parametreleri benzerdir, bu durumzamana göre lineer farmakokinetiği düşündürür. Sağlıklı gönüllülerle tip-2 diyabetli hastalararasında empagliflozin farmakokinetiği açısından klinik olarak anlamlı bir farklılık yoktur. Yüksek oranda yağlı ve yüksek kalorili bir yemekten sonra empagliflozin 25 mg alınması, hafif oranda daha düşük bir maruziyetle sonuçlanmıştır. Açlık koşulları ile karşılaştırıldığında, EAAyaklaşık %16 oranında ve Cmaks yaklaşık %37 oranında azalmıştır. Yiyeceklerin empagliflozinfarmakokinetiği üzerinde gözlenen etkileri, klinik olarak anlamlı kabul edilmez, empagliflozinyiyeceklerle birlikte veya ayrı olarak kullanılabilir. Dağılım:Görünür kararlı durum dağılım hacmi, popülasyon farmakokinetik analizlerine dayanarak, 73,8 L olarak tahmin edilmiştir. Sağlıklı gönüllülere oral [14C]-empagliflozin çözeltisiuygulanmasını takiben kırmızı kan hücre parçalanması yaklaşık %37 ve plazma proteinbağlanması %86 bulunmuştur. Biyotransformasyon:Empagliflozinin insan plazmasında majör bir metaboliti tespit edilmemiştir ve en belirgin metabolitleri 3 glukuronid konjugatıdır (2-,3- ve 6-O glukuronid). Her metabolitin sistemikmaruziyeti, ilaca bağlı toplam materyalin %10'undan daha azdır. In vitro çalışmalar,empagliflozinin insanlardaki primer metabolizma yolunun, üridin 5'-difosfo-glukuronosiltransferazlar UGT2B7, UGT1A3, UGT1A8 ve UGT1A9 aracılığı ile glukuronidasyonolduğunu düşündürmektedir. Eliminasyon:Popülasyon farmakokinetik analizlere dayanarak, empagliflozinin görünür terminal yarılanma ömrü 12,4 saat olarak tahmin edilmiştir, görünür oral klerensi 10,6 L/saattir. Empagliflozin oralklerensi açısından kişiler arası ve rezidüel değişkenlikler sırası ile %39,1 ve %35,8'dir. Gündebir kez verilen dozla, empagliflozinin kararlı durum plazma konsantrasyonlarına 5. dozlaulaşılmıştır. Yarı ömrü ile uyumlu olarak, kararlı durumda, plazma EAA açısından %22'yekadar birikim gözlenmiştir. Oral [14C]-empagliflozin çözeltisinin sağlıklı gönüllülereuygulanmasından sonra, ilaçla ilişkili radyoaktivitenin yaklaşık %96'sı, feçes (%41) veyaidrarla (%54) atılmıştır. Feçeste geri kazanılan ilaçla ilişkili radyoaktivitenin büyük bir kısmıdeğişmemiş ana ilaç olmuştur ve idrarla atılan ilaçla ilişkili radyoaktivitenin yaklaşık yarısıdeğişmemiş ana ilaç olmuştur. Hastalardaki karakteristik özelliklerRenal yetmezlikHafif, orta ve şiddetli renal bozukluğu olan hastalarda (eGFR<30 - <90 mL/dk/1,73 m2) ve böbrek yetmezliği /son dönem böbrek hastalığı (SDBH) olan hastalarda, renal fonksiyonlarınormal olan hastalarla karşılaştırıldığında, empagliflozinin EAA değerleri sırasıyla, yaklaşıkolarak, %18, %20, %66 ve %48 oranında artmıştır. Empagliflozinin pik plazma düzeyleri, ortadereceli renal bozukluğu ve böbrek yetmezliği/SDBH hastaları ile renal fonksiyonları normalolan hastalar arasında benzerdir. Empagliflozinin pik plazma düzeyleri, hafif ve şiddetli renalbozukluğu olan hastalarda, renal fonksiyonları normal olan hastalara göre, kabaca %20oranında daha yüksektir. Popülasyon farmakokinetik analizi, empagliflozinin görünür oralklerensinin, eGFR değerindeki azalma ile azaldığını, bunun da ilaç maruziyetinde yükselmeyeneden olduğunu göstermiştir. Hepatik yetmezlikChild-Pugh sınıflandırmasına göre hafif, orta ve şiddetli hepatik bozukluğu olan hastalarda empagliflozinin EAA değeri, hepatik fonksiyonları normal olan hastalara göre, sırasıylayaklaşık %23, %47 ve %75, Cmaks değeri ise yaklaşık %4, %23 ve %48 artmıştır. Vücut kitle indeksiPopülasyon farmakokinetik analizlerine dayanarak, vücut kitle indeksinin empagliflozin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi olmamıştır. Bu analizde EAA değerinin,BMI 25 kg/m2 olanlara göre, BMI 30, 35, ve 45 kg/m2 olan kişilerde sırası ile %5,82, %10,4 ve%17,3 daha düşük olduğu tahmin edilmiştir. CinsiyetPopülasyon farmakokinetik analizlerine dayanarak, cinsiyetin empagliflozin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi yoktur. IrkPopülasyon farmakokinetik analizlerinde, EAA değerinin, BMI 25 kg/m2 olan Asyalılarda, aynı BMI değerine sahip Asyalı olmayanlarla karşılaştığında, %13,5 oranında daha yüksek olduğutahmin edilmiştir. Geriyatrik popülasyonPopülasyon farmakokinetik analizlerine dayanarak, yaşın empagliflozinin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi olmamıştır. Pediyatrik popülasyonBir pediyatrik Faz 1 çalışması, empagliflozinin (5 mg, 10 mg ve 25 mg) farmakokinetiğini ve farmakodinamiğini, Tip 2 diabetes mellitus hastası çocuklar ve >10 - <18 yaşlarındakiadolesanlarda araştırmıştır. Gözlenen farmakokinetik ve farmakodinamik yanıtlar, erişkingönüllülerden elde edilen bilgilerle tutarlı bulunmuştur. 5.3. Klinik öncesi güvenlilik verileriGüvenlilik farmakolojisi, genotoksisite, fertilite ve erken embriyonik gelişimle ilgili konvansiyonel çalışmalardaki klinik dışı veriler insanlar için özel bir tehlike ortayakoymamıştır. Köpeklerde ve kemirgenlerde yapılan uzun dönem toksisite çalışmalarında, empagliflozinin klinik dozunun 10 katına eşit veya daha yüksek maruziyetlerinde toksisite belirtilerigözlenmiştir. Toksisitenin çoğu, vücut ağırlığı ve vücut yağında azalma, yiyecek tüketimindeartış, diyare, dehidratasyon, serum glikoz düzeyinde azalmayı da kapsayan idrarda glikoz kaybıve elektrolit dengesizlikleri, protein metabolizmasındaki ve glikoneogenezdeki artışla görülendiğer serum proteinlerinde yükselme, poliüri ve glikozüri gibi idrar değişiklikleri ve böbreklerlebazı yumuşak ve vasküler dokuların mineralizasyonunu da içeren mikroskobik değişiklikler ileilişkili sekonder farmakoloji ile uyumludur. Bazı türlerde, empagliflozinin 25 mg ile ilişkiliolarak, empagliflozinin klinik EAA maruziyetinin yaklaşık 4 katında, böbrekler üzerindeki,abartılı farmakolojik etkilerin mikroskobik kanıtları gözlenmiştir. Bu kanıtlar arasında, tübülerdilatasyon ve tübüler ve pelvik mineralizasyon bulunur. Empagliflozin genotoksik değildir. 2 yıl süreli bir karsinojenite çalışmasında empagliflozin, dişi sıçanlarda, maksimum klinik empagliflozin EAA maruziyetinin 72 kat fazlasına karşılık gelen, 700 mg/kg/gün düzeyindekien yüksek doza kadar, tümör insidansını arttırmamıştır. Erkek sıçanlarda, en yüksek dozda,mezenterik lenf nodlarında, tedaviye bağlı benign vasküler proliferatif lezyonları(hemanjiyomlar) gözlenmiştir. Ancak empagliflozinin maksimum klinik maruziyetininyaklaşık 26 katına karşılık gelen 300 mg/kg/gün dozda bu etki gözlenmemiştir. Sıçanlarda, 300mg/kg/gün ve üzerindeki dozlarda, testislerde interstisyel hücre tümörleri daha yüksekinsidansta gözlenmiş, empagliflozinin maksimum klinik maruziyetinin yaklaşık 18 katınakarşılık gelen 100 mg/kg/gün dozda ise gözlenmemiştir. Her iki tümör de sıçanlarda yaygındırve insanlarla ilişkili olması beklenmez. Empagliflozin, dişi farelerde, maksimum klinik maruziyetinin yaklaşık 62 katına karşılık gelen 1000 mg/kg/gün doza kadar tümör insidansını arttırmamıştır. Erkek farelerde 1000 mg/kg/gündozda renal tümörleri indüklemiştir, ancak empagliflozinin maksimum klinik maruziyetininyaklaşık 11 katına karşılık gelen 300 mg/kg/gün dozda bu indükleme görülmemiştir. Butümörlerin etki mekanizması, erkek farelerin renal patolojiye doğal predispozisyonuna ve birmetabolik yolağa bağlı olup, insanlarda karşılığı yoktur. Erkek farelerdeki renal tümörlerinsanlarla ilişkili bulunmamıştır. İnsanlarda, terapötik dozlardan sonraki maruziyetin yeterli derecedeki maruziyet miktarlarında, empagliflozinin fertilite veya erken embriyolojik gelişme üzerinde herhangi bir advers etkisiolmamıştır. Organogenez dönemi sırasında verilen empagliflozinin teratojen etkisisaptanmamıştır. Sadece maternal olarak toksik dozlarda verildiğinde empagliflozin, sıçanlardakaburga kemiklerinde eğriliğe ve tavşanlarda embriyofetal kayıplarda artışa neden olmuştur. Sıçanlarda yapılan pre- ve postnatal toksisite çalışmalarında, empagliflozine maksimum klinik maruziyetin yaklaşık 4 katındaki maternal maruziyetlerde, yavruların kilo alımında azalmagözlenmiştir. Empagliflozine maksimum klinik maruziyete eşdeğer bir sistemik maruziyetteböyle bir etki gözlenmemiştir. Bu bulguların insanlarla ilişkisi belirsizdir. Sıçanlarda yapılan bir juvenil toksisite çalışmasında, postnatal 21. günden postnatal 90. güne kadar empagliflozin uygulanması halinde, juvenil sıçanlarda sadece maksimum klinik doz olan25 mg'ın yaklaşık 11 katına karşılık gelen 100 mg/kg/gün dozlarda advers olmayan, minimal-hafif dereceli renal tübüler ve pelvik dilatasyon görülmüştür. İlaçsız 13 haftalık bir dönemsonrasında bu bulgular ortadan kalkmıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiTablet çekirdeğiLaktoz monohidrat (inek sütünden elde edilmiştir) Mikrokristalin selüloz Hidroksipropil selülozKroskarmelloz sodyum Kolloidal anhidr silika Magnezyum stearat Film kaplamaHipromelloz Titanyum dioksid (E171) Talk Makrogol (400) Demir oksit, sarı (E 172) 6.2 GeçimsizliklerUygulanabilir değildir. 6.3. Raf ömrü36 ay 6.4 Saklamaya yönelik özel tedbirler25°C'nin altında oda sıcaklığında saklanır. 6.5 Ambalajın niteliği ve içeriğiPVC/aluminyum perfore birim doz blisterler.Piyasaya 30 film tabletlik ambalaj büyüklükleri ile sunulur. 6.6 Tıbbi üründen arta kalan maddelerin imhası ve dier özel önlemlerKullanılmamış ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBoehringer Ingelheim İlaç Ticaret A.Ş. Esentepe Mah. Harman 1 Sok. Nidakule Levent No: 7/9 Kat: 15 34394 Şişli / İstanbul Tel: (0 212) 329 1100 Faks: (0 212) 329 1101 8. RUHSAT NUMARASI2017/241 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 10.04.2017 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ: 1saatlik tokluk glikozuMetformin veya metformin + bir sülfonilüre tedavisine ekleme olarak empagliflozin tedavisi, 24. haftada, 2 saatlik tokluk glikoz düzeylerinde (yemek tolerans testi) klinik olarak anlamlı birdüşüş sağlamıştır (metformine ekleme: plasebo +5,9 mg/dL, empagliflozin 10 mg: -46 mg/dL,empagliflozin 25 mg: -44,6 mg/dL, metformin + bir sülfonilüre tedavisine ekleme: plasebo -2,3 |
İlaç BilgileriJardiance 10 Mg Film Kaplı TabletEtken Maddesi: Empagliflozin Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.