Bosulif 100 Mg Film Kaplı Tablet Kısa Ürün BilgisiKISA URUN BILGISIBu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBI URUNUN ADIBOSULİF® 100 mg film kaplı tablet 2. KALITATIF VE KANTİTATIF BILEŞIMHer film kaplı tablet 100 mg bosutinibe eşdeğer 103,4 mg bosutinib monohidrat içerir. Yardımcı maddeler için, 6.1'e bakınız.3. FARMASÖTIK FORMFilm kaplı tablet. Bir yüzünde Pfizer ve diğer yüzünde 100 işlemeli, sarı renkte, oval, bikonveks film kaplı tablet. 4. KLİNIK ÖZELLIKLER4.1 Terapötik endikasyonlarBOSULİF, Yeni tanı konmuş kronik faz (KF) Philadelphia kromozomu pozitif (Ph+) kronikmiyeloid lösemisi (KML) olan yetişkin hastaların tedavisinde ve Daha önce en az bir basamak tirozin kinaz inhibitörü (TKI) (imatinib, dasatinib veyanilotinib) tedavisi alıp, direnç veya intolerans gelişmiş olan kronik faz (KF), akselerefaz (AF) ve blastik faz (BF) Philadelphia kromozomu pozitif (Ph+) kronik miyeloidlösemisi (KML) olan yetişkin hastaların tedavisinde endikedir. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Tedavi, KML'li hastaların tanı ve tedavisinde deneyimli bir doktor tarafından başlatılmalıdır.PozolojiYeni tanı konmuş KF Ph+ KMLBosutinib için önerilen doz günde bir kez 400 mg'dır. Direnç veya intolerans gelişmiş olan KF, AF veya BF Ph+ KMLBosutinib için önerilen doz günde bir kez 500 mg'dır. Klinik çalışmalarda, bosutinib ile tedavi, hastalık ilerleyene kadar veya hasta tarafından artık tolere edilemeyene kadar devam etmiştir. Doz ayarlamasıDaha önce tedavi edilen Ph+ lösemili yetişkin hastaların Faz 1/2 klinik çalışmalarında, aşağıdaki herhangi birinde şiddetli veya inatçı orta-advers reaksiyon gözlemlenmeyenhastalarda günde bir kez yemek ile beraber 500 mg'dan 600 mg'a kadar doz artışı yapılmasınaizin verilmiştir. Doz artışı için koşullar - Derece 3 veya üzeri ilaç ilişkili advers olay yaşanmaması ve - 8. haftaya kadar tam hematolojik yanıt (THY) alınamaması veya - 12. haftaya kadar tam sitogenetik yanıt (TSY) alınamaması Bosutinib 400 mg ile tedavi edilen yeni tanı konmuş KF KML hastalarının Faz 3 klinik çalışmasında, 3. ayda kırılma bölgesi (breakpoint cluster region)-Abelson (BCR-ABL)transkripsiyon < %10 göstermeyen, doz artışı sırasında Derece 3 ve 4 advers reaksiyongözlemlenmeyen ve en az Derece 1'e gerileyen tüm hematolojik olmayan Derece 2 toksisitelihastalarda yiyeceklerle günde bir kez maksimum 600 mg'a kadar 100 mg'lık artışlarla doz artışıyapılmasına izin verilmiştir. Daha önce 1 ya da daha fazla sayıda TKI ile tedavi edilmiş olanPh+ KML hastalarında yapılan bir Faz 4 klinik çalışmada, herhangi bir Derece 3 ya da 4 veyapersistan Derece 2 advers olaylar olmaksızın hastalık progresyonu belirtileri gösteren ya dayetersiz yanıt veren hastalarda dozun günde bir kez tok olarak alınan 500 mg'dan 600 mgdüzeyine çıkarılmasına izin verilmiştir. Daha önce tedaviye karşı direnç göstermiş ya da tedaviyi tolere edememiş olan KML hastalarında yapılan Faz 1/2 çalışmada, < 500 mg'da tedaviye başlayan 93 (93/558; %16,7)hastada, günlük olarak 600 mg'a kadar doz artışı olmuştur. Bosutinib tedavisine 400 mg ile başlayan, yeni tanı konmuş KF KML hastalarında yapılan Faz 3 çalışmasında, toplam 58 hasta (%21,6), günde 500 mg'a kadar doz artışı almıştır. Ek olarak,bosutinib tedavi grubundaki hastaların %10,4'ünde günde 600 mg'a kadar doz artışı olmuştur. Daha önce 1 ya da daha fazla TKI ile tedavi edilen ve günde 500 mg düzeyinde bosutinib tedavisine başlayan Ph+ KML hastalarında yapılan Faz 4 çalışmada, 1 hastada (%0,6) dozgünde 600 mg'a kadar artırılmıştır. 600 mg/gün'den daha büyük dozlar çalışılmamıştır ve bu nedenle verilmemelidir. Advers reaksiyonlar için doz ayarlamalarıHematolojik olmayan advers reaksiyonlar için doz ayarlamalarıEğer klinik olarak anlamlı orta şiddette veya ciddi hematolojik olmayan toksisite gelişirse, bosutinibe ara verilmeli ve toksisite ortadan kalktıktan sonra doz, 100 mg azaltılarak günde birkez olarak devam edilmelidir. Klinik olarak uygunsa, dozun günde bir kez doz azaltımındanönceki doza yükseltilmesi düşünülmelidir (bkz. bölüm 4.4). Günde 300 mg'dan daha az dozlarhastalara uygulanmıştır; ancak, etkililik değerlendirilmemiştir. Yükselmiş karaciğer transaminaz değeri: Eğer karaciğer transaminazlarında normalin üst sınırı (NÜS) değerinin 5 katından fazla artış olursa, bosutinib transaminaz düzeyleri < 2,5 x NÜSseviyesine ininceye kadar durdurulmalıdır. Daha sonra günde bir kez 400 mg ile devamettirilebilir. Eğer düzelme 4 haftadan daha uzun sürerse, bosutinib tedavisinin sonlandırılmasıdüşünülmelidir. Transaminaz düzeylerindeki yükselme > 3 x NÜS, bilirubin düzeylerindekiyükselme> 2 x NÜS ve alkalin fosfataz düzeyi <2 x NÜS ile eşzamanlı olarak ortaya çıkarsa,bosutinib kesilmelidir (bkz. bölüm 4.4). İshal: Ulusal Kanser Enstitüsü Advers Olaylar için Temel Terminoloji Kriteri [CTCAE] kapsamında derece 3-4 ishal durumunda bosutinibe ara verilmeli ve Derece < 1 olduktan sonragünde bir kez 400 mg ile devam edilebilir (bkz. bölüm 4.4). Hematolojik advers reaksiyonlar için doz ayarlamalarıCiddi veya ısrarcı nötropeni ve trombositopeni için Tablo 1'de açıklandığı gibi doz azaltımı önerilir: Tablo 1- Nötropeni ve trombositopeni için doz ayarlamaları
Uygulama şekli:BOSULİF, yemeklerle birlikte günde bir kez oral yoldan alınmalıdır (bkz. bölüm 5.2). Bir dozun 12 saatten uzun süreli kaçırılması durumunda hastaya ek bir doz verilmemelidir. Hastaertesi gün olağan reçete edilen dozu almalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Serum kreatinin düzeyi > 1,5 x NÜS olan hastalar KML çalışmalarından hariç tutulmuştur. Çalışmalar sırasında orta ve ciddi böbrek yetmezliği olan hastalarda maruz kalmada (EAA) artışgözlenmiştir. Yeni tanı konmuş KF Ph+ KMLOrta derecede böbrek yetmezliği olan hastalarda (Cockroft-Gault formülüyle hesaplanan kreatinin klerensi 30-50 mL/dk [KrKL]) önerilen günlük bosutinib dozu yemeklerle birlikte 300mg/gün'dür (bkz. bölüm 4.4 ve 5.2). Yüksek şiddette böbrek yetmezliği bulunan hastalarda (Cockroft-Gault formülü ile hesaplanan KrKL< 30 mL/dk), önerilen bosutinib dozu yemeklerle birlikte alınan günde 200 mg'dir (bkz.bölüm 4.4 ve 5.2). Orta şiddette böbrek yetmezliği bulunan hastalarda günde bir defa 400 mg'ye doz yükseltme veya yüksek şiddette böbrek yetmezliği bulunan hastalarda günde bir defa 300 mg'ye dozyükseltme seçeneği, şiddetli veya kalıcı advers reaksiyon yaşamayan ve yeterli hematolojik,sitogenetik ve moleküler yanıt elde edemeyen kişilerde göz önünde bulundurulabilir: Direnç veya intolerans gelişmiş olan KF, AF veya BF Ph+ KMLOrta derecede böbrek yetmezliği olan hastalarda (Cockroft-Gault formülüyle hesaplanan kreatinin klerensi 30-50 mL/dk [KrKL]) önerilen günlük bosutinib dozu 400 mg/gün'dür (bkz.bölüm 4.4 ve 5.2). Yüksek şiddette böbrek yetmezliği bulunan hastalarda (Cockroft-Gault formülü ile hesaplanan KrKL<30 mL/dk), önerilen bosutinib dozu günde 300 mg'dir (bkz. bölüm 4.4 ve 5.2). Orta şiddette böbrek yetmezliği bulunan hastalarda günde bir defa 500 mg'ye doz yükseltme veya yüksek şiddette böbrek yetmezliği bulunan hastalarda günde bir defa 400 mg'ye dozyükseltme seçeneği, şiddetli veya ısrarcı advers reaksiyon yaşamayan ve yeterli hematolojik,sitogenetik ve moleküler yanıt elde edemeyen kişilerde göz önünde bulundurulabilir. Karaciğer yetmezliği:Karaciğer bozukluğu olan hastalarda kontrendikedir. Pediyatrik popülasyon:Bosutinib'in 18 yaşından küçük çocuklarda ve ergenlerde güvenliliği ve etkililiği belirlenmemiştir. Veri bulunmamaktadır. Geriyatrik popülasyon (>65 yaş):Yaşlılar için özel bir doz önerisine gerek yoktur. Yaşlılar ile ilgili sınırlı bilgi olduğundan, bu hastalarda dikkatli olunmalıdır. Kardiyak hastalıklar:Klinik çalışmalarda, kontrolsüz veya anlamlı kardiyak hastalığı olan hastalar (örneğin, yakın zamanda miyokard enfarktüsü, konjestif kalp yetmezliği veya unstabil anjina yaşamış olanhastalar) hariç tutulmuştur. İlgili kardiyak bozukluğu olan hastalarda dikkatli olunmalıdır (bkz.bölüm 4.4). Kısa süre önce görülmüş veya devam eden klinik olarak anlamlı gastrointestinal hastalık:Klinik çalışmalarda, kısa süre önce görülmüş veya devam eden klinik olarak anlamlı gastrointestinal bozukluk (örn. şiddetli kusma ve/veya ishal) yaşayan hastalar hariç tutulmuştur.Kısa süre önce görülmüş veya devam eden klinik olarak anlamlı gastrointestinal bozukluğu olanhastalarda dikkatli olunmalıdır (bkz. bölüm 4.4). 4.3 KontrendikasyonlarEtkin maddeye veya bölüm 6.1'de listelenen yardımcı maddelere karşı aşırı duyarlılık. Karaciğer bozukluğu (bkz. bölüm 5.1 ve 5.2).4.4 Özel kullanım uyarıları ve önlemleriKaraciğer fonksiyon anormallikleriBosutinib ile tedavi, serum transaminazlarında (ALT, AST) yükselme ile ilişkilidir. Transaminaz yükselmeleri genellikle tedavinin başlangıcında (her dereceden transaminaz yükselmesi yaşayan hastalarda,>%80'i ilk 3 ay içinde ilk olaylarını yaşamıştır) meydanagelmiştir. Bosutinib alan hastalar, tedavinin başlangıcı öncesinde ve tedavinin ilk 3 ayında heray ve klinik olarak gerekli olduğunda karaciğer fonksiyon testlerinden geçmelidir. Transaminazlarında artış olan hastalarda, bosutinib geçici olarak durdurulmalı (1. Dereceye kadar iyileşme olduğunda doz azaltma seçeneği göz önünde bulundurulmalıdır) ve/veyabosutinib tedavisi sonlandırılmalıdır. Özellikle bilirubinde eşzamanlı artışla birlikte görülentransaminaz artışları, ilaç kaynaklı karaciğer hasarının erken bir göstergesi olabilir ve buhastalarla uygun şekilde ilgilenilmesi gerekmektedir (bkz. bölüm 4.2 ve 4.8). İshal ve kusmaBosutinib tedavisi ishal ve kusma ile ilişkilendirilmiştir bu nedenle kısa süre önce görülmüş ya da devam eden klinik açıdan anlamlı gastrointestinal bozukluğu bulunan hastalar, (bu tarzhastalar klinik çalışmalardan hariç tutulmuştur) bu tıbbi ürünü dikkatli bir şekilde ve yalnızcaayrıntılı bir fayda-risk değerlendirmesi yapıldıktan sonra kullanmalıdır. İshal ve kusma yaşayanhastalar, ishal önleyici veya antiemetik bir tıbbi ürün ve/veya sıvı replasmanını içeren şekildestandart bakım kapsamında tedavi ile yönetilmelidir. Ayrıca, bu olaylar bosutinibin geçiciolarak durdurulması, doz azaltma ve/veya bosutinib kullanımının sonlandırılmasıyla dayönetilebilir (bkz. bölüm 4.2 ve 4.8). Antiemetik ajan, domperidon, QT aralığı (QTc) süresiniuzatarak torsades de pointes- aritmileri tetikleyebilir; bu nedenle domperidon ile birliktekullanımdan kaçınılmalıdır. Bu madde, yalnızca başka tıbbi ürünler etkili olmadığındakullanılmalıdır. Bu durumlarda kişisel bir fayda-risk analizi yapılması zorunludur ve hastalarQTc süre uzaması açısından izlenmelidir. MiyelosüpresyonBosutinib ile tedavi, anemi, nötropeni ve trombositopeni olarak tanımlanan miyelosüpresyon ile ilişkilidir. Kan sayımları ilk ay her hafta, daha sonrasında da aylık olarak veya klinik olarakbelirtildiği şekilde yapılmalıdır. Miyelosüpresyon, bosutinibin geçici olarak durdurulması, dozazaltma ve/veya bosutinib kullanımının sonlandırılmasıyla da yönetilebilir/yönetilmelidir (bkz.bölüm 4.2 ve 4.8). Sıvı tutulumuBosutinib ile tedavi perikardiyal efüzyon, plevral efüzyon, pulmoner ödem ve/veya periferik ödemi de içeren şekilde sıvı tutulumu ile ilişkilendirilebilir. Hastalar standart bakım tedavisi ileizlenmeli ve yönetilmelidir. Ayrıca, bu olaylar bosutinibin geçici olarak durdurulması, dozazaltma ve/veya bosutinib kullanımının sonlandırılmasıyla da yönetilebilir (bkz. bölüm 4.2 ve4.8). Serum lipazSerum lipazda yükselme gözlemlenmiştir. Daha önce pankreatit geçmişi olan hastalarda dikkatli olunması önerilmektedir. Lipaz seviyesindeki yükselmelere abdominal belirtilerin eşliketmesi durumunda, bosutinib kullanımı kesilmeli ve pankreatiti ortadan kaldırmak üzere uyguntanısal tedbirler alınmalıdır (bkz. bölüm 4.2). EnfeksiyonlarBosutinib, hastaları bakteri, mantar, virüs veya protozoan enfeksiyonlarına karşı hassas hale getirebilir. Proaritmi potansiyeliAritminin de eşlik etmediği, otomatik makine değerleri ile elde edilen QTc süresinde uzama gözlemlenmiştir. Bosutinib, daha önce QTc süre uzaması eğilimi geçmişi olan, kontroledilmeyen veya kayda değer düzeyde kalp hastalıkları bulunan (kısa süre önce miyokardenfarktüsü, konjestif kalp yetmezliği, unstabil anjina veya klinik açıdan anlamlı bradikardiyaşamış olanlar) ya da QTc süresini uzattığı bilinen tıbbi ürünler kullanan (ör. anti-aritmi tıbbiürünleri veya QTc süresini uzatabilecek diğer maddeler [bkz. bölüm 4.5]) hastalara dikkatli birşekilde uygulanmalıdır. Hipokalemi ve hipomagnezemi de bu etkiyi arttırabilir. Bosutinib tedavisine başlanmadan önce QTc üzerindeki etkilerin izlenmesi önerilir ve tedavi öncesinde ve klinik olarak gerekli olduğunda bir referans elektrokardiyogramı (EKG) çekilmesiönerilmektedir. Hipokalemi veya hipomagnezemi bosutinib uygulaması öncesinde düzeltilmelive tedavi sırasında düzenli olarak izlenmelidir. Böbrek yetmezliğiBosutinib tedavisi KML hastalarında böbrek fonksiyonlarında klinik olarak anlamlı bir azalmaya neden olabilir. Klinik çalışmalarda, bosutinib ile tedavi edilen hastalarda tahminiglomerüler filtrasyon hızında (eGFR) zaman içinde düşüş gözlemlenmiştir. 400 mg ile tedaviedilen yeni tanı konmuş KF KML hastalarında eGFR'de başlangıca göre medyan düşüş 1. yılda11,1 mL/dk/1,73 m2 ve tedavi almaya devam eden hastalar için 5. yılda 14,1 mL/dk/1,73 m2'dir.500 mg ile tedavi edilen daha önce tedavi almamış KML hastaları eGFR'de 1. yılda 9,2mL/dk/1,73 m2 ve tedavi almaya devam eden hastalar için 5. yılda 12 mL/dk/1,73 m2 ve 10yılda 16,6 mL/ dk/1,73 m2'ye kadar medyan düşüş göstermiştir. 500 mg ile tedavi edilen dahaönce tedavi edilmiş kronik fazda ve ilerlemiş fazda KML hastaları eGFR'de 1. yılda 7,6mL/dk/1,73 m2, tedavi almaya devam eden hastalar için 5. yılda 12,3 mL/dk/1,73 m2 ve 10.yılda 15,9 mL/ dk/1,73 m2'ye medyan düşüş göstermiştir. Daha önce 1 ya da daha fazla TKI iletedavi edilen ve günde 500 mg tedavi uygulanan Ph+ KML hastalarında, tedavi uygulanmaktaolan hastalar için medyan eGFR'de başlangıca göre kaydedilen azalma 1 yılda 9,2 mL/dk/1,73m2 ve 4 yılda 14,5 mL/dk/1,73 m2 olarak saptanmıştır. Böbrek fonksiyonlarının tedavi başlatılmadan önce değerlendirilmesi ve bosutinib tedavisi sırasında yakından izlenmesi önemlidir. Özellikle daha önce böbrek sorunları yaşamış olan yada böbrek fonksiyon bozuklukları için risk faktörleri sergileyen hastalarda (diüretikler,anjiyotensin dönüştürücü enzim (ACE) inhibitörleri, anjiyotensin reseptör blokerleri venonsteroidal antiinflamatuvar ilaçları (NSAİİ'ler) içeren şekilde nefrotoksisite potansiyelibulunan tıbbi ürünlerin kullanımı dahil) dikkatli olunmalıdır. Bir böbrek yetmezliği çalışmasında, orta şiddette ve ciddi böbrek fonksiyonu bozukluğu bulunan gönüllülerde bosutinib maruziyetleri artmıştır. Orta şiddette ve ciddi böbrek bozukluğuolan hastalarda doz azaltma önerilmektedir (bkz. bölüm 4.2 ve 5.2). Serum kreatinin düzeyi > 1,5 x NÜS olan hastalar KML çalışmalarından hariç tutulmuştur. Orta şiddette ve ciddi böbrek yetmezliği olan hastalarda artan maruziyet (EAA) ile ilgilifarmakokinetik bir analizde, çalışmalar sırasında tedavi başlangıcında ciddi böbrek yetmezliğigözlemlenmiştir (bkz. bölüm 4.2 ve 5.2). Yükseltilmiş 600 mg bosutinib alan, orta şiddette böbrek bozukluğu bulunan KML hastaları için klinik veriler oldukça sınırlıdır (n = 3). Asya ırkıPopülasyon farmakokinetik analizlerine göre, Asyalılar daha düşük bir klirense sahipti ve bu da artan maruziyete neden olmuştur. Bu nedenle, bu hastalar özellikle doz artırımı durumundaadvers reaksiyonlar açısından yakından izlenmelidir. Ciddi cilt reaksiyonlarıBosutinib, Stevens-Johnson Sendromu ve Toksik Epidermal Nekroliz gibi şiddetli cilt reaksiyonlarını tetikleyebilir. Bosutinib, tedavi sırasında ciddi cilt reaksiyonları yaşayanhastalarda kalıcı olarak durdurulmalıdır. Tümör lizis sendromuTümör lizis sendromu (TLS) görülme olasılığı nedeniyle, bosutinib tedavisine başlanmadan önce klinik olarak anlamlı dehidrasyonun ve yüksek ürik asit seviyelerinin tedavi edilmesiönerilmektedir (bkz. bölüm 4.8). Hepatit B reaktivasyonuHepatit B virüsü (HBV) kronik taşıyıcısı olan hastalarda, BCR-ABL tirozin kinaz inhibitörleri ile tedavi sonrası, Hepatit B reaktivasyonu ortaya çıkmıştır. Bazı vakalar, karaciğer nakli veyaölüme sebep olan akut karaciğer yetmezliği veya fulminan hepatit ile sonuçlanmıştır. BOSULİF tedavisine başlanmadan önce, hastalar HBV enfeksiyonu açısından test edilmelidir. Pozitif HBV serolojisine sahip (aktif hastalığı olanlar dahil) ve tedavi sırasında HBVenfeksiyonu için pozitif test sonucu veren hastalarda, tedavi başlatılmadan önce karaciğerhastalığı ve HBV tedavisi konusunda uzman hekimlere danışılmalıdır. BOSULİF ile tedaviyeihtiyaç duyan HBV taşıyıcıları, tedavi boyunca ve tedavi sonlandırıldıktan sonra birkaç ayboyunca aktif HBV enfeksiyonu bulgu ve belirtileri için yakından izlenmelidir (bkz. bölüm4.8). FotosensitiviteBosutinib tedavisi ile ilişkili fotosensitivite riski nedeniyle, doğrudan güneş ışığına veya ultraviyole (UV) radyasyonuna maruziyetten kaçınılmalı veya en aza indirilmelidir. Hastalarakoruyucu giysi ve yüksek güneş koruma faktörlü (SPF) güneş kremi gibi önlemleri kullanmalarısöylenmelidir. Sitokrom P 450 (CYP)3A inhibitörleriBosutinibin plazma konsantrasyonunda artış oluşabileceğinden bosutinibin güçlü veya orta düzeyde CYP3A inhibitörleri ile eşzamanlı kullanımından kaçınılmalıdır (bkz. bölüm 4.5). Mümkün olan durumlarda CYP3A inhibisyon potansiyeli olmayan ya da minimum düzeyde olan alternatif bir eş zamanlı tıbbi ürün seçimi önerilmektedir. Bosutinib tedavisi sırasında güçlü veya orta düzeyde bir CYP3A inhibitörünün uygulanması gerektiğinde, bosutinib tedavisine ara verilmesi ya da bosutinib dozunun azaltılması seçeneklerigöz önünde bulundurulmalıdır. CYP3A indükleyicileriBosutinibin plazma konsantrasyonunda düşüş oluşabileceğinden bosutinibin güçlü veya orta düzeyde CYP3A indükleyicileri ile eşzamanlı kullanımından kaçınılmalıdır (bkz. bölüm 4.5). Besinlerin etkisiGreyfurt suyuda dahil greyfurt ürünleri ve CYP3A inhibitörü olduğu bilinen diğer gıdalardan kaçınılmalıdır (bkz. bölüm 4.5). 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer tıbbi ürünlerin bosutinib üzerindeki etkileriCYP3A inhibitörleriBosutunibin güçlü CYP3A inhibitörleri (itrakonazol, ketokonazol, posakonazol, vorikonazol, klaritromisin, telitromisin, nefazodon, mibefradil, indinavir, lopinavir/ritonavir, nelfinavir,ritonavir, sakinavir, boceprevir, telaprevir, greyfurt ürünleri dahil fakat bunlarla sınırlıolmayan) ile veya orta dereceli CYP3A inhibitörleri (flukonazol, siprofloksasin, eritromisin,diltiazem, verapamil, amprenavir, atazanavir, darunavir/ritonavir, fosamprenavir, aprepitant,krizotinib, imatinib dahil fakat bunlarla sınırlı olmayan) ile birlikte kullanıldığında bosutinibplazma konsantrasyonunda bir artış meydana geleceğinden kaçınılmalıdır. Hafif CYP3A inhibitörleri, bosutinib ile birlikte kullanılıyorsa dikkatli olunmalıdır. Mümkün olan durumlarda CYP3A enzimi inhibisyon potansiyeli olmayan ya da minimum düzeyde olan alternatif bir eş zamanlı tıbbi ürün kullanımı önerilmektedir. Eğer bosutinib tedavisi sırasında güçlü veya orta dereceli bir CYP3A inhibitörü uygulanması gerekiyorsa, bosutinib tedavisinin kesilmesi veya doz azaltılması düşünülmelidir. Açlık koşullarında günde 5 doz halinde 400 mg ketokonazolün (güçlü bir CYP3A inhibitörü) günlük tek doz 100 mg bosutinib ile birlikte uygulandığı 24 sağlıklı birey üzerinde yapılan birçalışmada, ketokonazol, bosutinibin tek başına uygulandığı durum ile karşılaştırıldığındabosutinib Cmaks değerini 5,2 kat, plazmadaki bosutinib EAA değerini de 8,6 kat arttırmıştır. Tokluk koşullarında günde tek bir doz halinde 125 mg aprepitantın (orta düzeyde bir CYP3A inhibitörü) günlük tek doz 500 mg bosutinib ile birlikte uygulandığı 20 sağlıklı birey üzerindeyapılan bir çalışmada, aprepitant, bosutinibin tek başına uygulandığı durum ilekarşılaştırıldığında bosutinib Cmaks değerini 1,5 kat, plazmadaki bosutinib EAA değerini de 2kat artırmıştır. CYP3A indükleyicileriBosutinib ile birlikte güçlü CYP3A indükleyicileri (karbamazepin, fenitoin, rifampisin, St. John's Wort dahil ancak bunlarla sınırlı olmayan) veya orta CYP3a indükleyicileri (bosentan,efavirenz, etravirin, modafinil, nafsilin dahil ancak bunlarla sınırlı olmayan) ile birliktekullanıldığında bosutinib plazma konsantrasyonunda bir azalma meydana geleceğindenkaçınılmalıdır. Bosutinibin rifampisin ile eş zamanlı uygulaması sırasında bosutinibteki yüksek düşüş nedeniyle güçlü veya orta şiddette CYP3A uyarıcıları ile eş zamanlı olarak bosutinib dozununarttırılması, maruziyet kaybını yeterli miktarda takviye etmeyebilir. Bosutinibin hafif CYP3A indükleyicileri ile birlikte kullanılması gerektiği durumlarda dikkatli olunmalıdır. Tokluk koşullarında günde 6 doz halinde 600 mg rifampisinin günlük tek doz bosutinib ile birlikte uygulandığı 24 sağlıklı birey üzerinde yapılan bir çalışmada, bosutinib 500 mg'nin tekbaşına uygulandığı durumla karşılaştırıldığında bosutinibe maruz kalma sırasıyla (plazmadaCmaks ve EAA) %14'e ve %6'ya düşmüştür. Proton pompası inhibitörleri (PPİ'ler)Bosutinib PPİ ile eş zamanlı olarak uygulanılırken dikkatli olunmalıdır. PPİ'lere alternatif olarak kısa etkili antasitler düşünülmeli ve bosutinib ile antasit uygulama zamanları mümkünolduğunca birbirinden ayrılmalıdır (ör. bosutinibin sabah, antiasitlerin de akşam alınması).Bosutinib , in vitroolarak pH bağımlı suda çözünürlük göstermektedir. Açlık durumda birdenfazla oral lansoprazol (60 mg) dozu ile eş zamanlı olarak tek bir oral doz halinde bosutinib (400mg) uygulananan 24 sağlıklı gönüllü üzerinde yapılan bir çalışmada 400 mg bosutinibin tekbaşına uygulandığı durumla karşılaştırıldığında bosutinib Cmaks ve EAA değerleri sırasıyla%54'e ve %74'e düşmüştür.Bosutinibin diğer tıbbi ürünler üzerindeki etkileriTokluk durumunda tek doz 500 mg bosutinibin tek doz 150 mg dabigatran eteksilat mesilat (p-glikoprotein [P-gp] substratı) ile birlikte uygulandığı 27 sağlıklı birey üzerinde yapılan bir çalışmada, dabigatran eteksilat mesilatın tek başına uygulandığı durum ile karşılaştırıldığında,bosutinib dabigatranın plazma Cmaks veya EAA değerlerini arttırmamıştır. Çalışma sonuçları,bosutinibin klinik olarak anlamlı P-gp inhibe edici etki sergilemediğini göstermiştir. Bir in vitroçalışmada, CYP1A2, CYP2B6, CYP2C9, CYP2C19 ve CYP3A4 substratları olan tıbbi ürünlerin metabolizmasının bosutinib tarafından indüksiyonun bir sonucu olarak terapötikdozlarda ilaç-ilaç etkileşiminin görülme olasılığının düşük olduğunu göstermiştir.Bir in vitroçalışmada, CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 veya CYP3A4/5 substratları olan tıbbi ürünlerin metabolizmasının bosutinib tarafındaninhibisyonunun bir sonucu olarak terapötik dozlarda ilaç-ilaç etkileşiminin görülme olasılığınındüşük olduğunu göstermiştir.İn vitroçalışmalar klinik olarak anlamlı dozlarda bosutinibin meme kanseri direnç proteini (sistemik BCRP), organik anyon taşıyıcı peptid (OATP)1B1, OATP1B3, organik anyon taşıyıcı(OAT)1, OAT3, organik katyon taşıyıcı (OCT)2'yi inhibe etme potansiyelinin düşük olduğunu;ancak gastrointestinal kanalda BCRP'yi ve OCT1'i imhibe etme potansiyelinin bulunduğunugöstermektedir.Anti-aritmik tıbbi ürünler ve QT'yi uzatabilecek diğer maddelerBosutinib, amiodaron, disopiramid, prokainamid, kinidin ve sotalol gibi anti-aritmik tıbbi ürünleri kullanan ya da klorokin, halofantrin, klaritromisin, domperidon, haloperidol, metadonve moksifloksasin gibi QT uzamasına yol açabilecek diğer tıbbi ürünleri kullanan hastalardadahil QT süre uzaması yaşamış ya da böyle bir risk barındıran hastalarda, dikkatli bir şekildekullanılmalıdır (bkz. bölüm 4.4). Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:Özel veri bulunmamaktadır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kullanım kategorisi:Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadınlara bosutinib tedavisi sırasında ve son bosutinib dozundan sonra en az 1 ay boyunca etkin kontrasepsiyon kullanmaları ve gebe kalmamalarıtavsiye edilmelidir. Ayrıca; hasta kusma ya da ishalin oral kontraseptiflerinin tam emiliminiengelleyerek oral olarak uygulanan doğum kontrol yöntemlerinin etkisini azaltabileceğikonusunda bilgilendirilmelidir. Gebelik dönemiBosutinib'in gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. BOSULİF gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Hamilelerde bosutinib kullanımı ile ilgili sınırlı veri bulunmaktadır. Hayvanlar üzerindekiçalışmalar üreme toksisitesi göstermiştir (bkz. bölüm 5.3). Bosutinib gebelik sırasında veyadoğum kontrol yöntemi kullanmayan çocuk sahibi olma potansiyeli olan kadınlardakullanılması önerilmez. Eğer bosutinib hamilelik sırasında kullanılıyorsa ya da hasta bosutinibalırken gebe kalırsa, fetüse potansiyel bir tehlike olduğu konusunda uyarılmalıdır. Laktasyon dönemiBosutinibin ve metabolitlerinin anne sütüne geçip geçmediği bilinmemektedir. Sıçanlar üzerinde [14C] radyoaktif işaretli bosutinib ile yapılan bir çalışmada, anne sütünde bosutinibtürevli radyoaktivite tespit edilmiştir (bkz. bölüm 5.3). Emzirilen bebek üzerindeki potansiyelrisk göz ardı edilemez. Bosutinib ile tedavi sırasında emzirmeye son verilmelidir. Üreme yeteneği/FertiliteKlinik olmayan bulgulara dayanarak, bosutinibin insanlarda üreme fonksiyonunu ve fertiliteyi bozma potansiyeli vardır (bkz. bölüm 5.3). Bosutinib tedavisi nedeni ile fertilitede bozulmapotansiyeli bulunduğundan bosutinib ile tedavi edilen erkeklerin tedavi öncesi spermsaklanması konusunda görüş almaları önerilmektedir. 4.7 Araç ve makine kullanımı üzerindeki etkilerBosutinibin araç ve makine kullanma kabiliyeti üzerinde etkisi yoktur ya da önemsenmeyecek kadar azdır. Bununla birlikte, eğer bosutinib kullanan bir hasta, baş dönmesi, yorgunluk, görmebozukluğu araç ya da makine kullanımını etkileyebilecek başka istenmeyen etkilerlekarşılaşması durumunda, istenmeyen etki devam ettiği sürece bu faaliyetlerden kaçınmalıdır. 4.8 İstenmeyen etkilerGüvenlilik profilinin özetiToplamda 1.372 Ph+ lösemi hastası, en az 1 doz monoterapi bosutinib almıştır. Tedavinin medyan süresi 26,30 aydır (aralık: 0,03-170,49 ay). Bu hastalar, yeni tanı konmuş Ph+ KF KMLhastaları ya da önceki tedaviye karşı direnç göstermiş ya da tedaviyi tolere etmemiş kronik,akselere veya blastik faz KML veya Ph+ akut lenfoblastik lösemi (ALL) hastalarıdır. Buhastalar arasından 268'i (400 mg başlangıç dozu) ve 248'i (500 mg başlangıç dozu) daha öncetedavi edilmemiş KML hastalarının dahil olduğu 2 Faz 3 çalışmasından, 60'ı (400 mg başlangıçdozu) daha önce tedavi görmemiş KML hastalarında yapılan bir Faz 2 çalışmasından, 570 ve63'ü (Faz 2: 500 mg başlangıç dozu) daha önce tedavi edilmiş Ph+ lösemi hastaları üzerindeyapılan 2 Faz 1/2 çalışmasından ve 163'ü (500 mg başlangıç dozu) daha önce tedavi edilmişKML hastalarında yapılan bir Faz 4 çalışmasındandır. Medyan tedavi süresi sırasıyla 55,1 ay(aralık: 0,2-60,05 ay), 61,6 ay (0,03-145,86 ay), 15,3 ay (aralık: 0,3-21,8 ay) 11,1 ay (aralık:0,03-170,49 ay), 30,2 ay (aralık: 0,2-85,6 ay), ve 37,80 ay (aralık: 0,16-50 ay)'dır. Güvenlilikanalizi tamamlanan bir uzatma çalışmasının verilerini içermektedir. 1.349 (%98,3) hasta için herhangi bir toksisite derecesinde en az 1 advers reaksiyon bildirilmiştir. Hastaların >%20'si için en sık bildirilen advers reaksiyonlar ishal (%80,4), bulantı(%41,5), karın ağrısı (%35,6), trombositopeni (%34,4), kusma (%33,7), döküntü (%32,8),yorgunluk (%32), alanin aminotranseraz (ALT) düzeyinde artış (%28), anemi (%27,2), pireksi(%23,4), aspartat aminotransferaz (AST) düzeyinde artış (%22,5), ve baş ağrısıdır (%20,3). 943(%68,7) hasta için en az 1 Derece 3 veya Derece 4 advers reaksiyon bildirilmiştir. Hastaların>%5'inde görülen Derece 3 veya Derece 4 advers reaksiyonlar; trombositopeni (%19,7), ALTartışı (%14,6), nötropeni (%10,6), ishal (%10,6), anemi (%10,3), lipaz düzeyinde artış (%10,1),AST artışı (%6,7) ve döküntüdür (%5). Advers reaksiyonların listesiBosutinib klinik çalışmalarında aşağıdaki advers reaksiyonlar rapor edilmiştir. Bunlar yeni tanı konmuş KF KML ya da önceki tedaviye direnç göstermiş ya da tedaviyi tolere etmemiş kronik,akselere veya blastik faz KML veya Ph+ akut lenfoblastik lösemi (ALL) tedavisine ve dahaönce en az 1 doz tek ajanlı bosutinib almış 1.372 hastadan gelen advers reaksiyon verilerinindeğerlendirilmesini temsil etmektedir. Advers reaksiyonlar sistem organ sınıfına, sıklık kategorisine ve şiddetinin derecesine göre listelenmektedir. Sıklık kategorileri şu şekilde tanımlanmaktadır: Çok yaygın (>l/10); yaygın(>l/100 ile <1/10); yaygın olmayan (>l/1000 ile <1/100); seyrek (>l/10.000 ile <1/1000); çokseyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her bir sıklıkgrubu içinde, advers reaksiyonlar azalan ciddiyet sırasıyla sunulmaktadır. Enfeksiyonlar ve enfestasyonlarÇok yaygın: Solunum yolu enfeksiyonu (alt solunum yolu enfeksiyonu, viral solunum yolu enfeksiyonu, üst solunum yolu enfeksiyonu, viral üst solunum yolu enfeksiyonu dahil),nazofarenjit Yaygın: Pnömoni (atipik pnömoni, bakteriyel pnömoni, fungal pnömoni, nekrotizan pnömoni, streptokokal pnömoni dahil), grip (H1N1 grip dahil), bronşit (Kist ve polipler de dahil olmak üzere) iyi huylu ve kötü huylu neoplazmalarYaygın olmayan: Tümör lizis sendromu* Kan ve lenf sistemi hastalıklarıÇok Yaygın: Trombositopeni (azalmış platelet sayımı dahil), nötropeni (azalmış nötrofil sayımı dahil), anemi (azalmış hemoglobin, azalmış kırmızı kan hücre sayısı dahil), Yaygın: Lökopeni (azalmış beyaz kan hücresi sayımı dahil) Yaygın olmayan: Febril nötropeni, granülositopeni Bağışıklık sistemi hastalıklarıYaygın: İlaç aşırı duyarlılığı Yaygın olmayan: Anafilaktik şok Metabolizma ve beslenme hastalıklarıÇok yaygın: İştah azalmasıYaygın: Dehidratasyon, hiperkalemi (kandaki potasyum artışı dahil), hipofosfatemi (kandaki fosforun azalması dahil) Sinir sistemi hastalıklarıÇok yaygın: Baş dönmesi, baş ağrısı Yaygın: Disguzi Kulak ve iç kulak hastalıklarıYaygın: Kulak çınlaması Kardiyak hastalıklarYaygın: Perikardiyal efüzyon Yaygın olmayan: Perikardit Vasküler hastalıklarYaygın: Hipertansiyon (yüksek kan basıncı, yüksek sistolik kan basıncı, esansiyel hipertansiyon, hipertansif kriz dahil) Solunum, göğüs bozuklukları ve mediastinal hastalıklarıÇok yaygın: Plevral efüzyon, dispne, öksürükYaygın: Pulmoner hipertansiyon (pulmoner arteriyel hipertansiyon, pulmoner arter basıncı artışı dahil), solunum yetmezliği Yaygın olmayan: Akut pulmoner ödem (pulmoner ödem dahil) Bilinmiyor: İnterstisyel akciğer hastalığı Gastrointestinal hastalıklarÇok yaygın: Diyare, kusma, bulantı, abdominal ağrı (karın bölgesinde rahatsızlık, alt karın bölgesinde ağrı, üst karın bölgesinde ağrı, karın bölgesinde hassasiyet, gastrointestinal ağrı)Yaygın: Gastrointestinal hemoraji (anal kanama, gastrik kanama, intestinal kanama, altgastrointestinal kanama, rektal kanama, üst gastrointestinal kanama dahil), pankreatit (akutpankreatit dahil), gastrit Hepatobiliyer hastalıklarYaygın: Hepatotoksisite (hepatit, toksik hepatit, karaciğer bozukluğu dahil), hepatik fonksiyon anormaliği (hepatik enzim artışı, karaciğer fonksiyon testlerinde anormallik, karaciğerfonksiyon testlerinde artış, transaminazda artış dahil) Yaygın olmayan: Karaciğer hasarı (ilaçla indüklenen karaciğer hasarı, hepatosellüler hasar dahil) Deri ve deri altı doku hastalıklarıÇok yaygın: Döküntü (maküler döküntü, makülopapüler döküntü, papüler döküntü, pruritik döküntü dahil), kaşıntıYaygın: Fotosensitivite reaksiyonu, (polimorf ışık erüpsiyonu dahil), ürtiker, akne Yaygın olmayan: Eritema multiforma, eksfolyatif döküntü, ilaç erüpsiyonuBilinmiyor: Stevens-Johnson Sendromu*, Toksik epidermal nekroliz* Kas-iskelet bozuklukları ve bağ doku ve kemik hastalıklarıÇok yaygın: Artralji, sırt ağrısı Yaygın: Miyalji Böbrek ve idrar yolu hastalıklarıYaygın: Akut böbrek hasarı, böbrek yetmezliği, böbrek fonksiyon bozukluğu Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıÇok yaygın: Ödem (göz kapağı ödemi, yüzde ödem, genel ödem, lokalize ödem, periferal ödem, periorbital ödem, periorbital şişme, periferal şişme, şişme, göz kapağı şişmesi dahil), pireksi,yorgunluk (asteni, halsizlik dahil) Yaygın: Göğüs ağrısı (göğüs bölgesinde rahatsızlık dahil), ağrı AraştırmalarÇok yaygın: Lipaz artışı (hiperlipazemi dahil), Alanin aminotransferaz artışı (anormal alanin aminotransferaz dahil), Aspartat aminotransferaz artışı, Kan kreatinin artışıYaygın: Elektrokardiyogram QT uzaması (Uzun QT sendromu dahil), kanda amilaz artışı(hiperamilazemi dahil), kan kreatin fosfokinaz artışı, Gama glutamiltransferaz artışı, Kanbilirubin artışı (Hiperbilirubinemi dahil, Konjuge bilirubin artışı, Konjuge olmayan kanbilirubin artışı dahil) * Pazarlama sonrası tanımlanan ADR Seçilen advers reaksiyonların tanımıAşağıda yer alan açıklamalar; yeni tanı konmuş KF KML hastaları veya daha önce tedaviye karşı direnç göstermiş ya da tedaviyi tolere edememiş olan kronik, akselere veya blastik fazKML veya Ph+ ALL hastaları için en az bir doz bosutinib almış 1.372 hastalık bir güvenlilikpopülasyonuna dayanmaktadır. Kan ve lenf sistemi hastalıklarıAnemi rapor edilen 372 hastadan (%27,1) 6'sında anemi nedeniyle bosutinib kullanımına son verilmiştir. 95 hastada (%25,5) Derece 1 maksimum toksisite, 135 hastada (%36,3) Derece 2,113 hastada (%30,4) Derece 3 ve 29 hastada (%7,8) Derece 4 meydana gelmiştir. Bu hastalararasında, ilk olaya kadar geçen medyan süre 29 gündür (aralık: 1-3.999 gün) ve olay başınamedyan süre 22 gündür (aralık: 1-3.682 gün). Nötropeni rapor edilen 209 hastadan (%15,2) 19'unda nötropeni nedeniyle bosutinib kullanımına son verilmiştir. 19 hastada (%9,1) Derece 1 maksimum toksisite, 45 hastada(%21,5) Derece 2, 95 hastada (%45,5) Derece 3 ve 50 hastada (%23,9) Derece 4 meydanagelmiştir. Bu hastalar arasında ilk olaya kadar geçen medyan süre 56 gündür (aralık: 1-1.769gün) ve olay başına medyan süre 15 gündür (aralık: 1-913 gün). Trombositopeni rapor edilen 472 hastanın (%34,4) 42'sinde trombositopeni nedeniyle bosutinib kullanımına son verilmiştir. 114 hastada (%24,2) Derece 1 maksimum toksisite, 88 hastada(%18,6) Derece 2, 172 hastada (%36,4) Derece 3 ve 98 hastada (%20,8) Derece 4 meydanagelmiştir. Bu hastalar arasında, ilk olaya kadar geçen medyan süre 28 gündür (aralık: 1-1.688gün) ve olay başına medyan süre 15 gündür (aralık: 1-3.921 gün). Hepatobiliyer hastalıklarALT veya AST artışlarını (tüm derecelerde) advers reaksiyonları olarak bildiren hastalar arasında, çalışmada gözlemlenen başlangıç için medyan süre 29 gündür; bunda ALT ve ASTiçin başlangıç aralığı 1-3.995 gündür. Bir olay için medyan süre, A^T ve AST için sırasıyla 17gün (aralık: 1-1.148 gün) ve 15 gündür (aralık: 1-803 gün). Alternatif nedenler olmadan, bosutinib ile tedavi edilmiş 2/1.711 (%0,1) kişide ilaca bağlı karaciğer hasarı (ALT veya AST > 3 x NÜS ile eşzamanlı olarak total bilirubin > 2 x NÜS vealkalen fosfataz < 2 x NÜS olacak şekilde tanımlanır) gözlenmiştir. Hepatit B reaktivasyonuBCR-ABL TKI'ler ile ilişkili olarak hepatit B reaktivasyonu bildirilmiştir. Bazı vakalarda karaciğer nakli gerektirecek ya da ölümcül olabilecek düzeyde akut karaciğer yetmezliği veyafulminan hepatit görülmüştür (bkz. bölüm 4.4). Gastrointestinal hastalıklarİshal gözlenen 1.103 (%80,4) hastadan, 14'ü bu olay nedeniyle bosutinibi bırakmıştır. Hastaların 756'sına (%68,5) ishal tedavisi için eşzamanlı olarak tıbbi ürünler verilmiştir.Derece 1 maksimum toksisite hastaların 575'inde (%52,1), Derece 2 383'ünde (%34,7), Derece3 144'ünde (%13,1), Derece 4 ise 1 hastada (%0,1) meydana gelmiştir. İshal advers olaylarıyaşayan hastalar arasında, ilk olaya kadar geçen medyan süre 2 gündür (aralık: 1-2.702 gün) veher dereceden ishal için medyan süre 2 gündür (aralık: 1-4.247 gün). İshal olayı yaşayan 1.103 hasta arasında 218 hasta (% 19,8) tedaviye ara verilerek tedavi edilmiş ve bunlar arasında 208'i (%95,4) yeniden bosutinib tedavisine dönmüştür. Yeniden tedaviyedönenler arasında, 201'i (%96,6) daha sonra bir olay yaşamamış ya da daha sonra yaşanan ishalolayı nedeniyle bosutinibi bırakmamıştır. Kardiyak hastalıklarYedi hastada (%0,5) QTcF süre uzaması (500 ms'den büyük) gözlemlenmiştir. On bir (%0,8) hasta, başlangıç düzeyinden > 60 ms QTcF artışı yaşamıştır. QTc süre uzamasını da içerenşekilde kontrol edilemeyen veya kayda değer düzeyde kalp hastalığı bulunan hastalar,başlangıçta klinik çalışmalara dahil edilmemiştir (bkz. bölüm 5.1 ve 5.3). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TUFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta:[email protected]; tel: 0 800 314 0o 08; faks: 0 312 218 35 99) 4.9 Doz aşımı ve tedavisiKlinik çalışmalarda bosutinib aşırı dozu ile ilgili deneyim birkaç vaka ile sınırlıdır. Aşırı dozda bosutinib alan hastalar gözlemlenmeli ve bu hastalara uygun destekleyici tedaviuygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri, BCR-ABL tirozin kinaz inhibitörleriATC kodu: L01EA04 Etki mekanizmasıBosutinib, farmakolojik olarak kinaz inhibitörü olarak bilinen bir tıbbi ürün sınıfına aittir. Bosutinib KML'yi destekleyen anormal Bcr-Abl kinazını inhibe eder. Modelleme çalışmaları,bosutinibin Bcr-Abl kinaz alanını bağladığını göstermiştir. Bosutinib aynı zamanda Src, Lynve Hck'yi de içeren Src familyasını da inhibe etmektedir. Bosutinib, asgari olarak PDGFreseptörü ile c-Kit'i inhibe etmektedir. İn vitroçalışmalarda, bosutinib belirlenmiş KML hücre dizisinin, Ph+ ALL hücre dizilerinin ve hastadan elde edilen primer primitif KML hücrelerinin çoğalması ve sağkalımını inhibeetmiştir. Bosutinib, murin miyeloid hücre dizilerinde bulunan Bcr-Abl'nin 18 imatinibe karşıdirençli formundan 16'sını inhibe etmiştir. Bosutinib tedavisi, çıplak farelerde KMLtümörlerinin büyüme boyutunda düşüş sağlamış ve Bcr-Abl'nin imatinibe karşı dirençliformlarında murin miyeloid tümörlerinin büyümesini inhibe etmiştir. Bosutinib aynı zamandareseptör tirosin kinazlar c-Fms, EphA ve B reseptörleri, Trk familyası kinazları, Axl familyasıkinazları, Tec familyası kinazları, ErbB familyasının bazı üyeleri, reseptör olmayan tirosinkinaz Csk, Ste20 familyasının serin/treonin kinazları ve iki kalmoduline bağlı protein kinazınıda inhibe etmektedir.Farmakodinamik etkilerSağlıklı gönüllüler üzerinde gerçekleştirilen randomize, tek dozlu, çift kör (bosutinib açısından), çapraz, plasebo ve açık etiketli moksifloksasin kontrollü bir çalışmada 500 mgbosutinib uygulamasının düzeltilmiş QTc üzerindeki etkisi değerlendirilmiştir. Bu çalışmadan elde edilen veriler, bosutinibin önerilen doz olan ve yemekle alınan günde 500 mg bosutinibin, supraterapötik plazma konsantrasyonu koşullarında sağlıklı gönüllülerde QTcsüre uzamasına neden olmadığını göstermektedir. Sağlıklı gönüllülerde ağız yoluyla tek dozhalinde alınan 500 mg bosutinibin (terapötik doz) ve 400 mg ketokonazol ile 500 mgbosutinibin (supraterapötik bosutinib konsantrasyonlarını elde etmek için) uygulanmasınınardından, tek taraflı %95 güven aralığı (GA) üst sınırında, QTc'deki orta değişim, tüm dozsonrası zaman noktalarında 10 ms'den düşük olmuş ve QTc süre uzatımını ifade eden herhangibir advers olay gözlemlenmemiştir. Karaciğeri hasar görmüş gönüllülerde karaciğer fonksiyonlarında azalma ile QTc süre uzaması > 450 ms sıklığında artış gözlemlenmiştir. Daha önce 500 mg bosutinib ile tedavi edilen Ph+lösemi hastaları üzerinde yapılan bir Faz 1/2 klinik çalışmada, 570 hastadan 9'unda (%1,6)başlangıçtan itibaren QTcF'de > 60 ms'lik artış gözlemlenmiştir. Yeni Ph+ KF KML tanısıkonmuş 400 mg bosutinib ile tedavi edilen hastalar üzerinde yapılan bir Faz 3 klinik çalışmada,bosutinib tedavi grubunda (N=268) başlangıca göre QTcF'de > 60 ms'lik artışı olan hastabulunmamaktadır. Yeni Ph+ KF KML tanısı konmuş 500 mg bosutinib ile tedavi edilen hastalarüzerinde yapılan bir Faz 3 klinik çalışmada, bosutinib alan 248 hastadan 2'sinde (%0,8)başlangıçtan itibaren QTcF'de >60 ms'lik artış gözlemlenmiştir. Daha önce 1 ya da daha fazlaTKI ile tedavi edilen ve bosutinib 500 mg tedavisi uygulanan Ph+ KML hastalarında (N=163)yapılan Faz 4 klinik çalışmada, hiçbir hastada QTcF'de başlangıca göre >60 ms artış ortayaçıkmamıştır. Bosutinibin proaritmi potansiyeli göz ardı edilemez. Klinik etkililikDaha önce tedavi edilmemiş KML ile kronik _ fazdaki klinik çalışmaBosutinib 400 mg çalışmasıYeni tanı konmuş yetişkin Ph+ KF KML hastalarında günde 400 mg tek başına bosutinibin etkililik ve güvenliliğini değerlendirmek üzere tek başına günde 400 mg imatinib ilekarşılaştırmalı 2 kollu, Faz 3, açık etiketli, çok merkezli süperiorite çalışması yürütülmüştür.Çalışmada b2b2 ve/veya b3b2 transkripti bulunan ve başlangıçta BCR-ABL kopyaları >0 olan487 Ph+ KML hastasını (modifiye edilmiş ITT (mlTT) popülasyonu) içeren Ph+ veya Ph- yenitanı konmuş 536 (her tedavi grubunda 268'er hasta) KF KML hastası (ITT popülasyonu)randomize edilmiştir. Çalışmanın primer etkililik sonlanım noktası 12. ayda (48 hafta) mlTT popülasyonda imatinib tedavi grubuna kıyasla bosutinib tedavi grubunda major moleküler bir yanıt (MMY) göstermeoranıdır. MMY; merkezi laboratuvar tarafından değerlendirilen minimum 3.000 ABLtranskripti olacak şekilde, uluslararası skalada < %0,1 BCR A^L/A^L oranı (standart halegetirilmiş başlangıç noktasından >3 log azalmaya denk gelir) olarak tanımlanmıştır. Ana sekonder sonlanım noktaları 12 ayda TSY, TSY süresi, MMY süresi, olaysız sağkalım ve genel sağkalımdır. 12. ayda TSY; kemik iliğinden elde edilen > 20 metafazın kromozombantlama analizinde Ph+ metafazların bulunmaması veya uygun bir sitogenetik değerlendirmebulunmuyorsa MMY olarak tanımlanmıştır. 12. ayda MMY dışındaki sonlanım noktaları içinp-değerleri ve 12 ayda TSY çoklu karşılaştırmalar için ayarlanmamıştır. mlTT popülasyonu için başlangıç özellikleri 2 tedavi grubu arasında yaş (bosutinib grubu için medyan yaş 52 ve imatinib grubu için 53; hastaların sırasıyla %19,5'i ve %17,4'si 65 yaş veüzeridir), cinsiyet (sırasıyla %42,3 ve %44 kadın), ırk (sırasıyla Kafkasyalı %78 ve %77,6,Asyalı %12,2 ve %12,4, Siyahi veya Afrikan Amerikan %4,1 ve %4,1, ve Diğer %5,7 ve %5,4,ve imatinib grubunda 1 bilinmeyen) ve Sokal risk skoru (sırasıyla düşük risk %35 ve %39,4,orta risk %43,5 ve %38,2, yüksek risk %21,5 ve %22,4) açısından iyi dengelenmiştir. mlTT popülasyonunda 60 aylık takip sonrasında, bosutinib ile tedavi edilen hastaların (N=246) %60,2'si ve imatinib ile tedavi edilen hastaların (N=239) %59,8'i halen ilk basamak tedavialmaktadır. mlTT popülasyonunda 60 aylık takip sonrasında, hastalığın AF veya BF KML'ye ilerlemesi nedeniyle çalışmayı bırakma imatinib ile tedavi edilen hastalar için %1,7'e kıyasla bosutinib iletedavi edilen grupta %0,8 olmuştur. Altı (%2,4) bosutinib hastası ve yedi (%2,9) imatinibhastası AF KML veya BF KML'ye dönüşmüştür. Araştırmacı tarafından değerlendirilensuboptimal yanıt veya tedavi başarısızlığı nedeniyle çalışmanın bırakılması, imatinib ile tedaviedilen gruptaki hastaların %15,5'ine kıyasla bosutinib ile tedavi edilen gruptaki hastaların%5,3'ünde görülmüştür. Çalışma sırasında bosutinib grubunda 12 (%4,9) ve imatinib grubunda14 (%5,8) hasta hayatını kaybetmiştir. ITT popülasyonunda ek transformasyon meydanagelmemiştir, ITT popülasyonunda bosutinib kolunda 2 ek ölüm meydana gelmiştir. Tablo 2'de MMY ve TSY etkililik sonuçları özetlenmiştir.
12. ayda mlTT popülasyonunda, MY4 oranı (minimum 9.800 ABL transkript ile < %0,01 BCR ABL [standardize edilmiş başlangıçtan >4 log azalmaya denk gelir] şeklinde tanımlanır) imatinib tedavi grubuna kıyasla bosutinib tedavi grubunda daha yüksek bulunmuştur (bosutinib grubunda %20,7'ye [%95 GA: %15,7-%25,8] karşılık imatinib grubunda %12 [%95 GA: %7,9-%16,1], tahmini risk oranı 1,88 [%95 GA: 1,15-3,08], tek taraflı p değeri=0,o052). 3, 6 ve 9. aylarda MMY'li hastaların oranı imatinib tedavi grubuna kıyasla bosutinib tedavi grubunda daha yüksektir (Tablo 3). Tablo 3-mlTT popülasyonunda 3, 6 ve 9. aylarda tedaviye göre MMY karşılaştırması
60. ayda mlTT popülasyonunda MMY, MY4 ve MY45 olan hastaların oranı, imatinib grubuna kıyasla bosutinib grubunda daha yüksekti (Tablo 4). Sokal risk alt gruplarında 60. aydaki MMYoranları Tablo 5'te özetlenmiştir.
Tablo 5 - 60. ayda mITT popülasyonunda Sokal risk skoruna göre MMY özeti
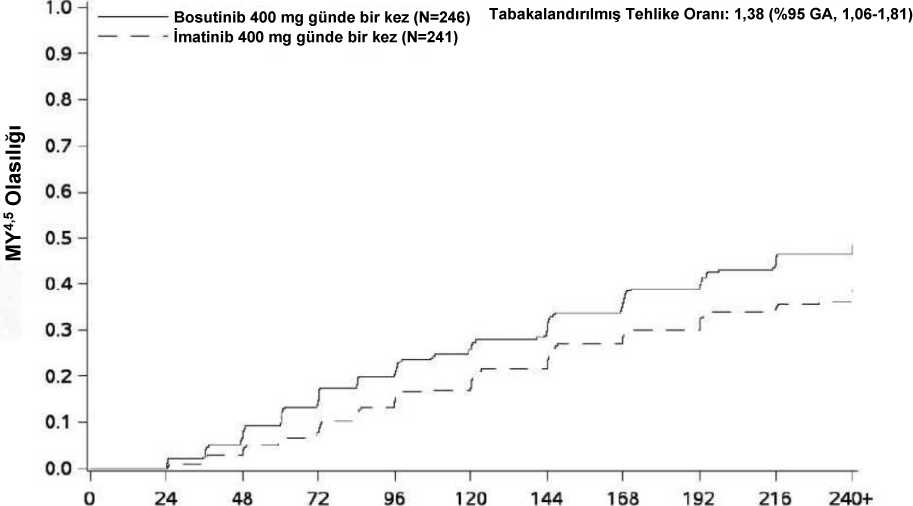
TSY'siz tedaviyi bırakmanın karşılaştırmalı riski için ayarlanmış TSY'nin kümülatif insidansı mlTT popülasyonunda bosutinib tedavi grubunda imatinib tedavi grubuna kıyasla dahayüksektir (60. ayda %83,3'e [%95 GA: %78,1-%87,4] karşılık %76,8 [%95 GA: %70,9-%81,6]; kademelenmiş orantısal alt dağıtımlı bir tehlike modelinden tehlike oranı [HR]: 1,35[%95 GA: 1,11-1,64]). TSY'ye (sadece yanıt verenler) olan medyan süre bosutinib grubunda24 haftaya (aralık: 1l,4-120,7) karşılık imatinib grubunda 24,3 hafta (aralık: 11,4-96,6)olmuştur. MMY, MY4 ve MY4,5'e kadar geçen medyan süre mlTT popülasyonunda (sadece yanıt verenler) bosutinib tedavi grubu için sırasıyla 36,1 hafta (aralık: 11,9-241,9), 83,7 hafta (aralık:12,4-244,3), 108 hafta (aralık: 24,1-242,1) iken, imatinib tedavi grubunda sırasıyla 47,7 hafta(aralık: 12,1-216,1), 84,4 hafta (aralık: 23,6-241,9), 120,4 haftaydı (aralık: 24,6 -240,7). Şekil 1 ila 3'te gösterildiği gibi, olay olmadan tedaviyi bırakmanın karşılaştırmalı riski için ayarlanmış MMY, MY4 ve MY4,5'in kümülatif insidansı, imatinib ile karşılaştırıldığındabosutinib ile daha yüksekti. Şekil 1 - Kümülatif MMY insidansı (mlTT popülasyonu)
Bosutinib: 246(0> 2O6tZ0) 94(111)58(139)30(162)19[170)12(173)10(175)6(179)4(181)3(182)İmatinib: 241(0) 2D4(11)116(ei)62(116>Z9(13S)23(145)16(153)10(156)10(155)90 57)5(150) 1.00,9-,5040.30.20.1-0.0. Bosutinib 400 mg günde bir kez (N=246) Tabakalandırılmış Tehlike Oranı: 1,32 (%95 GA, 1,04-1,68) ^ İmatinib 400 mg günde bir kez (N=241)
n 24T" 48T" 72
_ /
T" 96 12014416Ö192215Randomizasyondan itibaren geçen süre (hafta)240+Risk altındaki sayı (Kümülatif Olaylar):Bosutinib: 246(0) 216(2) 160(42)127I67)104(85)86(97)70(112)56(122)50(129)39(138) 28(145)İmatinib: 241(0) 209(3) 172(25)133(41)101(65)66(77)76(85)61(96)49(107)39(115} 28(120)
Bosutinib: 246(0)218(0)185(16)159(36)138(30)116(64)103(76)89(88)76(98)65(108)50(1191İmatinib: 241(0}210(0)188(8)155(19)128(95)116(42)107(54)86(69)79(73)67(83)47(93)188(8)155(19)128(95)116(42)107(54)86(69)79(73)67(83)47(93)mlTT popülasyonunda, TSY'ye ulaşan hastalar arasında 4. yılda yanıtın sürdürülmesi için Kaplan-Meier tahmini, bosutinib ve imatinib gruplarında sırasıyla %97,4 (%95 GA: %93,9-%98,9) ve %93,7 (%95 GA: %88,9-%96,5) (HR 0,39 [%95 GA: 0,14-1,13] idi. MMY'ye ulaşanhastalar arasında 4. yılda yanıtın sürdürülmesi için Kaplan-Meier tahmini, bosutinib ve imatinibgruplarında sırasıyla %92,2 (%95 GA: %86,8-%95,4) ve %92 (%95 GA: %85,9-%95,5) (HR 1,09 [%95 GA: 0,49-2,44] idi. 60. ayda, mITT popülasyonunda bosutinib ve imatinib ile tedavi edilen hastaların sırasıyla %43,9'u (%95 GA: %37,7-%50,1) ve %38,6'sında (%95 GA: %32,4-%44,7) (tahmini risk oranı1,24 [%95 GA: 0,87, -1,78]), şu kriterlere göre tanımlanan MY4 mevcuttu: 1 yıllık süre zarfındayapılan tüm değerlendirmelerde en az MY4 ile minimum 3 yıl boyunca tedavi. 60. ayda mITT popülasyonunda tedavi sırasında olaysız sağkalım olaylarının kümülatif insidansı bosutinib kolunda %6,9 (%95 GA: %4,2-%10,5) ve imatinib kolunda %10,4 (%95GA: %6,9-%14,6) (HR 0,64, %95 GA: 0,35-1,17) idi. 60. ayda mITT popülasyonunda genel sağkalımın Kaplan-Meier tahminleri bosutinib ve imatinib hastaları için sırasıyla %94,9 (%95 GA: %91,1-%97) ve %94 (%95 GA: %90,1-%96,4) (HR 0,80, %95 GA: 0.37-1.73) olmuştur. Retrospektif bir analizde, ITT popülasyonundaki değerlendirilebilir hastalar arasında, bosutinib kolunda daha fazla hastada 200/248 (%80,6) imatinib kolundaki hastalara 153/253 (%60,5)kıyasla erken moleküler yanıt (BCR-ABL transkriptleri 3. ayda <%10) elde edilmiştir, tahmini risk oranı 2,72 (%95 GA: 1,82-4,08). Erken moleküler yanıt veren ve vermeyen bosutinib hastalarında 60. aydaki MMY ve olaysız sağkalım Tablo 6'da özetlenmiştir.
60. ayda mlTT popülasyonunda, bosutinib kolunda [6 (%2,4) bosutinib ve 12 (%5) imatinib] daha az hastada saptanabilir yeni mutasyonlar görülmüştür. İmatinibe karşı direnç gösteren veya imatinibi tolere etmeyen, kronikfazda (KF), akselere fazda (AF) ve blastik fazda (BF) KML hastaları üzerinde yapılan Faz 1/2 klinik çalışmaDaha önce 1 TKI (imatinib) veya 1'den fazla TKI (imatinib ardından dasatinib ve/veyanilotinib) ile tedavi edilmiş kronik fazda, akselere fazda ve blastik faz için ayrı kohortlarlaimatinibe karşı direnç gösteren veya imatinibi tolere etmeyen hastalarda günde bir defa verilen500 mg bosutinibin etkililiği ve güvenliliğinin değerlendirilmesi için tek kollu, Faz 1/2 açıketiketli, çok merkezli bir klinik çalışma yürütülmüştür.Bu araştırmada, daha önce yalnızca 1 TKI (imatinib) ile tedavi edilen kronik faz KML hastaları, daha önce imatinib ve en az 1 ilave TKI (dasatinib ve/veya nilotinib) ile tedavi edilen kronikfaz KML hastaları, daha önce en az 1 TKI (imatinib) ile tedavi edilmiş akselere veya blastfazındaki KML hastaları ve daha önce en az 1 TKI (imatinib) ile tedavi edilmiş Ph+ ALLhastalarını içeren şekilde bu araştırmada bosutinib tedavisi görmüş 570 hasta bulunmaktadır. Çalışmanın birincil etkililik sonlanım noktası, imatinibe karşı direnç gösteren, daha önce yalnızca 1 TKI (imatinib) ile tedavi edilmiş kronik faz KML hastalarında 24. haftada majörsitogenetik yanıt (MSY) oranı olmuştur. Diğer etkililik sonlanım noktaları, kümülatifsitogenetik ve moleküler yanıt oranlarını, sitogenetik ve moleküler yanıtlara kadar geçen süreyive bu yanıtların süresini, başlangıç mutasyonlarındaki yanıtı, AF/BF'ye dönüşüm,progresyonsuz sağkalım ve tüm kohortlar için genel sağkalımı içermektedir. Faz 1/2 çalışmanın sonunda halen bosutinib kullanan ve araştırmacının değerlendirmesine göre bosutinib tedavisinin yarar sağladığı hastaların yanı sıra Faz 1/2 çalışma kapsamında daha öncebosutinib kullanmayı bırakan ve uzun süreli sağkalım takibi uygulanan veya Faz 1/2 çalışmayıtamamlayan hastaların uzatma çalışmasına kayıt için uygun olduğu kabul edilmiştir. Gerekbosutinib tedavisi uygulanan gerekse uzun süreli sağkalım takibinde olan her hasta, sonhastanın 10 yıllık takip süresine (ilgili hastanın Faz 1/2 çalışmada ilk bosutinib dozununuygulandığı tarihe göre hesaplanmaktadır) ulaşmasına kadar uzatma çalışmasına devametmiştir. Uzatma çalışmasının etkililik sonlanım noktaları sitogenetik ve moleküler yanıtların süresini, AF/BF'ye transformasyonu, progresyonsuz sağkalım ve genel sağkalımı içermiştir. Etkililik analizleri, tamamlanan bu uzatma çalışmasından elde edilen verileri içermektedir. KF KML HastalarıDaha önce imatinib ve en az 1 ilave TKI ile tedavi edilmiş Ph+ KF KML hastaları için etkililik sonuçları (minimum takip 120 ay, medyan tedavi süresi 9 ay (0,23 - 164,28 ay) ve sırasıyla 60.ve 120. ayda halen tedavi almaya devam eden hasta oranları %20,2 ve %7,6) ve daha önceyalnızca imatinib ile tedavi edilmiş Ph+ KF KML hastaları için sonuçlar (minimum takip 120ay, medyan tedavi süresi 26 ay (0,16 - 170,49 ay) ve sırasıyla 60. ve 120. ayda halen tedavialmaya devam eden hasta oranları %40,5 ve %19,4) Tablo 7'de verilmektedir. Akselere ve blastik fazlardaki KML hastalarıAF (minimum takip 120 ay, medyan tedavi süresi 10 ay (0,10 - 156,15 ay) ve sırasıyla 60 ve 120. ayda halen tedavi almaya devam eden hasta oranları %12,7 ve % 7,6) ve BF (minimumtakip 120 ay, medyan tedavi süresi 2,8 ay (0,03 - 71,38 ay) ve sırasıyla 60. ve 120. ayda halentedavi almaya devam eden hasta oranları %3,1ve % 0) Ph+ KML hastaları için etkililiksonuçları Tablo 7'de verilmiştir.
Görüntüleme tarihi: Faz 1/2 çalışma 2 Ekim 2015, Uzatma tarihi 2 Eylül 2020 Sitogenetik Yanıt kriterleri: MSY, tam [kemik iliğinden %0 Ph+ metafazları veya floresan in situ hibridizasyondan (FISH) <%1 pozitif hücreler] veya kısmi (%1-%35) sitogenetik yanıtları içermiştir. Sitogenetik yanıtlar, her birkemik iliği numunesinde >/= 20 metafaz hücre arasında Ph+ metafazlarının yüzdesine dayalıdır. >/= 20 metafazkullanılabilir olmadığında başlangıç sonrası sitogenetik değerlendirmeler için FISH analizi (>/= 200 hücre)kullanılabilir. Uzatma çalışmasında, spesifik bir tarihte geçerli bir sitogenetik değerlendirme mevcut olmamasıdurumunda TSY, MMY'ye dayanarak yerine konmuştur. Moleküler yanıt kriterleri: Faz 1/2 çalışmada MMY/MY4, merkezi laboratuvar (uluslararası ölçekte olmayan) tarafından değerlendirildiği üzere, <%0,1/0,01 BCR-ABL transkripti olarak tanımlanmıştır. Uzatma çalışmasında,olgu bildirim formunda yerel laboratuvar tarafından değerlendirilip yanıt veren hastalarda MMY/MY4 elde edildiğibelirtilmiştir. Kısaltmalar: AF=Akselere faz, BF=Blastik faz, Ph+=Philadelphia kromozomu pozitif; KF=Kronik faz, KML=kronik miyeloid lösemi; KM=Kaplan-Meier; N/n=hasta sayısı; N/A=Uygulanamaz, N/R=Ulaşılamaz,N/E=tahmin edilemez; GA=Güven Aralığı, MSY=Majör Sitogenetik Yanıt, TSY=Tam Sitogenetik Yanıt,Kümİns= Kümülatif İnsidans, MMY= Majör Moleküler Yanıt, BCR-ABL=kırılma bölgesi (breakpoint clusterregion)-Abelson
a
b
c
d
e Sitogenetik için geçerli bir başlangıç değerlendirmesi olan ancak Çin, Güney Afrika, Hindistan veya Rusya'da örneklerin moleküler değerlendirme için ülke dışına gönderilememesi nedeniyle, çalışmaya bu ülkelerdenkatılmayan hastaları (N) içermektedir. KF hastaları için analizler, başlangıç sonrasında yanıtı sürdüren başlangıçyanıt verenlerinin yanıt veren olmasına izin vermektedir. Asgari takip süresi (son hastanın ilk dozundan verigörüntüleme tarihine kadarki süre) yalnızca imatinib ile tedavi edilmiş KF için 120 ay. Yanıta ulaşan ve bunu muhafaza eden hastaları (N) içerir. En az 1 doz bosutinib alan hastalar (N) dahil. Olay olmadan tedavinin kesilmesinin yarışan riskine göre ayarlanan kümülatif insidans analizi. Sınırlı sayıdaki gruplar için analiz edilmemiştir. KF, AF ve BF kohortlarında genel sağkalım Şekil 4'te grafiksel olarak gösterilmiştir. Şekil 4 - KF2L, KF3L, AF ve BF'de Kaplan-Meier Genel Sağkalım Tahmini Ölüm zamanı (ay)Riske tabi gönüMü / Kümülatif OlaylarmiKF2LKF3LAFBF^,8föııo">4İ\W»22¦ ' mwımTablo 8- KF KML'nin değerlendirilebilir popülasyonunda başlangıçtaki BCR-ABL mutasyon durumuna göre yanıt; imatinib ve dasatinib ve/veya nilotinib öncesi (üçüncü
Daha önce nilotinib ile tedavi edilen ve E255V mutasyonu bulunan bir hasta en iyi yanıt olarak THY almıştır. İn vitrotestleri, bosutinibin T315I veya V299L mutasyonuna karşı sınırlı düzeyde aktivitesi olduğunu göstermiştir. Bu nedenle, bu mutasyonlara sahip hastalarda klinik aktivitebeklenmemektedir.Daha önce 1 ya da daha fazla TKI ile tedavi edilmiş Ph+ KML hastalarında yapılan Faz 4 Klinik çalışmaDaha önce 1 ya da daha fazla TKI ile tedavi edilmiş KF, AF veya BF hastalık açısından ayrı kohortlara ayrılan TKI'ya dirençli ya da TKI'yı tolere edemeyen KML hastalarında günde birkez 500 mg bosutinibin sağladığı etkililiği ve güvenliliği değerlendirmek üzere tek kollu, açıketiketli, randomize olmayan, çok merkezli bir Faz 4 çalışma yapılmıştır. Bu araştırmada, daha önce 1 TKI (imatinib veya dasatinib veya nilotinib) ile tedavi edilmiş olan 46 KF Ph+ KML hastasını, daha önce 2 TKI (imatinib ve/veya dasatinib ve/veya nilotinib) iletedavi edilmiş olan 61 KF Ph+ KML hastasını, daha önce 3 TKI (imatinib ve dasatinib venilotinib) ile tedavi edilmiş olan 49 KF Ph+ KML hastasını, daha önce en az 1 TKI (2 hastadaha önce 2 TKI ile tedavi edilmiş ve 2 hasta daha önce 3 TKI ile tedavi edilmiştir) ile tedavi edilmiş olan 4 AF Ph+ KML hastasını ve daha önce en az 1 TKI ile tedavi edilmiş olan 3 Ph-KML hastasını içeren toplam 163 hastaya bosutinib tedavisi uygulanmıştır. Daha önce 1 ya da 2 TKI ile tedavi edilmiş KF Ph+ KML olan hastalar ve daha önce 3 TKI ile tedavi edilmiş KF Ph+ KML olan hastalar için primer etkililik sonlanım noktası, 1 yılda (52.hafta) belirlenen kümülatif doğrulanmış MSY'dir. Daha önce herhangi bir TKI tedavisiuygulanmış olan AF ve BF Ph+ KML hastaları için primer etkililik sonlanım noktasını 1 yıldaki(52. hafta kümülatif doğrulanmış genel hematolojik yanıt (GHY) oluşturmuştur. Ph+ KF KMLhastalarındaki diğer etkililik sonlanım noktaları kümülatif sitogenetik ve moleküler yanıtoranını, sitogenetik ve moleküler yanıtların süresini, başlangıç mutasyonlarındaki yanıtı,AF/BF'ye transformasyonu, progresyonsuz sağkalımı ve genel sağkalımı içermektedir. Ph+AF/BF kohortundaki ek sonlanım noktaları kümülatif sitogenetik ve moleküler yanıt oranlarını,progresyonsuz sağkalımı ve genel sağkalımı içermektedir. KF KML hastalarıBir yıldaki (52 hafta) kümülatif doğrulanmış MSY'yi (%95 GA) içeren primer sonlanım noktası oranı, daha önce 1 ya da 2 TKI ile tedavi edilmiş olan hastalarda %76,5 (66,9, 84,5) ve dahaönce 3 TKI ile tedavi edilmiş olan hastalarda %62,2 (46,5 - 76,2) olarak saptanmıştır. Daha önce 1 (medyan tedavi süresi 47,5 ay [0,9-50,1 ay] ve halen tedaviye devam eden %60,9), 2 (medyan tedavi süresi 41,9 ay [0,4-48,9 ay] ve halen tedaviye devam eden %45,9) ve 3(medyan tedavi süresi 20 ay [0,2-48,9 ay] ve halen tedaviye devam eden %38,8) TKI ile tedaviedilmiş olan Ph+ KF KML hastalarında en az 3 yıl süren takipten sonra, çalışmanın kapanıştarihinde elde edilen ek etkililik sonuçları Tablo 9'da sunulmaktadır. Tablo 9 - Daha önce tedavi görmüş kronik faz Ph+ KML hastalarında etkililik sonuçları
TS Y değerlendirmesi için FISH analizi (>200 hücre) kullamlabilmiştir. Geçerli bir kemik iliği veya FISH değerlendirmesi olmayan ve en az MMY elde edilen hastalar TSY olarak kabul edilmektedir.Kümülatif Moleküler Yanıt kriterleri: MMY, MY4 ve MY4,5, uluslararası ölçekte sırasıyla <% 0,1,< %0,01 ve < %0,0032 BCR-ABL/ABL oranı (standardize edilmiş başlangıca göre > 3, > 4 ve >4,5 log azalmaya karşılık gelmektedir) ve merkezi laboratuvar tarafından değerlendirilen sırasıylaminimum 10.000, 10.000 ve 32.000 ABL transkripti olarak tanımlanmıştır.a Geçerli bir başlangıç değerlendirmesi olan hastaları (N) içermektedir. Minimum 36 ay takip süresi(son hastanın ilk dozu aldığı tarihten veri görüntüleme kaydı tarihine kadar geçen süre).b Yanıt elde edilen ya da yanıtı devam eden hastaları (N) içermektedir. Olay olmaksızın tedaviyi bırakılma yarışan riski için ayarlanmış kümülatif MMY, MY4 ve MY4,5 insidansı Şekil 5'te gösterilmektedir. Şekil 5 - Kümülatif Moleküler Yanıt İnsidansı (KF Değerlendirilebilen Popülasyon)
Tedavi basamağına göre elde edilen moleküler yanıtlar Tablo 10'da gösterilmektedir.
KF hastalarda, tedavi uygulaması sırasında AF veya BF KML'ye progresyonlar meydana gelmemiştir. AF KML hastalarıPh+ AF KML olan hastalarda, medyan tedavi süresi 22,1 ay (aralık: 1,6-50,1 ay), 1 yılda (52 hafta) kümülatif doğrulanmış GHY, kümülatif TSY oranında olduğu gibi %75 (%95 GA: 19,4,99,4) olarak belirlenmiş ve 3 hastanın tümünde, elde edilen TSY tedavi sırasında da devametmiştir. Başlangıçta BCR-ABL Mutasyonlarına göre yanıtKF kohortundaki on hastada başlangıçta mutasyonlar (A365V, E453K, E255K, E255V, Q252H, L298V [her biri n=1], Y253F ve G250E [her biri n=2]) olduğu kaydedilmiştir. KFkohortundaki bir hastada, çalışmanın 8. gününde F359I mutasyonu olduğu saptanmıştır. AFkohortundaki bir hastada, başlangıçta 2 mutasyon (F311L ve L387F) tanımlanmıştır. KFkohortunda mutasyonları olan hastalar arasında, moleküler yanıtlar 4/11 (%36,4) hastadagözlenmiş, E255V mutasyonu olan 1 hastada MMY ve sırasıyla F359I, Y253F ve A365Vmutasyonu olan 3 hastada MY4,5 elde edilmiştir. AF kohortundaki mutasyonları olan hastadaherhangi bir yanıt elde edilmemiştir. 5.2 Farmakokinetik özelliklerGenel özelliklerEmilim:Tek doz bosutinibin (500 mg) sağlıklı gönüllülere yemekle birlikte uygulanması sonrasında, mutlak biyoyararlanım %34'tür. Emilim göreceli olarak yavaş olduğundan pik konsantrasyonaulaşma için medyan süre (tmaks) 6 saattir. Bosutinib 200 ve 600 mg arası bir doz aralığında EAAve Cmaks değerlerinde doz oranlı artışlar göstermektedir. Aç durumla karşılaştırıldığında, yemekile bosutinibin Cmaks değeri 1,8 kat ve EAA değeri 1,7 kat artmaktadır. KML hastalarında günde400 mg bosutinibin yiyeceklerle uygulanmasını takiben kararlı durumda Cmaks (geometrikortalama varyasyon katsayısı % [CV]) 145 (14) ng/mL, ve EAAss (geometrik ortalama, %CV)2.700 (16) ng*h/mL'dir. Yemek ile günlük 500 mg bosutinib uygulamasını takiben, Cmaks değeri200 (6) ng/mL ve EAAss değeri 3.640 (12) ng»h/mL'dir. Bosutinibin çözünebilirliği pH'abağlıdır ve emilim, gastrik pH arttığında azalmaktadır (bkz. bölüm 4.5). Dağılım:120 mg bosutinibin sağlıklı gönüllülere tek intravenöz doz uygulanmasını takiben, bosutinib için ortalama dağılım hacmi (% varyasyon katsayısı [CV]) 2.331 (32) L olmuştur; bu dabosutinibin ekstra vasküler dokulara kapsamlı bir şekilde dağıtıldığını göstermektedir. Sağlıklı gönüllüler üzerinde yapılan in vitroex vivo(%96) çalışmalarda bosutinibin insan plazmasındaki proteinlere yüksek oranda bağlandığı ve bu bağın konsantrasyona bağlıolmadığı gözlemlenmiştir.Biyotransformasyon:İn vitroin vivoin vitroçalışmalar, bosutinib metabolizmasına müdahil olanmajör sitokrom P450 izoziminin CYP3A4 olduğunu ve ilaç etkileşim çalışmaları daketokonazol ve rifampisinin bosutinib farmakokinetikleri üzerinde etkisi olduğunu göstermiştir(bkz. bölüm 4.5). CYP 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 veya 3A5 ile bosutinibmetabolizması gözlemlenmemiştir.Eliminasyon:Sağlıklı gönüllülerde intravenöz tek bir doz halinde 120 mg bosutinib sonrasında, ortalama (%CV) vücuttan uzaklaştırılma yarı ömrü yaklaşık 35,5 (24) saat ve ortalama (%CV) klerens 61,9 (26) L/sa'dır. Ağız yoluyla alınan bosutinib üzerinde yapılan bir kütle dengesiçalışmasında, toplam dozun ortalama %94,6'sı 9 günde geri çıkarılmıştır; majör vücuttan dışarıatma yolu dışkılama (%91,3) olmakla birlikte, %3,29'luk bir oran da idrarla atılmaktadır.Dozun yüzde yetmiş beşi 96 saat içinde geri çıkarılmıştır. İdrarda bosutinibin değişmedenvücuttan atılma oranı hem sağlıklı gönüllülerde hem de ileri evre habis solid tümörleri bulunangönüllülerde yaklaşık %1 düzeyindedir. Doğrusallık/Doğrusal olmayan durum:Bosutinib 200 ve 600 mg arası bir doz aralığında EAA ve Cmaks değerlerinde doz oranlı artışlar göstermektedir. Bosutinib 200-600 mg dozları arasında lineer farmakokinetik özelliklersergiler. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Bir böbrek yetmezliği çalışmasında, hafif, orta şiddette veya ciddi böbrek yetmezliği bulunan 26 gönüllüye yemekle birlikte tek doz halinde 200 mg bosutinib verilmiş ve 8 kişinin sonuçlarısağlıklı gönüllülerle eşleşmiştir. Böbrek yetmezliği şu KrKL değerlerine bağlıdır (Cockcroft-Gault formülü ile hesaplanır): < 30 mL/dk (ciddi böbrek yetmezliği), 30 < KrKL < 50 mL/dk(orta şiddetli böbrek yetmezliği) veya 50 < KrKL < 80 mL/dk (hafif şiddetli böbrek yetmezliği).Orta şiddetli ve ciddi böbrek yetmezliği bulunan gönüllülerde, sağlıklı gönüllüler ilekarşılaştırıldığında sırasıyla %35 ve %60 düzeyde EAA artışı gözlemlenmiştir. Maksimummaruziyet Cmaks değeri, orta şiddetli ve ciddi böbrek yetmezliği olan gruplarda sırasıyla %28 ve%34 oranda artmıştır. Bosutinib maruziyeti, hafif şiddetli böbrek yetmezliği bulunan kişilerdeartış göstermemiştir. Bosutinibin böbrek yetmezliği bulunan gönüllülerde vücuttanuzaklaştırılma yarı ömrü, sağlıklı gönüllülerdekine benzerdir. Böbrek yetmezliği için doz ayarlamaları bu çalışmanın sonuçlarına ve 200-600 mg doz aralığında bosutinibin bilinen lineer farmakokinetiğine dayanmaktadır. Karaciğer yetmezliği:Yemekle verilen 200 mg'lik bir bosutinib dozu, karaciğer bozukluğu bulunan 18 gönüllüden oluşan bir kohortta (Child-Pugh, sınıf A, B ve C) değerlendirilmiş ve 9 kişi sağlıklı gönüllülerile aynı sonucu vermiştir. Child-Pugh, sınıf A, B ve C'de plazmada bosutinibin Cmaks değerisırasıyla 2,4 kat, 2 kat ve 1,5 kat; plazmada bosutinibin EAA değeri ise sırasıyla 2,3 kat, 2 katve 1,9 kat artmıştır. Sağlıklı gönüllüler ile karşılaştırıldığında hepatik bozuklukları olangönüllülerde bosutinib için t^ değeri artmıştır. Pediyatrik popülasyon:BOSULİF henüz 18 yaşından küçük çocuklarda ve ergenlerde çalışılmamıştır. Yaş, cinsiyet, ırk özellikleri:Bu demografik faktörlerin etkilerini değerlendirmek için resmi bir çalışma yapılmamıştır. Ph+ lösemi veya malign solid tümörü bulunan hastalarda ve sağlıklı gönüllülerde popülasyonfarmakokinetik analizleri yaşın, cinsiyetin veya vücut ağırlığının klinik olarak anlamlı etkileribulunmadığını göstermektedir. Popülasyon farmakokinetik analizleri, Asyalıların bosutinibmaruziyetinde (EAA) yaklaşık %25'lik bir artışa karşılık gelen, %18 daha düşük bir klirensesahip olduğunu ortaya koymuştur. 5.3 Klinik öncesi güvenlilik verileriBosutinib, güvenlilik farmakolojisi, yinelenen doz toksisitesi, genotoksisite, üremeye ilişkin toksisite ve fototoksisite çalışmalarında değerlendirilmiştir. Güvenlilik farmakolojisiBosutinib, solunum fonksiyonları üzerinde herhangi bir etki yaratmamıştır. Merkezi sinir sistemi (MSS) üzerinde yapılan bir çalışmada, bosutinib ile tedavi edilen sıçanların göz bebeğiboyutunda küçülme ve yürümede bozulma gözlemlenmiştir. Göz bebeği boyutu için gözlemsizetki düzeyi (GED) belirlenmemiştir ancak yürüme bozukluğu için GED, 400 mg'lık klinikdozla elde edilen insan maruziyetinin yaklaşık 11 katı ve 500 mg'lık klinik dozla elde edileninsan maruziyetinin yaklaşık >8 katı maruziyetlerde oluşmuştur (ilgili türlerde bağlanmamışCmaks'a göre). hERG miktar tayinlerinde in vitro bosutinib aktivitesi, kardiyak ventrikülerrepolarizasyon (QTc) süre uzatması için bir potansiyel bulunduğunu göstermektedir.Bosutinibin ağız yoluyla uygulandığı, köpekler üzerinde yapılan bir çalışmada, bosutinib, 400mg dozluk klinik maruziyetin 3 katına ve 500 mg dozluk klinik maruziyetin 2 katına (ilgilitürlerde bağlı olmayan Cmaks'a dayalı olarak) kadar maruziyetlerde kan basıncındadeğişikliklere, anormal atriyal veya ventriküler aritmilere veya PR, QRS ya da EKG'nin QTcsüre uzamasına neden olmamıştır. Gecikmeli bir nabız artışı gözlemlenmiştir. Köpeklerüzerinde yapılan bir intravenöz çalışmada, 400 mg klinik doz ile elde edilenin yaklaşık 6 ile 20katı arası ve 500 mg doz ile elde edilenin yaklaşık 4 ile 15 katı arası değişen maruziyetlerdenabızda geçici artışlar ve kan basıncında düşüşler ile QTc için minimum süre uzaması (<10msn) gözlemlenmiştir (ilgili türlerde bağlanmamış Cmaks'a göre). Gözlemlenen etkiler ve tıbbiürün tedavisi arasındaki ilişki sonuçsuz kalmıştır. Tekrarlanan doz toksisitesiSıçanlarda 6 aya kadar, köpeklerde 9 aya kadar süre için yapılan tekrarlanan doz toksisitesi çalışmaları, bosutinib toksisitesinde birincil hedef organın gastrointestinal sistem olduğunuaçığa çıkarmıştır. Klinik toksisite emareleri, dışkı değişikliklerini içermiştir ve gıda tüketimindeazalma ve kilo kaybı ile ilişkilendirilmiştir; bunlar zaman zaman ölüme veya seçici ötenaziyeyol açmıştır. Histopatolojik olarak, lümen genişlemesi, goblet hücresi hiperplazisi, kanama, erozyon ve bağırsak yolunda ödem ile mesenterik lenf nodlarında eritrositoz ve kanama gözlemlenmiştir.Sıçanlarda, karaciğer de bir hedef organ olarak tanımlanmıştır. Toksisiteler, karaciğerenzimlerinde artış veya hepatoselüler sitotoksite belirtilerinin eksikliğinde oluşan hepatoselülerhipertropi ile ilgili olarak karaciğer ağırlıklarında artış ile karakterize edilmektedir ve bunlarıninsanlarla ilişkisi bilinmemektedir. Türler arası maruziyet karşılaştırması, sıçanlar ve köpeklerüzerinde yapılan sırasıyla 6 ve 9 aylık çalışmalarda advers olaylar ortaya çıkarmayanmaruziyetlerin 400 mg'lik ve 500 mg'lik klinik dozlarla elde edilen insan maruziyetine benzerolduğunu göstermektedir (ilgili türlerde bağlı olmayan EAA değerine dayalı olarak). GenotoksisiteBakteriyel in vitroin vitroin vivosistemlerde metabolik aktivasyon ile ya da metabolik aktivasyon olmadan yapılan genotoksisite çalışmaları, bosutinibinmutajenik potansiyeline dair bir kanıt göstermemiştir.Üreme ve gelişim toksisitesiSıçanlar üzerinde yapılan bir üreme çalışmasında, erkeklerde fertilitede hafif bir düşüş gözlemlenmiştir. Dişilerde embriyonik resorpsiyonlarda artış ve implantasyonlar ile canlıembriyolarda düşüş gözlemlenmiştir. Erkeklerde (günde 30 mg/kg) ve kadınlarda (günde 3mg/kg) advers üreme etkilerinin gözlemlenmediği doz, 400 mg'lik klinik dozdan doğan insanmaruziyetinin sırasıyla 0,6 ve 0,3 katı ve 500 mg'lik klinik dozdan doğan insan maruziyetininsırasıyla 0,5 ve 0,2 katı kadar maruziyetlere yol açmıştır (ilgili türlerde bağlı olmayan EAAdeğerine dayalı olarak). Erkek fertilitesi üzerine etkisi göz ardı edilemez (bkz. bölüm 4.6). Gebe Sprague-Dawley sıçanlarında yapılan bir plasenta transferi çalışmasında, fetüslerin gebelik sırasında bosutinib türevli radyoaktiviteye maruziyeti gösterilmiştir. Sıçanlar üzerindeyapılan bir doğum öncesi ve doğum sonrası gelişim çalışmasında, > 30 mg/kg/gün dozundadoğan yavru sayıları azalmış, toplam tek seferde doğan yavru kaybı insidansı artmış ve 70mg/kg/gün dozunda doğumdan sonra yavruların büyümesinde azalma gerçekleşmiştir. Yan etkigelişmesi gözlemlenmeyen doz (10 mg/kg/gün), 400 mg ve 500 mg klinik dozlarda insanlardagörülenin sırasıyla 1,3 katına ve 1 katına eşit maruz kalmayla sonuçlanmıştır (ilgili türlerdebağlı olmayan EAA değerine dayalı olarak). Tavşanlar üzerinde yapılan bir toksisiteçalışmasında anneler için toksik dozda fetüs anomalileri gözlemlenmiş (birleşik sternebra veiki fetüste farklı viseral gözlemler bulunması) ve fetüs vücut ağırlığında hafif bir düşüşolmuştur. Tavşanlarda test edilen en yüksek dozda (10 mg/kg/gün) fetüs üzerinde adversetkilere neden olmayan maruziyet, 400 mg ve 500 mg dozlarda insanlarda görülenin sırasıyla0,9 ve 0,7 katıdır (ilgili türlerde bağlı olmayan EAA değerine dayalı olarak). Emziren Sprague-Dawley sıçanlarında ağız yoluyla tek doz halinde (10 mg/kg) [14C] radyoaktif işaretli bosutinib uygulamasının ardından, radyoaktivite, dozlamadan 0,5 sa sonra kadar kısabir süre içinde anne sütüne geçmiştir. Sütte radyoaktivite konsantrasyonu, plazmadaolduğundan 8 kat yüksektir. Bu da ölçülebilir radyoaktivite konsantrasyonlarının anne sütü alanyavruların plazmasında görülmesine neden olmuştur. KarsinojenisiteBosutinib, 2 yıllık sıçan ve 6 aylık rasH2 fare karsinojenisite çalışmalarında karsinojenik bulunmamıştır. FototoksisiteBosutinib, UV-B ve UV-A aralığında ışık absorbe etme yetisi göstermiş ve pigmentli sıçanların cildine ve gözün damarlı orta tabakasına dağıtılmıştır. Ancak bosutinib ile, 400 ve 500 mgklinik dozlarla insanlarda oluşan maruziyetin sırasıyla 2 ve 3 katına kadar olan maruziyetlerde UV radyasyon bulunurken bosutinibe maruz kalmış pigmentli sıçanlarda ciltte veya gözlerde fototoksisite potansiyeli göstermemiştir (ilgili türlerde bağlanmamış Cmaks'a göre). 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiTablet çekirdeğiMikrokristalin selüloz (E460)Kroskarmeloz sodyum (E468) Poloksamer 188 Povidon (E1201) Magnezyum stearat (E470b) Film kaplamaPolivinil alkolTitanyum dioksit (E171)Makrogol 3350 Talk (E553b) Sarı demir oksit (E172) 6.2 GeçimsizliklerUygulanamaz. 6.3 Raf ömrü48 ay. 6.4 Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. 6.5 Ambalajın niteliği ve içeriği14 veya 15 tablet içeren beyaz opak 3 katmanlı PVC/ACLAR/PVC blister Her kartonda 28 veya 30 tablet (paket başına 2 blister) veya 112 tablet (paket başına 8 blister) bulunur. Tüm ambalaj boyutları satışa sunulmayabilir. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler veya atık materyaller, 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHIBIPfizer PFE İlaçları A.Ş. Esentepe Mah. Büyükdere Cad. Levent 199 Blok No: 199 İç Kapı No: 106 Şişli / İstanbul 8. RUHSAT NUMARASI2019/106 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 21.02.2019 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriBosulif 100 Mg Film Kaplı TabletEtken Maddesi: Bosutinib Monohidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.