Idelvion 2000 Iu Enjeksiyonluk Çözelti Hazırlamak İçin Toz ve Çözücü Kısa Ürün BilgisiKISA URUN BILGISI¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'a bildirmeleribeklenmektedir. Bakınız Bölüm 4.8 Advers reaksiyonlar nasıl raporlanır? 1. BEŞERI TIBBİ ÜRÜNÜN ADIIDELVION 2000 IU enjeksiyonluk çözelti hazırlamak için toz ve çözücü Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Bir flakon nominal olarak 2000 IU albumin ile rekombinant füzyon proteinini bağlayan koagülasyon faktörü IX (rIX-FP) (INN= albutropenonakog alfa) etkin maddesi içerir. Faktör IX, Çin Hamsteriovaryum hücrelerinden elde edilmektedir. 5 mL enjeksiyonluk su ile sulandırıldıktan sonra, çözelti 400 IU/mL albutropenonakog alfa içerir. Potens (Uluslararası Birim [IU]); faktör IX konsantresi için Dünya Sağlık Örgütü (WHO) Uluslararası Standardına karşı kalibre edilen in-vitroaktifleştirilmiş kısmi tromboplastin zamanı(aPTT)-bazlı tek aşamalı pıhtılaşma tayini kullanılarak belirlenmektedir.Albutrepenonakog alfa; rekombinant albuminin rekombinant koagülasyon faktörü IX'e genetik füzyonu ile oluşturulan, rekombinant DNA teknolojisi ile üretilen saflaştırılmış bir proteindir. İnsanalbumin cDNA'sının insan koagülasyon faktörü IX cDNA'sına genetik füzyonu, proteinin tek birrekombinant proteini olarak üretilmesine olanak sağlar ve kimyasal konjugasyondan kaçınılarak ürünhomojenitesini güvence altına alır. Rekombinant faktör IX bölümü, plazma türevli faktör IX'inThr148 allelik formu ile identiktir. Rekombinant faktör IX ve albumin molekülleri arasındakiparçalanabilir bağlayıcı, doğal faktör IX'teki endojenöz aktivasyon peptidinden türevlenmiştir. Yardımcı maddeler:Trisodyum sitrat dihidrat 25 mM Yardımcı maddeler için bölüm 6.1 'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti hazırlamak için toz ve çözücüAçık sarı ila beyaz toz ve enjeksiyonluk çözelti için berrak, renksiz çözücü 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarIDELVION (albutropenonakog alfa), hemofili B'si olan (konjenital faktör IX eksikliği) hastalarda kanamanın tedavisi ve profilaksisinde endikedir. Belge Doğrulama Kodu: 1ZW56SHY3SHY3Q3NRZW56ZW56ZW56Z1 Ax Belge Takip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys IDELVION tüm yaş gruplarında kullanılabilir. 4.2. Pozoloji ve uygulama şekliIDELVION tedavisi, hemofili B tedavisinde tecrübeli bir hekim gözetiminde başlatılmalıdır. Tedavi takibiTedavi süresince, uygulanacak doz ve tekrarlanan infüzyon sıklığına rehberlik etmesi için faktör IX seviyelerinin uygun şekilde tayin edilmesi tavsiye edilir. Bireysel hastaların faktör IX'e yanıtlarındadeğişiklik görülebilir, yani farklı yarılanma ömrü ve iyileşme gösterebilirler. Vücut ağırlığına dayalıdozun, düşük kilolu veya fazla kilolu hastalarda ayarlanması gerekebilir. Özellikle majör cerrahigirişimler söz konusu olduğunda, ikame tedavisinin koagülasyon analizi (plazma faktör IX aktivitesi)ile kesin olarak izlenmesi zorunludur. Hastaların kan numunelerinde Faktör IX aktivitesini tayinetmek için bir in vitrotromboplastin zamanı (aPTT)-bazlı tek aşamalı bir pıhtılaşma tekniğikullanıldığında; plazma faktör IX aktivitesi sonuçları hem aPTT reaktifinin türünden hem dekullanılan referans standarttan önemli ölçüde etkilenebilir. Kaolin bazlı aPTT reaktifi veya Aktin FSaPTT reaktifi kullanılarak tek aşamalı bir pıhtılaşma tekniği ile yapılan ölçüm, büyük olasılıklaaktivite seviyesinin düşük tahmin edilmesiyle sonuçlanacaktır. Bu, özellikle laboratuvar ve/veyatayinde kullanılan reaktifleri değiştirirken önemlidir.Pozoloji/uygulama sıklığı ve süresi:İkame tedavisinin dozu ve süresi; faktör IX eksikliğinin şiddetine, kanama bölgesine ve miktarına ve hastanın klinik durumuna bağlıdır. Uygulanan faktör IX birimlerinin sayısı; faktör IX ürünleri için güncel WHO standardı ile ilişkili olan Uluslararası Birim (IU) cinsinden ifade edilir. Plazmadaki faktör IX aktivitesi, yüzde (normal insanplazmasına göre) veya Uluslararası Birim (plazmadaki faktör IX için Uluslararası Standarda göre)cinsinden ifade edilir. Faktör IX aktivitesinin bir Uluslararası Birimi (IU), normal insan plazmasının 1 mL'sindeki faktör IX miktarına eşdeğerdir. İhtiyaç anında tedaviGerekli faktör IX dozu hesaplaması; vücut ağırlığı (kg) başına 1 Uluslararası Birim (IU) faktör IX'in, dolaşımdaki faktör IX seviyesini 12 yaşında veya daha büyük hastalarda ortalama 1,3 IU/dL (normaldeğerin % 1,3'ü) ve 12 yaşından küçük hastalarda 1 IU/dL (normal değerin % 1'i) oranında arttırmasıbeklendiğine ilişkin ampirik bulguya dayanmaktadır. Gerekli doz, aşağıdaki formül kullanılarakbelirlenir: Gerekli doz (IU)= vücut ağırlığı (kg) x istenen faktör IX artışı (normal değerin %'si veya IU/dL) x {gözlenen geri kazanımın tersi (IU/dL başına IU/kg)} Beklenen faktör IX artışı (IU/dL veya normal değerin %'si)= Doz (IU) x Geri kazanım (IU/kg başına IU/dL)/vücut ağırlığı (kg) Uygulanacak miktar ve uygulama sıklığı; daima her bir vakadaki klinik etkililiğe göre uyarlanmalıdır. 12 yaşından küçük hastalar1 IU/kg başına 1 IU/dL'lik kademeli geri kazanım için; doz şu şekilde hesaplanmaktadır: Doz (IU)= vücut ağırlığı (kg) x istenilen faktör IX artışı (IU/dL) x 1 dL/kg Örnek 1. Şiddetli hemofili B'si 0ian*§20''kg ®feğif^ğİndafe;ibiF*h8stada normalin % 50'lik pik seviyesi Belge Do 2. IDELVION'un 25 kg ağırlığındaki hastaya uygulanan 1000 lU'luk dozunun, 1000 IU/25 kg x 1 (lU/kg başına IU/dL)= 40 IU/dL (normalin % 40'ı) olacak şekilde enjeksiyon sonrası bir piktefaktör IX artışı ile sonuçlanması beklenmelidir. 12 yaşında veya daha büyük hastalar1 IU/kg başına 1,3 IU/dL'lik kademeli geri kazanım için; doz şu şekilde hesaplanmaktadır: Doz (IU)= vücut ağırlığı (kg) x istenilen faktör IX artışı (IU/dL) x 0,77 dL/kg Örnek 1. Şiddetli hemofili B'si olan 80 kg ağırlığındaki bir hastada normalin % 50'lik pik seviyesigereklidir. Uygun doz, 80 kg x 50 IU/dL x 0,77 dL/kg= 3080 IU olacaktır. 2. IDELVION'un 80 kg ağırlığındaki hastaya uygulanan 2000 IU'luk dozunun, 2000 IU x 1,3 (IU/kgbaşına IU/dL)/80 kg= 32,5 IU/dL (normalin % 32,5'i) olacak şekilde enjeksiyon sonrası bir piktefaktör IX artışı ile sonuçlanması beklenmelidir. Aşağıdaki kanama olayları durumunda; faktör IX aktivitesi, ilgili periyodda verilen plazma aktivitesi seviyesinin (normalin %'si veya IU/dL cinsinden) altına düşmemelidir. Aşağıdaki tablo, kanamaepizodlarının kontrolü ve önlenmesi için ve ameliyatlarda kullanılacak dozlar için kılavuz olarakkullanılabilir:
ProfilaksiCiddi hemofili B'si olan hastalarda kanamaya karşı uzun süreli profilaksi için; olağan dozlar haftada bir kez 35 ila 50 IU/kg'dır. Haftalık bir rejimde iyi bir şekilde kontrol edilen bazı hastalar, 10 veya 14 günlük bir zaman aralığında 75 IU/kg'a kadar dozlarla tedavi edilebilirler. Bazı durumlarda, özellikle genç hastalarda, daha kısa doz aralıkları veya daha yüksek dozlar gerekebilir.
Profilaksi sırasında kanama epizodundan sonra, hastalar en az 24 saat arayla ya da hasta için'"'"'m olduğu kabul edilen daha uzun aralıklarla uygulanan 2 doz IDELVION ile profilaksi rejimlerini mümkün olduğunca yakın tutmalıdırlar. Uygulama şekli:IDELVION intravenöz kullanım içindir. Uygulamadan önce tıbbi ürünün sulandırılmasına ilişkin talimatlar için bölüm 6.6'ya bakınız. Sulandırılmış preparat, hastanın rahat hissedeceği maksimum 5 mL/dk'ya kadarlık bir hızda intravenöz olarak yavaş bir şekilde enjekte edilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği/Karaciğer yetmezliği:IDELVION'un böbrek ve/veya karaciğer yetmezliği olan hastalarda kullanımına ilişkin herhangi bir klinik çalışma yürütülmemiştir. Pediyatrik popülasyon:Rutin profilaksi için, pediyatrik hastalar için tavsiye edilen doz rejimi haftada bir defa 35 - 50 IU/kg'dır (bkz. bölüm 5.2.). Geriyatrik popülasyon:Yaşlı hastalarda (65 yaş üzeri) pozoloji ve uygulama şekli klinik çalışmalarda belirlenmemiştir. 4.3. KontrendikasyonlarIDELVION; etkin maddeye (albumin ile koagülasyon faktör IX'u bağlayan rekombinant füzyon proteini (rIX-FP)), bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine veya hamsterproteinine karşı aşırı duyarlılığı olan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriHipersensitiviteIDELVION ile alerjik türde hipersensitivite reaksiyonları görülebilir. Ürün, hamster protein kalıntıları içermektedir. Hipersensitivite semptomları meydana gelirse; tıbbi ürünün kullanımı derhaldurdurulmalı ve uygun tedavi başlatılmalıdır. Hastalar kurdeşen, yaygın ürtiker, göğüste sıkışmahissi, hırıltılı solunum, hipotansiyon ve anafilaksi dahil hipersensitivite reaksiyonlarının erkenbulguları hakkında bilgilendirilmelidir. Bu semptomların görülmesi durumunda; hastalaraIDELVION uygulamasını durdurmaları ve hekimleri ile irtibata geçmeleri önerilir. Tüm faktör IXürünleri alerjik reaksiyon potansiyeline sahiptir. Başlangıç faktör IX uygulamasının, alerjikreaksiyonlar için uygun tıbbi bakımın sağlanabileceği şekilde tıbbi gözetim altında gerçekleştirilmesiönerilir. Şok durumunda, şok için standard tıbbi tedavi uygulanmalıdır. İnhibitörlerHemofili B tedavisinde IDELVION ile gerçekleştirilen faktör replasman tedavisi sırasında faktör IX'e karşı inhibitör oluşumu bildirilmiştir.İnsan koagülasyon Faktör IX ürünleri ile tekrarlanan tedaviden sonrahastalar, uygun biyolojik testler kullanılarak Bethesda birimlerinde (BU) ölçülmesi gereken nötralizeedici antikorların (inhibitör) gelişimi açısından takip edilmelidir.
literatürde, faktör ix mnıbıtorunun ortaya çıkışı w alerjik reaksiyonlar arasında Dır korelasyonun varlığını gösteren raporlar mevcuttur. Bu nedenle; alerjik reaksiyonlar görülen hastalar, bir inhibitörün varlığı açısından değerlendirilmelidir. Faktör IX inhibitörü olan hastalarda, daha sonrakifaktör IX uygulamaları karşısında anafilaksi riskinin artmış olabileceği göz önündebulundurulmalıdır. Faktör IX ürünleri ile alerjik reaksiyon riski olduğundan; ilk faktör IX uygulaması, tedavi eden doktorun kararına göre, alerjik reaksiyonlar için uygun tıbbi bakımın sağlanabileceği tıbbi gözlemaltında gerçekleştirilmelidir. TromboembolizmPotansiyel trombotik komplikasyon riski nedeniyle; bu ürünü karaciğer hastalığı olan hastalara, ameliyat sonrası hastalara, yeni doğanlara veya trombotik olaylar veya DIC (Dissemine İntravaskülerKoagülasyon) riski taşıyan hastalara uygularken, uygun biyolojik testler ile trombotik ve yaygındamar içi pıhtılaşmasının erken bulguları bakımından klinik gözetim başlatılmalıdır. Bu durumlarınher birinde, IDELVION ile tedavinin yararı bu komplikasyonların riski ile karşılaştırılmalıdır. Kardiyovasküler olaylarHalihazırda kardiyovasküler risk faktörleri taşıyan hastalarda, FIX ile ikame tedavisi kardiyovasküler riski artırabilir. Kateterle ilişkili komplikasyonlarSantral venöz kateter gerekirse; lokal enfeksiyonlar, bakteriyemi ve kateter bölgesi trombozu dahil, santral venöz kateter ile ilişkili komplikasyon riski göz önünde bulundurulmalıdır. Pediyatrik popülasyonListelenen uyarılar ve önlemler hem yetişkin hem de çocuk hastalara uygulanır. Yaşlılar:IDELVION'un klinik çalışmaları 65 yaş ve üzeri gönüllüleri içermemektedir. Yaşlıların genç gönüllülerden farklı yanıt gösterip göstermedikleri bilinmemektedir. İmmün Tolerans İndüksiyonu:IDELVION'un immün tolerans indüksiyonunda kullanımında güvenlilik ve etkililiğine dair veri bulunmamaktadır. Sodyum içeriğiEğer maksimum doz (15 ml = 6000 IU) uygulanırsa, bu tıbbi ürün her dozda (70 kg vücut ağırlığı) 25,8 mg'a (1,13 mmol) kadar sodyum ihtiva eder. Bu miktar, Dünya Sağlık Örgütü (WHO) tarafındanyetişkinler için önerilen maksimum günlük 2 g sodyumun %1,29'una karşılık gelmektedir. Bu durum,kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. İzlenebilirlikBiyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriIDELVION'un diğer tıbbi ürünler ile herhangi bir etkileşimi raporlanmamıştır.
4.6. Gebelik ve LaktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (kontrasepsiyon)Veri mevcut değildir. Gebelik dönemiGebelik ve/veya embriyonik/fetal gelişim ve/veya doğum ve/veya postnatal gelişim bakımından hayvan çalışmaları yeterli değildir. IDELVION ile hayvanlar üzerinde üreme çalışmalarıgerçekleştirilmemiştir. Hemofili B kadınlarda nadir olarak görüldüğü için; IDELVION'un gebelikdöneminde kullanımına ilişkin deneyim mevcut değildir. Bu nedenle, IDELVION gebelik döneminde yalnızca açık bir şekilde gerekli ise kullanılmalıdır. Laktasyon dönemiIDELVION'un laktasyon döneminde kullanımına ilişkin deneyim mevcut değildir. Bu nedenle emzirme döneminde yalnızca açık bir şekilde gerekli ise kullanılmalıdır. Üreme yeteneği/Fertilite:Faktör IX'in fertilite üzerindeki etkilerine ilişkin bilgi mevcut değildir. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma yeteneği üzerinde herhangi bir etki gözlenmemiştir. Ancak, baş dönmesin i de içeren sersemlik haline neden olabileceğinden araç ve makine kullanımını etkileyebileceği gözönünde bulundurulmalıdır. 4.8. İstenmeyen etkilerGüvenlilik profilinin özetiFaktör IX ürünlerinin kullanımı ile; seyrek olarak hipersensitivite veya alerjik reaksiyonlar (anjiyoödem, enjeksiyon bölgesinde yanma ve batma hissi, üşüme, kızarma, yaygın ürtiker, baş ağrısı,kurdeşen, hipotansiyon, letarji, bulantı, huzursuzluk, taşikardi, göğüste sıkışma, karıncalanma,kusma, hırıltılı solunum içerebilen) gözlenmiştir. Seyrek vakalarda, bu reaksiyonlar anafilaksiyeilerlemiş ve faktör IX inhibitörlerinin gelişimi ile yakın zamansal ilişki içinde ortaya çıkmıştır (ayrıcabkz. bölüm 4.4). Faktör IX inhibitörleri alan ve alerjik reaksiyon öyküsü olan hemofili B hastalarındaimmun tolerans indüksiyonunun başlatılmasını takiben nefrotik sendrom rapor edilmiştir. CHO (Çin Hamsteri Ovaryumu) hücrelerinden elde edilen faktör IX ürünlerinin kullanımı ile, çok seyrek olarak hamster proteinine karşı antikor gelişimi gözlemlenmiştir. Hemofili B'li hastalar, faktör IX'e karşı nötralize edici antikorlar (inhibitörler) geliştirebilir. Bu tür inhibitörler meydana gelirse; durum yetersiz bir klinik cevap olarak kendini gösterir. Bu gibidurumlarda, uzmanlaşmış bir hemofili merkezi ile temasa geçilmesi önerilir. Daha önceden tedaviedilmemiş hastaları değerlendiren bir klinik çalışmada yüksek titreli inhibitöre sahip bir vakabildirilmiştir. IDELVION ile elde edilen pazarlama sonrası deneyimde, daha önceden tedavi edilmişhastalarda inhibitör gelişiminin olduğu gözlenmiştir. logralama Kodu: lZW56SHY3SHY3Q3NRZW56ZW56ZW56ZlAx Belge Takip Adresi:https://www.turkiyeLgQv.tr/şaglik7titçk,-ebys,uygulanmasından sonra tromibocmbonk olayların potansiyel riski mevcuttur. Duşuk şatlıklı faktör IXDüşük saflıklı preparatlar için riskin daha yüksek olması ile birlikte faktör IX ürünlerinin Belge Do
ürünlerinin kullanımı, miyokard infarktüsü, dissemine instravasküler koagülasyon, venöz tromboz ve pulmoner emboli ile ilişkilendirilmiştir. Yüksek saflıklı faktör IX kullanımı, nadir olarak bu tür adversreaksiyonlar ile ilişkilendirilmiştir. Advers reaksiyonların tablo halinde listesiBeş açık etiketli klinik çalışmaya 114 gönüllü katılmıştır ve IDELVION'a en az bir maruziyette 8 gönüllüde 14 advers reaksiyon bildirilmiştir. Aşağıda sunulan tablo, MedDRA sistem organ sınıfına(SOC ve Tercih Edilen Terim Düzeyi) göre listelenmiştir. Advers reaksiyonların sıklığı, klinik çalışmalardaki ilgili olayların yüzdesini esas almaktadır; hasta bazında ve enjeksiyon bazında değerlendirilmektedir ve şu şekilde listelenmektedir: (çok yaygın>1/10, yaygın (>1/100 ila <1/10, yaygın olmayan >1/1.000 ila <1/100, seyrek >1/10.000 ila <1/1.000,çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Seçili advers reaksiyonların tanımıDaha önce tedavi edilmemiş hastalarla yapılan klinik çalışmada yüksek titreli inhibitöre sahip bir vaka rapor edilmiştir (bkz. bölüm 5.1). Dar veri tabanı nedeniyle herhangi bir inhibitör insidansısağlanmamaktadır.Pediyatrik popülasyonÇocuklarda advers reaksiyonların sıklığı, türü ve şiddeti yetişkin hastalardakilere benzer olması beklenir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlıkmesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi(TÜFAM)'ne bildirmeleri gerekmektedir ([email protected]. Doz aşımı ve tedavisiIDELVION ile doz aşımına ilişkin herhangi bir semptom rapor edilmemiştir.
FARMAKOLOJIK ÖZELLIKLER5.5.1. Farmakodinamik özelliklerFarmakoterapötik grup: ATC kodu: Antihemorajikler: Kan koagülasyon faktörü IX B02BD04 Etki MekanizmasıIDELVION (INN= albutrepenonakog alfa); hemostaz için gerekli olan, eksik koagülasyon faktörü IX ile etkin bir biçimde yer değiştiren ve daha uzun doz rejimleri sağlayan, rekombinant albumin ilerekombinant füzyon proteinini bağlayan rekombinant koagülasyon faktörü IX'tir. IDELVION'unyarılanma ömrünün uzaması ve sistemik maruziyette artış; uzun bir intrinsik yarılanma ömrüne sahiprekombinant albumin ile füzyon yoluyla elde edilir. Albumin; immün savunma veya immün yanıttayer almayan, yaklaşık 20 günlük uzun bir yarılanma ömrüne sahip olan, plazmadaki doğal, inert birtaşıyıcı proteindir. Albumin ile rekombinant koagülasyon faktörü IX'in genetik füzyonu, faktör IX'inyarılanma ömrünü uzatır (bkz. bölüm 5.2.). IDELVION, faktör IX aktive olana kadar dolaşımda bozulmadan kalır, bundan sonra albumin bölünür ve koagülasyon için gerekli olması durumunda, aktif hale gelmiş faktör IX'i (FIXa) serbest bırakır. Farmakodinamik etkilerHemofili B, faktör IX seviyelerindeki azalma nedeniyle ortaya çıkan, cinsiyete bağlı kalıtımsal bir kan pıhtılaşma bozukluğudur ve kendiliğinden, kaza veya cerrahi travmalar sonucunda eklemler,kaslar veya iç organlarda aşırı kanamalara neden olur. Replasman tedavisi ile; faktör IX'in plazmaseviyeleri artırılır ve böylece faktör eksikliğinin geçici olarak düzeltilmesine olanak sağlanarakkanama eğilimi ortadan kaldırılır. Faktör IX ekstrinsik yolakta faktör VII/doku faktörü kompleksi ile aktive olurken; aynı zamanda intrinsik koagülasyon yolağında faktör XIa ile aktive olur. Aktif hale gelen faktör IX, aktif faktör VIIIile birlikte faktör X'u aktive eder. Bu, sonuç olarak, protrombinin trombine dönüşmesi ile sonuçlanır.Trombin daha sonra fibrinojeni fibrin'e dönüştürür ve pıhtı oluşabilir. Hemofili B hastalarında faktörIX aktivitesi hiç yoktur veya büyük oranda azalmıştır ve bu nedenle ikame tedavisi gerekebilir. Klinik etkililik ve güvenlilikle ilgili genel bilgiFaz 1/2 çalışması, 17 gönüllüde (13 - 46 yaş) rIX-FP'nin tedavi etkililiğini ve kanama epizodlarının önlenmesini değerlendirmiştir; profilaksi kolundaki 13 gönüllü yaklaşık 11 ay süreyle IDELVIONile haftalık profilaksi almıştır ve ihtiyaç anında tedavi kolundaki 4 gönüllü ise kanama olaylarınınmeydana gelmesi üzerine IDELVION almıştır. 85 kanama epizodunun tamamı 1 veya 2 dozIDELVION ile başarılı bir şekilde tedavi edilmiştir. IDELVION'un etkililiği, faz 2/3 çalışmasının açık-etiket, kontrolsüz kısmında yaşları 12 ila 61 arasında değişen, önceden tedavi edilmiş (PTP) toplam 63 erkekte değerlendirilmiştir. Bu gönüllülerher 7-, 10- ve/veya 14-günlük aralıklarla profilaksi için ve/veya ihtiyaç anında kanama epizodlarınıntedavisi için IDELVION almışlardır. Tüm gönüllülerde ciddi (FIX düzeyi < % 1) veya orta derecedeciddi (FIX düzeyi < % 2) hemofili B vardır. Önceden tedavi edilmiş 40 hasta profilaksi içinIDELVION almıştır. Profilaktik tedavi alan gönüllüler haftada bir kez 35 - 50 IU/kg ile tedaviye başlamıştır. Hastaların bir alt grubu, 75 IU/kg'lık önerilen doz ve bireysel ayarlamalar ile, genişletilmiş tedavi aralıklarına(her 10 veya 14 günde bir) geçmiştir. Önceden tedavi edilmiş 21 hasta, 98 ila 575 (medyan 386)günlük ilave tedavi süresi boytiScai'' ^ 'güniük*Wfof'ilafcsi*a¥aiığmda kalmıştır. Bu gönüllülerden 8'i Belge Do(% J8) T4gunluK pronlaKsı Doyunca en az bir kanama yaşarken; nattada Dir kez pronlaksı sırasında kanama olayı yaşamamışlardır. Tüm kanamalar için Yıllık Medyan Kanama Oranı (ABR) IDELVION ile 7 günlük profilakside 0 (aralık 0 - 6) ve 14 günlük profilakside ise 1,08 (aralık 0 -9,1) olmuştur. Rutin profilaksi tedavisinin uzun süreli etkililiği ve güvenliliği, 5 yıla kadar sürelerde yapılan açık etiketli ilave bir çalışmada teyit edilmiştir. Bu çalışmada, 12 yaş ve üzerindeki (54 yetişkin ve 5adolesan) toplam 59 PTP, profilaksi için ve/veya talep üzerine kanama epizotlarının tedavisi içinIDELVION almıştır. Profilaktik tedavi gören hastalar, haftada bir kez 35-50 IU/kg dozuyla tedaviye devam etmiş veya başlamıştır. Hastaların bir alt grubu, önerilen dozlar olan 75 IU/kg (10 veya 14 gün) veya 100 IU/kg(21 gün) ile uzatılmış tedavi aralıklarına (10, 14 veya 21 günde bir) geçiş yapmıştır. Çalışmanınsonunda, 14 PTP (%24) 7 günlük profilaksi aralığında, toplam 11 (%19), 25 (%42) ve 9 (%15) PTPsırasıyla 10, 14 ve 21 günlük uzatılmış profilaksi aralığında devam etmiştir. Çalışma sırasında, 21günlük rejimdeki 2 PTP (%18), artan kanama komplikasyonları nedeniyle daha sık bir dozuygulamasına geçiş yapmıştır. Tüm kanamalar için IDELVION ile yapılan 7, 14 ve 21 günlükprofilaksideki tahmin edilen medyan Yıllık Kanama Oranları (ABR) sırasıyla 1,3 (aralık 0-8), 0,9(aralık 0-13) ve 0,3'tür (aralık 0-5). Halihazırda mevcut bilgiler; haftada bir kez uygulanan rejim ile karşılaştırıldığında potansiyel olarak kanama riskinde artış ile ilişkilendirilmesine rağmen, bazı hastalar için tedavi aralıklarınınuzatılmasını desteklemektedir. Ayrıca, ABR farklı faktör konsantrasyonları arasında ve farklı klinik çalışmalar arasında karşılaştırılabilir olmadığına dikkat edilmelidir. Önceden tedavi edilmiş 12 yaş altındaki hastalarda kanama kontrolü ve profilaksisiIDELVION'un etkililiği, 12'si 6 yaşından küçük olan, yaşları 1 - 10 arasında değişen (medyan yaş6) ve kanama epizodlarının kontrolü ve profilaksisi için IDELVION alan önceden tedavi edilmiştoplam 27 erkek hastanın yer aldığı bir faz 3 çalışmasında değerlendirilmiştir. 27 gönüllünün tamamı,13,1 aylık (9, 18 ay) ortalama çalışma süresince IDELVION ile haftalık profilaksi tedavisi almıştır.106 kanama epizodunun çoğunluğu (94; % 88,7), tek bir enjeksiyonla tedavi edilirken; 103'ü (% 97,2'si) 1-2 enjeksiyonla tedavi edilmiştir. Bir kanamanın sona ermesindeki hemostatik etkililik,tedavi edilen tüm kanama epizodlarının % 96'sında mükemmel veya iyi olarak derecelendirilmiştir.Haftada bir defadan daha uzun tedavi aralıklarının etkililik ve güvenliliğini araştıran klinik çalışmalardevam etmektedir. Rutin profilaksi tedavisinin uzun süreli etkililiği ve güvenliliği, 5 yıla kadar sürelerde yapılan açık etiketli ilave bir çalışmada teyit edilmiştir. Bu çalışmada, 12 yaş altındaki toplam 24 PTP, profilaksiiçin ve/veya talep üzerine kanama epizotlarının tedavisi için IDELVION almıştır. Profilaktik tedavi gören hastalar, haftada bir kez 35-50 IU/kg dozuyla tedaviye devam etmiş veya başlamıştır. Hastaların bir alt grubu, önerilen dozlar olan 75 IU/kg ile uzatılmış tedavi aralıklarına(10 veya 14 günde bir) geçiş yapmıştır. Çalışmanın sonunda, 17 PTP (%71) 7 günlük profilaksiaralığında, toplam 3 (%12) ve 4 (%17) PTP sırasıyla 10 ve 14 günlük uzatılmış profilaksi aralığındadevam etmiştir. Çalışma sırasında, 14 günlük rejimdeki 4 PTP (%50), artan kanama komplikasyonlarınedeniyle daha sık bir doz uygulamasına geçiş yapmıştır. Tüm kanamalar için IDELVION ile yapılan7 ve 14 günlük profilaksideki tahmin edilen medyan Yıllık Kanama Oranları (ABR) sırasıyla 2,0(aralık 0-14) ve 5,6'dır (aralık 0-8). Perioperatif idare_ .. ...Babelge, güvenLi elektonik imza ile imzaknm^tır.,.,.Belge oJierifif!er(atifortâffldakı^üveöiflikzve <et#ıliık)iki pivotalaaz 3dçaiısmasın4aveeuzunsSüreiieekıstansiyon çalışmasında değerlendirilmiştir. Protokole göre; etkililik analizi, majör ve minör cerrahi ope^ diş veya diğer cerrahi invaziv girişimler geçiren yaşları 5-58 arasında değişen 21 hastada gerçekleştirilen 30 cerrahi operasyonu içermektedir. IDELVION bolus enjeksiyonuyla uygulanmıştır.Dozlama, gönüllünün farmakokinetiği ve tedaviye verdiği klinik yanıta göre kişiselleştirilmiştir.Cerrahi operasyonların %96,7'sinde (n=29) 14 ile 163 IU/kg aralığında tek preoperatif bolusuygulanmıştır. Değerlendirilen tüm prosedürlerde hemostatik etkililik çok iyi veya iyi olarakderecelendirilmiştir. 14 günlük postoperatif dönemde, hastalar 0 ila 11 infüzyon ve toplam 0 ila 444IU/kg aralığında dozlar almıştır. Daha önce tedavi edilmemiş olan hastalarIDELVION'un güvenliliği ve etkililiği hemofili B'si olan (<%2 endojen FIX aktivitesi) daha önce tedavi edilmemiş 12 pediatrik hasta (PUP) ile gerçekleştirilen çok merkezli açık etiketli bir klinikçalışmada değerlendirilmiştir. Bu hastaların 11'i 0 ila 1 yaş aralığındadır. Medyan maruziyet günüsayısı 50 olmuştur (aralık 22 ila 146 arası maruziyet günü) ve 8 daha önce tedavi edilmemiş olanhasta ihtiyaç anında tedavi, profilaksi, cerrahi ve PK dönemlerinde >50 maruziyet gününe ulaşmıştır. 12 daha önce tedavi edilmemiş olan hastanın tümü rutin profilaksi ve 11'i 7 günlük rejimi almıştır. Genel medyan profilaksi süresi 11,5 aydır (aralık: 3,1 ila 32,3 ay). 7 günlük profilaksi rejiminde 6aydan fazla tedaviye ulaşan 9 daha önce tedavi edilmemiş olan hastada, ortalama yıllık kanama oranı(ABR) 1,16 olmuştur (aralık 0 ila 3,1). 9 daha önce tedavi edilmemiş olan hastadan beşinin ABR'si 0olmuştur. 7 günlük profilaksi rejimi için (N = 9) medyan aylık doz 195,9 IU/kg olmuştur (aralık 171,8ila 215,6 IU/kg). Beş gönüllü profilaksiden önce değişen sürelerde ihtiyaç anında tedavi görmüştür, maruziyet günü sayısı 1 ila 4 aralığında olmuştur. Tüm çalışma periyotları boyunca 10 daha önce tedavi edilmemiş olan hastada gözlemlenen 37 kanama olayının %94'ü 1 veya 2 infüzyonla başarıyla kontrol edilmiştir. 5.2. Farmakokinetik özelliklerGenel ÖzelliklerYetişkin popülasyonIDELVION'un farmakokinetiği 25, 50 ve 75 lU/kg'lık tek doz intravenöz enjeksiyonu takiben değerlendirilmiştir. 50 IU/kg tek doz IDELVION enjeksiyonunu takiben farmakokinetik parametreler(aşağıdaki tabloya bakınız), tek aşamalı koagülasyon tekniği ile ölçülen plazma faktörü IXaktivitesine bağlıdır. 7. gündeki ve 14. gündeki ortalama faktör IX aktivitesi sırasıyla % 13,76 ve %6,10 olmuştur. 30 haftaya kadar süreyle gerçekleştirilen tekrarlı farmakokinetik değerlendirme, stabilbir farmakokinetik profil ve inkremental iyileşmenin zamanla tutarlı olduğunu göstermiştir. Profilaksi sırasında kanama kontrolünü sağlamak için, klinik çalışmalarda % 5 - 10'luk çukur seviyeleri hedeflenmiştir. Farmakokinetik simülasyonlar, 50 IU/kg'lık tekli IDELVIONenjeksiyonunu takiben % 5 plazma FIX aktivitesine ulaşma zamanının yetişkinler için 12,5 günolacağını öne sürmektedir. 50 lU/kg'lık Tek Doz IDELVION Enjeksiyonunu Takiben Şiddetli Hemofilisi Olan Hastalar için Farmakokinetik Parametreler (Medyan (min, maks))
Emilim:IDELVION intravenöz olarak uygulanır ve doğası gereği % 100 emilim ve biyoyaralanıma sahiptir. Dağılım:IDELVION, kan hacmi ile karşılaştırıldığında (vücut ağırlığının % 7,7'si), kararlı halde yaklaşık 1 dL/kg veya vücut ağırlığının % 10'u kadar sınırlı bir dağılım hacmine sahiptir. Biyotransformasyon:IDELVION, endojen FIX ve endojen albumin ile aynı düzenli katabolik yolaklardan geçen bir rekombinant terapötik protein olduğu için, spesifik çalışmalar geçerli değildir. Eliminasyon:IDELVION, endojen FIX ve endojen albumin ile aynı düzenli katabolik yolaklardan geçen bir rekombinant terapötik protein olduğu için, spesifik çalışmalar geçerli değildir. Hastalardaki karakteristik özelliklerPediyatrik popülasyonIDELVION'un farmakokinetik parametreleri; tek doz 50 IU/kg intravenöz enjeksiyonu takiben adolesanlarda (12 - <18) ve çocuklarda (1 - <12) değerlendirilmiştir. Farmakokinetik parametreler(aşağıda gösterilmiştir), tek aşama pıhtılaşma tekniği ile ölçülen plazma faktörü IX aktivitesi - zamanprofili esas alınarak hesaplanmıştır. 50 lU/kg'lık Tek Doz IDELVION enjeksiyonunu takiben Yaş Kategorisi ile IDELVION'un Farmakokinetik Parametre Karşılaştırması (Medyan (min, maks))
Profilaksi sırasında kanama kontrolünü sağlamak için, klinik çalışmalarda % 5 - 10'luk çukur seviyeleri hedeflenmiştir. Farmakokinetik simülasyonlar, 50 IU/kg'lık tekli IDELVIONenjeksiyonunu takiben % 5 plazma FIX aktivitesine ulaşma zamanının 1-<6 yaş çocuklar için 7 gün,6-<12 yaş çocuklar için 9 gün ve 12-<18 yaş çocuklar için ise 11 gün olacağını öne sürmektedir. 5.3. Klinik öncesi güvenlilik verileriKlinik dışı veriler; konvansiyonel güvenlilik farmakoloji, tek ve tekrarlı doz toksisitesi, genotoksisite, trombojenisite ve lokal tolerabilite çalışmalarına dayanarak, insanlara ilişkin özel hiçbir tehlikegöstermemiştir.  Karsinojenisite ve üreme toksikolojisine ilişkin herhangi bir inceleme yürütülmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiToz:Trisodyum sitrat dihidrat Polisorbat 80MannitolSukroz HCl (pH ayarlaması için) Çözücü:Enjeksiyonluk su 6.2. GeçimsizliklerGeçimsizlik çalışmaları yapılmadığından dolayı; bu ürün bölüm 6.1'de bahsi geçenler dışında, başka hiçbir tıbbi ürün, seyreltici ya da çözücü ile karıştırılmamalıdır. 6.3. Raf ömrü36 ay Sulandırma sonrası, kimyasal ve fiziksel kullanım stabilitesi 25 oC altındaki oda sıcaklığında 8 saat süreyle kanıtlanmıştır. Mikrobiyolojik açıdan, sulandırılmış ürün hemen kullanılmalıdır. Eğer hemen kullanılmazsa kullanım içi saklama süreleri ve kullanım öncesindeki koşullar kullanıcının sorumluluğundadır. 6.4. Saklamaya yönelik özel tedbirler25 oC altındaki oda sıcaklığında ve orijinal ambalajında ışıktan koruyarak saklayınız. Ürünü dondurmayınız. Çocukların göremeyeceği ve erişemeyeceği yerlerde saklayınız. Tıbbi ürün sulandırıldıktan sonraki saklama koşulları için bölüm 6.3.'e bakınız. 6.5. Ambalajın niteliği ve içeriğiBirincil ambalajTıpalı (kauçuk), diskli (plastik) ve kapaklı (alüminyum) 10 mL'lik toz içeren flakon (tip I cam) ve tıpalı (kauçuk), diskli (plastik) ve kapaklı (alüminyum) 5 mL'lik enjeksiyonluk su içeren flakonda(tip I cam) kullanma talimatı ile birlikte karton kutuda sunulur. Takdim: Her bir kutuda: 1 adet toz içeren flakon 1 adet 5 mL enjeksiyonluk çözelti 1 adet filtre transfer cihazı 20/20® > elektronik imza ile imzalanmıştır. Uygulama seti (dahili kutu): 1 adet tek kullanımlık 10 mL'lik enjektör 1 adet kelebek infüzyon seti 2 adet alkollü mendil 1 adet steril olmayan plaster 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerGenel talimatlar- Çözelti, berrak ya da biraz bulanık, sarı ila renksiz olmalıdır. Filtrelendikten/enjektöre çekildikten(aşağıdaki bölüme bakınız) sonra, sulandırılmış ürün, uygulama öncesinde, partiküler madde verenk değişimi açısından görsel olarak incelenmelidir. - Bulanık ya da tortulu çözeltiler kullanılmamalıdır. - Sulandırma ve enjektöre çekme işlemleri aseptik koşullar altında gerçekleştirilmelidir. SulandırmaÇözücü oda sıcaklığına getirilir. IDELVION ve çözücü flakon kapaklarının çıkarıldığından, tıpaların antiseptik bir çözelti ile muamele edildiğinden ve Mix2Vial ambalajı açılmadan önce kurumayabırakıldığından emin olunur. 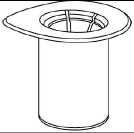 Mix2Vial ambalajını kapağını sıyırarak açınız. Mix2Vial'ı blister ambalajından çıkarmayınız!
1 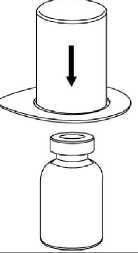 Çözücü flakonunumavidoğrudan aşağıyadoğru itiniz.
2 Blister ambalajı, kenarından tutarak ve dikey olarakyukarı doğru çekerek Mix2Vial'dan dikkatli şekilde çıkarınız. Mix2Vial setini değil, yalnızca blisterambalajını çektiğinizden emin olun.
3 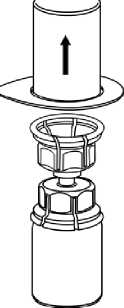  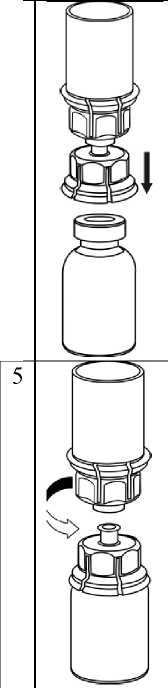 IDELVION flakonunuşeffafdoğrudan aşağıyadoğru itiniz.Çözücü otomatik olarak IDELVION flakonu içerisine akacaktır.Bir elinizle Mix2Vial setinin IDELVION kısmını ve diğer elinizle çözücü-kısmını kavrayıp seti dikkatli bir şekilde saat yönünün tersine doğru iki parça halinde çevirerek ayırınız. İliştirilen mavi Mix2Vial adaptörü ile birlikte çözücü flakonunu çıkarınız.
6 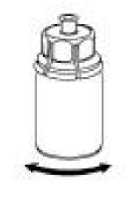 Madde tamamen çözünene kadar, iliştirilen şeffaf adaptör ile birlikte IDELVION flakonunu yavaşça karıştırınız. Çalkalamayınız.
7 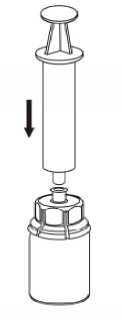 Boş steril bir enjektör içerisine hava çekiniz. IDELVION flakonu dikey konumdayken, enjektörü saat yönünde çevirerek takılan Mix2Vial'ın Luerkilidine bağlayınız. Havayı IDELVION flakonuna enjekte ediniz.  Enjektöre çekme ve uygulama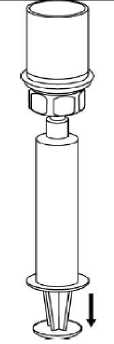 Enjektör pistonunu basılı tutarak, sistemi ters çevirip pistonu yavaşça geri çekerek çözeltiyi enjektöre çekiniz.
8 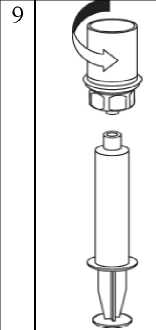 Çözelti enjektöre transfer edildikten sonra, enjektör silindirini sıkıca tutunuz (enjektör pistonu aşağıya bakacak şekilde) ve saat yönünün tersine çevirerekşeffaf Mix2Vial adaptörünü enjektörden ayırınız.IDELVION enjeksiyonu için, faktör IX'in bazı enjeksiyon ekipmanlarının iç yüzeyine yapışmasının bir sonucu olarak, tedavi başarısız olabileceği için; sunulan uygulama setlerinin kullanılması tavsiyeedilir.Kanın enjektörde pıhtılaşabilme ve dolayısıyla fibrin pıhtılarının hastaya geçebilmesi riski olduğundan dolayı; ürün ile dolu enjektöre kan geçmemesine dikkat edilmelidir.IDELVION çözeltisi seyreltilmemelidir.Sulandırılmış çözelti, yavaş intravenöz enjeksiyon ile uygulanmalıdır. Uygulama hızı, hastanın rahat edeceği seviyeye göre belirlenmelidir.Kullanılmamış olan tıbbi ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7.RUHSAT SAHIBICSL Behring Biyoterapi İlaç Dış Ticaret A.Ş.Ü sküdar/İstanbul8.RUHSAT NUMARASI2022/723 Z.V-/Z.Z.// z.j gy belge İlk ruhsatlandırma tarihi: 08.12.2022 Ruhsat yenileme tarihi: - 10. KÜB'ÜN YENILENME TARIHI |
İlaç BilgileriIdelvion 2000 Iu Enjeksiyonluk Çözelti Hazırlamak İçin Toz ve ÇözücüEtken Maddesi: Albutrepenonakog Alfa Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.




