Climara Forte 7,8 Mg/25 Cm 2 Transdermal Flaster Kısa Ürün BilgisiKISA ÜRÜN BILGISI1. BEŞERI TIBBİ ÜRÜNÜN ADICLIMARA® FORTE 7,8 mg/25 cm2 transdermal flaster 2. KALİTATİF VE KANTİTATİFBİLEŞİMEtkin madde:24 saatte nominal 100 mikrogram salgılayan, 7,6 mg estradiol (7,8 mg estradiol hemihidrat'a eşdeğer) içeren 25 cm2'lik flasterYardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMYapışkan akrilat matriksinde estradiol içeren flasterden oluşan transdermal taşıma sistemi. Flasterden transdermal salım 7 gün devam eder. Sistemin aktif maddesi estradioldür. Sistemin diğer bileşenleri farmakolojik olarak aktif değildir. Oval transdermal flaster; aktif maddeyi transparan taşıyıcı bir film tabakasında içeren yarı saydam homojen matrikslidir. 4.KLINIK ÖZELLIKLER4.1. Terapötik endikasyonlar 1 yıldan fazla bir süredir menopozdaki kadınlarda östrojen eksikliğinin hormon replasmantedavisinde (HRT) Osteoporozun önlenmesi konusunda onaylanmış tıbbi ürünlere tolerans gösterilememesiveya kontrendike olması durumunda kırık riski yüksek olan postmenopozal kadınlardaosteoporozun önlenmesi 4.2. POZOİOJİ VE UYGULAMA ŞEKLIPOZOİOJİ / UYGULAMA SıKLıĞı VE SÜRESI:HRT başlatıldığında hormonal kontrasepsiyon durdurulmalı ve hastaya, gerekirse, hormonal olmayan kontraseptif önlemleri alması önerilmelidir. Klimakterik semptomların kontrolü Tedavi en düşük CLIMARA dozu ile başlamalıdır. Gerekli görülürse daha yüksek doz kullanılmalıdır. Tedaviye başlandıktan sonra semptomların düzelmesi için gerekli olan endüşük etkin doz en kısa süre boyunca kullanılmalıdır. Osteoporozun önlenmesi Postmenopozal kemik kaybının önlenmesi için tedaviye menopozdan sonra mümkün olduğu kadar erken başlanmalıdır. Tedavi bireysel gereksinimlere göre ayarlanmalıdır. Uzun sürelitedavi önerilir. CLIMARA FORTE tedavisine başlama: Tedavi kesintisiz ya da siklik olarak verilebilir. Sürekli ardışık ya da siklik tedavinin değiştirilmesi: Önceki tedavi rejiminin bitiminin ertesi günü tedaviye başlanır. Doz Sürekli kullanım için: Flasterler kesintisiz olarak haftada bir uygulanmalı, 7 günün sonunda çıkarılmalı ve bir yenisi farklı bir uygulama yerine yapıştırılmalıdır. Periyodik kullanım için: Flasterler siklik olarak da kullanılabilir. Bu tercih edildiğinde flasterler birbirini izleyen 3 hafta boyunca uygulanmalı, bunu yeni bir siklusa başlamadan önce 7 günlük bir ara izlemelidir. Bir progestojen eklenmesi Hasta histerektomi geçirmediyse dışarıdan alınan östrojen kullanılmamalıdır. Uterusu sağlam olan kadınlarda CLIMARA FORTE tedavisine her ayın en az 12-14 günü boyunca kullanılmaküzere bir progestojen eklenmelidir. Önceden endometriozis tanısı konmadıysa, histerektomilikadınlarda progestojen ilavesi tavsiye edilmemektedir. Normal olarak progestojen uygulanma periyodu tamamlandıktan 2-3 gün sonra menstrüasyona benzer bir kanama görülür. Uygulama şekli:CLIMARA FORTE flasterin yüzeyini örten koruyucu şeffaf plastik tabaka kaldırıldıktan sonra flaster gövde ya da kalçada kuru, temiz deriye yapıştırılmalıdır. CLIMARA FORTE memeüzerine ya da yakınına yapıştırılmamalıdır. Flasterin yapıştırıldığı deri alanı yağlı, tahriş olmuşya da herhangi bir şekilde hasarlı olmamalıdır. Flaster bel hizasına yapıştırılmamalıdır, ziragiysilerin sürtünmesiyle düşebilir. Otururken flasterin yer değiştireceği bölgelere uygulamadankaçınılmalıdır. Flaster, ambalajın açılması ve koruyucu folyonun kaldırılmasından hemen sonra yapıştırılmalıdır. Flaster, yaklaşık 10 saniye boyunca, özellikle kenarlarda iyi bir temassağlandığından emin olunarak bastırılmalıdır. Flaster kalkarsa yapışkanlığı korumak için basınçuygulanmalıdır. Uygulama yerleri en az bir haftalık aralarla değişecek şekilde rotasyona tabi tutulmalıdır. Flaster doğru uygulandığında her zamanki gibi duş veya banyo almanız mümkündür. Flaster ancak çok sıcak banyo ya da saunada deriden kalkabilir. Unutulan ya da kaybolan flasterler - Flasterin 7 gün tamamlanmadan önce düştüğü durumlarda flaster tekrar uygulanabilir.Gerektiğinde 7 günlük doz aralığının geri kalan kısmı için yeni bir flaster uygulanmalıdır. - Hasta flasteri yapıştırmayı unuttuğunda hatırladığı zaman hemen uygulamalıdır. Dahasonraki flaster normal olarak 7 günlük doz aralığı ardından kullanılmalıdır. Eğer flaster düşerse veya birkaç gün kullanımı unutulursa, düzensiz kanama oluşabilir. özel popülasyonlara ilişkin ek bilgiler:Karaciğer yetmezliği:CLIMARA FORTE özel olarak karaciğer yetmezliği olan hastalarda çalışılmamıştır. CLIMARA şiddetli karaciğer hastalığı olan kadınlarda kontrendikedir (Bkz. Bölüm 4.3).Karaciğer fonksiyon bozukluğu olan kadınlar için yakın gözetim gereklidir ve karaciğerfonksiyon belirteçlerinde bozulma olması durumunda HRT kullanımı durdurulmalıdır (Bkz.Bölüm 4.4). Böbrek yetmezliği:CLIMARA FORTE özel olarak böbrek yetmezliği olan hastalarda çalışılmamıştır. Pediyatrik popülasyon:CLIMARA FORTE'un çocuklarda ve ergenlerde kullanım endikasyonu yoktur. Geriyatrik popülasyon:Yaşlı hastalarda doz ayarlamasını gerektirecek veri bulunmamaktadır. 4.3. KontrendikasyonlarCLIMARA FORTE aşağıdaki koşullarda kontrendikedir; Gebelik ve laktasyon Tedavi edilmemiş endometrial hiperplaziTanı konmamış anormal genital kanamaMeme kanseri ya da şüphesi, ya da geçmişte geçirilmiş olmasıÖstrojen bağımlı malign tümörler, örn. endometrial kanser ya da şüphesiAkut karaciğer hastalığı veya karaciğer fonksiyon testleri normale dönmediği sürecekaraciğer hastalığı öyküsü Aktif ya da yeni akut arteriyel tromboembolizm (örn. miyokard enfarktüsü, inme, angina) Geçmişte veya mevcut venöz tromboemboli (derin ven trombozu, pulmoner emboli)Etkin maddeye veya bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşıaşırı duyarlılıkPorfiria Bilinen trombofilik bozukluklar (örn. protein C, protein S veya antitrombin eksikliği; Bkz. Bölüm 4.4.) 4.4. özel kullanım uyarıları ve önlemleriMenopoz sonrası semptomların tedavisinde, HRT sadece yaşam kalitesini olumsuz etkileyen semptomlar için başlatılmalıdır. Her durumda, riskler ve faydalar en az yılda bir kez dikkatlibir şekilde değerlendirilmeli ve HRT'ye ancak fayda riskten ağır bastığı sürece devamedilmelidir. Erken menopoz tedavisinde HRT ile ilişkili risklere dair kanıtlar sınırlıdır. Bununla birlikte, daha genç kadınlarda mutlak risk seviyesinin düşük olması nedeniyle, bu kadınlar için fayda verisk dengesi daha yaşlı kadınlardakine göre daha olumlu olabilir. Tıbbi muayene/takip HRT'yi başlatmadan veya yeniden başlatmadan önce, eksiksiz bir kişisel ve aile tıbbi geçmişi alınmalıdır. Fiziksel (pelvik ve meme dahil) muayene, tıbbi geçmişe ve kontrendikasyonlara vekullanım uyarılarına göre yönlendirilmelidir. Tedavi sırasında, kişiye göre uyarlanmış sıklıktave yapıda periyodik kontroller önerilmektedir. Kadınlara, memelerinde oluşacak herhangi birdeğişikliği doktoruna veya hemşiresine bildirmesi gerektiği konusunda bilgi verilmelidir(aşağıdaki 'Meme kanseri' bölümüne bakınız). Mamografi gibi uygun görüntüleme yöntemleridahil olmak üzere tetkikler, bireyin klinik ihtiyaçlarına göre modifiye edilmiş, güncel olarakkabul edilmiş tarama uygulamalarına uygun olarak yapılmalıdır. Venöz tromboemboli HRT, venöz tromboemboli (VTE), yani derin ven trombozu veya pulmoner embolizmgelişmesi bakımından 1,3-3 kat risk ile ilişkilendirilmektedir. Bu tip bir olayın HRTkullanımının ilk yılı içinde ortaya çıkması sonraki yıllara göre daha olasıdır (Bkz.Bölüm 4.8). Trombofilik durumları olduğu bilinen hastalarda artmış VTE riski vardır ve HRT buriski artırabilir. Bu nedenle HRT bu hastalarda kontrendikedir (Bkz. Bölüm 4.3). VTE için genellikle tanımlanan risk faktörleri; östrojen kullanımı, ileri yaş, majörcerrahi, sistemik lupus eritematozus (SLE), aşırı şişmanlık (VKI >30 kg/m2), uzun süreliimmobilizasyon, gebelik / postpartum dönemi ve kanserdir. VTE'de variköz venlerinolası rolü ile ilgili bir görüş birliği bulunmamaktadır. Tüm postoperatif hastalardaolduğu gibi, cerrahi sonrası VTE'yi önlemek için profilaktik önlemler düşünülmelidir.Elektif cerrahinin ardından uzun süreli immobilizasyon uygulanacaksa, HRT'nin 4 ila 6hafta önce geçici olarak durdurulması önerilmektedir. Kadın tamamen mobilize olanakadar tedaviye yeniden başlanmamalıdır. VTE kişisel öyküsü olmayan, ancak birinci derece akrabasında erken yaşta trombozöyküsü olan kadınlarda, kısıtlamaları (trombofilik kusurların sadece bir bölümütaramayla belirlenebilmektedir) hususunda dikkatli bir danışmanlıktan sonra taramaönerilebilir. Aile bireylerinde trombozla ayrılan bir trombofilik kusur belirlenirse veyakusur 'ciddi' ise (örn., antitrombin, protein S veya protein C eksiklikleri ya da kusurlarınbir kombinasyonu) HRT kontrendikedir. Halihazırda kronik antikoagülan tedavi gören kadınlar, HRT kullanımının fayda-riskinin dikkatli bir şekilde değerlendirilmesini gerektirir. Tedaviye başlandıktan sonra VTE gelişirse ilaç kesilmelidir. Hastalara potansiyel birtromboembolik semptomun (örneğin, bir bacağın ağrılı şişmesi, göğüste ani ağrı,dispne) farkına vardıklarında derhal doktorlarıyla iletişime geçmeleri söylenmelidir. Koroner arter hastalığı (KAH) Randomize kontrollü araştırmalarda önceden KAH bulunan ya da bulunmayan ve kombine östrojen-progestojen veya yalnızca östrojen içeren HRT kullanan kadınlarda miyokardenfarktüsüne karşı koruma sağlanmasıyla ilgili kanıt elde edilmemiştir. Kombine östrojen-progestojen tedavisiKombine östrojen-progestojen HRT kullanımı sırasında KAH'nın göreceli riski hafif bir artış göstermektedir. Temel mutlak KAH riski önemli ölçüde yaşa bağlı olduğu için, östrojen-progestojen kullanımına bağlı fazladan KAH vakalarının sayısı menopoz dönemine yaklaşansağlıklı kadınlarda çok düşüktür, ancak yaş ilerledikçe artacaktır. Sadece östrojen içeren tedaviRandomize kontrollü çalışmalarda sadece östrojen içeren tedavi alan histerektomi yapılmış kadınlarda KAH bakımından herhangi bir risk artışı saptanmamıştır. Endometriyal hiperplazi ve karsinom Uterusu sağlam olan kadınlarda uzun süreli östrojen uygulamasıyla endometriyal hiperplazive karsinom riski artmaktadır. Yalnızca östrojen kullananlarda endometriyal kanserbakımından kullanmayanlara kıyasla bildirilen artış, tedavi süresi ve östrojen dozuna bağlıolmak üzere 2 ila 12 kat daha fazladır (Bkz. Bölüm 4.8). Tedavinin kesilmesinden sonra enaz 10 yıl süreyle risk yüksek kalabilir. En az ayda 12 gün/28 günlük siklus şeklinde siklik olarak progestojen eklenmesi veyasürekli olarak kombine östrojen-progestojen tedavisi uygulanması, histerektomiuygulanmamış olan kadınlarda yalnızca östrojen içeren HRT ile ilişkili risk artışınıönlemektedir. Oral doz olarak 2 mg'den fazla estradiol, 0,625 mg'den fazla konjuge östrojen lerin ve 50mikrogram/gün'den fazla bantlar için eklenen progestojenlerin endometriyal güvenliliğibelirlenmemiştir. Tedavinin ilk aylarında beklenmeyen kanama ve lekelenme olabilmektedir. Beklenmeyenkanama veya lekelenmenin tedavide belli bir süre geçtikten sonra ortaya çıkması ya datedavi bırakıldıktan sonra devam etmesi halinde, bu durumun nedeni olabilecekendometriyal malignitenin dışlanması için endometriyal biyopsi dahil tanıya yönelikaraştırmalar yapılmalıdır. Progestojen ile karşılanmayan östrojen stimülasyonu rezidüel endometriyozis odaklarındapremalign veya malign dönüşüme yol açabilmektedir. Bu nedenle, endometriyozisnedeniyle histerektomi uygulanmış olan kadınlarda rezidüel endometriyozis varsa, östrojenreplasman tedavisine progestojen eklenmesi düşünülmelidir. Meme kanseri Genel kanıtlar kombine östrojen-progestojen veya yalnızca östrojen içeren HRT kullanan kadınlarda HRT kullanma süresine bağlı olmak üzere meme kanseri riskinde artış olduğunugöstermektedir. Kombine östrojen-progestojen tedavisiRandomize plasebo kontrollü bir araştırma olan Women 's Health Initiative(WHI) çalışması ve prospektif epidemiyolojik çalışmaların bir meta analizi kombine östrojen-progestojen içerenHRT kullanan kadınlarda meme kanseri bakımından yaklaşık 3 (1-4) yıl sonunda belirgin halegelen bir risk artışı bulunduğu konusunda tutarlılık sergilemektedir (Bkz. Bölüm 4.8).Sadece östrojen içeren tedaviWHI çalışmasında sadece östrojen içeren HRT alan histerektomi yapılmış kadınlarda meme kanseri bakımından herhangi bir risk artışı saptanmamıştır. Gözlemsel çalışmalarda çoğunluklameme kanseri tanısı alma bakımından hafif bir artış olduğu, ancak bu artışın östrojen-progestojen kombinasyonu kullananlardaki riske kıyasla düşük olduğu bildirilmiştir (Bkz.Bölüm 4.8). Büyük bir meta analizin bulguları, tedavi kesildikten sonra bu artmış riskin zaman içinde azalacağını ve başlangıç düzeyine dönmek için gereken sürenin önceki HRT kullanımınınsüresine bağlı olduğunu göstermiştir. HRT'nin 5 yıldan uzun süre kullanıldığı durumlarda, sözkonusu risk 10 yıl veya daha uzun süre devam edebilir. HRT, özellikle östrojen-progestojen kombine tedavisi, meme kanserinin radyolojik tespitini olumsuz etkileyebilecek mamografik görüntülerin yoğunluğunu arttırmaktadır. Over kanseri Over kanseri, meme kanserinden daha nadir görülür. Bu geniş meta analizden elde edilen epidemiyolojik kanıtlar, tek başına östrojen veya kombine östrojen -progestojen içeren HRT ürünlerini kullanan kadınlarda 5 yıl içerisinde belirgin halegelen ve kesildikten sonra zamanla azalan hafif bir risk artışı göstermektedir. WHI çalışması dahil diğer bazı çalışmalar, kombine HRT kullanımının benzer veya biraz daha düşük bir risk ile ilişkili olabileceğini ileri sürmektedir (Bkz. Bölüm 4.8). İskemik inme Kombine östrojen-progestojen ve tek başına östrojen tedavisi iskemik inme riskinde 1,5 kata kadar olan artışla ilişkilendirilmektedir. Rölatif risk yaş veya menapozdan itibaren geçen süreyegöre değişmemektedir. Bununla birlikte, başlangıçtaki inme riski büyük oranda yaşa bağlıdır veHRT kullanan kadınlardaki genel inme riski yaşla birlikte artmaktadır (Bkz. Bölüm 4.8). İzlem gerektiren durumlar Aşağıdaki durumlardan herhangi birinin bulunması, önceden ortaya çıkmış olması ve/veya gebelik ya da önceki hormon tedavisi sırasında alevlenmesi durumunda hasta yakındanizlenmelidir. CLIMARA FORTE tedavisi sırasında bu durumların tekrarlayabileceği ya daalevlenebileceği dikkate alınmalıdır, özellikle: - Leiomyom (uterin fibroidleri) ya da endometriozis - Tromboembolik bozukluk öyküsü ya da risk faktörleri (aşağıya bakınız) - Östrojene bağımlı tümör için örneğin meme kanseri için birinci derece kalıtım gibi riskfaktörleri - Hipertansiyon - Karaciğer bozuklukları (örn. karaciğer adenomu) - Vasküler tutulumu olan/olmayan diabetes mellitus - Kolelitiazis - Migren ya da şiddetli baş ağrısı - Sistemik lupus eritematozus - Endometrial hiperplazi öyküsü (aşağı bakınız) - Epilepsi - Astım - Otoskleroz - Herediter anjiyoödemTedavinin ani kesilme nedenleri: Tedavi bir kontrendikasyon saptanması halinde ve aşağıdaki durumlarda kesilmelidir: - Sarılık ya da karaciğer fonksiyonlarının kötüleşmesi - Kan basıncında anlamlı artış - Yeni başlangıçlı migren tipi baş ağrısı - Gebelik Hepatit C Hepatit C virüsü (HCV) enfeksiyonları için tedavi gören hastalarda, dasabuvir içeren veya içermeyen ombitasvir/paritaprevir/ritonavir içeren tıbbi ürünlerle yapılan klinik deneylersırasında, normalin üst sınırının (ULN) 5 katından fazla transaminaz (ALT) yükselmeleri,kombine hormonal kontraseptifler (KHK'lar) gibi etinilestradiol içeren ilaçlar kullanankadınlarda önemli ölçüde daha sık meydana gelmiştir. Ek olarak, glekaprevir/pibrentasvir iletedavi edilen hastalarda da, KHK gibi etinilestradiol içeren ilaçlar kullanan kadınlarda ALTyükselmeleri gözlenmiştir. Etinilestradiol dışındaki estradiol gibi östrojenli tıbbi ürünlerkullanan kadınların, östrojen kullanmayanlarla benzer bir ALT yükselme oranına sahip olduğugözlenmiştir. Ancak, bu diğer östrojenleri kullanan kadın sayısının sınırlı olması nedeniyle,dasabuvir içeren veya içermeyen ombitasvir / paritaprevir / ritonavir kombinasyon ilaç rejimiile ve ayrıca glekaprevir / pibrentasvir rejimi ile birlikte uygulama konusunda dikkatli olunmasıönerilir (Bkz. Bölüm 4.5). Diğer durumlar Önceden hipertrigliseridemili kadınlar östrojen ya da hormon replasman tedavisi sırasındayakından izlenmelidir; çünkü bu durumda östrojen tedavisi ile pankreatite yol açan plazmatrigliseritlerinde büyük artışların olduğu nadir vakalar bildirilmiştir. Eksojen östrojenler, kalıtsal ve edinilmiş anjiyoödem semptomlarını indükleyebilirler veyaşiddetlendirebilirler. Östrojenler tiroid bağlayıcı globulin (TBG) artışına yol açarak proteine bağlı iyot (PBI), T4düzeyi (kolon ya da radyoimmünolojik tayin ile) ya da T3 düzeyi (radyoimmünolojik tayinile) ile ölçülen total tiroid hormonunun artmasına neden olur. T3 rezin alımındaki azalmaise TBG artışını yansıtır. Serbest T4 ve serbest T3 konsantrasyonları değişmez. Serumdakidiğer bağlayıcı proteinler artabilir; kortikoid bağlayıcı globulin (CBG) ve cinsiyet hormonbağlayıcı globulin (SHBG) sırasıyla kortikosteroid ve cinsiyet steroidlerinin dolaşımdakidüzeylerinin artışına yol açar. Serbest ya da biyolojik aktif hormon konsantrasyonlarıdeğişmez. Diğer plazma proteinleri artabilir (anjiyotensinojen/renin substratı, alfa-I-antitripsin, seruloplazmin). Kloazma özellikle kloazma gravidarum öyküsü olan kadınlarda bazen ortaya çıkabilir.Kloazma eğilimi olan kadınlarda HRT kullanımı sırasında güneşe ya da ultraviole ışınınamaruziyet en az düzeye düşürülmelidir. Östrojen sıvı tutulmasına sebep olabilir. Bu nedenle, kardiyak ve renal fonksiyonbozukluğu olan hastalar dikkatle gözlenmelidir. HRT kullanımı bilişsel işlevlerde iyileşme sağlamaz. Kombine veya yalnızca östrojen içeren HRT kullanmaya 65 yaşından sonra başlayan kadınlarda olası demans riskininartmasıyla ilgili birtakım kanıtlar bulunmaktadır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriNot: Potansiyel etkileşimleri belirlemek için eş zamanlı kullanılan ilaçların reçete bilgilerine bakılmalıdır. Diğer tıbbi ürünlerin CLIMARA FORTE'ye etkileri:Seks hormonlarının klirensini artıran maddeler (enzim indüksiyonuyla azalan etkililik), örneğin:Östrojenlerin metabolizması, antikonvülsanlar (örn. barbitüratlar, fenitoin, primidon, karbamezapin) ve antiinfektifler (örn. rifampisin, rifabutin, nevirapin, efavirenz) ve ayrıcamuhtemel olarak felbamat, griseofulvin, okskarbazepin, topiramat ve St. John's wort(Sarıkantaron) içeren bitkisel ürünler gibi ilaç metabolize eden enzimleri özellikle sitokrom P450enzimlerini indüklediği bilinen maddelerle eş zamanlı kullanım ile artabilir.Transdermal uygulamada karaciğerdeki ilk geçiş etkisi önlenmiş olur ve bu nedenle transdermal uygulanan östrojenler oral hormonlara göre enzim indükleyicilerden daha az etkilenebilir.Klinik olarak, artan östrojen ve progestojen metabolizması etkinin azalmasına ve uterus kanamaprofilinde değişikliklere yol açabilir. Enzim indüksiyonu birkaç günlük tedaviden sonra gözlemlenebilir. Maksimal enzim indüksiyonu genellikle birkaç hafta içinde görülür. İlaç tedavisi kesildikten sonra enzimindüksiyonu yaklaşık 4 haftaya kadar sürebilir. Seks hormonlarının klirensi üzerinde değişken etkileri olan maddeler:Birçok HIV proteaz inhibitörü ve non-nükleozid revers transkriptaz inhibitörü kombinasyonları, HCV inhibitörü kombinasyonları dahil olmak üzere cinsiyet hormonlarıylabirlikte uygulandığında, östrojen ve progestinin plazma konsantrasyonlarını artırabilir veyaazaltabilir. Bu değişiklikler bazı olgularda klinik olarak ilgili olabilir. Bu nedenle, olası etkileşimleri ve herhangi ilgili önerileri belirlemek için eş zamanlı kullanılan HIV/HCV ilaçlarının reçete bilgilerine başvurulmalıdır. Seks hormonlarının klirensini azaltan maddeler (enzim inhibitörleri):Azol antifungaller (ör. flukonazol, itrakonazol, ketokonazol, vorikonazol), verapamil, makrolidler (ör. klaritromisin, eritromisin), diltiazem ve greyfurt suyu gibi güçlü ve orta dereceCYP3A4 inhibitörleri östrojen plazma konsantrasyonlarını artırabilir. Diğer etkileşimlerHCV enfeksiyonları için tedavi gören hastalarda, dasabuvir içeren veya içermeyen ombitasvir/paritaprevir/ritonavir içeren tıbbi ürünlerle yapılan klinik deneyler sırasında,normalin üst sınırının (ULN) 5 katından fazla transaminaz (ALT) yükselmeleri, KHK'lar gibietinilestradiol içeren ilaçlar kullanan kadınlarda önemli ölçüde daha sık meydana gelmiştir.Estradiol gibi etinilestradiol dışındaki östrojenli tıbbi ürünler kullanan kadınlar, östrojenkullanmayanlarla benzer bir ALT yükselme oranına sahip olduğu gözlenmiştir. Ancak, bu diğeröstrojenleri kullanan kadın sayısının sınırlı olması nedeniyle, dasabuvir içeren veya içermeyenkombinasyon ilaç rejimi ombitasvir/paritaprevir/ritonavir ve ayrıca glekaprevir /pibrentasvirrejimi ile birlikte uygulama konusunda dikkatli olunması önerilir (Bkz. Bölüm 4.4). Laboratuvar TestleriSeks steroidlerinin kullanılması, karaciğer, tiroid, adrenal ve renal fonksiyonların biyokimyasal parametrelerini, örneğin kortikosteroid bağlayıcı globülin ve lipid / lipoprotein fraksiyonlarıgibi (taşıyıcı) proteinlerin plazma düzeylerini ve karbonhidrat metabolizması, koagülasyon vefibrinoliz parametrelerini içeren belirli laboratuvar testlerinin sonuçlarını etkileyebilir.Değişiklikler genel olarak normal laboratuvar aralığı dahilinde kalır. Daha fazla bilgi içinbölüm 4.4 Diğer durumlar bölümüne bakınız. 4.6. Gebelik ve laktasyonGenel tavsiye:Çocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon):Çocuk doğurma potansiyeli olan kadınların tedavi süresince etkili, hormonal olmayan doğum kontrolü uygulamaları gerekir. Gebelik dönemi:Gebelik sırasında CLIMARA FORTE kullanımı kontrendikedir. CLIMARA FORTE ile ilaç tedavisi sırasında gebelik oluşursa ilaç derhal kesilmelidir. Epidemiyolojik çalışmalar istem dışı (yanlışlıkla) östrojen kullanmış olan kadınların çocuklarında doğumsal kusur riskinde herhangi bir artış ya da teratojenik etki göste rmemiştir. Laktasyon dönemi:Laktasyon sırasında CLIMARA FORTE kullanımı kontrendikedir. Düşük miktarlarda seks hormonu anne sütüne geçebilir. Üreme yeteneği / Fertilite:Fertilite verisi bulunmamaktadır. 4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makina kullanma yeteneği üzerine etkisini değerlendiren herhangi bir çalışma yürütülmemiştir. CLIMARA FORTE kullanıcılarında araç ve makine kullanma yeteneğiüzerinde herhangi bir etki gözlemlenmemiştir. 4.8. İstenmeyen etkilerTedavinin ilk birkaç ayında yoğun kanamalar, lekelenme ve memede hassasiyet veya büyüme ortaya çıkabilir. Bunlar genellikle geçici olup normal olarak tedavi kesildikten sonra ortadankalkar. Aşağıdaki liste klinik çalışmalarda kaydedilen advers ilaç reaksiyonlarının yanı sırapazarlama sonrası rapor edilen advers ilaç reaksiyonlarını listelemektedir. Advers ilaçreaksiyonları, 3 adet faz III klinik çalışmada (n = 611 riskli kadın) kaydedilmiştir ve transdermaluygulamayı takiben sırasıyla 50 mikrogram/gün estradiol ya da 100 mikrogram/gün estradioltedavisi ile en azından olası ilişkili olduğu düşünülenler aşağıda sunulmuştur. Advers ilaç reaksiyonlarının hastaların toplam %76'sında ortaya çıkması beklenir. Klinik çalışmalarda hastaların > % 10'unda ortaya çıkan advers ilaç reaksiyonları uygulama yeri tahrişive meme ağrısı olmuştur. Advers reaksiyonlar, aşağıda sistem organ sınıfı (MedDRA) ve sıklık derecelerine göre listelenmektedir. Sıklık dereceleri şu şekilde tanımlanmaktadır: Çok yaygın (>1/10); yaygın(>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çokseyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Kan ve lenf sistemi hastalıklarıYaygın olmayan: Purpura* Bağışıklık sistemi hastalıklarıBilinmiyor: Herediter anjioödemin şiddetlenmesi (Pazarlama sonrası bildirilen advers olay) Metabolizma ve beslenme hastalıklarıYaygın: Ödem, kilo artışı Yaygın olmayan: Hiperkolesterolemi* Sinir sistemi hastalıklarıYaygın: Baş ağrısı, depresyon, baş dönmesi, sinirlilik, letarji, terleme artışı, sıcak basması Yaygın olmayan: Anksiyete, uykusuzluk, apati, emosyonel labilite, konsantrasyon bozukluğu,parestezi, libido değişikliği, öfori*, tremor*, ajitasyon* GÖZ HASTALıKLARıYaygın olmayan: Abnormal görme*, göz kuruluğu* Kardiyak hastalıklarıYaygın olmayan: Palpitasyonlar, hipertansiyon* Vasküler hastalıklarıYaygın olmayan: Migren, yüzeysel flebit*, Bilinmiyor: Serebral iskemik olay (Pazarlama sonrası bildirilen advers olay) Solunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın olmayan: Dispne*, rinit* Gastrointestinal hastalıklarYaygın: Bulantı, flatulansYaygın olmayan: İştah artışı, konstipasyon, dispepsi*, diyare*, rektal bozukluk* Bilinmiyor: Karın ağrısı veya şişkinlik (abdominal distansiyon), kolestatik sarılık (Pazarlamasonrası bildirilen advers olay) Deri ve deri altı doku hastalıklarıYaygın: Uygulama yerinde kaşıntı, döküntüYaygın olmayan: Akne, alopesi, deride kuruluk, benign meme neoplazması, memede büyüme, memede hassasiyet, tırnak bozuklukları*, deride nodül*, hirsutizm* Bilinmiyor: Kontakt dermatit, egzama, memede ağrı (Pazarlama sonrası bildirilen advers olay) Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın olmayan: Eklem bozukluğu, kas krampları Üreme sistemi ve meme hastalıklarıYaygın: Menstruel bozukluk, vajinal akıntı, vulva/vajina bozuklukları.Yaygın olmayan: İdrar sıklığında/aciliyetinde artış, benign endometrial neoplazma, endometrial hiperplazi, üriner inkontinans*, sistit*, idrarda renk değişikliği*, hematüri*, uterusbozuklukları* Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Ağrı Yaygın olmayan: Yorgunluk, anormal laboratuvar testi* , asteni, ateş*, grip-nezle benzeri sendrom*, bitkinlik* *Tek olgularda bildirilmiştir. Çalışma popülasyonunun küçük olması (n=611) nedeniyle bu sonuçlar temelinde olayların yaygın olmayan ya da seyrek olduğuna karar verilemez. Meme kanseri 5 yıldan uzun süreyle kombine östrojen-progestojen tedavisi uygulanan kadınlarda meme kanseri tanısı bakımından 2 kata kadar risk artışı olduğu bildirilmiştir. Yalnızca östrojen içeren tedavi uygulanan kadınlardaki risk artışı östrojen-progestojen kombinasyonu kullanan kadınlara kıyasla düşüktür. Risk düzeyi kullanım süresine bağlıdır (Bkz. Bölüm 4.4). En büyük randomize plasebo kontrollü araştırma (WHI çalışması) ile prospektif epidemiyolojik çalışmalara ilişkin en büyük meta analizin sonuçlarına dayanan mutlak risk tahminlerisunulmaktadır. Prospektif epidemiyolojik çalışmaların en büyük meta analizi - VKİ 27 (kg/m2) olan kadınlarda 5 yıllık kullanım sonrasında meme kanseri bakımından öngörülen ek risk) olan kadınlarda 5 yıllık kullanım sonrasında meme kanseri bakımından öngörülen ek risk
VKI 27 (kg/m2) olan kadınlarda 10 yıllık kullanım sonrasında meme kanseri bakımından öngörülen ek risk) olan kadınlarda 10 yıllık kullanım sonrasında meme kanseri bakımından öngörülen ek risk
Endometriyal kanser Uterusu bulunan postmenopozal kadınlar Uterusu bulunan ve HRT kullanmayan kadınlarda endometriyal kanser riski 1000 kadında 5'tir. Uterus bulunan kadınlarda endometriyal kanser riskini artırması nedeniyle yalnızca östrojeniçeren HRT kullanımı önerilmez (Bkz. Bölüm 4.4). Yalnızca östrojen içeren tedavinin dozuna ve kullanım süresine bağlı olarak, endometriyal kanser riskindeki artış epidemiyolojik çalışmalarda 50-65 yaş grubundaki her 1000 kadında tanıalan 5 ila 55 ilave olgu şeklindedir. Yalnızca östrojen içeren tedaviye siklus başına en az 12 gün süreyle bir progestojen eklenmesi bu risk artışını engelleyebilir. Milyon Kadın Çalışmasında beş yıl süreyle (ardışık veya sürekliolarak) kombine HRT kullanımı endometriyal kanser riskini artırmamıştır (RR: 1 (0,8 -1,2)). Over kanseri: Tek başına östrojen veya kombine östrojen-progestojen içeren HRT kullanımı over kanseri tanısı alma riskindeki hafif bir artış ile ilişkilendirilmiştir (Bkz. Bölüm 4.4). 52 epidemiyolojik çalışmadan elde edilen bir meta analizde, halihazırda HRT kullanan kadınlarla HRT'yi hiç kullanmamış kadınlar (RR 1,43, 95 % GA 1,31-1,56) karşılaştırıldığındaover kanser riskinde artış bildirilmiştir. 50-54 yaş aralığında 5 yıl süreyle HRT kullanankadınlar için bu sayı her 2000 tedavi alan hastada yaklaşık 1 ilave vaka ile sonuçlanmaktadır.HRT kullanmayan 50-54 yaş aralığındaki kadınlarda, 5 yıllık süreçte 2000 kadından 2'sine overkanseri teşhisi konulması beklenmektedir. Venöz tromboembolizm riski: HRT venöz tromboembolizm (VTE), yani derin ven trombozu veya pulmoner embolizm gelişmesi bakımından 1,3 ila 3 kat fazla rölatif riskle ilişkilendirilmektedir. Bu tip bir olayınHRT kullanımının ilk yılı içinde ortaya çıkması daha olasıdır (Bkz. Bölüm 4.4.). WHIçalışmasının sonuçları sunulmaktadır: WHI Çalışmaları - 5 yıllık kullanımda VTE bakımından ek risk
Koroner arter hastalığı riski: Koroner arter hastalığı riski 60 yaş üzerinde olup kombine östrojen-progestojen kullananlarda hafif oranda artmaktadır (Bkz. Bölüm 4.4). İskemik inme riski: Tek başına östrojen ve kombine östrojen-progestojen tedavisi iskemik inme ile ilgili rölatif riskinin 1,5 kata kadar olan artmasıyla ilişkilendirilmektedir. HRT kullanımı sırasındahemorajik inme riski artmamaktadır. Bu rölatif risk yaş veya kullanım süresine bağlı olmayıp, başlangıçtaki risk büyük oranda yaşa bağlı olduğundan, HRT kullanan kadınlardaki genel inme riski yaşla birlikte artmaktadır (Bkz.Bölüm 4.4).
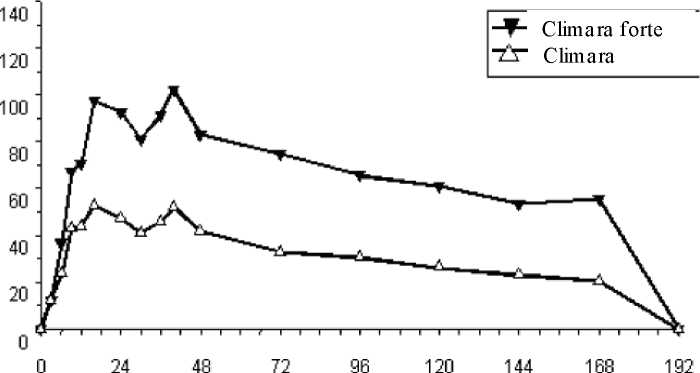
Östrojen/progestojen tedavisiyle ilişkili olarak başka advers reaksiyonlar da bildirilmiştir: - Safra kesesi hastalığı. - Deri ve deri altı bozuklukları: Kloazma, eritema multiforme, eritema nodosum, vaskülerpurpura. - 65 yaş üzerinde olası demans (Bkz. Bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected] ; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. DOZ AŞıMı VE TEDAVISIAşırı dozaj bu tür uygulamalarda olası değildir. Bulantı, kusma ve geri çekilme kanaması bazı kadınlarda meydana gelebilir. Spesifik bir antidot yoktur; flaster(-ler) kaldırılmalı vesemptomatik tedavi uygulanmalıdır. 5.FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Doğal ve yarı sentetik östrojenler (yalın) ATC kodu: G03CA03 Etki mekanizması ve farmakodinamik etkiler CLIMARA FORTE kimyasal ve biyolojik olarak endojen insan estradiolü ile aynı olan sentetik 17B- estradiol içerir. Menopozdaki kadında östrojen üretimi kaybını yerine koyarak menopozsemptomlarını azaltır. Östrojenler menopoz ya da ovariektomi ardından gelişen kemik kaybınıönler. Klinik etkililik ve güvenlilik Östrojen eksikliği semptomlarının düzelmesi - Menopoz semptomları tedavinin ilk birkaç haftasında düzelmeye başlar. Osteoporozun önlenmesi - Menopozda östrojen eksikliği kemik döngüsünün artışı ve kemik kitlesindeazalma ile ilişkilidir. Östrojenlerin kemik mineral yoğunluğu üzerine etkisi dozabağlıdır. Bununla birlikte, klinik çalışmalarda postmenopozal osteoporozunönlenmesinde CLIMARA FORTE etkinliği CLIMARA'ya göre anlamlıdüzeyde daha iyi bulunmamıştır. Koruma tedavi sürdükçe devam etmektedir.HRT kesildikten sonra kemik kitlesi tedavi edilmemiş kadınlardaki düzeyebenzer şekilde azalır. - WHI çalışması ve meta analizlerinin kanıtları tek başına ya da bir progestojenkombinasyonu ile mevcut HRT kullanımının - ağırlıklı olarak sağlıklı kadınlaraverilen - kalça, vertebral ve diğer osteoporotik kırıkları azalttığınıgöstermektedir. HRT düşük kemik yoğunluğu olan ve/veya osteoporozsaptanmış kadınlarda da kırıkları önleyebilir, fakat bunun için kanıt sınırlıdır. CLIMARA FORTE ile biri ABD'de diğeri Avrupa'da olmak üzere osteoporozun önlenmesine yönelik iki klinik çalışma yapılmıştır. CLIMARA - İki yıllık tedaviden sonra lomber omurga kemik mineral yoğunluğundaki(KMY) artış Avrupa ve ABD'de çalışmasında sırasıyla %6,91 (%95 güvenaralığı (GA) 4,90-8,91) ve %4,09 (%95-GA 2,01-6,17) olmuştur. ABDçalışmasında, yanıt verenlerin oranı da değerlendirilmiştir. Tedavi sırasındalomber omurga bölgesinde KMY'yi koruyan veya kazanan kadınların yüzdesi%94'tür. - CLIMARA'nın femur boynu KMY'si üzerinde de etkisi olmuştur. Femurboynunda 2 yıl sonra artış, Avrupa ve ABD çalışmasında sırasıyla %5,73 (%95-gA 4,25-7,21) ve %1,61 (%95-GA 0,09-3,13)'dür. ABD çalışmasında, yanıtverenlerin oranı da değerlendirilmiştir. Tedavi sırasında femur boynundaKMY'yi koruyan veya kazanan kadınların yüzdesi %78'dir. CLIMARA FORTE - İki yıllık tedaviden sonra, lomber omurga kemik mineral yoğunluğundaki(KMY) artış Avrupa ve ABD çalışmasında sırasıyla %8,43 (%95-GA 6,93-9,93)ve %4,70 (%95-GA 2,98-6,42)'dir. ABD çalışmasında, yanıt verenlerin oranı dadeğerlendirilmiştir. Tedavi sırasında lomber omurga bölgesinde KMY'yikoruyan veya kazanan kadınların yüzdesi %90'dır. - CLIMARA FORTE'nin femur boynu KMY'si üzerinde de etkisi olmuştur.Femur boynunda iki yıl sonra artış, Avrupa ve ABD çalışmasında sırasıyla%5,63 (%95-GA 3,87-7,38) ve %1,53 (%95-GA 0,66-3,72)'dir. ABDçalışmasında, yanıt verenlerin oranı da değerlendirilmiştir. Tedavi sırasındafemur boynunda KMY'yi koruyan veya kazanan kadınların yüzdesi %68'dir. 5.2. Farmakokinetik özelliklerGenel özelliklerEmilim:CLIMARA FORTE dermal uygulaması sonrası, estradiol sürekli salıverilir ve sağlam deriden geçerek 7 günlük tedavi periyodu boyunca Şekil 1'deki gibi kanda sürekli bir estradiol düzeyisağlar. Transdermal uygulama sonrası estradiolün sistemik yararlanımı oral uygulamaya göreyaklaşık 20 kat fazladır. Bu fark transdermal yol ile uygulanan estradiolün ilk geçiş etkisinemaruz kalmamasına bağlıdır. Estradiole ilişkin major farmakokinetik parametreler aşağıdakitabloda özetlenmiştir.
Şekil 1 : CLIMARA ve CLIMARA FORTE uygulamaları ardından ortalama başlangıç düzeltilmemiş 17-P estradiol konsantrasyonuna karşı zaman profili
Uygulama sonrası süre(saat)Dağılım:Ekzojen östrojenlerin dağılımı, endojen östrojenlerin dağılımına benzerdir. Estradiolün tek intravenöz uygulamadan sonra görünen dağılım hacmi 1 L/kg'dır. Östrojenler kanda büyükölçüde serum proteinlerine bağlı olarak dolaşır. Estradiolün yaklaşık % 61'i serum albuminineve % 37'si seks hormonu bağlayıcı globuline (SHBG) bağlıdır.Biyotransformasyon:Transdermal uygulamadan sonra, estradiolün biyotransformasyonu, yaklaşık 1'lik bir estradiol/estron serum seviyesi oranı ile gösterilen üreme döneminin erken foliküler fazısırasında görülen aralık içinde estron ve ilgili konjugatların konsantrasyonlarına yol açar.Oral estradiol hormon replasman tedavisi boyunca yoğun ilk geçiş metabolizasyonunun sonucuolarak estradiol / estron oranını 0,1'e kadar düşüren fizyolojik olmayan yüksek estron seviyeleritransdermal uygulama ile önlenmektedir.Transdermal olarak uygulanan estradiolün biyotransformasyonu endojen hormon ile aynıdır: Estradiol temel olarak karaciğerde, ayrıca da ekstrahepatik olarak bağırsak, böbrek, iskeletkasları ve hedef organlarda metabolize edilir. Bu işlemler, tamamı belirgin şekilde daha azöstrojenik ve hatta non-östrojenik olan estron, estriol, katekolestrojenler ve bu maddelerin sülfatve glukuronid konjugatlarının oluşmalarını kapsar.Eliminasyon:Tek intravenöz uygulamanın ardından estradiolün total serum klerensi 10-30 mL/dk/kg aralığında büyük değişkenlik gösterir. Estradiol metabolitlerinin belirli kısmı safra yoluyla atılırve enterohepatik dolaşıma girer.Estradiolün metabolitleri başlıca sülfat ve glukuronidler şeklinde idrarla atılmaktadır.Doğrusallık / doğrusal olmayan durum:Çoklu 1 haftalık flaster uygulamasının ardından, ne estrodiol ne de estronun birikimi gözlenmemiştir. Dolayısıyla, estradiol ve estron'un kararlı durum serum seviyeleri tekuygulama sonrasında gözlenene uygundur.5.3. Klinik öncesi güvenlilik verileriEstradiolün toksisite profili iyi bilinmektedir. KÜB'ün diğer bölümlerine halihazırda dahil edilenlere ek olarak, reçeteyi yazan hekimlere yönelik hiçbir klinik öncesi veri yoktur.Primer dermal irritasyon çalışmalarında, CLIMARA FORTE flasterlerin uygulanmasıçıkarırken oluşan mekanik travma ile ilişkili hafif irritasyon ile sonuçlanmıştır. CLIMARAFORTE flasterlerin dermal duyarlılaştırma potansiyeli bulunmamaktadır. Bileşenler (yapışkan matris, destek ve salım dolgusu) üzerinde yapılan çalışmalar, CLIMARA FORTE flasterlerinin kullanımıyla ilgili herhangi bir risk göstermemiştir. 6.FARMASOTIK ÖZELLIKLER6.1. Yardımcı maddelerin listesiEtil oleat İzopropil miristatGliserol monolauratAkrilat kopolimer 6.2. GeçimsizliklerYoktur .6.3. Raf ömrü36 ay. 6.4. Saklamaya yönelik özel tedbirler30°C altında oda sıcaklığında saklayınız. Ambalajsız saklamayınız. Koruyucu tabaka çıkarıldıktan sonra hemen uygulayınız. 6.5. Ambalajın niteliği ve içeriğiKoruyucu kese içinde yüzey alanı 25 cm2 olan flaster. Flaster 2 yüzeyden oluşur: transparan polietilen film tabakası; akrilat yapışkan matriks içinde estradiol rezervuarı; koruyucu polyesterfilm, yapışkan yüzeye tutturulmuştur, kullanımdan önce çıkarılmalıdır. Koruyucu kese birdesikant içerir. 4 flaster içeren ambalaj. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerFlaster kullanıldıktan sonra, su ortamına ulaşırsa zararlı etkileri olabilen bir miktar estradiol içermektedir. Kullanılmış ya da kullanılmayan flasterler, yapışkan tarafları üst üste gelecekşekilde ikiye katlanarak Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj AtıklarınınKontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBayer Türk Kimya San. Ltd. Şti. Fatih Sultan Mehmet Mah. Balkan Cad. No: 53 34770 Ümraniye/İstanbulTel: (0216) 528 36 00Faks: (0216) 645 39 50 8. RUHSAT NUMARASI102/81 9. ILK RUHSAT TARIHI / RUHSAT YENILEME TARIHIİlk ruhsat tarihi: 26.09.1997 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENILENME TARİHİ.../.../.... |
İlaç BilgileriClimara Forte 7,8 Mg/25 Cm 2 Transdermal FlasterEtken Maddesi: Estradiol Hemihidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.