Motilium 1 Mg/ml Oral Süspansiyon Kısa Ürün BilgisiSindirim Sistemi ve Metabolizma » Gastrointestinal Fonksiyonel Hastalıklar » Motilite Stimülanları » Motilite Stimülanları » Domperidon KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADI MOTILIUM 1 mg/ml oral süspansiyon 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde : Bir ml oral solüsyon, etken madde olarak 1 mg domperidon içerir. Yardımcı maddeler : Sorbitol 350.00 Metil parahidroksibenzoat 1.80 mg Propil parahidroksibenzoat 0.20 mg Mikrokristalize selüloz ve sodyum karboksimetil selüloz 12.00 mg Sodyum sakarin 0.20 mg Sodyum hidroksit 0.01 mg Yardımcı maddelerin tam listesi için, bölüm 6.1'e bakınız. 3. FARMASÖTİK FORM Oral süspansiyon Beyaz homojen süspansiyon 4. KLİNİK ÖZELLİKLER 4.1 Terapötik endikasyonlar MOTILIUM aşağıdaki durumların tedavisinde endikedir: Epigastrik bölgede dolgunluk, erken doygunluk hissi, abdominal şişkinlik, üst abdominal bölgede ağrı, geğirme, gaz şişkinliği, flatulans, bulantı-kusma, mide yanması (mide içeriğinin ağza geri gelmesi ile birlikte ya da tek başına) gibi mide boşalmasında gecikme, gastroözofajiyal reflü ve özofajit bulgularıyla birlikte bulunan dispeptik semptom kompleksi. Fonksiyonel, organik, enfeksiyöz, diyetten ya da radyoterapi ve ilaç tedavilerinden ileri gelen bulantı ve kusmalar. Parkinson hastalığında da kullanılan dopamin agonistlerinden (L-dopa ve bromokriptin gibi) ileri gelen bulantı ve kusmalar. 4.2 Pozoloji ve uygulama şekli Pozoloji/ Uygulama sıklığı ve süresi: Erişkinler ve adolesanlar (12 yaşından büyük, 35 kg veya üzeri) Günlük maksimum doz 80 ml olacak şekilde, günde üç veya dört kez 10-20 ml (ml'sinde 1mg domperidon içeren oral süspansiyon). Tedavinin ilk süreci 4 hafta kadardır. Eğer 4 haftadan fazla tedavi gerekirse, hastalar yeniden değerlendirilmeli ve tedaviye devam için yeniden gözden geçirilmelidir. Tıbbi konsültasyon olmaksızın tedavi, 14 günlük devam tedavisini aşmamalıdır (bkz.Bölüm 4.4).Uygulama şekli Oral MOTILIUM'un yemeklerden önce alınması önerilmektedir. Yemeklerden sonra alındığında, ilacın emilimi bir miktar gecikmektedir. Ölçekli pipetin kullanımı için Bölüm 6.6'ya bakınız. Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği: MOTILIUM orta ve ciddi karaciğer yetmezliği olan hastalarda kontrendikedir (bkz.Bölüm4.3). Ancak, hafif karaciğer yetmezliği olan hastalarda doz ayarlamasına gerek yoktur (bkz.(bkz.Bölüm 4.4 ve 5.2).Pediyatrik popülasyon: Günlük maksimum doz 2.4 mg/kg olacak şekilde (günde 80 mg'ı geçmeyecek şekilde), günde üç veya dört kez 0.25 - 0.5 mg/kg. Mümkün olduğunca etkili olan en düşük dozda kullanılmalıdır. Geriyatrik popülasyon: 65 yaş ve üzeri hastalarda doz ayarlaması gerekmez. Domperidon erişkinlerde ve çocuklarda en düşük etkili dozda kullanılmalıdır ( bkz.Bölüm4.4). Bazı epidemiyolojik çalışmalar domperidonun, ciddi ventriküler aritmi ya da ani kardiyak ölüm riskinde artışla ilişkilendirilebildiğini göstermiştir ( bkz.Bölüm 4.8). Bu risk, 60 yaş üzeri hastalarda ya da günde 30 mg'dan fazla doz alanlarda daha yüksek olabilir.4.3 Kontrendikasyonlar MOTILIUM aşağıdaki durumlarda kontrendikedir: Domperidon veya yardımcı maddelerden herhangi birisine karşı bilinen aşırı duyarlılık. Prolaktin salgılayan hipofiz tümörü (prolaktinoma). MOTILIUM, gastrointestinal kanama, mekanik obstrüksiyon veya perforasyon gibi gastrik motilite artışının tehlikeli olabileceği durumlarda ve orta ya da ciddi karaciğer yetmezliği durumlarında kullanılmamalıdır (bkz.Bölüm 5.2).4.4 Özel kullanım uyarıları ve önlemleri Laktasyon sırasında kullanım: Önerilen en yüksek doz rejiminde anne sütüne geçen domperidonun toplam miktarının günde 7 ^g'dan az olduğu sanılmaktadır. Bu miktarın yenidoğan için zararlı olup olmadığı bilinmemektedir. Bu nedenle MOTILIUM almakta olan annelerin çocuklarını emzirmesi önerilmemektedir. Bebeklerde kullanımı: Nörolojik yan etkiler nadirdir (bkz.Bölüm 4.8). Yaşamın ilk aylarında metabolik fonksiyonlar ve kan-beyin bariyeri henüz tam gelişmediği için küçük çocuklarda nörolojik yan etki riski daha yüksektir. Doz aşımı çocuklarda ekstrapramidal semptomlara neden olabilir, ancak diğer nedenler de göz önüne alınmalıdır.Böbrek yetmezliği olan hastalarda kullanımı: Domperidon eliminasyon yarı ömrü uzun olduğu için şiddetli böbrek yetmezliği durumlarında tekrarlayan uygulamalarda MOTILIUM doz sıklığı yetmezliğin şiddetine bağlı olarak günde bir ya da iki kez olacak şekilde düşürülmelidir. Uzun süreli tedavi alan hastalar düzenli olarak izlenmelidir (bkz.Bölüm 5.2).Güçlü CYP3A4 inhibitörleri ile birlikte kullanımı QTc aralığını uzatan oral ketokonazol, eritromisin veya diğer güçlü CYP3A4 inhibitörleri ile birlikte eş zamanlı kullanımından kaçınılmalıdır (bkz.Bölüm 4.5).Kardiyak etkiler Bazı epidemiyolojik çalışmalar, domperidonun ani kardiyak ölüm veya ciddi ventriküler aritmi riskinde artmayla ilişkili olduğunu göstermiştir (bkz.Bölüm 4.8). Bu risk günde 30 mg'dan daha fazla oral doz alan ve 60 yaşından büyük hastalarda daha yüksek olabilir. MOTILIUM yetişkin ve çocuklarda en düşük etkili dozda kullanılmalıdır.MOTILIUM'un QTc aralığını uzatan diğer ilaçlar ile birlikte kullanımı, kalbin QTc iletim aralıklarında uzamanın mevcut olduğu hastalarda ve konjestif kalp yetmezliği gibi kalp hastalıklarının altında yatan önemli elektrolit bozuklukları olan hastalarda dikkat gerektirir. Uyarılar MOTILIUM Oral süspansiyon sorbitol (E420) içerdiğinden nadir kalıtımsal früktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir. Oral süspansiyon, metil parahidroksibenzoat (E218) ve propil parahidroksibenzoat (E216) içermektedir. Parahidroksibenzoatlar alerjik reaksiyonlara (muhtemelen gecikmiş tipte) sebebiyet verebilir. Bu tıbbi ürün her 1 mg/ml dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri Antasit ve antisekretuvar ilaçlar MOTILIUM ile birlikte kullanıldığında, yemeklerden önce değil sonra alınmalıdırlar; bu ilaçlar MOTILIUM tablet ve süspansiyon ile aynı anda alınmamalıdır. MOTILIUM, kanser kemoterapisi ile ilişkili bulantıyı azaltmak için kullanılan bir ilaç, depresyon tedavisinde kullanılan nefazadon, ya da aprepitant, kalp problemleri için veya AIDS/HIV, enfeksiyon tedavisi için alınan ilaçlar ile birlikte dikkatli kullanılmalıdır. Domperidonun ana metabolik yolu CYP3A4'tür. In vitrove insan çalışmalarından elde edilen veriler bu enzimi önemli ölçüde inhibe eden ilaçların eşzamanlı kullanımının domperidon plazma düzeylerinin artmasına neden olabileceğini göstermiştir.Sağlıklı kişilerde oral ketokonazol veya oral eritromisinle ayrı ayrı yapılan in vivo farmakokinetik/farmakodinamik etkileşim çalışmaları bu ilaçların, domperidonun CYP3A4 aracılığı ile ilk geçiş metabolizmasında belirgin bir inhibisyon oluşturduğunu doğrulamıştır. Günde dört kez domperidon 10 mg ve günde iki kez ketokonazol 200 mg kombinasyonuyla, ve farklı zaman noktalarında 1.2-17.5 milisaniye arasında değişen gözlem dönemi süresince QTc'nin ortalama 9.8 milisaniye uzadığı görülmüştür. Günde dört kez domperidon 10 mg ve günde üç kez eritromisin 500 mg kombinasyonuyla ise, farklı zaman noktalarında 1.6-14.3 milisaniye arasında değişen gözlem dönemi süresince QTc'nin ortalama 9.9 milisaniye uzadığı görülmüştür. Domperidonun kararlı durum Cmax ve AUC değerleri bu etkileşim çalışmalarında yaklaşık üç kat artmıştır. Bu çalışmalarda günde dört kez domperidon 10 mg monoterapisi QTc'de ortalama 1.6 milisaniye (ketokonazol çalışması) ve 2.5 milisaniye'lik (eritromisin çalışması) bir artışla sonuçlanmıştır. Bu arada ketokonazol monoterapisi (günde iki kez 200 mg) ve eritromisin monoterapisi (günde üç kez 500 mg) ise gözlem döneminde QTc'de sırasıyla ortalama 3.8 ve 4.9 milisaniye artışla sonuçlanmıştır. QTc'yi uzatan diğer ilaçlarla beraber kullanılmamalıdır. 4.6 Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) MOTILIUM un çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Gebelik dönemi Gebe kadınlarda pazarlama sonrası domperidon kullanımına ilişkin sınırlı sayıda veri mevcuttur. Sıçanlar üzerinde yapılan bir çalışmada üreme toksisitesinin yüksek ve maternal toksisite dozunda varlığını göstermiştir. İnsanlar açısından potansiyel riski bilinmemektedir. Bu nedenle MOTILIUM gebelik sırasında ancak beklenen terapötik yararın doğrulanabileceği durumlarda kullanılmalıdır. Laktasyon dönemi Emziren sıçanlarda ilaç anne sütüne geçmektedir (çoğunluğu metabolitler şeklinde: 2.5 mg/kg oral yolla ve intravenöz uygulandığında elde edilen en yüksek konsantrasyonlar sırasıyla, 40 ng/ml ve 800 ng/ml). Emziren kadınlarda domperidonun anne sütündeki konsantrasyonu plazma konsantrasyonlarının %10 - 50'sine karşılık gelmekte ve 10 ng/ml'yi geçmesi beklenmemektedir. Önerilen en yüksek doz rejiminde anne sütüne geçen domperidonun toplam miktarının günde 7 pg'dan az olması beklenmektedir. Bu konsantrasyonun yeni doğana zararlı olup olmadığı bilinmemektedir. Bu yüzden, MOTILIUM kullanan annelerin emzirmeleri önerilmemektedir. Üreme yeteneği/Fertilite Sıçanlarla yapılan bir çalışma, anne tarafından alınan yüksek toksik dozda, reprodüktif toksisite olduğunu göstermiştir. 4.7 Araç ve makine kullanımı üzerindeki etkiler MOTILIUM' un araç ve makine kullanma yeteneği üzerine etkisi ya hiç yoktur ya da ihmal edilebilir düzeydedir. 4.8 İstenmeyen etkiler MOTILIUM'un güvenliliği, 31 adet çift-kör, plasebo kontrollü çalışmada dispepsi, gastroözofajiyal reflü hastalığı (GÖRH), İritabl Barsak Sendromu (İBS), bulantı ve kusma ya da diğer ilişkili durumları olan 1275 hastada değerlendirilmiştir. Bütün hastalar en az 15 yaşındaydı ve en az bir doz MOTILIUM aldılar. Ortalama toplam günlük doz 30 miligram (10-80 mg aralığında) ve ortalama maruz kalma süresi 28 gündü (1-28 gün aralığında). Diyabetik gastroparez, kemoterapiye bağlı ikincil semptomlar veya parkinsonizm çalışmaları dahil edilmemiştir. Advers ilaç reaksiyonu sıklıkları aşağıdaki kriterlere göre derecelendirilmektedir: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10); yaygın olmayan (> 1/ 1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden tahmin edilemiyor). Psikiyatrik hastalıklar Yaygın olmayan: Libido kaybı, anksiyete Sinir sistemi hastalıkları Yaygın olmayan: Somnolans, baş ağrısı Gastrointestinal hastalıklar Yaygın: Ağız kuruluğu Yaygın olmayan: Diyare Deri ve derialtı dokusu hastalıkları Yaygın olmayan: Döküntü, kaşıntı Üreme sistemi ve meme hastalıkları Yaygın olmayan: Meme ağrısı, galaktore, meme hassasiyeti Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Yaygın olmayan: Asteni Diyabetik gastroparez dahil ek endikasyonlar ve uzun süre için domperidon yüksek dozlarının kullanıldığı 45 çalışmada, advers olayların (ağız kuruluğu dışında) sıklığı oldukça yüksekti. Bu durum prolaktin artışıyla ilişkili farmakolojik olarak tahmin edilebilen olaylar için bilhassa aşikardı. Yukarıda listelenen reaksiyonlara ek olarak, akatizi, memelerden akıntı, memelerde büyüme, memelerde şişme, depresyon, hipersensitivite, laktasyon bozukluğu ve düzensiz menstruasyon da bildirildi. Pazarlama sonrası deneyimKlinik çalışmalar sırasında raporlanan ve yukarıda listelenen advers etkilere ek olarak, pazarlama sonrası deneyimler sırasında aşağıdaki advers ilaç reaksiyonları raporlanmıştır: Bağışıklık sistemi hastalıkları Bilinmiyor: Anaflaktik reaksiyon (anaflaktik şok dahil) Psikiyatrik hastalıklar Bilinmiyor: Ajitasyon, sinirlilik hali Sinir sistemi hastalıkları Bilinmiyor: Konvülsiyon, ekstrapramidal bozukluk Göz hastalıkları Bilinmiyor: Okülojirik kriz Kalp hastalıkları (bkz.Bölüm 4.4)Bilinmiyor: Ventriküler aritmi, ani kardiyak ölüm, QTc uzaması Deri ve derialtı dokusu hastalıkları Bilinmiyor: Ürtiker, anjioödem Böbrek ve üriner hastalıklar Bilinmiyor: İdrar retansiyonu Üreme sistemi ve meme hastalıkları Bilinmiyor: Jinekomasti, amenore Araştırmalar Bilinmiyor: Karaciğer fonksiyon testinde anormallik, kan prolaktin seviyesinde artış Ekstrapiramidal bozukluk başlıca yenidoğanlar ve bebeklerde meydana gelir. Diğer merkezi sinir sistemi ilişkili konvülsiyon ve ajitasyon etkileri de başlıca yeni doğmuş bebeklerde ve çocuklarda rapor edilmiştir. 4.9 Doz aşımı ve tedavisi Belirtiler Doz aşımı başlıca yeni doğmuş bebeklerde ve çocuklarda bildirilmiştir. Doz aşımı semptomları olarak ajitasyon, değişen bilinç, konvülsiyon, dezoryantasyon, somnolans ve ekstrapiramidal reaksiyonlar görülebilir. Tedavi Domperidonun spesifik antidotu yoktur, ancak doz aşımı durumunda gastrik lavaj uygulaması kadar aktif kömür uygulaması da yararlı olabilir. Hastanın yakın tıbbi gözetim altında tutulması ve destekleyici tedavi önerilmektedir. Antikolinerjikler veya anti-parkinson ilaçlar ekstrapiramidal reaksiyonların kontrol edilmesinde yardımcı olabilir. 5. FARMAKOLOJİK ÖZELLİKLER 5.1 Farmakodinamik özellikler Farmakoterapötik grup : Propulsifler ATC kodu : A03FA03 Domperidon, anti-emetik özelliklere sahip bir dopamin antagonistidir. Domperidon, kan beyin engelini kolaylıkla geçemez. Domperidon kullananlarda, özellikle erişkinlerde, ekstrapiramidal yan etkiler çok nadir görülür, fakat domperidon hipofiz bezinden prolaktin salımını artırır. Anti-emetik etkisi, periferdeki (gastrokinetik) etkilerine ve kan-beyin engelinin dışında, area postremada yer alan kemoreseptör triger zondaki dopamin reseptörlerini antagonize etmesine bağlıdır. Hayvan çalışmaları, beyin dokusunda elde edilen düşük konsantrasyonlar ile birlikte, domperidonun özellikle dopamin reseptörleri üzerinde periferik etkili olduğunu göstermektedir. İnsanlarda yapılan çalışmalar oral domperidonun alt özofagus basıncını yükselterek antroduodenal motiliteyi iyileştirdiğini ve gastrik boşaltımı hızlandırdığını göstermiştir. Mide sekresyonlarına etkisi yoktur. 5.2 Farmakokinetik özellikler Genel özellikler Emilim:Domperidon, aç karına oral yolla alındığında, hızla emilerek, 30 ile 60 dakika arasında plazmada en yüksek konsantrasyonlara ulaşır. Oral yolla alınan domperidonun mutlak biyoyararlanımının düşük olması (yaklaşık %15), barsak duvarı ve karaciğerdeki yoğun ilk geçiş metabolizmasına bağlıdır. Normal bireylerde yemeklerden sonra alındığında domperidonun biyoyararlanımı artmakla birlikte, gastro-intestinal yakınmaları olanlar, domperidonu yemeklerden 15-30 dakika önce almalıdır. Mide asidinin azalması domperidonun emilimini bozar. Önceden alınan simetidin ya da sodyum bikarbonat oral biyoyararlanımı azaltır. Yemeklerden sonra oral yolla alındığında, doruk plazma seviyesine ulaşma süresi hafifçe uzar ve eğri altında kalan alan (AUC) hafifçe artar. Dağılım:Oral yolla alınan domperidon birikmez ve kendi metabolizmasını arttırmaz; ilk uygulamadan sonra elde edilen en yüksek plazma düzeyi olan 18 ng/ml ile, iki hafta süre ile günde 30 mg uygulama sonrası, 90 dakika sonra elde edilen en yüksek plazma düzeyi, 21 ng/ml, yaklaşık olarak aynıdır. Domperidon %91 -93 oranında plazma proteinlerine bağlanır. Radyoaktif işaretli ilaç ile hayvanlarla yapılan çalışmalarda, dokulara büyük oranda dağıldığı, ancak beyin dokusunda düşük konsantrasyonlarda bulunduğu gösterilmiştir. Sıçanlarda, plasentaya az miktarda geçer. Biyotransformasyon:Domperidon karaciğerde hidroksilasyon ve N-dealkilasyon ile hızla ve büyük oranda metabolize olur. Diyagnostik inhibitörlerle yapılan in vitro metabolizma testleri CYP3A4'ün domperidonun N-dealkilasyonunda yer alan en önemli P-450 sitokrom formu olduğunu, ayrıca CYP3A4, CYP1A2 ve CYP2E1'in de domperidonun aromatik hidroksilasyonunda yer aldığını göstermiştir. Eliminasyon:Oral yolla alındığında idrar ile %31, feçes ile %66 oranında atılır. Değişmeden atılan ilaç oranı küçüktür (feçes ile atılanın %10'u, idrar ile atılanın yaklaşık %1'i). Sağlıklı bireylerde oral yolla tek doz alındığında, plazma yarılanma ömrü 7-9 saattir, ancak ciddi böbrek yetmezliği olan hastalarda bu süre uzar. Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliği: Ciddi böbrek yetmezliği olan hastalarda (serum kreatinin>6 mg/100 ml veya >0.6 mmol/L) domperidon yarıömrü 7.4 saatten 20.8 saate yükselir, fakat plazma ilaç seviyeleri normal böbrek fonksiyonları olan hastalardan daha düşüktür. Çok küçük miktarda (yaklaşık olarak %1) değişmemiş ilaç böbrekle atılır (bkz.Bölüm 4.4).Karaciğer yetmezliği: Orta derecede karaciğer yetmezliği olan hastalarda (Pugh skor 7-9, Child-Pugh Sınıf B), domperidonun EAA ve Cmaks'ı sağlıklı hastalardan sırasıyla 2.9 ve 1.5 kat daha yüksektir. Serbest fraksiyonu %25 arttırılır ve terminal eliminasyon yarıömrü 15 saatten 23 saate uzar. Hafif karaciğer yetmezliği olan hastalar, protein bağlanmasında ya da terminal yarıömürde bir değişiklik olmadan Cmaks ve EAA'ya dayanarak sağlıklı hastalardan bir miktar daha düşük sistemik maruziyete sahiptirler. Ciddi karaciğer yetmezliği olan hastalarda çalışılmamıştır ( bkz.Bölüm 4.3).Pediatrik hastalar Pediatrik popülasyonda farmakokinetik veri mevcut değildir. 5.3 Klinik öncesi güvenlilik verileri In vitroin vivoelektrofizyolojik çalışmalar domperidonun insanlarda genel olarak orta düzeyde bir riskte QT aralığını uzattığını göstermiştir.HERG ile transfekte izole hücreler ve izole kobay miyositleri üzerindeki in vitro deneylerde, maksimum günlük 20 mg (günde 2 kez) doz verilmesinden sonra insanlardaki serbest plazma konsantrasyonu ile karşılaştırıldığında, iyon kanalları aracılığıyla mevcut inhibisyon IC50 değerlerine dayanarak, maruz kalma oranları 5 ile 30 kat arasında idi. İzole kardiyak dokulardaki in vitro deneylerde, aksiyon potansiyel süresinin uzaması için maruz kalma işaretleri insanlardaki maksimum günlük dozda (20 mg, günde 2 kez) serbest plazma konsantrasyonlarını aştı. Ancak, in vitro proaritmik modellerde (izole Langendorff perfüze kalp) ve in vivo modellerde (köpek, hint domuzu, torsades de pointese duyarlı tavşanlar) insanlardaki maksimum günlük dozda (20 mg, günde 2 kez) serbest plazma konsantrasyonlarını 17 kattan daha fazla aştı. Domperidonun, CYP3A4 ile metabolizmasının inhibisyonu varlığında, serbest plazma konsantrasyonları 10 kata kadar çıkabilir. Anne tarafından alınan yüksek toksik dozda (insanlar için önerilen dozun 40 katından fazla), sıçanlarda teratojenik etkiler görülmüştür. Farelerde ve tavşanlarda hiçbir teratojenite gözlenmemiştir. 6. FARMASÖTİK ÖZELLİKLER 6.1. Yardımcı maddelerin listesi Mikrokristalize selüloz Sodyum karboksimetil selüloz Sorbitol solüsyonu %70 (a/a) kristalleşmeyen solüsyon Metil parahidroksibenzoat Polisorbat 20 Propil parahidroksibenzoat Sodyum sakarin Sodyum hidroksit Saf su. 6.2 Geçimsizlikler Bilinen bir geçimsizliği yoktur. 6.3 Raf ömrü 24 ay 6.4 Saklamaya yönelik özel tedbirler 15-30°C arasında saklanmalıdır. 6.5 Ambalajın niteliği ve içeriği MOTILIUM süspansiyon şu malzeme kullanılarak ambalajlanmaktadır: 5 ml'lik pipetiyle beraber PP, çocuklardan koruma amaçlı vidalı kapaklı 200 ml'lik bal rengi amber cam şişelerde. Şişeler: 200 ml, bal rengi amber şişe, Ph.Eur. tür III Vidalı kapak: İçi ve dışı PP, çocuklardan koruma amaçlı. Pipet: 5 ml, şunlardan oluşur: Başlık: LDPE, saydam Piston kolu: Polistiren, beyaz Piston: LDPE, saydam 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Tüm kullanılmayan ürün veya atık maddeler 'Tıbbi Atıkların Kontrolü yönetmeliği' ve 'Ambalaj Atıklarının Kontrolü yönetmelikleri' ne uygun olarak imha edilmelidir. Çocuklar için kg ölçekli pipetin kullanışı: 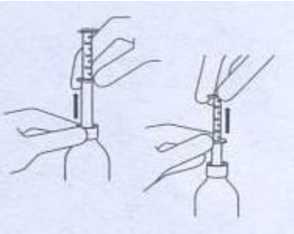 Kullanmadan önce şişeyi çalkalayınız.
Kullanmadan önce şişeyi çalkalayınız.Şişe, çocuk korumalı bir kapak ile gelir ve şu şekilde açılmalıdır: - Plastik kapağı aşağıya doğru bastırarak saatin aksi yönünde çeviriniz ve açınız. Pipeti kullanmak için yapılması gerekenler: - Pipeti, şişenin içine daldırınız. - Alt taraftaki halkayı sabit tutarak, üst pipet halkasını yukarı doğru çekmek suretiyle istenen dozaja (veya çocuk için ağırlığına) göre ayarlayınız. - Alt taraftaki halkayı tutarak, tüm pipeti şişeden çıkarınız. - Pipeti çocuğun ağzının içine boşaltarak sıvıyı uygulayınız. - Şişeyi kapayınız. - Pipeti su ile temizleyiniz. 7. RUHSAT SAHİBİ Johnson &Johnson Sıhhi Malzeme San. ve Tic. Ltd. Şti. Ertürk Sok. Keçeli Plaza No:13 34810 Kavacık - Beykoz / İSTANBUL Tel: 0216 538 20 00 Faks: 0216 538 23 69 8. RUHSAT NUMARASI 190 / 56 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ İlk ruhsatlandırma tarihi: 19.03.1999 Son yenileme tarihi: 13.10.2010 10. KÜB'ÜN YENİLENME TARİHİ 13 |
İlaç BilgileriMotilium 1 Mg/ml Oral SüspansiyonEtken Maddesi: Domperidon Atc Kodu: A03FA03 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.