İpraventol Steri-Neb 0.5MG/2.5MG-2.5ml Nebülizasyon İçin İnhalasyon Çözeltisi İçeren Tek Dozluk Ampul Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Adrenerjikler (İnhalan) » Adrenerjikli Kombinasyonlar » Salbutamol Kombinasyonları KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIİPRAVENTOL STERİ-NEB® 0.5 mg/2.5 mg - 2.5 mİ Nebülizasyon İçin İnhalasyonÇözeltisi İçeren Tek Dozluk Ampul 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeler:Her bir 2.5 mL'lik ampul;0.5 mg ipratropium bromür anhidr'e eşdeğer, 0.52 mg (8r)-3a-hidroksi-8-izopropil-laH-tropanyum bromür (±)>tropat monohidrat (= ipratropium bromür (INN)) ve, 2.5 mg salbutamol baza eşdeğer, 3.01 mg di[(RS)-2-ters-bütilamino-l-(4-hidroksi-3-hidroksimetil-fenil)etanol] sülfat (= salbutamol sülfat (INN)) içerir. Yardımcı maddeler:Yardımcı maddelerin tam bir listesi içİn, bölüm 6.Te bakınız.3. FARMASÖTİK FORMNebülizasyon için inhalasyon çözeltisi içerent tek dozluk ampul.Saydam, renksiz ya da hemen hemen renksiz solüsyon. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasy onlarİPRAVENTOL STERİ-NEB® birden fazla bronkodilatöre gerek duyulan hastalarda, obstrüktif havayolu hastalıklanna eşlik eden geri dönüşümlü bronkospazmm tedavisinde endikedir.4.2 Pozoloji ve uygulama şekli Fozoloji/uygulama sıklığı ve süresi:Erişkinler (yaşlı hastalar dahil) ve 12 yaşın üzerindeki adolesanlarda aşağıdaki dozlar önerilmektedir:Akut ataklann tedavisi:Semptomlarda hızla iyileşme sağlanması için olguların çoğunda 1 adet tek dozluk ampul yeterlidir. Şiddetli durumlarda eğer atak 1 adet tek dozluk ampul ile giderilemiyorsa, iki adet tek dozluk ampule ihtiyaç duyulabilir. Bu türlü durumlarda hastalar derhal doktorlarma ya da en yakm hastaneye başvurmalıdır. İdame tedavisi:Günde üç ya da dört kez l adet tek dozluk ampul. Uygulama şekli:İPRAVENTOL STERİ-NEB® uygun bir nebülizatörle veya intermitan pozitif basınçlı ventilatörle verilebilir.Kullanım talimatı için bölüm 6.6'dan sonraki bölüme bakınız. Özel popülasyonlara ilişkin ek bilgiler:BöbrekAcaraciğer yetmezliğiİPRAVENTOL STERİ-NEB® karaciğer ya da böbrek yetmezliği olan hastalarda incelenmemiştir. Bu hasta popülasyonlannda dikkatle kullamimalıdır.Pediyatrik popülasyon:On iki yaşın altındaki çocuklarda bilgilerin yetersiz olması nedeniyle, İPRAVENTOL STERİ-NEB® pediyatrik hastalarda endike değildir.Geriyatrik popülasyon:İPRAVENTOL STERİ-NEB® yaşlı kişilerde yukarıda verilen dozlarda kullamlabilir.4.3 KontrendikasyonlarİPRAVENTOL STERİ-NEB® aşağıdaki durumlarda kontrendikedir:- İlacın bileşenlerinden herhangi birine, atropine veya türevlerine karşı aşın duyarlılığı olanlar, - Hipertrofik obstrüktif kardiyomiyopati, taşiaritmi. 4.4 Özel kullanım uyarılan ve önlemleriSadece inhalasyon içindir.İPRAVENTOL STERİ-NEB® uygulamasından sonra ani aşın duyarlılık reaksiyonlan oluşabilir; bu şekilde nadiren ürtiker, anjiyoödem, döküntüler, bronkospazm ve orofarenjiyal ödem vakalan görülmüştür. Bu gibi durumlarda uygun anti-aleijik ajanlar kullanılmalı ve gerekirse genel destekleyici tedavi uygulanmalıdır. Aerosol şeklindeki ipratropium bromür tek başına veya bir adrenerjik beta2-agonist ile birlikte göze kaçtığında, oküler komplikasyonlar (midriyazis, göz içi basıncında artış, dar-açılı glokom, göz ağnsı) geliştiği bildirilen izole vakalar vardır. Konjonktivada konjesyon ve korneada ödem sonucu gelişen göz kızarmasıyla birlikte gözde ağn veya rahatsızlık hissi, bulamk görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabilir. Bu semptomlar herhangi bir kombinasyon şeklinde gelişirse, miyotik damlalar ile tedaviye başlanmalı ve hemen bir uzman hekimin görüşü alınmalıdır. Hastalara İPRAVENTOL STERİ>NEB®'in doğru bir şekilde nasıl kullanılacağı öğretilmelidir. İPRAVENTOL STERİ-NEB® içindeki çözelti veya bunun aerosolünün gözlerle temas etmemesi için dikkatli olunmalıdır. inhalasyon solüsyonımun bir ağızlık parçası aracılığıyla kullanılması Önerilir. Eğer ağızlık parçası yoksa ve nebülizatörün maskesi kullanılacaksa, bu maskenin hastamn yüzüne tam olarak oturması gereklidir. Glokoma karşı predispozisyon gösterebilecek hastalar, gözlerini korumalan konusunda özel olarak uyanlmalıdır. İPRAVENTOL STERİ-NEB® aşağıdaki durumlarda, özellikle önerilenden daha yüksek dozlann uygulanması söz konusu olduğunda, yalnızca dikkatli bir risk/yarar değerlendirilmesi yapıldıktan sonra kullanılmalıdır: Yeterince kontrol altında olmayan diabetes mellitus, - Yakınlarda geçirilmiş miyokard enfarktüsü, - Şiddetli organik kalp veya damar hastalıklan, - Hipertiroidizm, Feokromositoma, - Dar açılı glokom riski, - Prostat hipertrofısi. Mesane boynu obstrüksiyonu, - Myastenia gravis. Pazarlama sonrası verilerde ve yayınlanmış literatürde ender olgular şeklinde, salbutamol ile ilişkili miyokard iskemisi verileri bulunmaktadır. Solunum hastalığı için salbutamol almakta olan ve altta yatan şiddetli kalp hastalığı (örn. iskemik kalp hastalığı, taşiaritmi ya da şiddetli kalp yetmezliği) bulunan hastalar, göğüs ağnsı ya da kalp hastalığında ağırlaşmaya ilişkin başka semptomlar ortaya çıktığında doktora başvurmaları konusunda uyanlmalıdır. Dispne ve göğüs ağnsı gibi semptomlar değerlendirilirken dikkatli olunmalıdır, çünkü bunlar solunum ya da kalp kaynaklı olabilir. Beta2-agonist tedavisi, potansiyel olarak ağır bir hipokalemi ile sonuçlanabilir. Şiddetli havayolu obstrüksiyonunda özellikle dikkatli olunması önerilmektedir, çünkü bu etki ksantin türevleri, steroidler ve diüretikler ile eşzamanlı tedavi sonucunda potansiyalize olabilir. Aynca hipoksi, hipokaleminin kalp ritmi üzerindeki etkilerini şiddetlendirebilır (özellikle digoksin almakta olan hastalarda). Bu türlü durumlarda serum potasyum düzeylerinin izlenmesi önerilmektedir. Kistik fıbrozlu hastalar, gastrointestinal motilite bozukluklanna daha yatkın olabilirler. Akut, hızla kötüleşen dispne (solunum zorluğu) durumunda hemen bir doktora danışılması gereklidir. Bu nokta hastalara belirtilmelidir. Hastalar ayrıca, alman yanıtta azalma belirgin hale geldiğinde doktora başvurmalan gerektiği konusunda da uyanlmalıdır. Semptomlann kontrol altına alınabilmesi için önerilenden daha yüksek İPRAVENTOL STERİ-NEB® dozlanna ihtiyaç duyuluyorsa, hastanın tedavi planı bir doktor tarafından yeniden gözden geçirilmelidir. İPRAVENTOL STERİ-NEB®'in uterus kontraksiyonlan üzerindeki inhibitör etkisi dikkate alınmalıdır. Gebeliğin son trimesterinde olan hastalar, bu konu hakkında bilgilendirilmeli ve uyarılmalıdır. tPRAVENTOL STERİ-NEB® kullanımı, klinik dışı madde kötüye kullanımı için yapılan testlerde, örn. atletik performansın yükseltilmesi (doping) kapsamında, salbutamol için pozitif sonuçlara yol açabilir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekillenKsantin türevlerinin, diğer beta-adreneıjiklerin ve antikolineıjiklerin birlikte uygulanması yan etkileri artırabilir.Beta-agonistlerin indüklediği hipokalemi, ksantin türevleri, kortikosteroidler ve diüretikler ile yapılan eş-zamanh tedavi ile artabilir. Bu durum özellikle şiddetli havayolu obstrüksiyonu olan hastalarda dikkate alınmalıdır. Hipokalemi, digoksin almakta olan hastalarda aritmilere karşı duyarlılığı arttırabilir. Bu gibi durumlarda serum potasyum düzeylerinin izlenmesi tavsiye edilmektedir. Beta-blokörler ile birlikte eş-zamanh uygulama esnasında, bronkodilatör etkide potansiyel olarak ciddi bir azalma ortaya çıkabilir. Monoamin oksidaz inhibitörleri veya trisiklik antidepresanlar ile tedavi edilmekte olan hastalarda beta-adreneıjik agonistler dikkatle uygulanmalıdır, çünkü beta-adreneıjik agonistlerin aktiviteleri artabilir. Halotan, trikloroetilen ve enfluran gibi halojenli hidrokarbon anestetiklerinin inhalasyonu, beta- agonistlerin kardiyovasküler etkilerine karşı duyarlılığı artırabilir. Özel popülasyonlara ilişkin ek bilgiler:Özel veri bulunmamaktadır.Pediyatrik popülasyon:Özel veri bulunmamaktadır.4,6 Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi; C (ipratropium bromür.B ; salbutamol sülfat.C).Çocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon):Çocuk doğurma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduğu kabul edilen doğum kontrol yöntemleri kullanmalıdır.Gebelik dönemi:İPRAVENTOL STERİ-NEB® insanlarda gebelik sırasındaki güvenliği belirlenmemiştir. Gebelik sırasında ve özellikle ilk üç ay içerisinde, gebelikte ilaç kullanımıyla ilgili olağan önlemlere uyulmalıdır. İPRAVENTOL STERİ-NEB® gebelikte sadece fetus ve anne üzerinde dikkatli bir risk/yarar değerlendirmesi yapılarak kullamimahdır. Aynca gebeliğin üçüncü trimesterinde özel bir dikkat gereklidir. İPRAVENTOL STERİ-NEB®'in utenıs kontraksiyonlan üzerindeki inhibitör etkisi dikkate alınmalıdır (bkz. Özel kullanım uyanlan ve önlemleri). Laktasyon dönemi:Salbutamol sülfat ve ipratropium bromür muhtemelen süte geçerler ve bunlann yeni doğan üzerindeki etkileri bilinmemektedir. Yağda erimeyen kuatemer bazlar anne sütüne geçmekle birlikte ipratropium bromürün, özellikle de inhalasyon yoluyla alındığında, bebekte önemli düzeylere ulaşabilme olasılığı uzaktır. Bebeğini emziren bir anneye İPRAVENTOL STERİ-NEB® verilirken dikkatli olunması gerekir. İPRAVENTOL STERİ-NEB® kullanmanın yararlan, yenidoğan üzerindeki olası tehlikelere karşı tartılmalı ve beklenen yarar yenidoğan üzerindeki herhangi olası bir riske üstün gelmediği sürece kullanılmamalıdır.Üreme yeteneği/Fertilite:İPRAVENTOL STERİ-NEB® ile insan fertilitesi üzerindeki etkisi konusunda çalışma yürütülmemiştir. İpratropium bromür ve salbutamol ile yapılan klinik öncesi çalışmalarda fertilite üzerinde advers etki görülmemiştir (bkz. Klinik öncesi güvenlilik verileri).4.7 Araç ve makine kullanımı üzerindeki etkilerAraba ve makine kullanma becerileri üzerindeki etkileri konusunda çalışma yapılmamıştır.Ancak hastalar, İPRAVENTOL STERİ-NEB® tedavisi sırasında baş dönmesi, akomodasyon bozukluğu, midriyazis ve bulanık görme gibi istenmeyen etkiler geçirebilecekleri konusunda uyarılmalıdır. Eğer hastalarda yukarıda sözü edilen yan etkiler ortaya çıkarsa, araba kullanma ya da makine işletme gibi tehlike potansiyeli taşıyan işlerden uzak durmalıdırlar. 4.8 İstenmeyen etkilerListelenen istenmeyen etkilerin birçoğu İPRAVENTOL STERİ-NEB®'in antikolineıjik ve beta 2- sempatomimetik özelliklerine bağlanabilir. İnhalasyon yoluyla uygulanan bütün ilaçlar gibi, İPRAVENTOL STERİ-NEB® lokal irritasyon semptomlarına yol açabilir. Advers ilaç reaksiyonlan, klinik araştırmalarda ve ilacın onay sonrası kullanım dönemindeki farmakovijilans çalışmalannda elde edilen verilerden tanımlanmıştır.Klinik araştırmalarda en sık bildirilen yan etkiler baş ağrısı, boğazda irritasyon, öksürük, ağız kuruluğu, gastrointestinal motilite bozukluklan (konstipasyon, diyare ve kusma dahil), bulantı ve baş dönmesi olmuştur. Aşağıda belirtilen istenmeyen etkilerin sıklık oranlan şu şekildedir: Çok yaygın >1/10 Yaygm >1/100 ilâ <1/10 Yaygın olmayan >1/1,000 ilâ <1/100 Seyrek >1/10,000 ilâ <1/1,000 Çok seyrek <1/10,000 Bilinmiyor Eldeki verilerden hareketle tahmin edilemiyor. Bağışıklık sistemi hastalıklarıSeyrek: Anaflaktik reaksiyon, aşın duyarlılık, dil, dudaklar ve yüzdeanjiyoödera Metabolizma ve beslenme hastalıklarıSeyrek: HipokalemiPsikiyatrik hastalıklarYaygın olmayan: SinirlilikSeyrek: Mental bozukluk Sinir sistemi hastalıklarıYaygın olmayan: Baş dönmesi, baş ağnsı, tremorGöz hastalıklarıSeyrek: Akomodasyon bozukluğu, kornea ödemi, glokom1, göz ağnsı^ göz içibasıncında artış', midriyazis*, bulanık görme, konjonktivada hiperemi, haleler görme Kardiyak hastalıklarYaygın olmayan; Palpitasyonlar, taşikardiSeyrek: Aritmi, atriyal fibrilasyon, miyokard iskemisi, supraventriküler taşikardi Solunum, göğüs bozuklukları ve mediyastinal hastalıklarYaygın olmayan: Öksürük, disfoni, boğazda irritasyonSeyrek: Bronkospazm, paradoksal bronkospazm^, boğaz kuruluğu, laringospazm, farenjiyal ödem Gastrointestinal hastalıklarYaygın olmayan: Ağız kuruluğu, bulantıSeyrek: Gastrointestinal motilite bozukluğu (örn. diyare, konstipasyon, kusma), ağızda ödem, stomatit Deri ve derialtı dokusu hastahklanYaygın olmayan: Deri reaksiyonlanSeyrek: Hiperhidroz, döküntü, ürtiker, pruritus Kas'iskelet ve bağ dokusu hastalıklarıSeyrek: Kas spazmlan, kaslarda zayıflık, miyaljiBöbrek ve idrar hastalıklarıSeyrek: İdrar retansiyonu^Genel bozukluklar ve uygulama yerine ilişkin hastalıklarSeyrek: AsteniAraştırmalarYaygın olmayan: Sistolik kan basıncında yükselmeSeyrek: Diyastolik kan basıncında düşme ^ İnhalasyon yoluyla kullanılan diğer ilaçlarda olduğu gibi, doz uygulamasından sonra hınitılı solumada ani artış ve soluk darlığıyla kendisini gösteren paradoksal bronkospazm oluşabilir. Paradoksal bronkospazm çabuk etkili bir inhale bronkodilatöre yanıt verir ve derhal tedavi edilmelidir, İPRAVENTOL STERİ-NEB®'e hemen son verilmeli, hasta değerlendirilmeli ve gerekiyorsa alternatif bir tedavi uygulanmalıdır. İdrar retansiyonu riski, öncesinden üriner çıkış obstrüksiyonu bulunan hastalarda artabilir. 4.9 Doz aşımı ve tedavisiSemptomlarDoz aşımının oluşturduğu etkilerin öncelikle salbutamol ile bağıntılı olması beklenmektedir. Doz aşımında beklenen semptomlar, aşın beta-adreneıjik uyarının yol açtığı semptomlardır; en belirgin olanlan taşikardi, palpitasyon, tremor, hipertansiyon, hipokalemi, nabız basmcınm genişlemesi, anjinal ağn ve yüz-boyun bölgesinde kızarıklıktır. ipratropyum bromür doz aşımının beklenen semptomları (ağız kuruluğu, görsel akomodasyon bozukluklan gibi), sahip olduğu geniş terapötik aralık ve topikal uygulama nedeniyle hafif ve geçici niteliktedir. TedaviSedatifler ve trankilizanlar verilir; ağır vakalarda yoğun bakım uygulamr. Serum potasyum düzeyleri izlenmelidir. Beta-reseptor blokörleri, tercihen betaı-selektif olanlan, spesifik antidotlar olarak uygundurlar; ancak, bronşiyal obstrüksiyonda muhtemel bir artış dikkate alınmalıdır ve doz, bronşiyal astımı olan hastalarda dikkatle uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup; Adreneıjikler ve diğer obstrüktif havayolu hastalıklan ilaçlanATC kodu: R03AK04 İpratropium bromür, antikolineıjik (parasempatolitik) özellikleri olan bir kuatemer amonyum bileşiğidir. Klinik öncesi çalışmalarda, vagus sinirinden salıverilen nörotransmitter olan asetilkolinin etkilerini antagonize ederek, bu sinir aracılığıyla gerçekleşen refleksleri inhibe etmiştir. Antikolineıjikler, asetilkolinin bronş düz kaslanndaki M3 muskarinik reseptörlerle etkileşimi sonucu meydana gelen hücre içi siklik guanozin monofosfat (s-GMP) artışlannı önlerler. İpratropium bromür inhalasyonunu izleyen bronkodilatasyon, esas olarak lokal ve akciğere özgüdür ve sistemik bir etki değildir. Salbutamol sülfat, hava yollanndaki düz kaslara etki ederek, gevşemelerine yol açan bir beta2-adreneıjik ajandır. Salbutamol, trakeadan terminal bronşiyollere kadar olan bütün düz kaslan gevşetir ve bronkokonstriksiyona yol açan tüm etkilere karşı korunma sağlar. İpratropium bromür/salbutamol sülfat inhalasyon çözeltisi, ipratropium bromür ile salbutamol sülfatın eşzamanlı olarak salıverilmesi sonucu akciğerdeki muskarinik ve beta2-adreneıjik reseptörlerin her ikisi üzerinden etki oluşturur ve sonuç olarak her bir ajan ile elde edilenden daha üstün bir bronkodilatasyon elde edilmesini sağlar. Geri dönüşümlü bronkospazmı olan hastalar üzerinde yapılan kontrollü çalışmalarda İpratropium bromür/salbutamol sülfat inhalasyon çözeltisinin, her iki bileşeninden daha büyük bir bronkodilatör etkiye sahip olduğu ve istenmeyen etkilerde herhangi bir artışın bulunmadığı ortaya konulmuştur. 5.2 Farmakokinetik özellikler İpratropiuın bromürEmilim:İpratropium bromür, oral inhalasyondan sonra çok çabuk absorbe olur. İnhalasyondan sonraki sistemik biyoyararlamm, alınan dozun %10'ımdan düşüktür. DaSılım ve Bivotransformasvon:İpratropium bromür, kan-beyin bariyerini geçmez. Terminal eliminasyon fazındaki yanlanma ömrü, intravenöz uygulamadan sonra belirlendiği üzere, 1,6 saat civanndadır, Eliminasyon:İpratropium bromür, intravenöz uygulamadan sonra alman dozun %46'sı oranında böbrekler yoluyla atılır. İlaç ve metabolitlerinin eliminasyon yanlanma ömrü, radyoaktif işaretleme ile belirlendiği şekliyle 3.6 saattir. Dogrusallık/Dogrusal olmayan durum:Özel veri bulunmamaktadır. Salbutamol sülfatEmilim:Salbutomal sülfat, oral uygulama sonrasında gerek inhalasyonla gerekse gastrointestinal kanal yoluyla hızla ve tamamen emilir. Dağılım ve Bivotransformasvon:Plazma doruk salbutamol konsantrasyonlan uygulamayı izleyen üç saat içerisinde elde edilir. Salbutamol kan-beyin bariyerini geçer ve burada plazma konsantrasyonunun %5'i civannda bir konsantrasyona ulaşır, Eliminasyon:İlaç 24 saat sonra, değişmemiş olarak idrarla vücuttan atılır. Eliminasyon yanlanma ömrü 4 saattir. Doğrusallık/DoSrusal olmayan durum:Özel veri bulunmamaktadır. İpratropium bromür ve salbutamol sülfatın birlikte nebülize edilmelerinin, her iki bileşen için de sistemik emilimi potansiyalize etmediği ve bu nedenle İpratropium bromür/salbutamol sülfat inhalasyon çözeltisinin aditif aktivitesinin, inhalasyon sonrasında akciğer üzerindeki kombine lokal etkiye bağlı olduğu gösterilmiştir. 5.3 Klinik öncesi güvenlilik verileriipratropium bromür/salbutamol sülfat inhalasyon çözeltisinin tek inhalasyon şeklinde uygulama sonrasındaki akut toksisitesi, sıçanlarda ve köpeklerde incelenmiştir. Teknik olarak incelenmesi mümkün en yüksek dozlara kadar (sıçan: 887/5397 mikrogram/kg vücut ağırlığı [ipratropium bromür/salbutamol], köpek: 165/862 mikrogram/kg vücut ağırlığı [ipratropium bromür/salbutamol]) sistemik toksik etki belirtisi bulunmamaktaydı ve bileşik lokal olarak iyi tolere edildi. Tekil maddeler için intravenöz uygulama sonrasında yaklaşık LD50 değerlerinin, ipratropium bromürün test edildiği türlere bağlı olarak (fare, sıçan, köpek), ipratropium bromür için 12 ile 20 mg/kg ve salbutamol için 60 ile 70 mg/kg vücut ağırlığı arasında olduğu hesaplanmıştır.İpratropium bromür ve salbutamol kombinasyonu ile sırasıyla sıçanlar ve köpeklerde, 13 haftalık iki inhalasyon toksisitesi çalışması yürütülmüştür. Bu çalışmalarda, kalbin hedef organ olduğu ortaya çıkmıştır. 31.3/183.4 ile 375.5/2188.4 mikrogram/kg vücut ağırlığı/gün ipratropium bromür/salbutamol dozlannda, sıçanlann kalp ağırlıklarında doza bağlı olmayan bir artış gözlendi, ancak bu saptanabilir herhangi bir histopatolojık değişiklik ile birlikte değildi. Köpeklerde 32.3/197.6 ile 129.2/790.4 mikrogram/kg vücut ağırlığı/gün ipratropium bromür/salbutamol dozlan, kalp hızlannı hafifçe artırdı ve daha yüksek dozlarda, sol ventrikül papiller kaslarında, bazen mineralizasyonun eşlik ettiği, histopatolojik olarak saptanabilir sikatrisler ve/veya fibrozis gözlendi. Yukarıda sözü edilen çalışmalarda elde edilen bulgular, salbutamol gibi beta-adreneıjiklerin iyi bilinen etkileri olarak görülmelidir. Aynı zamanda ikinci bileşenin (ipratropium bromür) toksikolojik profili de yıllardır iyi bilinmektedir ve kafada bulunan mukoza! membranlarda kuruluk, midriyazis, yalnızca köpeklerde keratokonjonktivitis sikka (kuru göz), tonüs azalması ve gastrointestinal kanalda motilitenin inhibisyonu (sıçan) gibi tipik antikolineıjik etkilerdir. İpratropium bromür/salbutamol sülfat inhalasyon çözeltisinin iki tekil bileşeni İçin de üreme toksisitesi çalışmalan mevcuttur. Salbutamol farelerde yüksek dozlarda yank damaklara neden olmuştu. Bu olay iyi bilinmektedir ve diğer beta-adreneıjik bileşiklerin uygulanmasından sonra da ortaya çıkmaktadır. Günümüzde bu etkinin annedeki kortikosteron düzeyindeki bir artış sebebiyle ortaya çıktığı varsayılmaktadır ve başka türler için önem taşımayan bir genel stresin sonucu olduğu kabul edilebilir. Ek olarak, salbutamolün teratojenik özelliklere sahip olabileceği yönündeki kuşkulann oluşmasına yol açan preklinik bulgular, kadınlardaki kullanımını ilgilendiren kısıtlamalarda dikkate alınmış bulunmaktadır. Bu bulgulann dışmda, salbutamol ve ipratropium bromür ile yapılan çalışmalar, embriyo, fetüs ve yavrularda varsa bile, yalnızca maıjinal etkiler ortaya çıkarmıştır ve bu etkiler yalnızca matemal toksisite aralığı içinde oluşmuştur. Her iki tekil madde de çok sayıda in-vivo ve in-vitro testlerde incelenmiştir. Ne salbutamol ne de ipratropium bromür, herhangi bir mutajenik Özellik belirtisi göstermemiştir. Salbutamol ve ipratropium bromür ayn ayn, çeşitli in vivo karsinojenisite çalışmalannda neoplastik özellikleri yönleriyle incelenmişlerdir. Farelerde, ama sıçanlarda ve köpeklerde değil, oral salbutamol uygulamasından sonra, insanlarda kullamlan inhalasyon dozlannm 100 katından daha yüksek dozlarda, mezovaryum leiomyoması insidansmda artış gözlenmiştir. Leiomyoma gelişiminin eş-zamanlı beta-blokör uygulamasıyla engellenebilir özellikte olduğu bulunmuştur. Bu bulgulann türe özgü olduğu ve klinik önem taşımadıklan ve sonuç olarak salbutamolün klinik kullanımında herhangi bir kısıtlamaya yol açmayacaklan şeklinde değerlendirme yapılmıştır. İpratropyum bromür farelerde ve sıçanlarda oral yoldan verildiğinde, karsinojenik potansiyel ortaya çıkmamıştır. İpratropium bromür/salbutamol sülfat inhalasyon çözeltisinin ya da tekil aktif bileşenlerinin sebep olduğu herhangi bir immünotoksikolojik etkiye ilişkin herhangi bir veri bulunmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSodyum klorür Seyreltik Hidroklorik asit Enjeksiyonluk su6.2 GeçimsizliklerİPRAVENTOL STERİ-NEB®'in bilinen bir geçimsizliği yoktur.6.3 Raf ÖmrüİPRAVENTOL STERİ-NEB®'in raf ömrü 24 aydır.6.4 Saklamaya yönelik özel tedbirler25°C'nin altında, oda sıcaklığında saklanmalıdır. Direkt güneş ışığından korunmalıdır. Solüsyonun renginde değişiklik varsa kullanılmamalıdır.6.5 Ambalajm niteliği ve içeriğiİPRAVENTOL STERİ-NEB®, 20 adet 2.5 mL'lik STERİ-NEB olarak adlandınlan düşük dansiteli polietilen tek dozluk ampul içerir.6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürün ya da atık materyaller, Tıbbi Atıklann Kontrolü ve Ambalaj ve Ambalaj Atıklannın Kontrolü yönetmeliklerine uygun olarak imha edilmelidir.Kullanım TalimatıTek dozluk ampuller yalmzca, uygun nebülizatör cihazlan ile inhalasyon şeklinde kullanılmak içindir ve oral yoldan alınmamalı ya da parenteral yoldan uygulanmamalıdır. Nebülizatörü» imalatçısının ya da hekimin talimatlan doğrultusunda kullanıma hazırlayınız. Etiketli kılıfından bir ampulü çevirip çekerek çıkannız. Daha önce açılmış ya da çözeltisi renk değiştirmiş ampulü kullanmayınız (şekil A). Ampulü dik tutun ve kapağım çevirerek çıkann (şekil B). Nebülizatörün haznesine içeriği boşaltın (şekil C), Nebülizatörü nasıl birleştireceğiniz ve nasıl kullanacağınız konusunda üretici talimatlarına ve doktorunuzun tavsiyelerine uyunuz. Nebülizatörü kullandıktan sonra haznede kalan çözeltiyi atın. Ampulde kalan çözeltiyi de atmalısınız. Uygulama sonrasında nebülizatörü imalatçısının talimatlan doğrultusunda temizleyiniz. Nebülizatörün temiz tutulması önemlidir.  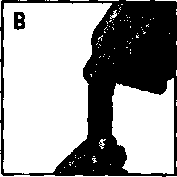 Tek dozluk ampuller koruyucu madde içermediğinden, mikroplarla bulaşmayı önlemek amacıyla, ampulün açıldıktan hemen sonra kullanılması ve her uygulamada yeni bir ampulün açılması önem taşımaktadır. Kısmen kullamimış, açılmış veya hasar görmüş tek dozluk ampuller atılmalıdır.
Tek dozluk ampuller koruyucu madde içermediğinden, mikroplarla bulaşmayı önlemek amacıyla, ampulün açıldıktan hemen sonra kullanılması ve her uygulamada yeni bir ampulün açılması önem taşımaktadır. Kısmen kullamimış, açılmış veya hasar görmüş tek dozluk ampuller atılmalıdır.İPRAVENTOL STERİ-NEB®'in, aynı özellikle özen göstermelisiniz.
nebülizatör içinde diğer ilaçlarla kanştırmamaya 7. RUHSAT SAHİBİMED-İLAÇ San. ve Tic. A.Ş. Veko Giz Plaza Maslak Mah. Meydan Sk. No:3 Kat:5-6 34396 Maslak-Şişli/istanbuI8. RUHSAT NUMARASI135/179. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİilk ruhsat tarihi: 24.12.2012 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ1Oküler komplikasyonlar aerosol şeklindeki ipratropium bromür tek başına veya bir adreneıjik beta2-agonist ile birlikte göze kaçtığında bildirilmiştir (bkz. bölüm 4.4). |
İlaç Bilgileriİpraventol Steri-Neb 0.5MG/2.5MG-2.5ml Nebülizasyon İçin İnhalasyon Çözeltisi İçeren Tek Dozluk AmpulEtken Maddesi: İpratropiyum bromür, Salbutamol sülfat Atc Kodu: R03AK04 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.