Sporanox Iv 10 Mg/ml Konsantre İnfüzyon Çözeltisi Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Antimikotik İlaçlar » Sistemik Antimikotikler » Triazol Türevleri » İtrakanazol KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADISPORANOX IV 10 mg/ml konsantre infüzyon çözeltisi2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:- Konsantre çözeltinin her ml'si 10 mg itrakonazol içerir. 25 ml'lik bir ampul 250 mg itrakonazol (itrakonazol trihidroklorür) içerir.İnfüzyon için çözücü ile karıştırıldıktan sonra karışımın her ml'si 3.33 mg itrakonazol içerir. 200 mg'lık tek dozluk itrakonazol 60 ml karışıma karşılık gelir. Yardımcı madde: - Hidroksipropil-P-siklodekstrin
400 mg 25 mcgl - Propilen glikol Yardımcı maddeler için 6.1'e bakınız 3. FARMASÖTİK FORMSPORANOX IV 10 mg/ml konsantre infüzyon çözeltisi ve infüzyon için çözücü (enjektabl %0.9 Sodyum Klorür) aşağıdakilerden oluşan işlem paketi şeklinde sunulmuştur:1. SPORANOX IV 10 mg/ml konsantre infüzyon çözeltisi: 25 ml'lik renksiz Tip-I ampullerde renksiz çözelti. 2. Enjektabl %0.9 Sodyum Klorür infüzyon için çözücü: 50 ml'lik (75 ml kapasiteli) polipropilen torbalarda. 3. İnfüzyon seti: 2 yollu musluklu ve hat içi filtreli 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarSPORANOX IV, sistemik mikozların tedavisi için endikedir: aspergillozis, kandidiyozis, kriptokokozis (kriptokoksik menenjit dahil) ve histoplazmoz.SPORANOX IV aynı zamanda sistemik mikozdan şüphelenilen febril nötropenik hastaların ampirik tedavisinde de endikedir. 4.2 Pozoloji ve uygulama şekliBu ürün, 2 yönlü vana ve 0,2 mikrometre hat içi filtreli uzatma hattı ile tedarik edilir. Hat içi filtre içeren özel uzatma hattı ürünün doğru uygulanmasını sağlamak için kullanılmalıdır (bkz. Bölüm 6.6).SPORANOX IV tedavinin ilk iki gününde yükleme dozu olarak günde iki defa verildikten sonra günde tek dozla tedaviye devam edilir. Tedavinin ilk 2 günü: Günde iki defa 1 saatlik infüzyonla 200 mg (60 ml karışım) SPORANOX IV (bkz. Bölüm 6.6). Tedavinin 3. gününden itibaren: Günde bir defa 1 saatlik infüzyonla 200 mg (60 ml karışım) SPORANOX IV. ondört günden uzun süreli kullanımdaki güvenliliği gösterilmemiştir. Sistemik mikozdan şüphelenilen febril nötropenik hastaların ampirik tedavisinde, nötropenide klinik olarak anlamlı düzelme elde edilene kadar tedaviye SPORANOX oral solüsyonla devam edilmelidir. Aspergilloz, kandidoz, kriptokokoz (kriptokoksik menenjit dahil) ve histoplazmoz durumunda tedaviye ITRASPOR kapsül ile devam edilmelidir. Özel popülasyonlara ilişkin ek bilgiler :Karaciğer yetmezliği:Karaciğer yetmezliği bulunan hastalarda intravenöz itrakonazol kullanımı ile ilgili veriler sınırlıdır. İtrakonazolün bu hasta popülasyonunda kullanımında dikkatli olunmalıdır (bkz. Bölüm 5.2).Böbrek yetmezliği:Böbrek yetmezliği bulunan hastalarda intravenöz itrakonazol kullanımı ile ilgili veriler sınırlıdır. SPORANOX IV formülasyonu için gerekli bir madde olan hidroksipropil-P-siklodekstrin glomerüler filtrasyon yoluyla elimine edilir. Bu nedenle kreatinin klerensinin 30 ml/dakikanın altında olduğu böbrek yetmezliği olan hastalarda SPORANOX IV kullanımı kontrendikedir (bkz. Bölüm 4.3).Hafif ve orta şiddetli böbrek yetmezliği olan hastalarda SPORANOX IV dikkatle kullanılmalıdır. Serum kreatinin düzeyleri yakından izlenmeli ve renal toksisiteden kuşkulanıldığında tedaviye ITRASPOR kapsüllerle devam edilmesi düşünülmelidir (bkz. Bölüm 4.4 ve Bölüm 5.2) Pediyatrik popülasyon:SPORANOX IV'nin çocuklarda kullanımı ile ilgili klinik veriler sınırlı olduğundan, sadecesağlanabilecek yarar, potansiyel riskin üzerinde olduğu durumlarda kullanılması önerilir (bkz. Bölüm 2 4.4). Geriyatrik popülasyonSPORANOX IV'nin yaşlı hastalarda kullanımı ile ilgili klinik veriler sınırlı olduğundan sadece sağlanabilecek yarar, potansiyel riskin üzerinde olduğu durumlarda kullanılması önerilir (bkz. Bölüm4.4). 4.3 Kontrendikasyonlar SPORANOX IV, itrakonazol ya da bileşiminde bulunan maddelere karşı aşırı duyarlı olan hastalarda kontrendikedir. SPORANOX IV, enjektabl Sodyum Klorürün kullanımının kontrendike olduğu durumlarda kontrendikedir. SPORANOX IV formülasyonundaki yardımcı maddelerden biri olan hidroksipropil-P-siklodekstrin glomerüler filtrasyon yoluyla elimine edilir. Bu nedenle ağır böbrek yetmezliği olan (kreatinin klerensinin 30 ml/dakikanın altında olmasıyla tanımlanır) hastalarda SPORANOX IV kullanımı kontrendikedir (bkz. Bölüm 4.2, Bölüm 4.4 ve Bölüm 5.2) Aşağıdaki ilaçların SPORANOX IV ile birlikte kullanımı kontrendikedir: (Aynı zamanda bkz. Bölüm 4.5) - QT aralığını uzatabilen CYP3A4 ile metabolize olan ilaçların, örneğin astemizol, bepridil, sisaprid, dofetilid, levasetilmetadol (levometadil), mizolastin, pimozid, kinidin, sertindol ve terfenadinin SPORANOX IV ile birlikte kullanılması kontrendikedir. SPORANOX IV ile birlikte kullanılması, bu ilaçların plazma konsantrasyonlarının artmasına ve bunun sonucu olarak QT uzamasına ve nadiren Torsade de pointes'e neden olabilir.- Lovastatin, atorvastatin ve simvastatin gibi CYP3A4 ile metabolize olan HMG-CoA redüktaz inhibitörleri. - Triazolam ve oral midazolam. - Dihidroergotamin, ergometrin (ergonovin), ergotamin ve metilergometrin (metilergonovin) gibi ergot alkaloidleri. - Nisoldipin. - Eletriptan. Metadon ve felodipin ile itrakonazol etkileştiği için itrakonazolün bu ilaçlardan herhangi birisi ile kullanımı kontrendikedir (bkz 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). SPORANOX IV, gebelikte kullanılmamalıdır (hayatı tehdit edici durumlar hariç) (bkz. Bölüm 4.6). SPORANOX IV kullanan doğurganlık potansiyeli olan kadınlarda, kontraseptif yöntemler kullanılmalıdır. SPORANOX IV tedavisi bitiminden itibaren bir sonraki menstruel döneme kadar, etkili kontraseptif yöntemler kullanılmaya devam edilmelidir. 4.4 Özel kullanım uyarıları ve önlemleriKardiyak etkiler :SPORANOX IV ile sağlıklı gönüllülerde yapılan çalışmada, sol ventriküler ejeksiyon fraksiyonunda geçici asemptomatik bir düşüş gözlemlenmiştir; bu bir sonraki infüzyondan önce düzelmiştir. İtrakonazolün negatif inotrop etkisi görülmüş ve SPORANOX IV'ye bağlı konjestif kalp yetmezliği vakaları bildirilmiştir. Günde 400 mg'dan yüksek dozla tedavi edilen hastalarda, daha düşük dozlarla tedavi edilenlere göre daha fazla oranda spontan kalp yetmezliği bildirilmiş olması, günlük toplam itrakonazol dozunun artışıyla kalp yetmezliği riskinin artabileceğine işaret eder. İlacın kullanımıyla elde edilecek yarar, olası riskten fazla olmadıkça SPORANOX IV konjestif kalp yetmezliği (KKY) veya hikayesi olan hastalarda kullanılmamalıdır. Hastanın yarar/risk değerlendirmesi yapılırken; endikasyonun ciddiyeti, doz rejimi (örn. günlük toplam doz) ve konjestif kalp yetmezliği açısından bireysel risk faktörleri göz önüne alınmalıdır. Bu risk faktörleri arasında; iskemik ve valvüler bozukluk gibi kalp hastalıkları, kronik obstrüktif akciğer hastalığı gibi önemli akciğer hastalığı ve böbrek yetmezliği ile diğer ödemle seyreden bozukluklar yer alır. Bu tür hastalar konjestif kalp yetmezliği bulgu ve belirtileri hakkında bilgilendirilmeli, dikkatli tedavi edilmeli ve tedavi süresince konjestif kalp yetmezliği bulgu ve belirtileri açısından izlenmelidir. Tedavi süresince bu tür bulgu ve belirtilerin görülmesi halinde, SPORANOX kullanımı kesilmelidir. Kalsiyum kanal blokerlerinin, itrakonazolünkine ek negatif inotrop etkileri olabilir. Ayrıca itrakonazol kalsiyum kanal blokerlerinin metabolizmasını inhibe edebilir. Bu nedenle, KKY riskinde artış olabileceğinden itrakonazol ile kalsiyum kanal blokerleri birlikte kullanılırken dikkat edilmelidir. Etkileşim potansiyeli : SPORANOX IV'nin klinik açıdan önemli ilaç etkileşimi potansiyeli bulunmaktadır. (bkz. Bölüm 4.5). Çocuklarda kullanım : SPORANOX IV'nin çocuklarda kullanımı ile ilgili klinik veriler olmadığından, sadece sağlanabilecek yarar, potansiyel riskin üzerinde olduğu durumlarda kullanılması önerilir. Yaşlılarda kullanım : SPORANOX IV'nin yaşlılarda kullanımı ile ilgili klinik veriler olmadığından, sadece sağlanabilecek yarar, potansiyel riskin üzerinde olduğu durumlarda kullanılması önerilir. Hepatik etkiler : SPORANOX kullanımı sonucunda çok seyrek olarak fatal akut karaciğer yetmezliği dahil ciddi hepatotoksisite görülmüştür. Bu hastaların çoğu daha önceden mevcut karaciğer hastalığı olan, bazı sistemik endikasyonlar için tedavi alan, belirgin başka bir medikal hastalığı olan ve/veya başka hepatotoksik ilaçlar alan kişilerdir. Bazı hastalarda karaciğer hastalığı ile ilgili belirgin risk faktörleri bulunmamaktadır. Bu vakaların bazıları tedavinin birinci ayında, bunların da bir kısmı birinci haftada gözlenmiştir. SPORANOX alan hastalarda karaciğer fonksiyonları izlenmelidir. Hastalar, iştahsızlık, bulantı, kusma, halsizlik, karın ağrısı veya idrar renginde koyulaşma gibi hepatiti düşündürebilecek işaret ve belirtilerin olması durumunda hekimlerine durumu bildirmeleri konusunda uyarılmalıdır. Bu hastalarda tedavi durdurulmalı ve karaciğer fonksiyon testleri uygulanmalıdır. Karaciğer enzim düzeyi yükselen veya aktif karaciğer hastalığı olan, ya da diğer ilaçlarla karaciğer toksisitesi gelişen hastalarda, beklenen yarar karaciğer hasarı riskinden yüksek olmadıkça tedaviye başlanmamalıdır. Bu tip vakalarda karaciğer enzim düzeyinin takip edilmesi gereklidir. Karaciğer yetmezliği : Karaciğer yetmezliği olan hastalarda intravenöz itrakonazolün kullanımı ile ilgili veriler sınırlıdır. İtrakonazolün bu hasta popülasyonunda kullanımında dikkatli olunmalıdır (bkz. Bölüm 4.2 ve Bölüm 5.2). Böbrek yetmezliği : Hidroksipropil-P-siklodekstrin intravenöz olarak uygulandığında glomerüler filtrasyon yoluyla elimine edilir. Bu nedenle kreatinin klerensinin 30 ml/dakikanın altında olduğu böbrek yetmezliği olan hastalarda SPORANOX IV kullanımı kontrendikedir (bkz. Bölüm 4.3). Hafif ve orta şiddetli böbrek yetmezliği olan hastalarda SPORANOX IV dikkatle kullanılmalıdır. Serum kreatinin düzeyleri yakından izlenmeli ve renal toksisiteden kuşkulanıldığında tedaviye ITRASPOR kapsül ile devam edilmesi düşünülmelidir. Çapraz aşırı duyarlılık : İtrakonazol ve diğer azol antifungaller arasında çapraz aşırı duyarlılık olduğuna ilişkin bilgi bulunmamaktadır. Başka bir azole karşı aşın duyarlılığı olan hastalara, SPORANOX IV reçete edilirken dikkatli olunmalıdır. Nöropati : SPORANOX IV tedavisine atfedilebilecek olabilecek bir nöropati görüldüğü takdirde, itrakonazol tedavisi sonlandınlmalıdır. İşitme kaybı : İtrakonazol tedavisi alan hastalarda geçici ya da kalıcı işitme kaybı bildirilmiştir. Bu raporların bir çoğunda birlikte kullanımın kontrendike olduğu kinidin de kullanılmıştır (bkz. Bölüm 4.3 ve Bölüm 4.5). İşitme kaybı, tedavi kesildiğinde genellikle düzelir ancak bazı hastalarda devam edebilir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri İtrakonazolün metabolizmasını etkileyen ilaçlarİtrakonazol esas olarak CYP3A4 ile metabolize olmaktadır. Rifampisin, rifabutin ve fenitoin gibi güçlü CYP3A4 enzim indükleyicileri ile etkileşim çalışmaları yapılmıştır. Bu çalışmalarda, etkililiklerini de büyük ölçüde azaltabilecek boyutta itrakonazol ve hidroksi-itrakonazolün biyoyararlanımı azaldığından, itrakonazolün bu güçlü enzim indükleyicileri ile birlikte kullanılması önerilmez. Karbamazepin, fenobarbital,Hipericum perforatum(St John's Wort) ve izoniazid gibi diğer enzim indükleyicileri ile ilgili veri olmamakla birlikte, benzer etkiler beklenmelidir. Efavirenz ve nevirapin gibi antivirallerin kullanımı itrakonazol plazma konsantrasyonunu düşürebilir.CYP3A4 enziminin ritonavir, indinavir, klaritromisin ve eritromisin gibi güçlü inhibitörleri, itrakonazolün biyoyararlanımını artırabilir. Itrakonazolün diğer ilaçların metabolizmasına etkisiİtrakonazol, sitokrom 3A ailesi ile metabolize edilen ilaçların metabolizmasını engelleyebilir. Bu duruma bağlı olarak bu ilaçların yan etkileri dahil, etkilerinde artma ve/veya uzama görülebilir. Başka bir ilaçla kullanıldığında, o ilacın Kısa Ürün Bilgisindeki metabolizma bilgileri dikkate alınmalıdır. Tedavi6 durdurulduktan sonra, itrakonazol plazma konsantrasyonları doza ve tedavi süresine bağlı olarak kademeli azalır (bkz. Bölüm 5.2). Bu durum, itrakonazolün beraber kullanılan bir başka ilaç üzerindeki inhibe edici etkisi söz konusu olduğunda göz önünde bulundurulmalıdır. Örnekler: İtrakonazol ile tedavi sırasında kontrendike olan ilaçlar:Torsade depointes'e neden olabilir. Lovastatin ve simvastatin gibi CYP3A4 ile metabolize olan HMG-CoA redüktaz inhibitörleri. Triazolam ve oral mi dazol am. Dihidroergotamin, ergometrin (ergonovin), ergotamin ve metilergometrin (metilergonovin) gibi ergot alkaloidleri. Eletriptan. Nisoldipin. Sisaprid, pimozid, metadon, levasetilmetadol (levometadil) veya kinidin ile itrakonazol ve/veya diğer CYP3A4 inhibitörleri ile birlikte kullanımı hayatı tehdit edici kardiyak ritim bozukluğu ve/veya ani ölüme yol açmaktadır (Bkz. 4.3 Kontrendikasyonlar). KKY riskinde artış nedeniyle itrakonazol ile kalsiyum kanal blokerleri beraber kullanılırken dikkat edilmelidir. İlaç metabolizmasında rol oynayan CYP3A4 ile etkileşimler dahil olası farmakokinetik etkileşimlere ek olarak, kalsiyum kanal blokerlerinin itrakonazolünkine ek negatif inotrop etkileri olabilir. Aşağıdaki ilaçlar dikkatle kullanılmalı ve plazma konsantrasyonlarıyla, etki veya yan etkileri izlenmelidir. İtrakonazol ile birlikte uygulanıyorsa bu ilaçların dozları gerekirse düşürülmelidir:Oral antikoagülanlar. Ritonavir, indinavir, sakinavir gibi HIV proteaz inhibitörleri. Busulfan, dosetaksel, trimetreksat ve vinka alkaloidleri gibi bazı antineoplastik ilaçlar. Dihidropiridin ve verapamil gibi CYP3A4 ile metabolize olan kalsiyum kanal blokerleri. Bazı immünosupresif ilaçlar: Siklosporin, rapamisin (sirolimus) ve takrolimus . Atorvastatin gibi CYP3A4 ile metabolize olan bazı HMG-CoA redüktaz inhibitörleri. Budesonid, deksametazon, flutikazon ve metilprednizolon gibi glukokortikoidler. Digoksin (P-glikoprotein inhibisyonu yoluyla). Diğerleri: Alfentanil, alprazolam, brotizolam, buspiron, karbamazepin, silostazol, disopiramid, ebastin, eletriptan, fentanil, halofantrin, IV midazolam, risperidon, perospiron, reboksetin, repaglinid, rifabutin. İtrakonazol ile zidovudin (AZT) ve fluvastatin arasında hiçbir etkileşim gözlenmemiştir. İtrakonazolün etinilöstradiolun ve noretisteronun metabolizmasını indükleyici bir etkisi gözlenmemiştir. Proteine bağlanma etkisiIn vitroçalışmalarda, itrakonazol ile imipramin, propranolol, diazepam, simetidin, indometasin, tolbutamid ve sülfametazin arasında plazma proteinlerine bağlanma açısından etkileşim olmadığı görülmüştür.4.6 Gebelik ve laktasyon Genel tavsiyeGebelik Kategorisi: CHayvanlar üzerinde yapılan çalışmalar, gebelik ve-veya embriyonal / fetal gelişim ve-veya doğum ve-veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir. SPORANOX IV, elde edilebilecek yararın fetüse olası risklerin üzerinde olduğu yaşamı tehdit eden sistemik mikozların dışında gebelerde kullanılmamalıdır (bkz. Bölüm 4.3). Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)SPORANOX IV kullanan doğurganlık potansiyeli olan kadınlarda, kontraseptif yöntemler kullanılmalıdır. SPORANOX IV tedavisi bitiminden itibaren bir sonraki menstruel döneme kadar, etkili kontraseptif yöntemler kullanılmaya devam edilmelidir.Gebelik dönemiGebelik döneminde SPORANOX IV kullanımı ile ilgili bilgiler sınırlıdır. Pazarlama sonrası deneyimlersırasında, konjenital anomali vakalan bildirilmiştir. Bu vakalar, iskelet, genito-üriner sistem, kardiyovasküler ve oftalmik malformasyonların yanısıra kromozomal ve birden fazla malformasyonun bir arada görülmesini içermektedir. SPORANOX ile nedensel bir ilişki saptanmamıştır. Gebeliğin ilk trimesterinde SPORANOX kullanımı - çoğunluğu vulvovajinal kandidoz için kısa dönem 8 tedavi alanlarda- ile ilgili epidemiyolojik veriler, bilinen herhangi bir teratojen maddeye maruz kalmamış kontrol grubuna göre yüksek malformasyon riski göstermemiştir. Laktasyon dönemiİtrakonazol çok az miktarda anne sütüne geçer. Bu nedenle, SPORANOX IV tedavisinden beklenen yarar ile emzirme sonucu doğabilecek riskler çok iyi değerlendirilmelidir. Herhangi bir şüphe durumunda hasta emzirmemelidir.Üreme yeteneği / fertiliteİtrakonazol tedavisinin üreme yeteneği üzerindeki etkileri araştırılmamıştır (bkz. Bölüm 5.3).4.7 Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma yeteneği üzerine etkileri ile ilgili bir çalışma bulunmamaktadır. Bazı durumlarda araç ve makine kullanımı sırasında baş dönmesi, görme bozukluğu ve duyma kaybı gibi yan etkiler oluşabilir, dikkatli olunmalıdır.4.8 İstenmeyen etkilerİntravenöz itrakonazol ile klinik çalışmalarda, en çok sıklıkta raporlanan advers deneyimler, gastrointestinal, metabolik ve besinsel ve hepato-bilier kaynaklıdır.Aşağıda Sistem Organı Sınıfına göre advers ilaç reaksiyonları sunulmuştur. Her bir Sistem Organı Sınıfı içindeki advers ilaç reaksiyonları aşağıdaki düzen kullanılarak insidansa göre verilmiştir: Çok yaygın (> 1/10); Yaygın (> 1/100 ila <1/10); Yaygın değil (> 1/1000 ila <1/100); Nadir (> 1/10.000 ila <1/1000) Çok nadir (< 1/10.000), Bilinmiyor (mevcut verilerden hesaplanamamaktadır). Kan ve lenf sistemi hastalıklarıBilinmiyor: Lökopeni, nötropeni, trombositopeniBağışıklık sistemi hastalıklarıBilinmiyor: Serum hastalığı, anjiyonörotik ödem, anafilaktik, anafilaktoid ve alerjik reaksiyonlarMetabolizma ve beslenme hastalıklarıYaygın: Hipokalemi Yaygın olmayan: Hiperglisemi Bilinmiyor: HipertrigliseridemiSinir sistemi hastalıklarıYaygın: Baş ağrısı, sersemlik hissi Yaygın olmayan: Hipoestezi Bilinmiyor: Periferik nöropati , paresteziGöz hastalıklarıYaygın olmayan: Görsel bozukluklar, görmede bulanıklık ve çift görme dahilKulak ve iç kulak hastalıklarıYaygın olmayan: Geçici ya da kalıcı işitme kaybı*Bilinmiyor: Tinnitus Kardiyak hastalıklarıBilinmiyor: Konjestif kalp yetmezliği , hipertansiyonSolunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın: DispneYaygın olmayan: Pulmoner ödem Bilinmiyor: sinüzit, üst solunum yolu enfeksiyonu, rinit Gastrointestinal hastalıklarıÇok yaygın: BulantıYaygın: Karın ağrısı, kusma, ishal, kabızlık Yaygın olmayan: Tat bozuklukları Bilinmiyor: Pankreatit, dispepsi, şişkinlik Hepato-bilier hastalıklarıYaygın: Hepatit, sarılık, hiperbillirubinemi, hepatik enzimlerde yükselme Bilinmiyor: Hepatotoksisite , akut karaciğer bozukluğu*Deri ve deri altı doku hastalıklarıYaygın: Döküntü, kaşıntıBilinmiyor: Toksik epidermal nekroliz, Stevens-Johnson sendromu, akut generalize ekzantematöz püstüloz, eritema multiforme, eksfolyatif dermatit, lökositoklastik vaskülit, ürtiker, alopesi, fotosensitivite Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın olmayan: Miyalji Bilinmiyor: ArtraljiBöbrek ve idrar hastalıklarıBilinmiyor: Pollaküri, üriner inkontinansÜreme sistemi ve meme hastalıklarıBilinmiyor: Menstrüel bozukluklar, erektil disfonksiyonGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıYaygın: Ödem, pireksi* bakınız Bölüm 4.4 4.9 Doz aşımı ve tedavisiDoz aşımı durumunda destekleyici önlemler uygulanmalıdır. İtrakonazol, hemodiyaliz ile uzaklaştırılamaz. Bilinen spesifik bir antidotu yoktur.5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik sınıflandırma: Sistemik kullanım için antimikotik, triazol türevi ATC kodu: J02A C02Bir triazol türevi olan itrakonazol, geniş etki spektrumuna sahiptir. In vitroçalışmalarda, itrakonazolün mantar hücrelerinde ergosterol sentezini bozduğu gösterilmiştir. Ergosterol mantarların hücre duvarının önemli bir bileşenidir. Sentezinin azalması antifungal etki ile sonuçlanır.İtrakonazol için yüzeysel mikotik enfeksiyonlardan yalnızca Candidatürleri için duyarlılık düzeyleri belirlenmiştir (CLSI M27-A2, duyarlılık düzeyleri EUCAST metoduyla gösterilememiştir). CLSI düzeyi değerleri şu şekildedir: duyarlı <0.125; doza bağlı duyarlı 0.25-0.5 ve dirençli >1 mcg/ml. Filamentoz funguslar için yorum yapılabilecek duyarlılık düzeyleri gösterilememiştir.In vitroçalışmalar, itrakonazolün genellikle <1 ^g/ml konsantrasyonunda insanlar için patojen birçok mantarın büyümesini engellediğini göstermiştir. Bu mantarlar şunlardır:Dermatofitler (Trichophyton spp., Microsporum spp., Epidermophyton floccosum),albicansdahil Candida spp., Cryptococcus neoformans, Malassezia spp., Trichosporon spp., Geotrichum spp.);Aspergillus spp.; Histoplasma spp.; Paracoccidioides brasiliensis; Sporothrix schenckii; Fonsecaeaspp.; Cladosporium spp.; Blastomyces dermatitidisCoccidiodes immitis; Pseudallescheria boydii;Penicillium marneffeiile diğer çeşitli maya ve mantarlar.11 CandidaCandida krusei, Candida glabrataCandida tropicalis,in vitrokoşullarda bunların bazı suşlarının itrakonazole karşı direnci farklılık göstermektedir.İtrakonazol tarafından inhibe edilmeyen başlıca mantar türleri ZygomycetesRhizopus spp., Rhizomucor spp., Mucor spp. ve Absidia spp.), Fusarium spp., Scedosporium spp.Scopulariopsisspp.'dir.Azollere direnç yavaş gelişir ve sıklıkla bir çok genetik mutasyon sonucu oluşur. Tanımlanan mekanizmalar arasında hedef enzim 14 <x-demetilazın kodunu çözen ERG11'in aşın ekspresyonu, hedefin afinitesini azaltan ERG11 nokta mutasyonları ve/veya hücre içine girişle sonuçlanan taşıyıcının aşırı ekspresyonu bulunmaktadır. Sınıfından bir üyesine direncin gelişmiş olması, diğer azollere de direnç gelişimini göstermemesine rağmen azol sınıfı içinde CandidaAspergillus fumigatussuşları bildirilmiştir.5.2 Farmakokinetik özelliklerGenel farmakokinetik özellikler:İntravenöz yoldan uygulanan itrakonazolün farmakokinetik özellikleri sağlıklı deneklerde ve hastalarda tek veya birden fazla doz alımını takiben, özel popülasyonlarda tek doz alımını takiben incelenmiştir. İtrakonazolün pik plazma konsantrasyonlarına intravenöz infüzyon sonunda ulaşılır, buradan sonra azalır. Hidroksi-itrakonazolün pik plazma konsantrasyonlarına (bkz. Biyotransformasyon) bir saatlik infüzyonun başında 3 saat içinde ulaşılır, buradan sonra azalır. Her bir 200 mg'lık intravenöz doz, itrakonazolün çözünürlüğünü arttırmak için 8 g hidroksipropil-P-siklodekstrin içerir. Her birinin farmakokinetik profili aşağıda ayrı ayrı tanımlanmıştır. Dağılım:Başlıca bağlandığı protein albumin olmak üzere plazmada, itrakonazolün büyük bir kısmı (% 99.8) proteinlere bağlıdır (hidroksi metaboliti için % 99.6). Lipidlere de belirgin bir afinitesi vardır. Plazmadaki itrakonazolün yalnızca % 0.2'si serbest halde bulunmaktadır. Dağılım hacminin yüksek olması (>700 litre), dokulara yaygın olarak dağıldığını göstermektedir. Akciğer, böbrek, karaciğer, kemik, mide, dalak ve kastaki konsantrasyonu, eş zamanlı plazma konsantrasyonunun 2-3 katı olarak bulunmuştur. Başta deri olmak üzere, keratinize dokulardaki konsantrasyonu, plazma derişiminin yaklaşık 4 katıdır. Beyindeki konsantrasyonun plazma konsantrasyonuna oranı yaklaşık birdir. Biyotransformasyon:İtrakonazol, karaciğerde büyük oranda metabolize olur ve çeşitli metabolitlerine dönüşür. In vitroin vitroolarak itrakonazol ile kıyaslanabilir antifungal etkililiğe sahiptir. Bu metabolitin konsantrasyonu, metabolize olmamış ilacınkinin yaklaşık iki katıdır.Eliminasyon:İntravenöz uygulama sonrası itrakonazol toplam plazma klerensi ortalama 381 ml/dakika'dır. İtrakonazol bir hafta içinde inaktif metabolitleri şeklinde idrarda yaklaşık %35 ve feçesle yaklaşık %54 atılmaktadır. İtrakonazol ve aktif metaboliti hidroksi-itrakonazolün idrarla atılan miktarı uygulanan intravenöz dozun %1'inden azını oluşturur. Oral yoldan alınan dozun %3-18 arasında değişen oranı feçesle değişmeden atılır. Oral yoldan alınan itrakonazol, bir hafta içinde esas olarak inaktif metabolitleri şeklinde idrar (%35) ve feçesle (%54) atılmaktadır. Doğrusallık / doğrusal olmayan durum:İtrakonazolün farmakokinetiği doğrusal değildir, bu nedenle çoklu doz verilmesi sonrasında plazmada birikir. Çoklu doz farmakokinetik bir çalışmada, uygulamanın 1. ve 2. gününde İtrakonazol IV günde iki kez 200 mg itrakonazolün 1 saatlik infüzyonu olarak ve ardından 3. günden 7. güne kadar günde bir kez 200 mg itrakonazolün 1 saatlik infüzyonu uygulanır. İtrakonazol IV'nin sabit plazma konsantrasyonlarına uygulamanın dördüncü dozundan sonra ulaşılır; hidroksi-itrakonazolün sabit plazma konsantrasyonlarına ise uygulamanın yedinci dozundan sonra ulaşılmaktadır. Sağlıklı gönüllülere 4 doz 200 mg itrakonazol IV uygulanımı sonrası ortalama Cmaks ve Cmin düzeyleri sırasıyla 3055 ng/ml ve 687 ng/ml iken aynı zaman noktalarında hidroksi-itrakonazol için ortalama değerler sırasıyla 1058 ng/ml ve 1263 ng/ml'dir. İntravenöz uygulama sonrası itrakonazolün ortalama toplam plazma klerensi 278 ml/dakikadır. Tekrarlı dozlama sonrası, itrakonazolün ortalama eliminasyon yarılanma ömrü yaklaşık 32.5 saattir. Hastalardaki karekteristik özelliklerKaraciğer yetmezliği:Karaciğer yetmezliği olan hastalarda intravenöz itrakonazolle yapılan çalışma bulunmamaktadır. İtrakonazol büyük oranda karaciğerde metabolize olur. 12 siroz hastası ve 6 sağlıklı kontrol vakasında tek doz itrakonazol (100 mg kapsül) uygulaması sonrası; itrakonazolün en yüksek plazma konsantrasyonu (Cmax), eğri altında kalan alanı (EAA) ve terminal yarılanma ömrü ölçülmüş ve bu iki grupta elde edilen veriler karşılaştırılmıştır. Siroz hastalarında itrakonazolün ortalama en yüksek plazma konsantrasyonlarının belirgin olarak düştüğü (yaklaşık %47) gözlenmiştir. Ortalama atılım yarılanma ömrü, karaciğer bozukluğu bulunmayan sağlıklı kontrol vakalarında 16 saat iken, siroz hastalarında 37 saate uzamıştır. Eğri altında kalan alan (EAA) sağlıklı vakalarda ve siroz hastalarında benzer bulunmuştur. Siroz hastalarında uzun süreli itrakonazol kullanımına ait veri bulunmamaktadır. (bkz. Bölüm 4.2 ve Bölüm 4.4) Böbrek yetmezliği:İntravenöz yoldan uygulanan itrakonazolün az bir bölümü (<%1) idrarla atılmaktadır. İntravenöz yoldan uygulanan tek bir dozdan sonra, hafif (Kreatinin klerensi: 50-79 ml/dak), orta (Kreatinin klerensi: 20-49 ml/dak) ve ağır (Kreatinin klerensi: <20 ml/dak) böbrek yetmezliği durumunda itrakonazolün ortalama terminal yarılanma ömürleri, sağlıklı gönüllülerdekine benzer olarak bulunmuştur (ortalama değerler böbrek yetmezliği olan hastalarda 42-49 saat ve sağlıklı gönüllülerde 48 saat). EAA düzeylerinden yola çıkılarak itrakonazole toplam maruz kalma derecesi orta ve ağır derecede böbrek yetmezliği durumlarında, böbrek fonksiyonları normal olanlara göre sırasıyla %30 ve %40 oranında azalmaktadır. Böbrek yetmezliği bulunan hastalarda itrakonazolün uzun süreli kullanımıyla ilgili veri bulunmamaktadır. Diyalizin itrakonazol ya da hidroksi-itrakonazolün yarılanma ömrü ya da klerensine herhangi bir etkisi yoktur. (bkz. Bölüm 4.2, Bölüm 4.3, Bölüm 4.4). Hidroksipropil-p-siklodekstrinBöbrek fonksiyonları normal olan hastalarda, SPORANOX'un intravenöz formülasyonundaki hidroksipropil-P-siklodekstrinin farmakokinetik profili incelendiğinde, 1 ila 2 saat arasında değişen kısa bir yarılanma ömrünün olduğu ve izleyen günlük dozlarda birikmediği gösterilmiştir. Sağlıklı deneklerde ve orta ya da ağır böbrek yetmezliği olan hastalarda 8 gram dozundaki hidroksipropil-P-siklodekstrinin büyük bölümü idrarla atılmıştır.İtrakonazolün 200 mg'lık tek bir intravenöz dozundan sonra, böbrek yetmezliği olanlarda hidroksipropil-P-siklodekstrine daha fazla maruz kalmaya yol açacak şekilde hidroksipropil-P-siklodekstrinin klerensi azalmıştır. Hafif, orta ve ağır böbrek yetmezliği olanlarda yarılanma ömürleri sırasıyla yaklaşık olarak normalin iki, dört ve altı katı uzun olarak bulunmuştur. Bu hastalarda infüzyonlara devam edilmesiyle kararlı duruma ulaşılana kadar hidroksipropil-P-siklodekstrin birikimi devam eder. Hidroksipropil-P-siklodekstrin hemodiyalizle vücuttan uzaklaştırılabilir. 5.3 Klinik öncesi güvenlilik verileriİtrakonazol üzerine klinik dışı veriler gen toksisitesi, primer karsinojenisite veya üreme bozukluğuna ilişkin işaretler göstermemiştir. Yüksek dozlarda adrenal korteks, karaciğer ve mononükleer fagosit sisteminde etkiler gözlemlenmiş ancak bunların önerilen klinik kullanım açısından düşük öneme sahip olduğu görülmüştür. Sıçanlar ve farelere yüksek dozlarda verilen itrakonazolün maternal toksisite, embriyotoksisite ve teratojenisitede doza bağlı artışa neden olduğu bulunmuştur. Kronik itrakonazol uygulamasının ardından genç köpeklerde kemik mineral yoğunluğunda genel bir düşme ve sıçanlarda kemik plakası aktivitesinde azalma, büyük kemiklerin kompakt alanında incelme ve kemik kırılganlığında artış gözlemlenmiştir.6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSPORANOX IV Ampul:- Hidroksipropil-P-siklodekstrin - Propilen glikol - Hidroklorik asit - Sodyum hidroksit - Enjeksiyonluk su %0.9 Sodyum Klorür Çözeltisi: - Sodyum Klorür - Enjeksiyonluk su 6.2 GeçimsizliklerSPORANOX IV yalnızca ürün ambalajındaki 50 ml %0.9 Sodyum Klorür Çözeltisi kullanılarak sulandırılmalıdır.%0.9 Sodyum Klorür Çözeltisi aralarında SPORANOX IV'nin de bulunduğu bir çok ilaçla geçimlidir. Ürün ambalajındaki 50 ml %0.9 Sodyum Klorür Çözeltisi dışında başka çözeltiler kullanılarak sulandırılması durumunda itrakonazolün çökelme riski bulunmaktadır. 6.3 Raf ömrüSPORANOX IV Ampul:24 ay. Son kullanma tarihi karton dış ambalaj üzerinde Son kullanma tarihi: ay/yıl şeklinde belirtilmiştir. %0.9 Sodyum Klorür Çözeltisi:- 36 ay. Karışım:- 24 saat. 6.4 Saklamaya yönelik özel tedbirlerSPORANOX IV Ampul:25°C altındaki oda sıcaklığında ve orjinal kutusu içinde saklayınız.%0.9 Sodyum Klorür Çözeltisi:25°C altı oda sıcaklığında saklayınız. Dondurmayınız.Karışım:Doğrudan güneş ışığı görmeyen bir yerde saklayınız.Mikrobiyolojik açıdan çözelti karıştırıldıktan hemen sonra kullanılmalıdır. Hemen kullanılamadığı durumlarda kullanımdan önceki saklama koşulları ve süresi kullanıcının sorumluluğundadır ve karışım işlemi kontrollü olarak valide edilmiş aseptik koşullarda gerçekleştirilmediği durumlarda normalde 2°C - 8°C arası sıcaklıkta 24 saatten uzun değildir. 6.5 Ambalajın niteliği ve içeriğiSPORANOX IV Ampul:- 250 mg itrakonazol içeren 25 ml silikonize tip-I cam ampullerde. %0.9 Sodyum Klorür :- 52-56 ml %0.9 Sodyum Klorür Enjektabl içeren, esnek giriş ve çıkış portları bulunan, 75 ml'lik esnek polipropilen infüzyon torbasında - İnfüzyon seti (iki yollu musluklu ve hat içi filtreli) 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller ''Tıbbi Atıkların Kontrolü Yönetmeliği'' ve ''Ambalaj Atıklarının Kontrolü Yönetmelik''lerine uygun olarak imha edilmelidir.25 ml SPORANOX IV konsantresinin, 50 ml %0.9 Sodyum Klorür Çözeltisi dışındaki diğer çözeltilerle seyreltildiğinde itrakonazolün çökme potansiyeli vardır. Ampulden tam olarak25 ml SPORANOX IV alınarak, yalnızca SPORANOX IV ile kombinasyon halinde kullanıma yönelik olarak hazırlanmış Sodyum Klorür İnfüzyon Torbasında seyreltilmelidir. Yalnızca satış ambalajı bileşenleri (yani, Sodyum Klorür infüzyon torbası, 2 yönlü vana ve 0,2 mikrometre hat içi filtreli uzatma hattı ve SPORANOX IV ampul) kullanılmalıdır. SPORANOX IV diğer ilaçlar ya da sıvılarla birlikte uygulanamaz (bkz. Bölüm 6.2).Karıştırma işlemine başlamadan önce SPORANOX IV konsantresi ve çözücü (Sodyum Klorür) görsel olarak incelenmelidir. Karışımın hazırlanması için yalnızca yabancı partikül içermeyen berrak çözeltiler kullanılmalıdır. SPORANOX IV konsantresinin tamamı, yavaş ve tek bir hareketle (en fazla 60 saniyede) Sodyum Klorür torbasına enjekte edilmelidir. Karıştırma işlemi esnasında bulanıklık görülebilir, ancak hafifçe karıştırdıktan sonra berraklaşacaktır. Torba, karıştırma sonrası ve uygulama öncesi görsel olarak incelendiğinde üründe küçük topaklar gözlenebilir. Bu topaklar ürün kalitesini etkilemez. Topakların alıcının dolaşımına geçmesini engellemek için 0,2 mikrometre hat içi filtre içeren özel uzatma hattı kullanılmalıdır. SPORANOX IV aşağıdaki talimatlara uyularak kullanılmalıdır: Ampulün açılmasıAmpulü aşağıda gösterildiği biçimde kırınız: -0)(*-* breaking levelSodyum Klorür torbasının açılması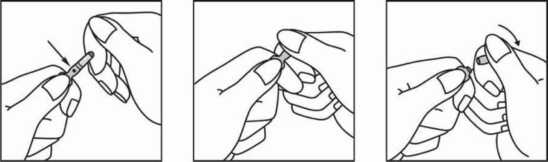 -Torbanın dış kılıfını işaretli yerden yırtarak açınız ve infüzyon torbasını açığa çıkarınız.SPORANOXIV konsantre ile %0.9 Sodyum Klorür Çözeltisinin karıştırılması-Tüm bileşenler oda sıcaklığında olmalıdır.- Seyreltme işlemini yalnızca ambalaj içinde sunulmuş olan infüzyon torbasıiçinde yapınız.- Aseptik teknik kullanarak uygun uzunlukta bir ek ilaç uygulama enjektörüyle (kit içinde enjektör bulunmamaktadır) ampulde bulunan konsantrenin tamamını çekiniz ve SPORANOX IV konsantreyiyavaş ve tek bir hareketle (en fazla 60 saniyede)torbaya ekleyin. Karıştırma işlemi esnasında biraz bulanıklık görülebilir. Bu, ürün için normal bir durumdur ve 25 ml SPORANOX IV'nin tüm içeriği Sodyum Klorür infüzyon torbası içinde seyreltilip hafifçe karıştırıldıktan sonra kaybolacaktır. Enjektörü, SPORANOX IV konsantresi torbaya aktarıldıktan sonra geri çekiniz.- SPORANOX IV tamamen torbaya aktarıldıktan sonra torbadaki içeriği yavaşça karıştırınız. Karışım berraklaşır ancak üründe küçük topaklar (lif veya pul benzeri, yarı saydam beyaz partiküller olarak tanımlanır) gözlenebilir. Bu topaklar ürün kalitesini etkilemez. - Karışım hemen kullanılmalı ve direkt güneş ışığından korunmalıdır. Uygulama, normal oda ışığında yapılabilir. (bkz. Bölüm 6.3 ve Bölüm 6.4) İnfüzyon öncesi yıkama prosedürü:İnfüzyon öncesinde diğer ilaçların kalıntıları ve itrakonazol arasındaki geçimsizlik sorunlarını önlemek için kateter yıkanmalıdır. 0,2 mikrometre hat içi filtre içeren kit ile birlikte tedarik edilen uzatma hattını steril %0,9 SodyumKlorür çözeltisi ile doldurun ve doğrudan damar içine giden intravenöz katetere bağlayın. Kit ile birlikte tedarik edilen uzatma hattını ve damar içine uygulanan intravenöz kateteri steril %0,9 Sodyum Klorür çözeltisi ile yıkayın. İnfüzyon-Karışım tek kullanımlıktır. Çözelti hafif karıştırmanın ardından kaybolmayan süt beyaz renge sahipse veya yabancı madde içeriyorsa ya da infüzyon torbası hasar görmüşse uygulama gerçekleştirilmemelidir.- İnfüzyon torbası artık 25 ml SPORANOX IV ve 50 ml %0.9 Sodyum Klorür Enjektabl içermektedir. - Not: Kit ile birlikte damlatma hazneli bir infüzyon hattı verilmemektedir. İnfüzyon hattındaki akış kontrol cihazını (örn. döner klemp) kapalı duruma getiriniz. Çıkış bağlantı noktası kırılabilir bölümünü çıkartınız. Aseptik teknik kullanarak, infüzyon hattının sivri ucunu, torbadaki fleksibl porta uygulayınız. - Akış kontrol cihazını yavaşça açarak, damlatma haznesini sıkarak (pompalama hareketi yaparak) yarısına kadar doldurunuz. - İnfüzyon hattındaki tüm hava boşalana kadar akış kontrol cihazını açık tutunuz. - İnfüzyon hattını, uzatma hattının iki yönlü kapatma musluğuna bağlayınız. - SPORANOX IV artık intravenöz infüzyonla uygulanmaya hazırdır. - İnfüzyon hızını bir akış kontrol cihazıyla (örn. döner klemp ya da infüzyon pompası) 1 ml/dakika (yaklaşık 25 damla/dakika) olarak ayarlayınız. - 60 ml çözeltiyi bir hastaya yaklaşık bir saatlik sürede uygulayınız. - 60 ml çözelti uygulandığınızda infüzyon işlemini durdurunuz. - 200 mg itrakonazol uygulanmış olmasına dikkat ediniz. - Damar yolunu aşağıda belirtildiği şekilde yıkayınız. Uygulama sonrası yıkama prosedürü:İnfüzyondan sonra, kateteri temizlemek için tam bir yıkama prosedürü başlatılmalıdır. Bu işlem itrakonazol kalıntıları ile daha sonra aynı kateter yoluyla uygulanabilecek diğer ilaçlar arasındaki geçimsizlik sorunlarını önlemek üzere yapılır. -Uzatma hattını ve kateteri 0.2 mikrometre hat içi filtreden hemen önceki bölümden ve iki yönlü kapatma musluğu seviyesinde 15 - 20 ml %0.9'luk steril Sodyum Klorür çözeltisi ile yıkayınız.- Yıkama işlemini 30 saniye ila 15 dakikalık sürekli bir akışla gerçekleştiriniz. - Yıkama sonrası torbayı, infüzyon hattını ve uzatma hattını çıkarınız ve atınız. - Kullanılmış SPORANOX infüzyon setini yeniden sterilize etmeyiniz ya da kullanmayınız. - Çökelmeyi önlemek için, birlikte uygulanması gereken diğer ilaçlar yalnızca yıkama işleminden sonra kateterden yapılmalıdır. - Bir multi-lümen kateter kullanılması durumunda, birlikte uygulanması gereken diğer ilaçlar SPORANOX IV infüzyon tamamlanana ve kateter yıkanana kadar uygulanmamalıdır. Polipropilen torba dizaynı için uygulama çizimi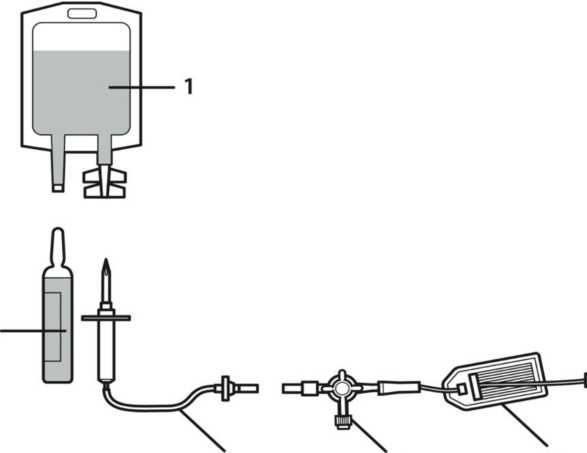
3451. Sodyum Klorür infüzyon torbası2. SPORANOX IV ampul 3. Damlatma hazneli infüzyon hattı (ambalajda bulunmaz) 4. ve 5. İki yönlü musluklu ve hat içi filtreli uzatma hattı 7. RUHSAT SAHİBİJohnson &Johnson Sıhhi Malzeme San. ve Tic. Ltd. Şti.,Kavacık Mah. Ertürk Sk. Keçeli Plaza No:13 Kavacık-Beykoz/İstanbul Tel: 0.216. 538 20 00 Faks: 0.216. 538 24 99 8. RUHSAT NUMARASI123/129. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi : 10.10.200710. KÜB'ÜN YENİLENME TARİHİ21 |
İlaç BilgileriSporanox Iv 10 Mg/ml Konsantre İnfüzyon ÇözeltisiEtken Maddesi: Itrakonazol Atc Kodu: J02AC02 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.