Adempas 2 Mg Film Kaplı Tablet Kısa Ürün BilgisiKalp Damar Sistemi » Antihipertansif İlaçlar (Yüksek Tansiyon İlaçları) » Diğer Antihipertansifler » Diğer Antihipertansif İlaçlar KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADIADEMPAS® 2 mg film kaplı tablet2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her bir film kaplı tablet 2 mg riociguat içerir.Yardımcı maddeler:Laktoz monohidrat 38.20 mgYardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMFilm kaplı tabletBir yüzünde Bayer logosu, diğer yüzünde 2 ve R baskısı bulunan, soluk turuncu renkte, yuvarlak, bikonveks tabletler (çentiksiz 6 mm çapında, 9 mm kavis yarıçapında ve 87.5 mg ağırlığında). 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarKronik tromboembolik pulmoner hipertansiyon (KTEPH, Dünya Sağlık Örgütü (DSÖ) Grup 4):ADEMPAS, inoperabl KTEPH'li, cerrahi tedavi sonrasında dirençli veya nükseden KTEPH'li erişkin hastaların tedavisinde egzersiz kapasitesinin ve DSÖ fonksiyonel sınıfının iyileştirilmesinde endikedir. Pulmoner arteriyel hipertansiyon (PAH, DSÖ Grup 1): ADEMPAS, erişkin PAH hastalarının tedavisinde, egzersiz kapasitesinin ve DSÖ fonksiyonel sınıfının iyileştirilmesinde ve klinik kötüye gidişin geciktirilmesinde endikedir. Riociguatın etkililiği tek başına kullanıldığında, ya da endotelin reseptör antagonistleri veya prostanoidler ile kombinasyon tedavisi almakta olan hastalarda gösterilmiştir. Etkililiği ortaya koyan çalışmalarda ağırlıklı olarak, DSÖ fonksiyonel sınıfı II-III olan ve idiyopatik veya kalıtsal PAH ya da bağ doku hastalığı ile ilişkili PAH etiyolojileri olan hastalar yer almıştır. 4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Tedavi sadece KTEPH veya PAH tedavisinde deneyimli bir hekim/sağlık profesyoneli tarafından başlatılmalı ve takip edilmelidir.ErişkinlerTedavi başlangıcıÖnerilen başlangıç dozu, 2 hafta süreyle günde üç kez alınan 1.0 mg'dır. Tabletler yemeklerle birlikte ya da ayrı olarak, aralarında yaklaşık 6 ila 8 saat bırakılarak günde üç kez alınmalıdır. Sistolik kan basıncı >95 mmHg ise ve hastada hipotansiyon bulgu ve belirtileri bulunmuyorsa, dozaj, 2 haftalık aralıklarla ve 0.5 mg'lık artışlarla maksimum günde üç kez 2.5 mg'a yükseltilmelidir. Sistolik kan basıncı 95 mmHg'nin altına düşerse, hastanın hipotansiyon bulgu ve belirtileri göstermiyor olması koşuluyla mevcut doz uygulamasına devam edilmelidir. Doz yükseltme aşamasında herhangi bir zamanda sistolik kan basıncı 95 mmHg'nin altına düşerse ve hasta hipotansiyon işaret veya semptomları gösterirse, mevcut doz günde üç kez 0.5 mg oranında düşürülmelidir. İdame dozuHipotansiyon bulgu ve belirtileri ortaya çıkmadığı sürece kişiye göre ayarlanmış olan doz ile devam edilmelidir. ADEMPAS'ın maksimum toplam günlük dozu 7.5 mg'dır. Bir dozun unutulması durumunda, tedaviye planlandığı şekilde bir sonraki dozla devam edilmelidir. İntolerans söz konusu ise, tedavinin herhangi bir zamanında dozun azaltılması düşünülebilir. Tedavinin kesilmesiTedaviye üç gün veya daha uzun süreyle ara verilmesinin gerektiği durumlarda, tedaviye 2 hafta süreyle günde üç kez 1 mg olacak şekilde yeniden başlanır ve yukarıda tarif edilen doz titrasyon rejimi ile tedaviye devam edilir. Uygulama şekli:Oral kullanım içindir.Özel popülasyonlara ilişkin ek bilgiler:Tedavinin başlangıcında bireysel olarak yapılan doz titrasyonu, dozun, hastanın ihtiyacına göre ayarlanmasına olanak tanımaktadır.Böbrek yetmezliği:Hafif, orta veya ciddi derecede böbrek yetmezliği (kreatinin klerensi 80-15 mL/dak) olan hastalarda ADEMPAS'a maruziyetin daha yüksek olduğu görülmüştür (bkz. Bölüm 5.2 Farmakokinetik özellikler). Bireysel doz titrasyonu sırasında özellikle dikkatli olunmalıdır.Kreatinin klerensi <15 mL/dak olan ya da diyaliz tedavisi görmekte olan hastalar ile çalışılmamıştır ve bu nedenle ADEMPAS'ın bu hastalarda kullanılması önerilmemektedir (bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Karaciğer yetmezliği:Hafif derecede karaciğer yetmezliği (Child Pugh A) olan hastaların riociguat plazma konsantrasyonları, sağlıklı kontrol grubu ile benzer bulunmuştur.Orta derecede karaciğer yetmezliği (Child Pugh B) olan hastalarda ADEMPAS'a maruziyetin daha yüksek olduğu görülmüştür (bkz. Bölüm 5.2 Farmakokinetik özellikler). Bireysel doz titrasyonu sırasında özellikle dikkatli olunmalıdır. Ciddi karaciğer yetmezliği (Child Pugh C) olan hastalar ile çalışılmamıştır ve bu nedenle ADEMPAS'ın bu hastalarda kullanılması önerilmemektedir (bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Pediyatrik popülasyon:ADEMPAS'ın güvenliliği ve etkililiği, 18 yaşın altındaki hastalarda henüz test edilmemiştir. Bilgi mevcut değildir. Bu nedenle, ADEMPAS'ın pediyatrik hastalarda kullanılması önerilmemektedir.Geriyatrik popülasyon:Yaşlılarda ADEMPAS'a maruziyet artmıştır. Yaşlılarda (>65 yaş), bireysel doz titrasyonu sırasında özellikle dikkatli olunmalıdır (bkz. Bölüm 5.2 Farmakokinetik özellikler).Diğer:Sigara kullanımıHalen sigara kullanmakta olan kişilere sigarayı bırakmaları tavsiye edilmelidir. Sigara içen kişilerde riociguatın plazma konsantrasyonları, sigara içmeyen kişilere göre azalmıştır. Tedavi sırasında sigara kullanmayı bırakan ya da kullanmaya başlayan hastalarda riociguat dozunun ayarlanması gerekebilir (bkz. Bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri ve Bölüm 5.2 Farmakokinetik özellikler). Gebelik Tedaviye başlamadan önce ve tedavisi sırasında her ay gebelik testi yapılması tavsiye edilir. 4.3. KontrendikasyonlarADEMPAS gebelik döneminde kontrendikedir (bkz. Bölüm 4.6 Gebelik ve laktasyon ve Bölüm 5.3 Klinik öncesi güvenlilik verileri).ADEMPAS'ın nitratlarla veya nitrik oksit açığa çıkaran bileşikler ile (örn. amil nitrit) herhangi bir formda eşzamanlı uygulanması kontrendikedir (bkz. Bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). Riociguatın spesifik fosfodiesteraz tip 5 (PDE-5) inhibitörleri (sildenafil, tadafil, vardenafil gibi) ile veya spesifik olmayan PDE inhibitörleri (dipiridamol ya da teofilin gibi) ile birlikte kullanılması kontrendikedir (bkz. Bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). ADEMPAS, aktif madde ya da bölüm 6.1'de (Yardımcı Maddelerin Listesi) listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan kişilerde kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriPulmoner veno-oklüzif hastalık (PVOH)Pulmoner vazodilatörler, PVOH'si olan hastalarda kardiyovasküler durumu anlamlı ölçüde kötüleştirebilirler. Bu nedenle, ADEMPAS'ın bu tip hastalarda kullanılması önerilmemektedir. Pulmoner ödem belirtilerinin ortaya çıkması halinde, ilişkili PVOH olasılığı değerlendirilmelidir ve teyid edilirse ADEMPAS ile tedavi kesilmelidir. KanamaPlasebo kontrollü klinik çalışma programında, ADEMPAS alan hastaların %2,4'ünde ciddi kanama meydana gelirken, plasebo alan hiçbir hastada ciddi kanama meydana gelmemiştir. ADEMPAS alan 5 hastada (%1) ciddi hemoptizi meydana gelirken (ölümcül sonucu olan bir olay dahil), plasebo alan hiçbir hastada ciddi hemoptizi meydana gelmemiştir. Ciddi hemorajik olaylar ayrıca 2 hastada görülen vajinal hemoraji, 2 hastada görülen katater bölgesi hemorajisi ve birer hastada görülen subdural hematom, hematemez ve intra-abdominal hemorajiyi içermektedir. HipotansiyonADEMPAS kan basıncını düşürür. Hipovolemi, ciddi sol ventrikül çıkış yolu obstrüksiyonu, dinlenme halinde hipotansiyon, otonomik disfonksiyonu veya antihipertansiflerle ya da güçlü CYP ve P-gp/BCRP inhibitörleriyle eş zamanlı tedavi alan hastalarda, semptomatik hipotansiyon potansiyeli veya iskemi göz önünde bulundurulmalıdır (bkz. Bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). Hasta hipotansiyon belirti ve semptomları geliştirirse, doz azaltımı değerlendirilmelidir. Diğer tıbbi ürünlerle eşzamanlı kullanımRiociguatın güçlü, çok yolaklı CYP inhibitörleri ve P-gp (P-glikoprotein)/BCRP (meme kanseri direnç proteini) inhibitörleri gibi azol antimikotikler (örn. ketokonazol, itrakonazol) ya da HIV proteaz inhibitörleri (örn. ritonavir) ile eşzamanlı kullanılması, riociguat maruziyetindeki belirgin artış nedeniyle önerilmemektedir (bkz. Bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). Riociguatın tirozin kinaz inhibitörü erlotinib gibi güçlü CYP1A1 inhibitörleri ve immünosupresif ilaç siklosporin A gibi güçlü P-gp/BCRP inhibitörleri ile eşzamanlı kullanılması, riociguat maruziy etini artırabilir (bkz. Bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). Bu ilaçlar dikkatli kullanılmalıdır. Kan basıncı takip edilmeli ve riociguat dozunun azaltılması düşünülmelidir. Çalışılmamış hasta popülasyonlarıADEMPAS, aşağıdaki hasta popülasyonlarında çalışılmamıştır ve dolayısıyla ADEMPAS'ın bu popülasyonlarda kullanılması önerilmemektedir: Tedavinin başlangıcında sistolik kan basıncı <95 mmHg olan hastalar, Ciddi karaciğer yetmezliği (Child Pugh C) olan hastalar, Kreatinin klerensi <15 mL/dak olan ya da diyaliz tedavisi görmekte olan hastalar. Bu tıbbi ürün her dozunda 38.20 mg laktoz monohidrat ihtiva eder. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. Çocuk doğurma potansiyeli olan kadınlarADEMPAS, hamilelik döneminde kullanıldığında fetüste zarara neden olabilir ve hamile olan kadınlarda kullanımı kontrendikedir. Çocuk doğurma potansiyeli olan kadınlarda, tedaviye başlanmadan önce hamilelik ihtimali dışlanmalı ve ADEMPAS tedavisi süresince güvenilir korunma yöntemleri uygulanmalıdır. Her ay gebelik testi yapılması tavsiye edilir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriFarmakokinetik Etkileşimler:Diğer maddelerin riociguat üzerindeki etkileri Riociguat esas olarak sitokrom P450 aracılı (CYP1A1, CYP3A4, CYP2C8, CYP2J2) oksidatif metabolizma, değişmemiş ilacın doğrudan safra/feçes ile atılımı ve değişmemiş ilacın glomerüler filtrasyonuyla böbreklerden atılımı yoluyla vücuttan temizlenir. İn vitroçalışmalara göre riociguatın, P-gp/BCRP membran taşıyıcı proteinlerinin substratı olduğu bulunmuştur. Bu enzimlerin veya taşıyıcıların inhibitörleri ya da indükleyicileri, riociguat maruziyetini etkileyebilir.İn vitroortamda, güçlü bir CYP3A4 ve P-gp inhibitörü olarak sınıflandırılan ketokonazolün, riociguat metabolizması ve atılımı açısından çok yolaklı bir CYP ve P-gp/BCRP inhibitörü olduğu gösterilmiştir (bkz. Bölüm 5.2 Farmakokinetik özellikler). Riociguatın günde bir kez 400 mg ketokonazol ile birlikte uygulanması sonucunda ortalama EAA değerinde %150 (%370'e kadar) artış ve ortalama Cmaks değerinde %46 artış meydana gelmiştir. Terminal yarılanma ömrü 7.3 saatten 9.2 saate uzarken, toplam vücut klerensi 6.1 L/saatten 2.4 L/saate düşmüştür.Bu nedenle, ADEMPAS'ın azol antimikotikler (örn. ketokonazol, itrakonazol) gibi güçlü, çok yolaklı CYP ve P-gp/BCRP inhibitörleri veya HIV proteaz inhibitörleri (örn., ritonavir) ile eşzamanlı kullanılması önerilmemektedir (bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri ve Bölüm 5.2 Farmakokinetik özellikler). İmmünosupresif ilaç siklosporin A gibi, P-gp/BCRP'yi güçlü bir şekilde inhibe eden ilaçlar dikkatli kullanılmalıdır (bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri). İn vitroin vitroortamda erlotinib ve gefitinib en yüksek inhibitör potensi göstermiştir. Buna göre, CYP1A1 inhibisyonuna bağlı ilaç-ilaç etkileşimi (bkz. Bölüm 5.2 Farmakokinetik özellikler), özellikle sigara kullanan kişilerde riociguat maruziyetinde artışa neden olabilir. Bu nedenle güçlü CYP1A1 inhibitörleri dikkatli kullanılmalıdır (bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri).Güçlü ve selektif bir CYP3A4 inhibitörü olarak sınıflandırılan ve zayıf ila orta düzeyli P-gp inhibitörü olduğu bildirilmiş olan klaritromisinin (günde iki kez 500 mg) eşzamanlı uygulanması, Cmaks değerinde anlamlı bir değişiklik olmaksızın riociguatın ortalama EAA değerinde %41 oranında, orta düzeyli bir artışa neden olmuştur. Bu durumun klinik olarak anlamlı olduğu düşünülmemektedir. Riociguat, asidik ortam ile karşılaştırıldığında nötr pH değerlerinde daha düşük çözünürlük sergilemektedir. Üst gastrointestinal pH değerini artıran ilaçların bir arada kullanılması, oral biyoyararlanımda azalmaya neden olabilir. Proton pompa inhibitörü omeprazol (günde bir kez 40 mg) ile ön tedavi ve eşzamanlı tedavi, riociguatın ortalama EAA değerini %26 ve ortalama Cmaks değerini %35 düşürmüştür. Bu durumun klinik olarak anlamlı olduğu düşünülmemektedir. Eşzamanlı antiasit alüminyum hidroksit/magnezyum hidroksit uygulanması, riociguatın ortalama EAA değerini %34 ve ortalama Cmaks değerini %56 düşürmüştür (bkz. Bölüm 4.2 Pozoloji ve uygulama). Antiasitler ADEMPAS'tan en az bir saat sonra alınmalıdır. CYP3A4'ün orta düzeyli indükleyicisi olduğu bildirilmiş olan bosentan, PAH hastalarında riociguatın kararlı durumdaki plazma konsantrasyonlarını %27 oranında azaltmış; fakat kombinasyonun etkililiğini olumsuz etkilememiştir (bkz. Bölüm 4.1 Terapötik endikasyonlar). Riociguatın güçlü CYP3A4 indükleyicileri (örn. fenitoin, karbamazepin, fenobarbiton veya sarı kantaron [St. John's Wort]) ile eşzamanlı uygulanması da riociguat plazma konsantrasyonunun anlamlı düzeyde azalmasına neden olabilir. Riociguatın güçlü CYP3A4 indükleyicileri ile eşzamanlı uygulanması durumunda, doz ayarlamasına rehberlik edecek veriler mevcut değildir. Riociguatın diğer maddeler üzerindeki etkileri İn vitroortamda riociguat ve ana metaboliti, terapötik plazma konsantrasyonlarında, majör CYP izoformlarının (CYP 3A4 dahil) ya da taşıyıcılarının (örn. P-gp/BCRP) inhibitörleri ya da indükleyicileri değildir.Riociguat ve CYP3A4 prob substratı midazolam arasında karşılıklı farmakokinetik etkileşim olmadığı in vivokoşullarda gösterilmiştir.Riociguat ve ana metabolitinin in vitroortamda CYP1A1'in güçlü inhibitörleri olduğu gösterilmiştir. Bu nedenle erlotinib veya granisetron gibi, anlamlı düzeyde CYP1A1 aracılı biyotransformasyon yoluyla temizlenen ilaçlarla eşzamanlı kullanımında, klinik açıdan belirgin ilaç-ilaç etkileşimlerinin gerçekleşme olasılığı göz ardı edilemez.Farmakodinamik Etkileşimler: NitratlarADEMPAS 2.5 mg tablet, dilaltı nitrogliserinin (0.4 mg) kan basıncı düşürücü etkisini, ilaç alındıktan 4 ve 8 saat sonra güçlendirmiştir. Bu nedenle, ADEMPAS'ın nitratlarla veya nitrik oksit açığa çıkaran bileşikler ile (amil nitrit gibi) herhangi bir formda eşzamanlı uygulanması kontrendikedir (bkz. Bölüm 4.3 Kontrendikasyonlar). PDE-5-inhibitörleriHayvan modelleri üzerinde gerçekleştirilen klinik öncesi çalışmalarda, sildenafil ya da vardenafil ile riociguat kombine edildiğinde, sistemik kan basıncını düşürücü aditif etki gösterilmiştir. Bazı vakalarda artan dozlarla birlikte sistemik kan basıncı üzerinde aditif etkiler gözlenmiştir. Stabil sildenafil tedavisindeki (günde üç kez 20 mg) 7 PAH hastası ile gerçekleştirilen araştırma amaçlı bir etkileşim çalışmasında, riociguatın tek dozları (ardışık olarak 0.5 mg ve 1 mg) aditif hemodinamik etkiler göstermiştir. Bu çalışmada 1 mg riociguatın üzerindeki dozlar incelenmemiştir. Tek başına sildenafil tedavisine kıyasla stabil sildenafil tedavisi (günde üç kez 20 mg) ve riociguat (günde üç kez 1.0 mg-2.5 mg) uygulanan 18 PAH hastasında 12 haftalık bir kombinasyon çalışması gerçekleştirilmiştir. Çalışmanın uzun süreli uzatma kısmında (kontrolsüz tasarım), sildenafil ve riociguatın birlikte kullanılması, ağırlıklı olarak hipotansiyon nedeniyle olmak üzere yüksek oranda çalışmadan ayrılmalar ile sonuçlanmıştır. Çalışılan popülasyonda, kombinasyonunun olumlu klinik etkisi olduğu yönünde bir kanıt mevcut değildir. Riociguatın spesifik fosfodiesteraz tip 5 (PDE-5) inhibitörleri (sildenafil, tadafil, vardenafil gibi) ile veya spesifik olmayan PDE inhibitörleri (dipiridamol ya da teofilin gibi) ile birlikte kullanılması kontrendikedir (bkz. Bölüm 4.3 Kontrendikasyonlar). Varfarin/FenprokumonRiociguat ve varfarin ile eşzamanlı tedavi, antikoagülana bağlı protrombin zamanını değiştirmemiştir. Riociguatın diğer kumarin türevleri (örn. fenprokumon) ile eşzamanlı uygulanmasının da protrombin zamanını değiştirmesi beklenmemektedir. Riociguat ve CYP2C9 substratı varfarin arasında karşılıklı farmakokinetik etkileşimler olmadığı in vivokoşullarda gösterilmiştir.Asetil salisilik asitRiociguat insanlarda ne asetilsalisilik asidin neden olduğu kanama zamanı üzerinde artırıcı etki göstermiş ne de trombosit agregasyonunu etkilemiştir. Besinler ve süt ürünleri: Besinler ile klinik olarak anlamlı herhangi bir etkileşim gözlenmemiştir (bkz. Bölüm 5.2 Farmakokinetik özellikler). Özel popülasyonlara ilişkin ek bilgilerSigara kullanan kişilerde riociguat maruziyeti %50-60 oranında azalmıştır (bkz. Bölüm 5.2 Farmakokinetik özellikler). Bu nedenle, hastalara sigarayı bırakmaları tavsiye edilmelidir (bkz. Bölüm 4.2 Pozoloji ve uygulama şekli).4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: XÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)ADEMPAS gebe kadınlarda kullanıldığında fetüse zarar verebilir. Çocuk doğurma potansiyeli olan kadınların ADEMPAS tedavisine başlamadan önce, tedavi sırasında her ay ve ADEMPAS tedavisini bıraktıktan bir ay sonraki gebelik testi sonucu negatif olmalıdır. Hastalara, gebe kalmaları veya gebelikten şüphelenmeleri halinde hekim/sağlık profesyoneliyle iletişim kurmaları tavsiye edilmelidir.Çocuk doğurma potansiyeli olan kadınlar, ADEMPAS tedavisi sırasında ve ADEMPAS tedavisinden sonraki 1 ay boyunca etkili doğum kontrol yöntemleri kullanmalıdır. Hastalar, yüksek oranda etkili bir doğum kontrol yöntemi (rahim içi araç [RİA, kontraseptif implant veya tubal sterilizasyon) veya yöntemlerin kombinasyonunu (bariyer yöntemiyle birlikte hormon yöntemi veya iki bariyer yöntemi) kullanmayı tercih edebilir. Seçilen doğum kontrol yöntemi partnere vazektomi uygulanmasıysa, bu yöntemle birlikte hormon veya bariyer yöntemi de kullanılmalıdır. Fetüse yönelik risk veya hastaya hangi doğum kontrol yönteminin önerilmesi gerektiği konusunda herhangi bir şüphe olması halinde, bir kadın doğum uzmanına danışılması tavsiye edilir. Gebelik dönemiRiociguatın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3 Klinik öncesi güvenlilik verileri).Bu nedenle ADEMPAS gebelik döneminde kontrendikedir (bkz. Bölüm 4.3 Kontrendikasyonlar). Laktasyon dönemiRiociguatın emziren kadınlarda kullanımına ilişkin veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalardan elde edilen veriler, riociguatın sütle atıldığını göstermektedir.Emzirilen çocuklarda ciddi advers reaksiyonların ortaya çıkma olasılığı nedeniyle, ADEMPAS emzirme döneminde kullanılmamalıdır. Emzirmenin durdurulup durdurulmayacağına ya da tedavinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, tedavinin emziren anne açısından faydası dikkate alınmalıdır. Üreme yeteneği/Fertiliteİnsanlarda riociguatın fertilite üzerindeki etkilerini değerlendirmek için spesifik bir çalışma gerçekleştirilmemiştir. Sıçanlar üzerinde yapılan bir çalışmada erkek ve dişi fertilitesi üzerinde herhangi bir etki görülmemiştir (bkz. Bölüm 5.3 Klinik öncesi güvenlilik verileri).4.7. Araç ve makine kullanımı üzerindeki etkilerBaş dönmesi bildirilmiştir, araç ve makine kullanma yeteneğini etkileyebilir (bkz. Bölüm 4.8 İstenmeyen etkiler). Hastalar araç veya makine kullanmadan önce, ADEMPAS'a nasıl tepki verdiklerinin farkında olmalı ve gerekiyorsa hekimlerine başvurmalıdırlar.4.8. İstenmeyen etkilerGüvenlilik profilinin özetiADEMPAS'ın güvenliliği, en az bir riociguat dozu almış olan 650'nin üzerinde KTEPH veya PAH hastasının yer aldığı faz III çalışmalarda değerlendirilmiştir (bkz. Bölüm 5.1 Farmakodinamik özellikler). ADEMPAS'ın güvenlilik profilinin her iki popülasyonda benzer olduğu görülmüş olduğundan, plasebo kontrollü, 12 ve 16 haftalık klinik çalışmalarda tanımlanan advers ilaç reaksiyonları (AİR'ler) aşağıdaki listede birleştirilmiş sıklıklar şeklinde gösterilmektedir. İstenmeyen etkilerin büyük çoğunluğuna vaskülatürde veya gastrointestinal sistemde düz kas hücrelerinin relaksasyonu neden olmuştur. En yaygın olarak bildirilen, ADEMPAS ile tedavi edilen (günde üç kez 2.5 mg'a kadar) hastaların >%10'unda ortaya çıkan advers reaksiyonlar şunları içermiştir: baş ağrısı, baş dönmesi, dispepsi ve gastrit, periferik ödem, bulantı, diyare ve kusma. Kontrolsüz, uzun süreli uzatma çalışmalarındaki daha uzun süreli gözlemlerde güvenlilik profili, plasebo kontrollü faz III çalışmalarında gözlenene benzer olmuştur. ADEMPAS ile tedavi edilen KTEPH veya PAH hastalarında ciddi hemoptizi ve pulmoner hemoraji (ölümle sonuçlanan vakalar dahil) gözlenmiştir (bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Pivotal, plasebo kontrollü çalışmalarda bir advers olay (AO) nedeniyle çalışmalardan ayrılmaların genel oranları, tüm tedavi kollarında düşüktür (Birleştirilmiş veriler: ADEMPAS için %2.9 ve plasebo için %5.1). Advers reaksiyonların listesiADEMPAS ile gözlenen advers ilaç reaksiyonları, aşağıda listelenmektedir. Advers ilaç reaksiyonları, sistem organ sınıfına göre sınıflandırılmaktadır (MedDRA versiyon [15.0]). Belli bir reaksiyonu, eşanlamlılarını ve ilişkili durumları tanımlamak için en uygun MedDRA terimi kullanılmıştır. Klinik çalışmalarda bildirilen advers ilaç reaksiyonları sıklıklarına göre sınıflandırılmaktadır. Şu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Faz III çalışmalarındaki hastalarda bildirilen tedaviye bağlı tüm advers ilaç reaksiyonları (birleştirilmiş CHEST 1 ve PATENT 1 verileri): Enfeksiyonlar ve enfestasyonlarYaygın: GastroenteritKan ve lenf sistemi hastalıklarıYaygın: Anemi (ilgili laboratuvar parametreleri dahil)Sinir sistemi hastalıklarıÇok yaygın: Baş dönmesi, baş ağrısıKardiyak hastalıklarYaygın: PalpitasyonlarVasküler hastalıklarÇok yaygın: HipotansiyonSolunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Hemoptizi, epistaksis, nazal konjesyon Yaygın olmayan: Pulmoner hemoraji*Gastrointestinal hastalıklarÇok yaygın: Dispepsi ve gastrit, diyare, bulantı, kusmaYaygın: Gastroözofageal reflü hastalığı, disfaji, gastrointestinal ve abdominal ağrılar, konstipasyon, abdominal distansiyon Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: Periferik ödem* Kontrolsüz tasarımlı, uzun süreli uzatma çalışmalarında ölümcül pulmoner hemoraji bildirilmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr;[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99).4.9 Doz aşımı ve tedavisiDikkatsizlik sonucu, 2-32 gün arasında günlük toplam 9-25 mg riociguat doz aşımı vakaları bildirilmiştir.Advers reaksiyonlar, daha düşük dozlarda görülenlerle benzer olmuştur (bkz. Bölüm 4.8 İstenmeyen etkiler). Spesifik bir antidotu mevcut değildir. Doz aşımı durumunda, gerektiği şekilde standart destekleyici önlemler alınmalıdır. Belirgin hipotansiyon durumunda aktif kardiyovasküler destek gerekebilir. Riociguatın plazma proteinine yüksek oranda bağlanma özelliği nedeniyle, diyalizle uzaklaştırılması beklenmemektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Kardiyovasküler ATC kodu: C02KX05Etki mekanizması/Farmakodinamik etkiler: Riociguat, nitrik oksit (NO) reseptörü ve kardiyopulmoner sistemde bir enzim olan çözünür guanilat siklaz (sGC) uyarıcısıdır. NO, sGC'ye bağlandığında, bu enzim sinyalleyici molekül siklik guanozin monofosfat (cGMP) sentezini katalize eder. Hücre içi cGMP; vasküler tonusu, proliferasyonu, fibrozu ve inflamasyonu etkileyen düzenleyici proseslerde önemli bir rol oynar. Pulmoner hipertansiyon; endotel disfonksiyon, bozulmuş nitrik oksit sentezi ve NO-sGC-cGMP yolağının yetersiz uyarılması ile ilişkilidir. Riociguat, ikili etki mekanizmasına sahiptir. NO-sGC bağlanmasını stabilize ederek sGC'yi endojen NO'ya duyarlı hale getirir. Riociguat ayrıca NO'dan bağımsız olarak, farklı bir bağlanma bölgesi yoluyla sGC'yi doğrudan uyarır. Riociguat, NO-sGC-cGMP yolağında iyileşme sağlayarak cGMP üretiminde artışa yol açar. Klinik etkililik: KTEPH hastalarında etkililikÇalışma tasarımıKTEPH hastalarında randomize, çift kör, çok-uluslu, çok-merkezli, plasebo kontrollü bir faz III çalışma (CHEST-1) gerçekleştirilmiştir. Çalışmaya, ameliyata uygun olmayan (bağımsız bir karar kurulunca değerlendirildiği üzere) ya da pulmoner endarterektomi (PEA) sonrasında dirençli veya nükseden KTEPH'li hastalar alınmıştır. Hasta popülasyonu, 18 ila 80 yaş arası erkek ve kadın hastalardan oluşmuştur. Hastaların %72'si ameliyata uygun olmayan KTEPH, %28'i ise PEA sonrasında dirençli veya nükseden KTEPH hastasıdır. Hastaların büyük çoğunluğunda çalışma başlangıcında DSÖ Fonksiyonel Sınıfın II (%31) veya III (%64) olduğu belirlenmiştir. Başlangıçtaki ortalama altı dakikalık yürüme mesafesi (6DYM) 347 metredir. Hastaların hiçbiri önceden tedavi almamıştır (PAH'a spesifik ilaçlar hariç tutulmuştur). CHEST-1'e tedavi uygulanmış ve güvenlilik değerlendirmesi açısından uygun 261 hasta alınmış olup bu hastalar, iki tedavi grubundan birine randomize edilmişlerdir: riociguat ile günde üç kez 2.5 mg'a kadar bireysel doz titrasyonu (BDT) (n=173, riociguat grubu olarak adlandırılmaktadır) veya plasebo (n=88). Sekiz haftalık titrasyon fazı süresince riociguat dozu, hastanın sistolik kan basıncı ve hipotansiyon belirti veya semptomlarına dayalı olarak 2 haftada bir titre edilmiştir. Titrasyon sonunda bireyselleştirilmiş bir doza ulaşılmıştır. Etkililik sonlanım noktaları:Tüm p-değerleri katmanlı Wilcoxon testine dayanmıştır (farklı bir test belirtilmediği sürece). Tüm %95 Güven Aralığı (GA) ve tedavi etkileri için eşdeğişken analizi (ANCOVA) esas alınmıştır. Birincil sonlanım noktası:Birincil sonlanım noktası, 16. haftada (son vizit) 6DYM'de başlangıca göre, plasebo ile karşılaştırmalı değişikliktir. 2. haftadan itibaren yürüme mesafesinde düzelmeler açıkça görülmüş ve 16. haftada (n=261) riociguat grubunda 6DYM'deki artış plasebo ile karşılaştırıldığında 46 m olmuştur (%95 GA: 25 m ila 67 m; p<0.0001) (ITT analizi, bkz. Tablo 1). Değerlendirilen tüm alt gruplarda plasebo karşısında riociguat ile daha fazla düzelmeler gözlenmiştir. Ameliyata uygun olmayan hastalar (n=189) 6DYM'de 54 m'lik bir artış gösterirken (%95 GA: 29 m ila 79 m), PEA sonrasında dirençli veya nükseden KTEPH'li hastalarda (n=72) 6DYM'deki artış 27 m olmuştur (%95 GA: -10 m ila 63 m). Tablo 1: CHEST-1 çalışmasında 16. haftada (son vizit: ITT analiz seti) riociguatın 6DYM üzerindeki etkileri
İkincil sonlanım noktaları:Yürüme mesafesindeki düzelmelere ek olarak klinik olarak anlamlı ikincil sonlanım noktalarında istikrarlı düzelmeler elde edilmiştir. Aşağıdaki ikincil etkililik değişkenlerinde plasebo grubuna kıyasla riociguat grubu için istatistiksel olarak anlamlı düzelme gösterilmiştir: Pulmoner vasküler direnç (PVR): Anlamlı düzeyde azalmış PVR (p<0.0001, başlangıca göre plasebo için düzeltilmiş ortalama değişiklik: -246 dyn*s*cm"5; %95 GA -303 ila -190; p<0.0001; bkz. Tablo 2). NT-proBNP: Anlamlı düzeyde azalmış NT-proBNP (başlangıca göre plasebo için düzeltilmiş ortalama değişiklik -444 ng/L, GA -843 ila -45; bkz. Tablo 2). DSÖ fonksiyonel sınıfı: 16. haftada (son vizit) plasebo grubuna (%15) kıyasla riociguat grubunda (%33) en az bir fonksiyonel sınıf şeklinde anlamlı düzelme olmuş ve en az bir fonksiyonel sınıf azalması riociguat grubundaki hastaların %5'inde, plasebo grubunun ise %7'sinde görülmüştür (p = 0.0026; bkz. Tablo 3). Fonksiyonel sınıf, riociguat grubundaki hastaların %62' sinde, plasebo grubundakilerin ise %78'inde değişmemiştir. Aşağıdakiler için riociguat grubu lehine etki gösterilmiştir (hiyerarşik testlerin sınırlamasıyla1): Klinik kötüleşmeye kadar geçen süre: Plasebo ile tedavi edilen hastalara kıyasla riociguat ile tedavi edilen hastalarda klinik kötüleşmeye kadar geçen süre uzamıştır (p = 0.1724; Katmanlı log-sıra testi). 16. haftada (son vizit) plasebo (%5.7) ile karşılaştırıldığında riociguat ile tedavi edilen hastalarda (%2.3), klinik kötüleşme vakalarının daha düşük insidansta olması yönünde bir eğilim gözlenmiştir (p = 0.2180, Mantel-Haenszel tahmini, bkz. Tablo 4, bkz. Şekil 1). Borg CR 10 ölçeği: Borg CR 10 ölçeğinde düzelme (riociguat için -0.8'e kıyasla plasebo için +0.2, p = 0.0035). Avrupa yaşam kalitesi (EQ-5D): EQ-5D'de düzelme (başlangıca göre değişiklik 0.13; %95 GA 0.06 ila 0.21; p<0.0001). Pulmoner Hipertansiyon ile Yaşama (LPH): LPH'de düzelme (başlangıca göre değişiklik -5.8; p = 0.1220; %95 GA -10.45 ila -1.06).
Tablo 3: CHEST-1 çalışmasında 16. haftada (son vizit, ITT analiz seti) riociguatın Fonksiyonel Sınıftaki değişiklik üzerindeki etkileri
Tablo 4: CHEST-1 çalışmasında riociguatın klinik kötüleşme vakaları üzerindeki etkileri (ITT analizi seti)
Not: Hastalar birden fazla klinik kötüleşme vakası yaşamış olabilir. Şekil 1: Klinik kötüleşmeye kadar geçen sürenin CHEST-1 Kaplan-Meier grafiği(Bay 63-2521 = Riociguat; ITT analiz seti)100.0% 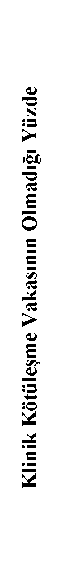
900%80.0% 700%500%40.0% 300%10.0%
2S 42
56
S4
14
¦'2
Bay 63-2521 Bireysel Titrasyon Plasebo
Log-Sıra P-Değeri: 0.1724
T 55 70Tedavinin Başlangıcından Sonraki GünHemodinamik parametreler:Kapsamlı bir kardiyopulmoner hemodinamik veri grubu oluşturmak üzere, plasebo kontrollü çalışmanın başında ve sonunda 233 hastada sağ kalp kateterizasyonu gerçekleştirilmiştir (bkz. Tablo 5). Plasebo ile karşılaştırıldığında riociguat grubunda istatistiksel olarak anlamlı derecede PVR'de (yukarıya bakınız) ve ortalama pulmoner arter basıncında (PAPort) azalma (-5.0 mmHgf p<0.0001) ve kardiyak indekste artış (0.47 L/dak/m2; p<0.0001) gösterilmiştir. Yukarıda tanımlanan hemodinamik değişkenlerde görülen düzelme, diğer ilişkili hemodinamik parametrelerde de gözlenmiştir. Tablo 5: CHEST-1, başlangıç ile son vizit arasında hemodinamik parametrelerdeki değişim: Riociguat 1.0-2.5 mg (RIO) ve plasebo (PBO) karşılaştırması (ITT analiz seti)
Diğer tüm parametreler, önceden sonlanım noktası olarak tanımlanmamıştır. Uzun süreli KTEPH tedavisiCHEST-1 çalışmasını tamamlayan 237 hasta, açık etiketli bir uzatma çalışmasına (CHEST-2) dahil edilmiştir. Sonlandırma tarihinde ortalama tedavi süresi 388 gün olup, medyan süre 336 gündür (aralık: 15 ila 989 gün) ve toplam riociguat maruziyeti 206 hasta yılıdır. CHEST-2 çalışmasında, 6DYM ve fonksiyonel sınıfta ek düzelmeler gözlenmiştir. Bir yılda sağkalım olasılığının %98 olduğu belirlenmiştir. PAH hastalarında etkililikÇalışma tasarımıDaha önceden tedavi edilmemiş olan ya da bir endotelin reseptör antagonisti (ERA) veya bir prostasiklin analoğu (inhale, oral veya subkütan) ile önceden tedavi almış olan PAH hastalarında randomize, çift kör, çok uluslu, çok merkezli, plasebo kontrollü bir faz III çalışma (PATENT-1) gerçekleştirilmiştir. Genel hasta popülasyonu, idiyopatik PAH (%61), ailesel PAH (%2), bağ dokusu hastalığı ile ilişkili PAH (%25), konjenital kalp hastalığı (%8), portal hipertansiyon (%3) ve anoreksijen veya amfetamin kullanımına bağlı PAH (%1) tanılarından birine sahip 18 ila 80 yaş arasında, erkek ve kadın hastalardan oluşmuştur. Hastaların büyük çoğunluğunda çalışma başlangıcında DSÖ Fonksiyonel Sınıfının III (%54) veya II (%42) olduğu belirlenmiştir. Genel ortalama başlangıç 6DYM değeri 363 metredir. Hastaların %50'si daha önceden tedavi edilmemiş, %44'ü ERA'lar ile önceden tedavi almış, %6'sı ise tek başına prostasiklin analogları ile tedavi edilmiştir. PATENT-1'e tedavi uygulanan ve güvenlilik değerlendirmesi açısından uygun 443 hasta alınmış olup bu hastalar, üç tedavi grubundan birine randomize edilmiştir: riociguat ile günde üç kez 2.5 mg'a kadar bireysel doz titrasyonu (n=254); plasebo (n=126); ve günde üç kez 1.5 mg'a kadar üst sınırlı doz titrasyonu (n=63; araştırma amaçlı doz kolu; istatistiksel değerlendirme yapılmamıştır). Sekiz haftalık titrasyon fazı boyunca riociguat dozu, hastanın sistolik kan basıncı ve hipotansiyon belirti veya semptomlarına dayalı olarak 2 haftada bir titre edilmiştir. Titrasyon sonunda bireyselleştirilmiş bir doza ulaşılmıştır. Etkililik sonlanım noktaları:Daha önceden tanımlanmış birincil analiz, plaseboya karşı riociguat 2.5 mg tedavi kolu (riociguat grubu olarak adlandırılmaktadır) ile yapılmıştır. Tüm p-değerleri katmanlı Wilcoxon testine dayanmıştır (farklı bir test belirtilmediği sürece). Tüm %95 GA ve tedavi etkileri için eşdeğişken analizi (ANCOVA) esas alınmıştır. Birincil sonlanım noktası:Birincil sonlanım noktası, 12. haftada (son vizit) 6DYM'de başlangıca göre, plasebo ile karşılaştırmalı değişikliktir. 2. haftadan itibaren yürüme mesafesinde düzelmeler açıkça görülmüş ve 12. haftada riociguat grubunda plasebo ile karşılaştırıldığında 36 m olmuştur (%95 GA: 20 m ila 52 m; p<0.0001) (ITT analizi, bkz. Tablo 6). Değerlendirilen tüm alt gruplarda plaseboya kıyasla riociguat ile daha fazla düzelmeler gözlenmiştir. Daha önceden tedavi edilmemiş hastalarda (n=189) 6DYM'de 38 m'lik artış olmuştur (%95 GA: 14 m ila 62 m). Daha önceden tedavi edilmiş hastalar (n=191) 6DYM'de 36 m'lik artış göstermiştir (%95 GA: 15 m ila 56 m). Önceden ERA'larla tedavi edilmiş olan hastalarla (n=167) yapılan ileri alt grup analizi, 26 m'lik bir tedavi etkisi tahmini ortaya koymuştur (%95 GA: 5 m ila 46 m). Daha önceden prostasiklin analogları ile tedavi edilmiş hastalarda (n=272), tedavi etkisi tahmini 101 m olmuştur (%95 GA: 27 m ila 176 m).
İkincil sonlanım noktaları:Yürüme mesafesindeki düzelmelere ek olarak klinik olarak anlamlı ikincil sonlanım noktalarında istikrarlı düzelmeler elde edilmiştir. Aşağıdaki ikincil etkililik değişkenlerinde plasebo grubuna kıyasla riociguat grubu için istatistiksel olarak anlamlı düzelme gösterilmiştir: Pulmoner Vasküler Direnç (PVR): Anlamlı düzeyde azalmış PVR (p<0.0001, başlangıca göre plasebo için düzeltilmiş ortalama değişiklik: -226 dyn3s*cm-5; %95 GA -281 ila -170; p<0.0001; bkz. Tablo 7). NT-proBNP: Anlamlı düzeyde azalmış NT-proBNP (başlangıca göre plasebo için düzeltilmiş ortalama değişiklik -432 ng/L, %95 GA -782 ila -82; bkz. Tablo 7). DSÖ fonksiyonel sınıfı: 12. haftada (son vizit) plasebo grubuna (%14) karşın riociguat grubunda (%21) en az bir fonksiyonel sınıf şeklinde anlamlı düzelme olmuş ve riociguat grubundaki hastaların %4'ünde, plasebo grubunun ise %14'ünde en az bir fonksiyonel sınıf azalması görülmüştür (p = 0.0033; bkz. Tablo 8). Fonksiyonel sınıf, riociguat grubundaki hastaların %76'sında, plasebo grubundakilerin ise %71'inde değişmemiştir. (%6.3) ile karşılaştırıldığında riociguat ile tedavi edilen hastalarda (%1.2), anlamlı düzeyde daha az klinik kötüleşme vakası gözlenmiştir. (p = 0.0285, Mantel-Haenszel tahmini, bkz. Tablo 9, bkz. Şekil 2). Borg CR 10 ölçeği: Borg CR 10 ölçeğinde anlamlı düzelme (riociguat için -0.4'e kıyasla plasebo için +0.1, p = 0.0022; bkz. Tablo 7). Hastaların sağlığı açısından aşağıdakiler için riociguat grubu lehine etki gösterilmiştir (hiyerarşik testlerin sınırlamasıyla4): Avrupa yaşam kalitesi (EQ-5D): Başlangıca göre değişiklik 0.06; %95 GA 0.01 ila 0.11; p = 0.0663). Pulmoner Hipertansiyon ile Yaşama (LPH): LPH'de düzelme (başlangıca göre değişiklik -6.2; p = 0.0019; %95 GA -9.8 ila -2.5). Tablo 7: PATENT-1 çalışmasında 12. haftada (son vizit) riociguatın PVR, NT-proBNP ve Borg CR 10 ölçeği üzerindeki etkileri
Tablo 8: PATENT-1 çalışmasında 12. haftada (son vizit; ITT analiz seti) riociguatın Fonksiyonel Sınıftaki değişiklik üzerindeki etkileri
Tablo 9: PATENT-1 çalışmasında riociguatın klinik kötüleşme vakaları üzerindeki etkileri (ITT analizi seti)
Not: Hastalar birden fazla klinik kötüleşme vakası yaşamış olabilir. Şekil 2: Klinik kötüleşmeye kadar geçen sürenin PATENT-1 Kaplan-Meier grafiği (Bay 63-2521 = Riociguat; ITT analiz seti)
100.0% -
90.0%
N -3 aS O fl s >ZJS 5^ S ri'S
80.0%
70.0% -
60.0% -
50.0%
40.0%
30.0% - 20.0%
Log-Sıra P-Değeri: 0.0046
10 .%
Bay 63-2521 Bireysel Titrasyon Plasebo 00% -
14
28
42
56
70
S 4 Tedavi Başlangıcından Sonraki GünHemodinamik parametreler:Kapsamlı bir kardiyopulmoner hemodinamik veri grubu oluşturmak üzere, plasebo kontrollü çalışmanın başında ve sonunda 339 hastada sağ kalp kateterizasyonu gerçekleştirilmiştir (bkz. Tablo 10). Plasebo ile karşılaştırıldığında riociguat grubunda istatistiksel olarak anlamlı olmak üzere PVR'de (yukarıya bakınız) ve ortalama pulmoner arter basıncında (P APort) (-3.8 mmHgf p<0.0001) azalma ve kardiyak indekste artış (0.56 L/dak/m2; p<0.0001) gösterilmiştir. Yukarıda tanımlanan hemodinamik değişkenlerde görülen düzelme diğer ilişkili hemodinamik parametrelerde de gözlenmiştir. Tablo 11: PATENT-1; başlangıç ile son vizit arasında hemodinamik parametrelerdeki değişim: riociguat 1.0-2.5 mg (RIO) ile plasebo (PBO) karşılaştırması - ITT analiz seti
Diğer tüm parametreler, önceden sonlanım noktası olarak tanımlanmamıştır. Uzun süreli PAH tedavisiPATENT-1 çalışmasını tamamlayan 363 hasta, açık etiketli bir uzatma çalışmasına (PATENT-2) dahil edilmiştir. PATENT-2'de sonlandırma tarihinde ortalama tedavi süresi 438 gün olup, medyan süre 441 gündür (aralık: 1 ila 1078 gün) ve toplam riociguat maruziyeti 436 hasta yılıdır. PATENT-2 çalışmasında, 6DYM ve fonksiyonel sınıfta ek düzelmeler gözlenmiştir. Bir yılda sağkalım olasılığının %96 olduğu belirlenmiştir. 5.2. Farmakokinetik özelliklerGenel ÖzelliklerEmilim:Riociguatın mutlak biyoyararlanımı yüksektir (%94). Riociguat hızla emilir ve maksimum konsantrasyonlara (Cmaks), tablet alındıktan 1-1.5 saat sonra ulaşılır. Riociguatın yiyeceklerle birlikte alınması, EAA'sını değiştirmez. Cmaks değeri az miktarda azalmıştır (%35 düşüş). Bu düşüşün, klinik açından anlamlı olduğu düşünülmemektedir. Bu nedenle ADEMPAS yemeklerle birlikte ya da ayrı olarak alınabilir. Dağılım:İnsanlarda plazma proteinine bağlanma yüksek oranda olup, yaklaşık %95'tir ve esas olarak serum albümin ve a1-asidik glikoproteine bağlanmaktadır. Dağılım hacmi orta düzeyli olup, kararlı durumdaki dağılım hacmi yaklaşık 30 L'dir. Biyotransformasyon:CYP 1A1, CYP 3A4, CYP 2C8 ve CYP 2J2 tarafından katalize edilen N-demetilasyon riociguatın majör biyotransformasyon yolağı olup, dolaşımdaki başlıca aktif metabolitini oluşturmakta (farmakolojik aktivite: riociguatın onda biri ila üçte biri) ve bu metabolit daha sonra farmakolojik olarak inaktif olan N-glukuronide metabolize olmaktadır. CYP1A1, karaciğerde ve akciğerlerde riociguatın ana metabolitinin oluşumunu katalize etmektedir ve CYP1A1'in örneğin sigara dumanında bulunan polisiklik aromatik hidrokarbonlarla indüklenebildiği bilinmektedir. Eliminasyon:Toplam riociguat (ana bileşik ve metabolitleri) hem böbrekler (%33-45) hem de safra/feçes yoluyla (%48-59) atılır. Uygulanan dozun yaklaşık %4 ila %19'u böbrekler yoluyla değişmemiş riociguat şeklinde atılmaktadır. Uygulanan dozun yaklaşık %9-44'ü feçeste değişmemiş riociguat şeklinde bulunmuştur. İn vitroverilere göre, riociguat ve ana metaboliti, P-gp ve BCRP taşıyıcı proteinlerinin substratlarıdır.Riociguat yaklaşık 3-6 L/saatlik sistemik klerens ile, düşük klerensli ilaç olarak sınıflandırılabilir. Eliminasyon yarılanma ömrü sağlıklı bireylerde yaklaşık 7 saat, hastalarda ise yaklaşık 12 saattir. Doğrusallık/doğrusal olmayan durum:Riociguatın farmakokinetiği 0.5 mg ila 2.5 mg aralığında doğrusaldır. Tüm dozlarda riociguat maruziyetinde (EAA) bireylerarası değişkenlik (%CV) yaklaşık %60'tır. Hastalardaki karekteristik özelliklerGeriyatrik hastalar:Yaşlı hastalarda (>65 yaş), plazma konsantrasyonlarının daha genç hastalara kıyasla daha yüksek olduğu görülmüş, özellikle toplam (görünür) ve renal klerensindeki azalma edeniyle olmak üzere, ortalama EAA değeri yaşlılarda yaklaşık %40 daha yüksek bulunmuştur (bkz. Bölüm 4.2 Pozoloji ve uygulama şekli). Karaciğer yetmezliği olan hastalar:Hafif derecede karaciğer yetmezliği (Child Pugh A olarak sınıflandırılmış) olan sirozlu bireylerdeki maruziyette klinik olarak anlamlı herhangi bir değişiklik olmamıştır. Orta derecede karaciğer yetmezliği (Child Pugh B olarak sınıflandırılmış) olan sirozlu bireylerde riociguatın ortalama EAA değeri, sağlıklı kontroller ile karşılaştırıldığında %50-70 oranında artmıştır (bkz. Bölüm 4.2 Pozoloji ve uygulama şekli). Ciddi karaciğer yetmezliği (Child Pugh C olarak sınıflandırılmış) olan hastalara ilişkin veri bulunmamaktadır. Bu nedenle ADEMPAS'ın bu hastalarda kullanılması önerilmemektedir (bkz. Bölüm 4.2 Pozoloji ve uygulama şekli ve Bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Böbrek yetmezliği olan hastalar:Genel olarak, riociguat için doza ve beden ağırlığına normalize edilen ortalama maruziyet değerleri, böbrek fonksiyonları normal olan bireyler ile karşılaştırıldığında böbrek yetmezliği olan bireylerde daha yüksek bulunmuştur. Aynı değerlerin ana metabolit için sağlıklı bireyler ile karşılaştırıldığında böbrek yetmezliği olan bireylerde daha yüksek olduğu belirlenmiştir. Hafif (kreatinin klerensi 80-50 mL/dak), orta (kreatinin klerensi <50-30 mL/dak) veya ciddi (kreatinin klerensi <30 mL/dak) böbrek yetmezliği olan hastalarda, riociguat plazma konsantrasyonlarının (EAA) sırasıyla %43, %104 ve %44 oranında arttığı gözlenmiştir (bkz. Bölüm 4.2 Pozoloji ve uygulama şekli). Kreatinin klerensi <15 mL/dak olan ya da diyaliz tedavisi görmekte olan hastalara ilişkin veri bulunmamaktadır. Bu nedenle, ADEMPAS'ın kreatinin klerensi <15 mL/dak olan ya da diyaliz tedavisi görmekte olan hastalarda kullanılması önerilmemektedir (bkz. Bölüm 4.2 Pozoloji ve uygulama şekli ve Bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Riociguatın plazma proteinine yüksek oranda bağlanma özelliği nedeniyle, diyalizle uzaklaştırılması beklenmemektedir. Cinsiyet, etnik kökenler arası farklılıklar, beden ağırlığı kategorileri:Farmakokinetik veriler, riociguata maruziyette cinsiyet, etnik köken veya beden ağırlığına bağlı herhangi bir ilişkili fark ortaya koymamaktadır. Farmakokinetik/Farmakodinamik ilişkilerRiociguat plazma konsantrasyonları ile sistemik ve pulmoner vasküler direnç, sistolik kan basıncı ve kalp debisi gibi hemodinamik parametreler arasında doğrudan bir ilişki bulunmaktadır.5.3. Klinik öncesi güvenlilik verileriGüvenlilik farmakolojisi, tek doz toksisitesi, fototoksisite, genotoksisite ve karsinojenisiteyi kapsayan standart çalışmalar ışığında klinik dışı veriler, insanlar için spesifik bir tehlike ortaya koymamıştır.Tekrarlayan doz toksisitesi çalışmalarında gözlenen etkiler temelde riociguatın aşırı farmakodinamik aktivitesine (hemodinamik ve düz kas gevşetici etkileri) bağlı olmuştur. Riociguatın hızlı büyüyen adolesan sıçanlarda kemik oluşumu üzerindeki etkileri (genel kemik kütlesinde artış gibi) görülmüştür. Riociguatın erişkin sıçanlara uygulanmasından sonra bu tür etkiler gözlenmemiştir. Sıçanlarda erkek ve dişi fertilitesi üzerinde herhangi bir etki görülmemiştir. Sıçanlar ve tavşanlar üzerinde gerçekleştirilen gelişim toksisitesi çalışmaları, riociguatın üreme toksisitesini göstermiştir. Sıçanlarda, kardiyak malformasyon oranında artışın yanı sıra, insandaki maruziyetin (günde üç kez 2.5 mg) yaklaşık 7 katı kadarki maternal sistemik maruziyette erken rezorpsiyona bağlı olarak gestasyon oranında azalma gözlenmiştir. Tavşanlarda, insanlardaki maruziyetin (günde üç kez 2.5 mg) yaklaşık 3 katı sistemik maruziyetle başlayarak düşükler ve fetal toksisite görülmüştür. Sıçanlarda, insan maruziyetinin 7 katına kadarki dozlara karşılık genel sistemik maruziyette ADEMPAS karsinojenik etki göstermemiştir. Fareler üzerinde gerçekleştirilen karsinojenisite çalışmasında, insan terapötik maruziyetine yakın maruziyet düzeylerinde bozulmuş gastrointestinal motilite, disbiyoz ve kronik inflamasyon, bunları takiben mukoza dejenerasyonu ve reaktif hiperplazi ve ayrıca intestinal tümörlerde istatistiksel olarak anlamlı olmayan bir artış görülmüştür. Bu olaylar dizisi, farelerde inflamasyon ve dejenerasyon gibi uyaranlara karşı tipik bir reaksiyondur ve bu nedenle bu tümörlerin insanlar ile ilişkili olmayacağı kabul edilmektedir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiMikrokristalin selüloz Krospovidon Hipromelloz 5cP Laktoz monohidrat Magnezyum stearat Sodyum lauril sülfat Hidroksipropil selüloz Hipromelloz 3cP Propilen glikol Titanyum dioksit (E 171)Kırmızı demir oksit (E 172) Sarı demir oksit (E 172) 6.2. GeçimsizliklerBilinen herhangi bir geçimsizliği bulunmamaktadır.6.3. Raf ömrü36 ay6.4. Saklamaya yönelik özel tedbirler30°C'nin altındaki oda sıcaklığında saklayınız.6.5. Ambalajın niteliği ve içeriğiKarton kutuya yerleştirilmiş PP/Alüminyum folyo blister ambalajlarda 42 film kaplı tablet (21 tablet x 2 blister)Karton kutuya yerleştirilmiş PP/Alüminyum folyo blister ambalajlarda 84 film kaplı tablet (21 tablet x 4 blister) 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİBayer Türk Kimya San. Ltd. Şti.Fatih Sultan Mehmet Mah. Balkan Cad. No: 53 34770 Ümraniye-İstanbul Tel: 0216 528 36 00 Faks: 0216 645 39 50 8. RUHSAT NUMARASI2014/3689. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 08.05.2014 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriAdempas 2 Mg Film Kaplı TabletEtken Maddesi: Riociguat Atc Kodu: C02KX05 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.