Tisseel Lyo 1ml Trombin Çözeltisi Ve 1ml Fibrinoj... Kısa Ürün BilgisiKan ve Kan Yapıcı Organlar » Kanama Durdurucu İlaçlar » K Vitamini ve Diğer Hemostatikler » Local hemostatics KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADI TISSEEL LYO, 1mL Trombin Çözeltisi ve 1mL Fibrinojen Çözeltisi İçeren İki Bileşenli Fibrin Yapıştırıcı 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin maddeler: 1 mL yapıştırıcı protein çözeltisi (Flakon 1 ve 2): - İnsan fibrinojeni (pıhtılaşabilir protein) 72-110 mg1/mL - Aprotinin (sentetik) 3000 KIU2/mL 1 mL trombin çözeltisi (Flakon 3 ve 4): - İnsan trombini 500 IU(3/mL (45-55 mg/mL total protein içinde) - Kalsiyum klorür 40 mikromol/mL Her TISSEEL LYO kutusunda, ikisi liyofilize kuru toz (Flakon 1 ve 3), ikisi çözücü (Flakon 2 ve 4) içeren dört flakon bulunur. Flakon 1: Liyofilize edilmiş, buharla ısıtılmış, solvent/deterjan uygulanmış, insan kaynaklı yapıştırıcı protein konsantresi Flakon 2: 3000 KIU(1)/mL liyofilize sentetik aprotinin içeren aprotinin çözeltisi (yapıştırıcı protein konsantresi için çözücü) Flakon 3: Liyofilize edilmiş buharla ısıtılmış, solvent/deterjan uygulanmış insan trombini. Flakon 4: Kalsiyum klorür çözeltisi (trombin çözeltisi oluşturmak için çözücü) Yardımcı maddeler: 1 mL yapıştırıcı protein çözeltisi (Flakon 1 ve 2): - Polisorbat 80: 0.6 - 1.9 mg/mL Diğer yardımcı maddeler için, bkz. 6.1. 3. FARMASÖTİK FORM Yapıştırıcı çözelti hazırlamak için kuru toz ve renksiz ya da soluk sarı renkli ve berrak ya da hafif opalesan çözeltiler. 4. KLİNİK ÖZELLİKLER 4.1. Terapötik endikasyonlar Standart cerrahi tekniklerin yetersiz kaldığı şu durumların destekleyici tedavisinde endikedir (Bkz. Bölüm 5.1): - Daha iyi bir hemostaz sağlanmasında - Doku yapıştırıcı olarak damar cerrahisi, gastrointestinal anastomozlar ile serebrospinal sıvı veya duramater ile temas oluşabilen beyin cerrahisi ve diğer cerrahi girişimlerde (örn. KBB, göz ve spinal cerrahi) yara iyileşmesi veya sütür desteği için. - Ayrılmış dokuların (örn. doku flepleri, greftler, split skin greftler [mesh greftler]) yapıştırma/sızdırmazlığı güçlendirmek için. Tam heparinize hastalarda etkinliği kanıtlanmıştır. 4.2. Pozoloji ve uygulama şekli TISSEEL LYO yalnızca bu konuda deneyimli hekimler tarafından kullanılmalıdır. Pozoloji / Uygulama sıklığı ve süresi Uygulanacak TISSEEL LYO miktarı ve uygulama sıklığı hastanın klinik gereksinimine göre belirlenmelidir. Uygulanacak dozu, cerrahi girişimin şekli, etkilenen alanın büyüklüğü, uygulamanın nasıl yapılacağı ve uygulama sayısı belirler. Ürünün uygulanma dozu tedaviyi uygulayan hekim tarafından bireysel olarak belirlenmelidir. Klinik çalışmalarda bireysel dozlar 4 ile 20 mL arasında değişmektedir. Bazı prosedürler (örn., karaciğer travması ya da geniş yanık alanlarının sızdırmazlığının sağlanması için yapılanlar) daha yüksek hacimler gerektirebilir. Başlangıç uygulamasının yapışma sağlanması istenen anatomik bölge ya da hedeflenen yüzeyi kaplayacak miktarlarda ürün kullanılarak yapılması önerilir. Gerekirse uygulama tekrarlanabilir. Ancak TISSEEL LYO polimerize olmuş bir tabakaya yapışmayacağından, daha önceden polimerize olmuş bir TISSEEL LYO tabakası üzerine yeniden uygulanmasından kaçınılmalıdır. Yapıştırılacak yüzeyler için bir rehber olmak üzere 1 kutu TISSEEL LYO, 1mL Trombin Çözeltisi ve 1mL Fibrinojen Çözeltisi İçeren İki Bileşenli Fibrin Yapıştırıcı (1 mL yapıştırıcı protein çözeltisi + 1mL trombin çözeltisi) en az 10 cm2 lik bir alan için yeterli olacaktır. TISSEEL LYO spreyleme yöntemiçok daha geniş yüzeylerikaplamak için yeterli olacaktır.Aşırı granülasyon dokusunun oluşumunun önlenmesi ve katılaşmış fibrin yapıştırıcının dereceli absorpsiyonun sağlanması için TISSEEL LYO sadece ince bir tabaka halinde uygulanmalıdır. Uygulama şekli: Yalnızca epilezyonel kullanım içindir. Çözeltiyi bölüm 6.6'da tarif edildiği şekilde hazırlayınız. TISSEEL LYO'nun spreyleme yöntemi ile optimum güvenli kullanımının sağlanması için, aşağıdaki öneriler dikkate alınmalıdır: Açık yara cerrahisinde - en fazla 2.0 bar (28.5 psi) basınç uygulayan bir basınç regülatör cihazı kullanılmalıdır. Minimal invazif/laparoskopik prosedürlerde - en fazla 1.5 bar (22 psi) basınç uygulayan ve yalnızca karbondioksit gazı kullanılan bir basınç regülatör cihazı kullanılmalıdır. TISSEEL LYO uygulanmadan önce, yaranın yüzey alanı standart teknikler kullanılarak (örn. aralıklı şekilde kompres, eküvyon, aspirasyon cihazları kullanımı) kurutulmalıdır. TISSEEL LYO talimatlara göre sulandırılmalı ve bu ürün için önerilen cihazlarla uygulanmalıdır (Bkz. bölüm 6.6). Spreyleme yöntemi için cerrahi prosedüre göre gereken basınç ve doku mesafesine yönelik spesifik öneriler ve aplikatör uçlarının uzunluğu bölüm 4.4 ve 6.6'da sunulmaktadır. Minimal hacimde fibrin doku yapıştırıcı kullanımı gerektiren cerrahi girişimlerde ürünün ilk bir kaç damlasının kullanılmayıp atılması önerilmektedir. Özel popülasyonlara ilişkin ek bilgiler Böbrek/karaciğer yetmezliği: Lokal olarak etki göstermek amacıyla geliştirilmiştir. Böbrek veya karaciğer yetmezliği olan hastalarda dozaj ayarlamasına yönelik bir çalışma bulunmamaktadır. Pediyatrik popülasyon: Ürünün güvenlilik ve etkililiği pediyatrik hastalarda değerlendirilmemiştir. Kullanılacaksa doz erişkinlerdeki gibi cerrahi girişimin şekli, alanın büyüklüğü, uygulama tipi ve sayısına göre uygulamayı yapacak hekim tarafından belirlenmelidir. Geriyatrik popülasyon: Yaşlılarda doz erişkinlerdeki gibi cerrahi girişimin şekli, alanın büyüklüğü, uygulama tipi ve sayısına göre uygulamayı yapacak hekim tarafından belirlenmelidir. 4.3. Kontrendikasyonlar TISSEEL LYO konvansiyonel cerrahi tekniklerle kontrol altına alınamayan aktif ya da masif arteriyel kanamalar ile venöz kanamalarda tek başına endike değildir. TISSEEL LYO intravasküler olarak uygulanmamalıdır. İntravasküler uygulama yaşamı tehdit edebilecek boyutta tromboembolik olaylarla sonuçlanabilir. TISSEEL LYO aprotinin dahil içeriğindeki aktif veya yardımcı maddelerden herhangi birisine karşı aşırı duyarlılık durumunda kontrendikedir. TISSEEL LYO cerrahi yaranın kapatılması amacıyla kullanılan deri sütürlerinin yerine kullanım için endike değildir. 4.4. Özel kullanım uyarıları ve önlemleri Sadece epilezyonel kullanım içindir. İntravasküler uygulanmamalıdır. Preparatın istenmeden intravasküler olarak uygulanması yaşamı tehdit edebilecek boyutta tromboembolik komplikasyonlara neden olabilir. Fibrin yapıştırıcıları basınçlı gaz ile kullanırken dikkatli olunmalıdır. Basınçlı gaz kullanılarak yapılan herhangi bir uygulamada yaşamı tehdit edebilecek boyutlarda hava veya gaz embolisi, doku yırtılması veya kompresyona neden olan gaz sıkışması riski bulunmaktadır. TISSEEL LYO'yu ince bir tabaka oluşturacak şekilde uygulayınız. Fazla pıhtı kalınlığıürünün etkinliğini ve yara iyileşme sürecini olumsuz etkileyebilir.Fibrin yapıştırıcıların uygulanması için basınç regülatörü içeren sprey cihazlarınınkullanımı ile yaşamı tehdit edebilecek olan fatal hava veya gaz embolisi meydanagelmiştir. Bu olayların sprey cihazının önerilen basınçlardan daha yüksek basınçtave/veya doku yüzeyine yakın olarak kullanımıyla ilişkili olduğu düşünülmektedir. Buriskin fibrin yapıştırıcıların CO2düşünülmektedir, dolayısıyla TISSEEL LYO açık yara cerrahisinde spreyleme yöntemiile uygulandığında bu risk göz ardı edilemez.TISSEEL LYO'yu sprey cihazı kullanarak uygularken, kullanılacak basınç düzeyi spreycihazı üreticisi tarafından önerilen basınç aralığı dahilindeki olmalıdır (basınç vemesafeler için Bölüm 6.6'daki tabloya bakınız).TISSEEL LYO sprey uygulaması yalnızca üretici tarafından önerilen sprey mesafesinindoğru şekilde belirlenmesinin mümkün olduğu durumlarda yapılmalıdır. Önerilenmesafeden daha yakın sprey uygulamayın.TISSEEL LYO'yu spreyle uygularken hava veya gaz embolisi oluşma ihtimali nedeniylekan basıncındaki değişiklikler, nabız, oksijen saturasyonu ve end tidal CO2izlenmelidir (ayrıca Bkz. Bölüm 4.2).TISSEEL LYO kapalı vücut boşlukları içinde Easy Sprey / Sprey Seti sistemleri ile kullanılmamalıdır. İstenmeyen vücut bölgelerindeki doku adezyonlarının önlenmesi için, TISSEEL LYO uygulamasından önce uygulama için belirlenen alanın dışındaki vücut bölgelerinin yeteri kadar korunduğundan / örtüldüğünden emin olunmalıdır. Fibrin yapıştırıcıların beyin ve spinal kord gibi kapalı alanların içinde uygulandığı durumlarda kompresyona bağlı komplikasyon riski dikkate alınmalıdır. Yapıştırıcı protein bileşeniyle trombin bileşeninin uygun bir şekilde karıştığından emin olmak için ürünün ilk birkaç damlasının kullanımdan hemen önce uygulama kanülünden atılması önerilir. Herhangi bir protein ürününde olduğu gibi, alerjik tipte aşırı duyarlılık reaksiyonları mümkündür. İntravasküler uygulama, duyarlı hastalarda aşırı duyarlılık reaksiyonlarının görülme riskini ve şiddetini arttırabilir. TISSEEL LYO kullanımıyla aşırı duyarlılık ve ölümcül olabilen anafilaktik şok dahil anaflaktik reaksiyonlar bildirilmiştir. Aşırı duyarlılık reaksiyonlarının belirtileri arasında ürtiker, göğüste sıkışma hissi, hırıltılı solunum ve hipotansiyon bulunur. Bu semptomlar ortaya çıkarsa uygulama derhal durdurulmalı ve şok tedavisi için geçerli mevcut standart önlemler alınmalıdır. Uygulama alanında kalan ürün temizlenmelidir. TISSEEL LYO sentetik protein (aprotinin) içermektedir. Aprotinin varlığına bağlı olarak lokal uygulamada dahi anafilaktik reaksiyon riski vardır. Daha önceki uygulamalarda iyi tolere edilmiş olsa bile tekrarlayan uygulamalarda risk daha yüksektir. Bu nedenle aprotinin veya aprotinin içeren ürün uygulamaları hasta kayıtlarına işlenmelidir. Sentetik aprotinin yapısal olarak bovin aprotinine benzediği için TISSEEL LYO'nun bovin proteinlerine allerjisi olan hastalarda kullanımı dikkatle değerlendirilmelidir. Koroner arter bypass cerrahisinde randomize olmayan iki retrospektif çalışmada, fibrin yapıştırıcı uygulanan hastalarda istatistiksel olarak anlamlı artmış mortalite riski gözlenmiştir. Her ne kadar bu hasta grubunda belirli bir neden-sonuç ilişkisi gösterilememiş olsa da TISSEEL LYO kullanımı ile artmış risk gözardı edilememektedir. Bu nedenle ürünün kazayla intravasküler uygulanmaması için azami çaba gösterilmelidir. Arteria ophtalmica bölgesinde tromboembolik komplikasyonlar oluşabileceğinden TISSEEL LYO'nun nazal mukozaya enjeksiyonundan kaçınılmalıdır. TISSEEL LYO'nun dokuya enjeksiyonu lokal doku hasarı riski içermektedir. TISSEEL LYO ince bir tabaka oluşturacak şekilde uygulanmalıdır. Fazla pıhtı kalınlığı ürünün etkinliğini ve yara iyileşmesi sürecini olumsuz etkileyebilir. Polisorbat 80 temas dermatiti gibi lokal deri iritasyonuna neden olabilir. Virüs güvenilirliği TISSEEL LYO insan plazmasından üretilmektedir. İnsan kanından ya da plazmasından elde edilen ürünler, virüsler gibi, hastalığa neden olabilecek enfeksiyon etkenlerini içerebilir. Bu ürünlerin bir enfeksiyon etkenini bulaştırma riskini azaltmak için, donör plazmaları bazı virüslerle daha önce karşılaşmış olmaya veya mevcut virüs enfeksiyonlarına karşı taranır ve inaktivasyon / uzaklaştırma işlemleri uygulanır. Bu önlemlere rağmen, bazı ürünler hastalık bulaştırabilir. Bu ürünlerde henüz bilinmeyen hastalık etkenlerinin bulunma olasılığı da mevcuttur. [ör. virüsler ve teorik olarak Creutzfeld-Jacobs hastalığı (CJD) etkeni]. HIV, HBV ve HCV gibi zarflı virüslere, HAV gibi zarfsız virüslere karşı alınan önlemler etkili olarak kabul edilir. Parvovirüs B19 gibi bazı küçük zarfsız virüsleri uzaklaştırmak ya da inaktive etmek için alınan önlemlerin etkisi ise kısıtlıdır. Parvovirus B19 virüsü en ciddi olarak gebe kadınları (fetusda enfeksiyona neden olabilmektedir), immün yetmezlikli hastaları veya artmış eritropoezi olan hastaları (örn. hemolitik anemi durumu) etkilemektedir. TISSEEL LYO her uygulandığında hasta ile ürün serisi arasındaki bağlantının korunabilmesi için, ürünün adı ve seri numarasının kaydedilmesi önemle tavsiye edilmektedir. Okside selüloz içeren preparatlar TISSEEL LYO ile birlikte kullanılmamalıdır (bkz. Bölüm 6.2. Geçimsizlikler). 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri TISSEEL LYO ile etkileşim çalışmaları yapılmamıştır. Karşılaştırılabilir ürünler veya trombin çözeltilerine benzer olarak ürün, alkol, iyot-ya da ağır metal iyonları- içeren solüsyonlarla (örn. antiseptik çözeltilerle) denatüre olabilir. TISSEEL LYO uygulamasından önce bölge bu tür maddelerden iyice temizlenmelidir. Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon Pediyatrik yaş grubunda TISSEEL LYO ile herhangi bir etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyon Genel tavsiye Gebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) TISSEEL LYO'nun çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Bilinen olumsuz bir etkisi bulunmamaktadır. Gebelik dönemi TISSEEL LYO'nun gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar gebelik/embriyonal/fötal gelişim/doğum ya da doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (Bkz. kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. TISSEEL LYO gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Parvovirüs B19 enfeksiyonu hakkında bilgi için bölüm 4.4'e bakınız. Laktasyon dönemi TISSEEL LYO'nun anne sütüne geçip geçmediği bilinmemektedir. Yapıştırıcı protein çözeltisi ve trombin çözeltisinin insan ya da hayvan sütü ile atılmasına ilişkin yetersiz/sınırlı bilgi mevcuttur. Memedeki çocuk açısından bir risk olduğu göz ardı edilemez. Emzirmenin durdurulup durdurulmayacağına ya da TISSEEL LYO tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken emzirmenin çocuk açısından faydası ve TISSEEL LYO tedavisinin emziren anne açısından faydası dikkate alınmalıdır. Üreme yeteneği/Fertilite Hayvan üreme çalışmaları yürütülmemiştir. İnsanlardaki üreme yeteneği / fertiliteyi etkileyip etkilemediği bilinmemektedir. 4.7. Araç ve makine kullanımı üzerindeki etkiler Araç ve makina kullanımı üzerinde bilinen bir etkisi yoktur. 4.8. İstenmeyen etkiler Fibrin yapıştırıcılar/hemostatlarla tedavi edilen hastalarda nadir olgularda hipersensitivite veya alerjik reaksiyonlar (bunlarla sınırlı kalmamak kaydıyla anjiyoödem, uygulama yerinde yanma ve batma, bradikardi, bronkospazm, titreme, dispne, kızarma (flushing), yaygın ürtiker, başağrısı, hipotansiyon, letarji, bulantı, kaşıntı, huzursuzluk, taşikardi, göğüste baskı hissi, karıncalanma, kusma, hırıltı dahil) ortaya çıkabilir. İzole olgularda bu reaksiyonlar ciddi anafilaksiye kadar ilerlemiştir. Bu reaksiyonlar özellikle preparat ile tekrarlanan uygulamalarda, ya da aprotinine (bölüm 4.4'e bakınız) veya ürünün bileşimdeki diğer maddelerden herhangi birisine karşı aşırı duyarlılığının olduğu bilinen hastalara uygulandığında özellikle görülebilir. TISSEEL LYO ile birden fazla uygulamada iyi tolere edilmiş olsa bile, TISSEEL LYO'nun sonraki uygulanmaları ya da sistemik aprotinin uygulanması ciddi bir anafilaktik reaksiyonla sonuçlanabilir. Nadiren fibrin yapıştırıcı/hemostatik ürünlerin antikorlarına karşı reaksiyon gelişebilir. İstemeden gerçekleşen intravasküler uygulama tromboembolik olaylara ve dissemine intravasküler koagülasyona (DIC) neden olabilir. Dahası intravasküler uygulamada anafilaktik reaksiyon riski bulunmaktadır (bölüm 4.4'e bakınız). Viral bulaş ajanları ile ilgili güvenirlik için bölüm 4.4'e bakınız. Aşağıda listelenen istenmeyen etkiler TISSEEL'in güvenlilik ve etkililiğini araştırmak amacıyla yapılan klinik çalışmalarda ve Baxter'in fibrin yapıştırıcı ürünleriyle ilgili pazarlama sonrası deneyimlerde bildirilmiştir. Bu klinik çalışmalarda TISSEEL kardiyak, vasküler ve total kalça replasman cerrahisinde hemostaza ek olarak uygulanmış ya da karaciğer ve dalak cerrahisinde kullanılmıştır. Diğer klinik çalışmalar arasında aksiller lenf düğümü diseksiyonu uygulanan hastalarda lenf damarlarının sızdırmazlığının sağlanması, kolon anastomozlarında sızdırmazlığın sağlanması ve posterior fossa girişimlerinde duramater sızdırmazlığının sağlanması amacıyla kullanımı bulunmaktadır. Klinik çalışmalarda toplam 1146 hastaya Baxter'ın fibrin yapıştırıcı ürünleri uygulanmıştır. Sıklık aşağıdaki kriterlere göre değerlendirilmiştir. Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1,000 ila <1/100), seyrek (>1/10,000 ila <1/1,000), çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlar Yaygın: Postoperatif yara enfeksiyonu Kan ve lenf sistemi hastalıkları Yaygın olmayan: Fibrin yıkım ürünleri artışı Bağışıklık sistemi hastalıkları Bilinmiyor: Aşırı duyarlılık reaksiyonları*; Anaflaktik reaksiyonlar*; Anaflaktik şok*; Parestezi; Bronkospazm; Hırıltılı solunum; Kaşıntı; Eritem Sinir sistemi hastalıkları Yaygın: Duyusal bozukluklar Kardiyak hastalıklar Bilinmiyor: Bradikardi; Taşikardi Vasküler hastalıklar Yaygın: Aksiller ven trombozu** Seyrek: Hipotansiyon Bilinmiyor: Hematom, arteriyel emboli, serebral arter embolisi, serebral enfarktüs** Solunum, göğüs bozuklukları ve mediastinal hastalıklar Bilinmiyor: Dispne Gastrointestinal hastalıklar Yaygın olmayan: Bulantı Bilinmiyor: Barsak tıkanıklığı Deri ve deri altı doku hastalıkları Yaygın: Döküntü Bilinmiyor: Ürtiker, yara iyileşmesinde gecikme Kas-iskelet bozuklukları, bağ doku ve iskelet hastalıkları Yaygın: Bir ekstremitede ağrı Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Yaygın: Ağrı, vücut ısısında artış Yaygın olmayan: Uygulamayla ilişkili ağrı Bilinmiyor: Yüzde ve boyunda kızarma (flushing), ödem Yaralanma ve zehirlenme Çok yaygın: Seroma Bilinmiyor: Anjiyoödem * Anaflaktik reaksiyonlar ve anafilaktik şok fatal sonlanmaları da içermektedir. ** Superior petrozal sinüse intravasküler uygulama sonucu Sınıf Reaksiyonları Fibrin yapıştırıcı/hemostat ürün sınıfının kullanımıyla ilişkili diğer advers reaksiyonlar arasında hava veya gaz basınçlı cihazların kullanılmasına bağlı hava veya gaz embolisi bulunmaktadır. Bu olayın sprey cihazının önerilen başınçtan daha yüksek ve doku yüzeyine çok yakın kullanımı ile ilişkili olduğu görünmektedir. Hipersensitivite belirtileri arasında uygulama yerinde iritasyon, göğüste baskı hissi, titreme, başağrısı, letarji, huzursuzluk ve kusma bulunur. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9. Doz aşımı ve tedavisi Doz aşımına ilişkin herhangi bir bilgi bulunmamaktadır. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik grup : Lokal hemostatik, ATC kodu: B02BC; doku yapıştırıcılar, ATC kodu: V03AK Fibrin adezyon sistemi, fizyolojik kan pıhtılaşmasının son dönemini taklit eder. Fibrinojenin fibrin monomerleri ve fibrinopeptidlere parçalanmasıyla fibrinojenin fibrine dönüşümü gerçekleşir. Fibrin monomerleri biraraya toplanır ve bir fibrin pıhtısı oluşur. Trombinin ve kalsiyum iyonlarının birlikte etkisiyle faktör XIII'den oluşan faktör XIIIa, fibrin liflerinin çapraz bağlanmasıyla pıhtıyı sabitleştirir. Yarada iyileşme süreci ilerlerken, plazmin uyarısıyla fibrinolitik aktivite artar ve fibrinin fibrin yıkım ürünlerine dönüşümü başlar. Fibrinin proteolitik yıkımı anti-fibrinolitiklerce inhibe edilir. TISSEEL Lyo bileşiminde bulunan aprotinin bir anti-fibrinolitik olarak pıhtının prematür yıkımını önler. Etkinliği kanıtlamak için gerçekleştirilen in vivoçalışmalarda hastaların durumunu mümkün olduğunca yansıtan dört hayvan modeli seçilmiştir. Çalışmalarda TISSEEL yara iyileşmesinde olduğu kadar primer ve sekonder hemostazın sağlanmasında da etkili olarak bulunmuştur.TISSEEL prospektif, paralel olarak dizayn edilmiş, randomize (1:1), çift kör, çok merkezli bir klinik çalışmada, kardiyopulmoner bypass ve medyan sternotomi uygulanması gereken 317 kardiyak cerrahi hastasında, ürünün tek virüs inaktivasyonu yapılmış eski formülasyonu ile karşılaştırılarak değerlendirilmiştir. Hastalar, yalnızca konvansiyonel yöntemlerle hemostaz sağlanamadığı durumlarda, TISSEEL ile ya da kontrol preparatıyla tedavi edilmiştir. Sonlanım noktası olarak hemostazın ilk 5 dakika içinde sağlanması ve yara yerinin cerrahi olarak kapatılmasına kadar devam etmesi alınmıştır. Tek taraflı %97.5 güvenlik aralığı kullanılarak ölçülen sonuçlara göre, başarıyla tedavi edilenlerde TISSEEL (çift virüs inaktivasyonu yapılmış), önceki formülasyondan (tek virüs inaktivasyonu yapılmış) daha başarısız bulunmamıştır.
5.2. Farmakokinetik özellikler TISSEEL LYO sadece lokal uygulama için tasarlanmıştır, intravasküler uygulama kontrendikedir. Dolayısıyla insanda intravasküler farmakokinetik çalışmalar yapılmamıştır. Değişik tür laboratuvar hayvanlarında farmakokinetik çalışmalar gerçekleştirilmemiştir. Fibrin yapıştırıcılar/hemostatlar endojen fibrin ile aynı yolla fibrinolizis ve fagositoz ile metabolize olurlar. Emilim:Yerel olarak TISSEEL LYO uygulanan vücut bölgelerinden vücut sıvı ve dokularına emilim olmaz. Dağılım:Vücutta karaciğerden doğal olarak üretilen fibrinojen en yoğun olarak plazmada bulunur. Kan plazmasının yaklaşık %5'i fibrinojendir. Plazmadaki fibrinojen miktarı yaklaşık olarak 5 g/litre'dir. Fibrinojen sadece kan plazmasında değil, aynı zamanda çeşitli vücut sıvılarında da (lenf sıvısı, iltihabi sıvı birikintileri vb) bulunur. Kanı pıhtılaştıran bir protein olan trombin normalde vücut sıvılarında bulunmaz. İhtiyaç halinde karaciğerde üretilen protrombinin enzimatik yıkımıyla oluşur ve fibrinojeni fibrine yani suda erimeyen haline dönüştürür. Aprotinin vücutta doğal olarak üretilmez ve bulunmaz. Sığır kaynaklı aprotinin intravenöz yoldan uygulandığında plazma yarılanma süresinin yaklaşık 150 dakika olduğu ve terminal yarılanma süresinin ise yaklaşık 10 saat olduğu bilinmektedir. Biyotransformasyon:Trombinin etkisiyle fibrinojenin fibrine dönüşümü sonucu oluşmuş fibrin monomerleri biraraya toplanır ve fibrin pıhtısı oluşur. Fibrin liflerinin çapraz bağlanmasıyla sabitleşen pıhtıdaki fibrin ise daha sonra yani pıhtıya artık gerek kalmadığı zaman fibrin yıkım ürünlerine dönüşür. Karaciğerde metabolize edilen fibrin yıkım ürünleri ise böbreklerden atılır. Vücuda dışarıdan uygulanan aprotinin lizozomal emnzimler tarafından yavaş bir yıkıma uğrarlar. Eliminasyon:Fibrin yıkım ürünleri böbreklerden elimine olmaktadır. Tek bir intravenöz doz radyoaktif işaretli aprotinin uygulanması sonrası, radyoaktivitenin yaklaşık %25-40 kadarı idrarla elimine edilmiştir. Bir milyon KIU aprotininin 30 dakikada infüzyonu sonrası yaklaşık %2'si, 2 milyon KIU'luk daha yüksek bir doz aprotininin 30 dakikada infüzyonu sonrası ise yaklaşık %9'u idrarla değişmeden atılmaktadır. 5.3. Klinik öncesi güvenlilik verileri Doğası ve etki mekanizması (sistemik etkisinin ve diğer organ ve dokulara dağılımının olmayıp yerel etkinliği olması) yanında genellikle tek doz olarak birkaç ml kullanılması (sadece istisnai vakalarda tekrarlayan uygulama yapılır) nedeniyle TISSEEL LYO'nun kronik toksisitesi, karsinojenitesi, üreme ve gelişimsel toksikolojisi veya immun stimulasyonu hakkında preklinik güvenlik verileri mevcut değildir. Sıçan ve tavşanlarda yapılan tek doz toksisite çalışmalarında TISSEEL ile akut toksisite görülmemiştir. Dahası usulüne uygun olarak gerçekleştirilen in vitroin vitroolarak insan fibroblast kültürlerinde mükemmel hücresel kompatabilite ve non sitotoksisiteyi gösterecek şekilde iyi tolere edilmiştir. Literatürün ayrıntılı olarak gözden geçirilmesine dayanarak, rezidü solvent/deterjan reaktiflerinin TISSEEL LYO üzerinde herhangi bir negatif etki ya da toksisite oluşturması beklenmez.6. FARMASÖTİK ÖZELLİKLER 6.1. Yardımcı maddelerin listesi Bileşen 1: Yapıştırıcı Protein Çözeltisi İnsan albumini L-Histidin Niyasinamid Polisorbat 80 (Tween 80) Sodyum sitrat dihidrat Enjeksiyonluk Su Bileşen 2: Trombin Çözeltisi İnsan albumini Sodyum klorür Enjeksiyonluk Su 6.2. Geçimsizlikler Okside selüloz içeren preparatlar, alkol, iyot ve ağır metallerle temasın ardından yapıştırıcı protein ve trombin çözeltileri denatüre olabilirler. Bu tıbbi ürün, bölüm 6.6'da belirtilenler dışında başka tıbbi ürünlerle karıştırılmamalıdır. 6.3. Raf ömrü 24 ay. 6.4. Saklamaya yönelik özel tedbirler 2-8 °C arasında saklanmalıdır. Dondurulmasından kaçınılmalıdır. Donmuş ürünleri çözüp kullanmayınız. Işıktan korumak için orjinal ambalajında saklanmalıdır. TISSEEL LYO'nun kimyasal ve fiziksel stabilitesi, bileşenleri karıştırıldıktan sonra da oda sıcaklığı ile 37 °C arasında 4 saat süreyle korunur (karıştırılan çözelti tekrar buzdolabına konmamalıdır). Mikrobiyolojik açıdan, yüzde yüz kontaminasyonu önleyici bir yöntemden emin olunmadığı müddetçe, ürün hemen kullanılmalıdır. Hemen kullanılmadığı durumlarda saklama zamanı ve koşulları kullanıcının sorumluluğundadır. 6.5. Ambalajın niteliği ve içeriği Bütün bileşenler Avrupa Farmakopesisi gereksinimlerini karşılayan cam şişelere doldurulmuştur. Yapıştırıcı protein konsantresini içeren flakon içinde dönebilen manyetik bir pervane bulunur. Her TISSEEL LYO kutusu aşağıdaki bileşenleri içerir:- 1 flakon liyofilize Yapıştırıcı Protein Konsantresi (bileşen 1, 91 mg/ml liyofilize insan fibrinojeni) - 1 flakon liyofilize İnsan Trombini (bileşen 2, 500 IU/ml liyofilize insan trombini) - 1 flakon Aprotinin Çözeltisi (bileşen 1 için 3000 KIU/ml sentetik aprotinin içeren çözücü) - 1 flakon Kalsiyum Klorür Çözeltisi (bileşen 2 için 40 ^mol/ml kalsiyum klorür içeren çözücü) - Rekonstitüsyon ve uygulama için bir kit Rekonstitüsyon ve Uygulama kit içeriği Rekonstitüsyon ve uygulama kiti steril olmayan alanda rekonstitüsyon için bir tek-steril takım-ekipman, steril alanda aplikasyon için de bir çift-steril-takım ekipman içerir. Rekonstitüsyon seti 2 adet tek kullanımlık iğne, 1 adet mavi çizgili tek kullanımlık enjektör ve 1 adet siyah çizgili tek kullanımlık enjektör içerir. Aplikasyon seti 2 tek kullanımlık iğne, 1 adet mavi çizgili tek kullanımlık enjektör, 1 adet siyah çizgili tek kullanımlık enjektör, 1 adet DUPLOJECT İki-Enjektör Klipsi, 2 birleştirme parçası ve 4 aplikasyon iğnesi içerir. Rekonstitüsyon ve uygulama ayrıntıları için izleyen bölüme bakınız. Sterilizasyon etilen oksit ile sağlanmıştır. Kutular açılmadığı ve zarar görmediği müddetçe steril ve non-pirojendir. Tek kullanımlıktır ve re-sterilize edilemez. 6.6. Tıbbi ürünlerden arta kalan maddelerin imhası ve diğer özel önlemler Genel TISSEEL LYO uygulanmasından önce, uygulama istenen alan dışındaki vücut alanının korunarak istenmeyen adezyonların oluşması önlenmelidir. TISSEEL LYO'nun eldiven ve aletlere yapışmasını önlemek için buralar serum fizyolojik ile ıslatılmalıdır. Yapıştırılacak yüzeyler için bir rehber olmak üzere 1 kutu TISSEEL LYO, 1mL Trombin Çözeltisi ve 1mL Fibrinojen Çözeltisi İçeren İki Bileşenli Fibrin Yapıştırıcı (1 mL yapıştırıcı protein çözeltisi + 1mL trombin çözeltisi) en az 10 cm2 lik bir alan için yeterli olacaktır. Doz yapıştırılacak/sızdırmazlığı sağlanacak alanın genişliğine göre değişir. TISSEEL LYO'nun iki bileşeninin birbirinden ayrı olarak ardışık uygulanmasından kaçınılmalıdır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrol Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir. Hazırlama ve rekonstitüsyon Fibrin yapıştırıcının bileşenlerinin rekonstitüsyonu öncesi bütün flakonların kauçuk tıpaları temizlenmelidir. Ürünle dezenfektanın direkt temasından kaçınılmalıdır (Bkz. Bölüm 4.5). I - Yapıştırıcı Protein Çözeltisinin hazırlanması (birinci bileşen):Yapıştırıcı protein çözeltisini oluşturmak için Liyofilize Protein Konsantresi Aprotinin Çözeltisi kullanılarak çözülür. Liyofilize protein çözeltisi FİBRİNOTERM ısıtma ve karıştırma cihazı ile hazırlanır (önerilen metod). Hazırlama için alternatif olarak 33-37 °C steril su banyosu da kullanılabilir. FİBRİNOTERM cihazı ile hazırlama:- FİBRİNOTERM cihazı sabit olarak 37 °C ısı sağlar. Aynı zamanda her liyofilize yapıştırıcı protein konsantresi içeren flakonda bulunan manyetik karıştırıcıyı döndürerek çözülme zamanını kısaltır. - Liyofilize protein konsantresi ve aprotinin çözeltisi içeren flakonları FİBRİNOTERM cihazındaki uygun yerlere yerleştirip 3 dakika kadar ön-ısıtma uygulayınız. - Tek-steril takım içindeki iğne ve mavi çizgili enjektör yardımıyla Aprotinin çözeltisini Liyofilize Yapıştırıcı Protein Konsantresi içeren flakona transfer ediniz. Liyofilize Yapıştırıcı Protein Konsantresi içeren flakonu FİBRİNOTERM cihazının karıştırıcı gözüne (eğer gerekirse adaptörü kullanarak) yerleştiriniz ve tam çözülme sağlanıncaya kadar karışmasını sağlayınız. Flakon ışığa karşı tutulduğunda herhangi bir partikül görünmüyorsa rekonstitüsyon tamamlanmış demektir. Eğer halen partiküller varsa tam çözülme sağlanana kadar 37 °C'de birkaç dakika daha karışması için bekleyiniz. Tam çözülme sağlanınca manyetik karıştırıcıyı kapatınız. Not: Aşırı karıştırma ürünün kalitesini azaltabilir. - Hemen kullanılmayacaksa Yapıştırıcı Protein Çözeltisini karıştırmaksızın 37 °C'de bekletin. Homojenitenin devamlılığını sağlamak için yapıştırıcı protein çözeltisini çift-steril-takım içindeki mavi çizgili enjektöre çekmeden önce sallamaya devam ediniz. - Steril koşullarda, hazırlanmış olan yapıştırıcı protein çözeltisini flakondan çekiniz. - Ayrıntılı bilgi için FİBRİNOTERM cihazı kullanma kılavuzuna bakınız. Sıcak su banyosu kullanarak hazırlama:- Liyofilize yapıştırıcı protein konsantresi ve aprotinin çözeltisi içeren flakonları 33-37°C arasında bir sıcak su banyosunda yaklaşık 3 dakika kadar ısıtınız (37 °C'nin üzerindeki sıcaklıklarda ısıtmayınız). - Tek-steril-takım içerisinden çıkan mavi çizgili enjektör ve iğne yardımı ile Aprotinin Çözeltisini Liyofilize Yapıştırıcı Protein Konsantresi içeren flakona transfer ediniz. - Liyofilize Yapıştırıcı Protein Konsantresini 33-37 °C'de bulunan sıcak su banyosuna yeniden yerleştirerek bir dakika kadar bekletiniz. - Yavaşça karıştırınız ancak aşırı hareketlerden kaçınınız. Daha sonra flakonu sıcak su banyosuna döndürerek tam çözünme için periyodik olarak kontrol ediniz. Flakon ışığa tutulduğunda partikül görünmüyorsa rekonstitüsyon tamamlanmış demektir. Eğer halen partikül mevcutsa flakonu 33-37 °C'de birkaç dakika daha, çözülme tamamlanana kadar bekletiniz. - Eğer hemen kullanılmayacaksa Yapıştırıcı Protein Çözeltisini 33-37 °C'de tutmaya devam ediniz. Homojenliği sağlamak için çözeltiyi mavi çizgili enjektöre çekmeden önce yavaşça sallayınız. - Hazırlanmış yapıştırıcı protein çözeltisini steril koşullarda enjektöre çekiniz. Not: rekonstutisyon için FİBRİNOTERM cihazı yerine sıcak su banyosu kullanılırken, muhtemel kontaminasyonu önlemek için flakonu suya batırırken özel dikkat gerekir. II - Trombin Çözeltisinin hazırlanması (ikinci bileşen)Liyofilize İnsan Trombin Konsantresi, Trombin Çözeltisi oluşturmak üzere Kalsiyum Klorür Çözeltisi ile çözülür. Kalsiyum Klorür Çözeltisi içeren flakonun içeriğini Trombin flakonuna transfer ediniz. Tek-steril-kit içinde sağlanmış olan siyah çizgili ikinci iğneyi kullanınız. Liyofilize materyali çözmek için yavaşça sallayınız. Trombin çözeltisini ısıtmak için FİBRİNOTERM cihazı veya sıcak su banyosu kullanılabilir. Kullanılana kadar Trombin çözeltisini 33-37 °C'de bekletiniz. Kullanımdan önce trombin çözeltisini flakondan çift-steril kit içinde bulunan ikinci iğne ve siyah çizgili enjektör ile çekiniz. Not: Bileşenlerden birinin rekonstitüsyonu için kullanılan iğne ve enjektörleri diğer bileşenin rekonstitüsyonu için kullanmayınız; ikinci bileşen flakon veya enjektör içerisinde katılaşabilir. III - Rekonstitüsyonu yapılmış Fibrin Yapıştırıcı Bileşenlerinin kullanımıFibrin yapıştırıcı bileşenler hazırlandıktan sonra 4 saat içerisinde kullanılmalıdır. Rekonstitüsyondan sonra solüsyonu soğutmayınız veya dondurmayınız. Uygulama: Yapıştırıcı Protein ve Trombin çözeltileri berrak veya çok hafif opak olmalıdır. Partikül içeren veya rengi daha koyu olan çözeltileri kullanmayınız. Hazırlanan ürünler uygulamadan önce görsel olarak partikül ve renk değişikliği açısından kontrol edilmelidir. Uygulamadan önce TISSEEL LYO 33-37 °C'ye ısıtılmalıdır. TISSEEL LYO 37 °C'nin üzerindeki sıcaklıklara ve mikrodalgaya maruz bırakılmamalıdır Uygulama için Yapıştırıcı Protein ve Trombin Çözeltisi içeren iki tek kullanımlık enjektör DUPLOJECT ikili enjektör yuvasına (klips) sabitlenmeli ve bu oluşturulmuş takım bir aplikasyon iğnesi ve bağlantı parçası ile birleştirilmelidir. DUPLOJECT İkili Enjektör sisteminin ortak pistonu karışma olmadan önce eşit hacimlerde ürünün enjekte edilmesini sağlar. Enjektör Pistonu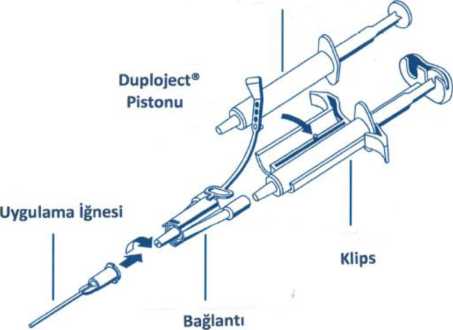
Parçası- Yapıştırıcı Protein ve Trombin çözeltisi ile dolu iki enjektörü klips içindeki yuvalarına yerleştiriniz. Her iki enjektör de eşit hacimlerde doldurulmuş olmalıdır.- İki enjektörün ucunu da bağlantı parçası ile sıkıca birleştiriniz. Bağlantı şeritini DUPLOJECT ikili enjektör sistemine iliştirerek, birleştirme parçasını sabitleyiniz. Şeritin kopması durumunda yedek birleştirme parçası kullanılır. Yedek parçadaki şeritin de kopması durumunda ürün yine de kullanılabilir ama sızıntı olmaması için bağlantının sağlamlığı iyice kontrol edilmelidir. - Birleştirme parçasına uygulama iğnesini iliştiriniz. İğne deliğinin tıkanmaması için birleştirme parçası ve uygulama iğnesi içindeki havayı uygulamaya başlamadan hemen öncesine kadar çıkarmayınız. - Uygulama yapılacak yüzeye ya da yapıştırılacak parçaların yüzeyine karışmış Yapıştırıcı Protein - Trombin Çözeltisini uygulayınız. Fibrin yapıştırıcı bileşenlerin uygulanması kesintisiz olmalıdır; kesinti durumunda iğne içinde hızla tıkanıklık oluşur. Bu durumda uygulama iğnesi değiştirilir. Birleştirme parçasında tıkanma olması durumunda ambalajdaki yedek birleştirme parçasını kullanınız. Not: Yüksek Trombin konsantrasyonu (500 IU/mL) nedeniyle yapıştırıcı bileşenlerin harmanlanmasından saniyeler sonra fibrin yapıştırıcı oluşmaya başlar. Minimal invazif girişimlerde kullanım için ve büyük ya da uygulamanın zor olduğu yerlere uygulama için BAXTER tarafından sağlanan diğer aksesuarlarla da uygulama mümkündür. Bu uygulama cihazlarıyla uygulanması sırasında, ilgili cihazın Kullanım Talimatı'na uyulmalıdır. TISSEEL LYO uygulamasından sonra, yeterli polimerizasyon sağlamak için en az 2 dakika gerekmektedir. Bazı uygulamalarda, taşıyıcı madde olarak ya da sağlamlaştırma için kolajen parçası gibi biyouyumlu materyal kullanılabilir. Sprey Uygulaması TISSEEL LYO sprey cihazı kullanarak uygulanırken, basınç ve dokuya mesafenin aşağıda üretici tarafından önerilen aralıklar dahilinde olduğundan emin olunmalıdır.
TISSEEL LYO'yu spreyle uygularken hava veya gaz embolisi oluşma ihtimali nedeniylekan basıncındaki değişiklikler, nabız, oksijen saturasyonu ve end tidal CO2izlenmelidir (Bkz. Bölüm 4.2. ve 4.4).Kapalı toraks ve abdominal boşluklara TISSEEL LYO uygulaması için DuploSpray MIS aplikatör ve regülatör sisteminin kullanımı önerilir. Kullanım sırasında lütfen DuploSpray MIS cihazının kullanım talimatına uyunuz.
2 7. RUHSAT S AHİBİEczacıbaşı-Baxter Hastane Ürünleri Sanayi ve Ticaret A.Ş. Cendere Yolu, Pırnal Keçeli Bahçesi 34390 Ayazağa-İSTANBUL Tel: (0.212) 329 62 00 Faks: (0.212) 289 92 75 Web: www.eczacibasi-baxter.com.tr8. RUHSAT NUMARASI 66 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ İlk ruhsat tarihi: 14.03.2011 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ 17 1 EPU (Avrupa Farmakope Ünitesi), 1800 KIU (Kallidinogenaz İnaktivatör Ünitesi)'ne karşılık gelir.2Trombin aktivitesi, trombin için geçerli WHO Uluslararası Standardı kullanılarak hesaplanmıştır. |
İlaç BilgileriTisseel Lyo 1ml Trombin Çözeltisi Ve 1ml Fibrinoj...Etken Maddesi: Insan Fibrinojeni, Aprotinin, Insan Trombini, Kal... Atc Kodu: B02BC Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.