Tisseel 4 Ml Kullanıma Hazır Enjektör Kısa Ürün BilgisiKan ve Kan Yapıcı Organlar » Kanama Durdurucu İlaçlar » K Vitamini ve Diğer Hemostatikler » Local hemostatics KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADITISSEEL 4 mL Kullanıma Hazır Enjektör2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Bileşen 1 : Yapıştırıcı protein çözeltisi İnsan fibrinojeni (pıhtılaşabilir protein) 91 mg(1)/mL Aprotinin (sentetik) 3000 KIU(2)/mL Bileşen 2: Trombin çözeltisi İnsan trombini 500 IU(3)/mL Kalsiyum klorür 40 |imol/mL (1)(2)(3)Çift bölmeli enjektör, bölmelerden birinde derin dondurulmuş 2 mL yapıştırıcı protein çözeltisi (sentetik aprotininli), diğerinde ise derin dondurulmuş 2 mL trombin çözeltisi (kalsiyum klorürlü) içerir. Bölmeler içerisindeki çözeltiler karıştırıldığında 4 mL kullanıma hazır çözelti oluşur.Kullanıma hazır 4 mL çözeltinin bileşimi aşağıdaki şekildedir: İnsan fibrinojeni (pıhtılaşabilir protein) 182 mg Sentetik aprotinin 6000 KIU İnsan trombini 1000 IU Kalsiyum klorür 80 |imol TISSEEL 0.6-5 IU/mL kadar insan fibrinojeni ile birlikte saflaştırılmış insan faktör XIII'ü içerir. Yardımcı madde(ler): Polisorbat 80 (Tween 80) 0.6-1.9 mg/mLYardımcı maddeler için, bkz. 6.1. 3. FARMASÖTİK FORMDoku yapıştırıcılar Derin dondurulmuşDerin dondurulmuş durumdaki görünümü:Renksiz ya da soluk sarı renkli ve donmuş opak çözeltilerÇözünmüş durumdaki görünümü:Renksiz ya da soluk sarı renkli berrak çözeltiler4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarStandart cerrahi tekniklerin yetersiz kaldığı şu durumların destekleyici tedavisindeendikedir (Bkz. Bölüm 5.1): Daha iyi bir hemostaz sağlanmasında. Vasküler cerrahide, gastrointestinal anastomozlarda, beyin cerrahisi girişimlerinde ve serebro-spinal sıvı veya dura mater ile temas oluşabilen cerrahi girişimlerde (örn., KBB, göz ve omurilik cerrahisinde) sütür desteği ve yara iyileşmesini kolaylaştırmak için doku yapıştırıcı olarak. Ayrılmış dokuların (örn., doku flepleri, greftleri, split skin greftler [mesh greftler]) yapışmasını teşvik ederek doku sızdırmazlığı sağlamak için. Tam heparizasyon yapılmış hastalarda etkinliği kanıtlanmıştır. 4.2. Pozoloji ve uygulama şekliTISSEEL yalnızca bu konuda deneyimli hekimler tarafından kullanılmalıdır.Pozoloji / Uygulama sıklığı ve süresi:Uygulanacak TISSEEL miktarı ve uygulama sıklığı hastanın klinik gereksinimine göre bireysel olarak belirlenmelidir.Uygulanacak dozu, sadece bunlarla sınırlı olmamakla beraber, cerrahi girişimin şekli, alanın büyüklüğü, uygulama şekli ve sayısı belirler. Ürünün uygulanma şekli, tedaviyi uygulayan hekim tarafından bireysel olarak belirlenmelidir. Klinik çalışmalarda 4 ile 20 mL arasında değişen bireysel dozlar kullanılmıştır. Bazı prosedürler (örn., karaciğer travması ya da geniş yanık alanlarının sızdırmazlığının sağlanması için yapılanlar) daha yüksek hacimler gerektirebilir. Tedavi başlangıcında seçilen anatomik alana veya hedef yüzeye uygulanacak ürün miktarı belirlenen alanı tamamen kaplayacak miktarda olmalıdır. Gerekirse uygulama tekrarlanabilir. Ancak TISSEEL polimerize olmuş bir tabakaya yapışmayacağından, daha önceden polimerize olmuş bir TISSEEL tabakası üzerine yeniden uygulanmasından kaçınılmalıdır. Yapıştırılacak yüzeyler için bir rehber olmak üzere 1 kutu TISSEEL 2 mL (1 mL yapıştırıcı protein çözeltisi artı 1 mL trombin çözeltisi) en az 10 cm2 lik bir alan için yeterli olacaktır. TISSEEL spreyleme yöntemiçok daha genişyüzeyleri kaplamak için yeterli olacaktır.Aşırı granülasyon dokusunun oluşumunun önlenmesi ve katılaşmış fibrin yapıştırıcının dereceli absorpsiyonun sağlanması için TISSEEL sadece ince bir tabaka halinde uygulanmalıdır. Uygulama şekli:Epilezyonel kullanım içindir.TISSEEL'in spreyleme yöntemi ile optimum güvenli kullanımının sağlanması için, aşağıdaki öneriler dikkate alınmalıdır: Açık yara cerrahisinde - en fazla 2.0 bar (28.5 psi) basınç uygulayan bir basınç regülatör cihazı kullanılmalıdır. Minimal invazif/laparoskopik prosedürlerde - en fazla 1.5 bar (22 psi) basınç uygulayan ve yalnızca karbondioksit gazı kullanılan bir basınç regülatör cihazı kullanılmalıdır. TISSEEL uygulanmadan önce, yaranın yüzey alanı standart teknikler kullanılarak (örn. aralıklı şekilde kompres, eküvyon, aspirasyon cihazları kullanımı) kurutulmalıdır. TISSEEL talimatlara göre sulandırılmalı ve bu ürün için önerilen cihazlarla uygulanmalıdır (Bkz. bölüm 6.6). Spreyleme yöntemi için cerrahi prosedüre göre gereken basınç ve doku mesafesine yönelik spesifik öneriler ve aplikatör uçlarının uzunluğu bölüm 4.4 ve 6.6'da sunulmaktadır. Minimal fibrin yapıştırıcı kullanımının yeterli olacağı cerrahi işlemlerde ürünün ilk birkaç damlasının uygulama kanülünden atılarak kullanılmaması önerilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek / Karaciğer yetmezliği:Lokal olarak etki göstermek amacıyla geliştirilmiştir. Böbrek veya karaciğer yetmezliği olan hastalarda dozaj ayarlamasına yönelik bir çalışma bulunmamaktadır.Pediyatrik popülasyon:Ürünün güvenlilik ve etkililiği pediyatrik hastalarda değerlendirilmemiştir. Kullanılacaksa doz erişkinlerdeki gibi cerrahi girişimin şekli, alanın büyüklüğü, uygulama tipi ve sayısına göre uygulamayı yapacak hekim tarafından belirlenmelidir.Geriyatrik popülasyon:Yaşlılarda doz erişkinlerdeki gibi cerrahi girişimin şekli, alanın büyüklüğü, uygulama tipi ve sayısına göre uygulamayı yapacak hekim tarafından belirlenmelidir.4.3. Kontrendikasyonlar TISSEEL'in konvansiyonel cerrahi tekniklerle kontrol edilemeyen aktif veya basınçlı arteriyel veya venöz kanamalarda tek başına kullanımı kontrendikedir. TISSEEL cerrahi yaranın kapatılmasında kullanılan deri sütürlerinin yerine kullanılamaz. TISSEEL, hiçbir şekilde intravasküler olarak uygulanmamalıdır. İntravasküler uygulama yaşamı tehdit eden tromboembolik olaylarla sonuçlanabilir. İçeriğindeki aktif veya yardımcı maddelerden herhangi birisine karşı aşırı duyarlılık durumunda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriSadece epilezyonel kullanım içindir. İntravasküler uygulamayınız.TISSEEL'in kazayla intravasküler olarak uygulanması durumunda yaşamı tehdit eden tromboembolik olaylar gelişebilir. Fibrin yapıştırıcıları basınçlı gaz ile kullanırken dikkatli olunmalıdır. Basınçlı gaz kullanılarak yapılan herhangi bir uygulamada yaşamı tehdit edebilecek boyutlarda hava veya gaz embolisi, doku yırtılması veya kompresyona neden olan gaz sıkışması riski bulunmaktadır. TISSEEL'i ince bir tabaka oluşturacak şekilde uygulayınız. Fazla pıhtı kalınlığıürünün etkinliğini ve yara iyileşme sürecini olumsuz etkileyebilir.Fibrin yapıştırıcıların uygulanması için basınç regülatörü içeren sprey cihazlarınınkullanımı ile yaşamı tehdit edebilecek olan fatal hava veya gaz embolisi meydanagelmiştir. Bu olayların sprey cihazının önerilen basınçlardan daha yüksek basınçtave/veya doku yüzeyine yakın olarak kullanımıyla ilişkili olduğu düşünülmektedir.Bu riskin fibrin yapıştırıcıların CO2yerine hava ile spreylendiğinde daha yüksekolduğu düşünülmektedir, dolayısıyla TISSEEL açık yara cerrahisinde spreylemeyöntemi ile uygulandığında bu risk göz ardı edilemez.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
5 dakika içinde oluşan ve yara yerinin cerrahi olarak kapatılmasına kadar devameden hemostaz | ||
|
|
TISSEEL (çift virüs inaktivasyonu yapılmış) |
Fibrin doku yapıştırıcı (tek virüs inaktivasyonu yapılmış) |
|
Tedavi başlangıcında analiz |
127/144 (% 88.2) |
129/144 (% 89.6) |
|
Protokolden sonraki analiz |
108/123 (% 87.8) |
122/135 (% 90.4) |
5.2. Farmakokinetik özellikler
TISSEEL sadece lokal uygulama için tasarlanmıştır, intravasküler uygulama kontrendikedir. Bu nedenle dolayısıyla insanda intravasküler farmakokinetik çalışmalar yapılmamıştır.Değişik tür laboratuvar hayvanlarında farmakokinetik çalışmalar gerçekleştirilmemiştir.
Emilim:
Yerel olarak TISSEEL uygulanan vücut bölgelerinden vücut sıvı ve dokularına emilim olmaz.
Dağılım:
Vücutta karaciğerden doğal olarak üretilen fibrinojen en yoğun olarak plazmada bulunur. Kan plazmasının yaklaşık %5'i fibrinojendir. Plazmadaki fibrinojen miktarı yaklaşık olarak 5 g/litre'dir. Fibrinojen sadece kan plazmasında değil, aynı zamanda çeşitli vücut sıvılarında da (lenf sıvısı, iltihabi sıvı birikintileri vb) bulunur.
Kanı pıhtılaştıran bir protein olan trombin normalde vücut sıvılarında bulunmaz. İhtiyaç halinde karaciğerde üretilen protrombinin enzimatik yıkımıyla oluşur ve fibrinojeni fibrine yani suda erimeyen haline dönüştürür.
Aprotinin vücutta doğal olarak üretilmez ve bulunmaz. Sığır kaynaklı aprotinin intravenöz yoldan uygulandığında plazma yarılanma süresinin yaklaşık 150 dakika olduğu ve terminal yarılanma süresinin ise yaklaşık 10 saat olduğu bilinmektedir.
Biyotransformasyon:
Trombinin etkisiyle fibrinojenin fibrine dönüşümü sonucu oluşmuş fibrin monomerleri biraraya toplanır ve fibrin pıhtısı oluşur. Fibrin liflerinin çapraz bağlanmasıyla sabitleşen pıhtıdaki fibrin ise daha sonra yani pıhtıya artık gerek kalmadığı zaman fibrin yıkım ürünlerine dönüşür. Karaciğerde metabolize edilen fibrin yıkım ürünleri ise böbreklerden atılır.
Vücuda dışarıdan uygulanan aprotinin lizozomal emzimler tarafından yavaş bir yıkıma uğrarlar.
Eliminasyon:
Fibrin yıkım ürünleri böbreklerden elimine olmaktadır.
Tek bir intravenöz doz radyoaktif işaretli aprotinin uygulanması sonrası, radyoaktivitenin yaklaşık %25-40 kadarı idrarla elimine edilmiştir. Bir milyon KIU aprotininin 30 dakikada infüzyonu sonrası yaklaşık %2'si, 2 milyon KIU'luk daha yüksek bir doz aprotininin 30 dakikada infüzyonu sonrası ise yaklaşık %9'u idrarla değişmeden atılmaktadır.
5.3. Klinik öncesi güvenlilik verileri
TISSEEL genellikle bir dozda uygulanır, sadece az sayıdaki istisnai durumda birkaç mL daha uygulama gerekmektedir. Uygulama yöntemlerinin özel olması yanında yapısı ve etki mekanizması (sistemik etki olmadan veya diğer organ ve dokulara dağılım olmadan yerel etki oluşturması) nedeniyle kronik toksisite, karsinojenite, üreme ve gelişim toksisitesi ya da immun stimulasyon açısından TISSEEL ile preklinik güvenlilik verileri mevcut değildir.Sıçan ve tavşanlarda yapılan tek doz toksisite çalışmalarında TISSEEL akut toksisiteye neden olmamıştır. Dahası usulüne uygun yapılan
in vitroin vitro
insan fibroblast kültürlerinde iyi tolere edilmiştir. Detaylı literatür gözden geçirmeye dayanarak, çözücü/deterjan rezidülerinin TISSEEL üzerindeki toksisitesinin ihmal edilebilir düzeylerde olduğu kabul edilir.6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Bileşen 1: Yapıştırıcı Protein Çözeltisi İnsan Albumini
L-Histidin
Niyasinamid
Polisorbat 80 (Tween 80)
Sodyum Sitrat Dihidrat
Enjeksiyonluk Su Bileşen 2: Trombin Çözeltisi
İnsan Albumini
Sodyum Klorür
Enjeksiyonluk Su
6.2. Geçimsizlikler
Düşük pH trombin aktivitesini etkileyebileceğinden, okside selüloz içeren preparatlar TISSEEL ile birlikte kullanılmamalıdır.Bu tıbbi ürün bölüm 6.6'da bahsedilenlerin dışındaki diğer ilaçlarla karıştırılmamalıdır.
6.3. Raf ömrü
24 ay.Çözülmüş ürünün raf ömrü için bölüm 6.6'ya bakınız.
6.4. Saklamaya yönelik özel tedbirler
Çocukların göremeyeceği ve erişemeyeceği yerlerde saklayınız.Dondurucuda (< -20°C) saklayınız.
Kullanılıncaya kadar soğuk zincir kırılmamalıdır.
Işıktan korumak için TISSEEL'i kutusu içinde saklayınız.
Bir kez çözüldükten sonra ürün 72 saat içinde kullanılmalıdır. Bir kez çözüldükten sonra yeniden dondurmayınız ya da buzdolabında saklamayınız.
6.5. Ambalajın niteliği ve içeriği
Hem Yapıştırıcı Protein Çözeltisi, hem de Trombin Çözeltisi tek kullanımlık çift hazneli polipropilen enjektör içinde yer alır.TISSEEL ambalajı içinde şu bileşenler bulunmaktadır:
- Bir adet tek kullanımlık çift hazneli polipropilen enjektör (bölmelerden birinde 2 mL derin dondurulmuş Yapıştırıcı Protein Çözeltisi, diğerinde 2 mL derin dondurulmuş Trombin Çözeltisi).
- Bir uygulama cihazı (DUO-Set): 2 birleştirme parçası, 4 uygulama kanülü (künt uçlu), 1 çift enjektör pistonu.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Genel
TISSEEL uygulanmasından önce, uygulama istenen alan dışındaki vücut alanının korunarak istenmeyen adezyonların oluşması önlenmelidir.TISSEEL'in eldiven ve aletlere yapışmasını önlemek için buralar serum fizyolojik ile ıslatılmalıdır.
Yapıştırılacak yüzeyler için bir rehber olmak üzere 1 kutu TISSEEL 2 mL (1 mL yapıştırıcı protein çözeltisi artı 1 mL trombin çözeltisi) en az 10 cm lik bir alan için yeterli olacaktır.
Kullanılacak doz uygulama alanının genişliğine göre değişir.
TISSEEL'in iki bileşeninin ardışık olarak ayrı ayrı kullanımından kaçınılmalıdır.
Kullanıma hazırlama
Hem Yapıştırıcı Protein Çözeltisi, hem de Trombin Çözeltisi tek kullanımlık çift hazneli enjektör içinde yer alır. Önceden doldurulmuş çift hazneli enjektörün uygulama uçları birer kapakla kapalı durumdadır ve her bir enjektörün piston tarafı silikondan mamül lastik bir stoperle kapalıdır. Bu bileşkenin tümü alüminyum-plastik karışımından mamül iki adet steril torbayla aseptik koşullarda sarılmıştır. Dıştaki ambalajın bütünlüğü bozulmadıysa, içteki torba ve içindekiler sterildir.Çift hazneli kullanıma hazır enjektörün çözme işlemi aşağıdaki yöntemlerle yapılabilir:
İki bileşenli yapıştırıcının çözülmesi ve ısıtılması işleminin 33 - 37°C arası sıcaklıkta steril su banyosuyla yapılması önerilir. Su banyosunun sıcaklığı 37°C'ı geçmemelidir (belirlenmiş bu sıcaklıklar arasında tutulması için su banyosunun sıcaklığı bir termometre aracılığıyla sürekli izlenmeli ve gerektiğinde içindeki su yenilenmelidir. Çözme ve ısıtma için steril su banyosu kullanılırken, önceden doldurulmuş çift hazneli enjektör bileşkesi aluminyum-plastik torbalarından çıkarılmalıdır). Çözme işlemi tamamlanana ve uygulama ucu iliştirilmeye hazır olana kadar, enjektördeki koruyucu kapak yerinden çıkarılmamalıdır. TISSEEL tümüyle çözülene ve vücut sıcaklığına gelene kadar kullanılmamalıdır.
1) Hızlı çözme (steril su banyosu ile)
Piston ile iç torbayı steril alana getiriniz ve kullanıma hazır çift hazneli enjektörü iç torbasından çıkararak doğrudan steril suya yerleştiriniz. Çözme işlemi boyunca enjektörün tümüyle suya battığından emin olunuz.
Tablo: 33°C (maksimum 37°C) sıcaklıkta steril su banyosunda çözme süreleri
|
ÜRÜN |
Çözme ve ısıtma süreleri (aluminyum-plastiktorbada ) |
|
TISSEEL 2 mL |
5 dakika |
|
TISSEEL 4 mL |
5 dakika |
|
TISSEEL 10 mL |
12 dakika |
Ürünü çözmenin bir diğer yolu da işlemi steril alan dışındaki bir bölgedeki steril olmayan bir sıcak su banyosu içinde gerçekleştirmektir.
Bu amaçla kullanıma hazır çift hazneli enjektörü her iki torbasını da açmadan steril alan dışındaki su banyosuna yerleştiriniz. Enjektörün çözme işlemi boyunca tümüyle suya batmış olarak kaldığından emin olunuz. Çözme işleminden sonra su banyosundan çıkarttığınız kullanıma hazır çift hazneli enjektörün dış torbasını kurulayınız ve iç torbası içinde steril alana getiriniz.
Tablo: Steril alan dışında 33°C (maksimum 37°C) sıcaklıkta su banyosunda çözme süreleri
|
ÜRÜN |
Çözme ve ısıtma süreleri (aluminyum-plastiktorbada ) |
|
TISSEEL 2 mL |
30 dakika |
|
TISSEEL 4 mL |
40 dakika |
|
TISSEEL 10 mL |
80 dakika |
Üçüncü bir seçenek olarak doku yapıştırıcı bileşenler 33°C (maksimum 37°C) sıcaklıkta tutulan bir inkübatör içinde çözülebilir.
İnkübatör içindeki ısıtma ve çözme süreleri aşağıdaki tabloda belirtilmiştir. Bu veriler alüminyum-plastik torbası içindeki ürünle ilgili verilerdir.
Tablo: İnkübatörde 33°C (maksimum 37°C) sıcaklıkta çözme süreleri
|
ÜRÜN |
Çözme ve ısıtma süreleri (aluminyum-plastik torbada) |
|
TISSEEL 2 mL |
40 dakika |
|
TISSEEL 4 mL |
85 dakika |
|
TISSEEL 10 mL |
105 dakika |
Çözme işlemi oda sıcaklığında da yapılabilir. Oda sıcaklığındaki çözme süreleri aşağıdaki tabloda belirtilmiştir. Ürün çözüldükten sonra oda sıcaklığında saklanmalı ve 72 saat içinde kullanılmalıdır.
Ürün oda sıcaklığında çözüldükten sonra, kullanımdan kısa süre öncesinde 33°C (maksimum 37°C) sıcaklığa ısıtılmalıdır. Aşağıdaki tabloda ürün çözüldükten sonraki bu ek ısıtma süreleri de yer almaktadır.
Tablo: Oda sıcaklığında çözme süresi + kullanmadan kısa bir süre önce inkübatörde 33°C (maksimum 37°C) sıcaklığa ısıtma süresi
Oda sıcaklığında çözme süreleri
ÜRÜN
(aluminyum-plastik torbada )
Oda sıcaklığında çözdükten sonra inkübatörde 33°C
(maksimum 37°C) sıcaklığa
|
|
|
|
ısıtma süreleri (aluminyum-plastik torbada ürün) |
|
TISSEEL 2 mL |
60 dakika |
+ |
15 dakika |
|
TISSEEL 4 mL |
110 dakika |
+ |
25 dakika |
|
TISSEEL 10 mL |
160 dakika |
+ |
35 dakika |
Not:
Ürünü elleriniz arasında tutarak çözmeye çalışmayınız.Çözme/ısıtma için mikrodalga fırın kullanmayınız.
Çözdükten sonra yeniden soğutmayınız / dondurmayınız ya da buzdolabında saklamayınız.
Çözüldükten sonrası stabilitesi
Hızlı çözme işlemi (33-37°C arası sıcaklıkta) gerçekleştirilmişse, TISSEEL çözüldükten sonra 33-37°C arası sıcaklıkta en fazla 12 saat saklanabilir.Oda sıcaklığında çözünmüş ürün ambalajı açılmadığı sürece kontrollü oda sıcaklığında (+25 °C'ı geçmeyen) 72 saate kadar saklanabilir. Çözüldükten sonra 72 saat içinde kullanılmayan TISSEEL atılmalıdır.
Çözdükten sonra / uygulama öncesi yapılması önerilenler
İki çözeltinin en uygun şekilde harmanlanması için, her iki bileşenin de kullanımdan hemen öncesine kadar 33 - 37 °C arası sıcaklığı ısıtılması gerekmektedir. Bu amaçla 37°C sıcaklık aşılmamalı ve mikrodalga fırın kullanılmamalıdır!Yapıştırıcı Protein ve Trombin Çözeltileri berrak ya da hafif opelasan olmalıdır. Bulanık olan ya da partikül içeren çözeltileri kullanmayınız. Çözülmüş ürünlerin kullanmadan önce partikül içerip içermediği ve renk değiştirip değiştirmediği kontrol edilmelidir. Partikül içeren ya da renk değiştirmiş ürünler kullanılmamalıdır.
Çözülmüş Yapıştırıcı Protein Çözeltisi sıvı halde olmalıdır, kıvamı hafifçe visköz olabilir. Çözeltinin kıvamı jöle gibiyse, denatüre olduğu varsayılmalıdır (soğuk zincirde olan bir kırılmaya bağlı olarak veya ısıtma sırasında aşırı sıcaklığa maruz kalma sonucu). Bu durumda TISSEEL kullanılmamalıdır.
Çift hazneli kullanıma hazır enjektör yalnızca kullanım öncesinde plastik torbalarından çıkarılmalıdır. Enjektördeki koruyucu kapağı ise yalnızca uygulamadan hemen önce çıkarınız. TISSEEL'i yalnızca uygun bir şekilde tümüyle çözülmüş ve ısıtılmış olduğu durumlarda (sıvı kıvam sağlanmışsa) kullanınız.
Daha ayrıntılı bilgi için sorumlu hemşire ya da doktora danışınız.
Uygulama
Uygulama için set içindeki birleştirme parçası ve uygulama kanülü Yapıştırıcı Protein Çözeltisi ve Trombin Çözeltisi içeren çift hazneli enjektöre iliştirilir. Çift bölmeye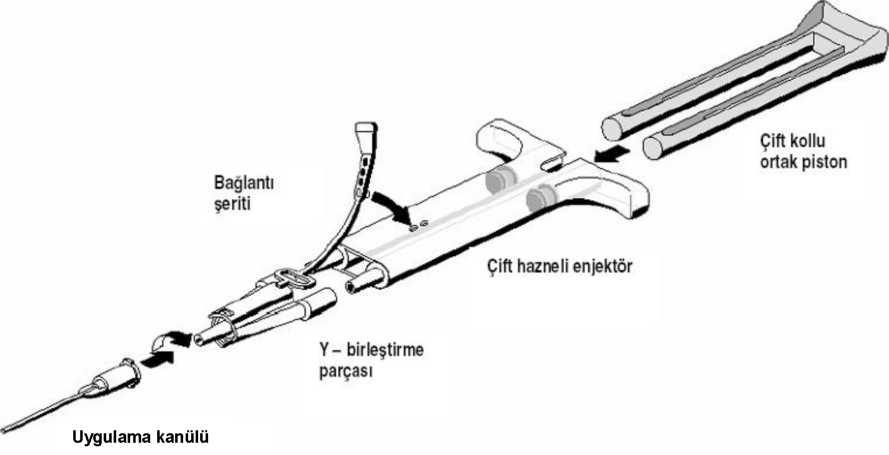 - Bağlantı şeridi çift hazneli enjektöre iliştirilerek, birleştirme parçası sabitlenir. Şeridin kopması durumunda yedek birleştirme parçası kullanılır. Yedek parçadaki şeridin de kopması durumunda ürün yine de kullanılabilir ama sızıntı olmaması için bağlantının sağlamlığı iyice kontrol edilmelidir.
- Bağlantı şeridi çift hazneli enjektöre iliştirilerek, birleştirme parçası sabitlenir. Şeridin kopması durumunda yedek birleştirme parçası kullanılır. Yedek parçadaki şeridin de kopması durumunda ürün yine de kullanılabilir ama sızıntı olmaması için bağlantının sağlamlığı iyice kontrol edilmelidir.
uygulanan çift kollu ortak piston sayesinde, uygulama kanülü içinde karışarak dışarıya çıkmadan önce birleştirme parçasına her iki çözeltiden eşit miktarda iletilir.
- Birleştirme parçasına bir uygulama kanülü iliştirilir.
Uygulama kanülünün tıkanmaması için birleştirme parçası ve uygulama kanülü içindeki havayı uygulamaya başlamadan hemen öncesine kadar çıkarmayınız.
- Uygulama yapılacak yüzeye ya da yapıştırılacak parçaların yüzeyine karışmış Yapıştırıcı Protein - Trombin Çözeltisini uygulayınız.
Fibrin yapıştırıcı bileşenlerin uygulanması kesintisiz olmalıdır; kesinti durumunda kanül içinde hızla tıkanıklık oluşur. Bu durumda uygulama kanülü değiştirilir. Birleştirme parçasında tıkanma olması durumunda ambalajdaki yedek birleştirme parçasını kullanınız.
Not:
Yüksek Trombin konsantrasyonu (500 IU/mL) nedeniyle yapıştırıcı bileşenlerin harmanlanmasından saniyeler sonra fibrin yapıştırıcı oluşmaya başlar.Endoskopik kullanım, minimal invazif girişimlerde kullanım, büyük ya da uygulamanın zor olduğu yerlere uygulama için BAXTER tarafından sağlanan diğer aksesuarlarla da uygulama mümkündür. Bu uygulama cihazlarıyla uygulanması sırasında, ilgili cihazın Kullanım Talimatı'na uyulmalıdır.
TISSEEL uygulanmasından sonra yeterli polimerizasyonun sağlanması için en az 2 dakika beklenmelidir.
Bazı uygulamalarda, taşıyıcı madde olarak ya da sağlamlaştırma için kolajen parçası gibi biyo-uyumlu materyal kullanılabilir.
Sprey Uygulaması
TISSEEL sprey cihazı kullanarak uygulanırken, basınç ve dokuya mesafenin aşağıda üretici tarafından önerilen aralıklar dahilinde olduğundan emin olunmalıdır.
TISSEEL sprey uygulaması için önerilen basınç, mesafe ve cihazlar | |||||
Cerrahi |
Kullanılacak sprey seti |
Kullanılacak aplikatör uçları |
Kullanılacakbasınçregülatörü |
Hedefdokuyaönerilenmesafe |
Önerilen sprey basıncı |
|
Açık yara |
Tisseel / Artiss Sprey Seti |
Geçerli değildir |
EasySpray |
10-15cm |
1,5-2,0 bar (21,5-28,5 psi). |
|
Tisseel / Artiss Sprey Seti 10'lu ambalaj |
Geçerli değildir |
EasySpray | |||
|
| |||||
|
Laparoskopik / minimal invazif prosedürler |
Geçerli değildir |
Duplospray MIS Aplikatör 20cm |
Duplospray MIS Regülatör Duplospray MIS Regülatör NIST B11 |
2 - 5 cm |
1,2-1,5 bar (18-22 psi) |
|
Duplospray MIS Aplikatör 30cm |
Duplospray MIS Regülatör Duplospray MIS Regülatör NIST B11 | ||||
|
Duplospray MIS Aplikatör 40cm |
Duplospray MIS Regülatör Duplospray MIS Regülatör NIST B11 | ||||
|
Değiştirilebilir uç |
Duplospray MIS Regülatör Duplospray MIS Regülatör NIST B11 | ||||
TISSEEL'i spreyle uygularken hava veya gaz embolisi oluşma ihtimali nedeniylekan basıncındaki değişiklikler, nabız, oksijen saturasyonu ve end tidal CO2düzeyleri izlenmelidir (Bkz. Bölüm 4.2. ve 4.4).
Kapalı toraks ve abdominal boşluklara TISSEEL uygulaması için DuploSpray MIS aplikatör ve regülatör sistemi'nin kullanımı önerilir. Kullanım sırasında lütfen DuploSpray MIS cihazının kullanım talimatına uyunuz.
Artan ürünün atılması
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıkların Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİ
Eczacıbaşı-Baxter Hastane Ürünleri Sanayi ve Ticaret A.Ş.Cendere Yolu, Pırnal Keçeli Bahçesi 34390 Ayazağa-İSTANBUL Tel: (0.212) 329 62 00 Faks: (0.212) 289 92 75
8. RUHSAT NUMARASI
849. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
10.12.201210. KÜB'ÜN YENİLEME TARİHİ
19İlaç Bilgileri
Tisseel 4 Ml Kullanıma Hazır Enjektör
Etken Maddesi: Insan Fibrinojeni, Aprotinin, Insan Trombini, Kal...
Atc Kodu: B02BC
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.