Dematrac 25mg/2.5ml Iv Enjeksiyon Ve İnfüzyon Içi... Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIDEMATRAC 25 mg/2.5 mL iv enjeksiyon ve infüzyon için solüsyon içeren ampul2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Bir ampulde;Atrakuryum besilat...... 25 mg (10 mg/ml) Yardımcı maddeler:Yardımcı maddeler için 6.1.'e bakınız.3. FARMASÖTİK FORMAmpulBerrak cam ampul içinde renksiz ve berrak, steril solüsyon. pH=3.2-3.7 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarDEMATRAC, cerrahi girişimlerde veya kontrollü ventilasyon sırasında trakeal entübasyonu sağlamak ve iskelet kaslarını gevşetmek ve yoğun bakım ünitelerindeki (YBÜ) hastalarda mekanik ventilasyonu kolaylaştırmak amacıyla genel anesteziye ek olarak uygulanır. Son derece selektif, kompetitif veya non-depolarizan bir nöromüsküler blokördür.4.2. Pozoloji ve uygulama şekliİzleme:TÜM NÖROMÜSKÜLER BLOKÖRLERDE OLDUĞU GİBİ, DEMATRAC UYGULAMASI SIRASINDA BİREYSEL DOZ İHTİYACINI BELİRLEMEK İÇİN NÖROMÜSKÜLER FONKSİYONUN İZLENMESİ ÖNERİLİR. Pozoloji/uygulama sıklığı ve süresi:Erişkinler;Enjeksiyon şeklinde;Erişkinlerde doz (gereken tam blok süresine bağlı olarak) 0.3-0.6 mg/kg'dır ve 15-35 dakika süre ile yeterli gevşeme sağlar. Endotrakeal entübasyon genellikle 0.5-0.6 mg/kg'lık dozun i.v. enjeksiyonundan sonraki 90 saniye içinde gerçekleştirilebilir.Tam blok süresi, gerektikçe 0.1-0.2 mg/kg'lık ek dozların uygulanması ile uzatılabilir. Artarda uygulanan ek dozlar birikmeye neden olmaz. Tam blok sonunda kendiliğinden düzelme, tetanik cevabın normal nöromüsküler fonksiyonun % 95'ine ulaşması ölçü olarak alındığında, yaklaşık 35 dakikada gerçekleşir. DEMATRAC'ın oluşturduğu nöromüsküler blok, öncesinde ya da birlikte atropin uygulanan, standart dozlarda neostigmin ve edrofonyum gibi antikolinesteraz ilaçlarla, hiçbir rekürarizasyon belirtisi olmaksızın hızla geri döndürülebilir. İnfüzyon şeklinde:DEMATRAC, uzun süren cerrahi girişimlerde, bolus olarak uygulanan 0.3-0.6 mg/kg'lık ilk dozdan sonra nöromüsküler blokun sürdürülmesi için 0.3-0.6 mg/kg/saat hızında sürekli infüzyon şeklinde uygulanabilir. DEMATRAC önerilen infüzyon hızında kardiyopulmoner bypass ameliyatlarında infüzyon şeklinde uygulanabilir. Vücut ısısının, oluşturulan hipotermi ile, 25°-26°C'ye düşürülmesi atrakuryumun inaktivasyonunu yavaşlatır,bu nedenle düşük ısılarda normal infüzyon hızının yaklaşık yarısı ile tam nöromüsküler blok sürdürülebilir. DEMATRAC aşağıdaki infüzyon solüsyonları ile aşağıda belirtilen sürelerde geçimlidir. İnfüzyon solüsyonu
Stabilite süresi 24 saat 8 saat 8 saat 8 saat 4 saat Sodyum klorür intravenöz infüzyon BP (% 0.9 a/h) Glukoz intravenöz infüzyon BP (% 5 a/h) Ringer solüsyonu USP Sodyum klorür (%0.18 a/h) ve glukoz (%4 a/h) intravenöz infüzyon BP Bileşik sodyum laktat intravenöz infüzyon BP (Hartmann solüsyonu) 0.5 mg/ml ve üzerinde atrakuryum besilat konsantrasyonları verecek şekilde bu solüsyonlarla seyreltilme yapıldığında elde edilen solüsyonlar gün ışığında ve 30°C'ye kadar olan sıcaklık derecelerinde belirtilen sürelerde stabil kalır. Uygulama şekli: DEMATRAC i.v. enjeksiyon yoluyla uygulanır. Nöromusküler bloğun sürdürülmesi için sürekli DEMATRAC infüzyonu uygulanmalıdır. DEMATRAC kesinlikle intramüsküler uygulanmamalıdır.BU İLAÇ SADECE HASTANEDE VE BİR ANESTEZİ UZMANI DENETİMİNDE KULLANILMALIDIR.Özel popülasyonlara ilişkin ek bilgiler:Böbrek/ Karaciğer yetmezliği:DEMATRAC son dönem yetmezliği de içeren her düzeyde böbrek ve karaciğer yetersizliği olan hastalarda standart dozlarda uygulanabilir.Pediyatrik popülasyon:1 aydan daha büyük çocuklar için gerekli doz, vücut ağırlığına göre hesaplanan erişkin dozları ile aynıdır. 1 aydan daha küçük yeni doğanlarda ilacın güvenliliği ile ilgili veri yetersizdir. Bu nedenle kullanımı önerilmez.Geriyatrik popülasyon:DEMATRAC, yaşlı hastalarda standart dozlarda uygulanabilir. Ancak başlangıç dozunun yavaş uygulanması ve doz aralığının düşük bölümünden seçilmesi önerilir.Diğer:Kardiyovasküler hastalığı olan hastalar:Klinik olarak önemli kardiyovasküler hastalığı olan hastalarda DEMATRAC'ın başlangıç dozu 60 saniyeden daha uzun bir sürede uygulanmalıdır.Yoğun bakım ünitesindeki (YBÜ) hastalar:0.3-0.6 mg/kg'lık DEMATRAC'ın tercih edilen başlangıç bolus dozundan sonra, DEMATRAC nöromüsküler bloku devam ettirmek için 11-13 mikrogram/kg/dak (0.65-0.78 mg/kg/saat) hızlarında sürekli infüzyon şeklinde uygulanabilir, fakat doz gereksinmelerinde hastalar arasında geniş değişkenlikler olabilir. Doz gereksinmeleri zaman ile değişebilir. Bazı hastalarda 4.5 mikrogram/kg/dak (0.27 mg/kg/saat) kadar az veya 29.5 mikrogram/kg/dak (1.77 mg/kg/saat) kadar yüksek infüzyon hızlarına gerek olabilir. YBÜ hastalarına DEMATRAC'ın infüzyon olarak uygulanmasından sonra nöromüsküler bloktan kendiliğinden düzelme hızı, uygulama süresinden bağımsızdır. Spontan düzelmeden dörtlü uyarı oranı >0.75'e (train-of-four ratio, dörtlü uyarıda dördüncü seğirmenin yüksekliğinin birincisine oranı) dönüşün yaklaşık 60 dakika içinde gerçekleşmesi beklenir. Klinik çalışmalarda 32-108 dakika arasında gözlenmiştir.4.3. KontrendikasyonlarDEMATRAC, atrakuryum, sisatrakuryum ya da benzensülfonik aside aşırı duyarlı olduğu bilinen hastalara uygulanmamalıdır.4.4. Özel kullanım uyarıları ve önlemleriBÜTÜN NÖROMÜSKÜLER BLOKÖRLER GİBİ, DEMATRAC DA DİĞER İSKELET KASLARI İLE BİRLİKTE SOLUNUM KASLARINDA FELÇ OLUŞTURUR, ANCAK ŞUUR ÜZERİNEHERHANGİ BİR ETKİSİ YOKTUR. DEMATRAC SADECE UYGUN GENEL ANESTEZİ İLE BİRLİKTE VE DENEYİMLİ BİR ANESTEZİST TARAFINDAN VEYA ONUN YAKIN DENETİMİ ALTINDA, ENDOTRAKEAL ENTÜBASYON VE YAPAY SOLUNUM İÇİN UYGUN OLANAKLARIN MEVCUDİYETİNDE UYGULANMALIDIR.Diğer nöromüsküler blokörlerde olduğu gibi, duyarlı kişilerde DEMATRAC uygulaması sırasında histamin açığa çıkma ihtimali vardır. Histamin etkilerine artmış duyarlılık hikayesi olan hastalarda DEMATRAC uygulaması sırasında, dikkatli olunmalıdır. DEMATRAC'ın önerilen dozlarda anlamlı bir vagal veya gangliyon blokör etkisi yoktur. Bu nedenle, DEMATRAC önerilen dozlarda kalp hızı üzerine klinik olarak anlamlı bir etki göstermez. Nöromusküler blokörler arasında çapraz hipersensitivite bulunur. Diğer NMB ilaçlara duyarlı hastalara verilmemelidir. Ameliyat sırasındaki vagal stimülasyon veya birçok anestezik ilacın neden olduğu bradikardiyi önlemez. Miyastenia gravis, diğer nöromüsküler hastalıklar ve ciddi elektrolit dengesizliği olan hastalarda diğer non-depolarizan nöromüsküler blokörler gibi DEMATRAC'a de artmış duyarlılık görülebilir. DEMATRAC, arteriyel kan basıncı düşmelerine çok hassas olan hastalarda (örn. hipovolemik hastalarda), 60 saniyeden daha uzun bir sürede uygulanmalıdır. DEMATRAC yüksek pH'da inaktive olduğu için, tiyopenton veya herhangi bir alkali ajan ile birlikte aynı şırıngada karıştırılmamalıdır. DEMATRAC uygulaması için küçük bir ven seçilmişse, uygulama sonrası serum fizyolojik ile ven yıkanmalıdır. Diğer anestezik ilaçların da DEMATRAC'la aynı iğne ya da kanülden uygulanması halinde her ilacın yeterli hacimde serum fizyolojik ile yıkanması çok önemlidir. DEMATRAC hipotoniktir ve kan transfüzyonunun infüzyon yolundan uygulanmamalıdır. Malign hipertermiye duyarlı hayvanlardaki (domuz) çalışmalar ve malign hipertermiye duyarlı hastalarda yapılan klinik çalışmalarda, DEMATRAC'ın bu sendromun oluşmasını kolaylaştırıcı etki göstermediği saptanmıştır. Diğer non-depolarizan nöromüsküler blokörlerde olduğu gibi yanıklı hastalarda direnç gelişebilir. Bu hastalarda yanıktan beri geçen süre ve yanığın büyüklüğüne göre doz artırılması gerekebilir.Yoğun bakım ünitesi (YBÜ) hastaları:Atrakuryumun metaboliti olan lodanozin, yüksek dozlarda laboratuvar hayvanlarına uygulandığında geçici hipotansiyon ve bazı türlerde serebral eksitatör etkilerle ilişkili bulunmuştur. Atrakuryum alan YBÜ hastalarında nöbetler görülmesine rağmen bunun lodanozin ile nedensel ilişkisi saptanmamıştır (Bkz. İstenmeyen etkiler).4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleriHalotan, izofluran ve enfluran gibi inhalasyon anesteziklerinin birlikte uygulanması ile DEMATRAC'ın oluşturduğu nöromüsküler blok uzayabilir.Diğer non-depolarizan nöromüsküler blokörlerle olduğu gibi, DEMATRAC ile birlikte uygulandıklarında aşağıdaki ilaçlar non-depolarizan nöromüsküler blokun derinliğini ve/veya süresini artırabilirler: Antibiyotikler (aminoglikozidler, polimiksinler, spektinomisin, tetrasiklinler, linkomisin ve klindamisin) Antiaritmik ilaçlar (propranolol, kalsiyum-antagonistleri, lidokain, prokainamid ve kinidin) Diüretikler (furosemid ve muhtemelen mannitol, tiazid diüretikleri ve asetazolamid) Magnezyum sülfat Ketamin Lityum tuzları Gangliyon blokörleri (trimetafan, hekzametonyum) Nadiren bazı ilaçlar latent miyastenia gravisi maskeleyebilir, kötüleştirebilir veya miyastenik sendromu indükleyebilir. Böyle bir gelişme, DEMATRAC'a artmış bir duyarlılığa neden olabilir. Bu ilaçlar şunlardır: Çeşitli antibiyotikler, beta-blokörler (propranolol, oksprenolol), antiaritmik ilaçlar (prokainamid, kinidin), antiromatizmal ilaçlar (klorokin, D-penisilamin), trimetafan, klorpromazin, steroidler, fenitoin ve lityum. Kronik antikonvülsan tedavi uygulanan hastalarda non-depolarizan nöromüsküler blok başlaması için geçen süre uzayabilir ve blok süresi kısalabilir. DEMATRAC ile birlikte diğer non-depolarizan nöromüsküler blokörlerin uygulanması halinde, uygulanan DEMATRAC'ın eşdeğer etkili toplam dozlarından beklenenden çok daha fazla nöromüsküler blokaj oluşabilir. Farklı ilaç kombinasyonlarında görülebilecek sinerjik etkiler değişkendir. Süksametonyum klorür gibi depolarizan kas gevşeticiler, atrakuryum gibi nondepolarizan ajanların nöromüsküler blok etki sürelerini uzatmak amacıyla uygulanmamalıdır, çünkü bu antikolinesteraz ilaçlarla geri döndürülmesi zor olabilen, uzamış ve kompleks bir bloka yol açabilir. Özel popülasyonlara ilişkin ek bilgilerVeri bulunmamaktadır.Pediyatrik popülasyon:Veri bulunmamaktadır.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik Kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)DEMATRAC'ın doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır.Gebelik dönemiDiğer bütün nöromüsküler blokör ajanlarda olduğu gibi DEMATRAC hamilelikte anneye beklenen yararları fetüs üzerine muhtemel risklerinden fazla olduğuna inanılan durumlarda kullanılmalıdır. DEMATRAC sezaryen ameliyatlarında kas gevşemesini sürdürmek için uygundur; çünkü atrakuryum önerilen dozları takiben plasentadan klinik açıdan anlamlı miktarda geçmez. DEMATRAC gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Laktasyon dönemiDEMATRAC'ın anne sütüne geçip geçmediği bilinmemektedir.Üreme yeteneği/FertiliteDEMATRAC'ın üreme yeteneği ve fertilite üzerindeki etkisi bilinmemektedir.4.7. Araç ve makine kullanımı üzerindeki etkilerVeri yoktur.4.8. İstenmeyen etkilerRapor edilen istenmeyen etkiler aşağıdaki sıklık derecesine göre listelenmiştir:Çok yaygın (> 1/10); yaygın (> 1/100 - <1/10); yaygın olmayan (> 1/1000 - <1/100); seyrek (> 1/10.000 - <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor.) Bağışıklık sistemi hastalıklarıÇok seyrek: Anafilaksi. DEMATRAC ile birlikte, bir ya da daha fazla anestezik ilaç verilen hastalarda çok seyrek olarak anafilaksiye benzeyen reaksiyonlar bildirilmiştir.Sinir sistemi hastalıklarıYaygınlığı bilinmiyor: Nöbet. Nadiren atrakuryum yanında birçok ilaç alan YBÜ hastalarında nöbetler bildirilmiştir. Ancak bu hastaların genellikle nöbetleri tetikleyen bir veya daha çok medikal durumları olduğu bildirilmiştir (Örn: kraniyel travma, serebral ödem, viral ensefalit, hipoksik ensefalopati, üremi). Bu nöbetlerin laudanosin ile nedensel ilişkisi saptanmamıştır. Klinik çalışmalarda, plazma laudanosin konsantrasyonu ile nöbet oluşumu arasında herhangi bir korelasyon görülmemiştir.Vasküler hastalıklarYaygın: Hafif geçici hipotansiyon, deride kızarıklıkSolunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın olmayan: BronkospazmDeri ve derialtı hastalıklarıSeyrek: ÜrtikerKas-iskelet sistemi bozuklukları, bağ doku ve kemik hastalıklarıYaygınlığı bilinmiyor: Kas güçsüzlüğü ve/veya miyopati. YBÜ'ndeki ciddi hastalarda kas gevşeticilerin uzun süreli kullanımını takiben bazı kas güçsüzlüğü ve/veya miyopati raporları vardır. Bu hastaların birçoğu aynı zamanda kortikosteroid de kullanan hastalardır. DEMATRAC kullanımı sırasında bu semptomlar nadiren görülmektedir ve aralarında nedensel ilişki saptanmamıştır.4.9. Doz aşımı ve tedavisiBelirtiler:Uzamış kas paralizi ve bunun sonuçları aşırı dozajın ana belirtisidir.Tedavisi:Spontan solunum yeterli oluncaya kadar pozitif basınçlı ventilasyon ile suni solunumun sürdürülmesi gerekir. Bilinç bozulmayana kadar tam sedasyon gerekebilir. Geri dönüş atropin veya glikopirolat ile birlikte antikolinesteraz ilaçlar uygulanarak hızlandırılabilir.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Kas gevşeticiler, periferik etkili ajanlar ATC-kodu: M03AC04Atrakuryum yüksek derecede selektif, kompetitif veya non-depolarizan nöromüsküler blokör ilaçtır. (Non-depolarizan nöroblokerler, motor son-plaktaki reseptörlere bağlanarak asetilkolinin etkisini antagonize ederler. Atrakuryum cerrahi girişimlerde ve kontrollü ventilasyonun kolaylaştırılmasında yaygın olarak kullanılır.) Atrakuryumun göz içi basıncına hiçbir direkt etkisi yoktur, dolayısı yla göz ameliyatlarında kullanılmaya uygundur. 5.2. Farmakokinetik özellikler Genel özelliklerEmilim:Atrakuryum farmakokinetiği 0.3-0.6 mg/kg doz aralığında doğrusaldır. Eliminasyon yarı ömrü yaklaşık 20 dakikadır. Dağılım:Dağılım hacmi 0.16 l/kg'dır. Atrakuryumun plazma proteinlerine bağlanma oranı % 82'dir. Biyotransformasyon:Atrakuryum, fizyolojik pH ve ısıda enzimatik olmayan parçalanma (Hofmann eliminasyonu) ve spesifik olmayan esterazlarla katalize edilen ester hidrolizi ile inaktive olur. Atrakuryumun nöromüsküler blokaj etkisinin sona ermesi karaciğer veya böbreklerdeki metabolizmasına veya atılımına bağımlı değildir. Bu nedenle etki süresinin böbrek, karaciğer veya dolaşım fonksiyon bozukluklarından etkilenmesi beklenmez. Psödokolinesteraz düzeyleri düşük olan hastalardan alınan plazma ile yapılan testler atrakuryum inaktivasyonunun etkilenmeden ilerlediğini göstermiştir. Hastada fizyolojik sınırlarda kan pH'ı ve vücut ısısı değişikliklerinin oluşması atrakuryumun etki süresini anlamlı bir şekilde değiştirmez. Hemofiltrasyon ve hemodiafiltrasyonun atrakuryumun ve laudanosin dahil metabolitlerinin plazma düzeylerine etkisi minimaldir. Hemodiyaliz ve hemoperfüzyonun atrakuryum ve metabolitlerinin plazma düzeylerine etkisi bilinmemektedir. Eliminasyon:Atrakuryum eliminasyonu böbrek ya da karaciğer fonksiyonlarına bağlı değildir. Hastalardaki karakteristik özelliklerYoğun bakım ünitesindeki hastalar:Anormal böbrek ve/veya karaciğer fonksiyonu olan yoğun bakım ünitesi (YBÜ) hastalarında metabolitlerin konsantrasyonu daha yüksektir (Bkz. Özel kullanım uyarıları ve önlemleri). Ancak bu metabolitlerin nöromüsküler bloke edici etkisi yoktur. 5.3. Klinik öncesi güvenlilik verileriAtrakuryumin vitroin vivosıçan kemik iliği tayininde nöromusküler blokaj dozlarında mutajenik bulunmamıştır. Fare lenfoma tayininde hücrelerin yarısının öldüğü 60 mikrogram/ml dozda mutajenite gözlenmezken, 80 mikrogram/ml dozda orta derecede ve çok yüksek konsantrasyonda (1200 mikrogram/ml) zayıf mutajenite saptanmıştır. Atrakuryumun insanda kullanımı dikkate alındığında, insanlarda cerrahi relaksasyon sırasında kullanımında mutajenik riskin önemli olmadığı düşünülmektedir. Karsinojenite çalışması yapılmamıştır.6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesipH ayarı için benzen sülfonik asit çözeltisi Enjeksiyonluk su6.2. GeçimsizliklerDEMATRAC yüksek pH'da inaktive olduğu için, herhangi bir alkali ajan ile birlikte aynı şırıngada karıştırılmamalıdır.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler2°- 8°C arasında saklayınız. Işıktan koruyunuz. Dondurmayınız.Sadece taşıma veya soğuk depo dışında geçici depolama için 30°C'ye kadar sıcaklık derecelerinde kısa sürelerde tutulmasına izin verilebilir. DEMATRAC'ın 30°C'de bir ay depolanması ile %8 etki kaybı olacağı hesaplanmaktadır.Açılmış ampullerdeki kullanılmamış DEMATRAC atılmalıdır. 6.5. Ambalajın niteliği ve içeriği2.5 ml, 10 adet ampul6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTüm kullanılmayan ürün ve atık maddeler Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir.Ampul açma talimatları:Ampuller OPC (Tek Kırma Noktası) açma sistemi ile donatılmıştır ve aşağıdaki talimatlar doğrultusunda açılmalıdır: Resim 1'de gösterildiği gibi ampulü alt kısmından tutunuz. Resim 2'de gösterildiği gibi diğer elinizin başparmağını ampuldeki renkli noktaya bastırınız. 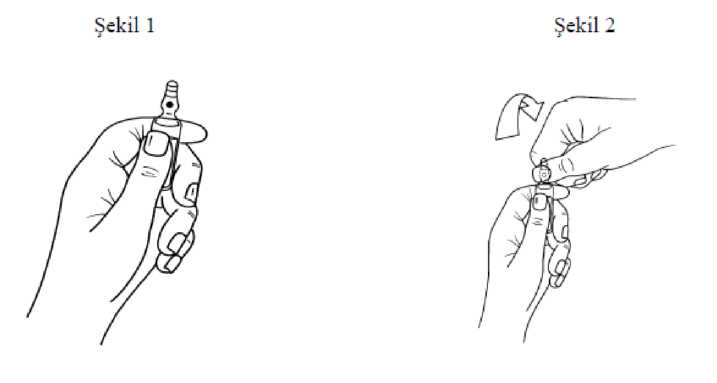
7. RUHSAT SAHİBİDem İlaç Sanayi ve Ticaret A.Ş.Dem Plaza İnönü Mah. Kayışdağı Cad. No: 172 34755 Ataşehir-İstanbul Tel: 02164284029 Faks: 02164284086 8. RUHSAT NUMARASI114/59. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ |
İlaç BilgileriDematrac 25mg/2.5ml Iv Enjeksiyon Ve İnfüzyon Içi...Etken Maddesi: Atrakuryum Besilat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.