Airbir 3/100 Mcg İnhalasyon İçin Toz İçeren Kapsül Kısa Ürün BilgisiKISA URUN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADI AİRBİR 3/100 mcg inhalasyon için toz içeren kapsül 2. KALITATIF VE KANTITATIF BILEŞIMEtkin maddeler:Arformoterol tartarat*
4,5 mcg 100 mcg Budesonid *3 mcg Arformoterol'e eşdeğer Yardımcı madde: 12,8955 mg
Laktoz Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORM İnhalasyon için toz içeren kapsül Kapak: şeffaf, Gövde: natural transparan renk kapsül içinde beyaz toz. 4. KLİNİK ÖZELLİKLER 4.1. Terapötik endikasyonlar AİRBİR 3/100 mcg inhalasyon için toz içeren kapsül, astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. AİRBİR 3/100 mcg inhalasyon için toz içeren kapsül, şiddetli astımı olan hastalar için uygun değildir. AİRBİR 3/100 mcg inhalasyon için toz içeren kapsül, 6-12 yaş grubundaki çocuklar için uygundur. 4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi: Astım AİRBİR'in içindeki maddelerin dozu her hasta için farklıdır ve hastalığın şiddetine göre belirlenmelidir. Bu durum, sadece tedaviye kombinasyon ile başlandığında değil, idame doz ayarlanırken de göz önünde tutulmalıdır. Hasta, kombinasyon preparatının içindeki dozların dışında bir doz kombinasyonuna gereksinim duyarsa uygun dozda beta2-agonist ve/veya kortikosteroidi tek başına içeren preparatlar verilmelidir. Doz, semptomların efektif kontrolünün idame ettirildiği en düşük değere titre edilmelidir. Hastalar hekimleri tarafından, en uygun AİRBİR dozunu kullanmaları açısından düzenli olarak değerlendirilmelidirler. Önerilen en düşük doz ile kontrol altına alındığında, bir sonraki adım tek başına inhale steroid tedavisinin denenmesini içerebilir. AİRBİR için iki tedavi yaklaşımı söz konusudur: A. AİRBİR idame tedavisi: Düzenli idame tedavi olarak AİRBİR ile birlikte kurtarıcı nitelikte ayrıca bir hızlı etki eden bronkodilatör alınır. B. AİRBİR idame ve semptom giderici tedavi: AİRBİR düzenli idame tedavi olarak ve aynı zamanda ihtiyaç halinde semptomları gidermek amaçlı alınır. A. AİRBİR idame tedavisi: Hastalara, kurtarıcı olarak yanlarında ayrıca bir hızlı etki eden bronkodilatör bulundurmaları önerilmelidir. Önerilen dozlar: Erişkinler (18 yaş ve üzeri): Günde iki kez 1-2 inhalasyon. Bazı hastalar için, günde toplam iki kez 4 inhalasyon dozunu aşmamak üzere daha yüksek doz kullanılması gerekebilir. Adolesanlar (12-17 yaş): Günde iki kez 1-2 inhalasyon. Çocuklar (6-11 yaş): Günde iki kez 2 inhalasyondur. Genel uygulamada günde iki kez kullanım ile semptomlar kontrol altına alındığında, semptomların kontrolünün sürdürülebilmesi için hekim tarafından hastanın uzun etkili bronkodilatöre ihtiyacı olduğu düşünülüyor ise, doz titre edilerek ulaşılan etkili en düşük doz, günde tek doz AİRBİR olarak kullanılabilir. Ayrıca bir hızlı etki eden bronkodilatör kullanımının artması, altta yatan bir kötüleşme olduğunu göstermektedir ve astım tedavisinin yeniden gözden geçirilmesi gerekmektedir. B. AİRBİR idame ve semptom giderici tedavi: AİRBİR düzenli idame tedavi olarak ve ihtiyaç halinde semptomları gidermek amaçlı alınır. Hastalara, kurtarıcı olarak AİRBİR'i her zaman yanlarında bulundurmaları öğütlenmelidir. AİRBİR'in idame ve semptom giderici tedavi şeklinde kullanımı özellikle aşağıdaki durumlarda dikkate alınmalıdır: Yetersiz astım kontrolü ve sık sık semptom giderici tedavi ihtiyacı Tıbbi müdahale gerektiren geçmişe yönelik astım alevlenmeleri Gerekli durumlarda çok sayıda ve sık AİRBİR alan hastalarda, doza bağımlı advers etkiler açısından yakın takibe ihtiyaç vardır. Önerilen dozlar: Erişkinler (18 yaş ve üzeri): Önerilen idame doz günde 2 inhalasyondur. Doz, sabah ve akşam birer inhalasyon veya sabah 2 ya da akşam 2 inhalasyon olarak alınabilir. Bazı hastalar için günde iki kez 2 inhalasyonluk idame doz uygun olabilir. Hastalar, ihtiyaç halinde semptomların giderilmesine yönelik, ilave olarak 1 inhalasyon almalıdırlar. Birkaç dakika sonra semptomlar devam ederse ilave bir inhalasyon uygulanmalıdır. Bir defada 6 inhalasyondan fazla uygulanmamalıdır. Normal şartlarda ihtiyaç duyulan toplam günlük doz 8 inhalasyondan fazla değildir. Bununla birlikte sınırlı bir süre için toplam günlük doz 12 inhalasyona kadar çıkabilir. Günde 8 inhalasyondan fazla kullanan hastalara mutlaka medikal yardım almaları önerilmelidir. Bu hastalar tekrar değerlendirilmeli ve idame tedavileri tekrar gözden geçirilmelidir. 18 yaşın altındaki adolesanlar ve çocuklar: Çocuklar ve adolesanlar için AİRBİR'in idame ve semptom giderici tedavi şeklinde kullanımı önerilmemektedir. Uygulama şekli: AİRBİR, sadece oral inhalasyon içindir. AİRBİR 3/100 mcg inhalasyon için toz içeren kapsüller yalnızca kutudan çıkan cihaz ile tatbik edilmelidir. İnhalasyon cihazı yoluyla nefes alındığında ilaç akciğerlere ulaşır. Bu nedenle, cihazın ağız parçası aracılığıyla derin ve güçlü nefes alınması önemlidir. Olası bir kandida enfeksiyonu riskini azaltmak için her AİRBİR 3/100 mcg inhalasyon için toz içeren kapsül uygulamasından sonra ağzın su ile iyice çalkalanması ve tükürülmesi önerilmektedir. Ayrıca ağzın su ile çalkalanması boğaz irritasyonunu engellemeye ve sistemik etki riskinin azaltılmasına muhtemelen yardımcı olabilir. İlacın akciğerlerdeki hedef bölgelere ulaşabilmesi ve uygun şekilde kullanıldığından emin olunması için doktor veya bir başka sağlık personeli kullanım talimatına uygun olarak cihazın nasıl kullanılacağını hastalara öğretmeli ve göstermeli, kapsüllerin sadece cihaz aracılığıyla inhalasyon yolu ile uygulanması gerektiği ve yutulmaması konusunda hastayı uyarmalıdır. Hastaların jelatin kapsülün parçalanabileceğim ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir. Hastaya jelatinin zararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazla delmemek suretiyle parçalanma olasılığı asgari düzeye indirilebilir. Kapsüller blister ambalajından kullanımdan hemen önce çıkarılmalıdır. Kullanıma ilişkin detaylı bilgi, kullanma talimatında mevcuttur. İnhalasyon cihazının doğru kullanımı için aşağıda verilen kuralları dikkatle izleyiniz. inhalasyon cihazı kullanım talimatları 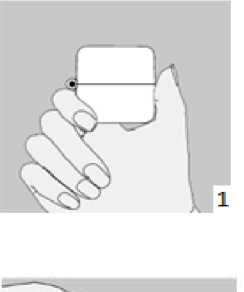 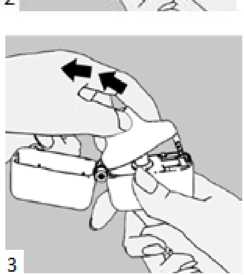 1., 2. ve 3. Toz başlığını yukarı doğru çekerek açınız. Daha sonra ağızlık parçasını açınız.
1., 2. ve 3. Toz başlığını yukarı doğru çekerek açınız. Daha sonra ağızlık parçasını açınız.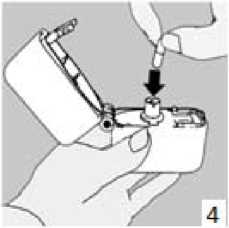 4. Blister ambalajından bir AİRBİR inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.
4. Blister ambalajından bir AİRBİR inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.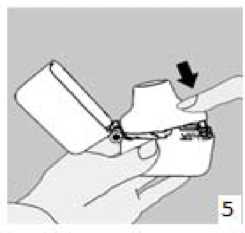 5. Ağızlık parçasını bir klik sesi duyuncaya değin sıkıca kapatınız. Toz başlığını açık bırakınız.
5. Ağızlık parçasını bir klik sesi duyuncaya değin sıkıca kapatınız. Toz başlığını açık bırakınız.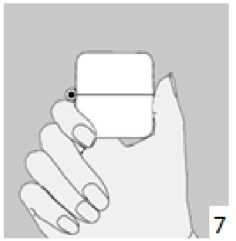 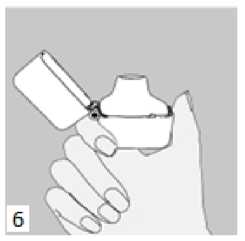 6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.
6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.Böylece kapsülde delikler açılacak ve nefes aldığınızda ilacın salıverilmesini sağlayacaktır. 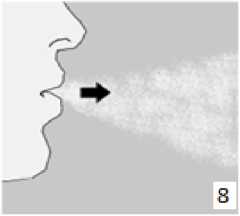 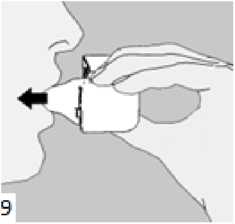 9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.
9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.
8. Nefesinizi tam olarak veriniz. Önemli: Hiçbir zaman ağızlık parçasına doğru nefes vermeyiniz. Basamak 8 ve 9'u bir kez daha tekrarlayınız, bu kapsülün tamamen boşalmasını sağlayacaktır. 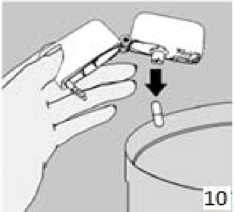 10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığını kapatınız ve inhalasyon cihazınızı yerine kaldırınız.
10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığını kapatınız ve inhalasyon cihazınızı yerine kaldırınız.inhalasyon cihazının temizleme işlemi İnhalasyon cihazını ayda bir kez yıkayınız. Kapağı ve ağızlığı açınız. Cihazı sıcak su ile yıkayarak içerisindeki tozlardan arındırınız. Cihaz içerisindeki suyu boşaltarak kağıt bez üzerinde kapak, ağızlık ve gövde kısımları açık kalacak şekilde kurumaya bırakınız. Kurumaya bırakılan cihaz kullanılmaya hazırdır. Eğer ihtiyaç varsa ağızlık kısmının dış yüzeyi ıslak olmayan nemli bir bezle silinebilir. Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği: Karaciğer ya da böbrek yetmezliği olan hastalarda AİRBİR kullanımı ile ilgili veri yoktur. Ancak budesonid ve formoterol ilk geçiş sırasında hepatik metabolizma ile elimine edildiklerinden, ağır karaciğer sirozu olanlarda maruziyet artabilir. Pediyatrik popülasyon: AİRBİR idame tedavisi Adolesanlar (12-17 yaş): Günde iki kez 1-2 inhalasyondur. Çocuklar (6-11 yaş): Günde iki kez 2 inhalasyondur. 6 yaşından küçük çocuklar: AİRBİR'in 6 yaşından küçük çocuklarda kullanılması önerilmez. AİRBİR idame ve semptom giderici tedavi 18 yaşın altındaki adolesanlar ve çocuklar: Çocuklar ve adolesanlar için AİRBİR'in idame ve semptom giderici tedavi şeklinde kullanımı önerilmemektedir. Geriyatrik popülasyon: Yaşlılarda özel doz gereksinimleri yoktur. Arformoterol ile gerçekleştirilen klinik çalışmalarda günde iki kez 15 mcg, günde iki kez 25 mcg ve plasebo kullanan hastalar arasında ventriküldeki ektopik odaktan çıkan EKG uyarıları 65-<75 yaş arası hastalarda karşılaştırılabilir olmuştur. Bununla birlikte günde bir kez 50 mcg arformoterol uygulamasında bu uyarılar daha yüksek sıklıkta gözlenmiştir. Bu bulgunun klinik anlamlılığı bilinmemektedir. 4.3. Kontrendikasyonlar AİRBİR arformoterol tartarata, rasemik formoterole, budesonide ya da inhale edilen laktoza (düşük miktarlarda süt proteinleri içerir) karşı aşırı duyarlılığı (alerji) olanlarda kullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleri Arformoterol, formoterolün (R, R)-enantiomeri olan selektif uzun etkili beta2-adrenerjik reseptör agonistidir (beta2-agonist). İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediyatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir sabit dozlu kombinasyon preparatı kullanılması önerilir. Hasta tedaviyi etkisiz bulduğunda ya da AİRBİR'in önerilen en yüksek dozundan daha fazla inhalasyon gerektiğinde doktoruna başvurmalıdır (Bkz Bölüm. 4.2). Astımın ani ve giderek kötüleşmesi hayatı tehdit eden bir durumdur, hasta acil olarak doktor kontrolüne alınmalıdır. Bu durumda kortikosteroid tedavisinin arttırılması örneğin oral yoldan bir kortikosteroid verilmesi ya da bir enfeksiyon varsa antibiyotik verilmesi uygundur. AİRBİR başka bir uzun etkili beta2-agonist ile birlikte kullanılmamalıdır. AİRBİR astımda ilk tedavi seçeneği olarak kullanılmamalıdır. Günlük AİRBİR dozu, önerilen maksimum dozu aşmamalıdır. Hastalara kurtarıcı inhaler olarak AİRBİR'i (AİRBİR idame ve semptom giderici tedavi kullanan hastalar için) veya başka hızlı etki eden bronkodilatör ilaçlarını (sadece idame tedavide AİRBİR kullanan tüm hastalar) her zaman yanlarında bulundurmaları öğütlenmelidir. Hastalar astımları aniden kötüleştiği takdirde tıbbi tedavi almaları gerektiği konusunda bilgilendirilmelidirler. Hastalar, semptomlar olmasa bile AİRBİR'in idame dozunu doktorun önerdiği şekilde almaları konusunda bilgilendirilmelidir. AİRBİR'in profilaktik kullanımı (örneğin egzersizden önce) henüz araştırılmamıştır. Astım semptomlarına karşılık AİRBİR'in semptom giderici dozları alınmalıdır, fakat bu dozlar, örneğin egzersizden önce, düzenli profilaktik kullanım amaçlı değildir. Bu tür bir amaç için başka bir hızlı etki eden bronkodilatör kullanılmalıdır. Tedavi kesileceği zaman dozun giderek azaltılması önerilmektedir. Tedavi, birden kesilmemelidir. Astım semptomları kontrol altına alındıktan sonra, AİRBİR dozunun yavaş yavaş azaltılması düşünülebilir. Tedavi dozu azaltılırken hastanın düzenli olarak kontrol edilmesi önemlidir. AİRBİR'in etkili en düşük dozu kullanılmalıdır (Bkz. Bölüm 4.2). İlaç başlandıktan sonra ilk üç ay hastalar yakından takip edilmelidir. AİRBİR ile tedavi sırasında, astımla ilişkili advers etkiler ve alevlenmeler görülebilir. Hastadan AİRBİR ile tedaviye devam etmesi, fakat AIRBİR'e başlandıktan sonra astım semptomları kontrol altına alınamazsa veya kötüleşirse tıbbi destek alması istenmelidir. İnhalasyon yoluyla uygulanan diğer tedavilerde olduğu gibi, ilaç alındıktan sonra hırıltılı soluk alıp vermekte ani bir artış ile birlikte paradoksikal bronkospazm görülebilir. Bu durumda AİRBİR ile tedavi kesilmelidir; tedavi tekrar değerlendirilmeli ve gerekirse başka bir tedaviye geçilmelidir. Uzun süre özellikle yüksek dozda inhalasyon yoluyla herhangi bir kortikosteroid kullanıldığında sistemik etkiler görülebilir. Bu etkilerin görülme olasılığı oral kortikosteroidlere oranla daha azdır. Oluşabilecek sistemik etkiler; Cushing's sendromu, Cushing benzeri özellikler, adrenal yetmezlik, kemik mineral yoğunluğunda azalma, katarakt, glokom ve daha nadir olarak çeşitli psikolojik veya psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon veya agresyonu kapsayan davranışsal etkiler (özellikle çocuklarda) ile çocuklar ve adolesanlarda büyüme geriliğidir. Uzun süre inhalasyon yoluyla kortikosteroid alan çocukların büyümeleri doktor tarafından izlenmelidir. Büyüme yavaşlarsa, inhalasyon yoluyla kullanılan kortikosteroidin dozunun düşürülmesi hedeflenerek tedavi yeniden değerlendirilmelidir. Büyüme yetersizliği riski, kortikosteroid tedavisinin sağladığı fayda ile kıyaslanmalıdır. Ayrıca hastanın, pediyatrik solunum hastalıkları uzmanına yönlendirilmesi düşünülmelidir. Uzun süreli çalışmalara ait sınırlı veriler, inhalasyon yoluyla steroid kullanan çocukların ve adolesanların büyük çoğunluğunun sonunda yetişkin boy hedeflerine ulaştığını göstermektedir. Ancak, başlangıçta, büyümede az ve geçici olarak bir gerileme (yaklaşık 1 cm) görülmüştür. Bu durum genellikle tedavinin ilk bir yılı içinde görülür. İnhalasyon yoluyla kullanılan budesonid ile yapılan uzun süreli çalışmalar çocuklarda günlük ortalama 400 mikrogram (ölçülü doz) veya yetişkinlerde günlük 800 mikrogram (ölçülü doz) dozun kemik mineral yoğunluğu üzerinde belirgin bir etkisinin olmadığını göstermiştir. AİRBİR'in daha yüksek dozları ile görülen etkilerine ilişkin bilgi yoktur. Daha önceki sistemik steroid tedavisi nedeniyle adrenal yetmezliğinin belirtileri varsa, böyle hastalar AİRBİR tedavisine alınırken dikkatli olunmalıdır. İnhalasyonla alınan budesonid tedavisinin yararı, oral steroide duyulan gereksinimi en aza indirmesidir, ancak oral steroid tedavisinden inhalasyon tedavisine geçen hastalar uzun zaman adrenal yetmezlik riski ile karşı karşıya olabilirler. Geçmişte acil olarak yüksek doz kortikosteroid tedavisi görmüş olan ya da uzun süre yüksek dozda inhalasyon yoluyla steroid kullanmış hastalar da risk altında olabilir. Yüksek dozlarda inhale kortikosteroidler ile uzun süreli, özellikle önerilenden daha yüksek dozlarla tedavi, klinik açıdan önemli adrenal baskılanmaya neden olabilir. Bu nedenle ağır enfeksiyonlar gibi stres durumlarında veya elektif operasyon uygulanan dönemlerde ilave sistemik kortikosteroid tedavisi düşünülmelidir. Steroid dozlarında hızlı azalma, akut adrenal krizleri tetikleyebilir. Akut adrenal kriz sırasında görülebilecek belirti ve işaretler kısmen belirsiz olabilir, ancak anoreksi, abdominal ağrı, kilo kaybı, yorgunluk, baş ağrısı, bulantı, kusma, bilinç seviyesinde azalma, nöbet, hipotansiyon ve hipoglisemiyi kapsayabilir. Oral tedaviden AİRBİR'e geçilirken, alerjik veya artritik belirtiler görünümünde rinit, egzama ve kas eklem ağrısı gibi genel olarak daha düşük bir sistemik steroid etki görülecektir. Bu durumlar için özel tedavi başlatılmalıdır. Nadir olarak, yorgunluk, baş ağrısı, bulantı ve kusma oluşması halinde, genel yetersiz bir glukokortikosteroid etkiden şüphelenmek gerekir. Böyle durumlarda oral glukokortikosteroid dozlarının geçici olarak arttırılması bazen gereklidir. Hastalara, ağız ve boğaz bölgesinde pamukçuk oluşma riskini azaltması için idame dozun her inhalasyonundan sonra ağızlarını suyla çalkalamaları öğütlenmelidir. Pamukçuk oluşması durumunda, ihtiyaç duyulan inhalasyonun ardından ağızlarını su ile çalkalamalıdırlar. AİRBİR ile itrakonazol ve ritonavir veya diğer güçlü CYP3A4 inhibitörleri birlikte kullanılmamalıdır (Bkz. Bölüm 4.5). Bunun mümkün olmadığı durumlarda, etkileşen ilaçların uygulanmaları arasındaki süre mümkün olduğu kadar uzun olmalıdır. Güçlü CYP3A4 inhibitörlerini kullanan hastalarda, AİRBİR idame ve semptom giderici tedavi önerilmemektedir. AİRBİR, tirotoksikoz, feokromasitoma, diabetes mellitus, tedavi edilmemiş hipokalemi, hipertrofik obstrüktif kardiyomiyopati, idiyopatik subvalvular aort stenozu, şiddetli hipertansiyon, anevrizma veya iskemik kalp hastalığı, kardiyak aritmiler (özellikle üçüncü derece atriyoventriküler blok), şiddetli kardiyak dekompansasyon, taşiaritmi ya da kalp yetmezliği gibi ağır kardiyovasküler hastalığı olanlarda dikkatli kullanılmalıdır. AİRBİR içeriğindeki arformoterol dahil beta2 uyarıcıların hiperglisemik etkileri nedeniyle, diyabetik hastalarda AİRBİR tedavisi başlatıldığında kan glukoz değerlerinin izlenmesi tavsiye edilir. Daha önceden kardiyak problemleri bulunan ve teofilin ile AİRBİR'i bir arada kullanacak hastalarda dikkatli olunmalıdır. QTc aralığı uzamış hastalarda AİRBİR kullanırken dikkatli olunmalıdır. Formoterol QTc aralığının uzamasına neden olabilir. Aktif ya da pasif akciğer tüberkülozu, solunum yollarında fungal ve viral enfeksiyonu olan hastalarda, inhalasyonla kullanılan kortikosteroidlere gerek olup olmadığı ve dozu yeniden değerlendirilmelidir. Yüksek dozda beta2-agonist tedavisi, ciddi hipokalemi ile sonuçlanabilir. Beta2-agonistlerin hipokalemiye neden olan veya ksantin türevleri, steroidler ve diüretikler gibi hipokalemik etkiyi arttıran diğer ilaçlarla birlikte kullanılması, beta2-agonistlerin olası hipokalemik etkisini arttırabilir. Hipokalemi advers etki olasılığının arttığı; değişken sıklıkta hızlı etkili bronkodilatörlerin kullanıldığı stabil olmayan astım, hipoksi nedeniyle hipokalemi riskinin artabileceği akut ağır astım ve bu riskin artabileceği diğer durumlarda özel dikkat gösterilmesi önerilmektedir. Bu tür durumlarda serum potasyum düzeylerinin dikkatle izlenmesi önerilmektedir. Bütün beta2-agonistlerde olduğu gibi, diyabetik hastalarda kan glukoz düzeyleri daha sık izlenmelidir. Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında dozun kademeli olarak azaltılması değerlendirilmeli ve eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. AİRBİR'in etkin maddesi arformoterol, uzun etkili beta2-adrenerjik agonistler sınıfına dahildir. Uzun etkili diğer bir beta2-agonist olan salmeterol ile yapılan bir çalışmada, salmeterol ile tedavi edilen hastalarda plasebo grubu ile karşılaştırıldığında astım nedeniyle ölüm oranının daha yüksek olduğu gözlenmiştir (sırasıyla 13/13176 ve 3/13179). Astımla ilişkili ölüm oranının arformoterol ile artıp artmadığına dair yeterli çalışma yürütülmemi ştir. Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. Formoterol ile yapılan klinik çalışmalar, formoterol kullanan hastalarda (özellikle 5-12 yaş arası hastalarda) ciddi astım ataklarının sıklığının plasebo alanlara göre daha yüksek olduğunu düşündürmüştür (bkz. Bölüm 4.8). Bu çalışmalar, ciddi astım alevlenme oranları açısından tedavi grupları arasındaki farkların doğru olarak ölçülmesine imkan vermemektedir. Laktoz uyarısı AİRBİR yardımcı madde olarak laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. Yardımcı madde laktoz, alerjik reaksiyonlara sebebiyet verebilecek, düşük miktarlarda süt proteinleri içerir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri CYP3A4 inhibitörleri: Budesonidin metabolik değişimi, CYP P450 3A4 ile metabolize olan maddeler tarafından (örn. ketokonazol, itrakonazol, vorikonazol, posakonazol, klaritromisin, telitromisin ve HIV proteaz inhibitörleri (ritonavir)) engellenmekte olduğundan bu ilaçlarla birlikte kullanımından kaçınılmalıdır. Bunun mümkün olmadığı durumlarda inhibitör ile budesonidin kullanımı arasındaki zaman aralığı mümkün olduğunca uzun olmalıdır. CYP P450 3A4'ün bu güçlü inhibitörlerinin birlikte kullanılması budesonidin plazma düzeylerini yükseltebilir. Güçlü CYP3A4 inhibitörlerini kullanan hastalarda, AİRBİR idame ve semptom giderici tedavi önerilmemektedir. Beta blokör ilaçlar: Beta-adrenerjik blokör ilaçlar, arformoterolün etkisini zayıflatabilir ya da tamamen inhibe edebilirler. Bu nedenle zorunlu olmadıkça, AİRBİR, beta-adrenerjik blokör ilaçlarla (göz damlaları dahil) birlikte kullanılmamalıdır. AİRBİR içeriğindeki arformoterol, beta-blokörlerin (beta1-selektif) bradikardik etkisini azaltabilir. Monoamin oksidaz inhibitörleri ve trisiklik antidepresanlar Monoamino oksidaz inhibitörleri ve trisiklik antidepresanlarla birlikte kullanıldığında QTc aralığı uzayabilir ve ventriküler aritmi riski artar. Monoamino oksidaz inhibitörleri ve furazolidon ve prokarbazin gibi benzer özellikteki ilaçlarla birlikte kullanıldığında hipertansif reaksiyonlar artabilir. Ksantin türevleri, steroidler veya diüretikler Ksantin türevleri, steroidler veya diüretikler ile birlikte tedavi beta2 agonistlerin muhtemel hipokalemik etkisini kuvvetlendirebilir. Antikolinerjik ilaçlar Antikolinerjik ilaçlar arformoterolün bronkodilatör etkisini arttırabilir. Dijital glikozidleri Dijital glikozidleri ile tedavi edilen hastalarda hipokalemi, aritmiye eğilimi arttırabilir. Sempatomimetik ilaçlar Diğer sempatomimetik maddelerin birlikte verilmesi, AİRBİR'in istenmeyen etkilerinin güçlendirebilir. Atomoksetin arformoterolden kaynaklanan taşikardiyi arttırabilir. Diğer: Kinidin, disopiramid, prokainamid, fenotiyazinler, antihistaminikler (terfenadin), makrolid antibiyotikleri ile birlikte kullanıldığında QTc aralığı uzayabilir ve ventriküler aritmi riski artar. Ayrıca L-dopa, L-tiroksin, oksitosin ve alkol, beta2-sempatomimetiklere karşı kardiyak toleransı azaltabilir. Halojenli hidrokarbon yapısındaki anestezik ilaçlarla birlikte kullanıldığında aritmi riski artar. Diğer beta-adrenerjik ilaçlarla birlikte kullanıldığında aditif etki görülebilir. Budesonid ve formoterolün astım tedavisinde kullanılan diğer ilaçlarla etkileşimi gözlenmemiştir. Özel popülasyonlara ilişkin ek bilgiler Özel popülasyonlara ilişkin herhangi bir etkileşim çalışması yürütülmemi ştir. Pediyatrik popülasyon: Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması yürütülmemi ştir. 4.6. Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (kontrasepsiyon) Gebelikte, AİRBİR tedavisine veya arformoterol ve budesonidin birlikte kullanılmasına yönelik herhangi bir klinik veri mevcut değildir. Sıçanlardaki bir embriyo-fetal gelişim çalışmasının verileri formoterol ve budesonid kombinasyonundan kaynaklanan herhangi bir artmış etkiyi işaret etmemiştir. Formoterolün hamile kadınlarda kullanımına yönelik yeterli veri mevcut değildir. Hayvan çalışmalarında, çok yüksek sistemik dozların kullanıldığı üreme çalışmalarında formoterol advers etkilere neden olmuştur (Bkz. Bölüm 5.3). Gebe kadınlarda, arformoterol ile yapılmış yeterli ve iyi kontrollü çalışma bulunmamaktadır. Sıçanlar ve tavşanlar ile yapılan çalışmalarda, arformoterolün teratojenik olduğu gösterilmiştir. Arformoterol aynı zamanda sıçanlarda yenidoğan ölümlerine ve gelişme geriliğine neden olmuştur. Diğer beta2-adrenerjik uyarıcılar gibi arformoterol de uterus düz kası üzerine gevşetici etkisi nedeniyle, doğum sürecini baskılayabilir. Yaklaşık 2000 gebeden elde edilen veriler, inhale budesonidin kullanılması ile ilişkili olarak teratojenik riskin artmadığını göstermektedir. Hayvan çalışmalarında glukokortikosteroidlerin malformasyonlara neden olduğu gösterilmiştir (Bkz. Bölüm 5.3). Bu durum, önerilen dozların verildiği insanlarda aynı değildir. Hayvan çalışmalarında, glukokortikoidlerin doğumdan önce aşırı miktarda alınmasının intrauterin gelişmede gecikme, yetişkin kardiyovasküler hastalık ve glukokortikoid reseptör yoğunluğunda, teratojenik doz aralığının altında görülen nörotransmitter döngüsü ve etkilerinde kalıcı değişikliklere yönelik bir ilişki saptanmıştır. Gebelik dönemi AİRBİR gebelikte ancak sağlanan fayda ortaya çıkabilecek risklerden fazla olduğunda kullanılabilir. Budesonidin, yeterli astım kontrolünü idame ettirecek etkili en düşük dozu kullanılmalıdır. Laktasyon dönemi Budesonid anne sütüne geçer. Ancak tedavi dozlarında kullanıldığında bebeğe zararlı etkisi olması beklenmez. Arformoterolün insanlarda anne sütüne geçip geçmediği bilinmemektedir. Arformoterol emziren sıçanların sütünde tespit edilmiştir. AİRBİR, emziren annelere, ancak anneye sağlanan faydanın, çocukta görülebilecek riskten daha fazla olması halinde verilebilir. Üreme yeteneği/Fertilite 10 mg/kg dozlarına kadar (mg/m2 temelinde yetişkinler için önerilen günlük maksimum inhalasyon dozunun yaklaşık 2700 katı) oral olarak uygulanan arformoterol, sıçanlarda fertilite ve üreme performansı üzerinde herhangi bir etkiye neden olmamıştır. 4.7. Araç ve makine kullanımı üzerindeki etkiler Arformoterol/budesonid kombinasyonunun araç ve makine kullanımı üzerindeki etkilerine yönelik veri mevcut değildir. Formoterol/budesonid kombinasyonunun araç ve makine kullanmaya herhangi bir etkisi yoktur ya da ihmal edilebilir düzeydedir. Baş dönmesi veya buna benzer yan etkiler gelişen hastalara, araç veya makine kullanmamaları önerilmelidir. İstenmeyen etkiler AİRBİR, hem budesonid hem de arformoterol içerdiğinden bu maddelerin her birine ait, aynı tipte ve aynı sıklıkta advers etkiler görülebilir. Arformoterol, formoterolün (R, R)-enantiomeri olduğundan dolayı, formoterol ile gözlenen istenmeyen etkilere benzer etkiler meydana gelmesi olasıdır. En yaygın yan etkiler; beta2-agonistlerle tedavide görülen tremor ve palpitasyon gibi yan etkilerdir. Bu etkiler hafiftir ve tedavinin birkaç günü içinde kaybolurlar. Budesonidin KOAH'da kullanıldığı 3 yıllık bir klinik çalışmada deride morarma %10 ve pnömoni %6 sıklıkla görülürken plasebo grubunda bu oranlar sırasıyla %4 ve %3 olarak saptanmıştır (sırasıyla p<0.001 ve p<0.01). Yan etkiler organ sınıfı ve sıklığa göre sıralanmıştır. Sıklık tanımlaması: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
** Belirtilen advers etkiler pazarlama sonrası deneyim süresince formoterol ile tedavi edilmekte olan hastalarda bildirilmiştir. *** Çocuklarda daha seyrek gözlenmektedir. Diğer inhalasyon tedavilerinde olduğu gibi bazı vakalarda nadiren paradoksikal bronkospazm gelişebilir. Paradoksikal bronkospazm çok seyrek gözlenen bir olgudur ve doz uygulamasından sonra hırıltıda ani bir artış ve nefes darlığı ile meydana gelebilir. Paradoksikal bronkospazm meydana geldiği takdirde hızlı etkili bir inhale bronkodilatör ile tedavi edilmelidir. Tedavi hemen sonlandırılmalı ve gerekli ise alternatif bir tedavi uygulanmalıdır. Beta2-agonistlerle tedavi, insülin, serbest yağ asitleri, gliserol ve keton cisimlerinin kan düzeyinin yükselmesine neden olabilir. Orofarinkste gözlenen kandida enfeksiyonu ilaç birikiminden kaynaklanmaktadır. Kandida enfeksiyonu riskini minimuma indirgemek için hastalara ilaç uygulamasından sonra ağızlarını su ile çalkalamaları öğütlenmelidir. İnhale kortikosterodilerle tedaviye başlayan yeni tanılı KOAH hastalarında pnömoni gelişme riskinde artış vardır. Bununla birlikte budesonid ile tedavi edilen 4643 KOAH hastasının ve inhale kortikosteroid ile tedavi görmeyen 3643 KOAH hastasının katıldığı 8 klinik çalışmanın değerlendirmesi pnömoni için artmış risk göstermemiştir. Bu 8 çalışmanın 7'sinden elde edilen sonuçlar meta analiz olarak yayımlanmıştır. Uzun süre özellikle yüksek dozda inhalasyon yoluyla herhangi bir kortikosteroid kullanıldığında sistemik etkiler görülebilir. Bu etkilerin görülme olasılığı oral kortikosteroidlere oranla daha azdır. Oluşabilecek sistemik etkiler; Cushing's sendromu, Cushing benzeri belirtiler, adrenal yetmezlik, çocuklar ve adolesanlarda büyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt ve glokomdur. Enfeksiyonlara karşı artmış hassasiyet ve stres koşullarına adapte olmada azalma da meydana gelebilir. Etkiler muhtemelen doza, uygulama süresine, birlikte kullanılan veya daha önceki steroid maruziyetine ve bireysel hassasiyete bağlıdır. 4.8. Doz aşımı ve tedavisi Arformoterolün doz aşımı durumunda tremor, baş ağrısı, metabolik asidoz, sedasyon, hipertansiyon, anjina, hipertansiyon veya hipotansiyon, sinirlilik, ağız kuruluğu, kas krampları, baş dönmesi, fatig, kırıklık, insomnia, palpitasyon gibi beta2- agonistlere bağlı tipik etkiler görülebilir. Formoterol ile izole vakalarda bildirilen belirtiler; taşikardi, hiperglisemi, hipokalemi, QTc aralığında uzama, aritmi, bulantı ve kusmadır. Destekleyici ve semptomatik tedavi uygulanabilir. Ciddi vakalarda hastalar hastaneye yatırılmalıdır. Kardiyoselektif beta-blokörlerin kullanılması düşünülebilir, fakat beta-adrenerjik blokör kullanımı bronkospazma neden olabileceğinden bu tedavi yalnızca doktor gözetimi altında ve çok dikkatli uygulanmalıdır. Serum potasyum düzeyi izlenmelidir. Akut bronşiyal obstrüksiyonu olan hastaya 3 saat içinde verilen formoterolün 90 mikrogramlık bir dozu güvenilirlik konusunda sorun yaratmamıştır. Çok yüksek dozlarda olsa bile, akut budesonid doz aşımının klinik açıdan sorun oluşturması beklenmez. Uzun süre çok yüksek dozlarda kullanılırsa, hiperkortisizm ve adrenal baskılanması gibi sistemik glukokortikosteroid etkileri ortaya çıkabilir. Arformoterol doz aşımına bağlı olarak AİRBİR tedavisinin kesilmesi gerekirse, inhalasyon yoluyla kullanılan uygun bir kortikosteroid tedavisinin uygulanması düşünülmelidir. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik grup: Adrenerjikler ve obstrüktif solunum yolu hastalıklarında kullanılan diğer ilaçlar ATC kodu: Arformoterol R03AC Budesonid R03BA02 Etki mekanizması ve farmakodinamik etkiler: AİRBİR, arformoterol ve budesonid içerir ve her ikisinin de etki mekanizmaları farklıdır ve astım alevlenmelerinin azalabilmesi için aditif etki gösterirler. Budesonid ve arformoterolün spesifik özellikleri bu kombinasyonun, hem idame hem de semptom giderici tedavide kullanılmasını sağlamaktadır. Arformoterol Formoterol, geri dönüşümlü solunum yolu obstrüksiyonu olan hastalarda inhale edildiğinde, bronş düz kasında hızlı ve uzun etkili gevşeme sağlayan, selektif bir beta2-adrenerjik agonisttir. Bronş genişletici etkisi doza bağımlı olarak 1-3 dakika içinde hızla başlar ve tek bir dozdan sonra etkisi en az 12 saat sürer. Formoterolün (R, R)-enantiomeri olan arformoterol selektif uzun etkili beta2-adrenerjik reseptör agonistidir (beta2-agonist) ve rasemik formoterolden [hem (S,S) hem de (R, R)-enantiomerlerini içermektedir] iki kat daha güçlü etkiye sahiptir. (S, S)-enantiomeri bir beta2-agonisti olarak (R, R)-enantiomerinden yaklaşık 1000 kat daha az güçlüdür. Beta2-reseptörleri bronşiyal düz kasta ve beta1-reseptörleri kalpte en baskın adrenerjik reseptörler olarak tanımlanmasına rağmen, veriler ayrıca beta2-reseptörlerin insan kalbinde toplam beta-adrenerjik reseptörlerin %10-%50'sini oluşturduğunu belirtmektedir. Bu reseptörlerin kesin fonksiyonu belirlenememiştir, fakat bu reseptörler oldukça selektif beta2-agonistlerin kardiyak etkilerinin olma olasılığını arttırmaktadır. Arformoterol de dahil olmak üzere beta2-adrenoseptör agonist ilaçlarının farmakolojik etkileri en azından kısmen hücre içi adenil siklazın uyarılmasına bağlanabilir. Hücre içi adenil siklaz enzimi adenozin trifosfatın (ATP) siklik-3',5'-adenozin monofosfata (siklik AMP) dönüşümünü katalizler. Hücre içi siklik AMP seviyelerinin artması, bronşiyal düz kasların rahatlamasına ve hücrelerden özellikle de mast hücrelerinden ani aşırı duyarlılık mediyatörlerinin salınımının engellenmesine neden olur. İn vitroİn vitrove hayvansal bulguların insanlarla ilgili anlamlılığı bilinmemektedir.Budesonid: Budesonid inhale edildiğinde, solunum yollarında doza bağımlı antienflamatuvar etki gösteren, semptomlarda ve astım alevlenmelerinde azalma sağlayan bir glukokortikosteroiddir. İnhale edilen budesonid, sistemik kortikosteroidlere göre daha az ciddi advers etkilere sahiptir. Glukokortikosteroidlerin bu antienflamatuvar etkisinden sorumlu olan esas mekanizma bilinmemektedir. 5.2. Farmakokinetik özellikler Genel özellikler Arformoterol, formoterolün (R, R)-enantiomeri olduğundan kombinasyona ait farmakokinetik veriler formoterol/budesonid kombinasyonu üzerinden verilmiştir. Emilim:Formoterol/Budesonid kombinasyonu ve bileşimindeki budesonid ve formoterolü tek başına içeren ilaçların, budesonid ve formoterolün sistemik yararlanımları açısından biyoeşdeğer olduğu gösterilmiştir. Buna rağmen formoterol ve budesonidi tek başına içeren ilaçlarla kıyaslandığında, formoterol/budesonid kombinasyonu ile kortizol baskılanmasında hafif bir artış görülmüştür. Bu farkın klinikteki güvenilirlik üzerine bir etkisi yoktur. Budesonid ve formoterolün farmakokinetik etkileşimine ilişkin bir kanıt yoktur. Budesonid ve formoterolü tek başına içeren preparatların veya formoterol/budesonid kombinasyonunun uygulanmasından sonra her bir maddenin farmakokinetik parametreleri karşılaştırılabilir. Budesonid, kombinasyon şeklinde uygulandığında, eğri altındaki alanı (AUC) biraz yüksek, emilimi daha hızlı ve doruk plazma konsantrasyonu biraz daha yüksektir. Formoterol tek başına ya da kombinasyon şeklinde kullanıldığında, doruk plazma konsantrasyonları birbirine yakındır. İnhalasyonla alınan budesonid hızla emilir ve doruk plazma konsantrasyonuna 30 dakika içinde ulaşılır. Yapılan çalışmalarda, kuru toz inhaleri aracılığıyla inhale edilen budesonidin akciğerlere ulaşan miktarı, hastaya ulaşan dozun %32-44'ü kadardır. Uygulanan dozun sistemik yararlanımı, hastaya ulaşan dozun yaklaşık %49'u kadardır. 6-16 yaş çocuklarda akciğerdeki depozisyonu, aynı doz verilen yetişkinler ile aynı aralığa denk gelmektedir, sonuç plazma konsantrasyonları saptanmamıştır. İnhale edilen formoterol hızla emilir ve 10 dakika içinde doruk plazma konsantrasyonuna ulaşır. Yapılan çalışmalarda, kuru toz inhaleri aracılığıyla inhale edilen formoterolün akciğerlere ulaşan miktarı, hastaya ulaşan dozun %28-49'udur. Sistemik yararlanım, hastaya ulaşan dozun yaklaşık %61'i kadardır. Dağılım ve metabolizma:Formoterol yaklaşık %50, budesonid %90 oranında plazma proteinlerine bağlanır. Dağılım hacmi, formoterol için yaklaşık 4 L/kg, budesonid için ise yaklaşık 3 L/kg'dır. Formoterol konjugasyon reaksiyonları ile metabolize olur (aktif O-demetilasyon ve deformilasyon metabolitleri oluşur, ancak bunlar inaktif konjugatlar olarak görülür). Budesonid karaciğerden ilk geçişi sırasında (yaklaşık %90) ilk geçiş metabolizmasına uğrayarak glukokortikosteroid aktivitesi düşük metabolitlerine dönüşür. En önemli metabolitleri olan 6-P-hidroksibudesonid ve 16-a-hidroksiprednizolonun glukokortikosteroid aktivitesi budesonidin aktivitesinin %1'inden azdır. Budesonid ve formoterol arasında herhangi bir metabolik etkileşim ya da yer değiştirme reaksiyonları olduğuna ilişkin bulgu yoktur. Eliminasyon:Formoterol dozunun büyük bir kısmı karaciğerde metabolize olarak böbrekler aracılığıyla atılır. İnhalasyondan sonra hastaya ulaşan formoterol dozunun %8-13'lük miktarı metabolize edilmeden idrarla atılır. Formoterolün sistemik klerensi yüksektir (yaklaşık 1.4 L/dak.) ve plazma yarılanma süresi ortalama 17 saattir. Budesonid, CYP3A4 enziminin katalize ettiği reaksiyonlar ile metabolize olarak atılır. Budesonid metabolitleri, aynen ya da konjuge edilerek böbrekler aracılığıyla atılır. İdrarda değişmemiş halde budesonid miktarı ihmal edilebilir düzeydedir. Budesonidin sistemik klerensi yüksektir (yaklaşık 1.2 L/dak.) ve intravenöz yoldan uygulandığında plazma eliminasyon yarılanma süresi ortalama 4 saattir. Hastalardaki karakteristik özellikler Böbrek yetmezliği:Formoterol ve budesonidin böbrek yetmezliği olan hastalardaki farmakokinetiği konusunda bilgi yoktur. Karaciğer yetmezliği:Karaciğer yetmezliği olanlarda budesonid ve formoterolün sistemik yararlanımı artabilir. Pediyatrik popülasyon:Formoterol ve budesonidin çocuklardaki farmakokinetiği konusunda bilgi yoktur. 5.3. Klinik öncesi güvenlilik verileri Budesonid ve formoterol tek başına ya da ikisinin kombinasyonu ile hayvanlarda yapılan toksisite çalışmalarında görülen etkiler abartılmış farmakolojik etkilerdir. Üreme ile ilgili hayvan çalışmalarında budesonid gibi kortikosteroidlerin malformasyonlara (yarık damak, iskelet malformasyonları) sebep olduğu gösterilmişse de bu etkilerin önerilen dozlarla tedavi edilen insanlar için geçerli olmadığı görülmüştür. Hayvanlarda, formoterol ile yapılan üreme çalışmalarında, sistemik yararlanımın yüksek olduğu erkek sıçanlarda fertilitede azalma ve sistemik yararlanımın klinikteki kullanımdan önemli ölçüde yüksek olduğu durumlarda, implantasyon kayıpları ile birlikte postnatal yaşam süresinde ve doğum kilosunda azalma gözlenmiştir. Ancak bu hayvan deneylerinin sonuçları insanlar için geçerli değildir. Arformoterolün karsinojenik potansiyelini değerlendirmek için farelerde (oral yol ile uygulama) ve sıçanlarda (inhalasyon yolu ile uygulama) uzun süreli çalışmalar yürütülmüştür. CD-1 fareleriyle gerçekleştirilen 24 aylık karsinojenite çalışmasında, 1 mg/kg üzerindeki oral arformoterol dozları dişi farelerde uterin ve servikal endometriyal stromal poliplerin ve stromal hücre sarkomlarının insidansında doz ile ilişkili artışa neden olmuştur (EAA maruziyeti, yetişkinler için önerilen günlük maksimum inhalasyon dozunun uygulanmasının ardından gözlenen maruziyetin yaklaşık 70 katı'dır). Sprague-Dawley sıçanları ile gerçekleştirilen 24 aylık karsinojenite çalışmasında 200 mcg/kg inhale arformoterol dozu dişi sıçanlarda tiroid bezi hücre adenom ve karsinomların insidansında istatistiksel olarak anlamlı artışa neden olmuştur (EAA maruziyeti, yetişkinler için önerilen günlük maksimum inhalasyon dozunun uygulanmasının ardından gözlenen maruziyetin yaklaşık 130 katı'dır). 40 mcg/kg inhalasyon dozunda tümör bulgularına rastlanmamıştır (EAA maruziyeti, yetişkinler için önerilen günlük maksimum inhalasyon dozunun uygulanmasının ardından gözlenen maruziyetin yaklaşık 55 katı'dır). Bakterilerde gerçekleştirilen mutajenite testlerinde, memeli hücrelerinde gerçekleştirilen kromozom aberasyon analizlerinde ve farelerde gerçekleştirilen mikronükleus testlerinde arformoterolün mutajenik veya klastojenik olmadığı gösterilmiştir. 6. FARMASÖTİK ÖZELLİKLER 6.1. Yardımcı maddelerin listesi Laktoz 6.2. Geçimsizlikler Geçerli değil. 6.3. Raf ömrü 24 ay 6.4. Saklamaya yönelik özel tedbirler 25°C'nin altındaki oda sıcaklığında ve kuru yerde saklayınız. 6.5. Ambalajın niteliği ve içeriği AİRBİR 3/100 mcg inhalasyon için toz içeren 60 ve 120 kapsül, PVC/PVDC/Alü blister ambalajlarda inhalasyon cihazı ve kullanma talimatı ile birlikte karton kutuda sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİ Neutec İnhaler İlaç San. ve Tic. A.Ş. Sakarya 1. Organize Sanayi Bölgesi 2. Yol No:3 Arifiye / Sakarya Tel: 0850 201 23 23 Faks: 0212 482 24 78 e-mail: [email protected] 8. RUHSAT NUMARASI (LARI) 255/68 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TA RİHİİlk ruhsat tarihi:26.12.2013 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ 25 |
İlaç BilgileriAirbir 3/100 Mcg İnhalasyon İçin Toz İçeren KapsülEtken Maddesi: Arformoterol Tartarat/budesonid Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.