Airplus 50/500mcg Capsair İnhalasyon İçin Toz Içe... Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Adrenerjikler (İnhalan) » Adrenerjikli Kombinasyonlar » Salmeterol Kombinasyonları KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIAİRPLUS 50/500 mcg capsair inhalasyoD için toz içeren kapsül2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Salmeterol ksinafoat* 72,65 mcg Flutikazon propiyonat 500 mcg *50 mcg Salmeterol'e eşdeğer. Yardımcı maddeler: Laktoz 12,42735 mg Yardımcı maddeler için 6.1 'e bakınız. 3. FARMASÖTİK FORMU İnhalasyon için toz içeren kapsül Flesh opak, natural transparan renk kapsül içerisinde beyaz toz. 4. KLİNİK ÖZELLİKLER 4.1 Terapötik endikasyonlar Astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan İtibaren verilir. Orta ve ağır KOAH olgularında semptomları ve atak sıklığım azaltır. 43.Pozoloji ve uygulama şekli PozolojiAıygulama sıklığı ve sûresi:AİRPLUS sadece İnhalasyon yolu ile uygulanır. Hastalar» belirtileri olmasa dahi optimum fayda için AİRPLUS'ı düzenli olarak kullanmaları gerektiği konusunda uyarılmalıdır. Hastaların düzenli olarak doktor kontrolünde bulundurularak aldıkları AİRPLUS dozunun optimum düzeyde kalması sağlanmalı ve sadece doktor önerisi ile değiştirilmelidir. Astım Doz, belirtileri etkili olarak kontrol eden en düşük doza ayarlanmalıdır. Günde 2 kez uygulanan AİRPLUS ile belirtilerin kontrolü sağlandığında, etkili en düşük doz açısından, günde 1 kez uygulanan AİRPLUS da değerlendirmeye dahil edilebilir. Hastalara hastalıklarının şiddetine göre uygun flutikazon propiyonat dozu içeren AİRPLUS verilmelidir. Eğer hasta yalnız inhale kortikosteroid tedavisi ile yeterli derecede kontrol edilemiyorsa tedavinin terapötik olarak eşdeğer kortikosteroid dozunda AİRPLUS ile değiştirilmesi astım kontrolünde düzelme sağlayabilir. Astımı yalnız inhale kortikosteroid tedavisi ile yeterli derecede kontrol edilebilen hastalarda tedavinin AİRPLUS ile değiştirilmesi astım kontrolünü sürdürürken kortikosteroid dozunun azaltılmasını sağlayabilir. Daha ayrıntılı bilgi için lütfen Farmakodmamik özellikler bölümüne bakınız. Tavsiye Edilen Dozlar: 12 yaş ve üzeri ergenler: Günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 100 mikro gram flutikazon propiyonat). veya günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 250 mikrogram flutikazon propiyonat).veyagünde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 500 mikrogram flutikazon propiyonat). 18 yaş ve üzeri yetişkinler: Yetişkinlerde 14 güne kadar tüm AİRPLUS dozlarının iki katma çıkarılması ile düzenli olarak günde iki kez alınan doz karşılaştırılabilir güvenlilik ve tolerabilitededir ve bu durum astım tedavi rehberlerinde gösterildiği gibi hastalar ilave kısa süreli inhale kortikosteroid tedavisine ihtiyaç duyduklarında (14 güne kadar) göz önünde bulundurulabilir. Kronik Obstrüktif Akciğer Hastalığı (KOAH) Yetişkin hastalar için tavsiye edilen doz günde 2 kez 1 iohalasyon 50/250 mikrogram-50/500 mikro gram salmeterol/flutikazon propiyonattır. Günde iki kez alınan 50/500 raikrogramlık maksimum salmeterol/flutikazon propiyonat dozunun tüm nedenlere bağlı ölümleri azalttığı gösterilmiştir (Bkz. 5.2 Klinik çalışmalar). Uygulama şekli:AİRPLUS, sadece o rai inhalasyon içindir.AİRPLUS inhalasyon tozu kapsülleri yalnızca kutudan çıkan cihaz ile tatbik edilmelidir, inhalasyon cihazı yoluyla nefes alındığında ilaç akciğerlere ulaşır. Bu nedenle, cihazın ağız parçası aracılığıyla derin ve güçlü nefes alınması önemlidir. Olası bir kandida enfeksiyonu riskini azaltmak için her doz uygulamasından sonra ağzın su ile iyice çalkalanması ve tükürülmesi önerilmektedir. Ayrıca ağzın su ile çalkalanması boğaz irritasyonunu engellemeye ve sistemik etki riskinin azaltılmasına muhtemelen yardımcı olabilir. İlacın akciğerlerdeki hedef bölgelere ulaşabilmesi ve uygun şekilde kullanıldığından emin olunması için doktor veya bir başka sağlık personeli kullanım talimatına uygun olarak cihazın nasıl kullanılacağını hastalara öğretmeli ve göstermeli, kapsüllerin sadece cihaz aracılığıyla inhalasyon yolu ile uygulanması gerektiği ve yutulmaması konusunda hastayı uyarmalıdır. Hastaların jelatin kapsülün parçalanabileceğin! ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir. Hastaya jelatinin zararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazla delmemek suretiyle parçalanma olasılığı asgari düzeye indirilebilir.Kapsüller blister ambalajından kullanımdan hemen önce çıkarılmalıdır.Kullanıma ilişkin detaylı bilgi kullanma talimatında mevcuttur. İnhalasyon c ihadının doğru kullanımı için aşağıda verilen kuralları dikkatle izleyiniz.12. ve 3. Toz başlığım yu kan doğru çekerek açınız. Daha sonra ağızlık parçasını açuuz. 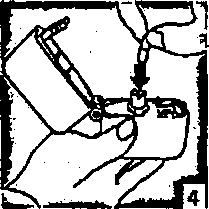 4. Blister ambalajından bir AİRPLUS inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.
4. Blister ambalajından bir AİRPLUS inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir. 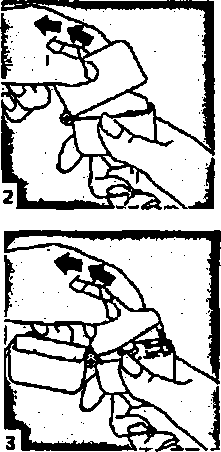 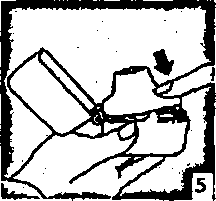 5. Ağızlık parçasını bir klik sesi duyuncaya değin sıkıca kapatınız. Toz başlığını açık bırakınız.
5. Ağızlık parçasını bir klik sesi duyuncaya değin sıkıca kapatınız. Toz başlığını açık bırakınız.  6. ve 7. İnhalasyon cihazım ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.
6. ve 7. İnhalasyon cihazım ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.Böylece kapsülde delikler açılacak ve nefes aldığınızda ilacın salıverilmesini sağlayacaktır. 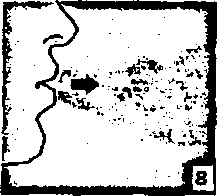 8. Nefesinizi tam olarak veriniz.
8. Nefesinizi tam olarak veriniz.önemli: Hiçbir zaman ağızlık parçasına doğnı nefes vermeyiniz. 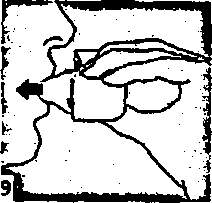 9. İnhalasyon cihazının ağzım açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.
9. İnhalasyon cihazının ağzım açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.Basamak 8 ve 9'n bir kez daha tekrarlayınız, bu kapsülün tamamen boşalmasını sağlayacaktır. 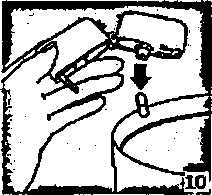 10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığım kapatınız ve inhalasyon cihazınızı yerine kaldırınız.
10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığım kapatınız ve inhalasyon cihazınızı yerine kaldırınız.İnhalasyon cihazını temizleme İşlemi İnhalasyon cihazım ayda bir kez yıkayınız, Kapağı ve ağızlığı açınız. Cihazı sıcak su ile yıkayarak içerisindeki tozlardan arındırınız. Cihaz içerisindeki suyu boşaltarak kağıt bez üzerinde kapak, ağızlık ve gövde kısımları açık kalacak şekilde kurumaya bırakınız. Kurumaya bırakılan cihaz kullanılmaya hazırdır. Eğer ihtiyaç varsa ağızlık kısmının dış yüzeyi ıslak olmayan nemli bir bezle silinebilir. Özel popfllasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği: Doz modifikasyonu gerekli değildir. Pediyatrik popfilasyon: 4-12 yaş arası çocuklarda AİRPLUS 50/100 mikrogranı inhalasyon için toz içeren kapsül kullanılır. 4 yaşından küçük çocuklarda AİRPLUS kullanımı ile ilgili bilgi yoktur. Gcriyatrik popOlasyon: Doz modifikasyonu gerekli değildir. 43KontrendikasyonlarAİRPLUS, bileşenlerinden herhangi birine karşı aşın duyarlılığı olan hastalarda kontrendikedir (Bkz. 6.1 Yardımcı maddeler listesi). 4.4 Özel kullanım uyarıları ve ÖnlemleriAstım tedavisinde normalde kademeli bir program izlenmelidir ve hastanın yanıtı klinik olarak ve akciğer fonksiyon testleriyle izlenmelidir.AİRPLUS hafif astım tedavisi için önerilmez. AİRPLUS hızlı ve kısa etkili bir bronkodilatörün (örneğin salbutamol) kullanımuıı gerektiren akut belirtileri rahatlatmak için değildir. Hastalara rahatlamak için kullanmaları gereken ilaçlan her zaman yanlarında bulundurmaları tavsiye edilmelidir. Belirtileri gidermek için kısa etkili bronkodilatör kullanımının artması astım kontrolünün kötüleştiğini gösterir ve bu durumda olan hastalar bir hekim tarafından tekrar muayene edilmelidir. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. Astım kontrolünün ani ve ilerleyen şekilde kötüleşmesi hayatı tehdit eden bir durumdur ve hastanın bir hekim tarafından tekrar muayene edilmesi gereklidir. Kortikosteroid dozunun artırılması düşünülmelidir. AİRPLUS'ın mevcut dozunun astımı yeterli derecede kontrol edemediği dununda hasta hekim tarafından tekrar muayene edilmelidir. Hastalar alevlenme dönemlerinde ise ya da Önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. Astımlı ya da KOAHMı hastalarda alevlenme bir enfeksiyon ile ilişkili ise ilave kortikosteroid tedavisi ve antibiyotik uygulanması düşünülmelidir. Astımlı hastalarda alevlenme riski nedeniyle AİRPLUS tedavisi ani olarak kesilmemelidir, tedavi dozu hekim gözetiminde kademeli olarak azaltılmalıdır. KOAH'lı hastalarda tedavinin kesilmesine semptomatik dekompanzasyon eşlik edebilir ve tedavinin kesilmesi bir hekim gözetiminde yapılmalıdır. KOAH'da yİlksek doz kullanımının avantaj sağladığına ilişkin klinik kanıtlar yetersizdir.AİRPLUS alan KOAH'lı hastalarla yapılan çalışmalarda pnömoni bildirimlerinde artış olmuştur (Bkz. 4.8 İstenmeyen etkiler). Alevlenme ve pnömoninin klinik özellikleri sıklıkla birbirleriyle Örtüştüğünden, hekimler KOAH'lı hastalarda pnömoni gelişmesi olasılığına karşı dikkatli olmalıdır.Kortikosteroid içeren tüm inimle ilaçlarla olduğu gibi» aktif veya sessiz akciğer tüberkülozu olan hastalarda AİRPLUS dikkatli kullanılmalıdır. AİRPLUS tirotoksikozlu hastalarda dikkatli kullanılmalıdır. Tüm sempatomimetik ilaçlarla, özellikle terapötik dozlardan daha, yüksek dozlarda uygulandıklarında, bazen sistolik kan basıncında ve kalp hızında artış gibi kardiyovasküler etkiler görülebilir. Bu nedenle AİRPLUS önceden kardiyovasküler hastalığı olanlarda dikkatli kullanılmalıdır. Tüm sempatomimetik ilaçlarla, terapötik dozdan daha yüksek dozlarda uygulandıklarında serum potasyum düzeylerinde geçici bir azalma meydana gelebilir. Bu nedenle, düşük serum potasyum düzeylerine eğilimi olan hastalarda AİRPLUS dikkatli kullanılmalıdır. Herhangi bir inhale kortikosteroid Özellikle yüksek dozlarda, uzun süre kullanıldığında sistemik etkiler oluşabilir. Oral kortikosteroid uygulamasına göre bu etkilerin oluşma olasılığı çok daha azdır (Bkz. 4.9 Doz aşımı ve tedavisi). Olası sistemik etkiler; Cushing sendromu, Cushing benzeri belirtiler, adrenal supresyon, çocukların ve adolesanlann büyümesinde gecikme, kemik minemi dansitesinde azalma, katarakt ve glokomu içerir. Bu nedenle, astımı olanlarda inhale kortikosteroid dozunun, etkili kontrolü sağlayan en düşük doza ayarlanması Önemlidir. Stres yaratması muhtemel acil ve elektif durumlarda adrenal yanıt bozukluğu olasılığı daima akılda tutulmalıdır ve uygun kortikosteroid tedavisi düşünülmelidir (Bkz. 4.9 Doz aşımı ve tedavisi). Uzun süre inhale kortikosteroid tedavisi alan çocukların boyunun düzenli olarak izlenmesi tavsiye edilmektedir. Bazı bireyler inhale kortikosteroidlere çoğu hastada olduğundan daha fazla duyarlılık gösterebilir. Yetersiz adrenal cevap olasılığından dolayı, oral steroid tedavisinden inhale flutikazon propiyonat tedavisine geçirilen hastalar yakından izleyerek tedavi edilmeli ve adrenal fonksiyon düzenli olarak izlenmelidir. Sistemik kortikosteroidlerin kesilmesinden sonra hipotalamik pituiter adrenal aks (IIPA) fonksiyonlarının düzelmesi için birkaç ay geçmesi gerekmektedir. Stres ve şiddetli astım ataklarında sistemik steroid tedavisi kesilmiş olan hastalar tekrar oral kortikosteroid tedavisine başlamaları ve acil olarak hekimlerine başvurmaları hususunda bilgilendirilmelidir. inhale flutikazon propiyonat tedavisine geçildiğinde, sistemik steroid dozu yavaş yavaş azaltılmalı ve hastalar stres zamanlarında ve şiddetli astım ataklarında ilave tedavi için gereklilik olabileceğini gösteren steroid uyan kartlan taşımalan hususunda teşvik edilmelidir.inhale flutikazon propiyonat tedavisine başlandığında, sistemik steroid dozu kademeli olarak azaltılmalı ve hastalar stres zamanlarında ek tedavinin gerekli olabileceğini gösteren steroid uyan kartı taşımaları konusunda teşvik edilmelidir. Nadiren kan glukoz düzeylerinde artış rapor edilmiştir (Bkz. 4.8 İstenmeyen etkiler) ve diabetes mellitus öyküsü olan hastalara reçete edilirken bu husus göz Önünde bulundurulmalıdır. Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen Ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. ABD'de yapılan SMART adlı büyük çaplı bir çalışmada standart tedaviye eklenen salmeterol (salmeterol-flutikazon propiyonatın bir bileşeni) veya plasebo karşılaştırılmış ve elde edilen verilere göre salmeterol uygulanan hastalarda astıma bağlı ölümlerde anlamlı bir artış görülmüştür. Bu çalışmada elde edilen veriler Afro-Amerikalı hastaların, salmeterol kullanımı sırasında plaseboya kıyasla solunum ile ilgili ciddi olay veya ölüm riskine daha fazla maruz kalabileceğini düşündürmektedir. Bu artışın fârmakogenetiğe veya diğer faktörlere bağlı olup olmadığı bilinmemektedir. SMART çalışması, inhalasyon yoluyla eşzamanlı kortikosteroid kullanımının astıma bağlı ölüm riskim artınp artırmadığının belirlenmesi amacıyla tasarlanmamıştır (Bkz 5.1 Fannakodinamik özellikler). İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediatrik ve adölesan hastalarda, her İki ilaca uyumu garanti altında almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. Laktoz uyarısı AlRPLUS'ın her bir dozu 12,42735 mg laktoz içermektedir. Bu miktar, laktoz intoleransı olan kişilerde normalde bir probleme neden olmamaktadır. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriKullanımı zorunlu olmadıkça, selektif veya selektif olmayan beta-blokerlerin kullanılmasından kaçınılmalıdır.Diğer beta adreneıjik içeren ilaçların eşzamanlı kullanımı potansiyel aditif etkiye sahip olabilir. Normal şartlar altında, inhalasyon yolu ile uygulanmasından sonra, geniş ilk geçiş metabolizması ve karaciğer ve bağırsakta sitokrom P450 3A4'0n aracılık ettiği yüksek sistemik klerens sonucu, flutikazon propiyonatın düşük plazma konsantrasyonlarına ulaşılır. Bu nedenle, flutikazon propiyonatın aracılık ettiği klinik olarak anlamlı ilaç etkileşimi olası değildir. Sağlıklı gönüllüler Üzerinde yapılan bir ilaç etkileşim çalışması, ritonavirin (oldukça güçlü sitokrom P450 3A4 inhibitörü), flutikazon propiyonatın plazma konsantrasyonlarını büyük oranda artırabildiğini ve serum kortizol konsantrasyonlarında anlamlı azalmaya yol açtığım göstermiştir. Pazarlama sonrası kullanım sırasında intranazal veya inhale flutikazon propiyonat ve ritonavir alan hastalarda Cushing sendromu ve adrenal supresyon dahil sistemik kortikosteroid etkiler ile sonuçlanan klinik olarak anlamlı ilaç etkileşimleri bildirilmiştir. Bu nedenle, hastaya olan potansiyel yaran sistemik kortikosteroid yan etkileri riskinden fazla olmadıkça, ritonavir ve flutikazon propiyonatın birlikte kullanımından kaç ınılmalıdır.Çalışmalar, diğer sitokrom P450 3A4 inhibitörlerinin, serum kortizol konsantrasyonlarında Önemli bir düşüş olmadan flutikazon propiyonata sistemik maruziyette ihmal edilebilir (eritromism) ve küçük (ketokonazol) artışlara neden olduklarım göstermiştir. Bununla birlikte, flutikazon propiyonata sistemik olarak manız kalma potansiyeli artacağından, güçlü P450 3A4 inhibitörlerİ (örneğin ketokonazol) ile birlikte kullanıldığında dikkatli olunmalıdır. Bir ilaç etkileşim çalışmasında eşzamanlı sistemik ketokonazol kullanımının plazma salnıeterol manıziyetini anlamlı derecede artırdığı gözlenmiştir (Cmaks 1*4 kat ve EAA 15 kat), bu durum QTc aralığında uzamaya neden olabilir (Bkz 5.2 Farmakokinetik Özellikler). Güçlü CYP3A4 inhibitörleri (örn, ketokonazol) ile salmeterol birlikte uygulandığında dikkatli olunmalıdır. Ketokonazol ile eşzamanlı kullanımından, tedavinin yararlan salmeterolün artan sistemik yan etkiler riskinden daha yüksek olmadığı sürece kaçınılmalıdır. Diğer potent CYP3A4 inhibitörleri ile benzer bir etkileşim riskinin olması muhtemeldir (Örn, itrakonazol, telitromisin, ritonavir). 4.6 Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) AİRPLUS'ın doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır. Gebelik dönemiGebelikte kullanım ile ilgili yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar fireme toksisitesinin bulunduğunu göstermiştir (Bkz. 5.3 Klinik Öncesi güvenlilik verileri). İnsanlara yönelik potansiyel risk bilinmemektedir.Tek ilaç veya kombinasyon halindeki ilaçlarla hayvanlar üzerinde yapılan Öreme toksisite çalışmaları, güçlü bir beta 2 adrenoreseptör agonistinin ve glukokortikosteroidin aşın sistemik maruzjyet seviyelerinde beklenen fötal etkilerini açığa çıkarmıştır. İlaç kullanımı ancak anneye sağlaması beklenen yaran fetusa olan olası bir riskten fazla ise düşünülmelidir. Bu sınıftaki ilaçlarla ilgili geniş klinik deneyim, etkilerinin terapötik dozlarla ilişkili olduğuna dair bir kanıt ortaya koymamıştır. Ne salmeterol ksinafoatm ne de flutikazon propiyonatın genetik toksisite potansiyeline sahip olduğu gösterilmiştir. Gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemi Salmeterol ksinafoat ve flutikazon propiyonatın gebelik ve emzirme döneminde kullanımı ile ilgili deneyimler yetersizdir. Emzirme döneminde tercihen kullanılmamalıdır. Salmeterol süte geçer. TerapÖtik dozlarda inhale edilen salmeterol ve flutikazon propiyonatm plazma düzeyleri çok düşüktür ve buna bağlı olarak anne sütündeki konsantrasyonların düşük olması muhtemeldir. Bu, sütünde düşük ilaç konsantrasyonları ölçülen emziren hayvanlar üzerinde yapılan çalışmalarla desteklenmiştir. Üreme yeteneği/Fertilite Veri bulunmamaktadır. 4.7 Araç ve makine kullanımı üzerindeki etkiler AİRPLUS'ın araç ve makine kullanımı üzerindeki etkileri ile ilgili spesifik bir çalışma yoktur, ancak her iki ilacın farmakolojisi herhangi bir etkisi olmayacağını göstermektedir. 4.8 İstenmeyen etkiler AİRPLUS, salmeterol ve flutikazon propiyonat içerdiğinden her iki bileşenle de ilişkili olan tipte ve şiddette advers reaksiyonlar görülebilir. Bu iki bileşiğin birlikte verilmesiyle ilave advers etki bildirilmemiştir. Diğer inhalasyon tedavilerinde olduğu gibi, ilaç alındıktan sonra hırıltılı solunumda ani artış ile paradoksal brortko spazm oluşabilir. Bu durum hızlı ve kısa etkili inhale bronkodilatör ile hemen tedavi edilmelidir. Salmeterol/flutikazon propiyonat kullanımı hemen kesilmeli, hasta kontrol edilmeli ve gerekirse alternatif tedavi uygulanmalıdır. Salmeterol/flutikazon propiyonat ile ilgili advers olaylar aşağıda verilmiştin Sıklık sınıflandırması, Çok yaygm (>1/10); yaygın (>1/100 ve <1/10); yaygın olmayan (>1/1000 ve <1/100); seyrek (>I/10.000 ila <1/1000) ve izole raporlar dahil çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) şeklinde tanımlanmıştır. Çok yaygm ve yaygın olaylar genellikle klinik çalışma verilerinden belirlenmiştir. Seyrek ve çok seyrek olaylar genellikle spontan verilere dayanmaktadır. Enfeksiyonlar ve enfestasyonlar Yaygm: Ağız ve boğazda kandidiyaz, pnömoni, bronşit Bağışıklık sistemi hastalıkları Yaygın olmayan: Kütanöz duyarlılık reaksiyonları Çok seyrek: Anjiyoödem (temelde yüzde ve orofarinksde ödem), solunum semptomları (dispne ve/veya bronkospazm), anafilaktik şok dahil anafilaktik reaksiyonlar Endokrin hastalıkları Çok seyrek: Cushing sendromu, Cushing benzeri özellikleri, adrenal süpresyonu, çocuklar ve adolesanlarda gelişim geriliği, azalan kemik mineral yoğunluğu, katarakt, glokom Metabolizma ve beslenme hastalıkları Yaygın: Hipokalemi Çok seyrek; Hiperglisemi Psikiyatrik hastalıklar Çok seyrek: Anksiyete» uyku bozuklukları ve hiperaktivite ve iritabilite (temelde çocuklarda) dahil davranış değişiklikleri Bilinmiyor: Depresyon, huzursuzluk (çoğunlukla çocuklarda) Sinir sistemi hastalıkları Çok yaygın: Baş ağnsı Yaygın: Tremor Kardiyak hastalıklar Yaygın: Palpitasyon Yaygın olmayan: Taşikardi Çok seyrek: Kardiyak aritmi (atrial fıbrilasyon, supraventriküler taşikardi ve ekstrasistol dahil) Solunum» göğüs bozuklu klan ve mediastinal hastalıklar Çok yaygın: Nazofarenjit Yaygın: Boğaz irritasyonu, ses kısıklığı/disfoni, sinüzit, pnömoni (KOAH'lı hastalarda) Çok seyrek: Paradoksikal bronkospazm Deri ve deri altı doka hastalıkları Yaygın: Kontüzy onlar Kas-iskelet bozuklukları, bağdoku ve kemik hastalıktanYaygın: Kas krampları, travmatik kırıklar Çok seyrek: Artralji, miyalji4.9 Doz aşımı ve tedavisi Semptomlar ve bulgular AİRPLUS, salmeterol ve/veya flutikazon propiyonat ile ilgili doz aşımı bilgileri aşağıda verilmiştir. Salmeterolün aşın dozu ile beklenen belirtiler ve bulgular tremor, baş ağnsı, taşikardi, sistolik kan basıncında artış ve hipokalemİ gibi tipik aşın beta2-adreneıjik stimülasyonuna bağlıdır. Flutikazon propiyonatın onaylanan dozlarını aşan dozlarda akut inhalasyonu geçici olarak hipotalamus-hipofiz-adrenal ekseninin baskıl anmasına yol açabilir. Bu durum acil önlem alınmasını gerektirmez; adrenal fonksiyonlar birkaç gün içinde eski haline döner. Eğer onaylanan AİRPLUS dozunun üzerindeki dozlar uzun sûre alınmaya devam edilirse anlamlı derecede adrenokortikal supresyon oluşabilir. Özellikle onaylanan dozun üzerinde uzun süre (birkaç ay ya da yıl) ilaca maruz kalan çocuklarda çok seyrek olarak akut adrenal krizler ile ilgili bildiriler bulunmaktadır. Gözlenen özelliklere bilinç kaybı ve/veya konvülsiyonlarla ilişkili hipoglisemi dahildir. Travmaya maruz kalma, cerrahi girişim, enfeksiyon veya inhale flutikazon propiyonat dozunda hızlı azalma gibi durumlar akut adrenal krizi tetikleyebilecek durumlardır. Hastaların, AİRPLUS'ı onaylanan dozların üzerindeki dozlarda kullanmalan tavsiye edilmemektedir. Tedavinin düzenli olarak gözden geçirilmesi ve dozun hastalığın etkili kontrolünü sağlayan en düşük onaylı doza azaltılması önemlidir (Bkz. 4.2 Pozoloji ve uygulama şekli). TedaviTercih edilen antidotlar, bronkospazm hikayesi olan hastalarda dikkatli kullanılması gereken kardiyoselektif beta-bloker ajanlardır. Eğer AİRPLUS tedavisinin, ilacın beta-agonist bileşeninin aşın dozundan dolayı kesilmesi gerekiyorsa, uygun kortikosteroid replasman tedavisine başlanması düşünülmelidir.5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik ÖzelliklerATC Kodu: R03A K06Faımakoterapötik gnıbu: Adreneıjikler inhalantlar (Selektif beta-2-adreneıjik reseptör agonistleri) ve diğer inhalantlar (kortikosteroidler) Etki mekanizmasıAİRPLUS farklı etki mekanizma lanna sahip salmeterol ve flutikazon propiyonat içerir. Salmeterol belirtilere karşı korurken, flutikazon propiyonat akciğer fonksiyonlarını düzeltir ve alevlenmeleri önler. AİRPLUS eşzamanlı olarak beta-agonist ve inhale kortikosteroid tedavisi uygulanan hastalar için daha uygun bir rejim sunabilir. Her iki ilacın da etki mekanizma lan aşağıda verilmiştir:Salmeterol Salmeterol» reseptörün dış bölgesine bağlanan bir uzun yan zinciri olan, selektif uzun etkili (12 saat) bir beta2-adrenoseptör agonistidir. Salmeterolün bu fannakolojik özellikleri histaminin neden olduğu bronkokonstriksiyonu daha etkili bir şekilde önler ve kısa etkili konvansiyonel betaı-agonistlerin önerilen dozlarına göre en az 12 saat süren, daha uzun süreli bıonkodilatasyon sağlar. in vitrotestler salmeterolün, insan akciğerlerinde histamin, lökotrienler ve prostaglandin D2 gibi mast hücresi mediatörlerinin salıverilmesininin güçlü ve uzun süreli bir inhibitörü olduğunu göstermiştir.İnsanda salmeterol inhale edilen alerjenlere karşı erken ve geç faz yanıtlarını inhibe eder; geç faz yanıtı önleyici etkisi tek bir dozu takiben 30 saat boyunca, bronkodilatör etki sona erdiğinde bile devam eder. Tek bir salmeterol dozu bronşiyal aşın cevaplılığı azaltır. Bu özellikler salmeterolün ilave olarak non-bronkodilatör aktivitesi olduğunu göstermektedir ancak bu etkinin klinik açıdan anlamı tam olarak açıklığa kavuşmamıştır. Bu mekanizma kortikosteroidleıin anti-enflamatuvar etki mekanizmasından farklıdır.Flutikazon propiyonat Flutikazon propiyonat, tavsiye edilen dozlarda inhalasyon yoluyla verildiğinde akciğerlerde güçlü bir anti-enflamatuvar etki gösteren ve sistemik olarak verilen kortikosteroidlerle gözlenen yan etkiler olmadan astımın belirtilerini ve alevlenmelerini azaltan bir glukokortikoidtir. İnhale flutikazon propiyonat ile kronik tedavi boyunca, günlük adrenokortikal hormon salıverilmesi, çocuklar ve yetişkinlerde tavsiye edilen en yüksek dozlarda bile genellikle normal sınırlar içinde kalmıştır. Diğer inhale steroidlerden inhale flutikazon propiyonata geçildikten sonra, günlük adrenokortikal hormonların salıverilmesi geçmişte ve halen aralıklı oral steroid kullanımına rağmen tedricen düzelir, böylece inhale flutikazon propiyonat ile normal adrenal fonksiyon değerlerine dönüldüğü gösterilmiş olur. Adrenal rezerv de kronik tedavi sırasında, stimülasyon testinde normal bir artışla ölçüldüğü üzere normal kalır. Bununla birlikte önceki tedaviden kalan herhangi hir rezidüel adrenal hozukluğun önemli bir süre devam edebileceği göz önünde bulundurulmalıdır (Bkz. 4.4 Özel kullanım uyarılan ve önlemleri). 5.2 Farmakokinetİk ÖzelliklerHayvanlarda veya insanlarda inhalasyon yoluyla birlikte uygulanan salmeterol ve flutikazon propiyonatın birbirlerinin faımakokinetiğini etkilediğine dair herhangi bir bulgu yoktur.Bu nedenle farmakokinetik açıdan her iki bileşen ayn ayn düşünülebilir. 15 sağlıklı denekte yapılan plasebo kontrollü, çapraz geçişli bir çalışmada 7 gün süreyle birlikte salmeterol (inhalasyon yoluyla günde iki kez 50 mcg) ve bir CYP3A4 inhibitörü olan ketokonazol (oral yolla günde bir kez 400 mg) uygulanması plazma salmeterol maruziyetinde anlamlı bir artışa neden olmuştur (Cm.v. 1.4 kat ve EAA 15 kal). Tekrarlı dozlama ile salmeterol birikiminde bir artış bulunmamaktadır. Üç denekte QTc uzaması veya sinüs taşikardisinin eşlik ettiği palpitasyon nedeniyle, birlikte salmeterol ve ketokonazol uygulaması kesilmiştir. Kalan 12 denekte birlikte salmeterol ve ketokonazol uygulanması kalp hızında, kan potasyumunda veya QTc aralığında klinik açıdan anlamlı bir etki yaratmamıştır. (Bkz. 4.4 Özel kullanım uyanları ve Önlemleri ve 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri). Emilim:Salmeterol Salmeterol akciğerlerde lokal olarak etki eder, bu nedenle plazma seviyeleri terapötik etkinin belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra çok düşük plazma konsantrasyonları gösterdiği için (yaklaşık 200 pg/ml veya daha az) plazmadaki ilaç miktarının tayini teknik olarak zor olduğundan salmeterolün farmakokinetıği ile ilgili sadece sınırlı veriler bulunmaktadır. Salmeterol ksinafoatın düzenli kullanımım takiben, hidroksinaftoik asit sistemik dolaşımda tayin edilebilir ve kararlı durum konsantrasyon!arı * yaklaşık 100 ng/ml'ye ulaşır. Bu konsantrasyonlar, toksisite çalışmalarında gözlenen kararlı durum konsantrasyonlarından 1000 kez daha düşüktür. Havayolu tıkanıklığı olan hastalarda uzun süreli düzenli kullanımında (12 aydan fazla) herhangi bir zararlı etki görülmemiştir. Flutikazon propiyonat Her bir ınhaler cihazı için flutikazon propiyonatın mutlak biyoyararlanımı inhalasyon veya intravenöz farmakokinetik verilerin çalışma içerisinde ve çalışmalar arasında karşılaştırılması ile hesaplanmıştır. Sağlıklı erişkin deneklerde mutlak biyoyararlanım iki faiklı kuru toz inhaleri ile uygulanan flutikazon propiyonat (%7.8 ve %9.0), basınçlı ölçülü doz inhaler ile uygulanan flutikazon propiyonat (%10.9), basınçlı ölçülü doz inhaler ile uygulanan saimeterol-flutikazon propiyonat (%5.3) ve kuru toz inhaler ile uygulanan salmeterol-flutikazon propiyonat (%5.5) için belirlenmiştir. Astım ya da KOAH hastalarında flutikazon propiyonata sistemik maruziyetin daha az derecede olduğu görülmüştür. Sistemik absorpsiyon başlıca akciğerlerden gerçekleşir ve başlangıçta hızlı olup daha sonra yavaşlamaktadır. Kalan inhale doz yutulabilir, fakat yutulan kısım sudaki düşük çözünürlüğü ve % 1 'den daha az oral biyoyararlanımla sonuçlanan presistemik eliminasyonundan dolayı sistemik maruziyete çok az katkıda bulunmaktadır. İnhale dozun arttınlmasıyla sistemik maruziyette doğrusal artış olur. Da&lım:Salmeterol Salmeterolün plazma proteinlerine bağlanma oranı %96'dır. Flutikazon propiyonat Flutikazon propiyonatın plazma proteinlerine bağlanma oranı orta derecede yüksektir (% 91). Kararlı durumdaki dağılım hacmi geniştir. Bivotransformasvon:Salmeterol İn vitrobir çalışma salmeterolün sitokrom P450 3A4 (CYP3A4) tarafından büyük oranda a-hidroksisalmeterole (alifatik oksidasyon) metabolize edildiğini göstermiştir.Flutikazon propiyonat Flutikazon propiyonat başlıca sitokrom P450 enzimi CYP3A4 tarafından inaktif karboksilik asite metabolize edilerek sistemik dolaşımdan çok hızlı temizlenir. CYP3A4 inhibiiörleri olarak bilinen ajanlar ile birlikte kullanıldığında flutikazon propiyonata sistemik maruziyet potansiyel olarak artacağından dikkatli olunmalıdır. Eliminasvon:Salmeterol Eliminasyon yarılanma ömrü 5.5 saattir. SalmeterolOn %60 dışkı ile %25 idrar ile itrah edilir. Flutikazon propiyonat Flutikazon propiyonatın dispozisyonu, yüksek plazma klerensi (1150 ml/dak) ve yaklaşık 8 saat olan terminal yanlanma ömrü ile kaıakterizedir. Flutikazon propiyonatın renal klerensi ihmal edilebilir düzeydedir (< % 0.2) ve % 5'ten azı metabolitleri şeklindedir. Hastalardaki karakteristik özellikler Böbrek/Karaciğer yetmezliği:Veri bulunmamaktadır.Değişik yaş gruplan:Popülasyon farmakokinetiği analizi, astım hastalarıyla ilgili veriler kullanılarak yapılmış (flutikazon propiyonat (FP) için 9 ve salmeterol için 5 klinik çalışma) ve aşağıdakileri göstermiştir:- Tek başına verilen FP (100 mikro gram) ile karşılaştırıldığında, salmeterol/flutikazon propiyonat (50/100 mikrogram) verildikten sonra adolesanlarda ve yetişkinlerde (oran 1.52 [% 90 GA 1.08, 2.13]) ve çocuklarda (oran 1.20 [% 90 GA 1.06, 1.37]) daha yüksek FP maruziyeti görülmüştür. - Adolesanlara ve yetişkinlere (oran 1.63 [%90 GA 1.35, 1.96]) kıyasla salmeterol/flutikazon propiyonat (50/100 mikrogram) alan çocuklarda daha yüksek FP maruziyeti gözlenmiştir. - Bu bulguların klinik anlamı bilinmemektedir, ancak, hem adolesanlarda ve yetişkinlerde hem de çocuklarda, salmeterol/flutikazon propiyonat (50/100 mikrogram) ve FP'ı (100 mikrogram) karşılaştıran 12 hafta kadar silren klinik çalışmalarda hipotalamus-hipofiz-adrenal ekseni üzerindeki etkileri arasında farklılık gözlenmemiştir. 50/500 mikrogramlık daha yüksek salmeterol/flutikazon propiyonat dozu alındığında, tek başına uygulanan eşdeğerde FP dozu karşılaştırıldığında FP maruziyeti benzer bulunmuştur. - Adolesanlar ve yetişkinlere kıyasla salmeterol/flutikazon propiyonat (50/100 mikrogram) alan çocuklarda daha yüksek salmeterol maruziyeti gözlenmiştir (oran 1.23 [% 90 GA 1.10, 1.38]). - Bu bulguların klinik anlamı bilinmemektedir, ancak, 12 hafta kadar süren çalışmalarda yetişkinler, adolesanlar ve çocuklar arasında kardiyovasküler etkilerinde veya tremor bildirilerinde farklılık gözlenmemiştir. Klinik ÇalışmalarSalmeterol ile yapılan klinik çalışmalar AstımSalmeterol Çok Merkezli Astım Araştırma Çalışması (The Salmeterol Multi-center Asthma* Research Trial) (SMART), standart tedaviye eklenen salmeterol veya plasebonun gûvenliliğinin karşılaştırıldığı, ABD'd e yapılan büyük çaplı bir çalışmadır. Primer sonlanma noktasında (solunum ile ilişkili ölüm ve solunum ile ilişkili yaşamı tehdit eden olayların kombine sayısı) anlamlı farklar mevcut değildir. Bu çalışma salmeterol uygulanan hastalarda astıma bağlı ölüm vakalarında anlamlı bir artış göstermiştir (28 haftalık sürede plasebo grubundaki 13,179 hastada 3 ölüm vakasına karşı salmeterol grubundaki 13,176 hastada 13 ölüm vakası). Bu çalışma inhalasyon yoluyla eşzamanlı kortikosteroid kullanımının etkisinin değerlendirilmesi için tasarlanmamıştır. Bununla birlikte post-hoc analizler başlangıçta inhalasyon yoluyla alman steroidler kullanan hastalar içm astıma bağlı ölüm açısından tedavi gruplan arasında anlamlı bir fark göstermemiştir (plasebo grubunda 3/6138'e karşı salmeterol grubunda 4/6127). İnhalasyon yoluyla steroid kullanılmayan gruplardaki astıma bağlı ÖlUm vakalarının sayısı salmeterol grubunda 9/7049 olurken plasebo grubunda 0/7041 idi. Ayrıca, Salmeterol-FP kolunda 8,030 ve flutikazon propiyonat kolunda 7,925 hastayı içeren 42 klinik çalışmanın bir meta analizi, ciddi solunum ile ilişkili olaylar veya astıma hağlı olarak hastaneye yatma açısından salmeterol-FP ile flutikazon propiyonat arasında istatistiksel bir fark göstermemiştir. Salmeterol/flutikazon propiyonat ile yapılan klinik çalışmalar Astım 3416 astım hastasının katıldığı 12 aylık geniş hir çalışmada (Optimal Astım Kontrolünün Sağlanması - Gaining Optimal Asthma controL, GOAL), önceden belirlenmiş astım kontrol düzeylerine ulaşmada salmeterol/flutikazon propiyonatın etkililik ve güvenliliği tek başına verilen inhale kortikosteroid ile karşılaştın İmi şt ir. Tedavi dozu * 'Tam kontrol' sağlanıncaya veya çalışma ilacının en yüksek dozuna ulaşıncaya kadar her 12 haftada bir artırılmıştır. Kontrolün, tedavinin son 8 haftasının en az 7'sinde devam etmesi gerekiyordu. Bu çalışmada aşağıdaki sonuçlar elde edilmiştir: Sadece inhale kortikosteroid ile tedavi edilen hastaların %59'u *'iyi kontrol' düzeyine ulaşırken salmeterol/flutikazon propiyonat kullanan hastalarda bu oran % 71 olmuştur. Sadece inhale kortikosteroid ile tedavi edilen hastaların % 28*i **'tam kontrol' düzeyine ulaşırken salmeterol/flutikazon propiyonat kullanan hastalarda bu oran % 41 olmuştur. Bu etkiler tek başına inhale kortikosteroide kıyasla, salmeterol/flutikazon propiyonat ile daha erken ve daha düşük inhale kortikosteroid dozunda görülmüştür. GOAL çalışmasında aynı zamanda aşağıdaki sonuçlara ulaşılmıştır: Sadece inhale kortikosteroid tedavisi ile karşılaştırıldığında salmeterol/flutikazon propiyonat ile alevlenme oram %29 daha düşüktür. Astım kontrolünde 'İyi kontrol' ve 'Tara kontrol' durumuna ulaşma Yaşam Kalitesi'ni artırmıştır. Salmeterol/flutikazon propiyonat ile tedaviden sonra hastaların % 61'i yaşam kalitelerinin 'minimal düzeyde bozulduğunu' veya 'hiç bozulmadığını' bildirmişlerdir. Başlangıçta %8 olan bu etki astıma özgü yaşam kalitesi anketi ile ölçülmüştür. *lyi kontrol edilen astım: seyrek belirtiler veya seyrek olarak kısa etkili beta agonist kullanımı veya akciğer fonksiyonu beklenenin % 8 (Tinden az olması artı gece uyanma yok, alevlenme yok ve tedavide değişiklik gerektiren bir yan etki yok. **Tam kontrol edilen astım: belirti yok, kısa etkili beta-agonist kullanımı yok, akciğer fonksiyonu beklenenin %80'ine eşit veya büyük, gece uyanma yok, alevlenme yok, tedavide değişiklik gerektiren bir yan etki yok. Başka iki çalışmada tek başına inhale kortikosteroid kullanımıyla karşılaştırdığında salmeterol/flutikazon propiyonat ile akciğer fonksiyonunda düzelme ve belirtilerin görülmediği günlerin yüzde sinde artma, kurtarıcı ilaç kullanımında azalmadahadüşük inhale kortikosteroid dozu kullanma şeklinde iyileşme görülürken bronşiyal biyopsi ve bronkoalveolar lavaj ile ölçülen altta yatan havayolu enflamasyonunun kontrolü de devamlılık gösteımiştir.İlave çalışmalar, salmeterol/flutikazon propiyonatın tek tek bileşenleri ve plasebo ile kaışılaştınldığında salmeterol/flutikazon propiyonatın anlamlı derecede astım belirtilerini ve akciğer fonksiyonlarım iyileştirdiğini ve kurtarıcı ilaç kullanımını azalttığım göstermiştir, GOAJL çalışmasının sonuçlan bu sonlanma noktalarında salmeterol/flutikazon propiyonat ile görülen iyileşmenin en az 12 ay devam ettiğini göstermiştir. KOAH Kısa etkili beta2-agonistlerine % 10 reversibilite kısıtlaması olmayan semptomatik KOAH hastalan: Altı ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/250 mikrogram ve 50/500 mikrogram'lık salmeterol/flutikazon propiyonatın düzenli kullanımının akciğer fonksiyonunu hızlı ve anlamlı derecede düzelttiğini, nefes darlığım ve rahatlatıcı ilaç kullanımım anlamlı derecede azalttığını göstermiştir. Aynı zamanda hastaların sağlık durumunda da anlamlı derecede düzelme olmuştur. Kısa etkili beta2-agonistlerine %10'dan daha az reversibilite gösteren semptomatik KOAH hastalan: 6 ve 12 ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/500 mikrogram salmeterol/flutikazon propiyonatın düzenli kullanımının akciğer fonksiyonunu hızlı ve anlamlı derecede düzelttiğini, nefes darlığım ve rahatlatıcı ilaç kullanımım anlamlı derecede azalttığım göstermiştir. 12 aylık periyod boyunca KOAH alevlenme riski ve ilave oral kortikosteroid ihtiyacı anlamlı derecede azalmıştır. Aynı zamanda hastaların sağlık durumunda da anlamlı derecede düzelme olmuştur. Salmeterol/flutikazon propiyonat 50/500 mikrogram hem tedavi sırasında sigara içen, hem de sigarayı bırakmış hastalarda akciğer fonksiyonunu ve sağlık durumunu düzeltmede ve KOAH alevlenme riskini azaltmada etkili bulunmuştur. TORCH çalışması (TQwards a Revolution in COPD Health: KOAH* ta devrime doftnri:TORCH, KOAH hastalarında, günde 2 kez 50/500 mikrogram salmeterol/flutikazon propiyonatgünde 2 kez 50 mikrogram salmeterol günde 2 kez 500 mikrogram FP (flutikazon propiyonat) veya plasebo ile yapılan tedavinin tüm nedenlere bağlı Ölümler üzerindeki etkisini değerlendirmek için yapılan 3 yıllık bir çalışmadırBaşlangıç (bronkodilatörden önce) FEVj 'ibeklenen normal değerin % 60'mdan az oian orta-şiddetli ve şiddetli KOAHhastalan çift-kör tedavi almak üzere randomize edilmiştir. Çalışma boyunca, diğer inhale kortikosteroidler, uzun etkili brohkodilatörler ve uzun sûre sistemik kortikosteroidler dışında, her zamanki KOAH tedavilerini almalarına izin verilmiştir. Üç yıllık hayatta kalma durumu, çalışmadan çıfop çıkmadıklarına bakılmaksızın hastaların tümü için tespit edilmiştir. Başlıca sonlanma noktası, plase boya kıyasla salmeterol/flutikazon propiyonat için 3 yılda tüm nedenlere bağlı ölümlerin azaltılmasıdır (Tablo 1),Tablo 1
açısından gruplandırılmış bir log-rank analizi için ayarlanmış P değeri Salmeterol/flutikazon propiyonat, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskini % 17.5 oranında azaltmıştır (Risk Oram 0.825 (% 95 GA 0.68, 1.00, p = 0.052; tümü ara analizler için ayarlanmıştır), Plaseboya kıyasla, üç yıllık süre içinde herhangi bir zamanda herhangi bir nedenden dolayı şekillenen ölümlerde, salmeterol ile12 azalma (p 0.180) ve FP ile % 6 artış (p - 0.525) olmuştur (Tablo 1).Cox'urt Orarttısal Risk modelinin kullanıldığı destekleyici bir analiz, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskinde % 19 azalma gösteren salmeterol/JIutikazon propiyonat için 0.811'lik (%95 GA 0.670, 0.982, p- 0,031) bir risk oranı olduğunu göstermiştirModel önemli faktörler (sigara içme durumu, yaş, cinsiyetbölge, başlangıç FEVı ve Vücut Kitle indeksi) için ayarlanmıştır. Tedavi etkilerinin bu faktörlere göre değiştiğine dair kanıt yoktur (Tablo 1).Üç yıl içinde KOAH'a bağlı nedenlerden dolayı ölen hastaların yüzdesi plasebo için % 6.0, salmeterol için % 6.1, FP için % 6.9 ve salmeterol/JIutikazon propiyonat için % 4.7'dir (Tablo I).Plaseboya kıyasla salmeterol/JIutikazon propiyonatorta şiddetli ve şiddetli alevlenmeleri % 25 (% 95 GA: % 19 ve % 31 arasında; p <0.001) oranında azaltmıştır. Salmeterol/JIutikazon propiyonat alevlenme oranını, salmeterol ile karşılaştırıldığında % 12 (% 95 GA: % 5 ve %19 arasında; p0.002), FP ile karşılaştırıldığında da%9 (%95 GA: % 1 ve % 16 arasında; p ~ 0.024) oranında azaltmıştır. Plaseboya kıyasla salmeterol ve FP alevlenme oranını anlamlı derecede sırasıyla % 15 (% 95 GA: % 7 ve % 22 arasında; p <0.001) ve % 18 (% 95 GA: % 11 ve % 24 arasında;p <0.001) oranında azaltmıştır.St George Solunum Anketi (SGSA) ile ölçülen Sağlıkla ilİşMU Yaşam Kalitesiplaseboya kıyasla tüm aktif tedavi yöntemleri ile düzelmiştir. Öç ytl boyunca salmeterol/JIutikazon propiyonat ile sağlanan ortalama düzelme plaseboya kıyasla -3.1 birim (% 95 GA: -4.1 ve -2.1 arasında; p <0,001), salmeterole kıyasla -2.2 birim (p <0.001) ve FP'ye kıyasla -1.2 birimdir (p -0.017).Üç yıllık tedavi süresi boyunca, FEVj değerleri salmeterol/JIutikazon propiyonat ile tedavi edilenlerde plasebo ile tedavi edilenlerden daha yüksektir (3 yıl boyunca ortalama fark 92 ml, % 95 GA: 75108 ml; p <0.001). FEV/'i düzeltmede salmeterol/JIutikazon propiyonat salmeterolden veya FP 'den daha etkilidir (salmeterol için ortalama fark 50 ml, p <0.001 ve FP için 44 mL 'dir, p <0.001).Advers olay olarak bildirilen pnömoninin 3 yıllık tahmini olasılığı plasebo için % 12.3, salmeterol için % 13.3, FP için % 18.3 ve salmeterol/JIutikazon propiyonat İçin % 19.6'dır (Salmeterol/JIutikazon propiyonatın plaseboya karşı risk oram: 1.64, % 95 GA: 1.33 ve 2.01 arasında, p0.001). Pnömoni ile ilişkili ölümlerde artış olmamıştır; tedavi sırasında birincil olarakpnömoniye bağlı oldukları düşünülen Ölümler plosebo için 7, salmeterol için 9, FP için13 ve salmeterol/flutikazon propiyonat için 8 olarak tespit edilmiştirKemik kırılma olasılığında anlamlı farklılık yoktur (plasebo % 5.1, salmeterol % 5.1, FP % 5.4salmeterol/flutikazon propiyonat %6.3; plaseboya karşı salmeterol/flutikazon propiyonat için risk oranı: 1.22, % 95 GA: 0.87 ve 1.72 arasındap - 0.248). Göz bozuklukları, kemik bozuklukları ve hipotalamus-hipofız-adrenal eksen bozuklukları ile ilgili advers olayların insidansı düşüktür ve tedaviler arasında farklılık gözlenmemiştir. Salmeterol alan tedavi gruplarında kardiyak advers olaylarında artış olduğuna dair kanıt yoktur.5.3 Klinik öncesi giivenlilik verileri Salmeterol ksinafoat ve flutikazon propiyonat hayvanlar üzerinde yapılan toksisite testlerinde oldukça kapsamlı bir şekilde değerlendirilmiştir. Belirgin toksisite sadece insan kullanımı için tavsiye edilen dozlar aşıldığında oluşmuştur ve bunlar güçlü beta2-ad renoreseptör agonistlerin ve glukortikosteroidlerin kullanılmasıyla beklenen etkilerle uyumludur. Uzun süreli çalışmalarda salmeterol ksinafoat sıçan mezovaryumunun ve fare uterusunun düz kaslarında benign tümörlerin oluşumuna yol açmıştır. Kemirgenler farmakolojik olarak indüklenen bu tümörlerin oluşumuna duyarlıdır. Salmeterolün insanlarda onkojenik yönden anlamlı bir risk oluşturduğu düşünülmemektedir. Salmeterol ve flutikazon propiyonatın yüksek dozlarda birlikte uygulanması, bazı kardiyovasküler etkileşimlere yol açmıştır. Sıçanlarda görülen hafif derecede atriyal miyokardit ve fokal koroner arterit, normal dozların verilmesiyle düzelen geçici etkilerdir. Köpeklerde» salmeterolün tek başına verilmesi ile karşılaştırıldığında, birlikte yapılan uygulamaların ardından kalp atım hızındaki artışlar daha fazladır. Hayvanlarda, birlikte yapılan uygulamalar, ilaç sınıflan ile ilişkili diğer toksisitelerde bir değişikliğe neden olmamıştır. fi FARMASÖTtK ÖZELLİKLER6.1 Yardıma maddelerin listesi Laktoz6.2 GeçimsizliklerBilinen geçimsizliği yoktur.63 Raf ömrü 24 ay 6.4 Saklamaya yönelik özel tedbirler 25°C'nin altındaki oda sıcaklığında ve kuru yerde saklayınız. 6.5 Ambalajın niteliği ve içeriği AİRPLUS, inhalasyon için toz içeren 60 kapsül, PVC/PVDC/Alü blister ambalajlarda, karton kutuda, inhalasyon cihazı ve kullanma talimatı ile beraber ambalajlanır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel Önlemler Kullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİ Neutec İnhaler İlaç San. Ve Tİc. A.Ş. Sakarya 1. Organize Sanayi Bölgesi 2. Yol No:3 Arifiye / Sakarya Telefon numarası: 0850 201 23 23 Faks numarası: 0212 482 24 78 e-mail: [email protected] 8. RUHSAT NUMARASI (LARI) 251/12 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ tik ruhsat tarihi: 24.05.2013 Ruhsat yenileme tarihi: 10. KÜB'ÜNYENİLENME TARİHİ25 |
İlaç BilgileriAirplus 50/500mcg Capsair İnhalasyon İçin Toz Içe...Etken Maddesi: Salmeterol Ksinafoat, Flutikazon Propiyonat Atc Kodu: R03AK06 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.