Forpack 6/400 Mcg İnhalasyon İçin Ölçülü Dozlu Ae... Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Adrenerjikler (İnhalan) » Adrenerjikli Kombinasyonlar » Formoterol Kombinasyonları KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIFORPACK 6/400 mcg için ölçülü dozlu aerosol2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Formoterol fumarat dihidrat 6 mcgBudesonid 400 mcg Yardımcı madde(ler):Dehidrat alkol 1,728 mgYardımcı maddeler için, 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon İçin Ölçülü Dozlu AerosolAlüminyum inhaler kabı içinde basınçlı propellant gaz ile doldurulmuş süspansiyon. Alüminyum konteynere bir dozajlama valf eklidir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAstım:Astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren kullanılır. Amfizem ve Kronik bronşit: Formoterol, amfizem ve kronik bronşit hastalarında egzersiz kapasitesini artırmakta ve semptomatik düzelme sağlamaktadır. Formoterol, budesonid ile birlikte düzenli kullanıldığında orta ve ağır amfizem ve kronik bronşit olgularında atak sıklığını ve semptomları azaltmaktadır. Budesonid, amfizem ve kronik bronşit hastalarında monoterapi olarak kullanılmamalıdır. 4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Astım:Yetişkinler: Yetişkinler için önerilen doz günde iki kez bir inhalasyondur (sabah ve akşam yaklaşık 12 saat aralıklarla). Bazı hastalar için, günde toplam iki kez 2 inhalasyon dozunu aşmamak üzere daha yüksek doz kullanılması gerekebilir. Yetişkin hastalarda önerilen FORPACK başlangıç dozu, hastaların astım şiddetine bağlıdır. Önerilen maksimum FORPACK dozu günde iki kez 6 mcg/400 mcg dozudur. 12 yaş ve üzeri adölesanlar: 12 yaş ve üzeri adölesanlar için önerilen doz günde iki kez bir inhalasyondur (sabah ve akşam yaklaşık 12 saat aralıklarla). FORPACK inhalasyonunu takiben astım kontrolünde iyileşme tedavi başlangıcının ilk 15 dakikası içerisinde meydana gelebilmesine rağmen, maksimum yarar tedavi başlangıcından sonra 2 hafta veya daha uzun bir süre elde edilemeyebilir. Semptom rahatlama derecesi ve semptom rahatlama başlangıcı için gerekli zaman kişiden kişiye değişkenlik gösterebilir. Eğer daha önceki etkili FORPACK tedavi dozu yeterli astım kontrolünün sağlanmasında başarısız olursa, tedavi rejimi yeniden değerlendirilmeli ve ek tedavi seçenekleri (düşük doz FORPACK tedavi dozunun yüksek doz FORPACK dozu ile değiştirilmesi, ek inhale kortikosteroid dozu ilavesi veya oral kortikosteroid tedavisine başlanılması) göz önünde bulundurulmalıdır. FORPACK astım hastalığının başlangıç tedavisi için önerilmez. FORPACK, inhale kortikosteroidler gibi uzun süreli astım kontrolünde kullanılan ilaçlar ile astımı yeterli oranda kontrol edilemeyen hastalarda veya hastalığın şiddetinin hem LABA hem de kortikosteroid tedavisini gerektirdiği hastalarda kullanılmalıdır. Astım kontrolü sağlandığında hasta düzenli olarak değerlendirilmeli ve FORPACK tedavisi gözden geçirilmelidir (gerekirse sonlandırılmalıdır). Astımı düşük veya orta doz inhale kortikosteroidlerle kontrol edilen hastalarda FORPACK kullanılmamalıdır. FORPACK, akut bronkospazmın tedavisinde kullanılmamalıdır. Doz uygulama periyotları arasında astım semptomları meydana gelirse, semptomların hemen rahatlatılması için inhale kısa etkili beta2-agonist kullanılmalıdır. Amfizem ve kronik bronşit: Yetişkin hastalar için önerilen doz günde iki kez bir FORPACK 6 mcg/400 mcg dozunun inhale edilmesidir. Doz uygulama periyotları arasında nefes darlığı meydana gelirse, semptomların hemen rahatlatılması için inhale kısa etkili beta2-agonist kullanılmalıdır. Uygulama şekli:FORPACK, sadece oral inhalasyon yolu ile uygulanır.İnhalasyon spreyinin doğru kullanımı doktor veya eczacı tarafından hastaya gösterilmelidir. İnhalasyon sırasında hastalar tercihen oturmalı veya ayakta durmalıdır. İnhalasyon spreyi dik konumda kullanım için tasarlanmıştır. Olası bir kandida enfeksiyonu riskini azaltmak için her uygulamadan sonra ağzın su ile iyice çalkalanması ve tükürülmesi önerilmektedir. Ayrıca ağzın su ile çalkalanması boğaz irritasyonunu engellemeye ve sistemik etki riskinin azaltılmasına muhtemelen yardımcı olabilir. Kullanıma ilişkin detaylı bilgi, kullanma talimatında mevcuttur. İnhalasyon spreyinin doğru kullanımı için aşağıda verilen kuralları dikkatle izleyiniz. inhalasyon spreyinin kullanım talimatıİnhalasyon spreyinin test edilmesi: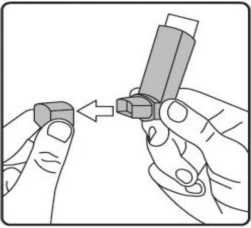 İlk kez kullanımdan önce hastalar ağızlık kapağını, kapağın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon spreyini iyi bir şekilde sallamalı, baş parmak ağızlığın altında inhalasyon spreyinin tabanında olacak şekilde parmaklar ve baş parmak arasında tutmalı ve boşluğa sıkım yapmalıdır. İnhalasyon spreyi her sıkımdan önce sallanmalıdır.
İlk kez kullanımdan önce hastalar ağızlık kapağını, kapağın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon spreyini iyi bir şekilde sallamalı, baş parmak ağızlığın altında inhalasyon spreyinin tabanında olacak şekilde parmaklar ve baş parmak arasında tutmalı ve boşluğa sıkım yapmalıdır. İnhalasyon spreyi her sıkımdan önce sallanmalıdır.İnhalasyon spreyi bir hafta veya daha uzun süre kullanılmadığında hastalar ağızlık kapağını çıkarmalı, inhalasyon spreyi ile boşluğa iki kez sıkım yapılmalıdır. İnhalasyon spreyinizi kullanacağınız zaman oturunuz veya ayakta dik durunuz. 1. İlk resimde gösterildiği gibi ağızlık kapağını çıkarınız. Ağızlığın temiz olduğundan emin olmak için içini ve dışını kontrol ediniz. 2. İnhalasyon spreyinizi her kullanımdan önce iyice çalkalayınız. 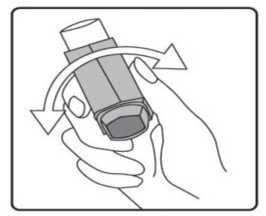 3. İnhalasyon spreyinizi baş parmağınız ağızlığın altında, inhalasyon spreyinizin tabanında olacak şekilde dik tutunuz.
3. İnhalasyon spreyinizi baş parmağınız ağızlığın altında, inhalasyon spreyinizin tabanında olacak şekilde dik tutunuz.
4. Ağızlığı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıca kapatınız. 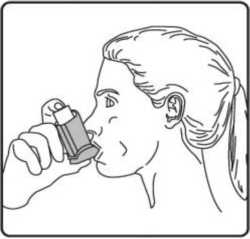 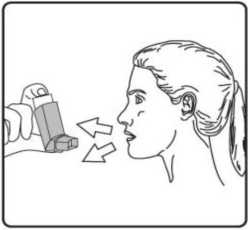 5. Ağzınızdan yavaş ve derin nefes alınız ve aynı anda bir puf doz boşaltmak için inhalasyon spreyinizin üst kısmına basınız.
5. Ağzınızdan yavaş ve derin nefes alınız ve aynı anda bir puf doz boşaltmak için inhalasyon spreyinizin üst kısmına basınız. 6. Nefesinizi yaklaşık 10 saniye veya rahatça tutabildiğiniz kadar tutunuz ve ağızlığı ağzınızdan çıkarıp parmağınızı inhalasyon spreyinizin üst kısmından çekiniz. Sonra yavaşça ağzınızdan nefes veriniz. İnhalerin içine nefes vermekten kaçınız.
6. Nefesinizi yaklaşık 10 saniye veya rahatça tutabildiğiniz kadar tutunuz ve ağızlığı ağzınızdan çıkarıp parmağınızı inhalasyon spreyinizin üst kısmından çekiniz. Sonra yavaşça ağzınızdan nefes veriniz. İnhalerin içine nefes vermekten kaçınız.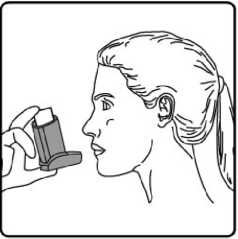 7. Her bir puf ilaç alımı arasında yaklaşık yarım dakika bekleyiniz ve sonra 2-6. basamakları tekrarlayınız.
7. Her bir puf ilaç alımı arasında yaklaşık yarım dakika bekleyiniz ve sonra 2-6. basamakları tekrarlayınız.8. Daha sonra, ağzınızı su ile çalkalayınız ve tükürünüz. Bunu yapmanız ağzınızda pamukçuk oluşumunun ve ses kısıklığının önlenmesine yardımcı olmak için önemlidir. 9. Kullanımdan sonra tozdan korumak için ağızlığın kapağını hemen kapatınız. Ağızlık kapağı doğru bir şekilde yerleştirildiğinde tam yerine oturacaktır. Eğer yerine oturmuyorsa, ağızlık kapağını diğer yöne çeviriniz. Çok fazla güç uygulamayınız. Hastalar 4, 5 ve 6. basamakları hızlı bir şekilde yapmamalıdır. Hastaların inhalasyon spreyini etkin hale getirmeden hemen önce mümkün olduğunca yavaş bir şekilde nefes almaya başlaması önemlidir. Hastalar aynanın önünde ilk birkaç uygulama için pratik yapmalıdırlar. Eğer hastalar inhalasyon spreyinin üstünden veya ağızlarının yanından buhar geldiğini görürse, 2. basamaktan itibaren uygulamaya tekrar başlamalıdırlar. inhalasyon spreyinin temizlenmesiİnhalasyon spreyinizi haftada en az bir kez temizleyiniz.1. Ağızlık kapağını çıkarınız. 2. Tüpü plastik gövdeden çıkarmayınız. 3. Kuru bir bez veya kumaş ile ağızlığın içini ve dışını ve plastik gövdeyi siliniz. 4. Ağızlık kapağını doğru bir şekilde yerleştiriniz. Kapağı yerleştirmek için çok fazla güç uygulamayınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda FORPACK kullanımı ile ilgili veri yoktur.Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda FORPACK kullanımı ile ilgili veri yoktur. Ancak budesonid ve formoterol ilk geçiş sırasında hepatik metabolizma ile elimine edildiklerinden, karaciğer fonksiyon bozukluğu budesonid ve formoterolün plazmada birikimine neden olabilir. Bu nedenle karaciğer hastalığı olan hastalar FORPACK kullanımı sırasında yakından izlenmelidir.Pediyatrik popülasyon:12 yaş altındaki astımlı çocuklarda FORPACK'in etkinliği ve güvenilirliği kanıtlanmadığından bu yaş grubunda kullanılması önerilmez. 12 yaş ve üzeri ergenlerde kullanım için bakınız 4.2. Pozoloji ve uygulama şekli.Geriyatrik popülasyon:Yaşlılarda doz ayarlanması gerekli değildir.4.3. Kontrendikasyonlar Formoterol fumarat, budesonid ve/veya ürünün içeriğindeki yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olanlarda, Status astmatikusun (astım nöbeti) veya astımın veya amfizem ve kronik bronşitin akut epizodlarının primer tedavisinde kullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriUzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir.FORPACK, astım hastalığının başlangıç tedavisi için önerilmez. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. Tedavi kesileceği zaman dozun giderek azaltılması önerilmektedir. Tedavi, birden kesilmemelidir. Hasta tedaviyi etkisiz bulduğunda ya da FORPACK'in önerilen en yüksek dozundan daha fazla inhalasyon gerektiğinde doktoruna başvurmalıdır (bkz. 4.2). Hızlı etki eden bronkodilatörlerin kullanımının artırılması hastalığın kötüleşmesine işaret eder ve tedavinin yeniden değerlendirilmesini gerektirir. Astım ve amfizem-kronik bronşit'in ani ve giderek kötüleşmesi hayatı tehdit eden bir durumdur, hasta acil olarak doktor kontrolüne alınmalıdır. Bu durumda kortikosteroid tedavisinin artırılması örneğin oral yoldan bir kortikosteroid verilmesi ya da bir enfeksiyon varsa antibiyotik verilmesi uygundur. FORPACK kurtarıcı ilaç olarak kullanılmamalıdır. Hastalara kurtarıcı inhaler ilaçlarını her zaman yanlarında bulundurmaları öğütlenmelidir. Hastalar, semptomlar olmasa bile FORPACK'i idame dozunu doktorun önerdiği şekilde her gün kullanmaları gerektiği konusunda bilgilendirilmelidir. Astım semptomları kontrol altına alındıktan sonra, FORPACK dozunun yavaş yavaş azaltılması düşünülebilir. Tedavi dozu azaltılırken hastanın düzenli olarak kontrol edilmesi önemlidir. FORPACK'in etkili en düşük dozu kullanılmalıdır (bkz. 4.2). Hastalar alevlenme dönemlerinde ise veya önemli ölçüde veya akut olarak kötüye giden amfizem-kronik bronşit şikayetleri varsa, FORPACK ile tedaviye başlanmamalıdır. İlaç başlandıktan sonra ilk üç ay hastalar yakından takip edilmelidir. FORPACK ile tedavi sırasında, astımla ilişkili advers etkiler ve alevlenmeler görülebilir. Hastadan FORPACK ile tedaviye devam etmesi, fakat FORPACK'e başlandıktan sonra astım semptomları kontrol altına alınamazsa veya kötüleşirse tıbbi destek alması istenmelidir. İnhalasyon yoluyla uygulanan diğer tedavilerde olduğu gibi, ilaç alındıktan sonra hırıltılı soluk alıp vermekte ani bir artış ile birlikte paradoksal bronkospazm görülebilir. Bu durumda FORPACK ile tedavi hemen kesilmelidir; tedavi tekrar değerlendirilmeli ve gerekirse başka bir tedaviye geçilmelidir. Paradoksal bronkospazm hızlı etkili bronkodilatörlere cevap verir ve hemen tedavi edilmesi gerekir (Bkz. Bölüm 4.8). Uzun süre özellikle yüksek dozda inhalasyon yoluyla herhangi bir kortikosteroid kullanıldığında sistemik etkiler görülebilir. Bu etkilerin görülme olasılığı oral kortikosteroidlere oranla daha azdır. Oluşabilecek sistemik etkiler; adrenal yetmezlik, kemik mineral yoğunluğunda azalma, katarakt, glokom ve çocuklar ve adölesanlarda büyüme geriliğidir. Uzun süre inhalasyon yoluyla kortikosteroid alan çocukların büyümeleri doktor tarafından izlenmelidir. Büyüme yavaşlarsa, inhalasyon yoluyla kullanılan kortikosteroidin dozunun düşürülmesi hedeflenerek tedavi yeniden değerlendirilmelidir. Büyüme yetersizliği riski, kortikosteroid tedavisinin sağladığı fayda ile kıyaslanmalıdır. Ayrıca hastanın, pediyatrik solunum hastalıkları uzmanına yönlendirilmesi düşünülmelidir. Uzun süreli çalışmalara ait sınırlı veriler, inhalasyon yoluyla steroid kullanan çocukların ve adölesanların büyük çoğunluğunun sonunda yetişkin boy hedeflerine ulaştığını göstermektedir. Ancak, başlangıçta, büyümede az ve geçici olarak bir gerileme (yaklaşık 1 cm) görülmüştür. Bu durum genellikle tedavinin ilk bir yılı içinde görülür. Kemik yoğunluğu üzerine potansiyel etkiler, özellikle uzun süre yüksek dozda kortikosteroid kullanan ve birlikte osteoporoz risk faktörleri taşıyan hastalarda göz önünde tutulmalıdır. İnhalasyon yoluyla kullanılan budesonid ile yapılan uzun süreli çalışmalar çocuklarda günlük ortalama 400 mikrogram (ölçülü doz) veya yetişkinlerde günlük 800 mikrogram (ölçülü doz) dozun kemik mineral yoğunluğu üzerinde belirgin bir etkisinin olmadığını göstermiştir. FORPACK'in daha yüksek dozları ile görülen etkilerine ilişkin bilgi yoktur. Daha önceki sistemik steroid tedavisi nedeniyle adrenal yetmezliğinin belirtileri varsa, böyle hastalar FORPACK tedavisine alınırken dikkatli olunmalıdır. İnhalasyonla alınan budesonid tedavisinin yararı, oral steroide duyulan gereksinimi en aza indirmesidir, ancak oral steroid tedavisinden inhalasyon tedavisine geçen hastalar uzun zaman adrenal yetmezlik riski ile karşı karşıya olabilirler. Geçmişte acil olarak yüksek doz kortikosteroid tedavisi görmüş olan ya da uzun süre yüksek dozda inhalasyon yoluyla steroid kullanmış hastalar da risk altında olabilir. Bu tip durumlarda HPA aksının fonksiyonu düzenli olarak kontrol edilmelidir. Stres veya elektif operasyon uygulanan dönemlerde ilave sistemik kortikosteroid tedavisi düşünülmelidir. Yüksek dozlarda inhale kortikosteroidler ile uzun süreli, özellikle önerilenden daha yüksek dozlarla tedavi, klinik açıdan önemli adrenal baskılanmaya neden olabilir. Bu nedenle ağır enfeksiyonlar gibi stres durumlarında veya elektif operasyon uygulanan dönemlerde ilave sistemik kortikosteroid tedavisi düşünülmelidir. Steroid dozlarında hızlı azalma, akut adrenal krizleri tetikleyebilir. Akut adrenal kriz sırasında görülebilecek belirti ve işaretler kısmen belirsiz olabilir, ancak anoreksi, abdominal ağrı, kilo kaybı, yorgunluk, baş ağrısı, bulantı, kusma, bilinç seviyesinde azalma, nöbet, hipotansiyon ve hipoglisemiyi kapsayabilir. Sistemik steroidler veya inhale budesonid ile uygulanan ek tedavi aniden sonlandırılmamalıdır. Oral tedaviden FORPACK'e geçilirken, alerjik veya artritik belirtiler görünümünde rinit, egzama ve kas eklem ağrısı gibi genel olarak daha düşük bir sistemik steroid etki görülecektir. Bu durumlar için özel tedavi başlatılmalıdır. Nadir olarak, yorgunluk, baş ağrısı, bulantı ve kusma oluşması halinde, genel yetersiz bir glukokortikosteroid etkiden şüphelenmek gerekir. Böyle durumlarda oral glukokortikosteroid dozlarının geçici olarak arttırılması bazen gereklidir. Hastalara, ağız ve boğaz bölgesinde pamukçuk oluşma riskini azaltması için idame dozun her inhalasyonundan sonra ağızlarını suyla çalkalamaları öğütlenmelidir. Pamukçuk oluşması durumunda, FORPACK tedavisine devam edilirken uygun bir lokal veya sistemik tedavi (örneğin oral antifungaller) uygulanmalıdır. FORPACK ile itrakonazol ve ritonavir veya diğer güçlü CYP 3A4 inhibitörleri birlikte kullanılmamalıdır (Bkz. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). Bunun mümkün olmadığı durumlarda, etkileşen ilaçların uygulanmaları arasındaki süre mümkün olduğu kadar uzun olmalıdır. Potent CYP3A4 inhibitörü kullanan hastalarda FORPACK tedavisi önerilmez. FORPACK tirotoksikoz, feokromasitoma, diabetes mellitus, tedavi edilmemiş hipokalemi, hipertrofik obstrüktif kardiyomiyopati, idiyopatik subvalvular aort stenozu, şiddetli hipertansiyon, anevrizma veya iskemik kalp hastalığı, taşiaritmi ya da kalp yetmezliği gibi ağır kardiyovasküler hastalığı veya konvülsif hastalığı olanlarda dikkatli kullanılmalıdır. QTc-aralığı uzamış hastalarda FORPACK kullanılırken dikkatli olunmalıdır. Formoterol QTc-aralığının uzamasına neden olabilir. Aktif ya da pasif akciğer tüberkülozu, solunum yollarında fungal ve viral enfeksiyonu olan hastalarda, inhalasyonla kullanılan kortikosteroidlere gerek olup olmadığı ve dozu yeniden değerlendirilmelidir. Yüksek dozda beta2-agonist tedavisi, ciddi hipokalemi ile sonuçlanabilir. Peta2-agonistlerin hipokalemiye neden olan veya ksantin türevleri, steroidler ve diüretikler gibi hipokalemik etkiyi artıran diğer ilaçlarla birlikte kullanılması, Peta2-agonistlerin olası hipokalemik etkisini artırabilir. Hipokalemi yan etki olasılığının arttığı; değişken sıklıkta hızlı etkili bronkodilatörlerin kullanıldığı stabil olmayan astım, hipoksi nedeniyle hipokalemi riskinin artabileceği akut ağır astım ve bu riskin artabileceği diğer durumlarda özel dikkat gösterilmesi önerilmektedir. Bu tür durumlarda serum potasyum düzeylerinin dikkatle izlenmesi önerilmektedir. Bütün Peta2-agonistlerde olduğu gibi, diyabetik hastalarda kan glukoz düzeyleri daha sık izlenmelidir. İnhaler steroidin kombine edildiği ileri yaş hastalarda pnömoni riski artabilmektedir. Amfizem-Kronik bronşit'te yüksek doz kullanımının avantaj sağladığına ilişkin klinik kanıtlar yetersizdir. Bu tıbbi ürün az miktarda -her dozda 100 mg'dan daha az- alkol içerir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriFarmakokinetik etkileşimler:Potent CYP3A4 inhibitörleri (örn. ketokonazol, itrakonazol, vorikonazol, posakonazol, klaritromisin, telitromisin, nefazodon ve HIV proteaz inhibitörleri) budesonidin plazma seviyelerini belirgin şekilde arttırmaktadır, bu nedenle bu ilaçlarla birlikte kullanımından kaçınılmalıdır. Bunun mümkün olmadığı durumlarda potent CYP3A4 inhibitörü ile budesonidin kullanımı arasındaki zaman aralığı mümkün olduğunca uzun olmalıdır (Bkz. Bölüm 4.4). Potent CYP3A4 inhibitörü olan ketokonazolün günde 1 kez 200 mg'ı ile oral budesonidin (tek doz olarak 3 mg) eş zamanlı olarak uygulanması, budesonidin plazma seviyelerini yaklaşık olarak 6 kat arttırmıştır. Budesonid uygulamasının ardından 12 saat sonra uygulanan ketokonazol, budesonid konsantrasyonunu yaklaşık olarak 3 kat arttırmıştır. Bu durum, ketokonazol ile budesonidin kullanımı arasındaki zaman aralığının uzatılmasının, budesonidin plazma seviyelerindeki yükselmeyi azalttığını göstermektedir. Yüksek doz inhale budesonid ile potent CYP3A4 inhibitörleri arasındaki etkileşimi gösteren sınırlı veriler, günde 1 kez 200 mg itrakonazol ile inhale budesonidin (tek doz olarak 1000 mcg) eş zamanlı olarak uygulanmasıyla, budesonidin plazma seviyelerinde belirgin bir artış (yaklaşık olarak 4 kat) meydana gelebileceğini göstermektedir. Farmakodinamik etkileşimler: Beta-adrenerjik blokör ilaçlar, formoterolün etkisini zayıflatabilir ya da tamamen inhibe edebilirler. Bu nedenle zorunlu olmadıkça, FORPACK, beta-adrenerjik blokör ilaçlarla (göz damlaları dahil) birlikte kullanılmamalıdır. Kinidin, disopiramid, prokainamid, fenotiyazinler, antihistaminikler (terfenadin), monoamino oksidaz inhibitörleri ve trisiklik antidepresanlarla birlikte kullanıldığında QTc aralığı uzayabilir ve ventriküler aritmi riski artar. Ayrıca L-dopa, L-tiroksin, oksitosin ve alkol, beta2-sempatomimetiklere karşı kardiyak toleransı azaltabilir. Monoamino oksidaz inhibitörleri ve furazolidon ve prokarbazin gibi benzer özellikteki ilaçlarla birlikte kullanıldığında hipertansif reaksiyonlar artabilir. Halojenli hidrokarbon yapısındaki anestezik ilaçlarla birlikte kullanıldığında aritmi riski artar. Diğer beta-adrenerjik ilaçlarla veya antikolinerjik ilaçlarla birlikte kullanıldığında aditif etki görülebilir. Dijital glikozitleri ile tedavi edilen hastalarda hipokalemi, aritmiye eğilimi arttırabilir. Budesonid ve formoterolün astım tedavisinde kullanılan diğer ilaçlarla etkileşimi gözlenmemiştir. 4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi C'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)FORPACK gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Çocuk doğurma potansiyeli bulunan kadınların tedavi süresince etkin doğum kontrol (kontrasepsiyon) yöntemleri uygulaması önerilmektedir. Gebelik dönemiGebelikte, FORPACK tedavisine veya formoterol ve budesonidin birlikte kullanılmasına yönelik herhangi bir klinik veri mevcut değildir. Sıçanlardaki bir embriyo-fetal gelişim çalışmasının verileri kombinasyondan kaynaklanan herhangi bir artmış etkiyi işaret etmemiştir.Formoterolün hamile kadınlarda kullanımına yönelik yeterli veri mevcut değildir. Çok yüksek sistemik dozların kullanıldığı hayvan üreme çalışmalarında formoterol advers etkilere neden olmuştur (Bkz. 5.3 Klinik öncesi güvenlilik verileri). Yaklaşık 2000 gebeden elde edilen veriler, inhale budesonidin kullanılması ile ilişkili olarak teratojenik riskin artmadığını göstermektedir. Hayvan çalışmalarında glukokortikosteroidlerin malformasyonlara neden olduğu gösterilmiştir (Bkz. 5.3 Klinik öncesi güvenlilik verileri). Bu durum, önerilen dozların verildiği insanlarda aynı değildir. Hayvan çalışmalarında, glukokortikoidlerin doğumdan önce aşırı miktarda alınmasının intrauterin gelişmede gecikme, yetişkin kardiyovasküler hastalık ve glukokortikoid reseptör yoğunluğunda, teratojenik doz aralığının altında görülen nörotransmitter döngüsü ve etkilerinde kalıcı değişikliklere yönelik bir ilişki saptanmıştır. FORPACK gebelikte ancak sağlanan fayda ortaya çıkabilecek risklerden fazla olduğunda kullanılabilir. Budesonidin, yeterli astım kontrolünü idame ettirecek etkili en düşük dozu kullanılmalıdır. Laktasyon dönemiFormoterolün insanlarda anne sütüne geçip geçmediği bilinmemektedir. Sıçanlarda, az miktarda formoterolün anne sütüne geçtiği belirlenmiştir. Budesonid anne sütüne geçer. Ancak tedavi dozlarında kullanıldığında bebeğe zararlı etkisi olması beklenmez.FORPACK, emziren annelere, ancak anneye sağlanan faydanın, çocukta görülebilecek riskten daha fazla olması halinde verilebilir. Üreme yeteneği/FertiliteSıçanlarla gerçekleştirilen bir üreme çalışmasında, mg/m baz alınarak insanlar için önerilen günlük maksimum inhalasyon dozunun sırasıyla yaklaşık 1/7 ve 1/3 dozlarında budesonid ve formoterolün kombine edilip inhalasyon yolu ile uygulanması kasık fıtığına neden olmuştur. mg/m baz alınarak insanlar için önerilen günlük maksimum inhalasyon dozunun sırasıyla yaklaşık 1/32 ve 1/16 dozlarında budesonid ve formoterolün kombine edilip inhalasyon yolu ile uygulanması teratojenik veya embriyosidal etkiye neden olmamıştır.4.7. Araç ve makine kullanımı üzerindeki etkilerFORPACK'in araç ve makine kullanma yeteneği üzerindeki etkisi bilinmemektedir.4.8. İstenmeyen etkilerFORPACK, hem budesonid hem de formoterol içerdiğinden bu maddelerin herbirine ait, aynı tipte ve aynı sıklıkta advers etkiler görülebilir. Bu iki maddenin birlikte kullanılmasına bağlı olarak advers etkilerde bir artış gözlenmemiştir. En yaygın yan etkiler; beta2-agonistlerle tedavide görülen tremor ve palpitasyon gibi yan etkilerdir. Bu etkiler hafiftir ve tedavinin birkaç günü içinde kaybolurlar. Budesonidin KOAH'da kullanıldığı 3 yıllık bir klinik çalışmada deride morarma %10 ve pnömoni%6 sıklıkla görülürken plasebo grubunda bu oranlar sırasıyla %4 ve %3 olarak saptanmıştır (sırasıyla p<0.001 ve p<0.01).Budesonid ya da formoterole bağlı aşağıdaki yan etkiler organ sınıfı ve sıklığa göre sıralanmıştır. Sıklık tanımlaması: çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek (<1/10.000) ve bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarYaygın: Orofarinkste Candida enfeksiyonlarıBağışıklık sistemi hastalıklarıSeyrek: Ani veya gecikmiş aşırı duyarlılık reaksiyonları, örn. ekzantem, ürtiker, kaşıntı, dermatit, anjiyoödem ve anafilaktik reaksiyonEndokrin hastalıklarıÇok seyrek: Cushing's sendromu, adrenal süpresyon, büyüme gerilemesi, kemik mineral yoğunluğunda azalmaMetabolizma ve beslenme hastalıklarıSeyrek: Hipokalemi Çok seyrek: HiperglisemiPsikiyatrik hastalıklarYaygın olmayan: Agresyon, psikomotor hiperaktivite, anksiyete, uyku bozuklukları Çok seyrek: Depresyon, davranış bozuklukları (esas olarak çocuklarda)Sinir sistemi hastalıklarıYaygın: Baş ağrısı, tremor Yaygın olmayan: Sersemlik Çok seyrek: Tat alma bozukluklarıGöz hastalıklarıÇok seyrek: Katarakt, glokomKardiyak hastalıklarYaygın: Palpitasyonlar Yaygın olmayan: TaşikardiSeyrek: Kardiyak aritmiler örn. atriyal fibrilasyon, supraventriküler taşikardi, ekstrasistoller Çok seyrek: Angina pektoris, QTc aralığının uzaması Vasküler hastalıklarÇok seyrek: Kan basıncında değişkenlikSolunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Boğazda hafif bir iritasyon, öksürme, ses kalınlaşması Seyrek: BronkospazmGastrointestinal hastalıklarYaygın olmayan: BulantıDeri ve deri altı doku hastalıklarıYaygın olmayan: MorarmaKas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın olmayan: Adale kramplarıİlacın birikimine bağlı olarak orofarinkste Candida enfeksiyonu gözlenebilir. Candida enfeksiyonu oluşma riskini en aza indirmek için, hastaya her bir doz kullanımından sonra ağzını su ile çalkalaması tavsiye edilmelidir. Orofaringeal Candida enfeksiyonu, inhale kortikosteroid tedavisini sonlandırmaksızın genellikle topikal antifungal ajanlarla tedavi edilir. Diğer inhalasyon tedavilerinde olduğu gibi bazı vakalarda nadiren paradoksal bronkospazm gelişebilir. Bu durum 10.000 kişide 1'den az kişiyi etkiler ve ilaç uygulamasının ardından nefes darlığı ve hırıltıda ani bir artışa neden olabilir. Paradoksal bronkospazm, hızlı etki eden inhale bronkodilatörlere yanıt verir ve hemen tedavi edilmelidir. FORPACK tedavisi derhal sonlandırılmalıdır, hasta değerlendirilmelidir ve eğer gerekli ise alternatif tedavi başlatılmalıdır (Bkz. Bölüm 4.4) Uzun süre özellikle yüksek dozda inhalasyon yoluyla herhangi bir kortikosteroid kullanıldığında sistemik etkiler görülebilir. Bu etkilerin görülme olasılığı oral kortikosteroidlere oranla daha azdır. Oluşabilecek sistemik etkiler; Cushing's sendromu, Cushing benzeri belirtiler, adrenal yetmezlik, çocuklar ve adolesanlarda büyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt ve glokomdur. Enfeksiyonlara karşı artmış hassasiyet ve stres koşullarına adapte olmakta azalma da meydana gelebilir. Etkiler muhtemelen doza, uygulama süresine, birlikte kullanılan veya daha önceki steroid maruziyetine ve bireysel hassasiyete bağlıdır. Beta2-agonistlerle tedavi, insülin, serbest yağ asitleri, gliserol ve keton cisimlerinin kan düzeyinin yükselmesine neden olabilir. 4.9. Doz aşımı ve tedavisiFormoterolün doz aşımı durumunda tremor, baş ağrısı ve palpitasyon gibi beta2 - agonistlere bağlı tipik etkiler görülebilir. İzole vakalarda bildirilen belirtiler; taşikardi, hiperglisemi, hipokalemi, QTc-aralığında uzama, aritmi, bulantı ve kusmadır. Destekleyici ve semptomatik tedavi uygulanabilir. Akut bronşiyal obstrüksiyonu olan hastaya 3 saat içinde verilen 90 mikrogramlık bir doz güvenilirlik konusunda sorun yaratmamıştır.Çok yüksek dozlarda olsa bile, akut budesonid doz aşımının klinik açıdan sorun oluşturması beklenmez. Uzun süre çok yüksek dozlarda kullanılırsa, hiperkortisizm, ve adrenal baskılanması gibi sistemik glukokortikosteroid etkileri ortaya çıkabilir. Formoterol doz aşımına bağlı olarak FORPACK tedavisinin kesilmesi gerekirse, inhalasyon yoluyla kullanılan uygun bir kortikosteroid tedavisinin uygulanması düşünülmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Adrenerjikler ve Obstrüktif Solunum Yolu Hastalıklarında KullanılanDiğer İlaçlar ATC kodu: R03AK07 Etki mekanizması ve farmakodinamik özellikleri: FORPACK, formoterol ve budesonid içerir ve her ikisinin de etki mekanizmaları farklıdır. Astım alevlenmelerinin azalabilmesi için aditif etki gösterirler. Her bir maddenin etki mekanizmaları aşağıdaki gibidir. Formoterol Formoterol, geri dönüşümlü solunum yolu obstrüksiyonu olan hastalarda inhale edildiğinde, bronş düz kasında hızlı ve uzun etkili gevşeme sağlayan, selektif bir beta2-adrenerjik uyarıcıdır. Bronş genişletici etkisi doza bağımlı olarak 1-3 dakika içinde hızla başlar ve tek bir dozdan sonra etkisi en az 12 saat sürer. Budesonid Budesonid inhale edildiğinde, solunum yollarında doza bağımlı antienflamatuvar etki gösteren, semptomlarda ve astım alevlenmelerinde azalma sağlayan bir glukokortikosteroiddir. İnhale edilen budesonid, sistemik kortikosteroidlere göre daha az ciddi advers etkilere sahiptir. Glukokortikosteroidlerin bu antienflamatuvar etkisinden sorumlu olan esas mekanizma bilinmemektedir. Astım Toplam 1076 hastayla gerçekleştirilen randomize, çift-kör, plasebo kontrollü iki çalışmada, formoterol/budesonid kombinasyonunun etkinliği ve güvenirliği formoterol, budesonid ve plasebo ile karşılaştırılmıştır. İlk çalışmada günde iki kez iki inhale 4.5/160 mcg formoterol/budesonid dozu uygulaması; 160 mcg budesonid, 4.5 mcg formoterol, ayrı dozlar halinde uygulanan 4.5 mcg formoterol+160 mcg budesonid ve plasebo ile karşılaştırılmıştır (Her bir ilaç günde iki kez iki inhalasyon olarak uygulanmıştır). İkinci çalışmada günde iki kez iki inhale 4.5/80 mcg formoterol/budesonid dozu uygulaması; 80 mcg budesonid, 4.5 mcg formoterol ve plasebo ile karşılaştırılmıştır (Her bir ilaç günde iki kez iki inhalasyon olarak uygulanmıştır). Her iki çalışmada da astım semptomlarındaki ve kurtarıcı albuterol kullanımındaki azalma, akşam ve sabah PEF'inde iyileşme ilk formoterol/budesonid dozu uygulamasının birinci günü içerisinde meydana gelmiştir ve iyileşme 12 haftalık tedavi sonunda da devam etmiştir. İki çalışmada da ilk formoterol/budesonid dozunu takiben FEVı tedavinin ilk 2 haftasında dikkate değer oranda iyileşmiş ve 12 hafta boyunca iyileşme devam etmiştir. KOAH Toplam 3668 KOAH hastasında hava yolu tıkanıklığının idame tedavisinde günde iki kez iki inhale 4.5/160 mcg formoterol/budesonid dozu ve günde iki kez iki inhale 4.5/80 mcg formoterol/budesonid dozu uygulamasının etkinliği ve güvenirliği 6 aylık ve 12 aylık randomize, çift-kör, plasebo kontrollü çok uluslu iki çalışmada değerlendirilmiştir. İlk çalışmada hastalar günde iki kez iki inhale 4.5/160 mcg formoterol/budesonid, 4.5/80 mcg formoterol/budesonid, 4.5 mcg formoterol+160 mcg budesonid, 160 mcg budesonid, 4.5 mcg formoterol veya plasebo almak üzere randomize edilmiştir. İkinci çalışmada hastalar günde iki kez iki inhale 4.5/80 mcg formoterol/budesonid, 4.5/160 mcg formoterol/budesonid, 4.5 mcg formoterol veya plasebo almak üzere randomize edilmiştir. İlk çalışmada günde iki kez iki inhale 4.5/160 mcg formoterol/budesonid dozu tedavi sonunda doz öncesi FEV1'de 4.5 mcg formoterol ve plaseboya göre ve 1 saatlik doz sonrası FEV1'de 160 mcg budesonide ve plaseboya göre, başlangıçtan itibaren anlamlı oranda daha fazla iyileşme sağlamıştır. İkinci çalışmada da günde iki kez iki inhalasyon 4.5/160 mcg formoterol/budesonid tedavisi sonunda doz öncesi FEV1'de 4.5 mcg formoterol ve plaseboya göre ve 1 saatlik doz sonrası FEV1'de plaseboya göre başlangıçtan itibaren anlamlı oranda daha fazla iyileşme sağlamıştır. Her iki çalışmada kurtarıcı medikasyon kullanımındaki azalma ve sabah ve akşam pik ekspiratuvar akışı ile ilgili sekonder sonlanım noktalarındaki iyileşmeler, 4.5/160 mcg formoterol/budesonid kullanımının etkinliğini desteklemiştir. 5.2. Farmakokinetik özellikler Genel özelliklerBudesonid ve formoterolün farmakokinetik etkileşime ilişkin bir kanıt yoktur.Emilim:Formoterol İnhale edilen formoterol hızlı bir şekilde emilir; pik plazma konsantrasyonlarına doz uygulamasından sonra 5-10 dakika içerisinde ulaşılır. Diğer oral inhalasyon ürünlerinde olduğu gibi, inhale edilen formoterolün büyük çoğunluğunun yutulduğu ve daha sonra gastrointestinal yoldan emildiği düşünülmektedir. Budesonid Oral olarak inhale edilen budesonid akciğerlerde hızlı bir şekilde emilir ve pik plazma konsantrasyonlarına 20 dakika içerisinde ulaşılır. Oral budesonid uygulamasından sonra pik plazma konsantrasyonlarına 1 -2 saat içerisinde ulaşılır ve geniş ilk geçiş metabolizmasından dolayı mutlak sistemik biyoyararlanımı %6-13 oranındadır. Buna karşın akciğerlere dağılan budesonidin çoğunluğu sistemik olarak emilir. Sağlıklı bireylerde ölçülü dozun %34'ü, ölçülü dozun %39'luk mutlak sistemik biyoyararlanımı ile akciğerde depolanır. Dağılım:Formoterol 10-500 nmol/L konsantrasyon aralığında formoterolün RR ve SS enantiyomerleri için plazma proteinlerine bağlanma sırasıyla, %46 ve %58 oranındadır. Dağılım hacmi yaklaşık 4 L/kg'dir. Budesonid Budesonidin dağılım hacmi yaklaşık 3 L/kg'dir. Budesonid %85-90 oranında plazma proteinlerine bağlanır. Biyotransformasyon:Formoterol Formoterolün primer metabolizması direkt glukuronidasyon ve O-demetilasyon ve bunu takiben inaktif metabolitlere konjugasyon yoluyla meydana gelir. Sekonder metabolik yollar deformilasyonu ve sülfat konjügasyonunu içerir. CYP2D6 ve CYP2C, O-demetilasyondan primer olarak sorumludurlar. Budesonid İnsan karaciğer homojenatları ile gerçekleştirilen in vitroçalışmalar budesonidin hızlı ve geniş ölçüde metabolize olduğunu göstermiştir. En önemli metabolitleri olan 6P-hidroksibudesonid ve 16a-hidroksiprednizolonun glukokortikosteroid aktivitesi budesonidin aktivitesinin %1'inden azdır. İnsan akciğerinde ve serum preparasyonlarında ihmal edilebilir metabolik inaktivasyon gözlenmiştir.Budesonid ve formoterol arasında herhangi bir metabolik etkileşim ya da yer değiştirme reaksiyonları olduğuna ilişkin bulgu yoktur. Eliminasyon:Formoterol Formoterolün atılımı radyoaktif işaretlenmiş formoterolün eş zamanlı oral ve intravenöz uygulamasını takiben 4 sağlıklı bireyde çalışılmıştır. Bu çalışmada radyoaktif işaretli formoterolün %62'si idrarla, %24'ü dışkıyla elimine edilmiştir. Budesonid Budesonid idrar ve dışkıyla metabolit halinde atılmaktadır. Radyoaktif işaretlenmiş dozun yaklaşık %60'ı idrarla atılmıştır. İdrarda değişmemiş budesonid saptanmamıştır. Budesonidin 22R formu 1.4 L/dak'lık sistemik klerensle, 22S formu 1.0 L/dak'lık sistemik klerens ile karaciğer tarafından klere olmuştur. Terminal yarı ömür her iki epimer için aynı olup (2-3 sa), dozdan bağımsızdır. Doğrusallık/Doğrusal olmayan durum:Formoterol Formoterolün farmakokinetiği incelenen doz aralığında (20-300 mcg) doğrusallık gösterir. Budesonid Klinikte kullanılan doz sınırları içinde budesonidin farmakokinetik profili doğrusallık gösterir. Hastalardaki karakteristik özelliklerPediyatrik hastalar:6-11 yaş aralığında astımı olan pediyatrik hastalarla gerçekleştirilen tek doz çalışmasında ölçülü doz inhaleri ile 4 inhalasyon 4.5/160 mcg formoterol/budesonid dozu uygulamasını takiben budesonidin plazma konsantrasyonları ölçülmüştür. 1.4 nmol/L pik plazma konsantrasyonları doz uygulamasından 20 dakika sonra meydana gelmiştir. Dağılan formoterol dozunun yaklaşık %3.5'i idrarda değişmemiş formoterol olarak bulunmuştur. Gerçekleştirilen bu çalışma ölçülü doz inhaleri ile uygulanan formoterol/budesonid kombinasyonunda budesonide toplam sistemik maruziyetin, aynı dozda kuru toz inhaleri ile uygulanan inhale budesonide toplam sistemik maruziyetten yaklaşık %30 daha düşük olduğunu göstermiştir. 5.3. Klinik öncesi güvenlilik verileriBudesonid ve formoterolün tek başına ya da ikisinin kombinasyonu ile hayvanlarda yapılan toksisite çalışmalarında görülen etkileri, abartılmış farmakolojik etkilerdir.Üreme ile ilgili hayvan çalışmalarında budesonid gibi kortikosteroidlerin malformasyonlara (yarık damak, iskelet malformasyonları) sebep olduğu gösterilmişse de bu etkilerin önerilen dozlarla tedavi edilen insanlar için geçerli olmadığı görülmüştür. Hayvanlarda, formoterol ile yapılan üreme çalışmalarında, sistemik yararlanımın yüksek olduğu erkek sıçanlarda fertilitede azalma ve sistemik yararlanımın klinikteki kullanımdan önemli ölçüde yüksek olduğu durumlarda, implantasyon kayıpları ile birlikte postnatal yaşam süresinde ve doğum kilosunda azalma gözlenmiştir. Ancak bu hayvan deneylerinin sonuçları insanlar için geçerli değildir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiHFA-134a Oleik Asit Dehidrat Alkol6.2. GeçimsizliklerGeçerli değil.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. Direkt gün ışığından ve donmaktan koruyunuz. Aerosol kutusu delinmemeli, boş olsa bile kırılmamalı, ateşten uzak tutulmalıdır.6.5. Ambalajın niteliği ve içeriğiFORPACK 6/400 mcg inhalasyon için ölçülü dozlu aerosol, 120 dozluk aerosol tüplerde karton kutuda kullanma talimatı ile birlikte sunulmaktadır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİNeutec İnhaler İlaç San. ve Tic. A.Ş.Sakarya 1. Organize Sanayi Bölgesi 2. Yol No:3 Arifiye / Sakarya Telefon: 0 850 201 23 23 Faks: 0 212 482 24 78 e-mail: [email protected] 8. RUHSAT NUMARASI (LARI)255/559. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 30.12.2013 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ21 |
İlaç BilgileriForpack 6/400 Mcg İnhalasyon İçin Ölçülü Dozlu Ae...Etken Maddesi: Formoterol Fumarat Dihidrat,budesonid Atc Kodu: R03AK07 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.