Farhem 12 Mcg İnhalasyon İçin Ölçülü Dozlu Aerosol Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Adrenerjikler (İnhalan) » Selektif Beta 2 Adrenoreseptör Agonistleri » Formoterol KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIFARHEM 12 mcg inhalasyon için ölçülü dozlu aerosol2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Formoterol fumarat dihidrat 12 mcgYardımcı maddeler:Dehidrat alkol 4,32 mgYardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon için ölçülü dozlu aerosol.Alüminyum inhaler kabı içinde basınçlı propellant gaz ile doldurulmuş süspansiyon. Alüminyum konteynere bir dozajlama valf eklidir. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlar Astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla bir inhale kortikosteroid ile birlikte kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren (inhaler steroidlerle kontrol altına alınmayan astımlı hastalarda) kullanılır. Orta ve ağır KOAH olgularında uzun etkili beta2 agonistler, hem semptomları kontrol altına almada hem de yaşam kalitesini düzeltmede ve alevlenme sıklığını azaltmada etkilidir. İnhale alerjenler, soğuk hava ya da egzersizle indüklenen bronkospazm profilaksisi. 4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Astım:Yetişkinler: FARHEM'in etkin maddesi formoterolün de dahil olduğu uzun etkili beta2 agonist sınıfı ilaçlar, astımlı hastalarda, yalnızca düzenli ve yeterli dozda inhale kortikosteroid alan hastalarda bu tedaviye ek olarak kullanılır. FARHEM dozu, hastanın kişisel ihtiyacına göre ayarlanmalı ve terapötik amaca ulaşılmasını sağlayan en düşük dozda uygulanmalıdır. Doz, önerilen maksimum dozu aşacak şekilde arttırılmamalıdır. İnhalasyondan 12 saat sonra FARHEM, hala önemli derecede bronkodilatör etki gösterdiğinden, çoğu olguda günde iki defa uygulama şeklindeki idame tedavisi, kronik durumlarla ilişkili gündüz ve gece görülen bronkokonstriksiyonu kontrol altına alır. Düzenli idame tedavisi için, günde iki defa 1 inhalasyon (12 mikrogram formoterole eşdeğer) kullanılması önerilir. Daha ciddi vakalarda günde 2 defa 2 inhalasyon verilir. Önerilen en yüksek idame dozu günde 48 mikrogramdır. Gerekirse belirtilerin hafifletilmesi için önerilen en yüksek günlük doz olan 48 mikrogramı aşmamak kaydıyla her gün 1-2 ilave inhalasyon kullanılabilir. Ancak haftada iki günden fazla ilave dozlara ihtiyaç olduğu takdirde doktora danışılmalı ve tedavi yeniden değerlendirilmelidir, çünkü bu durum hastalığın ağırlaştığının belirtisi olabilir. FARHEM, astım ataklarının akut semptomlarını hafifletmek için kullanılmamalıdır. Akut atak durumunda, kısa etkili bir beta2-agonist kullanılmalıdır (bkz. Bölüm 4.4). Çocuklar (5 yaş ve üzeri): FARHEM sadece inhale bir kortikosteroide ilave olarak reçete edilmeli ve kullanılmalıdır. Düzenli idame tedavisi için, günde iki defa 1 inhalasyon (12 mikrogram) kullanılması önerilir. İnhale kortikosteroid ile uzun etkili beta2 agonistin ayrı kullanılmasının gerekli olduğu durumlar dışında 5-12 yaş arası çocuklarda, inhale kortikosteroid ile uzun etkili beta2 agonist (LABA) içeren bir kombinasyon preparatla tedavi uygulanması tavsiye edilir (bkz. Bölüm 4.4. ve 4.8). Önerilen en yüksek doz günde 24 mikrogramdır. FARHEM, bir astım atağının akut semptomlarını hafifletmek için kullanılmamalıdır. Akut atak durumunda, kısa etkili bir beta2-agonist kullanılmalıdır (bkz. Bölüm 4.4). FARHEM, 5 yaşın altındaki çocuklarda önerilmez. Egzersizin neden olduğu bronkospazma karşı veya bilinen kaçınılamaz bir alerjen ile temastan önce profilaksi: Yetişkinler: Egzersizden veya alerjenle temastan en az 15 dakika önce 1 inhalasyon (12 mikrogram) inhale edilmelidir. Ciddi bronkospazm öyküsü olan hastalarda profilaktik olarak 2 inhalasyon (24 mikrogram) gerekli olabilir. Persistan astımı olan hastalarda, egzersizin neden olduğu bronkospazma karşı ya da bilinen kaçınılamaz bir alerjen ile temastan önce FARHEM'in kullanılması klinik açıdan endike olabilir. Ancak astım tedavisi bir inhale kortikosteroid de içermelidir. Çocuklar (5 yaş ve üzeri): Egzersizden veya alerjenlerle temastan en az 15 dakika önce 1 inhalasyon (12 mikrogram) inhale edilmelidir. FARHEM, sadece bir inhale kortikosteroide ek olarak kullanılmalıdır. Persistan astımı olan hastalarda, egzersizin neden olduğu bronkospazma karşı ya da bilinen kaçınılamaz bir alerjen ile temastan önce FARHEM'in kullanılması klinik açıdan endike olabilir. Ancak astım tedavisi bir inhale kortikosterid de içermelidir. Kronik obstrüktif akciğer hastalığı (KOAH): Düzenli idame tedavisi için, günde iki defa 1 inhalasyon (12 mikrogram) kullanılması önerilir. Çocuklar (5 yaş ve üzeri): Uygun değildir. Uygulama şekli:FARHEM yetişkinlerde ve 5 yaş ve üzerindeki çocuklarda inhalasyon yolu ile uygulanır. İnhalasyon spreyinin doğru kullanımı doktor veya eczacı tarafından hastaya gösterilmelidir. İnhalasyon sırasında hastalar tercihen oturmalı veya ayakta durmalıdır. İnhalasyon spreyi dik konumda kullanım için tasarlanmıştır.Elleri kuvvetsiz hastalar iki işaret parmağı inhalerin tepesinde, iki başparmağı ağız parçasının altında olacak şekilde iki elleri ile birlikte inhaleri tutabilirler. İnhalasyon için spreyi aktive ederken eş zamanlı olarak nefes alma işlevini ayarlamada zorlanan hastaların uygun bir hava odacığı kullanması önerilir. İnhalasyon spreyinin doğru kullanımı için aşağıda verilen kuralları dikkatle izleyiniz. İnhalasyon spreyinin kullanım talimatıİnhalasyon spreyinin test edilmesi: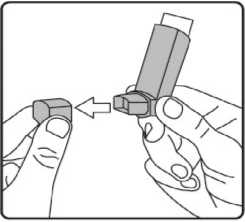 İlk kez kullanımdan önce hastalar ağızlık kapağını, kapağın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon spreyini iyi bir şekilde sallamalı, baş parmak ağızlığın altında inhalasyon spreyinin tabanında olacak şekilde parmaklar ve baş parmak arasında tutmalı ve boşluğa sıkım yapmalıdır. İnhalasyon spreyi her sıkımdan önce sallanmalıdır.
İlk kez kullanımdan önce hastalar ağızlık kapağını, kapağın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon spreyini iyi bir şekilde sallamalı, baş parmak ağızlığın altında inhalasyon spreyinin tabanında olacak şekilde parmaklar ve baş parmak arasında tutmalı ve boşluğa sıkım yapmalıdır. İnhalasyon spreyi her sıkımdan önce sallanmalıdır.İnhalasyon spreyi bir hafta veya daha uzun süredir kullanılmadığında hastalar ağızlık kapağını çıkarmalı, inhalasyon spreyi ile boşluğa iki kez sıkım yapılmalıdır. İnhalasyon spreyinizi kullanacağınız zaman oturunuz veya ayakta dik durunuz. 1. İlk resimde gösterildiği gibi ağızlık kapağını çıkarınız. Ağızlığın temiz olduğundan emin olmak için içini ve dışını kontrol ediniz. 2. İnhalasyon spreyinizi her kullanımdan önce iyice çalkalayınız. 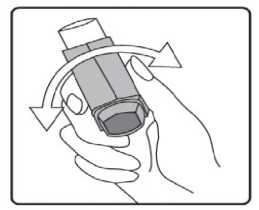 3. İnhalasyon spreyinizi baş parmağınız ağızlığın altında, inhalasyon spreyinizin tabanında olacak şekilde dik tutunuz.
3. İnhalasyon spreyinizi baş parmağınız ağızlığın altında, inhalasyon spreyinizin tabanında olacak şekilde dik tutunuz.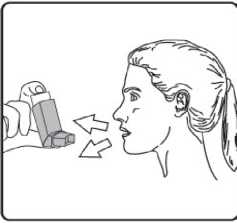 4. Ağızlığı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıca kapatınız.
4. Ağızlığı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıca kapatınız.
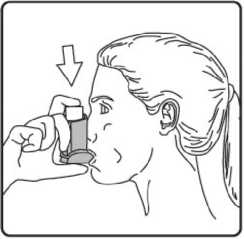 6. Nefesinizi yaklaşık 10 saniye veya rahatça tutabildiğiniz kadar tutunuz ve ağızlığı ağzınızdan çıkarıp parmağınızı inhalasyon spreyinizin üst kısmından çekiniz. Sonra yavaşça ağzınızdan nefes veriniz. İnhalerin içine nefes vermekten kaçınız.
6. Nefesinizi yaklaşık 10 saniye veya rahatça tutabildiğiniz kadar tutunuz ve ağızlığı ağzınızdan çıkarıp parmağınızı inhalasyon spreyinizin üst kısmından çekiniz. Sonra yavaşça ağzınızdan nefes veriniz. İnhalerin içine nefes vermekten kaçınız.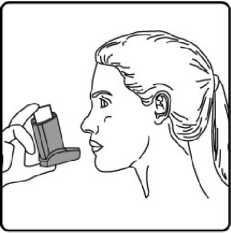 7. Her bir puf ilaç alımı arasında yaklaşık yarım dakika bekleyiniz ve sonra 2-6. basamakları tekrarlayınız.
7. Her bir puf ilaç alımı arasında yaklaşık yarım dakika bekleyiniz ve sonra 2-6. basamakları tekrarlayınız.8. Kullanımdan sonra tozdan korumak için ağızlığın kapağını hemen kapatınız. Ağızlık kapağı doğru bir şekilde yerleştirildiğinde tam yerine oturacaktır. Eğer yerine oturmuyorsa, ağızlık kapağını diğer yöne çeviriniz. Çok fazla güç uygulamayınız. Hastalar 4, 5 ve 6. basamakları hızlı bir şekilde yapmamalıdır. Hastaların inhalasyon spreyini etkin hale getirmeden hemen önce mümkün olduğunca yavaş bir şekilde nefes almaya başlaması önemlidir. Hastalar aynanın önünde ilk birkaç uygulama için pratik yapmalıdırlar. Eğer hastalar inhalasyon spreyinin üstünden veya ağızlarının yanından buhar geldiğini görürse, 2. basamaktan itibaren uygulamaya tekrar başlamalıdırlar. inhalasyon spreyinin temizlenmesiİnhalasyon spreyinizi haftada en az bir kez temizleyiniz.1. Ağızlık kapağını çıkarınız. 2. Tüpü plastik gövdeden çıkarmayınız. 3. Kuru bir bez veya kumaş ile ağızlığın içini ve dışını ve plastik gövdeyi siliniz. 4. Ağızlık kapağını doğru bir şekilde yerleştiriniz. Kapağı yerleştirmek için çok fazla güç uygulamayınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Formoterolün karaciğer veya böbrek yetmezliği olan hastalardaki kullanımına ilişkin klinik çalışma yapılmamıştır. Ancak, FARHEM'in böbrek ve karaciğer yetmezliği olan hastalarda kullanımında doz ayarlaması gerektiği konusunda teorik bir sebep bulunmamaktadır.Pediyatrik popülasyon:FARHEM, 5 yaşından küçük çocuklara tavsiye edilmez.Geriyatrik popülasyon:FARHEM, 65 yaş ve üzerindeki hastalarda diğer yetişkinlerle aynı dozlarda kullanılabilir.4.3. KontrendikasyonlarEtkin madde formoterole ya da içeriğindeki yardımcı maddelerden herhangi birine karşı aşırı duyarlılıkta kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleri Formoterol; astımlı hastalarda tek başına monoterapi olarak kullanılmamalıdır.FARHEM'in etkin maddesi formoterol, uzun etkili p2-adrenerjik agonistler sınıfına dahildir. Uzun etkili diğer bir p2-agonist olan salmeterol ile yapılan bir çalışmada, salmeterol ile tedavi edilen hastalarda plasebo grubu ile karşılaştırıldığında astım nedeniyle ölüm oranının daha yüksek olduğu gözlemiştir (sırasıyla 13/13176 ve 3/13179). Astımla ilişkili ölüm oranının formoterol ile artıp artmadığına dair yeterli çalışma yürütülmemiştir. Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir.Astım tedavisinde: FARHEM başka bir uzun etkili beta2-agonist ile birlikte kullanılmamalıdır. FARHEM, astımda ilk tedavi seçeneği olarak kullanılmamalıdır. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. Astım hastalarını tedavi ederken uzun etkili bir beta2 agonist (LABA) olan FARHEM, tek başına bir inhale kortikosteroid ile yeterli düzeyde kontrol edilemeyen ya da hastalığının şiddeti bir LABA ve inhale kortikosteroidin her ikisi ile tedavinin başlatılmasını kesin olarak gerektiren hastalarda bir inhale kortikosteroide ilave tedavi olarak kullanılmalıdır. İnhale kortikosteroid ile uzun etkili beta2 agonistin ayrı kullanılmasının gerekli olduğu durumlar dışında 6-12 yaş arası çocuklarda, inhale kortikosteroid ile uzun etkili beta2 agonist (LABA) içeren bir kombinasyon preparatla tedavi uygulanması tavsiye edilir (bkz. Bölüm 4.2. ve 4.8). İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediyatrik ve adolesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. FARHEM reçete edildiğinde hastalar aldıkları antienflamatuvar tedavinin yeterliliği açısından değerlendirilmelidirler. Hastalara, FARHEM almaya başladıktan sonra, belirtilerde düzelme olduğunda bile antienflamatuvar tedaviye değişiklik yapmaksızın devam etmeleri öğütlenmelidir. Günlük FARHEM dozu, önerilen maksimum dozu aşmamalıdır. Astım semptomları kontrol altına alındıktan sonra, FARHEM dozunun kademeli olarak azaltılması düşünülmelidir. Tedavinin azaltılması sırasında hastalar yakından izlenmeli ve FARHEM etkili en düşük dozda kullanılmalıdır. Formoterol ile yapılan klinik çalışmalar, formoterol kullanan hastalarda (özellikle 5-12 yaş arası hastalarda) ciddi astım ataklarının sıklığının plasebo alanlara göre daha yüksek olduğunu düşündürmüştür (bkz. Bölüm 4.8). Bu çalışmalar, ciddi astım alevlenme oranları açısından tedavi grupları arasındaki farkların doğru olarak ölçülmesine imkan vermemektedir. Semptomlar devam ettiği takdirde ya da semptomların kontrol edilebilmesi için gereken FARHEM dozlarının sayısı arttığı takdirde, doktorlar böyle bir gelişmenin genellikle altta yatan durumun kötüleştiğini gösteriyor olması nedeniyle kullanılan astım tedavisini yeniden değerlendirmelidir. Astım alevlenmesi esnasında FARHEM tedavisine başlanmamalı ya da doz arttırılmamalıdır. Hastalar alevlenme döneminde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. FARHEM, akut astım semptomlarının rahatlatılması için kullanılmamalıdır. Akut ataklarda kısa etkili bir beta2-agonist kullanılmalıdır. Hastalar, astımları aniden kötüleştiği takdirde tıbbi tedavi almaları gerektiği konusunda bilgilendirilmelidir. Eşlik eden şartlar: FARHEM kullanan hastalarda aşağıdaki durumların varlığında, özellikle doz sınırları konusunda olmak üzere, özel dikkat ve denetleme gereklidir: İskemik kalp hastalığı, kardiyak aritmiler (özellikle üçüncü derece atriyoventriküler blok), şiddetli kardiyak dekompansasyon, idiyopatik subvalvüler aortik stenoz, şiddetli hipertansiyon, anevrizma, feokromositoma, hipertrofik obstrüktif kardiyomiyopati, tirotoksikoz, QT aralığında bilinen veya şüphe edilen uzama (QTc >0.44 saniye; bkz. Bölüm 4.5). Daha önceden kardiyak problemleri bulunan ve teofilin ile formoterolü bir arada kullanan hastalarda dikkatli olunmalıdır. FARHEM dahil beta2 uyarıcıların hiperglisemik etkileri nedeniyle, diyabetik hastalarda FARHEM tedavisi başlatıldığında kan glukoz değerlerinin izlenmesi tavsiye edilir. Hipokalemi: FARHEM dahil beta2-agonist tedavisi sonucunda ciddi hipokalemi görülebilir. Hipokalemi, kardiyak aritmilere duyarlılığı arttırabilir. Hipoksi ve birlikte uygulanan tedavi hipokalemiyi şiddetlendirebileceğinden, şiddetli astımlı hastalarda özel bir dikkat önerilir (bkz. Bölüm 4.5). Böyle durumlarda serum potasyum düzeylerinin izlenmesi tavsiye edilir. Paradoksal bronkospazm: Diğer inhalasyon tedavilerinde olduğu gibi paradoksal bronkospazm ihtimali akılda tutulmalıdır. Böyle bir durum görüldüğünde, FARHEM tedavisi derhal kesilmeli ve alternatif tedavi başlatılmalıdır. Formoterol gibi uzun etkili beta2-agonistler kullanılırken, özellikle astım ile ilgili advers olaylar bakımından, bu ilaç başlandıktan sonra ilk üç ay hastalar yakından takip edilmelidir. Bu tıbbi ürün az miktarda -her dozda 100 mg'dan daha az- alkol içerir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer beta2-agonistler gibi FARHEM de; kinidin, disopiramid, prokainamid, fenotiyazinler, antihistaminikler, makrolidler, monoamin oksidaz inhibitörleri ve trisiklik antidepresanlar gibi ilaçlarla veya QTc aralığını uzattığı bilinen herhangi bir ilaçla birlikte dikkatli kullanılmalıdır. Çünkü bu ilaçlar, adrenerjik agonistlerin kardiyovasküler sistem üzerindeki etkilerini güçlendirebilir. QTc-aralığını uzattığı bilinen ilaçlara ventriküler aritmi eşlik etme riski artar (bkz. Bölüm 4.4).Diğer sempatomimetik maddelerin birlikte verilmesi, FARHEM'in istenmeyen etkilerini güçlendirebilir. Atomoksetin formoterolden kaynaklanan taşikardiyi arttırabilir. Ksantin türevleri, steroidler veya diüretikler ile birlikte tedavi beta2-agonistlerin muhtemel hipokalemik etkisini kuvvetlendirebilir (bkz. Bölüm 4.4). Halojenli hidrokarbonlarla eşzamanlı anestezi alan hastalarda aritmi riski artmaktadır. Beta-adrenerjik blokörler FARHEM'in etkisini zayıflatabilirler veya antagonize edebilirler. Bu yüzden FARHEM, zorunlu olmadıkça, beta-adrenerjik blokörler (göz damlaları dahil) ile birlikte verilmemelidir. Formoterol, beta-blokörlerin (betaı-selektif) bradikardik etkisini azaltabilir. Antikolinerjik ilaçlar formoterolün bronkodilatör etkisini arttırabilir. Özel popülasyonlara ilişkin ek bilgiler:Özel popülasyonlara ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: C.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar için FARHEM tedavisi sırasında özel bir gereklilik bulunmamaktadır. Eğer gebelik tespit edilirse, devam eden FARHEM tedavisinin alternatif tedavilere karşı yarar/risk oranı değerlendirilmelidir.Gebelik dönemiFARHEM, gerekli olmadıkça gebelik döneminde kullanılmamalıdır.FARHEM'in gebelik döneminde emniyeti henüz tespit edilmemiştir. Daha güvenli bir alternatif olduğu takdirde gebelik dönemi (özellikle hamileliğin sonunda ve doğum esnasında) süresince kullanımından kaçınılmalıdır. Diğer beta2-adrenerjik uyarıcılar gibi formoterol de uterus düz kası üzerine gevşetici etkisi nedeniyle, doğum sürecini baskılayabilir. Hayvan deneylerinde teratojenik etki görülmemiştir. Oral verildikten sonra formoterol emziren sıçanların sütünde tespit edilmiştir. Hamilelikte sadece anneye sağlayacağı yarar, fetusa olabilecek riskten daha fazlaysa kullanılmalıdır. Laktasyon dönemiFARHEM'in emzirme döneminde emniyeti henüz tespit edilmemiştir. Ancak, FARHEM kullanan anneler emzirmemelidir. Formoterolün insan sütüne geçip geçmediği bilinmemektedir. Etkin madde emziren sıçanların sütünde tespit edilmiştir.Üreme yeteneği/FertiliteBölüm 5.3'e bakınız.4.7. Araç ve makine kullanımı üzerindeki etkilerBaş dönmesi veya buna benzer yan etkiler gelişen hastalara, araç veya makine kullanmamaları önerilmelidir.4.8. İstenmeyen etkilerCiddi astım atakları:Formoterol ile uygulanan en az 4 haftalık plasebo-kontrollü klinik çalışmalar, formoterol alan hastalarda ciddi astım ataklarının sıklığının (günde iki kez 10-12 mikrogram için %0.9, günde iki kez 24 mikrogram için %1.9) plasebo alanlardakine (%0.3) göre daha yüksek olduğunu düşündürmüştür (özellikle 5-12 yaş arası hastalarda). Astımlı adolesan ve yetişkin hastalardaki deneyimler: ABD'de ruhsatlandırma için yapılan ve 12 yaş ve üstü toplam 1095 hastanın katıldığı 12 haftalık iki önemli kontrollü çalışmada, ciddi astım ataklarının (astımın hastanın hastaneye yatırılmasını gerektiren akut kötüleşmesi) günde iki kez verilen formoterol 24 mikrogram uygulamasında (9/271, %3.3) günde iki kez verilen formoterol 12 mikrogram uygulamasına (1/275, %0.4), plaseboya (2/277, %0.7) ya da albuterole (2/272, %0.7) göre daha sık ortaya çıktığı gözlenmiştir. Bu gözlemi araştırmak amacıyla daha sonra yapılan ve 2085 hastanın katıldığı bir klinik çalışmada, yüksek ve düşük doz gruplarında astımla ilgili ciddi advers olaylar karşılaştırılmıştır. 16 hafta süren bu klinik çalışmada elde edilen sonuçlar, formoterol dozuyla açık bir ilişki göstermemiştir. Bu çalışmada, ciddi astım ataklarının görüldüğü hastaların yüzde oranının formoterolde plaseboya göre biraz yüksek olduğu görülmüştür (üç çift-kör tedavi grubu için: formoterol 24 mikrogram günde iki kez (2/527, %0.4), formoterol 12 mikrogram günde iki kez (3/527, %0.6) ve plasebo (1/514, %0.2) ve açık-etiketli tedavi grubu için: formoterol 12 mikrogram günde iki keze ilave olarak ayrıca günde en fazla iki ek doz (1/517, %0.2). 5 yaş ve üzerindeki astımlı çocuklardaki deneyimler: Günde iki kez verilen formoterol 12 mikrogram dozun günde iki kez verilen formoterol 24 mikrogram doza ve plaseboya göre güvenliliği; günlük bronkodilatör ve antienflamatuvar tedaviye ihtiyaç duyan astım hastası 518 çocuğun (5-12 yaş arasındaki) katıldığı 52 haftalık, çok merkezli, randomize, çift-kör büyük bir çalışmada araştırılmıştır. Günde iki kez formoterol 24 mikrogram (11/171, %6.4) ya da günde iki kez formoterol 12 mikrogram alan (8/171, %4.7) çocuklarda görülen ciddi astım ataklarının plasebo alan çocuklardakine (0/176, %0.0) göre daha fazla olduğu görülmüştür. Diğer istenmeyen etkiler: Advers ilaç reaksiyonları, en sık görülen advers reaksiyon ilk sırada olacak şekilde sıklıklarına göre aşağıda sıralanmıştır. Her sıklık grubunda advers reaksiyonlar azalan ciddiyet derecesine göre sıralanmıştır. Advers ilaç reaksiyonları MedDRA'daki sistem organ sınıflarına göre listelenmektedir. Her bir sistem organ sınıfı içinde advers ilaç reaksiyonları azalan ciddiyet sırasına göre sunulmaktadır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıSeyrek: Aşırı duyarlılık (hipotansiyon, anjiyonörotik ödem)Çok seyrek: Aşırı duyarlılık (ürtiker, kaşıntı, egzantem, bronkospazm) Psikiyatrik hastalıklarYaygın olmayan: Ajitasyon, anksiyete, asabiyet, uykusuzlukSinir sistemi hastalıklarıYaygın: Baş ağrısı, titremeYaygın olmayan: Baş dönmesi Çok seyrek: Tat alma duyusu bozuklukları Kardiyak hastalıklarYaygın: Palpitasyonlar Yaygın olmayan: TaşikardiSeyrek: Atriyal fibrilasyon, supraventriküler taşikardi, ekstrasistollerin dahil olduğu kardiyak aritmiler, anjina pektoris, QT aralığında uzama Çok seyrek: Periferik ödem Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Paradoksal bronkospazm dahil bronkospazm, boğaz irritasyonu, akut astım alevlenmesiGastrointestinal hastalıklarSeyrek: BulantıKas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın olmayan: Kas krampları, miyaljiMetabolizma ve beslenme hastalıklarıSeyrek: Hipokalemi Çok seyrek: HiperglisemiVasküler hastalıklarÇok seyrek: Kan basıncında değişikliklerPazarlama sonrası spontan bildirimlerden elde edilen istenmeyen etkilerFormoterol ile tedavi edilen hastalarda aşağıdaki pazarlama sonrası advers ilaç reaksiyonları bildirilmiştir. Bu reaksiyonlar büyüklüğü kesin olmayan bir popülasyondan isteğe bağlı olarak bildirilmiş olduğundan, güvenilir bir şekilde sıklığı belirlemek mümkün değildir; dolayısıyla bilinmiyor olarak kategorize edilmiştir.Solunum, göğüs bozuklukları ve mediastinal hastalıklarBilinmiyor: ÖksürükDeri ve deri altı doku hastalıklarıBilinmiyor: Deri döküntüsüAraştırmalarBilinmiyor: Kan basıncında artış (hipertansiyon dahil)4.9. Doz aşımı ve tedavisiBelirtiler:FARHEM'in aşırı dozuna bağlı olarak beta2-adrenerjik uyarıcıların tipik etkilerinin görülmesi beklenir: bulantı, kusma, baş ağrısı, tremor, sedasyon, palpitasyonlar, taşikardi, ventriküler aritmiler, metabolik asidoz, hipokalemi, hiperglisemi, hipertansiyon. Tedavi: Destekleyici ve semptomatik tedavi uygulanır. Ciddi vakalarda hastalar hastaneye yatırılmalıdır. Kardiyoselektif beta-blokörlerin kullanılması düşünülebilir, fakat beta-adrenerjik blokör kullanımı bronkospazma neden olabileceğinden bu tedavi yalnızca doktor gözetimi altında ve çok dikkatli uygulanmalıdır. Serum potasyum düzeyi izlenmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Selektif beta2-adrenoreseptör agonisti)ATC kodu: R03AC13 Formoterol güçlü, seçici bir beta2-adrenerjik uyarıcıdır. Geri dönüşlü soluk yolu tıkanmaları olan hastalarda bronkodilatör bir etki gösterir. Etkisi çabuk (1-3 dakika içinde) başlar ve inhalasyondan 12 saat sonra hala belirgindir. Terapötik dozlarda kardiyovasküler etkileri önemsizdir ve ara sıra görülür. Formoterol, pasif olarak duyarlı hale getirilen insan akciğerlerinden lökotrienlerin ve histaminin salıverilmesini inhibe eder. Hayvanlarda yapılan deneylerde; ödemin ve iltihap hücrelerinin toplanmasının inhibisyonu gibi bazı antienflamatuvar özellikler gözlenmiştir. Kobay trakeasındaki invitro çalışmalar; rasemik formoterolün ve bunun (R,R)- ve (S,S)-enantiomerlerinin, ileri derecede selektif beta2-adrenoseptör agonistleri olduklarını göstermiştir. (R,R)-enantiomerden 800-1000 kat daha az potent olan (S,S)-enantiomeri, (R-R)-enantiomerin trakea düz kası üzerindeki aktivitesini etkilemez. Enantiomerlerden herhangi birinin rasemik karışıma tercih edilmesini gerektirecek herhangi bir farmakolojik neden yoktur.İnsanda inhale edilen alerjenlerin, egzersizin, soğuk hava, histamin veya metakolinin neden olduğu bronkospazmı önlemede formoterolün etkili olduğu gösterilmiştir. Kuru toz inhaler ile günde iki defa 12 mikrogram ve günde iki defa 24 mikrogram dozlarda inhale edilen formoterolün, stabil kronik obstrüktif akciğer hastalığı (KOAH) olan hastalarda hızlı etki ile bronkodilatasyon sağladığı, etkisinin en az 12 saat sürdüğü ve Saint George Solunum Yolları Anketi sonucuna göre yaşam kalitesi açısından kişisel faydayı beraberinde getirdiği gösterilmiştir. 5.2. Farmakokinetik özellikler Genel özelliklerFARHEM'in terapötik doz aralığı günde iki kez 12-24 mikrogramdır. Formoterolün plazma farmakokinetiği verileri sağlıklı gönüllülerde önerilen doz aralığından daha yüksek dozlar ve KOAH hastalarında terapötik dozların inhale edilmesi ile derlenmiştir. İdrarda saptanan ve sistemik maruziyetin dolaylı bir göstergesi olarak kullanılan değişime uğramamış formoterol düzeyleriyle, plazmadaki ilaç farmakokinetiği verileri arasında korelasyon vardır. İdrar ve plazma için hesaplanan eliminasyon yarı ömürleri birbirine yakındır.Emilim:Astım hastalarında basınçlı inhalasyon solüsyonu şeklinde 12 mcg formoterol dozu uygulamasını takiben emilim hem hızlı hem de yaygın olmuştur ve pik plazma konsantrasyonuna yaklaşık 15 dakika sonra ulaşılmıştır. Bu süre kuru toz inhaleri ile formoterol uygulamasında gözlenen süreden daha kısadır. Bir formoterol formülasyonundan diğerine geçiş yapılırken, emilim hızı göz önünde bulundurulmalıdır. 12 hafta boyunca günde iki defa 12 veya 24 mikrogram formoterol fumarat ile tedavi edilen KOAH hastalarında inhalasyondan 10 dakika, 2 saat ve 6 saat sonraki ortalama plazma formoterol konsantrasyonları; sırasıyla 11.5-25.7 ve 23.3-50.3 pmol/l arasında değişmiştir. Formoterolün ve/veya (R,R) ve (S,S) enantiomerlerinin kümülatif üriner itrahını araştıran çalışmalar, dolaşımdaki formoterol miktarının inhale edilen doz ile orantılı olarak arttığını göstermiştir (12- 96 mikrogram). 12 hafta süreyle günde 2 defa 12 mikrogram veya 24 mikrogram inhalasyonundan sonra idrarla atılan, değişikliğe uğramamış formoterol düzeyleri, astım hastalarında %63 ve %73 (ilk dozla son doz karşılaştırıldığında), KOAH hastalarında %19 ve %38 arasında değişen oranlarda yükselmiştir. Bu veriler, tekrarlanan dozlarda kullanılan formoterolün plazmada sınırlı olarak biriktiği izlenimini vermektedir. Tekrarlayan dozlardan sonra enantiomerlerden birinin, diğerinden daha fazla biriktiğine tanık olunmamıştır. İnhale edilen diğer ilaçlar için bildirildiği üzere inhaler aracılığıyla kullanılan formoterol dozunun çok büyük bölümü yutulmakta ve daha sonra gastrointestinal kanaldan emilmektedir. 3H ile işaretlenmiş 80 mikrogram formoterolün, iki gönüllüye oral olarak verilmesinin ardından dozun en az %65'i emilmiştir. Dağılım:Formoterolün plazma proteinlerine bağlanma oranı %61-64'tür Bunun önemli bir kısmı (%34) insan serum albüminine bağlanır. Terapötik dozlar ile erişilen konsantrasyon aralığında bağlanma yerlerinde doyma olmaz. Biyotransformasyon:Formoterol başlıca metabolizma ile elimine edilir; doğrudan glukuronidasyon biyotransformasyonun ana yoludur. Glukuronidasyonun izlediği O-demetilasyon, diğer bir biyotransformasyon yoludur. Formoterolün sülfat konjügasyonu ve ardından yine sülfat konjügasyonun gerçekleştiği deformilasyon, minör metabolik yollardır. Formoterolün glukuronidasyonunda (UGT1A1, 1A3, 1A6, 1A7, 1A8, 1A9, 1A10, 2B7 ve 2B15) ve O-demetilasyonunda (CYP2D6, 2C19, 2C9 ve 2A6) çok sayıda izoenzimin katalizör rolünü oynuyor olması; formoterol metabolizmasındaki spesifik bir izoenzimin inhibisyonu üzerinden ilaç-ilaç etkileşim potansiyelinin düşük olduğu izlenimini vermektedir. Terapötik dozlarla elde edilen konsantrasyonlardaki formoterol, sitokrom P450 izoenzimlerini inhibe etmemiştir veya indüklememiştir. Eliminasyon:12 hafta boyunca günde 2 defa 12 veya 24 mikrogram formoterol fumaratla tedavi edilen astım ve KOAH hastalarında, verilen dozun sırasıyla yaklaşık %10'u ve %7'si değişikliğe uğramamış olarak idrarda saptanmıştır. İdrardaki, değişikliğe uğramamış formoterolün; 12-120 mikrogram arasında değişen tek dozların verildiği sağlıklı gönüllülerdeki ve tek ve tekrarlanan dozlar kullanan astım hastalarındaki %40'ının (R-R), %60'ının (S,S)-enantiomeri olduğu görülmüştür. İlaç ve metabolitleri vücuttan tamamen atılırlar; bir oral dozun yaklaşık 2/3'si idrarla ve 1/3'i feçesle atılır. Kandaki formoterolün renal klerensi 150 ml/dakika'dır. Sağlıklı gönüllülerde 120 mikrogram tek doz formoterol fumarat inhalasyonundan sonra, idrarla atılma oranlarından hesaplanan, plazmadaki eliminasyon yarı-ömrü, formoterolde 10 saat; (R,R) ve (S,S)- enantiomerlerinde ise sırasıyla 13.9 ve 12.3 saat ölçülmüştür. Doğrusallık/Doğrusal olmayan durum:Farmakokinetik 20-300 mikrogram doz aralığında (oral uygulama) doğrusallık göstermektedir. Hastalardaki karakteristik özelliklerKaraciğer/Böbrek yetmezliği:Formoterolün karaciğer veya böbrek yetmezliği bulunan hastalardaki farmakokinetiği incelenmemiştir. Pediyatrik popülasyon:5-12 yaş grubundaki astımlı çocuklara 12 hafta boyunca inhalasyon yoluyla günde iki defa 12 veya 24 mikrogram formoterol fumarat verilerek yapılan bir çalışmada; değişime uğramaksızın idrarla atılan formoterol miktarı, ilk dozdan sonrakine kıyasla %18 ile %84 arasında değişen oranda artmıştır. Çocuklardaki birikim, erişkin hastalardakinden farklı olmamış ve %63 ile %73 arasında değişen bir oranda artmıştır (bkz. Emilim). İncelenen çocuklarda verilen formoterol dozunun yaklaşık %6'sı, değişmemiş formoterol olarak idrarda bulunmuştur. Geriyatrik popülasyon:Formoterolün yaşlı hastalardaki farmakokinetiği incelenmemiştir. Cinsiyet:Formoterol farmakokinetiği, hastaların kilosuna göre düzeltildikten sonra, erkeklerle kadınlar arasında, istatistiksel anlama sahip fark göstermemiştir. 5.3. Klinik öncesi güvenlilik verileriMutajenisite:Deneysel bitiş noktaları geniş bir alanı kapsayan mutajenik etki testleri yapılmış; hiç bir in vitroin vivotestte genotoksik etki bulunmamıştır.Karsinojenisite: Sıçanlarda ve farelerde yapılan iki yıllık çalışmalarda, herhangi bir karsinojenik potansiyel görülmemiştir. Çok yüksek dozlarla muamele edilmiş erkek farelerde selim adrenal subkapsüler hücre tümörleri görülme sıklığı hafifçe yüksek bulunmuştur. Ancak bu bulgu, yüksek dozlarda dişi genital organındaki selim düz kas tümörlerinin ve her iki cinsiyette görülen karaciğer tümörlerinin görülme sıklığında artış şeklinde patolojik değişikliklerin olduğu ikinci bir fare çalışmasında görülmemiştir. Çeşitli doz aralıklarında sıçanlarda yapılan iki çalışmada, mezovariyal leyomiyomlarda artış görülmüştür. Bu selim neoplazmalar sıçanların beta2-adrenerjik ilaçların yüksek dozları ile uzun süreli tedavisinde genellikle görülürler. Over kistleri ve selim granulosa/tekal hücreli tümörlerde de artış görülmüştür; beta-agonistlerin sıçanlarda overlere, çok muhtemelen kemiricilere has olan, etkileri olduğu bilinmektedir. Daha yüksek dozların kullanıldığı birinci çalışmada bildirilen diğer birkaç tip tümör, kontrol grubundakilere benzer sıklıkta görülmüş ve daha düşük doz kullanılan çalışmalarda görülmemiştir. Tümör sıklıklarının hiçbiri ikinci çalışmada kullanılan en düşük doz (insanlarda formoterolün tavsiye edilen maksimum dozundan beklenenden 10 kat daha yüksek sistemik düzeye yol açan bir doz) da istatistiksel olarak anlamlı bir dereceye yükselmemiştir. Bu bulgulara ve mutajenik potansiyelinin olmamasına dayanarak, formoterolün terapötik dozlarda kullanımının karsinojenik bir riski olmadığı hükmüne varılmıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiDehidrat alkol Oleik asit HFA 134a6.2. GeçimsizliklerBilinen geçimsizliği yoktur.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirlerİlacı, ilk açılmasından önce 2-8°C arasında buzdolabında, açıldıktan sonra 25°C'nin altındaki oda sıcaklığında saklayınız. Direkt gün ışığından ve donmaktan koruyunuz. Aerosol kutusu delinmemeli, boş olsa bile kırılmamalı, ateşten uzak tutulmalıdır.6.5. Ambalajın niteliği ve içeriğiFARHEM 12 mcg inhalasy on için ölçülü dozlu aerosol, 120 dozluk aerosol tüplerde, karton kutuda kullanma talimatı ile beraber sunulmaktadır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİNeutec İnhaler İlaç San. ve Tic. A.Ş.Sakarya 1. Organize Sanayi Bölgesi 2. Yol No:3 Arifiye / Sakarya Telefon numarası: 0 850 201 23 23 Faks numarası: 0 212 482 24 78 e-mail: [email protected] 8. RUHSAT NUMARASI(LARI)255/869. İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 31.12.2013 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriFarhem 12 Mcg İnhalasyon İçin Ölçülü Dozlu AerosolEtken Maddesi: Formoterol Fumarat Dihidrat Atc Kodu: R03AC13 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.