Atrivo Steri-neb 250 Mcg/1 Ml Nebülizasyon İçin I... Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Diğer İnhalanlar (solukla içeri çekilen ilaçlar) » Antikolinerjik İlaçlar » İpratropium Bromür KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIATRİVO STERİ-NEB® 250 mcg/1 ml Nebülizasyon İçin İnhalasyon Çözeltisi İçeren Tek Dozluk Ampul2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her tek dozluk 1 ml inhalasyon solüsyonu ampulü;250 mikrogram ipratropium bromür anhidr'e eşdeğer, 261 mikrogram (8r)-3a-hidroksi-8-isopropil-1aH, 5aH-tropanyum bromür (±)-tropat monohidrat (=ipratropium bromür monohidrat) içerir. Yardımcı maddeler:Sodyum klorür 8.5 mgYardımcı maddelerin tam bir listesi için, Bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMSteril nebülizasyon için inhalasyon çözeltisi içeren tek dozluk ampul.4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarKronik Obstrüktif Akciğer Hastalığı (KOAH), astım gibi tıkayıcı havayolu hastalıklarında akut bronkospazmın tedavisinde kullanılır.4.2. Pozoloji ve uygulama şekli Pozoloji, uygulama sıklığı ve süresi:Dozaj, hastanın bireysel ihtiyaçlarına göre ayarlanmalıdır ve hastaların tedavi sırasında tıbbi gözetim altında tutulması gerekir. Tedavisi sırasında, önerilen günlük dozların aşılmaması tavsiye edilmektedir.Eğer tedavi belirgin bir düzelme sağlamıyorsa veya hastanın durumu kötüleşiyorsa, yeni bir tedavi planının saptanması için doktora danışılmalıdır. Akut veya hızla kötüleşen dispne (nefes alıp vermede güçlük) durumunda, derhal bir doktora başvurulmalıdır. Doktor tarafından başka türlü reçete edilmediği takdirde, aşağıdaki dozlar önerilmektedir: 6-12 yaş arası çocuklar:250 mcg (1 ml 250 mcg tek dozluk ampul); bu doz hasta stabilize oluncaya kadar günlük maksimum 1 mg'a kadar (4 ampul) tekrarlanabilir. Dozlar arasındaki süre, doktor tarafından belirlenebilir. ATRİVO STERİ-NEB®, bir inhale beta-agonist ile kombine halde uygulanabilir. 12 yaşından küçük çocuklarda 1 mg'ı geçen günlük dozlar, tıbbi gözetim altında verilmelidir. 6 yaşın altındaki çocuklar:Bu yaş grubuna ilişkin bilgiler kısıtlı olduğu için, asağıda tavsiye edilen dozlar tıbbi gözetim altında verilmelidir: 125 mcg - 250 mcg (1 ml 250 mcg tek dozluk ampulün yarısı veya tamamı); bu doz hasta stabilize oluncaya kadar günlük maksimum 1 mg'a kadar (4 ampul) tekrarlanabilir. Dozlar arasındaki süre, doktor tarafından belirlenebilir. ATRİVO STERİ-NEB®, bir inhale beta-agonist ile kombine halde uygulanabilir. Erişkinler (yaşlılar dahil) ve 12 yaşından büyük ergenlerde:Akut nöbetlerde 500 mcg (2 tek dozluk ampul), hasta stabilize oluncaya kadar maksimum günlük doz 2 mg'a kadar tekrarlanabilir. Dozlar arasındaki süre, doktor tarafından belirlenebilir. ATRİVO STERİ-NEB®, bir inhale beta-agonist ile kombine halde uygulanabilir. Erişkinlerde ve 12 yaşından büyük çocuklarda 2 mg'ı geçen günlük dozlar, tıbbi gözetim altında verilmelidir. Uygulama şekli:Doğru bir uygulama için, lütfen kullanma talimatını dikkatle okuyunuz.Tek dozluk ampuller içinde bulunan solüsyon yalnızca, uygun nebülizatör cihazları ile inhalasyon seklinde kullanılmak içindir ve oral yoldan alınmamalı, ya da parenteral yoldan uygulanmamalıdır. 1 ml'lik tek dozluk ampuller serum fizyolojik ile 4 ml'lik son hacme kadar seyreltilebilir. ATRİVO STERİ-NEB®, piyasada bulunan çeşitli nebülizatör cihazları ile uygulanabilir. Başucu duvarında oksijen sisteminin mevcut olduğu durumlarda, solüsyonun en iyi uygulanma şekli, dakikada 6-8 litrelik bir akış hızı ile verilmesidir. ATRİVO STERİ-NEB® ile koruyucu madde olarak benzalkonyum klorür içeren disodyum kromoglikat inhalasyon çözeltileri aynı nebülizatör içinde birlikte uygulanmamalıdır.® ATRİVO STERİ-NEB , gerekli olduğu durumda kısa etkili beta2-agonist ile aynı nebülizatör içinde birlikte uygulanabilir. Çözelti karıştırıldıktan hemen sonra kullanılmalı ve kullanılmayan çözelti atılmalıdır. 1. Nebülizatörü, imalatçısının ya da hekimin talimatları doğrultusunda kullanıma hazırlayınız._2. Tek dozluk bir ampulü şeritten koparınız. 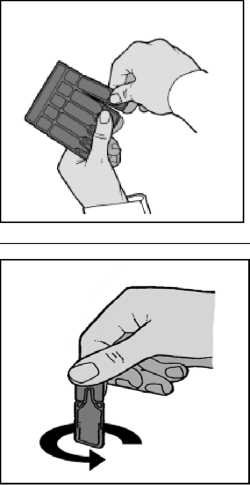
Şekil-1 3. Tek dozluk ampulü uç kısmını sertçe bükerek açınız.
Şekil-2 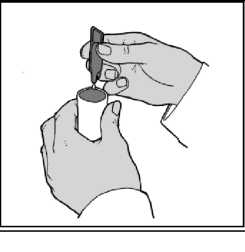 Şekil-3
Şekil-34. Tek dozluk ampulün içeriğini, nebülizatörün rezervuarına (depo kısmına) sıkarak boşaltınız. 5. Nebülizatörün parçalarını birleştirip, önerildiği şekilde inhale ediniz._6. Kullandıktan sonra, rezervuarda kalmış olabilecek solüsyonu atınız ve nebülizatörü, imalatçısının talimatları doğrultusunda temizleyiniz._Tek dozluk ampuller koruyucu madde içermediğinden, mikroplarla bulaşmayı önlemek amacıyla, ampulün açıldıktan hemen sonra kullanılması ve her uygulamada yeni bir ampulün açılması önem taşımaktadır. Kısmen kullanılmış, açılmış veya hasar görmüş tek dozluk ampuller atılmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek / Karaciğer yetmezliği:Ek bilgi bulunmamaktadır.Pediyatrik popülasyon:12 yaşın üzerindeki çocuklarda 2 mg günlük dozun, 12 yaşın altındaki çocuklarda 1 mg günlük dozun üzerindeki dozlar, tıbbi gözetim altında uygulanmalıdır.Geriyatrik popülasyon:Ek bilgi bulunmamaktadır.4.3. KontrendikasyonlarATRİVO STERİ-NEB® atropin veya türevlerine veya ilacın bileşenlerinden herhangi birine karşı aşırı duyarlı olduğu bilinen hastalarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriNebülizatör ile ilk dozun kullanılması tıbbi gözlem altında yapılmalıdır.ATRİVO STERİ-NEB® uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir; bu şekilde nadiren deri döküntüleri, ürtiker, anjiyoödem, orofarenjiyal ödem, bronkospazm ve anafilaksi vakaları görülmüştür. Bu gibi durumlarda uygun anti-alerjik ajanlar kullanılmalı ve gerekirse genel destekleyici tedavi uygulanmalıdır. ATRİVO STERİ-NEB® dar-açılı glokoma karşı predispoze olan ya da önceden üriner kanal çıkış obstrüksiyonu (örn. prostat hiperplazisi veya mesane boynu obstrüksiyonu) bulunan hastalarda dikkatle kullanılmalıdır. Prostat hipertrofili hastalarda yüksek doz sıkıntı yaratabileceğinden yaşlı ve prostat şikayetleri mevcut hastalarda serum fizyolojik ile sulandırılmalıdır. Kistik fibrozlu hastalar, gastrointestinal motilite bozuklukları gelişmesine daha meyilli olabilirler. Oküler komplikasyonlarAerosol şeklindeki ipratropium bromürün tek başına veya bir adrenerjik beta2-agonist ile birlikte kullanıldığında göze temas etmesi sonucunda oküler komplikasyonlar (midriyazis, göz içi basıncında yükselme, dar-açılı glokom, göz ağrısı) geliştiği bildirilen izole vakalar vardır. Konjonktivada konjesyon ve korneada ödem sonucu gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabilir. Bu semptomlar herhangi bir kombinasyon şeklinde görülürse, miyotik damlalar ile tedaviye başlanmalı ve hemen bir uzman hekimin görüşü alınmalıdır. Hastalara ATRİVO STERİ-NEB®'in doğru bir şekilde nasıl kullanılacağı öğretilmelidir. Çözeltinin veya buğusunun göze temas etmemesi için dikkatli olunması gereklidir. İnhalasyon çözeltisinin bir ağızlık parçası aracılığıyla kullanılması önerilir. Eğer ağızlık parçası yoksa ve bir nebülizatör maskesi kullanılacaksa, bu maskenin hastanın yüzüne tam olarak oturması gereklidir. Glokoma karşı predispoze olabilecek hastalar, gözlerini korumaları konusunda özellikle uyarılmalıdırlar. Diğer inhalasyon tedavilerinde olduğu gibi dozun uygulanmasından sonra hırıltılı solunumda ani artma ile birlikte inhalasyona bağlı bronkokonstriksiyon meydana gelebilir. Bu durumda uygulamaya derhal son verilmelidir. Bu tıbbi ürün 1 ml'de 8.5 mg sodyum klorür içermektedir. Bu dozda sodyum bağlı herhangi bir yan etki beklenmemektedir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBeta-adrenerjikler ve ksantin preparatları, bronkodilatör etkiyi arttırabilir.Dar-açılı glokom öyküsü olan hastalarda akut glokom riski (Bkz. Bölüm 4.4. Özel kullanım uyarıları ve önlemleri), nebülize ipratropium bromür ve beta mimetikler aynı anda kullanıldıklarında artabilir. Özel popülasyonlara ilişkin ek bilgiler:Özel veri bulunmamaktadır.Pediyatrik popülasyon:Özel veri bulunmamaktadır.4.6. Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi B'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (kontrasepsiyon):Çocuk doğurma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduğu kabul edilen doğum kontrol yöntemleri kullanmalıdır.Gebelik dönemi:ATRİVO STERİ-NEB®'in insanlarda, gebelik sırasındaki güvenliliği halen gösterilmemiştir. Doğrulanmış bir gebelik süresince, ya da bir gebelik kuşkusunda ATRİVO STERİ-NEB® kullanımının yararları, doğmamış bebek üzerindeki olası tehlikelerine karşı tartışılmalıdır. Özellikle gebeliğin ilk üç ayında, beklenen yararı fetusa muhtemel riskinden yüksek değilse kullanılmamalıdır. Preklinik çalışmalarda, insanlarda önerilen dozlardan belirgin ölçüde yüksek dozların inhalasyon yoluyla ya da intranazal olarak uygulanmasından sonra hiçbir embriyotoksik veya teratojenik etki görülmemiştir.Gebe kadınlara verilirken tedbirli olunmalıdır. Laktasyon dönemi:ATRİVO STERİ-NEB®'in süte geçip geçmediği bilinmemektedir. Yağda çözünmeyen katerner katyonlar anne sütüne geçmekle birlikte, ipratropium bromürün inhalasyon yoluyla uygulandığında, bebekte önemli düzeylere ulaşabilme olasılığı çok uzaktır. Ancak birçok ilaç anne sütüne geçtiğinden, bebeğini emziren bir anneye ATRİVO STERİ-NEB® verilirken dikkatli olunması gereklidir.Üreme yeteneği / Fertilite:İpratropium bromür ile yürütülen klinik öncesi çalışmalarda fertilite üzerinde advers etki görülmemiştir (Bkz. Bölüm 5.3. Klinik öncesi güvenlilik verileri). İpratropium bromür için fertilite konusunda klinik veri bulunmamaktadır.4.7. Araç ve makine kullanımı üzerindeki etkilerAraba ve makine kullanma becerileri üzerindeki etkileri konusunda çalışma yapılmamıştır.Ancak hastalar, ATRİVO STERİ-NEB® tedavisi sırasında baş dönmesi, akomodasyon bozukluğu, midriyazis ve bulanık görme gibi istenmeyen etkiler geçirebilecekleri konusunda uyarılmalıdır. Bu nedenle, araba kullanırken ya da makine işletirken dikkatli olmaları tavsiye edilmelidir. Eğer hastalarda yukarıda sözü edilen yan etkiler ortaya çıkarsa, araba kullanma ya da makine işletme gibi tehlike potansiyeli taşı yan işlerden uzak durmalıdırlar. 4.8. İstenmeyen etkilerListelenen istenmeyen etkilerin birçoğu ATRİVO STERİ-NEB®'in antikolinerjik özelliklerine bağlanabilir. İnhalasyon yoluyla uygulanan bütün ilaçlar gibi, ATRİVO STERİ-NEB® lokal irritasyon semptomlarına yol açabilir. Advers ilaç reaksiyonları, klinik araştırmalarda ve ilacın onay sonrası kullanım dönemindeki farmakovijilans çalışmalarında elde edilen verilerden tanımlanmıştır.Klinik araştırmalarda en sık bildirilen yan etkiler baş ağrısı, boğazda irritasyon, öksürük, ağız kuruluğu ve gastrointestinal motilite bozuklukları (konstipasyon, diyare ve kusma gibi), bulantı ve baş dönmesidir. Listelenen yan etkilerin sıklık oranları aşağıdaki gibidir: > 1/10 >1/100 ilâ <1/10 >1/1.000 ilâ <1/100 >1/10.000 ilâ <1/1.000
Çok yaygın Yaygın Yaygın olmayan Seyrek Çok seyrek < 1/10.000, Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) Bağışıklık sistemi hastalıklarıYaygın olmayan: Aşırı duyarlılık, anaflaktik reaksiyon, anjiyoödem (dilde, dudaklarda, yüzde)Sinir sistemi hastalıklarıYaygın: Baş ağrısı, baş dönmesiGöz hastalıklarıYaygın olmayan: Bulanık görme, midriyazis, göz içi basıncında artış, glokom, göz ağrısı, haleler görme, konjonktival hiperemi, korneada ödem Seyrek: Akomodasyon bozukluğuKardiyak hastalıklarYaygın olmayan: Palpitasyonlar, supraventriküler taşikardi Seyrek: Atriyal fibrilasyon, kalp hızında artışSolunum, göğüs bozuklukları ve mediyastinal hastalıklarYaygın: Boğazda irritasyon, öksürükYaygın olmayan: Bronkospazm, paradoksal bronkospazm, laringospazm, farenjiyal ödem, boğaz kuruluğu Gastrointestinal hastalıklarYaygın: Ağız kuruluğu, bulantı, gastrointestinal motilite bozukluğuYaygın olmayan: Diyare, konstipasyon, kusma, stomatit, ağızda ödem Deri ve derialtı dokusu hastalıklarıYaygın olmayan: Döküntü, pruritus Seyrek: ÜrtikerBöbrek ve idrar hastalıklarıYaygın olmayan: İdrar retansiyonu4.9. Doz aşımı ve tedavisiDoz aşımına özgü hiçbir semptom ile karşılaşılmamıştır. ATRİVO STERİ-NEB®'in geniş terapötik aralığı ve lokal olarak uygulandığı göz önüne alındığında, hiçbir ciddi antikolinerjik semptom beklenmez. Ağız kuruluğu, gözde akomodasyon bozuklukları ve kalp hızında artış şeklinde minör sistemik antikolinerjik aktivite belirtileri oluşabilir.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antikolinerjikler ATC kodu: R03BB01İpratropium bromür antikolinerjik (parasempatolitik) özellikleri olan, bir kuarterner amonyum bileşiğidir. Klinik öncesi çalışmalarda, vagus sinirinden salıverilen transmitter ajan olan asetilkolinin etkilerini antagonize ederek, bu sinir aracılığıyla gerçekleşen refleksleri inhibe eden bir bileşik olarak görünmüştür. Antikolinerjikler, asetilkolinin bronş düz kasları üzerindeki muskarinik reseptörlerle etkileşimi sonucu meydana gelen hücre içi Ca++ konsantrasyonu artışını önlerler. Ca++ salıverilmesine, IP3 (inozitol trifosfat) ve DAG (diaçilgliserol)'den oluşan ikinci haberci sistemi aracılık etmektedir. İpratropium bromür inhalasyonunu izleyen bronkodilatasyon, esas olarak lokal ve akciğerlerde bölgeye özgü bir etkidir ve sistemik yapıda değildir. Klinik öncesi ve klinik çalışmalarda elde edilen veriler Ipratropium bromürün, havayolları mukus sekresyonu, mukosiliyer klerens ya da gaz alış-verişi üzerinde hiçbir zararlı etkisi olmadığını göstermektedir. İpratropium bromürün astıma bağlı akut bronkospazm tedavisindeki bronkodilatör etkisi, erişkinler ve 6 yaşından büyük çocuklar üzerinde yürütülen çalışmalar ile gösterilmiştir. Ipratropium bromür bu çalışmaların çoğunluğunda, inhale bir beta-agonist ile kombine halde uygulanmıştır. Veriler kısıtlı olmakla birlikte, İpratropium bromürün bebeklerde ve çok küçük çocuklarda viral bronsiyolit ve bronkopulmoner displaziye bağlı bronkospazmın tedavisinde terapötik bir etkiye sahip olduğu gösterilmiştir. 5.2. Farmakokinetik özelliklerGenel özelliklerİpratropium bromürün terapötik etkisi, hava yolları içinde bir lokal aktivite sonucunda ortaya çıkmaktadır. Bronkodilatasyon ve sistemik farmakokinetik parametrelerin zaman içindeki seyirleri, birbirine paralel gitmezler.Emilim:İnhalasyonu izleyerek, formülasyona ve inhalasyon tekniğine bağlı olmak üzere, genellikle dozun %10 ile %30'u akciğerde tutulur. Dozun büyük bölümü yutulur ve gastrointestinal kanala geçer. Akciğerlerde tutulan doz bölümü, hızla dolaşıma geçer (dakikalar içinde). Oral ve inhale ipratropium bromür dozlarıyla total sistemik biyoyararlanımın, sırasıyla %2 ve %7 - %28 aralığında olduğu tahmin edilmektedir. Bu durum dikkate alındığında, ipratropium bromür dozunun yutulan bölümü sistemik temasa önemli bir katkıda bulunmamaktadır. Dağılım:İpratropiumun di spozisy onunu tanımlayan kinetik parametreler, i.v. uygulama sonrasındaki plazma konsantrasyonlarından hesaplanmıştır. Plazma konsantrasyonlarında hızlı bir bifazik azalma gözlenmiştir. Kararlı durumda görünür dağılım hacmi (Vdss) yaklaşık 176 L'dir (~ 2.4 L/kg). İlaç plazma proteinlerine minimal oranda bağlanır (%20'den düşük). Kuarterner amin olan ipratropium kan-beyin bariyerini geçmez. Biyotransformasyon:İpratropiumun total klirensi 2.3 L/dk ve renal klirensi 0.9 L/dk'dır. İntravenöz uygulamadan sonra dozun yaklaşık %60'ı metabolize olur; başlıca konjugasyon (%40) ile; inhalasyondan sonra sistemik dolaşıma geçen miktarın %77'si ise ester hidrolizi (%41) ve konjugasyon (%36) ile metabolize olur. İdrardaki temel metabolitlerin muskarinik reseptöre bağlanmaları çok azdır ve bu metabolitlerin etkili olmadıkları kabul edilmektedir. Eliminasyon:Terminal eliminasyon fazındaki yarı ömür yaklaşık 1.6 saattir. Ana bileşiğin kümülatif renal ekskresyonu (0-24 saat), intravenöz uygulanan dozun yaklaşık %46'sı, oral verilen dozun %1'inden azı, ve inhale edilen dozun yaklaşık %3 ile 13'ü olmuştur. İpratropium bromürün HFA 134a ya da CFC propellanı ile inhalasyonundan sonra 24 saatlik kümülatif renal ekskresyon, sırasıyla %12 ve %10 olmuştur. Bir ekskresyon balans çalışmasında, ilaca bağlı radyoaktivitenin (ana bileşikler ve bütün metabolitler dahil olmak üzere) kümülatif renal ekskresyonu (6 gün), intravenöz uygulamadan sonra %72.1, oral uygulamadan sonra %9.3 ve inhalasyondan sonra %3.2 olmuştur. Feçes ile atılan total radyoaktivite, intravenöz uygulamadan sonra %6.3, oral uygulamadan sonra %88.5 ve inhalasyondan sonra %69.4 olmuştur. İntravenöz uygulamadan sonra ilaca bağlı radyoaktivitenin ekskresyonuyla ilgili olarak, ekskresyon başlıca böbrek yoluyla olmaktadır. İlaca bağlı radyoaktivitenin (ana bileşik ve metabolitler) eliminasyon yarı-ömrü 3.2 saattir. Doğrusallık/Doğrusal olmayan durum:Geçerli değil. 5.3. Klinik öncesi güvenlilik verileriİpratropium bromürün lokal ve sistemik tolerabilitesi, çeşitli hayvan türlerinde değişik uygulama yolları kullanılarak, ayrıntılı bir şekilde araştırılmıştır.Akut inhalatif, oral ve intravenöz toksisite, çeşitli kemirgen ve kemirgen olmayan türlerde değerlendirilmiştir. İnhalasyon yoluyla uygulandığında erkek kobaylarda minimum letal doz 199 mg/kg idi. Sıçanlarda teknik olarak mümkün en yüksek dozlara kadar (örneğin 4 saatlik bir uygulamanın sonrasında 0.05 mg/kg, ya da ipratropium bromür 0.02 mg/puf ile 160 puf uygulaması) herhangi bir mortalite gözlenmemiştir. Fare, sıçan ve tavşan için oral LD50 değerleri, sırasıyla 1585, 1925 ve 1920 mg/kg olmuştur. Fare, sıçan ve köpek için intravenöz LD50 değerleri, sırasıyla 13.6, 15.8 ve yaklaşık 18.2 mg/kg olmuştur. Klinik bulgular arasında midriyazis, oral mukozada kuruluk, dispne, tremor, spazmlar ve/veya taşikardi bulunmaktaydı. Tekrarlı doz toksisite çalışmaları sıçan, tavşan, köpek ve Rhesus maymunlarında yürütülmüştür. Sıçanlarda, köpeklerde ve Rhesus maymunlarında 6 aya kadar süren inhalasyon çalışmalarında, maksimum yan etkisiz doz (MYED) sırasıyla 0.38 mg/kg/gün, 0.18 mg/kg/gün, ve 0.8 mg/kg/gün bulunmuştur. Köpeklerde oral mukoza kuruluğu ve taşikardi kaydedilmiştir. Bronkopulmoner sistem ya da herhangi başka bir organda, bileşikle bağıntılı histopatolojik lezyon gözlenmemiştir. Sıçanlarda 18 aylık oral uygulamadan sonra MYED 0.5 mg/kg/gün bulunmuştur. Diğer formülasyonlar (intranazal formülasyon, alternatif itici gaz HFA 134a ve laktoz toz formülasyonu) kullanılarak sıçanlarda 6 aya ve köpeklerde 3 aya kadar sürdürülen tekrarlı doz inhalasyon toksisitesi çalışmalarında, ipratropium bromürün genel toksisite profiline ilişkin herhangi ilave bir bilgi açığa çıkarılmamıştır. Köpeklerde 6 aya kadar sürdürülen intranazal uygulamada, >0.20 mg/kg/gün değerinde bir maksimum yan etkisiz doz (MYED) düzeyi ortaya konulmuş ve 13 haftaya kadar intranazal uygulama ile yapılan önceki çalışmalar doğrulanmıştır. İpratropium bromür ile yapılan tekrarlı doz toksisite çalışmalarında HFA formülasyonu ve klasik CFC formülasyonunun toksikolojik profillerinin benzer olduğu gösterilmiştir. İpratropium bromürün sudaki bir solüsyonu (0.05 mg/kg) sıçanlara inhalasyon ile uygulandığında (4 saat süreyle tek uygulama), lokal olarak iyi tolere edilmiştir. Tekrarlı doz toksisite çalışmalarında da ipratropium bromür lokal olarak iyi tolere edilmiştir. Kobaylarda ne aktif anaflaksi, ne de pasif kütanöz anafilaktik reaksiyonlara rastlanmıştır. In vitro (Ames testi) ve in vivo (mikronukleus testi, farelerde dominant letal test, Çin hamsteri kemik iliği hücrelerinde sitogenetik tayin) tayinlerde genotoksisite verisi bulunmamaktaydı. Fareler ve sıçanlarda yürütülen uzun dönemli çalışmalarda, hiçbir tümörijenik ya da karsinojenik etki gösterilmemiştir. İpratropium bromürün fertilite, embriyo-fetotoksisite ve peri-postnatal gelişme üzerindeki muhtemel etkilerinin araştırıldığı çalışmalar, fareler, sıçanlar ve tavşanlar üzerinde yürütülmüştür. Yüksek oral doz düzeyleri, yani sıçanlarda 1000 mg/kg/gün ve tavşanlarda 125 mg/kg/gün, her iki türde de maternotoksik idi; sıçanlarda ise aynı zamanda fetal ağırlıkta azalma ile birlikte embriyo-fetotoksisite de görüldü. Tedaviye bağlı malformasyon gözlenmemiştir. Ölçülü doz aerosolün, teknik olarak mümkün en yüksek inhalasyon dozları, sıçanlarda 1.5 mg/kg/gün ve tavşanlarda 1.8 mg/kg/gün, üreme üzerinde hiçbir advers etki göstermemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSodyum klorür Seyreltik hidroklorik asit Enjeksiyonluk su6.2. GeçimsizliklerATRİVO STERİ-NEB® ile koruyucu madde olarak benzalkonyum klorür içeren disodyum kromoglikat inhalasyon solüsyonları, aynı nebülizatör içinde birlikte uygulanmamalıdır.6.3. Raf ömrüATRİVO STERİ-NEB®'in raf ömrü 24 aydır.6.4. Saklamaya yönelik özel tedbirler25°C altında oda sıcaklığında saklayınız. Işıktan koruyunuz.6.5. Ambalajın niteliği ve içeriğiDüşük yoğunluklu polietilen malzemeden yapılmış olan ampuller, steril nebülizasyon için 1 ml'lik inhalasyon çözeltisi içerir. 20 ampul içeren ambalajında sunulmuştur.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerÖzel bir gereklilik yoktur.Kullanılmamış olan ürün ya da atık materyaller, Tıbbi Atıkların Kontrolü ve Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmeliklerine uygun olarak imha edilmelidir. Madde 4.2'ye bakınız. 7. RUHSAT SAHİBİMED İLAÇ San. ve Tic. AŞ.Veko Giz Plaza Maslak Mah. Meydan Sk. No:3 Kat:5-6 34396 Maslak-Şişli/İstanbul 8. RUHSAT NUMARASI136/929. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 31.12.2013 Ruhsat yenileme tarihi:10. KÜB YENİLENME TARİHİ11 |
İlaç BilgileriAtrivo Steri-neb 250 Mcg/1 Ml Nebülizasyon İçin I...Etken Maddesi: Ipratropium Bromür Monohidrat Atc Kodu: R03BB01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.