Clexane 4000 Anti-xa Iu/0.4 Ml Kullanıma Hazır En... Kısa Ürün BilgisiKan ve Kan Yapıcı Organlar » Antitrombotikler » Antitrombotik İlaçlar » Heparin » Enoksaparin Sodyum KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADICLEXANE® 4000 anti-Xa IU/0.4 mİ kullanıma hazır enjektör2. KALİTATİF VE KANTİTATİF BİLESİM9Etkinmadde:Enoksaparin sodyum: 40 mg (4000 anti-Xa IU'ya eşdeğer)Yardımcı madde:Yardımcı maddeler için 6.1'e bakınız.3. FARMASÖTİK FORMUKullanıma hazır enjektör Berrak, renksiz veya açık san çözelti4. KLİNİK ÖZELLİKLERİ4.1 Terapötik endikasyonlar Venöz tromboemboli profilaksisinde (venlerde pıhtı oluşumunun önlenmesi) özellikle bazı işlemler, örneğin ortopedik veya genel cerrahi sonrası Kalp yetmezliği, solunum yetmezliği, çeşitli enfeksiyonlar ve romatizmal hastalıkları içeren akut medikal hastalıklar nedeniyle yatağa bağlı hastaların venöz tromboemboli sinin profilaksisinde Hemodiyaliz sırasında ekstrakorporeal dolaşımda tromboz oluşumunun önlenmesinde Beraberinde pulmoner emboli gelişmiş veya gelişmemiş derin ven trombozunun tedavisinde Kararsız angina ve Q dalgasız (miyokard nekrozu bulunmasına karşın EKG de Q dalgasının gelişmediği) miyokard infarktüsü tedavisinde aspirin ile birlikte verilmelidir. 4.2 Pozoloji ve uygulama şekliPozoloj i/uygulama sıklığı ve süresi- Cerrahi hastalarında venöz tromboz profilaksisi:Orta derecede tromboemboli riski olan hastalarda (örn. abdominal cerrahi), önerilen enoksaparin sodyum dozu subkütan enjeksiyon yoluyla günde bir kez 20 mg ya da 40 mg'dır. Genel cerrahi girişimlerinde, ilk doz operasyondan 2 saat önce uygulanmalıdır.Yüksek derecede tromboemboli riski olan hastalarda (örn. ortopedik cerrahi) subkütan enjeksiyon yoluyla verilmesi önerilen enoksaparin sodyum dozu, cerrahiden 12 saat önce başlatılan ve cerrahiden 12-24 saat sonra devam edilen günde bir kez 40 mg'dır. Enoksaparin tedavisi genellikle, ortalama 7-10 gün süreyle uygulanır. Bazı durumlarda daha uzun süreli tedavi gerekebilir ve tedaviye hasta tromboemboli riski altında olmaya devam ettiği ve yatağa bağlı kaldığı sürece devam edilmelidir. İlk tedaviyi takiben günde bir kez 40 mg ile 3 hafta süreyle devam ettirilen tedavinin ortopedik cerrahide yararlı olduğu kanıtlanmıştır. Spinal/Epidural Anestezi ve Perkütan Koroner Revaskülarizasyon girişimleri için doz uygulama aralıklarıyla ilgili özel öneriler için: bkz. Özel kullanım uyarıları ve önlemleri bölümü. - Medikal hastalarda venöz tromboemboli profilaksisi:Önerilen doz subkütan enjeksiyon yoluyla günde bir kez 40 mg'dır.Enoksaparin sodyum ile tedavi en az 6 gün süreyle uygulanır ve tam hareket kazanana kadar, en fazla 14 gün süreyle devam edilir. -Hemodiyaliz sırasında ekstrakorporeal dolaşımda tromboz oluşumunun engellenmesi:Önerilen doz 1 mg/kg'dır. Yüksek hemoraji riski taşıyan hastalar için, doz ikili vasküler giriş için 0.5 mg/kg'a ve tek vasküler giriş için 0.75 mg/kg'a azaltılmalıdır. Hemodiyaliz sırasında enoksaparin sodyum, diyaliz seansının başında dolaşımın arteriyel koluna uygulanmalıdır. Uygulanan bu dozla 4 saatlik bir seans için genellikle yeterli bir etki sağlanabilmektedir. Fibrin halkalarının gözlendiği durumlarda 0.5 ila lmg/kg'lık ek bir doz uygulanabilir.-Pulmoner emboli ile birlikte ya da tek başına derin ven trombozlarının tedavisinde:Enoksaparin sodyum 1.5 mg/kg tek enjeksiyon olarak ya da 12 saatte bir lmg/kg doz subkütan olarak verilmelidir. Komplike tromboembolik hastalıklarda 1 mg/kg günde 2 kez verilmesi önerilir. Tedavi süresi genelde ortalama 10 gündür. Uygun olduğunda oral antikoagülan tedavisine başlanmalı ve enoksaparin tedavisi terapötik antikoagülan etki sağlanana kadar sürdürülmelidir.-Kararsız angina ve -Q dalgasız miyokard infarktüsünün tedavisi:Önerilen enoksaparin sodyum dozu, oral aspirin (günde bir kez 100 - 325 mg) ile birlikte subkütan enjeksiyon yoluyla 12 saatte bir uygulanan 1 mg/kg'dır.Bu hastalarda enoksaparin sodyum ile tedavi en az 2 gün süreyle uygulanmalı ve hastanın durumu stabilize olana kadar devam ettirilmelidir. Normal tedavi süresi 2-8 gündür. Uygulama şekli Subkütan enjeksiyon:Enoksaparin sodyum, venöz tromboembolik hastalığın önlenmesi, derin ven trombozu tedavisi, kararsız anjina ve Q dalgasız miyokard infarktüsü tedavisi için yalnızca Subkütan enjeksiyon yoluyla uygulanır.Arteriyel hat enjeksiyonu:Hemodiyaliz sırasında vücut dışı dolaşımda trombus oluşumunu önlemek amacıyla, bir diyaliz devresinin arteryel hattı yoluyla uygulanır.İntramüsküler yolla uygulanmamalıdır. Tek kulla nımlık enjektör hemen kullanıma hazırdır.Subkütan enjeksiyon tekniği:Önceden doldurulmuş tek kullanımlık şırıngalar derhal kullanım için hazırdır.Enjeksiyon tercihen hasta yatar durumdayken yapılmalıdır. Enoksaparin sodyum derin subkütan enjeksiyon yoluyla uygulanır. Önceden doldurulmuş 20 mg ve 40mg şırıngaları kullanırken ilaç kaybını önlemek için enjeksiyondan önce şırıngadan hava kabarcıklarını dışarı atmaya çalışmayınız. Uygulama sol ve sağ anterolateral veya posterolateral abdominal duvar arasında dönüşümlü olarak yapılmalıdır. İğne başparmak ile işaret parmağı arasında bastırmadan tutulan deri kıvrımına dikey olarak sonuna kadar batırılır. Bu deri kıvrımı enjeksiyon tamamlanıncaya kadar bırakılmamalıdır. Uygulamadan sonra enjeksiyon yerini ovuşturmayınız. Basit ve güvenli şekilde enjekte etmek içinŞırınganın sonuna yetindiğinde, güvenlik sistemi hareketin devamında aktil hale gelir, böylece. hastaya sıkıntı vermeden ıslak iflne tamamen korunur.¦ Uygulama biçimi ve yolu DERİ ALTINA(hcmodlyjlli endikasyonu yoksa). Kas içinden enjekle tlmeyifıiz,
Şırınganın güvenlik kapağını çelipçıkann.2bErtjekle edilecek miktarı hastanın ağırlığına göre ayarlayın.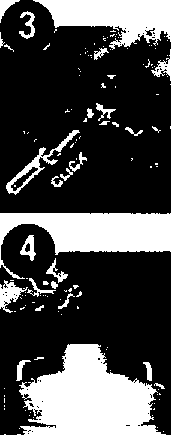 Uyarı: Güvenlik sistemi ancak şırınga tamamen boşaldığında aktil hale gelir.Enjeksiyon çtemi tek el İh* yap»l*.Böytece ianenin kasra batması önlenmiş otarTaşma varsa, enjeksiyon öncesinde lazfalılığı giderin.Taşma olmadıkça ?.ırın®a/t enjeksiyon »nefsinde bojallntayın, enfeksiyon izlemini uyflulaym,Enjeksiyon tercihen, uzanmış vaıiyeneki bir hastaya, gerek sağdan sferek soldan, anterofaterat ı/e postenolaieral karın kaslanrıın deriattı hücre dokusuna uygulanır iğne, uyg ıılayantn başparmak ile işaret parmağı araşma aldığı deri kıvrımına, sıyırır şekilde değii de dikey olarak batınlır. Enfeksiyon boyunca deri kıvrımı başparmak ve tjarel parmağı arasında sabit jekılds tutulur
Clexane LnoksapaıinÖzel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliği:(bkz. bölüm 4.4: Böbrek yetmezliği).Ağır böbrek yetmezliğiAğır böbrek yetmezliği (kreatinin klirensi <30 mİ/dakika) olan hastalar için aşağıdaki tablolara göre bir doz ayarlaması gerekir, zira bu hastalarda enoksaparin sodyuma maruz kalma anlamlı ölçüde artmaktadır.Terapötik dozaj sınırları için aşağıdaki dozaj ayarlamaları önerilmektedir:
Profilaktik dozaj sınırları için aşağıdaki dozaj ayarlamaları önerilmektedir:
Hafif ve orta dereceli böbrek yetmezliği:Orta dereceli böbrek yetmezliği (kreatinin klerensi 30-50 ml/dakıka) ve hafif böbrek bozukluğu (kreatinin klerensi 50-80 ml/dakika) olan hastalarda herhangi bir doz ayarlaması önerilmemekle birlikte, dikkatli klinik izlemenin yapılması tavsiye edilmektedir.Karaciğer yetmezliği:Klinik araştırmalar bulunmadığından, karaciğer bozukluğu olan hastalarda dikkatli olunmalıdır.Pediyatrik popülasyon:Enoksaparin sodyumun çocuklardaki güvenilirlik ve etkinliği kanıtlanmamıştır.Geriyatrik popülasyon:Böbrek fonksiyon bozukluğunun olmaması halinde yaşlılarda herhangi bir doz azaltımına gerek yoktur (bkz bölüm 4.4: Yaşlılarda Hemoraji, bölüm 4.2: Böbrek yetmezliği).4.3 KontrendikasyonlarEnoksaparin sodyum, heparin ya da diğer düşük molekül ağırlıklı heparinler dahil olmak üzere heparin türevlerine karşı aşın duyarlılık,Aktif majör kanama ve yakın tarihli hemorajik inme dahil olmak üzere yüksek kontrolsüz hemoraji riski taşıyan hastalıklar. 4.4 Özel kullanım uyarıları ve önlemleriGenel;Düşük molekül ağırlıklı heparinler üretim metodu, molekül ağırlığı, spesifik anti-Xa aktivitesi, ünite ve doz açısından eşdeğer olmadıklarından birbirlerinin yerine kullanılmamalıdır. Farmakokinetik özelikler ve bununla ilişkili biyolojik aktivitelerde (örn. anti-trombin aktivitesi ve trombosit etkileşimleri) farklılıklara yol açar. Her ürünün spesifik kullanım şekline özellikle dikkat edilmesi gerekmektedir. Spinal/Epidural Anestezi: Enoksaparin sodyum ve spinal/epidural anestezinin birlikte kullanımı ile uzun süreli ya da kalıcı paraliziye yol açan nöroaksiyel hematom olguları bildirilmiştir. Bu olaylar günde bir kez 40 mg veya daha düşük enoksaparin sodyum dozaj rejimleri ile nadir olarak görülmektedir. Bu risk, daha yüksek enoksaparin sodyum dozaj rejimleri, postoperatif yerleşik kateterlerin kullanımı ya da hemostazı etkileyen NSAİ ilaçlar gibi ilave ilaçların birlikte kullanımıyla daha büyüktür (bkz. bölüm 4.5). Ayrıca travmatik ya da tekrarlanan nöroaksiyel ponksiyonda ya da spinal operasyon veya spinal biçim bozukluğu hikayesi olan hastalarda da bu riskin arttığı düşünülmektedir. Hekimin epidural/spinal anestezi bağlamında antikoagülan uygulamaya karar vermesi halinde, belde orta hatta ağrı, sensoryel ve motor defisitler (alt ekstremitelerde uyuşukluk veya zayıflık), bağırsak ve/veya mesane disfonksiyonu gibi nörolojik bozukluk belirti ve semptomlarını saptamak üzere olağanüstü dikkat harcanmalı ve sık izleme yapılmalıdır. Hastalara yukarıdaki belirti ve semptomların herhangi birini yaşamaları halinde derhal hekime bildirmeleri talimatı verilmelidir. Spinal hematom belirti veya semptomlarından kuşkulanılması halinde, ivedilikle tanı konulmalı ve omurilik dekompresyonu dahil olmak üzere tedaviye başlanılmalıdır. Hekim, tromboprofilaksi için antikoagüle olmuş ya da antikoagüle edilmiş hastalarda nöroaksiyel müdahaleden önce potansiyel yarara karşı riski göz önünde bulundurmalıdır. Enoksaparin sodyum ile epidural ya da spinal anestezinin birlikte kullanımından kaynaklanan potansiyel kanama riskini azaltmak için ilacın farmakokinetik profili dikkate alınmalıdır (bkz. bölüm 5.2). Kateterin yerleştirilmesi ya da çıkarılması için en uygun zaman enoksaparinin antikoagülan etkisinin düşük olduğu zamandır. Bir kateterin yerleştirilmesi veya çıkarılması enoksaparin sodyumun DVT profilaktik dozlarının uygulanmasından sonra 10-12 saat süreyle geciktirilmelidir. Daha yüksek enoksaparin sodyum dozları (günde iki kez 1 mg/kg ya da günde bir kez 1.5 mg/kg) alan hastalar için bu sürenin daha uzun (24 saat) olması gerekecektir. Bir sonraki enoksaparin sodyum dozu kateter çıkarıldıktan en az 2 saat sonra verilmelidir. Heparin kaynaklı trombositopeni Enoksaparin sodyum trombozun eşlik ettiği ya da etmediği heparin kaynaklı trombositopeni öyküsü bulunan hastalarda olağanüstü dikkatle kullanılmalıdır. Heparin kaynaklı trombositopeni riski birkaç yıl süreyle devam edebilir. Eğer heparin kaynaklı trombositopeni öyküsünden kuşkulamlıyorsa, in vitro trombosit agregasyonu testlerinin sınırlı öngöriicü değeri bulunmaktadır. Böyle bir olguda enoksaparin sodyum kullanma karan ancak bu alanda bir uzman ile konsültasyon yapılarak verilmelidir. Perkütan koroner revaskülarizasyon girişimleri: Kararsız angina ve Q dalgasız miyokard infarktüsü tedavisi sırasında alet kullanılarak uygulanan vasküler girişimi takiben kanama riskini minimum düzeye indirmek için CLEXANE enjeksiyon, dozlar arasında bırakılması önerilen zaman aralıklarına kesin uyularak tatbik edilmelidir. Bu, Perkütan Koroner Girişim sonrası ponksiyon bölgesinde hemostaz elde edilmesi açısından önemlidir. Bir kapatma aleti kullanılması durumunda, kılıf hemen çıkarılmalıdır. El ile kompresyon yapılması durumunda kılıf, IV/Subkütan yolla uygulanan son enoksaparin sodyum enjeksiyonunun üzerinden 6 saat geçtikten sonra çıkarılmalıdır. Enoksaparin sodyum tedavisinin sürdürülmesi durumunda, planlanan bir sonraki doz kılıfın çıkarılmasının üzerinden 6 ila 8 saat geçtikten sonra verilmelidir. Girişim bölgesi kanama veya hematom oluşumu belirtileri açısından gözlenmelidir. Kalp kapak protezi olan gebe kadınlar: Mekanik kalp kapak protezi olan gebe kadınlarda tromboprofilaksi için CLEXANE enjeksiyonunun kullanımı yeterli olarak çalışılmamıştır. Tromboemboli riskini azaltmak amacıyla mekanik kalp kapak protezleri olan gebe kadınlara enoksaparin (günde iki kez 1 mg/kg) verilen bir klinik araştırmada, 8 kadından 2'sinde kapak blokajı görülmüş ve bu sebeple anne ile bebek kaybedilmiştir. Tromboprofilaksi amacı ile enoksaparin uygulanan mekanik kalp kapak protezli gebe kadınlarda pazarlama sonrası raporlarda izole protez tromboz vakaları bildirilmiştir. Mekanik kalp kapak protezi olan gebe kadınlar tromboembolizm için yüksek risk altında bulunabilirler. Laboratuvar testleri: Venöz tromboemboli profilaksisi için kullanılan dozlarda, enoksaparin sodyum kanama süresi ve global kan koagülasyon testlerini anlamlı olarak etkilememektedir ve ayrıca trombosit agregasyonu ya da fibrinojenin trombositlere bağlanması üzerinde herhangi bir etkisi bulunmamaktadır. Daha yüksek dozlarda, aPTT'de (aktif parsiyel tromboplastin zamanı) ve ACT'de (aktif pıhtılaşma zamanı) artışlar görülebilir. aPTT ve ACT'deki artışlar ile enoksaparin sodyumun artan antitrombotik aktivitesi arasında doğrusal bir korelasyon yoktur ve dolayısıyla enoksaparin sodyumun aktivitesini izlemek için uygun ve güvenilir değildirler. Intramüsküler uygulanmamalıdır. Hemoraji Tüm diğer antikoagülanlarda olduğu gibi kanama her yerde oluşabilir (Bkz. bölüm 4.8). Kanama oluşursa hemorajİnin kaynağı araştırılmalı ve uygun tedavi yapılmalıdır. Tüm diğer antikoagülan tedavilerinde olduğu gibi enoksaparin sodyum da, kanama potansiyelinin arttığı aşağıdaki durumlarda dikkatle kullanılmalıdır: - bozulmuş hemostaz, - peptik ülser öyküsü, - yakın tarihli iskemik inme, - kontrolsüz ağır arteriyel hipertansiyon, - diyabetik retinopati, - yakın tarihli nörolojik ya da oftalmolojik cerrahi, - Hemostazı etkileyen ilaçların birlikte kullanımı (Bkz. bölüm 4.5). Mekanik kalp kapak protezleri: Mekanik kalp kapak protezi olan hastalarda tromboprofilaksi için CLEXANE enjeksiyonunun kullanımı yeterli olarak çalışılmamıştır. Tromboprofilaksi için enoksaparin uygulanan mekanik kalp kapak protezli hastalarda izole kalp kapağı trombozu vakaları bildirilmiştir. Altta yatan hastal ıklan ve yetersiz klinik verileri içeren şaşırtıcı faktörler bu vakaların incelenmesini kısıtlamaktadırlar. Bu vakaların bir kısmı trombozun matemal veya fetal ölüme yol açtığı gebe kadınlardır. Mekanik kalp kapak protezi olan gebe kadınlar tromboembolizm için yüksek risk altında bulunabilirler. Yaşlılarda hemoraji: Yaşlılarda profilaktik dozaj sınırları ile kanama eğiliminde herhangi bir artış gözlenmemektedir. Bununla birlikte gecikmiş itrah nedeniyle yaşlı hastalar (özellikle 80 yaş ve üzerindeki hastalar) terapötik dozaj sınırlan ile kanama komplikasyonlan açısından artan risk altında olabilirler. Dikkatli kl inikizleme tavsiye edilmektedir (bkz. bölüm 4.2: Yaşlılar).Böbrek yetmezliği: Böbrek yetmezliği olan hastalarda, enoksaparin sodyuma maruz kalmada olan artış ile kanama riski de artar. Ağır böbrek bozukluğu (kreatinin klerensi <30 ml/dakika) olan hastalarda enoksaparin sodyuma maruz kalma anlamlı ölçüde arttığından, terapötik ve profilaktik dozaj sınırlan için bir dozaj ayarlanması önerilmektedir. Orta derecede böbrek yetmezliği (kreatinin klerensi 30-50 ml/dakika) ve hafif böbrek yetmezliği (kreatinin klerensi 50-80 ml/dakika) olan hastalarda herhangi bir dozaj ayarlanması önerilmemekle birlikte, dikkatli klinik izleme tavsiye edilmektedir (bkz. bölüm 4.2: Böbrek Yetmezliği). Düşük kilo: Düşük kilolu kadınlarda (<45 kg) ve düşük kilolu erkeklerde (<53 kg)profilaktik dozajlarla (kiloya göre ayarlanmamış) gözlemlenen enoksaparin sodyuma maruz kalmadaki artış, daha yüksek kanama riskine yol açabilir. Bu nedenle, bu hastalarda dikkatli klinik izleme tavsiye edilmektedir. Trombosit sayımının izlenmesi: Antikor aracılığıyla heparin kaynaklı trombositopeni riski düşük molekül ağırlıklı heparinlerle de söz konusudur. Trombositopeni oluşması halinde bu çoğunlukla enoksaparin sodyum tedavisi başladıktan sonraki 5. ve 21. günler arasında görülmektedir. Bu nedenle, enoksaparin sodyum ile tedaviye başlamadan önce ve daha sonra tedavi süresince düzenli olarak trombosit sayımının yapılması önerilmektedir. Uygulamada, trombosit sayımında anlamlı bir azalma (başlangıç değerinin %30 - 50'si) olduğunun doğrulanması halinde enoksaparin sodyum tedavisi derhal kesilmeli ve başka bir tedavi başlanmalıdır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriEğer kesin olarak endike değilse hemostazı etkileyen ajanların enoksaparin sodyum tedavisinden önce kesilmesi önerilmektedir. Bu ajanlar aşağıdaki ilaçlan içermektedir:- Sistemik salisilatlar, asetilsalisilik asit ve ketorolak dahil olmak üzere NSAİ ilaçlar, - Dekstran 40, tiklopidin ve klopidogrel, - Sistemik glukokortikoidler, - Trombolitikler ve antikoagülanlar, - Glikoprotein Ilb/IIIa antagonistler dahil olmak üzere diğer anti trombosit ajanlar. - Divalproex, plikamisin, valproik asit, sülfmpirazon. Varfarin; Beraber kullanım sırasında kanama riski artabilir. Antikoagülasyonu sağlamak ve geçici hiperkoagülabİlite ihtimaline karşı korumak üzere varfarin tedavisinin başlangıcında enoksaparin genellikle devam ettirilir. Eğer kombinasyon endike ise, enoksaparin sodyum dikkatli klinik izleme ve uygun olduğunda laboratuvar izlemesi yapılarak kullanılmalıdır. 4.6 Gebelik ve laktasyon Gebelik kategorisi:Gebelik kategorisi B'dir.Çocuk doğurma potansiyeli bulunan kadınlar /Doğum kontrolü (Kontrasepsiyon)Deneysel araştırmalar bir fetotoksisite veya teratojenite bulgusu ortaya koymamıştır.Gebelik dönemi:Gebe kadınlarda gerçekleştirilmiş yeterli ve iyi kontrollü araştırmalar bulunmadığından ve deneysel araştırmalar her zaman insanlardaki yanıtın öngörücüsü olmadığından, bu ilaç ancak hekimin kesin bir gereksinim saptaması halinde gebelik sırasında kullanılmalıdır.İnsanlarda, enoksaparin sodyumun gebeliğin ikinci trimesteri sırasında plasenta bariyerini geçtiğine ilişkin herhangi bir bulgu yoktur. Birinci ve üçüncü trimesterlerle ilgili herhangi bir bilgi bulunmamaktadır. (Bkz. bölüm 4.4: Kalp kapak protezi olan gebe kadınlar ve mekanik kalp kapak protezleri). Laktasyon dönemi:Deneysel çalışmalarda, 35S-enoksaparin sodyum ya da işaretli metabolitlerinin sütteki konsantrasyonunun çok düşük olduğu bildirilmiştir.Değişmemiş enoksaparin sodyumun insan sütünde atılıp atılmadığı bilinmemektedir. Enoksaparin sodyumun oral absorpsiyonu olası değildir. Bununla birlikte, bir önlem olarak, enoksaparin sodyum almakta olan süt veren annelerin emzirmeden kaçınmaları tavsiye edilmelidir. Üreme yeteneği/FertiliteÜreme yeteneği/fertilite'ye ait çalışma yapılmamıştır.4.7 Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerine bilinen herhangi bir etkisi yoktur.4.8 İstenmeyen etkilerEnoksaparin, klinik çalışmalarda enoksaparin alan 15.000'den fazla hastada değerlendirilmiştir. Bunlar, tromboembolik komplikasyonlar açısından risk altındaki hastalarda ortopedik veya abdominal cerrahiyi takiben derin ven trombozunun profilaksisi için 1776, hareket yeteneği şiddetli ölçüde kısıtlanmış akut medikal hastalarda derin ven trombozunun profilaksisi için 1169, pulmoner embolizmin eşlik ettiği veya etmediği derin ven trombozunun tedavisi için 559, kararsız angina ve Q-dalgasız miyokard infarktüsünün tedavisi için 1578 ve akut ST-yüksclmeli miyokard infarktüsünün tedavisi için 10176 hastayı içermiştir.Bu klinik çalışmalarda uygulanan enoksaparin sodyum rejimi endikasyonlara bağlı olarak farklılık göstermektedir. Enoksaparin sodyum dozu, cerrahiyi takiben veya hareket yeteneği şiddetli ölçüde kısıtlanmış akut medikal hastalarda günde bir kez 40 mg subkutan olmuştur. Pulmoner embolizmin (PE) eşlik ettiği veya etmediği derin ven trombozunun (DVT) tedavisinde, enoksaparin alan hastalar 12 saatte bir 1 mg/kg Subkütan dozu ya da günde bir kez 1.5 mg/kg Subkütan dozu ile tedavi edilmiştir. Kararsız angina ve Q-dalgasız miyokard infarktüsünün tedavisi için kl inikçalışmalarda, dozlar 12 saatte bir 1 mg/kg Subkütan olmuş ve akut ST-yükselmeli miyokard infarktüsünün tedavisi için klinik çalışmada enoksaparin sodyum rejimi 30 mg IV bolusu takiben 12 saatte bir 1 mg/kg Subkütan olmuştur.Bu klinik çalışmalarda gözlenen ve pazarlama sonrası deneyimde bildirilen ad ver s etkiler aşağıda ayrıntılı olarak verilmektedir. Sıklıklar şöyle tanımlanmaktadır: Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1000 ila <1/100); seyrek (> 1/10,000 ila <1/1,000); çok seyrek (< 1/10,000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Pazarlama sonrası deneyimde bildirilen advers olaylar bilinmiyor sıklık derecesi altında sıralanmaktadır. Hemoraji: Klinik çalışmalarda, hemorajiler en sık bildirilen reaksiyon olmuştur. Bunlar, hastaların (cerrahi hastaları1) en fazla %4.2'sinde bildirilen majör hemorajileri içermiştir. Bu olgulardan bazıları ölümle sonuçlanmıştır. Diğer antikoagülanlarla olduğu gibi, aşağıdaki ilişkili risk faktörlerinin varlığında hemoraji meydana gelebilir: Kanamaya yatkın organik lezyonlar, invazif girişimler veya hemostazı etkileyen ilaçların birlikte kullanılması (bkz. Bölüm 4.4 ve 4.5).
1 Cerrahi hastalarında, hemoraji komplikasyonları aşağıdaki durumlarda majör kabul edilmiştir: (1) hemoraji anlamlı bir klinik olaya neden olmuşsa ya da (2) hemorajiye hemoglobinde azalma >2 g/dL veya >2 ünite kan ürünü transfüzyonu eşlik etmişse. Retroperitoneal ve intrakraniyal hemorajiler her zaman majör kabul edilmiştir. Trombositopeni ve trombositoz
5 Diğer klinik olarak anlamlı advers reaksiyonlar Bu reaksiyonlar, endikasyonlar ne olursa olsun, sistem organ sınıfı, sıklık grubu ve azalan ciddiyet sırasına göre aşağıda sunulmaktadır.
* *: transaminaz düzeyleri >3 x normalin üst sınırı Pazarlama sonrası deneyimi: CLEXANE'ın ruhsat onayı alındıktan sonraki kullanımında aşağıdaki advers olaylar bildirilmiştir. Advers olaylar spontan bildirimleri temel aldığından, bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) sıklık derecesi altında sıralanmaktadırlar. Kan ve lenf sistemi hastalıkları:- Hemorajİk anemi - Trombozla birlikte immuno-aleıjik trombositopeni olgulan; bunlann bazılannda tromboz organ infarktüsü veya ekstremite iskemisiyle komplike olmuştur (bkz. Bölüm 4.4: Trombosit sayımlannın izlenmesi). - Eozinofili Bağışıklık sistemi hastalıktan- Şok da dahil olmak üzere anafilaktik/anafilaktoid reaksiyon Sinir sistemi hastalıkları- Başağnsı Vasküler hastalıklar- Enoksaparin sodyum ve spinal/epidural anestezi veya spinal ponksiyonun birlikte kullanımıyla spinal hematom (veya nöraksiyal hematom) olgulan bildirilmiştir. Bu reaksiyonlar uzun süreli veya kalıcı paralizi gibi değişen derecelerde nörolojik zedelenmelerle sonuçlanmıştır (bkz. Bölüm 4.4: Spinal/epidural anestezi). Hepato-bilier hastalıklar- Hepatoselüler karaciğer haşan - Kolestatik karaciğer haşan Deri ve deri altı dokusu hastalıktan- Çoğunlukla enjeksiyon yerinde meydana gelen deri nekrozu, kutanöz vaskülit (çoğunlukla bu fenomenlere infıltre olmuş ve ağrılı purpura veya eritematöz plaklar öncülük etmiştir). Enoksaparin sodyum ile tedavi kesilmelidir. - Enjeksiyon yerinde nodüller (kistik enoksaparin birikimi olmayan enflamatuvar nodüller). Bıı nodüller birkaç gün sonra çözülmektedir ve tedavinin kesilmesine neden olmamalıdır. - Alopesi Kas-iskelet bozukluktan, bağ doku ve kemik hastalıklan- Uzun süreli (3 aydan fazla) tedavi sonrasında osteoporoz. 4.9. Doz asımı ve tedavisi:# >İntravenöz, ekstrakorporeal veya subkütan enoksaparin sodyumun kazara doz aşımı hemorajik komplikasyonlara yol açabilir. Büyük dozlarda olsa dahi oral uygulamayı takiben enoksaparin sodyumun absorbe olması mümkün değildir. Antidotu ve Tedavisi:Antikoagülan etkiler protaminin yavaş intravenöz enjeksiyonu ile büyük ölçüde nötralize edilebilmektedir. Protamin dozu enjekte edilen enoksaparin sodyum dozuna bağlı olup, enoksaparin sodyum son 8 saat içinde uygulanmış ise 1 mg protamin 1 mg enoksaparin sodyumun antikoagülan etkisini nötralize etmektedir. Enoksaparin sodyum uygulanmasının üstünden 8 saatten daha uzun zaman geçmiş ise veya ikinci bir protamin dozunun gerekli olduğu belirlenmiş ise, 1 mg enoksaparin sodyum başına 0.5 mg protamin infüzyonu uygulanabilir. Enoksaparin sodyum enjeksiyonundan 12 saat sonra, protamin uygulanmasına gerek duyulmayabilir. Bununla birlikte, yüksek protamin dozlarıyla dahi, enoksaparin sodyumun anti-Xa aktivitesi hiçbir zaman tam olarak nötralize edilmez (maksimum yaklaşık %60). (bkz, protamin tuzlarının reçete bilgileri).5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Heparinler - Düşük molekül ağırlıklı heparinler ATC kodu: B01 AB05Enoksaparin sodyum yaklaşık 4500 dalton ortalama molekül ağırlığına sahip Düşük Molekül Ağırlıklı Heparindir. İlaç maddesi sodyum tuzudur. Moleküler ağırlık dağılımı; <2000 dalton <20% 2000 ilâ 8000 dalton >68% >8000 dalton <18% Enoksaparin sodyum, domuz intestinal mukozasından türetilen heparin benzil esterin alkalin depolimerizasyonu ile elde edilmektedir. Yapısı, zincirin İndirgenmeyen ucunda bir 2-0-sülfo-4-enepiranosüranik asit ve indirgenen uçta bir 2-N,6-0-disülfo-D-glukosamin ile karakterizedir. Enoksaparin yapısının yaklaşık %20'si (%15 ve %25 aralığında değişmektedir) polisakkarit zincirin indirgenen ucunda bir 1,6 anhidro türevi içermektedir. Yüksek anti-Xa (100 I.U./mg) ve düşük anti-II a veya anti-trombin (28 I.U. /mg) aktivitesi vardır. Bu antikoagülan aktiviteler anti-trombin III (ATIII) aracılığıyla sağlanarak insanlarda anti-trombotik aktivitelerle sonuçlanır. Anti-Xa/IIa aktivitesinin dışında, enoksaparinin gerek sağlıklı bireyler ve hastalarda gerekse klinik dışı modellerde başka anti-trombotik ve antienflamatuvar özellikleri de saptanmıştır. Bunlar, faktör Vlla gibi diğer koagülasyon faktörlerinin ATIII'e bağımlı inhibisyonunu, endojen Doku Faktör Yolu İnhibitörü (TFPI) saliminin indüksiyonunu ve vasküler endotelyumdan kan dolaşımına von Willebrand faktör (vWF) şahmında azalmayı içermektedir. Bu faktörlerin enoksaparinin genel anti-trombotik etkisine katkıda bulunduğu bilinmektedir. Klinik etkinlikKararsız angina ve non -Q miyokard infarktüsünün tedavisi:Geniş çaplı çok merkezli bir araştırmada, kararsız angina veya Q dalgasız miyokard infarktüsü akut fazında kaydedilen 3.171 hasta, aspirinle (100-325 mg/gün) birlikte subkütan yoldan 12 saatte bir 1 mg/kg enoksaparin sodyum ya da intravenöz yoldan aktive parsiyel tromboplastin zamanına (aPTT) dayanarak ayarlanmış fraksiyone olmayan heparin uygulanmak üzere randomize olarak ayrılmıştır. Hastaların klinik stabilizasyona, revaskülarizasyon girişimlerine ya da taburcu edilinceye kadar en az 2 gün süreyle ve en fazla 8 gün süreyle hastanede tedavi edilmeleri zorunlu tutulmuştur. Hastalann 30 güne kadar İzlenmesi zorunlu tutulmuştur. Enoksaparin sodyum, 14. günde saptanan ve 30 günlük dönem boyunca devam eden %16.2 gibi bir rölatif risk azalmasıyla tekrarlayan angina, miyokard enfarktüsü ve ölüm insidansım heparİne kıyasla anlamlı ölçüde düşürmüştür. Bunun yanı sıra, enoksaparin sodyum grubunda daha az sayıda hastaya perkütan transluminal koroner anjioplasti (PTCA) ya da koroner arter bypass greft (CABG) uygulaması yapılmıştır (30. günde %15.8 rölatif risk azalması).5.2. Farmakokinetik özellikler Genel özellikler:Enoksaparin sodyumun farmakokinetik parametreleri, önerilen dozaj sınırlarında tek ve tekrarlanan subkütan uygulamadan sonra ve tek İntravenöz uygulamadan sonra esas olarak plazma anti-Xa aktİvitesinin zaman süreci açısından ve ayrıca anti-IIa aktivitesine göre araştırılmıştır.» yAnti-Xa ve anti-IIa farmakokinetik aktivitelerin kantitatif tayini, spesifik substratlarla ve DMAH'lar (Düşük Molekül Ağırlıklı Heparinler) için uluslararası standartlara karşı (NIBSC) kalibre edilmiş bir enoksaparin standardı ile validasyonu yapılmış amidolitik yöntemler kullanılarak gerçekleştirilmiştir. Emilim:Enoksaparin sodyum subkütan enjeksiyonu takiben hızla ve tam olarak emilir. Emilim doğrudan uygulanan doz ile doğru orantılıdır. Bu durum fraksiyone olmayan heparinin aksine enoksaparin sodyum emiliminin lineer olduğunu ifade etmektedir. Subkütan enjeksiyonun ardından anti Xa aktivitesine dayanarak enoksaparinin biyoyararlanımı % 100'e yakındır. 100-200 mg/ml aralığındaki enjeksiyon hacmi ve doz konsantrasyonu sağlıklı gönüllülerde farmakokinetik parametreleri etkilememektedir. Ortalama maksimum plazma anti-Xa aktivitesi subkütan enjeksiyondan 3-5 saat sonra gözlenmekte ve 20 mg, 40 mg, 1 mg/kg ve 1.5 mg/kg dozlarının tek subkütan uygulanmasını takiben sırasıyla yaklaşık 0.2, 0.4, 1.0 ve 1.3 anti-Xa IU/ml'ye ulaşmaktadır. 30 mg dozda IV bolus ve hemen ardından subkütan yolla 12 saatte bir uygulanan 1 mg/kg, 1.16 IU/mL'lik başlangıç pik anti-Faktör Xa düzeyleri (n = 16) ve sabit durum düzeylerinin %88'ine karşılık gelen bir ortalama etkilenim sağlamıştır. Sabit duruma tedavinin ikinci gününde ulaşılmaktadır. Enoksaparinin farmakokmetiğinin önerilen dozaj sınırlarının üzerinde doğrusal olduğu görülmektedir. Hasta içi ve hastalar arası değişkenlik düşüktür. Sağlıklı gönüllülerde günde bir kez 40 mg ve günde bir kez 1.5 mg/kg rejimlerinin tekrarlanan subkütan uygulanmasını takiben, tek doz sonrasına kıyasla yaklaşık %15 daha yüksek bir ortalama maruz kalma oranı ile sabit duruma 2. gün ulaşılmaktadır. Sabit durum enoksaparin aktivitesi düzeyleri tek doz farmakokinetiği ile iyi öngörülmektedir. Günde iki kez 1 mg/kg rejiminin tekrarlanan subkütan uygulanmasını takiben sabit duruma 3. gün İle 4. gün arasında ulaşılmakta olup, tek doz sonrasına kıyasla yaklaşık %65 daha yüksek bir ortalama maruz kalma oranı ve sırasıyla yaklaşık 1.2 ve 0.52 IU/ml'lik ortalama pik ve taban düzeyleri saptanmaktadır. Enoksaparin sodyum farmakokinetiği dikkate alındığında, sabit durumdaki bu farklılık beklenen bir olgudur ve terapötik sınır içindedir. Subkütan uygulamadan sonra plazma anti-IIa aktivitesi anti-Xa aktivitesine kıyasla yaklaşık 10 kat daha düşüktür. Ortalama maksimum anti-IIa aktivitesi subkütan uygulamadan yaklaşık 3-4 saat sonra gözlenmekte ve günde iki kez 1 mg/kg ve günde bir kez 1.5 mg/kg'ın tekrarlanan uygulanmasını takiben sırasıyla 0.13 IU/ml ve 0.19 IU/ml'ye ulaşmaktadır. Dağılımı:Enoksaparin sodyum anti-Xa aktivitesinin dağılım hacmi yaklaşık 5 litredir ve kan hacmine bağlıdır. Bivotransformasvon:Enoksaparin sodyum esas olarak karaciğerde, depolimerizasyon ve/veya desülfasyon yoluyla son derece azalmış biyolojik potense sahip düşük molekül ağırlıklı türlere metabolize olmaktadır. Eliminasvon: İtrahın, tek subkütan dozdan sonra 4 saat ile tekrarlanan doz uygulamasından sonra 7 saat arasında seyreden bir yarılanma ömrü ile monofazik olduğu görülmektedir.Aktif metabolitlerin renal itrahı uygulanan dozun yaklaşık %10'unu ve aktif ve aktif olmayan metabolitlerin renal itrahı dozun %40'ını temsil etmektedir. HASTALARDAKİ KARAKTERİSTİK ÖZELLİKLERYaslılar: Bir popülasyon farmakokinetik analizinin sonuçlarına göre, enoksaparin sodyumun kinetik profili böbrek fonksiyonu normal olduğunda yaşlı bireylerde genç bireylere kıyasla farklılık göstermemektedir. Bununla birlikte, böbrek fonksiyonu yaşla birlikte düştüğünden, yaşlı hastalarda enoksaparin sodyum eliminasyonu azalma gösterebilir (bkz. bölüm 4.4: Yaşlılarda Hemoraj; bölüm 4.2: Yaşlılar; bölüm 5.2: Böbrek Yetmezliği). Böbrek yetmezliği: Sabit durumda anti-Xa plazma klirensi ile kreatinin klirensi arasında doğrusal bir ilişki gözlenmiştir ve bu, böbrek fonksiyonu bozulmuş hastalarda enoksaparin sodyum klirensinin azaldığını göstermektedir. Sabit durumda eğri altında kalan alan (EAA) ile ifade edilen anti-Xa maruz kalma, tekrarlanan günde bir kez subkütan 40 mg dozlarından sonra hafif böbrek yetmezliği (kreatinin klirensi 50-80 ml/dakika) ve orta derecede böbrek yetmezliği (kreatinin klirensi 30-50 ml/dakika) olan hastalarda küçük bir artış göstermektedir. Ağır böbrek yetmezliği (kreatinin klirensi <30 ml/dakika) olan hastalarda ise, sabit durumda EAA, tekrarlanan günde bir kez subkütan 40 mg dozlarından sonra ortalama %65 oranında anlamlı bir artış göstermektedir (bkz. bölüm 4.4: Böbrek Yetmezliği, bölüm 4.2: Böbrek Yetmezliği). Kilo: Tekrarlanan günde bir kez subkütan 1,5 mg/kg doz uygulamasından sonra, anti-Xa aktivitesi için ortalama EAA sabit durumda obez sağlıklı gönüllülerde (BMI 30-48 kg/m2) obez olmayan kontrollere kıyasla biraz daha yüksek olup, Amax (maksimum anti-Xa aktivitesi) artmamaktadır. Obez bireylerde subkütan doz uygulamasıyla daha düşük bir kiloya göre ayarlanmış klirens söz konusudur. Kiloya göre ayarlanmamış doz uygulandığında, tek bir subkütan 40 mg dozu takiben anti-Xa maruz kalma düzeyinin, normal kilolu kontrollerle karşılaştırıldığında düşük kilolu kadınlarda (< 45 kg) %52 ve düşük kilolu erkeklerde (< 57 kg) %27 daha yüksek olduğu saptanmıştır (bkz. bölüm 4.4: Düşük Kilo). Hemodiyaliz: Bir araştırmada, tek bir 0.25 veya 0.50 mg/kg intravenöz dozunu takiben eliminasyon oranının kontrol popülasyonuna kıyasla benzer ancak EAA'nın iki kat daha yüksek olduğu saptanmıştır. Farmakokinetik etkileşimler: » Eşzamanlı olarak birlikte uygulandığında, enoksaparin ile trombolitikler arasında herhangi bir farmakokinetik etkileşim gözlenmemiştir. 5.3 Klinik öncesi güvenlilik verileriEnoksaparİnin kanserojen potansiyelini değerlendirmeye yönelik olarak hayvanlar üzerinde uzun dönemli bir araştırma yapılmamıştır.Enoksaparİnin, Ames testi, fare lenfoma hücresi ileriye dönük mutasyon testi ve insan lenfosit kromozomal düzensizlik testi dâhil olmak üzere in vitro testlerde ve in vivo sıçan kemik iliği kromozomal düzensizlik testinde mutajenik olmadığı gözlemlenmiştir. Enoksaparİnin, erkek ve dişi sıçanlarda 20 mg/kg/gün subkütan doz düzeylerine kadar fertilite ve reprodüktıf performans üzerinde hiçbir etkisinin olmadığı gözlemlenmiştir. Gebe sıçan ve tavşanlarda, 30 mg/kg/gün enoksaparin subkütan doz düzeylerine kadar teratoloji araştırmaları yapılmıştır. Enoksaparin kaynaklı hiçbir teratojenik etki veya fetotoksisite bulgusuna rastlanmamıştır. Enoksaparİnin antikogülan etkilerinin yanı sıra, 15 mg/kg/gün doz uygulaması ile hem sıçan ve köpekler üzerinde yapılan 13 haftalık subkutan toksisite araştırmalarında hem de 10 mg/kg/gün doz uygulaması ile sıçan ve maymunlar üzerinde yapılan 26 haftalık subkutan ve intravenöz toksisite araştırmalarında hiçbir yan etki bulgusuna rastlanmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiEnjeksiyonluk Su6.2 Geçimsizlikler Subkütan Enjeksiyon:Diğer ürünler ile karıştırılmamalıdır.6.3 Raf ömrü36 ay6.4 Saklamaya yönelik özel tedbirler25°C'nin altmdaki oda sıcaklığında ve ambalajında saklayınız. Dondurmayınız.6.5 Ambalajın niteliği ve içeriği Sabit iğneli cam:Tip I cam hazneRef: BD Hypak® şırıngalar ya da BG şırıngalar ya da MG şırıngalar Tedarikçi: BD ya da BG ya da MG Paslanmaz Çelik Z6CN18/10 İğne koruması (sert plastik kapaklı):Sentetik poliizopren kauçuk ref. W7025/65, gri, West şirketi (latekssiz), Tedarikçi: BD ya daStiren butadiyen kauçuk, ref. FM27/0, gri, Helvoet (latekssiz), Tedarikçi: BD ya da Sentetik poliizopren kauçuk, ref. 4800 GS, gri, Stelmi (latekssiz), Tedarikçi: BD ya da Stelmi Tıpa:Klorobutil kauçuk-ref. PH701/50/C, siyah, West şirketi (latekssiz), Tedarikçi: BD ya daBromobutil kauçuk - ref. FM257/7, siyah, Helvoet (latekssiz), Tedarikçi: BD ya da Klorobutil kauçuk- ref. 6422NR, siyah, Stelmi (latekssiz), Tedarikçi: Stelmi 6.6 Beşeri Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Subkütan enjeksiyon:Enoksaparin sodyum, venöz tromboembolik hastalığın önlenmesi, derin ven trombozu tedavisi, kararsız anjina ve Q dalgasız miyokard infarktüsü tedavisi için yalnızca Subkütan enjeksiyon yoluyla uygulanır.Arteryel hat enjeksiyonu:Hemodiyaliz sırasında vücut dışı dolaşımda trombus oluşumunu önlemek amacıyla, bir diyaliz devresinin arteryel hattı yoluyla uygulanır.İntramüsküler yolla uygulanmamalıdır. Tek kullanımlık enjektör hemen kullanıma hazırdır. Subkütan enjeksiyon tekniği:Önceden doldurulmuş tek kullanımlık şırıngalar derhal kullanım için hazırdır.Enjeksiyon tercihen hasta yatar durumdayken yapılmalıdır. Enoksaparin sodyum derin subkütan enjeksiyon yoluyla uygulanır. Önceden doldurulmuş 2000 anti-Xa ve 4000 anti-Xa şırıngaları kullanırken ilaç kaybmı önlemek için enjeksiyondan önce şırıngadan hava kabarcıklarını dışarı atmaya çalışmayınız. Uygulama sol ve sağ anterolateral veya posterolateral abdominal duvar arasında dönüşümlü olarak yapılmalıdır. İğne başparmak ile işaret parmağı arasında bastırmadan tutulan deri kıvrımına dikey olarak sonuna kadar batınlır. Bu deri kıvrımı enjeksiyon tamamlanıncaya kadar bırakılmamalıdır. Uygulamadan sonra enjeksiyon yerini ovuşturmayınız. 7. RUHSAT SAHİBİSanofi aventis İlaçlan Ltd. Şti.Büyükdere Cad. No: 193, Levent - İstanbul 8. RUHSAT NUMARASI:109/909. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ:İlk ruhsat tarihi:27.04.2001 Ruhsat yenileme tarihi: 27.04.201110. KÜB'ÜN YENİLENME TARİHİ:16 |
İlaç BilgileriClexane 4000 Anti-xa Iu/0.4 Ml Kullanıma Hazır En...Etken Maddesi: Enoksaparin Sodyum Atc Kodu: B01AB05 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.