Tuzon %0.05 Burun Spreyi Kısa Ürün BilgisiSolunum Sistemi » Burunla İlgili İlaçlar » Topikal Dekonjestanlar ve Diğer Nazal İlaçlar » Kortikosteroidler » MometazonNazal KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBI URUNUN ADITUZON %0.05 burun spreyi2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:50.005mometazon furoat monohidrat içerir.
.75 mcg Yardımcı maddeler:Benzalkonyum klorür (% 50 çözelti)
0.40 mg/g Yardımcı maddeler için, Bkz. 6.1. 3. FARMASÖTİK FORMBurun spreyi.Beyaz- beyazımsı, homojen görünümlü kollaidal süspansiyon. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarTUZON, erişkinler, adolesanlar ve 6-11 yaş arasındaki çocuklarda mevsimsel süren alerjik rinit semptomlarının tedavisinde endikedir.
yıl boyu ik rinitin
ve TUZON, erişkinler ve 12 yaş ve üzerindeki adolesanlarda mevsimsel aler profilaksisinde endikedir. TUZON, 3-6 yaş arasında alerjik rinit tanısı almış olan çocuklarda kullanılabilir. Profilaktik tedaviye polen mevsiminin beklenen başlangıcından 2-4 hafta önce başlanmalıdır. TUZON, ayrıca, 18 yaş veya üzerindeki erişkinlerde nazal poliplerin, konjesyon ve koku duyusu kaybı dahil ilgili semptomların tedavisinde kullanılır. 4.2. Pozoloji ve uygulama şekli Pozoloji:İlk kullanımda veya sprey pompası 14 gün veya daha uzun bir süre kullanılmamışsa, kullanımdan önce sprey pompasını ayarlamak için, ilaç, düzgün bir şekilde püskürdüğü görülünceye kadar, genellikle 10 kez püskürtülmelidir. Her püskürtme 50 mikrogram mometazon furoata eşdeğer mometazon furoat monohidrat içeren yaklaşık 100 mg mometazon furoat süspansiyonu içerir. Eğer sprey pompası 14 gün veya daha uzun süreyle kullanılmamış ise, bir sonraki kullanımdan önce, 2 kez püskürtülerek, ilaç, düzgün bir şekilde püskürdüğü görülünceye kadar yeniden ayarlanmalıdır.Mevsimsel alerjik ya da yıl boyu süren rinit:Erişkinler (yaşlı hastalar dahil) ve adolesanlar:Profilaksi ve tedavi için genellikle önerilen günlük doz her burun deliğine günde bir kez iki püskürtme (50 mikrogram/1 pjskürtme) olmak üzere toplam 200 mikrogram'dır. Semptomların kontrol altına alınmasından sonra idame dozu her burun deliğine bir püskürtme olmak üzere günde toplam 100 mikrogram'a düşürülebilir.Semptomlar yeterince kontrol altına alınamamışsa, günlük maksimum doz her burun deliğine dört püskürtme olmak üzere toplam 400 mikrogram'a çıkarılabilir. Semptomların kontrol altına alınmasından sonra dozun düşürülmesi önerilir. 3-11 yas arasındaki çocuklar:Önerilen günlük doz her burun deliğine günde l|>ir kez bir püskürtme (50 mikrogram/1 püskürtme) olmak üzere toplam 100 mikrogram'dır.TUZON, mevsimsel alerjik rinitli bazı hastalarda ilk dozdan sonra 12 saat içerisinde klinik etkinlik başlangıcı göstermektedir. Tam tedavi faydası ilk 48 saat içerisinde sağlanamayabilir. Bundan dolayı hasta tam tedavi faydası sağlayabilmek için tedaviye devam etmelidir. Nazal polipozis tedavisi:Erişkinler (yaslı hastalar dahil) ve 18 yasında veva daha büyük adolesanlar:Önerilen günlük doz her burun deliğine günde iki kez iki püskürtme (50 mikrogram/1 püskürtme) olmak üzere toplam 200 mikrogram'dır. Semptomlar 5-6 hafta içinde yeterince kontrol altına alınamamışsa, günlük maksimum doz her burun deliğine günde i ki kez iki püskürtme ile toplam 400 mikrogram'a çıkarılabilir. Doz, semptomların etkin kontrolünü sağlayan en düşük doza ayarlanmalıdır. Günde iki kez uygulamayla 5-6 hşfta içinde semptomlarda hiçbir iyileşme görülmezse, alternatif tedaviler düşünülmelidir. Mometazon furoatın nazal polipozis tedavisi için çalışmaları 4 ay sürelidir. İlk dozu uygulamadan önce, pompayı iyice çalkalayınız ve ilaç, düzgün bir şekilde püskürdüğü görülünceye kadar 10 kez püskürtünüz. Pompa 14 gün veya daha uzun süre kullanılmamışsa, pompayı ilaç, düzgün bir şekilde püskürdüğü görülünceye ksdar 2 kez püskürtünüz. Her kullanımdan önce sprey pompasını çalkalayınız. İlk kullanımdan sonra 2 ay içerisinde ya da belirlenen sayıdaki püskürtmeden sonra sprey pompasını atabilirsiniz. Uygulama sıklığı ve süresi:Uygulama şekli:TUZON, burun deliklerine püskürtülerek kullanılır.Şişeyi yavaşça çalkalayınız ve kapağını çıkarınız. İlk kullanımda, kullanımdan önce sprey pomp a; için, 10 kez ya da ilaç düzgün bir şekil|d görülünceye kadar püskürtülmelidir. 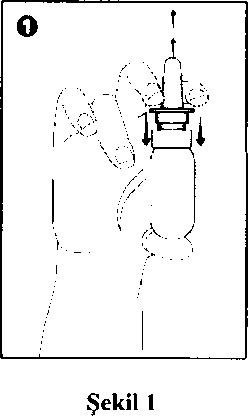
ısını ayarlamak le püskürdüğü Göze püskürtülmemelidir.Eğer bir haftadan uzun süre kullanıldı kullanırken iki kez ya da düzgün bir şekil görülünceye kadar püskürtülerek ayarlanmalıdır
amışsa tekrar de püskürdüğü . (Şekil 1) 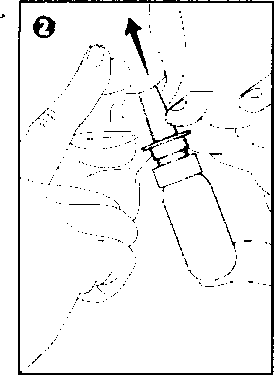
Şekil 2
öne eğip, sprey er burun deliğine
dil
aılasındaki duvara) vivetlice bir kez
mz. ?ir mendil ile silip
Burnunuzu yavaşça temizleyiniz. Bir burun deliğini kapayınız. Başınızı hafifçi şişesini dik tutarak sprey pompasının ucunu yerleştiriniz. (Şekil 2) Doğrudan septuma (iki burun deliği püskürtmeyiniz. Hafifçe burnunuzdan nefes alırken ku püskürtünüz. (Şekil 2) Nefesinizi ağzınızdan veriniz. Gerekli durunjlarda aynı işlemi aynı burun deliğine bir kez daha uygulayınız. Diğer burun deliği için de aynı uygulamayı yap|ı Püskürtme işlemi bitince spreyin ucunu temiz kapağını kapatınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/karaciğer yetmezliği:Böbrek ya da karaciğer yetmezliği olan hastalar için veri bulunmamaktadır.Pediyatrik popülasyon:Nazal kortikosteroidlerin sistemik etkileri, özellikle uzun sürelerle yüksek kullanımda görülebilir. Ruhsatlı dozlarda nazal kortikosteroidler alan çocuklarda yavaşlama bildirilmiştir. Nazal kortikosteroidler ile uzun süre tedavi edilen çocu uzunluğunun düzenli olarak takip edilmesi önerilir. Büyüme yavaşlar|s kortikosteroid dozunun mümkünse, etkin semptom kontrolü sağlayan en indirilmesi amacıyla tedavi gözden geçirilmelidir. Ayrıca hastanın bir çocuk uzmanına şevki düşünülmelidir.
dozlarda büyümede darda boy a, nazal şük doza Hastalıkları
dıı Geriyatrik popülasyon:Geriyatrik popülasyon için nazal polipozis tedavisi erişkinler gibidir.4.3. KontrendikasyonlarTUZON'un bileşenlerinden herhangi birine aşın duyarlılık durumunda kullanılmamalıdır.TUZON, nazal mukoza ile ilişkili tedavi edilmemiş lokalize enfeksiyonların [varlığında kullanılmamalıdır. Kortikosteroidlerin yara iyileşmesine olan inhibitör etkisinden dolayı yakın geçmişte burun ameliyatı veya travması geçirmiş olan hastalarda yara iyileşmeden önce nazal kortikosteroidler kullanılmamalıdır. 4.4. Özel kullanım uyarıları ve önlemleriMometazon furoat, aktif veya latent solunum yolu tüberküloz enfeksiyonun, tedavi edilmemiş mantar, bakteri veya sistemik virüs enfeksiyonları veya oküler herpeş simpleks enfeksiyonu olan hastalarda dikkatle kullanılmalıdır.Mometazon furoat ile 12 aylık bir tedaviden sonra nazal mukozada herhangi belirtisi gözlenmemiştir; aynı zamanda mometazon furoat nazal mukoza) histolojik fenotipine döndürme eğilimi göstermiştir. Her uzun süreli tedavide o
bir atrofı ı normal duğu gibi birkaç ay veya daha uzun süre mometazon furoat kullanan hastalar muhtemel naz:il mukoza değişikliği yönünden kontrol edilmelidir. Eğer burun veya farenkste lokalime mantar enfeksiyonu gelişirse, mometazon furoat ile tedavinin kesilmesi veya uygun tedavi uygulaması gerekebilir. Nazofarenkste inatçı iritasyon mometazon furoat ile tedavinin kesilmesini gerektirebilir. Mometazon furoat hastaların çoğunda burun semptomları üzerinde kontrol sağ bununla birlikte uygun başka bir tedavinin eş zamanlı kullanımı diğer sempt (özellikle göz semptomları) ilave iyileşme sağlayabilir.
ayacaktır; larda da
om Mometazon furoatın uzun süre kullanılması ile hipotalamo-hipofızeal-adrenal (ir.süpresyonuna ilişkin hiç bir delil yoktur. Bununla beraber uzun süren kortikosteroid kullanımından mometazon furoat kullanımına geçen hastalar için ilgi gerekir. Bu hastalarda sistemik kortikosteroidin kesilmesi, HPA aksın fo düzelinceye kadar bir kaç ay adrenal yetmezlik belirtileri ile sonuçlanabilir. B adrenal yetmezlik belirtileri gösterirlerse sistemik kortikosteroid tedavisine dev ve diğer tedavi usulleri ve gerekli önlemler uygulanmalıdır.
PA) aksın sistemik dikkatli bir aksiyonları u hastalar edilmeli
am Sistemik kortikosteroidlerden mometazon fiıroata geçişte bazı hastalar semptomlarda hafifleme görülmesine karşın sistemik kortikosteroid semptomlarından (örn. eklem ve/veya adale ağrısı, yorgunluk ve başlangıçta şikayetçi olabilirler. Bu durumda mometazon furoat ile tedaviye devam önerilmelidir. Böyle bir geçiş aynı zamanda aleıjik konjunktuvit veya ekzema var olan ve sistemik kortikosteroid tedavisi ile süprese olmuş alerjik duruml çıkmasına da neden olabilir.
da nazal kesilme depresyon) etmeleri i önceden arın açığa
gibi Tek taraflı polipler, kistik fıbrozla ilişkili polipler veya burun boşluklarını tam eden poliplerin tedavisinde mometazon furoatın güvenlilik ve etkililiği çalışılmaniı
len bloke ıştır.
am Görünümleri olağandışı veya düzensiz olan tek taraflı polipler, özellikle de ülserlime veya kanama olanlar daha ileri düzeyde tetkik edilmelidir. Nazal kortikosteroidlerin sistemik etkileri, özellikle uzun sürelerle yüksek kullanımda görülebilir. Ruhsatlı dozlarda nazal kortikosteroidler alan çocuklarda yavaşlama bildirilmiştir.
dozlarda büyümede Kortikosteroid kullanan potansiyel olarak immüno süprese olmuş hastalar bazı enfeksiyonlara (örn. su çiçeği, kızamık gibi) yakalanma riskine karşı uyarılmalj ve böyle bir durumla karşılaşıldığında tıbbi yardım alınmasının önemi belirtilmelidir. İntranazal kortikosteroid kullanımını takiben nazal septum perforasyonu veya ihtraoküler basınçta artış çok nadir olarak bildirilmiştir. Mometazon furoatın, 18 yaşından küçük çocuklarda ve adolesanlarda nazal tedavisindeki güvenlilik ve etkinliği üzerinde çalışma yapılmamıştır.
poliplerin Nazal kortikosteroidler ile uzun süre tedavi edilen çocuklarda boy uzunluğun olarak takip edilmesi önerilir. Büyüme yavaşlarsa, nazal kortikosteroid mümkünse, etkin semptom kontrolü sağlayan en düşük doza indirilmesi amaç gözden geçirilmelidir. Ayrıca hastanın bir çocuk hastalıkları uzmanı düşünülmelidir.
düzenli dozunun tedavi tıa şevki un
ıyla Tavsiye edilenden daha yüksek dozlarla tedavi klinik yönden anlamlı adrenal süpresyona yol açabilir. Önerilenden daha yüksek dozların kullanıldığına dair kanıtlar varsa, stres veya cerrahi dönemlerinde ilave sistemik kortikosteroid kullanımı düşünülmelidir. Yardımcı madde: Benzalkonyum klorür: TUZON, benzalkonyum klorür içermektedir. 1 püskürtmede 0,4 mg'a eşdeğer benzalkonyum klorür bulunur. Bu miktarın bronkospazma neden olması beklenmemektedir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriMometazon furoatın, loratadin ile birlikte klinik etkileşim çalışması yapılmıştır. Bu çalışmalarda, mometazon furoatın plazma konsantrasyonları düşük ölçüm limiti] 50 pg/ml olan hassas analizlerle ölçülemez düzeydedir.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi C'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin yeterli vejri mevcut değildir.Gebelik dönemiGebe kadınlarda yeterli ve kontrollü çalışma yapılmamıştır. Klinik olarak Önerilen maksimum dozun intranazal uygulamasından sonra mometazon plazma konsantrasyonları ölçülememektedir; bu nedenle fetusun maruz kaldığı mometazonun ihmal edilebilir ve üreme toksisitesi potansiyelinin çok düşük olması beklenir.Laktasyon dönemiDiğer nazal kortikosteroid preparatları ile olduğu gibi mometazon furoatın geb^, emziren veya gebelik riski taşıyan kadınlarda kullanımına karar verilirken anne, fetüs ve bebeğe verilebilecek olası zararlar, beklenen yararlarla karşılaştırılmalıdır. Gebeliği sırasında kortikosteroid tedavisi gören annelerin doğan bebekleri hipoadrenalizm yönünde|n dikkatle izlenmelidir.Üreme yeteneği/FertiliteMometazon furoatın insanlar üzerindeki üreme yeteneğine ilişkin yeterli veji mevcut değildir.4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerine etkisi bilinmemektedir.4.8. İstenmeyen etkilerKlinik çalışmalarda alerjik rinitli yetişkin ve adolesan hastalarda rapor edilen tedaviye bağlı istenmeyen olaylar aşağıda belirtilmiştir:Çok yaygın (> 1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1000 ila <1/100), seyrek (> 1/10000 ila <1/1000), çok seyrek (< 1/10000) Solunum, göğüs bozuklukları ve mediastinal hastalıklar:Yaygın:Epistaksis, farenjit, nazal yanma, nazal iritasyon, nazal ülserasyonGenel bozukluklar ve uygulama bölgesine ilişkin bozukluklar:Yaygın:Baş ağrısıKas-iskelet bozuklukları ve bağ doku ve kemik hastalıkları:Bilinmiyor:Çocuklarda uzun süreli kullanımda büyüme hızında yavaşlama Nazal kortikosteroidler ile uzun süreli tedavi alan çocukların boy uzunluğunun düzenli takip edilmesi önerilir.Göz Hastalıkları:Bilinmiyor:Göz basıncında artışa (glokom) bağlı olarak görme bozukluklanEpistaksis genelde hafif şiddette olup kendiliğinden geçmiştir. İnsidansı plaseboy daha yüksek (%5) olmakla birlikte karşılaştırılan aktif kontrol nazal kortikost (%15'e kadar) kıyaslanabilir veya daha düşüktür. Diğer tüm etkilerin insidansı karşılaştırılabilir oranlardadır.
a kıyasla eroidlerle ^lasebo ile Pediyatrik hastalarda, advers etki insidansı, ör. Baş ağrısı (%3), epistaksis (%6 iritasyon (%2) ve hapşırma (%2) plasebo ile kıyaslanabilir düzeydedir.
burunda anı aşırı anaflaksi Mometazon furoat monohidratın intranazal uygulamasından sonra nadiren duyarlılık reaksiyonu (bronkospazm, dispne gibi) meydana gelebilir. Çok nadireıjı ve anjiyoödem bildirilmiştir. Çok nadir olarak tat ve koku alma bozukluğu bildirilmiştir. Nazal Polipozis:Nazal polipozis için tedavi edilen hastalarda, advers olayhırın genel insidansı, plaseboyla kıyaslanabilir nitelikte olup alerjik rinitli hastalarda gözlemlenenlere benzerdir. Polipozis için yürütülen klinik çalışmalarda hastaların %1 veya daha [fazlasında bildirilen tedaviye bağlı advers olaylar şunlardır:Solunum, göğüs bozuklukları ve mediastinal hastalıklar:Çok yaygın:Yaygın:Üst solunum yolu enfeksiyonu günde bir kez 200 mikrogram ile, burun] kanaması günde bir kez 200 mcg ileYaygın olmayan:Gastrointestinal bozukluklar:
|
İlaç BilgileriTuzon %0.05 Burun SpreyiEtken Maddesi: Mometazon Furoat Monohidrat Atc Kodu: R01AD09 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.