Mitomycin-c Kyowa 10 Mg Enjektabl Flakon Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Antineoplastik İlaçlar (Kanser İlaçları) » Sitotoksik Antibiyotikler » Diğer Sitotoksik Antibiyotikler » Mitomisin KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADIMİTOMYCİN^C Kyowa 10 mg Enjektabl Flakon Steril-apirojen2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:10 mg Mitomisin-C içerir.Yardımcı madde(ler):Sodyum Klorür 240 mgYardımcı maddeler için bölüm 6.1' e bakınız. 3. FARMASÖTİK FORMKullanılmadan önce sulandırılan enjeksiyonluk çözelti Lastik tıpalı cam flakonda, mavi-mor toz4. KLİNİK ÖZELLİKLER4.1. Terapötik EııdikasyonlarMesane kanserinde sistemik ve mesane içi uygulamalarda, meme kanseri, baş-boyun yassı hücreli kanserleri, mide ve pankreas kanserleri, prostat kanseri, serviks uterinin yassı hücreli kanseri.4.2. Pozoloji ve Uygulama Şekli Pozoloji / uygulama sıklığı ve süresi:İniravenöz uygulamaİntravenöz uygulama mümkün olduğunca yavaş ve ekstravazasyonu önlemek için çok dikkatli olarak yapılmalıdır. Mutad doz aralığı 4-10 mg (0.06- 0.15 mg/kg) olup diğer ilaçlarla kombinasyon şeklinde ya da kemik iliği yenilenmesine bağlı olarak 1 -6 haftalık intervalle uygulanır. S}Kombinasyon tedavisinde genel doz şeması 10 mg /m vücut yüzey alanı şeklindedir ve doz ihtiyaç duyulduğunda tekrarlanır. Tek başına ya da kombinasyon tedavisinde dozun 40-80 mg (0.58-1.2 mg/kg) olarak uygulanmasıyla yeterli cevap sağlanmıştır. Daha yüksek doz rejimi 2 mg/ kg olarak toplam kümülatif doz şeklinde tek başına ya da kombinasyon olarak da uygulanabilir. intraarteriyel uygulamaSpesifik dokular içine uygulamada, MİTOMYCİN-C intraarteriyel yolla doğrudan tümör içine verilebilir. Doz azaltılmasıKümülatif miyelosüpresyondan dolayı hastalar her bir uygulamadan sonra gözetim altında tutulmalı ve toksik etkilerin ortaya çıkması durumunda doz azaltılmasına gidilmelidir. 0.6 mg/kg'dan yüksek dozların, miyelosüpresyona yol açma açısından düşük dozlardan daha etkili ve daha toksik olmadığı görülmüştür. Hastalığın ilerlemesiİki tedavi rejimi arasında hastalığın ilerlemesi durumunda, minimum cevap elde edilinceye kadar ilaç durdurulmalıdır. Mesane tümörlü hastalarda kullanımYüzeyel mesane tümörünün tedavisinde mutad doz 20-40 mg (20-40 mİ çözelti şeklinde)'dır ve haftada bir ya da 3 haftada bir üretral kateter yardımıyla mesane içine instilasyon yoluyla uygulanır. Çözelti mesanede minimum 1 saat tutulmalıdır. İlacın tutulduğu süre boyunca hastanın konumu her 15 dakikada bir değiştirilerek MİTOMYCİN-C'nin tüm mesane epiteline temas etmesi sağlanmalıdır. Mesanenin boşaltılması esnasında, kasık ya da genital bölgeden kaynaklanabilecek kontaminasyon açısından gerekli önlemler alınmalıdır. Yüzeyel mesane tümörünün tekrarlanmasının önlenmesi amacıyla çeşitli dozlar uygulanabilir. Bu dozlar 20 mg (20 mİ çözelti şeklinde) her 2 haftada bir ve 40 mg (40 mİ çözelti şeklinde) ayda bir ya da 3 ayda bir şeklinde bir üreter kateter yardımıyla mesaneye instilasyon şeklindedir. Tüm vakalarda doz, hastanın yaşı ve durumuna uygun şeklide ayarlanmalıdır. Uygulama şekli:İntravenöz olarak uygulanır. Gerektiği takdirde, intraarteriyel veya intravezikal yolla erişkinlerde uygulanabilir.Özel popülasyonlara ilişkin ek veriler:BÖbrek/Karaciğer yetmezliği:Advers reaksiyonlar artabileceğinden doz azaltılmalı veya uygun önlemler alınmalıdır. Peritonal diyaliz altındaki hastalarda gerekli dozun % 75'i uygulanmalıdır.Pediyatrik popülasyon:Prematüre bebeklerde, yeni doğanlarda, bebeklerde ve çocuklarda MİTOMYCİN-C'nin güvenliği kanıtlanmamıştır.Geriyatrik popülasyon:Yaşlı hastalarda fizyolojik fonksiyon azaldığından süresi uzamış kemik iliği depresyonu ve renal bozukluklar görülmesi mümkündür. Bu yüzden MİTOMYCİN-C enjeksiyonu alan hastalar yakından izlenip, doz ve doz aralıklarına Önem verilerek yaşlı hastalara dikkatle uygulanmalıdır.4.3. KontrendikasyonlarıMİTOMYCİN-C'ye karşı geçmişlerinde aşın duyarlılık bulunan hastalarda, platelet sayısının 75000/mm3, lökosit sayısının 3000/ mm3, kreatinin değerinin 1.7 mg/dl olduğu hastalarda ve protrombin zamanı veya kanama zamanının uzadığı hastalarda, koagülasyon bozukluklarında, ciddi enfeksiyonlarda ve gebelikte kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriMİTOMYCİN-C aşağıdaki hastalara çok dikkatli şekilde uygulanmalıdır: Karaciğer ya da böbrek bozuklukları olan hastalar (advers reaksiyonlar artabilir) Kemik iliği depresyonu bulunan hastalar (bu ürünün uygulaması kemik iliği depresyonunu şiddetlendirebilir) Enfeksiyon hastalıkları bulunan hastalar (bu ürünün uygulaması kemik iliği depresyonu sebebiyle enfeksiyonu ağırlaştırabilir) Varicella'lı hastalar (ölümcül sistemik bozukluklar meydana gelebilir) MİTOMYCİN-C sitotoksik kanser kemoterapisinde deneyimli bir hekim gözetiminde uygulanmalıdır. Doku ekstravazasyonuyla lokal ülserasyon ve selülitis ortaya çıkabileceğinden intravenöz enjeksiyon ve uygulama süresince azami dikkat gösterilmelidir. Ekstravasazyon ortaya çıkması durumunda etkilenen bölgeye derhal % 8.4'lük sodyum bikarbonat çözeltisinin uygulanması ve ardından 4 mg deksametazon enjeksiyonu önerilmektedir. Sistemik olarak uygulanacak 200 mg Vitamin B6 enjeksiyonunun, meydana gelen tahribata karşı dokuların yenilenmesini desteklediği belirtilmiştir. Hastalar, sık laboratuvar kontrolleriyle (hematolojik test, karaciğer fonksiyon testi ve böbrek fonksiyon testi vb. gibi) dikkatlice izlenmelidirler çünkü kemik iliği depresyonu gibi ciddi yan etkiler meydana gelebilir. Herhangi bir bozukluk görüldüğü takdirde, dozu azaltmak veya uygulamayı ertelemek gibi yeterli düzeyde önlemler alınmalıdır. Ek olarak, uzun süreli uygulama, yan etkilerin artmasına neden olabileceğinden dolayı büyük bir dikkat ile yapılmalıdır. Lökosit sayısı 4000/mm3, platelet sayısı 150000/ mm3 veya altında ise veya bu değerlerde progresif bir düşme gözlendiyse hematolojik düzelme oluşuncaya kadar ilaç kesilmelidir. Pulmoner toksisite geliştiyse ilaç kesilmelidir. Enfeksiyon ve kanama eğiliminin belirginleşmesi veya ağırlaşması olasılığına karşı özel önlemler gerekir. Sistemik MİTOMYCİN-C uygulanan hastalarda, öncelikle mikroanjiopatik hemolitik anemi, trombositopeni ve geri dönüşümsüz böbrek yetmezliğiyle ortaya çıkan ciddi komplikasyonlar gösteren ölümcül olabilen Hemolitik Üremik Sendrom (HUS) rapor edilmiştir. HUS, sistemik tedavinin herhangi bir zamanında, MİTOMYCİN-Cnin tek ajan ya da diğer ilaçlarla kombine şekilde kullanımıyla görülmesine rağmen, vakaların birçoğunda 60 mg'ın üzerindeki MİTOMYCİN-C dozlarının uygulanmasıyla ortaya çıkabilmektedir. Kan ürünü preparatlanmn transfuzyonuyla bu semptomların şiddetlenebileceği ilişkilendirilmektedir. Sendromun insidansı belirtilmemiştir. MİTOMYCİN-C ve diğer antikanser ajanlarını kombine kullanan hastalar akut lösemi veya myelodispastik sendrom (MDS) oluşma ihtimaline karşı uyarılmalıdır. MİTOMYCİN-C'nin uygulanması sırasında yan etkilerin özellikle başlangıcına dikkat edilmeli ve enjeksiyon uygulaması çok dikkatli yapılmalıdır. Yapılan hayvan çalışmalarında, subkutan uygulandığı farelerde ve intraperitonal ya da intravenöz uygulandığı sıçanlarda çeşitli tümör oluşumu rapor edilmiştir. İntravenöz uygulama vasküler ağrı, flebit, tromboz, enjeksiyon yerinde sertleşme ve nekroza neden olabileceğinden MİTOMYCİN-C olabildiğince yavaş enjekte edilmeli, uygulama yeri ve yöntemine büyük dikkat gösterilmelidir. İlacın damar dışına çıkması enjeksiyon yerinde ülserasyon, selülitis, sertleşme veya nekroza yol açabileceğinden ilacın damar dışına çıkmasından kaçınmak için ilaç, dikkatli bir şekilde enjekte edilmelidir. İntraarteriyal uygulama, deri/kas nekroz öncülüğü olan bölgeyi içeren yerde ülser, sertleşme, ağrı, kırmızılık, eritem, kabarcık ve erozyon gibi deri bozukluklarına sebep olabilir. Semptomlardan herhangi biri geliştiğinde uygulama durdurulmalı ve uygun önlemler alınmalıdır. Özellikle parankimatöz karaciğer bozuklukları, bilioma, kolanjit (hatta sklerozan) ve safra kanalı nekrozları ilacın hepatik arteriyal uygulanmasından sonra meydana gelebilir. Hepatik artere uygulamada ilacın hedeflenen alandan diğer alanlara akmasından dolayı gastroduodenal ülser, hemoraji, perforasyon meydana gelebilir, kateter sonunun konumu ve ilacın dağıldığı bölge fotoğrafla ya da diğer ölçümlerle konfirme edilmeli, olası sapmaya veya kateterin değiştirilmesi ve infuzyon oranına dikkat edilmelidir. Semptomlardan herhangi biri geliştiğinde uygulama durdurulmalı ve uygun önlemler alınmalıdır. Pazarlama sonrası verilerden intravezikal uygulama sonrasında mesane fıbrozu/kasılması, bazı seyrek vakalarda ise sistektomiye gerek duyulduğu rapor edilmiştir. Mesane nekrozu ya da penil nekroz da rapor edilmiştir (Bkz. bölüm 4.8 Advers Etkiler). Hastalar, intravezikal uygulama sonrasındaki ürinasyonun ardından kontakt dermatitin engellenmesi açısından ellerin ve genital bölgenin yıkanması konusunda uyarılmalıdır. Bu tıbbi ürün her bir flakonunda 240 mg sodyum klorür ihtiva eder. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriMİTOMYCİN-C enjeksiyonu aşağıda belirtilen ilaçlarla birlikte kullanıldığında dikkatli olunmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:Mevcut veri bulunmamaktadır.4.6. Gebelik ve Laktasyon Genel tavsiyeGebelik Kategorisi D'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü(Kontrasepsiyon)Gebe olduğundan şüphelenilen kadınlara uygulanması önerilmemektedir.Gebelik dönemiMitomisin-C enjeksiyonu gebe hastalara uygulanması önerilmemektedir. Farelerle yapılan hayvan çalışmaları, bu ilacın gelişimle ilgili inhibisyon, yarık damak, kuyruğun tamgelişmemesi, çenelerin tam gelişmemesi, bir ya da birkaç parmağın doğuştan olmayışı (ektrodaktili) v.b. gibi bu ilacın teratojenitesini göstermiştir. Laktasyon dönemiEmziren anneler, tedavi süresince emzirmeyi durdurmalıdırlar MİTOMYCİN-C süte geçer ve emziren annelerde kullanımı kontrendikedir.Üreme yeteneği/ FertiliteÜreme yeteneğine sahip yaşlardaki hastalara bu ilacın uygulanması gerektiğinde ilacın üreme organları üzerindeki potansiyel etkisi göz önünde bulundurulmalıdır.4.7. Araç ve makine kullanımına etkisiMİTOMYCİN-C yorgunluk ve güçsüzlüğe neden olabilir. Bu belirtilerin görüldüğü hastalar araç ve makine kullanmamaları konusunda uyarılmalıdır.4.8. İstenmeyen etkilerRapor edilen istenmeyen etkiler aşağıdaki sıklık derecesine göre listelenmiştir.Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Sistemik uygulama ile görülen aclvers etkilerEnfeksiyon ve infestasyonlar
Bilinmiyor: Bakteriyel enfeksiyon, viral veya mantar enfeksiyonu, sepsis ve septik şok |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
'^\Parametre |
Yanlanma ömrü (dak) |
AUCOoo (^ıg/mL.dak) | |
|
Doz |
V/2 |
rap | |
|
10 mg IV |
1.3 |
32*9 |
10.0 |
|
20 mg IV |
4.7 |
41.2 |
42.8 |
|
30 mg IV |
5.2 |
50.2 |
98.9 |
|
-^Parametre |
n |
CL |
V, |
V2 |
|
Doz |
|
(mL/dak/m2) |
(L/m2) |
(L/m2) |
|
6-8 |
9 |
314.7 |
9.0 |
23.0 |
|
10 |
9 |
320.8 |
9.6 |
32.2 |
|
15-20 |
12 |
355.6 |
10.1 |
23.6 |
Darılım:
Dokularda dağıinn (farelerle yapılan deney verileri)
Mitomisin-C konsantrasyonu, kanserli sıçanlara 8 mg/kg Mitomisin-C intravenöz olarak uygulandıktan 5 dakika sonra en yüksek akciğer, takiben deri, böbrek, kas, kalp, ince bağırsak, dalak, tümör, mide ve sonra karaciğer bulunmuştur. Mitomisin-C. SSS'e büyük olasılıkla geçmemektedir.
Protein bağlama oram (denge diyaliz ile)
|
Konsantrasyon (|Ag/mL) |
0.1 |
1.0 |
10.0 |
|
Bağlama oranı (%) |
12.8 |
9.4 |
8.4 |
Bivotransformasvon:
Mitomisin-C büyük ihtimalle karaciğerde sonradan aktive veya inaktı ve olan redüktant bir maddeye metabolize olur. (US in vitro çalışma verisi)
Eliminasvon:
İdrarda değişmemiş Mitomisin-C' nin itrah oranı, kanser hastalarında 10-30 mg Milomisin-C'nin bir defada enjekte edildikten sonraki 4 saat içinde dozun % 4,3-8,8'i olmuştur.
DoSrusaHık/do£rusal olmayan durum:
Mevcut veri bulunmamaktadır.
5.3. Preklinik güvenlik bilgileri
Tek doz toksisite (LD 50 mg/kg):
|
-Uygulama yolu Hayvan türleri ~ ^ |
I.V |
i.p. |
p.o. |
|
Fare (ICR türü farelerde) |
4.3 |
8.4 |
53.5 |
|
(ddy türü farelerde) |
8.2 |
8.4 |
26.8 |
|
Sıçan |
3.1 |
5.0 |
67.4 |
|
Tavşan |
3.4 |
N/A |
N/A |
|
Köpek |
0.72 |
N/A |
N/A |
Sıçanlara, 6 ay için günlük 0,4; 1,2; 3,6; 11; 33 veya 100 |xg/kg' lık doz intraperitonal olarak uygulandığında, 1 i ng/kg ve daha yüksek doz grubundaki hayvanlarda kilo artışının önlendiği. 100 |ig/kg grubunda ise istemli hareketlerde ve sklerotik gelişimde azalma ile 130 gün sonra ölümler kaydedilmiştir. Hematolojik ve biyokimyasal laboratuvaı* testlerinde (uygulamadan sonra 150. günde), erkekler ve 100 f.ıg/kg 'lık dişi grubunda, WBC'de (lökosiı sayısı) azalma eğilimi, K+yükselmesi, BUN ve NPN değerlerinde yükselme. 100 ^g/kg'lık erkek grubunda ise eritropeni, hematokrit miktarında azalma, hemoglobin konsantrasyonunda düşme, retikülositoz ve serum proteininde azalma ortaya çıkmıştır. Histopatolojik testlerde (uygulamadan sonra 150. günde), erkek ve dişilerde timus veya dalak atrofısi, erkeklerde testis, seminal vezikül ve prostat atrofısi ve 100 jag/kg 'hk dişi grubunda yumurtalık atrofısi olduğu ortaya çıkmıştır.
Teratojenite:
2.0-10.0 mg/kg tek intravenöz dozun, farelerde hamileliğin 10-14. günlerinde yaşayan fetusun büyümesini Önemli ölçüde engellemiştir. 7.5 mg/kg doz grubunda, yarık damak, kuyruk kısalığı, çenenin normale oranla çok küçük oluşu ve oligodaktili ile teratojenite görülmüştür.
Karsinojenite:
Ürünün 0.2 jıg'ı, toplam olarak 35 defa haftada 2 kere farelere subkutan uygulandığında, uygulamanın 39-54, haftasında lokal olarak sarkom kaydedilmişir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum Klorür 240 mg6.2. Geçimsizlikler
Mitomisin-C potensi çözünme için düşük pH çözeltisi kullanıldığında azalabilir, çözündükten hemen sonra kullanılması tavsiye edilir. Ek olarak, düşük pH'lı enjeksiyonluk çözeltiler ile karıştırılmaktan kaçınılması önerilir. Mitomisin-C' nin, düşük pH'lı Cefam antibiyotikleri, B1 vitamin ürünleri ve enjeksiyonluk cisplatin karışımı ile potensinin azaldığı bildirilmiştir. Bundan dolayı bu ürünlerle direkt karışımdan kaçınılmalıdır. Ayrıca, yüksek miktarlarda glukoz ya da laktoz içeren infüzyon solüsyonlarında Mıtomisin-C stabil olmadığından, kullanım öncesinde, bu infüzyon solüsyonları ile birlikte hazırlanmasından kaçınılması tavsiye edilir.63.Raf Ömrü48 aydır.
6.4. Saklamaya yönelik özel tedbirler
25T7de oda sıcaklığında ışıktan koruyarak saklayınız.
Dondurmayınız,
Orijinal ambalajında saklayınız.
Distile su ile rekonsititüe edilen MİTOMYCİN-C çözeltisi 5°C'de 24 saat (1 gün) stabildir. Rekonstitüe çözelti herhangi bir koruyucu içermediğinden mikrobiyolojik açıdan hazırlandıktan sonra mümkün olan en kısa sürede kullanılmalıdır. Eğer hemen kullanılmayacaksa buzdolabında (2-8°Cde) saklanmalı, 8 saat içinde kullanılmalıdır.
Oda sıcaklığında IV çözeltiler içindeki MİTOMYCİN-C stabilitesi:
% 5Glukoz çözeltisi |
Hemen kullanılmalıdır |
|
% 0.9 Sodyum Klorür Çözeltisi |
8 saat içinde kullam imalıdır. |
|
Sodyum Laktat Çözeltisi |
8 saat içinde kullanılmalıdır. |
6.5. Ambalajın niteliği ve içeriği
10 mg mavi-mor toz içeren, renksiz, kauçuk tıpa ve alüminyum kapaklı Tip I cam fiakonlardır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer Özel önlemler
MİTOMYCİN-C sitotoksik kanser kemoterapisinde deneyimli bir hekim gözetiminde uygulanmalıdır.Hazırlama Talimatları:
İnfüzyonluk çözeltinin hazırlanması:
MİTOMYCİN-C intravenöz uygulamadan önce steril distile su ile rekonstitiüe edilerek ön çözelti (konsantre çözelti) hazırlanmalıdır.
Konsantre çözelti:
MİTOMYCİN-C konsantre çözeltisi, steril enjeksiyonluk su kullanılarak 1 mg/2 mL (0,5 mg/1 mL) konsantrasyon oluşturacak şekilde hazırlanır. Bunun için; 2 mg toz içeren flakona; 4 mİ steril enjeksiyonluk su,
10 mg toz içeren flakona; 20 mİ steril enjeksiyonluk su,
20 mg toz içeren flakona; 40 mİ steril enjeksiyonluk su eklenir.
Çözünmesi için çalkalanır, çözünme hemen sağlanmazsa oda sıcaklığına gelene kadar bekletilebilir.
İniuzy onluk çözelti:%
0,9 sodyum klorür çözeltisi içine enjekte edilir.Infıizyonluk çözelti; % 5 glukoz çözeltisi ya da sodyum iaktat çözeltisi kullanılarak da hazırlanabilir ancak bu çözeltiler intravezikal olarak uygulanmamalıdır.
Uzun süreli uygulama için intravenöz in füzyonluk çözelti:
500 mİ % 0.9'luk sodyum klorür çözeltisi, infuzyon için bir kanüle bağlanır ve infuzyon süresi 60 dakika olarak ayarlanır, MİTOMYCİN-C çözeltisi de bir kanül yardımıyla 30-40 dakika boyunca % 0,9'luk sodyum klorür çözeltisi ile eş zamanlı olarak uygulanır. Arta kalan % 0,9'luk sodyum klorür çözeltisi (100-200 mL) 20 dakika boyunca verilir. İntravenöz uygulamada infuzyon boyunca enjektörün ven içinde olduğundan emin olunmalıdır. Ektravazasyon oluşması durumunda ciddi inflamatuvar reaksiyonlar meydana gelebilir. Böyle bir durumda intravenöz uygulamaya başka bir venden devam edilmelidir.
İntravezikal uygulama çözeltisinin hazırlanması:
Hesaplanan doz Mitomisin-C tozu, lmg/ml konsantrasyon oluşturacak şekilde steril enjeksiyonluk su ile çözülür. Bunun için;
2 mg toz içeren flakona; 2 mİ steril enjeksiyonluk su,
10 mg toz içeren flakona; 10 mİ steril enjeksiyonluk su,
20 mg toz içeren flakona; 20 mİ steril enjeksiyonluk su eklenir.
Rekonstitüe çözeltide çözünmeyen partiküller kalırsa, ılık su altında 2 dakika boyunca şeffaf çözelti elde edilinceye kadar dikkatlice çalkalanmalıdır.
Hazırlanan çözelti bir kateter yardımıyla mümkün olan en kısa sürede mesaneye uygulanmalıdır.
MİTOMYCİN-C, cilt ile temas ettirilmemelidir. Temas halinde derhal bol miktarda sabunlu suyla yıkanmalıdır ve ardından etkilenen bölgeye % 8,4 sodyum bikarbonat çözeltisi uygulanmalıdır. Epidermal dokudan penetrasyonu arttırabileceğinden krem ya da nemlendirici kullanılmamalıdır.
MİTOMYCİN-C'nin gözle teması halinde birkaç kez bol miktarda izotonik sodyum klorür (şalin) çözeltisi ile yıkanmalıdır. Komeal hasara karşı birkaç gün gözetim altında tutulmalı, gerekirse medikal tedavi alınmalıdır.
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi atıkların kontrolü yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri ne uygun olarak imha edilmelidir
7. RUHSAT SAHİBİ
Onko İlaç San. ve Tic. A.Ş.Koşuyolu Cad. No:34,
34718, Kadıköy / İstanbul Tel: (0216) 544 90 00 Faks: (0216) 545 59 92
ÜRETİM YERİ:
Kyowa Hakko Kirin,.Ltd.1-6-1, Ohtemachi, Chiyoda-ku, Tokyo, 100-8185 Japonya
8. RUHSAT NUMARASI(LARI)
99/369. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 10.06.1996Ruhsat yenileme tarihi: 29.09.2004
10. KÜB'ÜN YENİLENME TARİHİ
02.
01.2012İlaç Bilgileri
Mitomycin-c Kyowa 10 Mg Enjektabl Flakon
Etken Maddesi: Mitomisin-c
Atc Kodu: L01DC03
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.
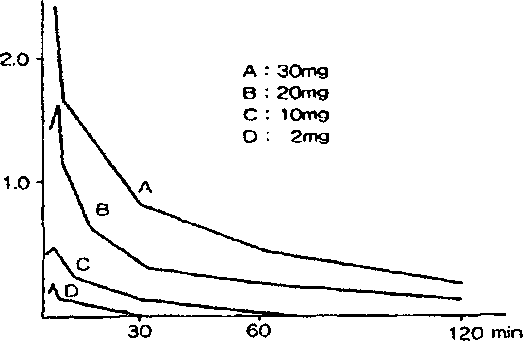 A,B,C,D Intravenöz olarak uygulanan Mitomisin-C Dozu Farmakokinetik parametreler
A,B,C,D Intravenöz olarak uygulanan Mitomisin-C Dozu Farmakokinetik parametreler