Xeplion 50mg/0,50ml IM Enjeksiyon İçin Uzun Salımlı Süspansiyon İçeren Kullanıma Hazır Enjeksiyon Kısa Ürün BilgisiSinir Sistemi » Psikoleptikler (Psikolojik İlaçlar) » Antipsikotikler » Diğer İlaçlar » Paliperidon KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIXEPLION 50 mg/0.50 mi l.M. enjeksiyon için uzun sahmlı süspansiyon içeren kulianıma hazır eniekiör2,KALİTATİF VE KANTİTATİF BİLEŞİM Etkin nıaddü:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CONSTA® ve XEPLION dozları | |
Daha önceki RİSPERDAL"^' CONSTA^ Dozu |
XEPLiON Enjeksiyonu |
2 haftada bir 25 mg |
Ayda bir 50 mg |
2 haftada bir 37,5 mg |
Ayda bir 75 mg |
2 haftada bir 50 mg |
Ayda bir 100 mg |
Önceki antipsikotik iiaçiarm sonlandıriiması, doğru reçeteleme bilgileri ile uyumlu olarak yapdmalıdır. XEPL10N kullanımı sonlandirılacaksa, uzatılmış salım Özelliği gÖz ününe alınmalıdır Diğer antipsikotik ilaçların kullanımında önerildiği gibi devam eden eksirapİramidal semptomlar (EPS) için ilaç gereksinimi periyodik olarak yeniden değerlendirilmelidir.
Özel popülasyoniara ilişkin ck bilgiler:
Böbrek yetnıcziiği:
XEPLION, böbrek yetmezliği olan hastalarda sistematik olarak incelenmemiştir {Bkz. Bölüm 5,2). Hafif böbrek yetmezliği olan hastalarda (kreatinin klerensi >50 - <80 mi/dak.), XEPLION'un önerilen başlangıç dozu, tedavinin birinci gününde 100 mg ve bir hafta sonra 75 mg'dır (her ikisi de deltoid kas içine uygulanır). Daha .sonra deltoid veya gluteal kas İçine hastanın bireysel tolerabiÜtesine ve/veya etkililiğe göre 25 ıng ila 150 mg aralığında ayda bir 50 mg uygulanır.
Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dak.) XEPL10N önerilmez.
Karaciğer yetmezliği:
XEPLION, kantciğer yetmezliği olan hastalarda incelenmemiştir. Oral paliperidon ile yapılan çalışmaya göre hafif veya orta derece karaciğer yetmezliği olan hastalarda, doz ayarlaması gerekli değildir.
Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir (Bkz. Bölüm 5.2). Bi! hastalardadikkaüi oiiuışnahdLr,
Pedİyatrik popülasyon:
XEPLION'un çocuklarda ve 18 yaşm altındaki ha.stalarda güvenliliği ve etkinliği incelenmemiştir,
Geriyatrik popülasyon:
XBPlJON'íJí's cikiltiiği ve gûveniiiligı 65 y;iş Bsiü hastalnrd;! kaniU<inmani!şiir.
Genel olarak, böbrek fonksiyonu normal olan yaşlı hastalarda, XEPLION'un önerilen dozu, böbrek fonksiyonu normal olan genç erişkin hastalarda önerilen dozla aynıdır. Yaşlı hastalarda böbrek fonksiyonları azalabileceğinden, böbrek fonksiyonunun durumuna göre doz ayarlaması gerekebilir (Bkz. Bölüm 4,2),
XEPLION, inme için risk faktörüne sahip demanslı yaşlı hastalarda dikkatli kulİaniimalıdır (Bkz. Bölüm 4.4),
Diğer
XEPLION için cinsiyet, ¡rk veya sigara kullanımına bağlı olarak doz ayarlaması yapılması önerilmez (Gebe kadınlar ve emziren anneler için Bkz. Bölüm 4.6),
4.3. Kontrcndİkasyonlar
Paliperidon palmitaE veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir,
Paliperidon, ri.sperİdonun aktif bİr metaboliti olduğu için XEPLION risperidona karşı bilinen aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyanları ve önlemleri
QT Aralığı
Diğer antipsikotiklerie olduğu gibi, bilinen kardiyovasktiler hastalığı olan veya ailesinde QT uzama Öyküsü olan hastalarda ve QT aralığını uzattığı düşünülen diğer ilaçlar ile birlikte kullanılacağı dummlarda, XEPLION reçetelenirken dikkaili olunmalıdır.
Nörolcptik sendrom
Hiperlermi, kas rijiditesi, otanomik instabilité, bilinç değişikliği ve serum kreatinin fosfokinaz seviyelerinde yükselme ile karakterize olan nöroleptik malign sendrom'un (NMS), paliperidon da dahil; antipsikotik ilaçlar ile oluştuğu bildirilmiştir. Ek klinik belirtiler arasında niiyogiobülinüri (rabdomiyoliz) ve akut böbrek yetmezliği de bulunabilir. Eğer bİr hastada NMS işaret eden bulgu ve semptomlar gelişirse, XEPLION da dahil olmak üzere tüm antipsikotik ilaçlar kesilmelidir.
Tardif Diskinezi
Dopamin reseptör antagonisti özelliğine sahip ilaçlar, özellikle dil ve/veya yüzde, ritmik, istem dışı hareketlerle karakterize olan tardif diskİnezinin indüksiyonu ile ilişkili bulunmuştur. Eğer lardif diskİnezinin bulgu ve semptomları ortaya çıkarsa, XEPLION da dahil olmak üzere tüm antipsikotik ilaçların kesilmesi değerlendirilmelidir.
HipergUsemi
XEPf,JON üe yapd;ın klinik çaisşoKsliirdiş olarak gİykiiza bağlı advers olayhjr, örn,;
kan gk^koz dilzeyinile arûş bildiriknişiir. linüpsikiitik ilaciarUi oldugii gsbt, diy;!befi
oUin ve diabctes meliüuis gelişıı^esi açisirid^in ri^k i';sk[örbri İKssüilardu, uygiin klinik
i/scnıe önciihi', ■ . ■
Hiperfn'olakiinenn■ ■ . ■ ■ ■
Doku kiHilirii çaiiŞiniiiaii nıenıe lihp.örlerinde hucrc büyüme^Hini prolakibl larafnıdan iHoiük' ediiebik'cegini neiiilnu'kıedir, KHnik ve epkJeniiyoiojik lüHipsjkoük kulhinnın
ik; iHşkısi ;iÇik bir şekilde gi^şcrik'meRiiş oisli da, dgili t^bbi öyklisy olan haslaksrda dikkıHİi ojuniiKiH! öncrHinekst'dır. PaHperidon pahııiiai ohisj prohskyne biiSli iüniörü olan lıasiaiarda dikkL'ufi külkii'iïli'iKihdir:
Kilo Alma
Atipik antipsikotik kullummıyla birlikte kilo alımı gözlenmiştir. Kilonun klinik olarak izlenmesi tavsiye edilmektedir.
OnosUttik hipotansiyon
Paliperidon, iilia-blokör aktivitesinden dolayı biizı hastalarda ortostatik hipotansiyonu indükleyebilİr. Oral paliperidon (İNVEGA 3 mg, 6 mg, 9 mg ve 12 mg) ile yapılan pltısebo kontrollü, 6 haftalık, sabit dozlu üç çalışmanın birleştirilmiş verilerine göre, plasebo ile tedavi edilen deneklerin %0,8'İne karşılık oral paliperidon ile tedavi edilen deneklerin %2,5'inde ortostatik hipotansiyon bildirilmiştir. XEPLION, bilinen kardiyovasküler hastalığı olan hastalarda (örn.; kalp yetmezliği, miyokart ini'arktüsü veya iskemi, ileti anormallikleri), serebrovasküler hastalığı veya hipotansiyona neden olabilecek durumlarda (örn.; dehidramsyon, hipovolemi ve antihipertansif ilaçlarla tedavi) dikkatli kullanılmalıdır.
Nöbetler
XEPLION, diğer antipsikotik ilaçlarda olduğu gibi nöbet öyküsü olan hastalarda veya nöbet eşiğini potansiyel olarak düşüren diğer koşulların bulunduğu hastalarda dikkatli kullanılmalıdır.
Böbrek yetmezliği
Paliperidonun plazma konsantra.syonu, böbrek yetmezliği olan hastalarda artmıştır ve bu nedenle hafif böbrek yetmezliği olan hastalarda doz ayarlaması önerilmekledir. Orta derece veya ağsr böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dak.) XEPLION önerilmez (Bkz. Bölüm 4.2 ve Bölüm 5.2).
Kü raciğcr yetmezi iği
Paliperidon, ağır karaciğer yetmezliği olan hastalarda (Child-Pugh Sınıf C) incelenmemiştir. Paliperidon, bu tür hastalarda kullanılıyorsa dikkatli olunması önerilir.
Demansı oktn yaf^h hastalar
Konvansiyonel vc aüpik antipsikotik ilaçlar demansa bağh psikozu olan yaşlı hastaların Icdavisindo kullanıldığında ölüm riskinde artışa neden olmaktadır.
XEPLION deo'ian.i^i yaşh haslalardii çaiişiiniunıı.inr. iiunc İçiei üírkíoriif dernanní oknı yiLşh İKiSKilardii dikkaiH küihinıhiiahdsr.
Genel mortalité
17 kontrollü klinik çalışmanın mela-analizinde, risperidon, aripiprazol, olanzapin ve ketiapin dahil olmak üzere diğer atipik antipsikotik ilaçlarla tedavi edilen ve demansı olan yaşlı hastalarda, mortalité riski plaseboya kıyasla artmıştır. Ri.speridon ile tedavi edilen ha.staiarda, pla,sebo için %3.1 olan mortalité%4olmuştur.
Serehrovaskiiler advers oUtyhır
Randomize plasebo kontrollü klinik çalışmalarda, risperidon, aripiprazol ve olanzapin gibi bazı utipik antipsikotik ilaçlaria tedavi edilen demansh yaşlı hastalarda serebrovasküler advers olaylarda yaklaşık 3 kat artmış risk görülmüştür. Bu artmış riskin mekanizması bilinmemektedir. XEPLION, inme açısından risk faktörieri taşıyan demansli yaşlı ha.sialarda dikkatli kullanılmalıdır,
LÖkapeni, Nötropeni ve AgmmilosUoz.
XEPLION dahil olmak üzere, antipsikotik ajanlarla lökopeni, nötropeni ve agranUlositoz olayları bildirilmiştir. Pazarlama sonrası denetim sırasında agranülosİtoz çok nadiren (<t/IO.OOO hasta) bildirilmiştir.
Klinik olarak anlamlı düzeyde düşük beyaz kan hücresi (WBC) sayımı veya ilaçla tetiklenmiş İökopeni/nötropeni öyküsüne sahip hastalar tedavinin ilk birkaç ayı boyunca izlenmeli ve ortada başka nedensel faktörler yokken WBC'de klinik olarak anlamlı bir düşüşe yönelik ilk belirtide XEPLION kullanımına son verilmesi düşünülmelidir.
Klinik olarak anlamlı nötropenisi olan hastalar ateş veya diğer enfeksiyon semptomları veya belirlileri açısından dikkatle izlenmeli ve bu tür semptomlar veya belirlilerin ortaya çıkma.sı halinde derhal tedavi edilmelidir. Şiddetli nötropenisi olan hastalar (mutlak nötrofil sayımı <1 X IO'VL) XEPLION kullanımına son vermeli ve iyüeşene kadar WBC düzeylerini takip ettirmelidir.
Venöz tromhoembolik olay
Antipsikotik ilaçlaria venöz tromboembolik olaylar (VTE) bildirilmiştir, Antipsikotik ilaç tedavisi gören hastalarda çoğunlukla kazanılmış VTE risk faktörieri bulunduğu için, VTE için tüm olası risk faktörieri, XEPLION ile tedaviden Önce ve tedavi süre.since tammlamnalı ve koruyucu önlemler alınmalıdır
Parkinson HastalığıvtLewy Cisinıcikli Demans
Parkinson hastalığı veya Levvy cisimcikli demansli hastalara XEPLION da dahİl olmak üzere antipsikotik ilaçlar reçete edilirken doktorlar yarar risk değerlendirmesi yapmalıdır; çünkü her iki ha.sta grubunda da, antipsikotik ilaçlara karşı duyariilığın artmış olması ile birlikte Nöroleptik Malign Sendrom riski artmış olabilir. Bu artmış duyarlılığın belirtileri, eksirapİramidal semptomlara ek olarak konfüzyon, obtundasyon, sık düşmeler ile biriikle postural instabilité olabilir. ;
Prİdpizın
Alfa-iicirenerjik blokör etkileri olan antipsikotik ihıçlarm (risperidon dahil), priapizmi indükledİği bildiriinıiştir. Pazarlama sonrası gözetim esnasında paliperidon ile prİapizm bildirilmiştir. Hastalar, priapizmin 3-4 saat içinde düzelmemesi durumunda acil tıbbi yardım almaları konusunda bilgilendirilmelidir (Bkz. Bölüm 4.8).
Vücııi ısısının koniroiii
Vücudun iç vücut ısısını düşürme yefeneğinin bozulması, antipsikotik ilaçlara bağlanmıştır. Aşırı egzersiz yapmak, aşırı sıcağa maruziyet, antikolincrjik aktivitesi olan ilaçların eş zamanlı uygulanması veya dehidratasyon bulunması gibi iç vücut ısısında yükselmeye katkıda bulunabilecek koşullan olan hastalara XEPLION reçete edilirken dikkatli olunması önerilir.
Anüemetik etki
Paliperidon ile yapılan klinik öncesi çahşmalarda, antiemetik etki gözlenmiştir. Bu etki, eğer İnsanlarda oluşursa, bağırsak tıkanması. Reye sendromu ve beyin tümörü gibi durumları veya belli ilaçların aşırı doz bulgu ve semptomlarını maskeleyebilir.
¡Jygıılama
XEPLION'un kan damarı içine kaza ile enjekie edilmesinin önlenmesi için dikkatli olunmalıdır.
XEPL10N her ml'sinde 1 mmol (23 mg)'dan dahava.sodyum İhtiva eder; yani esasında sodyum İçermez''. Sodyuma bağlı herhangi bir etki gözlenmez.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
XEPLION'un QT aralığını uzattığı bilinen ilaçlar, örn.; sınıf lA antiaritmikler (Öm.; kinidin, disopramid) ve sınıf 01 antiaritmikler (örn,; amiodaron, soialol), bazı antihistaminikler, bazı diğer antipsikotik ilaçlar ve bazı antimalaryaller (örn,; meflokin) ile birlikte reçete ederken dikkatli olunması önerilir,
Paliperidon palmitat, paliperidona hidroliz olduğu için (Bkz. Bölüm 5.2), ilaç*ilaç etkileşim potansiyeli değerlendirilirken oral paliperidon İle yapılan çalışmaların bulguları göz ününde bulundurulmalıdır.
XEPLION'un diğer ilaçları etkileme potansiyeli
Paliperidonun, sitokrom P-450 izoenzimleri ile metabolize olan ilaçlar ile klinik açıdan önemli farmakokinetik etkileşimlere neden olması beklenmemektedir. İnsan karaciğer
Sayfa IÜ/34
mikrozomlarmda yapıianin vitroçalışmalar, paliperidonun, CYPİA2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5 de dahii olmak üzere sisokrom P450 izoenzimleri larafıııdan melabolize ediien ilaçların metabolizmasmı önemli derecede baskılumatİığmı göstermiştir. Bu nedenle, paliperidonun, bu metabolik yolaklarla metaboİize ediien ilaçların klerensini klinik açıdan belirgin bir biçimde biiskılamasi beklenmemektedir, Paliperidonun, aynca enzim indükleyici özelliklerinin olması beklenmemektedir.
Palİperidon, yüksek konsantrasyonlarda P-glikoproteinin (P-gp) zayıf bir inhibiiörüdür.İn vivoveri mevcut değildir ve klinik açıdan ilişki bilinmemekledir.
Paliperidonun santral sinir sistemi üzerindeki primer etkileri ele alındığında (Bkz. Bölüm 4.8), XEPLION diğer santral etkili ilaçlar, örn.; anksiyolilikler, antİpsikotiklerin çoğu, hipnolikler, opiatlar, vb. veya alkol ile birlikte dikkatli kullanılmalıdır.
Palİperidon, levodopa ve diğer dopamin agonislierinin etkilerini antagonize edebilir. Bu kombina.syonun gerekli olduğuna karar verilirse, özellikle son evre Parkinson hastalığında her bir tedaviye ilişkin en düşük etkili doz reçete edilmelidir,
Ortostatik hipotansiyonu indükleme potansiyeli nedeni ile (Bkz. Bölüm 4.4), XEPL10N bu potansiyele sahip olan diğer terapötik ilaçlar, örn.; diğer antipsikotik ilaçlar, trisiklikler ile biriikle uygulandığı zaman aditif etki gözlenebilir.
Palİperidon nöbet eşiğini düşürdüğü bilinen diğer ilaçlar ile birlikte kombine edilirse dikkatli olunmas! önerilir (yani fenotiyazinler veya butirofenonlar, trisiklikler veya SSRI'lar, tramadol, meflokin, vb.).
Kararlı durumdaki oral uzatılmış salimli palİperidon tabletlerin (günde bir kez 12 mg) uzatılmış salimli divalproeks sodyum tablellerie (günde bir kez 500 mg ila 2000 mg) eşzamanlı olarak uygulanması, valproatm kararlı durum farmakokİnetiğini etkilememiştir.
XEPLION ve lityum arasında farmakokinetik etkileşim olası değildir.
Diğer ilaçların XEPLION'u etkileme potansiyelleri
Palİperidon, CYP1A2, CYP2A6, CYP2C9, CYP2C19 ve CYP3A5'in bir substratı değildir. Bu durum, bu izoenzimierin inhibitörleri veya indükleyicileri ile bir etkileşimin olası olmadığını düşündürmektedir.!n vitroçalışmalar, CYP2D6 ve CYP3A4'ün palİperidon metabolizmasında minimal olarak görev aldığını gösterse de, bu izoenzimierin, palİperidon metabolizmasında önemli bir rol oynadığına ilişkinin viıroveyain vivobulgular yoktur,İn vitroçalışmalar, paliperidonun bir P-gp substratı olduğunu göstermiştir.
Paliperidon, CYP2D6 ile kısıtlı derecede metabolize edilir (Bkz. Bölüm 5.2), Sağlikh gönüllülerde yapılan bir etkileşme çatışmasında, oral paliperidonun güçiU bir CYP2D6 inhibitorü olan paroksetinle birlikte uygulanması sonucu paliperidonun farmakokinetiği üzerinde klinik açıdan belirgin bir etki gözlenmemiştir.
Günde bir kere uygulanan uzatılmış salimli orai paliperidonun günde iki kere 200 mg karbamazepin ile birlikte uygulanması, paliperidonun ortalama kararlı durum C,ms ve EAA değerierinde yaklaşık olarak %37 oranında bir düşüşe neden olmuştur. Bu düşüş, büyük ölçüde, karbamazepin tarafından renal P-gp'nin indüklenmesinin bir sonucu olarak paliperidonun renal klerensinde %35 oranında artışa bağlıdır. Karbamazepinin eş zamanlı olarak uygulanması esnasında, idrarla değişmeden atılan ilaç miktarında minör bir azalma, paliperidonun CYP metabolizması veya biyoyararlanımı üzerinde düşük derecede etki olduğunu düşündürmekledir, Karbamazepin kullanımına başlandığında XEPLION dozu yeniden değerlendirilmeli ve gerekirse arttırılmalıdır. Bu durumun tersine, karbamazepin kul tanımı kesildiğinde XEPLION dozu yeniden değeriendirilmeli ve gerekirse azaltılmalıdır.
Fizyolojik pH koşullarında bir katyon olan paliperidon, yaklaşık olarak yarusı filtrasyon, yansı aktif .sekresyon yolu ile primer olarak değişmeden böbreklerden anlır. Böbrekte katyonik ilaçların aklif taşınmasını baskıladığı bilinen bir ilaç olan trimetroprimin eş zamanlı olarak uygulanması, paliperidonun farmakokinetiğini elkilememiştir,
12 mg oral uzatılmış salimli paliperidon tabletin tekli bir dozunun, uzatılmış salimli divalproeks sodyum tabletlerle (günde bir kez iki 500 mg'lık tablet) eşzamanlı olarak uygulanması muhtemelen artmış oral absorpsiyonun bir sonucu olarak paliperidonun Cmas ve EAA'sında yaklaşık %50'lik bir artışla sonuçlanmıştır. Sistemik klerenste herhangi bir etki gözlenmediğinden, uzatılmış salimli divalproeks sodyum tabletler ve XEPLION'un intramüsküler enjeksiyonu arasında klinik olarak anlamlı bir etkileşim beklenmemekledir. Bu etkileşim XEPLION ile çalışılmamıştır,
XEPLION ve lityum arasında farmakokinelik etkileşim olası değildir.
XEPLION'un Risperidon ile biriikte kullanımı
XEPLION'un risperidon ile biriikte kullanımı incelenmemiştir. Paliperidon, risperidonun aktif bir metaboliti olduğu İçin risperidon XEPLION ile birlikte kullanılacaksa, aditif paliperidon maruziyeti göz önüne alınmalıdır.
4.6. Gebelik ve laktasyon Genel tavsiye
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli hulunan kacImlar/Doğum kontrolü (Kontrasepsİyon)
Hayvanlar üzerinde yapılan araştırmalar üreme loksisitesinin bulunduğunu göstermiştir,
(Bkz, Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemekledir.
Gebelik dönemi
XEPLION'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir, XEPLION, kesin gerekli olmadıkça gebelik döneminde kullamlmamalidır.
Yüksek doz oral paliperidon ile tedavi edilen laboratuar hayvanlarında fetal ölümlerde hafif bir artış görülmüştür. Intramüsküler enjeksiyonla paliperidon palmitat uygulanan sıçanlarda, gebelik parametreleri etkilenmemiştir. Yüksek dozlar, anneler içİn tok.sik olmuştur. Maksimum insan maruziyetinin 20-22 katı daha yüksek olan oral dozlar veya maksimum insan maruziyetinin 6 katı daha yük,sek intramüsküler dozlar, fetüsü etkilememiştir. XEPLION'un insanda doğum sancısı ve doğum üzerindeki etkisi bilinmemektedir.
Gebeliğin üçüncü trımesterinde antipsikotik ilaçlara (paliperidon da dahil) maruz kalan yenİ doğanlar, doğumu takiben şiddeti değişebilen, anormal kas hareketleri (ekstrapiramidal işaretler/ekstrapiramidal semptomlar) ve/veya ilaç kesilme semptomları açısından risk altındadirlar. Bu semptomlar, ajitasyon, hipertoni, hipotoni, tremor, somnolans, respiratuar distres veya beslenme bozukluklarını içermektedir.
Laktasyon dönemi
Paliperidon anne siitü ile atılmaktadır (süte geçmektedir), XEPLION emzirme döneminde kullanılmamalıdır.
Üreme ycleneği/FertIlİte
Oral paliperidon tedavisi, prolaktin- ve santral sinir sistemi- aracılı etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların fertilitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi .sıçanların canlı embriyo sayısında çok az bir düşüş göstermiştir.
4J. Araç vo makine kutlanın« üzerindeki etkiler
XEPLION, zillin açıklığı gerektiren aktivitelere engel olabilir ve sediisyojı. sosíniolan*!. .^enkop vc huİLinık göriFie gibi görsel etkilere neden olabilir (Bkz, Bölüm 4.8), Bu nedenle hiLstalar, XEPLION'a karşı bireysel duyarlılıkları bilinene kadar araç veya makine kul i an mam alan konusunda uyanimalfdır.
4.8. İstenmeyen etkiler
Klinik çalışmalarda en sık bildirilen advers ilaç reaksiyonları (ADR'ler) insomnia, baş ağrtss, kilo alımı, enjeksiyon bölgesi reaksiyonları, ajitasyon, sonmokms, akatizi, bulantı, konstipasyon, sersemlik, tremor, kusma, üst .solum yolu enfeksiyonu, diyare ve taşikardidir. Bu advers ilaç reaksiyonları arasından akatizi dozla ilişkili olarak ortaya çıkmaktadır.
Aşağıda verilen Uim ADR'1er klinik çalışmalarda XEPLION ile tedavi edilen hastalardan bildirilen reaksiyonlardır. Şu terimler ve sikiık dereceleri kullandmıştır:
Çok yaygın (>1/10); yaygın (>1/100 ile <1/I0); yaygın olmayan (>1/1000 ile <1/100); seyrek (>i/10.0()0 ile <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
OrganSiiMh |
Advers İhıç Reaksiyoohirt | |||
■Siklik | ||||
Çok |
Yaygiii |
Yíívjíín Ohniivaii |
Seyrek | |
Enfeksiyonhu-veenİe'iüisvoniiir |
|
üsl sohiiiurn yohien ÍC kil iv0011 |
|
|
BagişikhkSİSiCİTiihaslahkian |
|
|
l'lipcrseıısinvlte |
|
E EKİ ok rio ha^salıkhin |
|
|
Híperproíakliíienií |
|
vebeiilcnniühaiiliil^klari |
|
Kilo aİHiM, kiiogiukozdüzeyindeyükiielme, kanIrigliseritdüzeyindiivükselıiie |
hiiKi'iiisüHneiríi, İşiah aruşL işlah azalması, kan kolesterol düzeyinde yüksehne |
|
Psikiyaırikhastaiiklar |
İiisofnnia |
Ajiiasyon |
Kabii.s |
|
Sinir sisierni haslahkiiiTj |
Baş uğriSi |
Di=;ionLparkiii<ıOin/.!iı,akaiiZLdi^kİiiezi,ekNü';.ipiraiiıkJalbozykhikk.tr,İR* mor, serseniirk, som no lan s |
Senkop, konviHsiyorı, íardíí diskiiie/i, dísarlE'i, ps;koinoü>r hipefakiiviU', piisUsnU ser.scüihk, k'larji |
NöroİeptikRiaiig^?',eii-ün:;nı,serebrovaskiyerolııy |
Göz İKs^;(ahkk.H'i |
|
|
Bulaj^ik görrriC |
Go/. kay!iıasL gö/ hareke! ho/ükhiSu |
Kıdak ve k' kulakİKisi idi klan |
|
|
Vértigo |
|
Karıl i yak hasiahkiar |
|
Taşikiy'di |
SiiHİs taşikardisi, kondüksiyon bozukhiğu, birinci dereceaniovenirikiiier blok, bradikiinli, orioslatik laşikardi sendronns, piilpiiasyonlar, e 1 e k 1 ri jk ard i y nul a QT üzaiTsasL jun'mal olnıayıınelekLmkisrdiyognım |
|
V^jskiHerhuiıiiihkiar |
|
HipertLyisivoii |
Oriostankhipouıjısiytiji |
|
CKistrrniiieHiinaiİ'ia:Siahk!ar |
|
KUSOKL RTBDON^IİIID RAİKIL-IIZHK/ÜST ABDOıRNNAİ AĞRİ, DIYAJ'C, BÜKHH'L KONSTIPASYOIİ, CIIŞ ÍÍÑRRSÍ |
Agjz kunijııgü |
|
Deri ve deri afli dokuİ?iist;ihkkL]i |
|
Döküntü |
(Jrûker, jencmüzc ka,^ijiü, kaşBin |
haç erüpsiyonu |
Kas-iiikt'iei bo/i!kh.ıkhH', bag dokü ve keni]k husiaiikkin |
|
Sirt uğnsi,ekHireiBHcdeağrş |
Miyalji, ckkiii serHiği |
|
üre ine sisienıi vc nieinı: |
|
|
JinekonK^sn, erektik disfonksivon. seksüel |
Menie akinüs^ |
İi;ısialskiiirı |
|
|
disfonksiyon,gaktkiore, anıeiiare,dii/eıısEZinco^lriiasyoii,nıensnık'i bozukluk,gecikmişEiienslriiasvon |
|
Genelbozüklükiiir \e uygulani;.* bölgesini; ilişkin hiüslabkkir |
|
Asleni,enjeksiyonbi'Hgesindesd1ieşnu%yorgunluk,enjeksiyonbölgesinde ugn |
Enjeksiyon hölgesifKİe kaşuHi |
Uygu kını abölgesinde üğn,eEijeksiyonbiiigesireaksiy-onlan,enJekHiyorıbölgi'sindc-nodül |
Aşağıda şizofreni tedavisinde oral sıralanmıştır;
paliperidon ile bildirilen ek advers ilaç reaksiyonları
Enfeksiyonlar ve enİesiiisyoiikir |
Yaygin: Nazoi'araiyilV'aviiHi ohiKivan: İdrar yok? enfeksiyonu, rinii |
Ba^işiklik sisk*nii iıastahklari |
Sevrek: Anafikikıik reaksiyon |
İ^sikiv^iüık h[i?;iahkksr |
Yaygnı olniLivan: Uyky bozukiuğü |
Sinir sisieiiii hasiahklan |
Sevrek: Geçici iskenıik asak, ^raiidmai konvüisiyon |
Kardiyak iıasiaiıkkir |
Yaygın olınayan: Sİiiüs arilnusi Sevi'ek: Sol dal bioğü |
Vaskliler hasUiijklar |
Vaygiii übnayan: Hipotansiyi'n Sevrek: İskenii |
Soh.i!uuri, göğüs bozükluklaii ve |
YaygHK Öksürük, kyıogokıringe;d agrs, burun |
nıediasiinal hasUihkkir |
iikansklıgiBllinnıiyor: Aspirasyon pnonuiiHSİ |
Gasiroietcsiinai hasiiihklar |
Yaygsn: Dispepsİ Yaygın olmayan: HazHiiSiziik Seyrek: İnce bağırsak ûkainkitği Biİiinrıiyor: Dilde şişme |
İ3eri ve deri aUı doku hastahkfan |
Seyrek: Anjioödein, papiiier dökiiniü |
Ka.H-iskek*s hozukhıklar, hag doku |
Yaygsn: Anralji |
ve kenıik hastahkku'1 |
Yavi-in olnıavan: Kas-iskeiei agrısi |
Böbrek ve idrar basialsklari |
Yaygin olnıayaii: Üriner miansiyon Seyrek: Üriner hıkonünans |
Gebeük, pueperiyuni durumiiiri ve BiHnmiyon NeCituslai ilaç kesihne .sfnipiomkirs (Bkz.
pernıata^ haslahklar-_BoUiiij 4.6)_BoUiiij 4.6)
_
(Jrenie sisienıi ve njesne Seyrek: Menıe aogornııanK nıen^e ağriSL menıe
huslLihkiars lia'isasiyeu, retroerLKİ ejakükısyoR
_Bijip.niiyor:. F^riapiziiı_
Bijip.niiyor:. F^riapiziiı
_Bijip.niiyor:. F^riapiziiı_
Genel bo/ykiüklar ve uyguiiiiBij Yaygin ahBay;in; FcrHeral ödeiiı
höige.jnc ilişkin hasiahkfar Şewe.k: Ödem_
Pazariama Sonrası Veriler
Paliperidon ile iik olarak pazariamu sonrası deneyimde spontun bildirimlere dayanan bir sikiık kategorisi ile verilen advers ilaç reaksiyonları aşağıdaki tabloda yer almakladır. Aşağıdaki terimler ve sıklık dereceleri kullanılmıştır;
Çok yaygın (>I/iO); yaygın (>1/100 ile <1/10); yaygın olmayan {>1/1000 ile <1/100); seyrek (>1/10,000 ile <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Spontan bildirimlere dayanan bir sıklık kategorisi ile paliperidon pazarlama sonrası deneyiminde tanımlanmış olan advers olaylar
Çok seyrek: Neonalal İlaç yoksunluk sendromu
Bu sınıfa özgü olaylar
Enjeksiyon bölgesi reaksiyonları: En sık bildirilen yan etki ağrıdır. Bu reaksiyonların çoğu hafif ila orta şiddettedir. Bütün faz 2 ve faz 3 klinik çalışmalarında, enjeksiyon bölgesi ağrısının bireysel algısı zamanla sıklık ve yoğunluğu azaltmayı amaçlayan görsel analog skalada değerlendirmiştir, Deltoid enjeksiyonlar gluleal enjeksiyonlara oranla biraz daha fazla ağnli olarak algılanmıştır. Diğer enjeksiyon bölgesi reaksiyonları çoğunlukta hafif yoğunluktadır ve enjeksiyon bölgesinde sertleşme (yaygın), kaşıntı (yaygın olmayan) ve nodüller (seyrek) olarak tanimlanmıştir.
Kilo alma: 150 mg'hk başlangıç dozunun kullanıldığı 13 haftalık çalışmada, vücut ağırlığının %7'si ve daha fazla kilo alma kriterini karşılayan bireylerin oranlan, XEPL10N gruplannda plasebo grubuna göre daha yüksek orandadır. %7 ve daha fazla anormal kilo alımı olan denek oranı, dozla ilişkili bir eğilim göstermiştir ve insİdans oranı plasebo grubunda %5 iken; XEPL10N 25 mg, 100 mg ve 150 mg gruplannda plasebo ile karşılaştırmalı olarak sırasıyla %6, %8 ve %13 bulunmuştur.
Uzun dönemde nüksü önleme çalışmiismm 33 haftalık açık etiketli geçiş/idame dönemi esnasnıda, XEPLION İ!e tedavi edilen deneklerin %12'si bu kritere uymuştur (çift-kör fazmdan son noktaya kadar >%7 kito artışı); açık etiketli başlangıca göre ortalama (SD) ağırlık değişikliği +0,7 (4,79) kg olmuştur.
Laboratuar te.stleri
Serum prohıktin: XEPLION alan deneklerde her iki cinsiyette de, serum prolaktin düzeyinde ortalama artışlar gözlenmiştir. 13 haftalık, çift kor, plasebo kontrollü üç çalışmadan elde edilen verilere göre, prolaktin düzeylerinde artışı düşündürebilecek advers olaylar (örn.; amenore, galaktore, jinekomasti) genelde deneklerin % Tinden azmda bildirilmiştir.
Sınıf etkileri
Antipsikotik ilaçların kullanılması sonucunda QT uzaması, ventriküler aritmiler (ventriküler fibrilasyon, ventriküler taşikardi), ani beklenmedik Ölüm, kardiyak arrest ve Torsades de pointes görülebilir,
Pulmoner embolizm ve derİn ven trombozu vakaları da dahil olmak üzere, antipsikotik ilaçlarla venöz tromboembolik olay bildirilmiştir (Sıklık bilinmemektedir).
4,9,Doz aşımı ve tedavisi
XEPLION'un, sağlık personeli tarafından uygulanması gerektiğinden hastaların aşın doz alma potansiyeli düşüktür.
Belirliler
Genellikle, beklenen bulgu ve .semptomlar paliperidonun bilinen farmakolojik etkilerinin artması şeklindedir. Bunlar, uyuşukluk ve sedasyon, taşikardi ve lıipotansiyon, QT uzaması ve ek.strapiramidal semptomlardır. Torsade de pointes ve ventriküler fibrilasyon, oral palİperidon ile doz aşımı ayarında rapor edilmiştir. Akut doz aşımı durumunda, birden fazla ilaç ihtimali düşünülmelidir.
7'eJüvi
Tedavi gereksinimleri ve iyileşme değerlendirilirken XEPLION'un uzatılmış salım özelliği ve
paliperidonun uzun yarılanma ömrü göz önünde tutulmalıdır. Paliperidonun spesifik bir
antidotu yoktur. Genel destekleyici önlemler uygulanmalıdır. Hava yolu açık tutulmalı,
korunmalı ve yeterli oksijenasyon, ventiiasyon sağlanmalıdır. Kardiyovasküler izlemeye
tiemen başlanmalı ve olası aritmiler için sürekli elektrokardİyografik izleme yapılmalıdır.
Sayfa 18/34
Hipotansiyon ve dolaşım kollapsı, iniravenöz sıvı ve/veya sempalomimetik ilaçlar gibi uygun önİennlerie tedavi edilmelidir. Ciddi ekstrapiramidal semptomların varlığında antikolinerjik İlaçlar uygulanmahdır. Hasta iyileşene kadar yakın denetim ve gözlem sürdürülmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinanıİk Özellikler
Farmakoterapötik grup; Diğer antipsikotikler ATCkodu:N05AXI3
XEPLİON paliperidonun (+)- ve {-)- rasemik karışımını içerir.
Etki mekanizması:
Paliperidon palmitat, paliperidona hidrolize olur (Bkz. Bölüm 5.3). Paliperidon, daha çok serotonerjik 5-HT:a antagonistik aktivitesi olan merkezi etkili dopamin D; antagonistidir, Paliperidon, aynı zamanda alia-l ve alfa-2 adrenerjik resepförierin ve Hı hi.staminerjik reseptörlerin antagonisti olarak etki eder. Paliperidonun kolinerjik muskarinik veya (İj- ve Bz-adrenerjik reseptörlere afinitesi yoktur. (+)- ve (-)- paliperidon enantiyomerierinin farmakolojik aktivitesi, kalitatif ve kanlitatif olarak benzerdir.
Şizofrenide etkili olan diğer ilaçlarda olduğu gibi paliperidonun etki mekanizması bilinmemekledir. Ancak, ilacın şizofrenideki ierapötik aktivitesinin, dopamin Tip 2 (Di) ve serotonin Tip 2 (SHT^a) reseptör antagonİzmasmın kombinasyonu ile kontrol edildiği öne sürülmüştür. Di ve SHT^a dışındaki diğer re.septörlerdeki antagonizmu, paliperidonun diğer etkilerinin bazılarını açıklayabilir.
Eiektrofızyoloji
Oral paliperidonun QT aralığı üzerindeki etkileri, şizofreni ve şizoafektif bozukluğu olan erişkinlerde yapılan iki randomize, çift-kör, çok merkezli, faz 1 çahşmasmda ve şizofrenili erişkinlerde yapılan aktif kontrollü, 6 haftalık, .sabit dozlu etkinlik çalışmalarında değerlendirilmiştir.
İlk faz 1 çalışmasında (n=141), denekler 7 gün süre ile günde bir kere hızlı salimli oral
paliperidon (4 mg'dan 8 mg'a titre edilerek) veya tek doz moksifloksasin (400 mg) almak
üzere randomize olarak ayrılmışlardır. Günde tek doz 8 mg hızlı salimli oral paliperidon
(n=50, 313 ng/ml) ile elde edilen ortalama kararlı durum maksimum plazma
konsantrasyonu, deltoid kas içine uygulanan önerilen maksimum 150 mg'lık XEPLİON dozu
Sayfa 19/34
ile gözlenen 2 kat daha yüksek maruziyete göre dalia yüksek bulunmuştur {öngörülen ortalama Cux = 50 ng/mİ), Model-ayarlı, gün'Ortalamalı lineer-deriveli QT düzeltmesinde {QTcLD), XEPLION tedavi grubunda {n=50) 5.5 milisaniye!ik (ms) ortalama artiş saptanmıştır(%90CI; 3.66; 7.25).
İkinci faz t çalışmasında {n=109) denekler; pla.sebo, maksimum önerilen orai uzatılmış salımh paliperidon dozu (günde bir kere 12 mg) ve bunu takiben önerilen aralığın üzerinde bir doza titrasyon {günde bir kere 18 mg) veya aynı farmakolojik ilaç sınıfından bir ilacı (günde iki kez 400 mg ketiapin) aktif kontrol olarak alacak şekilde rastgele ayrılmışlardır. Bu 10 günlük eşit etkinlik çalışmasmda, birincil karşılaşurma 12 mg uzatılmış salimli paliperidon ile ketiapin arasında yapılmıştır. Her bireyin saptanan tıax değerinde QTcLD'de başlangıca göre en düşük kareler ortalamasının değişikliği, 12 mg uzatılmış salimli paliperidon için (ortalama C,as 34 ng/ml), günde iki kez 400 mg ketiapin ite karşılaştırıldığında (orlatama 1183 ng/ml) 5.1 ms daha düşük bulunmuştur (%90 CI; -9.2; -0.9), Bu değer önceden belirlenmiş 10 ms olan eşit etkinlik kriterine uygundur. Her bireyin saptanan tm^ değerinde QTcLD'de başlangıca göre ortalama değişiklik, 18 mg uzatılmış salimli paliperidon için (ortalama Cıax 53 ng/ml), günde iki kez 400 mg ketiapin ile karşılaşlınldığında (ortalama 1183 ng/ml) 2.3 ms daha düşük bulunmuştur {%90 CI: -6.8; 2,3).
Her bireyin saptanan t5a\ değerinde QTcLD'de ortalama değişiktik, eşzamanlı plasebo grubunda saptanan ortanca t,Mx değerinde (karşılaştırılan aklif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaşiinldığında, 12 mg uzatılmış salimli paliperidon için 1.5 ms daha yüksek {%90 CI: -3.3; 6.2) ve günde iki kez 400 mg keiiapin için 8.0 ms daha yükseki%90CI: 3,1; 12.9) bulunmuştur. Her bireyin saptanan t^u.^ değerinde QTcLD'de ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca tn¡a^ değerinde (karşılaştfrılan aktif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaştırıldığında, 18 mg uzatılmış satımİi paliperidon için 4.9 ms daha yüksek (%90 Cl: -0.5; 10.3) ve günde İki kez 400 mg keliapin için 7.5 ms daha yüksek (%90 CI; 2,5; 12.5) bulunmuştur.
Bu çalişmalarm tıiçbirisinde herhangi bir zamanda deneklerde, başlangıca göre 60 mili.saniyeyi geçen bir değişiklik veya 500 milisaniyeyi geçen bir QTcLD görülmemiştir.
Ora! uzatılmış salimli paliperidonla ilgili .sabil dozlu üç etkinlik çalışmasında, standardize editmiş bir yöntem kullanılarak belirli günlerde (beklenen Cm¡ts sürelerini İçeren) 15 zaman noktasmda, kapsamlı elektrokardiyografi (ECG) ölçümleri almrnıştır. Uzatılmış salimli paliperidon ile tedavi edilen 836 denek, olanzapin ile tedavi edilen 357 denek ve plasebo ile tedavi edilen 350 deneğin loptu verilerine göre tierhangi bir zaman noktasında, herhangi bir
Sayfa 20/34
tedavi grubunda ortalama QTcLD artışı 5 milisaniyeyi geçmemiştin Bu çalışmalar esnasında, uzatılmış salimli 12 mg palİperidon ve olanzapin grupiartnm her birisinde bir denekte bir zaman noktasında 60 milisaniyeyi geçen değişiklik olmuştur (sırası ile 62 ve ! 10 milisaniye artişlan).
XEPLION'»n dört sabit dozlu etkinlik çalışmasmda, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamış ve herhangi bir zaman noktasmda 500 milisaniyeden fazla QTcLD değeri görülmemiştir. Uzun süreli nüksü önleme çalışmasında, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamıştır ve bir denekte 507 mili.saniyelik QTcLD değeri saptanmıştır (Bazett düzeltilmiş QT aralığı [QTcB] 483 milisaniye). Bu hastada ayrıca kalp hızı 45 alım/dakika bulunmuştur.
Klinik Etkinlik
XEPLION'un şizofreninin akut tedavi.sinde etkililiği, şizofreni için DSM-IV kriterlerini karşılayan akut nüks gelişmiş yatan erişkin ha.stalarda yapılan kısa süreli (biri 9 haftalık ve üçü 13 haftalık) çift-kör, randomize, plasebo kontrollü, sabit dozlu dört çalışmada değerlendirilmiştir. Bu çalışmalarda 1 XEPLİON'un sabit dozları, 9 haftalık çalışmada i, , 8. ve 36. günlerde ve 13 haftalık çalışmalarda ek olarak 64. günde verilmiştir (ilk iki doz için bir haftalık aralıklarla ve daha sonra idame için 4 haftada bir).
Etkinlik, Pozitif ve Negatif Sendrom Ölçekleri (PANSS) kullanılarak değerlendirilmiştir, PANSS, pozitif semptomları, negatif semptomları, dağınık düşünceleri, kontrol edilemeyen saldırganlikyheyecanı ve anksiyete/dcpresyonu değerlendirmek için beş faktörden oluşan valide edilmiş çok maddeli bir Ölçektir. Fonksiyon, Kişisel ve Sosyal Performans (PSP) ölçeği kullanılarak değerlendirilmiştir. PSP, sosyal olarak yararlı aktivite alanlarında kişisel ve sosyal fonksiyonu ölçen ve klinisyenin derecelendirdiği valide edilmiş bir ölçektir; iş ve çalışma, kişisel ve ,so.syal ilişkiler, kendi kendine bakım ve rahatsız edici ve agre.sif davranışlar. Sosyal, kişisel ve kendi kendine bakım alanlarında disfonksiyonun şiddeti, bu aktİviteleri başkalarının yardımı ile ve başkalarının yardımı olmaksızın uygulamada zorluk derecesi (yok, hafif, aşikar, belirgin, şiddetli) ile ölçülür. Benzer şekilde, agresif davranışlarda disfonksiyonun şiddeti, agresif davramşlann varlığı veya yokluğu (kabalık, başkalarma toplum içinde hakaret etmek, ne.sneleri kırmak, sözlü tehditler, fiziksel saldırı) ve bu davranışların sıklığı ile ölçülür.
XEPLİON'un üç sabit dozunu (başlangıçta 150 mg'hk deltoid enjeksiyon ve bunu takiben 25 mg/4 hafta, 100 mg/4 hafta veya İ50 mg/4 hafta şeklinde 3 gluteal veya deltoid doz) plasebo ile karşılaştıran 13 haftalık çalışmada (n=636), XEPLION'un üç dozu da, PANSS toplam
Sayfa 21!34
puanını diizeitmek açısından plaseboya göre üsEün bulunmuştur. Bu çalışmada, hem !00 mg/4 hafta hem de 150 mg/4 haftalık tedavi gruplan PSP puanı açısından phıseboya güre istatistiksel olarak anlamlı üstünlük güstermİşken, 25 mg/4 haftalık tedavi grubu üstünlük göstermemiştir. Bu bulgular, tedavi süresi boyunca etkililiği ve PANSS'de düzelmeyi desteklemektedir ve dördüncü gün kadar erken dönemde gözlenmiştir. Sekizinci günde ise 25 mg ve 150 mg'hk XEPL10N gruplarında plaseboya güre anlamlı farklılık gözlenmiştir.
XEPLION'un üç sabit dozunu (50 mg/4 hafta, 100 mg/4 hafta ve 150 mg/4 hafta) plasebo ile karşılaştıran diğer bir 13 haftalık çalışmada (n=349), sadece İOO mg/4 haftalık XEPLION grubu, PANSS toplam puanında düzelme açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 50 mg/4 hafla, hem de 100 mg/4 hafta dozları, PSP puanım düzeltmek açısından plaseboya üstün bulunmuştur. Bu çalışmaya 150 mg'lık bir doz dahil edilmesine rağmen, bu dozu alan gönüllü sayısı, bu dozun etkililiği İle ilgili kesin sonuçlara varmak için yeterli değildir.
XEPLION'un üç sabit dozunu (25 mg/4 hafta, 50 mg/4 hafta ve 100 mg/4 hafta) plasebo ile karşılaştıran üçüncü 13 haftalık çalışmada (n=5l3), XEPL10N'un üç dozu da, PANSS toplam puanım düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, paliperidon doz grupların tamamında, PSP puanı açısından plaseboya göre istatistiksel olarak anlatiilılık saptanmamıştır.
XEPLION'un iki sabit dozunu (50 mg/4 hafta ve İOO mg/4 hafta) plasebo ile karşılaştıran 9 haftalık çalışmada (n=197), XEPLION'un iki dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur,
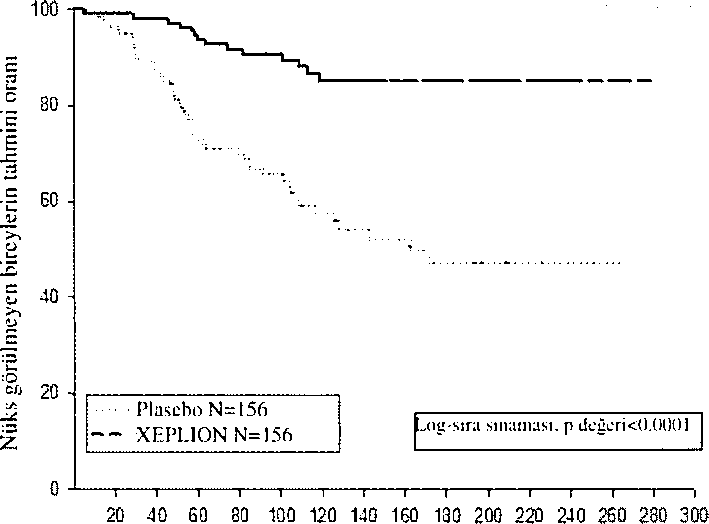
XEPLION'un şizofrenide semptomatİk kontrolü idame etmek ve şizofrenide relapsı geciktirme açısından etkililiği, şizofreni için DSM-IV kriterlerini karşılayan 849 yaşlı olmayan erişkin gönüllüleri içeren uzun süreli çift-kör, plasebo kontrollü, esnek dozlu bir çalışmada belirlenmiştir. Bu çalışma, 33 haftalık açık etiketli akut tedavi ve stabilizasyon fazı, randomize, plasebo kontrollü bir faz {nüks açısından gözlem yapmak üzere) ve 52 haftalık açık etiketli uzatma dönemini İçermiştir. Bu çalışmada, XEPLION dozlan ayda bir defa uygulanan 25, 50, 75 ve 100 mg dozlarını içermiştir; 75 mg dozuna yalnızca 52 haftalık açık etiketli uzatmada izin verilmiştir. Hastalar, başlangıçta 9 haftalık bir geçiş dönemi sırasında esnek dozlarda (25-100 mg) XEPLION almıştır. 24 haftalık koruma dönemine girmek İçin hastaların PANSS skorunun <75 olması gerekmiştir. Dozlama ayarlamalanna yalnızca koruma döneminin ilk 12 haftasında İzİn verilmiştir. Değişken uzunlukta çift-kÖr faz esnasında, hastalar .stabiliza.syon fazında aldıklan aynı XEPLION'un doz grubuna (ortanca süre 171 gün [aralıklar 1 gün-407 gün]) veya piasebo grubuna (orialama süre 105 gün [aralıklar 8 gün-441 gün] randomize olarak ayrılmıştır. Toplam 410 stabilize hasta, şizofreni semptomlarında nüks oluşana kadar, XEPLION veya plasebo gruplanna randomize olarak ayrılmiştır. Nüks, aşagıdakilerden birinin veya daha fazlasının ilk olarak ortaya çıkma zamanı olarak tanımlanmıştır. Bunlar; psikiyatrik hospitalizasyon, iki ardışık değerlendirmede toplam PANSS puanında >%25 artış (başlangıç puanı >40 ise) veya 10 puanlık artış (başlangıç puanı <40 ise), kasıtlı olarak kendi kendini yaralamak, saldırgan davranış, intihar/öldürmeye eğilimli düşünceler veya PANSS maddelerinin P1 (Delüzyonlar), P2 (kavramsal disorganizasyon), P3 (Halüsinasyonla ilgili davranış), P6 (Şüpheciiik/perseküsyon), P7 (Düşmanlık) veya G8 (işbirliği yapamama) ardışık iki değerlendirmesinde puanın >5 (maksimum başlangıç puanı <3 ise) veya >6 (maksimum başlangıç puanı 4 ise) olmasıdır, Primer etkinlik değişkeni, nükse kadar geçen süre olmuştur. Daha önceden planlanmış bir ara analiz (68 nüks olayı yaşandıktan sonra), nükse kadar geçen sürenin, XEPLION ile tedavi edilen hastalarda, plaseboya kıyasla anlamlı derecede daha uzun olduğunu göstermiştir (Şekil I) ve etkililiğin devam ettiği gösterildiğinden çalışma erken sonlandırılmıştır.
Şcki] 1, Zamany karşı niiksü kıyaslayan Kaplan -Meicr Grangi - Ara Analizi (Ti.'daviji aınü(,'layan analiz .si.'ii)
Rantlomi/asyundun beri geçen süre (gün)
Çalışmanın sonlandırıldıgı tarihe kadar tüm verileri içeren nihai verilere dayanılarak yapılan analizin sonucu, ara verilere dayalı birincil etkililik analizinin sonucu İle tutarlıdır.
Popiihısyon ull gruplarının incele nntıes i, cinsiyet, yaş veyaııktemci al m arak tedaviye yanıt açısından klinik olarak anlamlı fark göstermemiştir.
5.2. Farmakokineük özellikler Genel Özellikler
Emiiim:
Sudaki çözünürlüğünün aşın düşük olmasına bağlı olarak paliperidon palmilat, intramüsküler enjeksiyondan sonra paliperidona hidroliz olmadan önce yavaşça çözünür ve sistemik dolaşmıa absorbe olur. Tek bir intramüsküler enjeksiyonu takiben paliperidonun plazma konsantrasyonun, 13 günlük ortalama tmcix süresi içinde yavaş yavaş yükselerek maksimum plazma konsantrasyonlanna yükselir, ilacın salmması, birinci gün kadar erken bİr zamanda başlar ve 126 gün kadar sürer.
Deltoid kas içine tek doz intramüsküler enjeksiyonunu takiben (25 mg-150 mg), glútea! kas içine enjeksiyonla karşılaştınldıgmda onalama olarak %28 daha yüksek bir gözlenmiştir, 1. günde 150 mg ve 8. günde lüO mg'ın iki başlangıç deltoid intramüsküler enjeksiyonu, terapötik konsantrasyonlara hızla ulaşılmasına yardımcı olur. XEPLÍON'un salım profili ve doz rejimi, lerapötik konsantrasyonların devam etmesini sağlamaktadır. 100 mg'hk XEPLÍON dozu için ortalama kararlı durum doruk noktası: iki dalga ara.sındaki çukur oranı, gluteal uygulamayı takiben 1.8 ve delioid uygulamayı takiben 2,2 olmuştur. 25 mg*l50 mg'lık doz aralığmda XEPLION uygulamasını takiben paliperidonun görünen ortalama yanlanma ömrü 25 ile 49 gün arasında değişmiştir,
Paliperidon palmilat uygulamasını takiben paliperidonun (+) ve {-) enantiyomerleri birbirine dönüşür ve yaklaşık olarak l,6-L8'lik bir EAA {+)/(-) oranına ulaşır.
DaSıhm:
Popülasyon analizine göre paliperidonun görünen dağdım hacmi 391 litredir. Rasemik paliperidon plazma proteinine %74 oranında bağlanır.
Bivolransformasvon:
1 mg hızlı salimli '"*C-paliperidonun tek bir oral dozunun uygulanmasından 1 hafta sonra, dozun %59'u İdrarla değişmeden atılmıştır. Bu durum, paliperidonun karaciğerde ileri derecede metabolize olmadığını göstermektedir. Hiçbirisi verilen dozun %6.5'inden fazlasını kapsamayanin vivodöri metabolik yolak tanımlanmıştır: dealkilasyon, hidroksilasyon,
Sayfa 24/34
(Jehidrojenasyon ve benzisoksazotUn bölünmesi.!n viiroçahşmahır, paliperidon melaboiizmasmda CYP2D6 ve CYP3A4'Un rol oynadığmı göstermesine rağmen, paliperidonun metaboUzmasmdain vivoolarak bu izoenzimlerin öncmü bir rol oynadığına dair bir kanıt yoktur. Popiilasyon farmakokinetik analizleri, oral paliperidonun uygulanmasından sonra paliperidonun görünen klcrensinde CYP2D6 substratlarmın hızlı metabolize edicileri ile yavaş metabolize edicileri arasında ayırt edilebilir fark göstermemiştir, İnsan karaciğer mikrozomlarmda yapılanin viiroçalışmalar, paliperidonun, CYPIA2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5'i içeren sitokrom P450 izoenzimleri tarafından metabolize edilen ilaçlarm metabolizmasın! büyük ölçüde inhibe etmediğini göstermiştir,
In vitroçalışmalar, paliperidonun bir P*gp substratı olduğunu ve yüksek konsantrasyonlarda P-gp'nin zayıf bir inhibitörü olduğunu göstermiştir.In vivoveriler yoktur ve klinik ilişki bilinmemektedir.
Eliminasvon:
1 mg hızlı salimli ^'C-paliperidonun Eek bir oral doz uygulanması ile verilen radyoaktivitenin yaklaşık %80'i idrarda ve % li 'i feçeste bulunmuştur.
Dot'rusallık/Dot'rusal olmayan durum:
XEPL10N uygulamasını takiben toplam paliperidon maruziyeti, 25 mg-150 mg'hk doz aralığının üzerinde dozla oranUh olmuştur ve 50 mg'ı aşan dozlarda için dozla-orantıdan düşüktür.
Uzun eikiÜ paliperidon palmitat enjeksiyonu ile oral uzatılmış salimli paliperidonun karitla-pınlması
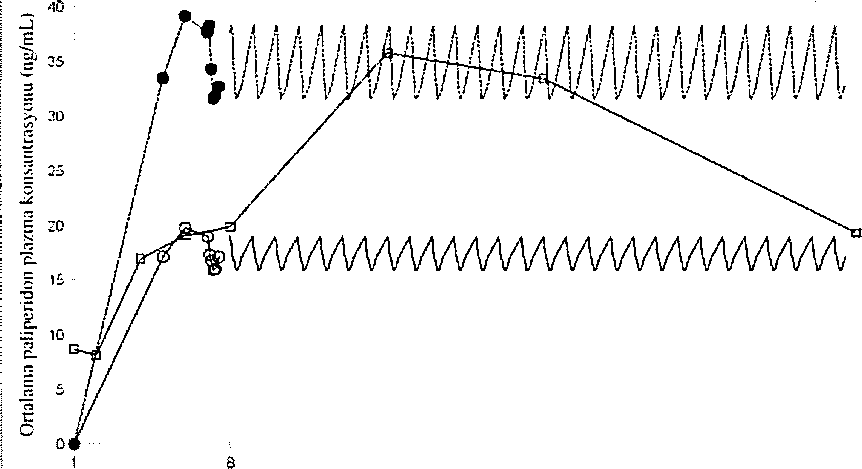
XEPLİON, paliperidonu ayda bir uygulamak üzere tasarianmıştır. Uzatılmış salimli oral paliperidon ise günde bir kere uygulanır. Şekil 2, önerilen başlangıç rejimi kullanılarak XEPLION uygulamasını takiben 5 hafta süre ile paliperidonun ortanca farmakokinetik profilini, oral uzatılmış salimli tablet (6 mg veya 12 mg) uygulaması ile karşılaştırmalı olarak sunmaktadır. XEPLION'un başlangıç rejimi (1. gün/8, günde deltoid kas içine 150 mg/100 mg), tedaviyi oral destek kullanmaksızın başlatırken kararlı durum paliperidon konsantrasyonlarına hızla ulaşmak üzere lasarlanmıştır.
00~i0ra! 6 mg palipcritİnıı --'-Oral 12 mg palİperidon
XEPUON
- Mesapliinan oral 6 mg kararlı durum
Musaplanan oral 12 karar!) durum
1522
Zaman (gün)
Şekil 2, Ora) uzatılmiş salimit lahlelin (6 mg veya 12 mg) günlük uygulaması ile karşılaşıırmalı olarak tincrilcn başlangıç rejimi kullanılarak (1 ,gün/8.günde dcitoid kus içine 150 mg/lOO mg palipcridona eşdeğer palİperidon palmiial iie başiatıgıç) XEPLION'un uygulamasını takiben 5 hal'la süre ile palİperidon için (malama farmakokinetik profillerini takiben ortalama piazma konsanirasyonu-zaman profilleri.
Genel olarak, XEPL10N ile gözlenen genel başlangıç plazma düzeyleri, 6 mg-12 mg uzatılmış salimli oral palİperidon ile gözlenen maruziyet sfmrları içinde bulunmuştur. XEPLION başlangıç rejiminin kullanılması, en düşük değerlerin görüldüğü doz öncesi günlerde bİle (8. gün ve 36. gün) hastaların, 6 mg-12 mg uzatılmış salimli oral paliperidonun bu maruziyet penceresinde kalmalannı saglamiştır. XEPLİON uygulamasmı takiben palİperidon farmakokinetiği için gönüllüler arasında değişkenlik, uzatılmış .salimli oral palİperidon tabletlerinde belirlenen değişkenliğe göre daha az bulunmuştur, iki ürün arasındaki ortanca farmakokinetik profillerindeki fark nedeni ile farmakokinetik özelliklerini direkt olarak karşılaştırılırken dikkatli olmak gerekir.
Hastalardaki karakteristik özellikler
Karaciizer yetmezliği:
Palİperidon, karaciğerde yaygın şekilde metaboİize edilmemektedir, XEPLION, karaciğer yetmezliği olan hastalarda incelenmemiş oima.sına rağmen, hafif veya orta derece karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir, Orta derecede karaciğer yetmezliği olan (Child-Pugh sınıf B) hastalarda orai paliperidon ile yapfIan bir çahşmada, serbest paliperidontm plazma konsantrasyonu, sağlıklı deneklerle benzerdir. Paliperidon, ağır karaciğer yetmezliği o!an hastalarda incelenmemiştir.
Böbrek vetmezliûi:
Hafif böbrek yetmezliği olan iıastaiarda XEPLION dozu azaiiılmalıdır. XEPLION'un, orta veya ağır böbrek yetmezliği olan hastalarda kullanılması önerilmez (Bkz. Bölüm 4,2). Değişik derecelerde böbrek yetmezliği olan deneklerde, tek bir oral 3 mg uzalılmış .salimli tablet paliperidon dozunun dağılımı İncelenmiştir, Paliperidon elİmİnasyonu, azalan kreatinin klerensi ile biriikte azalmıştır. Paliperidonun toplam klerensi, bozulmuş böbrek fonksiyonu olan hastalar arasında hafif böbrek yetmezliğinde (CrCI =50 - <80 ml/dak) ortalama %32, orta böbrek yetmezliğinde (CrCI= 30 - <50 ml/dak) ortalama%64ve ağtr böbrek yetmezliğinde {CrCI=10 - <30 ml/dak) ortalama %7I azalmıştır. Bu durum sağlıklı denekierie karşılaştırıldığında, maruziyelte (EAA¡f) sırası ile 1.5, 2,6 ve 4.8 kat ortalama artışa denk düşer. Hafif böbrek yetmezliği olan deneklerde XEPLION ile sınırlı sayıda gözleme ve farmakokinetik simülasyonlara göre, hafif böbrek yetmezliği olan hastalarda önerilen XEPLION başlangıç dozu tedavinin birinci gününde 100 mg'lık doz ve bir hafta sonra 75 mg'dır (her ikisi de deltoid kas içine uygulanır); daha sonra ayda bir (4 haftada bir) deltoid veya gluteal kas içine hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 50 mg'hk enjeksiyonlaria devam edilir (Bkz. Bölüm 4.2).
Yaslılarda:
Sadece yaşa bağlı dozaj ayariaması önerilmez. Ancak, kreatinin klerensinde yaşla ilgili azalma nedeni ile doz ayarlaması gerekli olabilir (Bkz. Bölüm 5.2 ve Bölüm 4.2).
ilk:
Oral paliperidon ile yapılan çalişmalarm popülasyon farmakokinetiği analiz verileri, XEPLION uygulamasını takiben paliperidonun farmakokinedğinde ırka bağlı farklılıkların kanıtını göstermemiştir.
Cinsiyet:
Erkekler ve kadınlar arasında klinik olarak anlamlı fark gözlenmemiştir.
Sigara kullanım durumu:
İnsan karaciğer enzimleri kullanılanin viiroçalışmalar temel alınarak, paliperidon CYP1A2 için bir .substrai değildir; dolayısıyla sigara kullanımının paliperidon farmakokinetiğine bir etkisi olmamalıdır. Buin viirobulgularla uyumlu olarak popUia,syon farmiikokinctik değerlendirmesi, sigara kullananlar ile kullunmayiinlar arasında herhangi bir fark ortaya koymamıştır.
5.3. KHnik önctsi güvtinlilik verileri
Toksikoioji
Oral uygulanan paliperidonun yanı sıra, dopamin D2 reseptörlerini antagonize eden diğer ilaçlarda olduğu gibi intramüsküler olarak uygulanan paliperidon palmitat tekrarlanan-doz loksisitesi çalışmalarında serum prolaktin düzeylerini yükseltmiştir.
Adolesanlar için mg/m2 bazında önerilen günde 12 mg'lık maksimum insan oral dozunun
0,12, 0,5 ve 1,8 katı olan günde 0,16, 0,63 ve 2,5 mg/kg'lık oral paliperidon dozlarıyla sıçanlarda yapılan 7 haflahk juvenil toksisitesi çalışmasında gelişim, cinsel olgunlaşma ve üreme performansı üzerinde hiçbir etkisi gözlenmemiştir. Günde 2,5 mg/kg'a kadar olan oral dozlar, 2,5 mg/kg/gün ile tedavi edilen dişi sıçanlarda öğrenme ve hafıza üzerine etkiler dişında erkek ve dişilerde norodavramşsal gelişimi olumsuz etkilememiştir. Bu etki leüavi bırakıldıktan .sonra gözlemlenmemiştir.
Günde 0,31, 1,25 ve 5 mg/kg dozlarında oral risperidonla (geniş Ölçüde paliperidona dönüştürülmüştür) tedavi edilen juvenil köpeklerie yapılan 40 haftalık bir çalışmada cinsel olgunlaşma günde 0,31 ve 1,25 mg/kg dozlarında olumsuz olarak etkilenmemiştir. Uzun kemik gelişimi günde 0,31 mg/kg dozunda etkilenmemiştir; etkiler günde 1,25 ve 5 mg/kg dozlarında gözlenmiştir,
Kars i noj en i site
İntramüsküler olarak enjekle edilen paliperidon palmiEaEm karsinojenik potansiyeli sıçanlarda değerlendirilmiştir, 10, 30 ve 60 mg/kg/ay'hk dozlarda dişi sıçanlarda meme bezi adenokarsinomlarmda istatistiksel olarak anlamlı bir artış olmuştur. Erkek sıçanlarda, XEPLION'un mg/kg esas alınarak 150 mg'hk maksimum önerilen insan dozunun 1.2 ve 2.2 katı olan 30 ve 60 mg/kg/ay'hk dozlarda meme bezi adenomları ve karsinomlannda isEatistiksel olarak anlamlı bir artış görülmüştür,
Risperidonun akEif bir metaboliti olan oral paliperidonun karsinojenik potansiyeli, farelerde ve sıçanlarda yürütülen risperidon çalışmalarına göre değerlendirilmiştir. Risperidon, farelere
18 ay süre ile ve .sıçanlara 25 ay süre ile JO mg/kg/gün şeklinde uygulanmıştır. Hipofiz bezi adenomlan, endokrin pankreas adenomian ve meme bezi adenokarsinomlanndii isEiitistiksel olarak anlamlı artışlar olmuştur. Diğer antipsikotik ihıçlann kronik olarak uygulanmasından sonra, kemirgenlerde meme, hipofiz ve endokrin pankreas tümörlerinde bir artış saptanmış ve bu artışın uzatılmış dopamin Di antagonizmasına bagİı olduğu düşünülmüştür. Kemirgenlerde bu tümör bulgularının insan riski ile ilişkisi bilinmemektedir.
Mutajenisite
Ames ters mulasyon testinde, fare lenfoma tayininde ve sıçan mikronükleus testinde paliperidonun mutajenik potansiyeli ile ilgili bulgu .saptanmamıştır. Palİperidon palmitat, Ames ters mutasyon testinde veya fare lenfoma tayininde genoioksik özellikler göstermemiştir.
Fertiiitede bozukluk
Oral palİperidon tedavisi, prolaktin- ve santral sinir sistemi* aracılı etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi .sıçanların ferlilitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi .sıçanların canlı embriyo sayısında hafif bir düşüş göstermiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Poİisorbat 20
Polietilen glikol 4000
Sitrik asit nionohidrat
Anhidr d i sodyum hidrojen fo.sfat
Sodyum dihidrojen fosfat monohidrat
Sodyum hidroksit
Enjeksiyonluk .su
6.2. Ge^imsizUkler
Geçimlilik ile ilgili çalışma yapılmadığmdan, bu tıbbi ürün başka tıbbi ürün veya seyreltici ile karıştınimamulı, intramüsküler uygulama direk olarak kİi içindeki enjektörden yapıİmaiıdir.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C aİtındsıki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
♦ 50 mg (0.50 mİ) paliperidon {78 mg paliperidon palmitata eşdeğer) süspansiyonu ile kullamma hazır piston tıpalı ve uç başlıklı (bromobutil lastik) bir enjektör (siklik-olefin-kopolimeri), merkezi mavi renkli bir güvenlik iğnesi ve merkezi gri renkli bir güvenlik iğnesi içeren kit
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği ve
Ambalaj Atıklarının Konirolü Yonelmeliklerine uygun olarak imha edilmelidir.
Kit, intramüsküler enjeksiyon için kullanıma hazır enjektör ve 2 güvenlik İğnesi içerir.
Pazariama Sonrası Veriler
Paliperidon ile iik olarak pazariamu sonrası deneyimde spontun bildirimlere dayanan bir sikiık kategorisi ile verilen advers ilaç reaksiyonları aşağıdaki tabloda yer almakladır. Aşağıdaki terimler ve sıklık dereceleri kullanılmıştır;
Çok yaygın (>I/iO); yaygın (>1/100 ile <1/10); yaygın olmayan {>1/1000 ile <1/100); seyrek (>1/10,000 ile <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Spontan bildirimlere dayanan bir sıklık kategorisi ile paliperidon pazarlama sonrası deneyiminde tanımlanmış olan advers olaylar
Çok seyrek: Neonalal İlaç yoksunluk sendromu
Bu sınıfa özgü olaylar
Enjeksiyon bölgesi reaksiyonları: En sık bildirilen yan etki ağrıdır. Bu reaksiyonların çoğu hafif ila orta şiddettedir. Bütün faz 2 ve faz 3 klinik çalışmalarında, enjeksiyon bölgesi ağrısının bireysel algısı zamanla sıklık ve yoğunluğu azaltmayı amaçlayan görsel analog skalada değerlendirmiştir, Deltoid enjeksiyonlar gluleal enjeksiyonlara oranla biraz daha fazla ağnli olarak algılanmıştır. Diğer enjeksiyon bölgesi reaksiyonları çoğunlukta hafif yoğunluktadır ve enjeksiyon bölgesinde sertleşme (yaygın), kaşıntı (yaygın olmayan) ve nodüller (seyrek) olarak tanimlanmıştir.
Kilo alma: 150 mg'hk başlangıç dozunun kullanıldığı 13 haftalık çalışmada, vücut ağırlığının %7'si ve daha fazla kilo alma kriterini karşılayan bireylerin oranlan, XEPL10N gruplannda plasebo grubuna göre daha yüksek orandadır. %7 ve daha fazla anormal kilo alımı olan denek oranı, dozla ilişkili bir eğilim göstermiştir ve insİdans oranı plasebo grubunda %5 iken; XEPL10N 25 mg, 100 mg ve 150 mg gruplannda plasebo ile karşılaştırmalı olarak sırasıyla %6, %8 ve %13 bulunmuştur.
Uzun dönemde nüksü önleme çalışmiismm 33 haftalık açık etiketli geçiş/idame dönemi esnasnıda, XEPLION İ!e tedavi edilen deneklerin %12'si bu kritere uymuştur (çift-kör fazmdan son noktaya kadar >%7 kito artışı); açık etiketli başlangıca göre ortalama (SD) ağırlık değişikliği +0,7 (4,79) kg olmuştur.
Laboratuar te.stleri
Serum prohıktin: XEPLION alan deneklerde her iki cinsiyette de, serum prolaktin düzeyinde ortalama artışlar gözlenmiştir. 13 haftalık, çift kor, plasebo kontrollü üç çalışmadan elde edilen verilere göre, prolaktin düzeylerinde artışı düşündürebilecek advers olaylar (örn.; amenore, galaktore, jinekomasti) genelde deneklerin % Tinden azmda bildirilmiştir.
Sınıf etkileri
Antipsikotik ilaçların kullanılması sonucunda QT uzaması, ventriküler aritmiler (ventriküler fibrilasyon, ventriküler taşikardi), ani beklenmedik Ölüm, kardiyak arrest ve Torsades de pointes görülebilir,
Pulmoner embolizm ve derİn ven trombozu vakaları da dahil olmak üzere, antipsikotik ilaçlarla venöz tromboembolik olay bildirilmiştir (Sıklık bilinmemektedir).
4,9,Doz aşımı ve tedavisi
XEPLION'un, sağlık personeli tarafından uygulanması gerektiğinden hastaların aşın doz alma potansiyeli düşüktür.
Belirliler
Genellikle, beklenen bulgu ve .semptomlar paliperidonun bilinen farmakolojik etkilerinin artması şeklindedir. Bunlar, uyuşukluk ve sedasyon, taşikardi ve lıipotansiyon, QT uzaması ve ek.strapiramidal semptomlardır. Torsade de pointes ve ventriküler fibrilasyon, oral palİperidon ile doz aşımı ayarında rapor edilmiştir. Akut doz aşımı durumunda, birden fazla ilaç ihtimali düşünülmelidir.
7'eJüvi
Tedavi gereksinimleri ve iyileşme değerlendirilirken XEPLION'un uzatılmış salım özelliği ve
paliperidonun uzun yarılanma ömrü göz önünde tutulmalıdır. Paliperidonun spesifik bir
antidotu yoktur. Genel destekleyici önlemler uygulanmalıdır. Hava yolu açık tutulmalı,
korunmalı ve yeterli oksijenasyon, ventiiasyon sağlanmalıdır. Kardiyovasküler izlemeye
tiemen başlanmalı ve olası aritmiler için sürekli elektrokardİyografik izleme yapılmalıdır.
Sayfa 18/34
Hipotansiyon ve dolaşım kollapsı, iniravenöz sıvı ve/veya sempalomimetik ilaçlar gibi uygun önİennlerie tedavi edilmelidir. Ciddi ekstrapiramidal semptomların varlığında antikolinerjik İlaçlar uygulanmahdır. Hasta iyileşene kadar yakın denetim ve gözlem sürdürülmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinanıİk Özellikler
Farmakoterapötik grup; Diğer antipsikotikler ATCkodu:N05AXI3
XEPLİON paliperidonun (+)- ve {-)- rasemik karışımını içerir.
Etki mekanizması:
Paliperidon palmitat, paliperidona hidrolize olur (Bkz. Bölüm 5.3). Paliperidon, daha çok serotonerjik 5-HT:a antagonistik aktivitesi olan merkezi etkili dopamin D; antagonistidir, Paliperidon, aynı zamanda alia-l ve alfa-2 adrenerjik resepförierin ve Hı hi.staminerjik reseptörlerin antagonisti olarak etki eder. Paliperidonun kolinerjik muskarinik veya (İj- ve Bz-adrenerjik reseptörlere afinitesi yoktur. (+)- ve (-)- paliperidon enantiyomerierinin farmakolojik aktivitesi, kalitatif ve kanlitatif olarak benzerdir.
Şizofrenide etkili olan diğer ilaçlarda olduğu gibi paliperidonun etki mekanizması bilinmemekledir. Ancak, ilacın şizofrenideki ierapötik aktivitesinin, dopamin Tip 2 (Di) ve serotonin Tip 2 (SHT^a) reseptör antagonİzmasmın kombinasyonu ile kontrol edildiği öne sürülmüştür. Di ve SHT^a dışındaki diğer re.septörlerdeki antagonizmu, paliperidonun diğer etkilerinin bazılarını açıklayabilir.
Eiektrofızyoloji
Oral paliperidonun QT aralığı üzerindeki etkileri, şizofreni ve şizoafektif bozukluğu olan erişkinlerde yapılan iki randomize, çift-kör, çok merkezli, faz 1 çahşmasmda ve şizofrenili erişkinlerde yapılan aktif kontrollü, 6 haftalık, .sabit dozlu etkinlik çalışmalarında değerlendirilmiştir.
İlk faz 1 çalışmasında (n=141), denekler 7 gün süre ile günde bir kere hızlı salimli oral
paliperidon (4 mg'dan 8 mg'a titre edilerek) veya tek doz moksifloksasin (400 mg) almak
üzere randomize olarak ayrılmışlardır. Günde tek doz 8 mg hızlı salimli oral paliperidon
(n=50, 313 ng/ml) ile elde edilen ortalama kararlı durum maksimum plazma
konsantrasyonu, deltoid kas içine uygulanan önerilen maksimum 150 mg'lık XEPLİON dozu
Sayfa 19/34
ile gözlenen 2 kat daha yüksek maruziyete göre dalia yüksek bulunmuştur {öngörülen ortalama Cux = 50 ng/mİ), Model-ayarlı, gün'Ortalamalı lineer-deriveli QT düzeltmesinde {QTcLD), XEPLION tedavi grubunda {n=50) 5.5 milisaniye!ik (ms) ortalama artiş saptanmıştır(%90CI; 3.66; 7.25).
İkinci faz t çalışmasında {n=109) denekler; pla.sebo, maksimum önerilen orai uzatılmış salımh paliperidon dozu (günde bir kere 12 mg) ve bunu takiben önerilen aralığın üzerinde bir doza titrasyon {günde bir kere 18 mg) veya aynı farmakolojik ilaç sınıfından bir ilacı (günde iki kez 400 mg ketiapin) aktif kontrol olarak alacak şekilde rastgele ayrılmışlardır. Bu 10 günlük eşit etkinlik çalışmasmda, birincil karşılaşurma 12 mg uzatılmış salimli paliperidon ile ketiapin arasında yapılmıştır. Her bireyin saptanan tıax değerinde QTcLD'de başlangıca göre en düşük kareler ortalamasının değişikliği, 12 mg uzatılmış salimli paliperidon için (ortalama C,as 34 ng/ml), günde iki kez 400 mg ketiapin ite karşılaştırıldığında (orlatama 1183 ng/ml) 5.1 ms daha düşük bulunmuştur (%90 CI; -9.2; -0.9), Bu değer önceden belirlenmiş 10 ms olan eşit etkinlik kriterine uygundur. Her bireyin saptanan tm^ değerinde QTcLD'de başlangıca göre ortalama değişiklik, 18 mg uzatılmış salimli paliperidon için (ortalama Cıax 53 ng/ml), günde iki kez 400 mg ketiapin ile karşılaşlınldığında (ortalama 1183 ng/ml) 2.3 ms daha düşük bulunmuştur {%90 CI: -6.8; 2,3).
Her bireyin saptanan t5a\ değerinde QTcLD'de ortalama değişiktik, eşzamanlı plasebo grubunda saptanan ortanca t,Mx değerinde (karşılaştırılan aklif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaşiinldığında, 12 mg uzatılmış salimli paliperidon için 1.5 ms daha yüksek {%90 CI: -3.3; 6.2) ve günde iki kez 400 mg keiiapin için 8.0 ms daha yükseki%90CI: 3,1; 12.9) bulunmuştur. Her bireyin saptanan t^u.^ değerinde QTcLD'de ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca tn¡a^ değerinde (karşılaştfrılan aktif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaştırıldığında, 18 mg uzatılmış satımİi paliperidon için 4.9 ms daha yüksek (%90 Cl: -0.5; 10.3) ve günde İki kez 400 mg keliapin için 7.5 ms daha yüksek (%90 CI; 2,5; 12.5) bulunmuştur.
Bu çalişmalarm tıiçbirisinde herhangi bir zamanda deneklerde, başlangıca göre 60 mili.saniyeyi geçen bir değişiklik veya 500 milisaniyeyi geçen bir QTcLD görülmemiştir.
Ora! uzatılmış salimli paliperidonla ilgili .sabil dozlu üç etkinlik çalışmasında, standardize editmiş bir yöntem kullanılarak belirli günlerde (beklenen Cm¡ts sürelerini İçeren) 15 zaman noktasmda, kapsamlı elektrokardiyografi (ECG) ölçümleri almrnıştır. Uzatılmış salimli paliperidon ile tedavi edilen 836 denek, olanzapin ile tedavi edilen 357 denek ve plasebo ile tedavi edilen 350 deneğin loptu verilerine göre tierhangi bir zaman noktasında, herhangi bir
Sayfa 20/34
tedavi grubunda ortalama QTcLD artışı 5 milisaniyeyi geçmemiştin Bu çalışmalar esnasında, uzatılmış salimli 12 mg palİperidon ve olanzapin grupiartnm her birisinde bir denekte bir zaman noktasında 60 milisaniyeyi geçen değişiklik olmuştur (sırası ile 62 ve ! 10 milisaniye artişlan).
XEPLION'»n dört sabit dozlu etkinlik çalışmasmda, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamış ve herhangi bir zaman noktasmda 500 milisaniyeden fazla QTcLD değeri görülmemiştir. Uzun süreli nüksü önleme çalışmasında, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamıştır ve bir denekte 507 mili.saniyelik QTcLD değeri saptanmıştır (Bazett düzeltilmiş QT aralığı [QTcB] 483 milisaniye). Bu hastada ayrıca kalp hızı 45 alım/dakika bulunmuştur.
Klinik Etkinlik
XEPLION'un şizofreninin akut tedavi.sinde etkililiği, şizofreni için DSM-IV kriterlerini karşılayan akut nüks gelişmiş yatan erişkin ha.stalarda yapılan kısa süreli (biri 9 haftalık ve üçü 13 haftalık) çift-kör, randomize, plasebo kontrollü, sabit dozlu dört çalışmada değerlendirilmiştir. Bu çalışmalarda 1 XEPLİON'un sabit dozları, 9 haftalık çalışmada i, , 8. ve 36. günlerde ve 13 haftalık çalışmalarda ek olarak 64. günde verilmiştir (ilk iki doz için bir haftalık aralıklarla ve daha sonra idame için 4 haftada bir).
Etkinlik, Pozitif ve Negatif Sendrom Ölçekleri (PANSS) kullanılarak değerlendirilmiştir, PANSS, pozitif semptomları, negatif semptomları, dağınık düşünceleri, kontrol edilemeyen saldırganlikyheyecanı ve anksiyete/dcpresyonu değerlendirmek için beş faktörden oluşan valide edilmiş çok maddeli bir Ölçektir. Fonksiyon, Kişisel ve Sosyal Performans (PSP) ölçeği kullanılarak değerlendirilmiştir. PSP, sosyal olarak yararlı aktivite alanlarında kişisel ve sosyal fonksiyonu ölçen ve klinisyenin derecelendirdiği valide edilmiş bir ölçektir; iş ve çalışma, kişisel ve ,so.syal ilişkiler, kendi kendine bakım ve rahatsız edici ve agre.sif davranışlar. Sosyal, kişisel ve kendi kendine bakım alanlarında disfonksiyonun şiddeti, bu aktİviteleri başkalarının yardımı ile ve başkalarının yardımı olmaksızın uygulamada zorluk derecesi (yok, hafif, aşikar, belirgin, şiddetli) ile ölçülür. Benzer şekilde, agresif davranışlarda disfonksiyonun şiddeti, agresif davramşlann varlığı veya yokluğu (kabalık, başkalarma toplum içinde hakaret etmek, ne.sneleri kırmak, sözlü tehditler, fiziksel saldırı) ve bu davranışların sıklığı ile ölçülür.
XEPLİON'un üç sabit dozunu (başlangıçta 150 mg'hk deltoid enjeksiyon ve bunu takiben 25 mg/4 hafta, 100 mg/4 hafta veya İ50 mg/4 hafta şeklinde 3 gluteal veya deltoid doz) plasebo ile karşılaştıran 13 haftalık çalışmada (n=636), XEPLION'un üç dozu da, PANSS toplam
Sayfa 21!34
puanını diizeitmek açısından plaseboya göre üsEün bulunmuştur. Bu çalışmada, hem !00 mg/4 hafta hem de 150 mg/4 haftalık tedavi gruplan PSP puanı açısından phıseboya güre istatistiksel olarak anlamlı üstünlük güstermİşken, 25 mg/4 haftalık tedavi grubu üstünlük göstermemiştir. Bu bulgular, tedavi süresi boyunca etkililiği ve PANSS'de düzelmeyi desteklemektedir ve dördüncü gün kadar erken dönemde gözlenmiştir. Sekizinci günde ise 25 mg ve 150 mg'hk XEPL10N gruplarında plaseboya güre anlamlı farklılık gözlenmiştir.
XEPLION'un üç sabit dozunu (50 mg/4 hafta, 100 mg/4 hafta ve 150 mg/4 hafta) plasebo ile karşılaştıran diğer bir 13 haftalık çalışmada (n=349), sadece İOO mg/4 haftalık XEPLION grubu, PANSS toplam puanında düzelme açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 50 mg/4 hafla, hem de 100 mg/4 hafta dozları, PSP puanım düzeltmek açısından plaseboya üstün bulunmuştur. Bu çalışmaya 150 mg'lık bir doz dahil edilmesine rağmen, bu dozu alan gönüllü sayısı, bu dozun etkililiği İle ilgili kesin sonuçlara varmak için yeterli değildir.
XEPLION'un üç sabit dozunu (25 mg/4 hafta, 50 mg/4 hafta ve 100 mg/4 hafta) plasebo ile karşılaştıran üçüncü 13 haftalık çalışmada (n=5l3), XEPL10N'un üç dozu da, PANSS toplam puanım düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, paliperidon doz grupların tamamında, PSP puanı açısından plaseboya göre istatistiksel olarak anlatiilılık saptanmamıştır.
XEPLION'un iki sabit dozunu (50 mg/4 hafta ve İOO mg/4 hafta) plasebo ile karşılaştıran 9 haftalık çalışmada (n=197), XEPLION'un iki dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur,
XEPLION'un şizofrenide semptomatİk kontrolü idame etmek ve şizofrenide relapsı geciktirme açısından etkililiği, şizofreni için DSM-IV kriterlerini karşılayan 849 yaşlı olmayan erişkin gönüllüleri içeren uzun süreli çift-kör, plasebo kontrollü, esnek dozlu bir çalışmada belirlenmiştir. Bu çalışma, 33 haftalık açık etiketli akut tedavi ve stabilizasyon fazı, randomize, plasebo kontrollü bir faz {nüks açısından gözlem yapmak üzere) ve 52 haftalık açık etiketli uzatma dönemini İçermiştir. Bu çalışmada, XEPLION dozlan ayda bir defa uygulanan 25, 50, 75 ve 100 mg dozlarını içermiştir; 75 mg dozuna yalnızca 52 haftalık açık etiketli uzatmada izin verilmiştir. Hastalar, başlangıçta 9 haftalık bir geçiş dönemi sırasında esnek dozlarda (25-100 mg) XEPLION almıştır. 24 haftalık koruma dönemine girmek İçin hastaların PANSS skorunun <75 olması gerekmiştir. Dozlama ayarlamalanna yalnızca koruma döneminin ilk 12 haftasında İzİn verilmiştir. Değişken uzunlukta çift-kÖr faz esnasında, hastalar .stabiliza.syon fazında aldıklan aynı XEPLION'un doz grubuna (ortanca süre 171 gün [aralıklar 1 gün-407 gün]) veya piasebo grubuna (orialama süre 105 gün [aralıklar 8 gün-441 gün] randomize olarak ayrılmıştır. Toplam 410 stabilize hasta, şizofreni semptomlarında nüks oluşana kadar, XEPLION veya plasebo gruplanna randomize olarak ayrılmiştır. Nüks, aşagıdakilerden birinin veya daha fazlasının ilk olarak ortaya çıkma zamanı olarak tanımlanmıştır. Bunlar; psikiyatrik hospitalizasyon, iki ardışık değerlendirmede toplam PANSS puanında >%25 artış (başlangıç puanı >40 ise) veya 10 puanlık artış (başlangıç puanı <40 ise), kasıtlı olarak kendi kendini yaralamak, saldırgan davranış, intihar/öldürmeye eğilimli düşünceler veya PANSS maddelerinin P1 (Delüzyonlar), P2 (kavramsal disorganizasyon), P3 (Halüsinasyonla ilgili davranış), P6 (Şüpheciiik/perseküsyon), P7 (Düşmanlık) veya G8 (işbirliği yapamama) ardışık iki değerlendirmesinde puanın >5 (maksimum başlangıç puanı <3 ise) veya >6 (maksimum başlangıç puanı 4 ise) olmasıdır, Primer etkinlik değişkeni, nükse kadar geçen süre olmuştur. Daha önceden planlanmış bir ara analiz (68 nüks olayı yaşandıktan sonra), nükse kadar geçen sürenin, XEPLION ile tedavi edilen hastalarda, plaseboya kıyasla anlamlı derecede daha uzun olduğunu göstermiştir (Şekil I) ve etkililiğin devam ettiği gösterildiğinden çalışma erken sonlandırılmıştır.
Şcki] 1, Zamany karşı niiksü kıyaslayan Kaplan -Meicr Grangi - Ara Analizi (Ti.'daviji aınü(,'layan analiz .si.'ii)

Rantlomi/asyundun beri geçen süre (gün)
Çalışmanın sonlandırıldıgı tarihe kadar tüm verileri içeren nihai verilere dayanılarak yapılan analizin sonucu, ara verilere dayalı birincil etkililik analizinin sonucu İle tutarlıdır.
Popiihısyon ull gruplarının incele nntıes i, cinsiyet, yaş veyaııktemci al m arak tedaviye yanıt açısından klinik olarak anlamlı fark göstermemiştir.
5.2. Farmakokineük özellikler Genel Özellikler
Emiiim:
Sudaki çözünürlüğünün aşın düşük olmasına bağlı olarak paliperidon palmilat, intramüsküler enjeksiyondan sonra paliperidona hidroliz olmadan önce yavaşça çözünür ve sistemik dolaşmıa absorbe olur. Tek bir intramüsküler enjeksiyonu takiben paliperidonun plazma konsantrasyonun, 13 günlük ortalama tmcix süresi içinde yavaş yavaş yükselerek maksimum plazma konsantrasyonlanna yükselir, ilacın salmması, birinci gün kadar erken bİr zamanda başlar ve 126 gün kadar sürer.
Deltoid kas içine tek doz intramüsküler enjeksiyonunu takiben (25 mg-150 mg), glútea! kas içine enjeksiyonla karşılaştınldıgmda onalama olarak %28 daha yüksek bir gözlenmiştir, 1. günde 150 mg ve 8. günde lüO mg'ın iki başlangıç deltoid intramüsküler enjeksiyonu, terapötik konsantrasyonlara hızla ulaşılmasına yardımcı olur. XEPLÍON'un salım profili ve doz rejimi, lerapötik konsantrasyonların devam etmesini sağlamaktadır. 100 mg'hk XEPLÍON dozu için ortalama kararlı durum doruk noktası: iki dalga ara.sındaki çukur oranı, gluteal uygulamayı takiben 1.8 ve delioid uygulamayı takiben 2,2 olmuştur. 25 mg*l50 mg'lık doz aralığmda XEPLION uygulamasını takiben paliperidonun görünen ortalama yanlanma ömrü 25 ile 49 gün arasında değişmiştir,
Paliperidon palmilat uygulamasını takiben paliperidonun (+) ve {-) enantiyomerleri birbirine dönüşür ve yaklaşık olarak l,6-L8'lik bir EAA {+)/(-) oranına ulaşır.
DaSıhm:
Popülasyon analizine göre paliperidonun görünen dağdım hacmi 391 litredir. Rasemik paliperidon plazma proteinine %74 oranında bağlanır.
Bivolransformasvon:
1 mg hızlı salimli '"*C-paliperidonun tek bir oral dozunun uygulanmasından 1 hafta sonra, dozun %59'u İdrarla değişmeden atılmıştır. Bu durum, paliperidonun karaciğerde ileri derecede metabolize olmadığını göstermektedir. Hiçbirisi verilen dozun %6.5'inden fazlasını kapsamayanin vivodöri metabolik yolak tanımlanmıştır: dealkilasyon, hidroksilasyon,
Sayfa 24/34
(Jehidrojenasyon ve benzisoksazotUn bölünmesi.!n viiroçahşmahır, paliperidon melaboiizmasmda CYP2D6 ve CYP3A4'Un rol oynadığmı göstermesine rağmen, paliperidonun metaboUzmasmdain vivoolarak bu izoenzimlerin öncmü bir rol oynadığına dair bir kanıt yoktur. Popiilasyon farmakokinetik analizleri, oral paliperidonun uygulanmasından sonra paliperidonun görünen klcrensinde CYP2D6 substratlarmın hızlı metabolize edicileri ile yavaş metabolize edicileri arasında ayırt edilebilir fark göstermemiştir, İnsan karaciğer mikrozomlarmda yapılanin viiroçalışmalar, paliperidonun, CYPIA2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5'i içeren sitokrom P450 izoenzimleri tarafından metabolize edilen ilaçlarm metabolizmasın! büyük ölçüde inhibe etmediğini göstermiştir,
In vitroçalışmalar, paliperidonun bir P*gp substratı olduğunu ve yüksek konsantrasyonlarda P-gp'nin zayıf bir inhibitörü olduğunu göstermiştir.In vivoveriler yoktur ve klinik ilişki bilinmemektedir.
Eliminasvon:
1 mg hızlı salimli ^'C-paliperidonun Eek bir oral doz uygulanması ile verilen radyoaktivitenin yaklaşık %80'i idrarda ve % li 'i feçeste bulunmuştur.
Dot'rusallık/Dot'rusal olmayan durum:
XEPL10N uygulamasını takiben toplam paliperidon maruziyeti, 25 mg-150 mg'hk doz aralığının üzerinde dozla oranUh olmuştur ve 50 mg'ı aşan dozlarda için dozla-orantıdan düşüktür.
Uzun eikiÜ paliperidon palmitat enjeksiyonu ile oral uzatılmış salimli paliperidonun karitla-pınlması
XEPLİON, paliperidonu ayda bir uygulamak üzere tasarianmıştır. Uzatılmış salimli oral paliperidon ise günde bir kere uygulanır. Şekil 2, önerilen başlangıç rejimi kullanılarak XEPLION uygulamasını takiben 5 hafta süre ile paliperidonun ortanca farmakokinetik profilini, oral uzatılmış salimli tablet (6 mg veya 12 mg) uygulaması ile karşılaştırmalı olarak sunmaktadır. XEPLION'un başlangıç rejimi (1. gün/8, günde deltoid kas içine 150 mg/100 mg), tedaviyi oral destek kullanmaksızın başlatırken kararlı durum paliperidon konsantrasyonlarına hızla ulaşmak üzere lasarlanmıştır.

00~i0ra! 6 mg palipcritİnıı --'-Oral 12 mg palİperidon
XEPUON
- Mesapliinan oral 6 mg kararlı durum
Musaplanan oral 12 karar!) durum
1522
Zaman (gün)
Şekil 2, Ora) uzatılmiş salimit lahlelin (6 mg veya 12 mg) günlük uygulaması ile karşılaşıırmalı olarak tincrilcn başlangıç rejimi kullanılarak (1 ,gün/8.günde dcitoid kus içine 150 mg/lOO mg palipcridona eşdeğer palİperidon palmiial iie başiatıgıç) XEPLION'un uygulamasını takiben 5 hal'la süre ile palİperidon için (malama farmakokinetik profillerini takiben ortalama piazma konsanirasyonu-zaman profilleri.
Genel olarak, XEPL10N ile gözlenen genel başlangıç plazma düzeyleri, 6 mg-12 mg uzatılmış salimli oral palİperidon ile gözlenen maruziyet sfmrları içinde bulunmuştur. XEPLION başlangıç rejiminin kullanılması, en düşük değerlerin görüldüğü doz öncesi günlerde bİle (8. gün ve 36. gün) hastaların, 6 mg-12 mg uzatılmış salimli oral paliperidonun bu maruziyet penceresinde kalmalannı saglamiştır. XEPLİON uygulamasmı takiben palİperidon farmakokinetiği için gönüllüler arasında değişkenlik, uzatılmış .salimli oral palİperidon tabletlerinde belirlenen değişkenliğe göre daha az bulunmuştur, iki ürün arasındaki ortanca farmakokinetik profillerindeki fark nedeni ile farmakokinetik özelliklerini direkt olarak karşılaştırılırken dikkatli olmak gerekir.
Hastalardaki karakteristik özellikler
Karaciizer yetmezliği:
Palİperidon, karaciğerde yaygın şekilde metaboİize edilmemektedir, XEPLION, karaciğer yetmezliği olan hastalarda incelenmemiş oima.sına rağmen, hafif veya orta derece karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir, Orta derecede karaciğer yetmezliği olan (Child-Pugh sınıf B) hastalarda orai paliperidon ile yapfIan bir çahşmada, serbest paliperidontm plazma konsantrasyonu, sağlıklı deneklerle benzerdir. Paliperidon, ağır karaciğer yetmezliği o!an hastalarda incelenmemiştir.
Böbrek vetmezliûi:
Hafif böbrek yetmezliği olan iıastaiarda XEPLION dozu azaiiılmalıdır. XEPLION'un, orta veya ağır böbrek yetmezliği olan hastalarda kullanılması önerilmez (Bkz. Bölüm 4,2). Değişik derecelerde böbrek yetmezliği olan deneklerde, tek bir oral 3 mg uzalılmış .salimli tablet paliperidon dozunun dağılımı İncelenmiştir, Paliperidon elİmİnasyonu, azalan kreatinin klerensi ile biriikte azalmıştır. Paliperidonun toplam klerensi, bozulmuş böbrek fonksiyonu olan hastalar arasında hafif böbrek yetmezliğinde (CrCI =50 - <80 ml/dak) ortalama %32, orta böbrek yetmezliğinde (CrCI= 30 - <50 ml/dak) ortalama%64ve ağtr böbrek yetmezliğinde {CrCI=10 - <30 ml/dak) ortalama %7I azalmıştır. Bu durum sağlıklı denekierie karşılaştırıldığında, maruziyelte (EAA¡f) sırası ile 1.5, 2,6 ve 4.8 kat ortalama artışa denk düşer. Hafif böbrek yetmezliği olan deneklerde XEPLION ile sınırlı sayıda gözleme ve farmakokinetik simülasyonlara göre, hafif böbrek yetmezliği olan hastalarda önerilen XEPLION başlangıç dozu tedavinin birinci gününde 100 mg'lık doz ve bir hafta sonra 75 mg'dır (her ikisi de deltoid kas içine uygulanır); daha sonra ayda bir (4 haftada bir) deltoid veya gluteal kas içine hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 50 mg'hk enjeksiyonlaria devam edilir (Bkz. Bölüm 4.2).
Yaslılarda:
Sadece yaşa bağlı dozaj ayariaması önerilmez. Ancak, kreatinin klerensinde yaşla ilgili azalma nedeni ile doz ayarlaması gerekli olabilir (Bkz. Bölüm 5.2 ve Bölüm 4.2).
ilk:
Oral paliperidon ile yapılan çalişmalarm popülasyon farmakokinetiği analiz verileri, XEPLION uygulamasını takiben paliperidonun farmakokinedğinde ırka bağlı farklılıkların kanıtını göstermemiştir.
Cinsiyet:
Erkekler ve kadınlar arasında klinik olarak anlamlı fark gözlenmemiştir.
Sigara kullanım durumu:
İnsan karaciğer enzimleri kullanılanin viiroçalışmalar temel alınarak, paliperidon CYP1A2 için bir .substrai değildir; dolayısıyla sigara kullanımının paliperidon farmakokinetiğine bir etkisi olmamalıdır. Buin viirobulgularla uyumlu olarak popUia,syon farmiikokinctik değerlendirmesi, sigara kullananlar ile kullunmayiinlar arasında herhangi bir fark ortaya koymamıştır.
5.3. KHnik önctsi güvtinlilik verileri
Toksikoioji
Oral uygulanan paliperidonun yanı sıra, dopamin D2 reseptörlerini antagonize eden diğer ilaçlarda olduğu gibi intramüsküler olarak uygulanan paliperidon palmitat tekrarlanan-doz loksisitesi çalışmalarında serum prolaktin düzeylerini yükseltmiştir.
Adolesanlar için mg/m2 bazında önerilen günde 12 mg'lık maksimum insan oral dozunun
0,12, 0,5 ve 1,8 katı olan günde 0,16, 0,63 ve 2,5 mg/kg'lık oral paliperidon dozlarıyla sıçanlarda yapılan 7 haflahk juvenil toksisitesi çalışmasında gelişim, cinsel olgunlaşma ve üreme performansı üzerinde hiçbir etkisi gözlenmemiştir. Günde 2,5 mg/kg'a kadar olan oral dozlar, 2,5 mg/kg/gün ile tedavi edilen dişi sıçanlarda öğrenme ve hafıza üzerine etkiler dişında erkek ve dişilerde norodavramşsal gelişimi olumsuz etkilememiştir. Bu etki leüavi bırakıldıktan .sonra gözlemlenmemiştir.
Günde 0,31, 1,25 ve 5 mg/kg dozlarında oral risperidonla (geniş Ölçüde paliperidona dönüştürülmüştür) tedavi edilen juvenil köpeklerie yapılan 40 haftalık bir çalışmada cinsel olgunlaşma günde 0,31 ve 1,25 mg/kg dozlarında olumsuz olarak etkilenmemiştir. Uzun kemik gelişimi günde 0,31 mg/kg dozunda etkilenmemiştir; etkiler günde 1,25 ve 5 mg/kg dozlarında gözlenmiştir,
Kars i noj en i site
İntramüsküler olarak enjekle edilen paliperidon palmiEaEm karsinojenik potansiyeli sıçanlarda değerlendirilmiştir, 10, 30 ve 60 mg/kg/ay'hk dozlarda dişi sıçanlarda meme bezi adenokarsinomlarmda istatistiksel olarak anlamlı bir artış olmuştur. Erkek sıçanlarda, XEPLION'un mg/kg esas alınarak 150 mg'hk maksimum önerilen insan dozunun 1.2 ve 2.2 katı olan 30 ve 60 mg/kg/ay'hk dozlarda meme bezi adenomları ve karsinomlannda isEatistiksel olarak anlamlı bir artış görülmüştür,
Risperidonun akEif bir metaboliti olan oral paliperidonun karsinojenik potansiyeli, farelerde ve sıçanlarda yürütülen risperidon çalışmalarına göre değerlendirilmiştir. Risperidon, farelere
18 ay süre ile ve .sıçanlara 25 ay süre ile JO mg/kg/gün şeklinde uygulanmıştır. Hipofiz bezi adenomlan, endokrin pankreas adenomian ve meme bezi adenokarsinomlanndii isEiitistiksel olarak anlamlı artışlar olmuştur. Diğer antipsikotik ihıçlann kronik olarak uygulanmasından sonra, kemirgenlerde meme, hipofiz ve endokrin pankreas tümörlerinde bir artış saptanmış ve bu artışın uzatılmış dopamin Di antagonizmasına bagİı olduğu düşünülmüştür. Kemirgenlerde bu tümör bulgularının insan riski ile ilişkisi bilinmemektedir.
Mutajenisite
Ames ters mulasyon testinde, fare lenfoma tayininde ve sıçan mikronükleus testinde paliperidonun mutajenik potansiyeli ile ilgili bulgu .saptanmamıştır. Palİperidon palmitat, Ames ters mutasyon testinde veya fare lenfoma tayininde genoioksik özellikler göstermemiştir.
Fertiiitede bozukluk
Oral palİperidon tedavisi, prolaktin- ve santral sinir sistemi* aracılı etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi .sıçanların ferlilitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi .sıçanların canlı embriyo sayısında hafif bir düşüş göstermiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Poİisorbat 20
Polietilen glikol 4000
Sitrik asit nionohidrat
Anhidr d i sodyum hidrojen fo.sfat
Sodyum dihidrojen fosfat monohidrat
Sodyum hidroksit
Enjeksiyonluk .su
6.2. Ge^imsizUkler
Geçimlilik ile ilgili çalışma yapılmadığmdan, bu tıbbi ürün başka tıbbi ürün veya seyreltici ile karıştınimamulı, intramüsküler uygulama direk olarak kİi içindeki enjektörden yapıİmaiıdir.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C aİtındsıki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
♦ 50 mg (0.50 mİ) paliperidon {78 mg paliperidon palmitata eşdeğer) süspansiyonu ile kullamma hazır piston tıpalı ve uç başlıklı (bromobutil lastik) bir enjektör (siklik-olefin-kopolimeri), merkezi mavi renkli bir güvenlik iğnesi ve merkezi gri renkli bir güvenlik iğnesi içeren kit
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği ve
Ambalaj Atıklarının Konirolü Yonelmeliklerine uygun olarak imha edilmelidir.
Kit, intramüsküler enjeksiyon için kullanıma hazır enjektör ve 2 güvenlik İğnesi içerir.
Eliminasvon:
1 mg hızlı salimli ^'C-paliperidonun Eek bir oral doz uygulanması ile verilen radyoaktivitenin yaklaşık %80'i idrarda ve % li 'i feçeste bulunmuştur.
Dot'rusallık/Dot'rusal olmayan durum:
XEPL10N uygulamasını takiben toplam paliperidon maruziyeti, 25 mg-150 mg'hk doz aralığının üzerinde dozla oranUh olmuştur ve 50 mg'ı aşan dozlarda için dozla-orantıdan düşüktür.
Uzun eikiÜ paliperidon palmitat enjeksiyonu ile oral uzatılmış salimli paliperidonun karitla-pınlması
XEPLİON, paliperidonu ayda bir uygulamak üzere tasarianmıştır. Uzatılmış salimli oral paliperidon ise günde bir kere uygulanır. Şekil 2, önerilen başlangıç rejimi kullanılarak XEPLION uygulamasını takiben 5 hafta süre ile paliperidonun ortanca farmakokinetik profilini, oral uzatılmış salimli tablet (6 mg veya 12 mg) uygulaması ile karşılaştırmalı olarak sunmaktadır. XEPLION'un başlangıç rejimi (1. gün/8, günde deltoid kas içine 150 mg/100 mg), tedaviyi oral destek kullanmaksızın başlatırken kararlı durum paliperidon konsantrasyonlarına hızla ulaşmak üzere lasarlanmıştır.

00~i0ra! 6 mg palipcritİnıı --'-Oral 12 mg palİperidon
XEPUON
- Mesapliinan oral 6 mg kararlı durum
Musaplanan oral 12 karar!) durum
1522
.2irxl Vs" |
|
lUhr |
fin |
|
[in.'i Lı;;-' |
l.!ı; bii4]ı£l
XEPL10N sadece tek kullanım içindir.
1. Homojen bir süspansiyon sağlamak için enjektörü en az !0 saniye kuvvetli bir şekilde Çulkaiııyımz,
2.Uygun iğneyi seçiniz,
DELTOİD enjeksiyon için hasta 90 kg'dan hafif ise merkezi mavi renkii iğne; hasta 9Ü kg veya daha ağır İse merkezi gri renkli İğne seçilir.
GLUTEAL enjeksiyon içİn merkezi gri olan iğne kullanınız.
3. Enjektörü dik olarak tutarken lastik uç başhgmı saat yönünde çevirerek çıkanntz.
4. Güvenlik iğnesinin kabmı yarıya kadar sıyırınız. Plastik sıyırma kabmı kıılkinarak iğne kılıfını kavrayınız. Güvenlik iğnesini enjektörün cam şırınga bağlantısına saat yönünde çevirerek takınız.
'"C:
İt
5, İğnenin kılıfını düz bir şekilde çekerek iğneden ayırınız, İğne gevşeyerek enjektörden çıkiibiieceği için kılıfı bükmeyiniz.
6. Havasım gidermek için, taksimış olan iğne iie birlikle enjektörü dik pozisyona getiriniz. Pi.ston çubuğunu dikkatti bir şekilde ileri iterek enjektörün havasını gideriniz.
7. Enjektör içeriğitıin tamiimını hastanın seçilen deltoid veya gluteal kast İçine İniramüskülcr ohırak enjekie ediniz, İntravaskülcr veya subkutan olarak uygulamayınız.
8. Enjeksiyon tamamlandiktan sonra iğne koruma sistemini etkinleştirmek içİn baş parmağınızı veya bir parmağınızı {8a, 8b) veya düz bir yüzeyi kuliantnız. 'Klik' sesi duyulduğu zaman iğne koruma sistemi tam olarak etkinleşmiştir. İğne ile birlikte enjektörü uygun şekilde atmız.
8a

8b

7. RUHSAT SAHİBİ
Johnson and Johnson Sihhi Miiİzemc San. ve Tic. Ltd. Şti
Kavacık Mahallesi Enürk Sokak Keçeli Plaza No: 13 Kavacık, Beykoz-İstanbul Tei :0216538 2000 Faks : O 216 538 23 69
8. RUHSAT NUMARASI
131/89
9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İik ruhsat tarihi: 11.08,2011 Ruhsat yenileme tarihi:
10. KÜB'ÜN YENİLENME TARİHİ
İlaç Bilgileri
Xeplion 50mg/0,50ml IM Enjeksiyon İçin Uzun Salımlı Süspansiyon İçeren Kullanıma Hazır Enjeksiyon
Etken Maddesi: Paliperidon palmitat
Atc Kodu: N05AX13
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.