KISA ÜRÜN BİLGİSİ
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
XEPLION 25 mg/0.25 mİ I.M, enjeksiyon için uzun salimli süspansiyon içeren kullımımii hazır enjektör
2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:
Her kuiliinmıa hazır dolu enjektörün 0,23 ml'sinde;
Paliperidon palmİtat 39 mg (25 mg paiiperidona eşdeğer)
Yardımcı maddeler:
Her 1 ml'de;
Anhidr disodyum hidrojen fosfat; 5 mg
Sodyum dihidrojen fosfat monohidrat; 2,5 mg
Sodyum hidroksit: 2,84 mg
Diğer yardımcı maddeler için 6,1 'e bakınız,
3. FARMASÖTİK FORM
Kullanıma hazır enjektör içinde uzun salimli süspansiyon Beyaz iie grimsi beyaz arası renkte süspansiyon.
4. KLİNİK ÖZELLİKLER
4.L TerapÖiik cndikasyonlar
XEPLION şizofreni tedsıvisi ve şizofreni semplomiannm tekrarının Önlenmesinde endikedir.
4.2. Pozoloji ve uygulama şekli Pozoloji:
Bugüne kiidar paliperidon ya da risperidon kulianmamış hastalar için XEPL10N ile tedaviye başlanmiidan önce, oral piiüperidon veya oral risperidonun tolerabüitesinin kanıtlanması önerilir.
XEPLION'ıın önerilen başlangıç dozu, terapötik konsantrasyonlara hızla ulaşılması amacıyla tedavinin birinci gününde 150 mg ve bir hafta sonra (8, gün) 100 mg'dır (her ikisi de delioid kas içine uygulanır) (Bkz, Bölüm 5,2). Önerilen ayhk idame dozu 75 mg'dır. Önerilen 25 mg iia 150 mg'hk doz; aralığmda hastanın bireysel tolerabililesine vc/veya etkililiğe göre bazı hastalar daha düşük ya da daha yüksek dazlardan yarar görebilir. İkinci dozu takiben aylık idame dozları deltoid veyagluleal kas içine uygulanabilir.
Uygulama sıklığı ve süresi:
idame dozunun ayarlanması ayda bir yapılabilir, XEPLİON'un uzatılmış .sahm özelliği doz ayarlaması yaparken göz önüne ahnnnalıdır (Bkz. Bölüm 5.2); çünkü idame dozlarmm tam etkisi birkaç ay ortaya çıkmayabilir.
Uygulama şekli:
XEPLION, sadece intramüsküler kullanım için hazırlanmıştır. Kas içine yavaş ve derin olarak enjekte edilmelidir. Kan damarı içine yanlışlıkla enjeksiyondan kaçınmak için dikkat edilmelidir. Her enjeksiyon bir sağlık uzmanı tarafından uygulanmalıdır. Uygulama tek bir enjeksiyon şeklinde yapılmalıdır. Doz, ayrı enjeksiyonlar şeklinde uygulanmamalıdır, ¡ntravasküler veya subkutan enjeksiyon uygulanmamalıdır,
XEPL10N'un delioid kas içİne uygulanması için önerilen iğne boyutu hastanm vücut ağırlığı ile belirlenir. 90 kg veya daha ağır olan hastalarda merkezi gri renkli {1 inch 22 G (38,1 ırdii K 0.72 mm O güvenlik iğnesi önerilir. 90 kg'dan hafif olan hastalarda merkezi mavi renkli (1 inch 23 G (25,4 nıns x 0.64 nını)) güvenlik iğnesi önerilir, Deltoid enjeksiyonlar iki deltoid kas arasında değişiİrilmelidir.
XEPLION'un gluteal kas İçine uygulanması için önerilen iğne merkezi gri renkli (1 'Mnch 22 G (3B.! ınm x 0.72 mn^l) güvenlik iğnesidir. Uygulama gluteal bölgenin üst dış kadranı içine yapılmalıdır. Gluteal enjeksiyonlar, ikİ gluteal kas arasında değiştirilmelidir.
Or:ıl veyit intnimiisküler olarak uyguianan risperidon, değişen derecelerde paİipcridona meiabolize edilmektedir. Risperidon yu da oral piiliperidosı XEPLION ile eşzamanlı olarak küllanılacaksa dikkatli olunmalıdır.
Adanan doziar
Dozlann ailanmasınm önlenmesi; XEPLION'un ikinci başlangıç dozunun İlk dozdan bir haiia sonra verilmesi önerilir. Doz atlanmasın! önlemek için ikinci doz, bir haftalık (8, gün) zaman noktasından iki gün önce veya sonra verilebilir. Benzer şekilde, başlangıç rejiminden sonra üçüncü enjeksiyonun ve sonraki enjeksiyonların ayda bir veriimesi önerilir. Aylık dozun atlanmaması için enjeksiyon, aylık zaman noktasından yedi gün önce veya sonra verilebilir.
İkinci XEPLİON enjeksiyonu için hedef tarih (gün 8 ± 2 gün) atlanırsa, önerilen yeniden başlangıç zamanı hastaya ilk enjeksiyonun uygulanmasından itibaren geçen süreye bağlıdır.
Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra <4 hafta): İlk enjeksiyondan sonra 4 haftadan daha kısa bir süre geçmişse, deltoid kas içine mümkün olan en kısa sürede 100 mg'lik ikinci enjeksiyon uygulanmalıdır. 75 mg'hk üçüncü XEPLION enjeksiyonu, ilk enjeksiyondan5hafta sonra deltoid ya da gluteal kas içine uygulanmalıdır (ikinci enjeksiyonun zamanlamasından bağımsız olarak). Daha .sonra hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 23 mg ila 150 mg aralığındaki dclioid ya da gluteal dozun normal aylık enjeksiyon siklusu takip edilmelidir.
Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra 4-7 hafta): İlk XEPLION
enjeksiyonundan sonra 4 ila 7 haftalık bir süre geçmişse, doz uygulamasma aşağıdaki şekilde
100 mg'lık iki enjeksiyonla devam edilmelidir;
1. Mümkün olan en kısa sürede dehoid kas içine bİr enjeksiyon,
2. Bir hafta sonra bir kez daha deiloid kas İçine bir enjeksiyon,
3. Hastanm bireysel tolerabilitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığındaki deltoid ya da gluteal dozun normal aylık enjeksiyon siklusunun sürdürülmesi.
Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra >7 hafta): !lk XEPL10N
enjeksiyonunun üzerinden yedi haftadan daha uzun bir süre geçmişse, doz uygulaması
yukarıda Pozoloji"' bölümünde tarif edildiği şekilde başlatılır.
Atlanan aylık İdame dozu (1 ay - 6 hafta); Tedaviye başlandıktan sonra XEPL10N'un ayda bir enjeksiyon siklusu önerilir. Son enjeksiyondan sonra altı haftadan daha kısa bir süre geçmişse, daha önce stabilize olmuş doz, mümkün ohın en erken zamanda uygulanmalı ve bunu takiben ayda bir enjeksiyon yaptimahdır.
Atlanan ayhk idame dozu (>6 hafta - 6 ay): Son XEPLION enjeksiyonunun üzerinden altı
haftadan daha uzun bir süre geçmişse öneriler şu şekildedir;
25 mg ila 100 mg arasındaki dozlarla stabilize olan hastalar için;
1, Mümkün olan en k)sa sürede hastanm daha önce stabilize olduğu aynı dozda deltoid kas
içine bir enjeksiyon,
2, Bir hafta sonra (8, gün) bir kez daha delioid kas İçine bir enjeksiyon (aynı doz),
3, Hastanın bireysel toierabilİiesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığmdakt deltoid ya da gluteal dozun normal aylık enjeksiyon siklusunun sürdürülmesi.
150 mg ile stabilize olan hastalar için:
1. Mümkün olan en kısa sürede 100 mg dozda deltoid kas içine bir enjeksiyon,
2. Bir hafta sonra (8. gün) 100 mg dozda bir kez daha deltoid kas içine bir enjeksiyon,
3. Hastanın bireysel tolerabilitesine ve/veya etkililiğe güre 25 nıg ila 150 mg aralığındaki deltoid ya da gluteal dozun normal aylık enjeksiyon siklusunun sürdürülmesi.
Atlanan ayhk idame dozu (>6 ay); XEPL10N'un son enjeksiyonunun üzerinden altı aydan daha uzun bir süre geçmişse, yukarıda XEPLION'un önerilen başlangıç tedavisi için tarif edildiği şekilde doz uygulaması başlatılır.
DiğerauEİpsikotik ilaçlardanKEPLlON'ageçiş;
Hastaların diğer antipsikotik ilaçlardan XEPL10N'a geçişini ele alan veya XEPLION'un diğer antipsikotiklerle biriikte eşzamanlı kullanılması ile ilgili sistematik olarak toplanmış veri bulunmamaktadır. Bugüne kadar paliperidon ya da risperidon kullanmamış hastalar için XEPLİON ile tedaviye başlanmadan önce, oral paliperidon veya oral risperidonun tolerabilitesi kanıllanmalıdır.
Oral antipsikotik ilaçlardan XEPLİON'a geçiş;
XEPLION tedavisi başlanacağı zaman daha önce kullanılan oral antipsikotikler kesilebilir. XEPLION, yukarıda Bölüm 4.2'nin başlangıcında tarif edildiği şekilde başlatılmalıdır.
Uzun etkili enjektabl antipsikotik ilaçlardan XEPLION'a geçiş;
Stabil hastalar uzun etkili L-njeklabl antipsikotik ilaçlardan XEPLION'a geçerken, XEPLION tedavisi bir sonraki programlımmış enjeksiyon zamanmda başlatılmalıdır. XEPLION bundan sonra ayda bir aralıklarla devam edilmelidir. Yukarıda Bölüm 4.2'nin başlangıcında tarif edilen bir haftalık doz ııyguliimasi başlatma rejimi gerekli değildir.
RİSPERDAL* CONSTA^ intramüsküler enjeksiyon için uzatılmış salimli süspansiyonun farklı dozlarında daha önce stabilize olmuş hastalar, ayda bir verilen dozlaria aşağıda tarif edildiği şekilde XEPLION ile idame tedavisi sırasında benzer paliperidon kararlı durum maruziyedne ulaşabilirler;
Kararlı durumda benzer paliperidon maruziyetine ulaşmak için gerekli RİSPERDAL®
CONSTA® ve XEPLION dozları |
Daha önceki RİSPERDAL® CONSTA® Dozu |
XEPLİON Enjeksiyonu |
2 haftada bir 25 mg |
Ayda bir 50 mg |
2 haftada bir 37,5 mg |
Ayda bir 75 mg |
2 haftada bir 50 mg |
Ayda bir 100 mg |
Önceki antip,sikotik ilaçların sonlan diril m a,sı, doğru reçeteleme bilgileri ile uyumlu olarak yapılmalıdır. XEPLION kullanımı .sonlandırılacaksa, uzatılmış .salım özelliği göz önüne alınmalıdır. Diğer antipsikotik ilaçların kullanımında önerildiği gibi devam eden ekstrapiramidal semptomlar (EPS) için ilaç gereksinimi periyodik olarak yeniden değerlendirilmelidir.
Öze! popülasyonlara ilişkin ck bilgiler:
Böbrek yetmcziiği:
XEPLION, böbrek yetmezliği olan ha.stalarda sistematik olarak incelenmemiştir (Bkz. Bölüm 5.2). Hafif böbrek yetmezliği olan hastalarda (kreatİnin klerensi >50 - <80 ml/dak.), XEPLION'uii önerilen başlangıç dozu, tedavinin birinci gününde 100 mg ve bir hafta sonra 75 mg'dır (her İkisi de deltoid kas içine uygulanır). Daha sonra deltoid veya gluteal kas içine hastanm bireysel tolerabilitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığında ayda bir 50 mg uygtılanır,
«
Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dak.) XEPL10N önerilmez.
Karaciğer yotmezliği:
XEPLION, karaciğer yetmezliği olan hastalarda incelenmemiştir. Oral puliperidon ile yapılan çalışmaya göre hafif veya orta derece karaciğer yetmezliği olan hastalarda, doz ayarlaması gerekli değildir.
Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir (Bkz, Bölüm
5.2). Bii dikkati! oluıınKihdır..
Pediyatrik popülasyon:
XEPL10N'un çocuklarda ve 18 yaşın alündaki hastalarda güvenliliği ve etkinliği incelenmemiştir,
Geriyatrik popülasyon:
KEFLION'un etkililiği ve güveiHİiHüi 6^ yaş ühiö kaniUııniTiaiTHŞtir,
Genel olarak, böbrek fonksiyonu normal olan yaşlı hastalarda, XEPLİON'un önerilen dozu, böbrek fonksiyonu normal olan genç erişkin hastalarda önerilen dozla aynıdır. Yaşlı hastalarda böbrek fonksiyonları azaiabileceginden, böbrek fonksiyommıın durumuna göre doz ayarlaması gerekebilir (Bkz. Bölüm 4.2),
XEPLION, inme için risk faktörüne sahip demanslı yaşlı hastalarda dikkatli kullanılmalıdır (Bkz. Bölüm 4.4).
Dİğor
XEPL10N için cinsiyet, ırk veya sigara kullanımına bağlı olarak doz ayarlaması yapılması öneriinıez (Gebe kadınlar ve emziren anneler için Bkz, Bölüm 4,6),
4.3. Kontrcndikasyoniar
Paliperidon pal milat veya yardımcı maddelerden herhangi birine karşı aşın duyarlılığı olduğu bilinen hastalarda kontrendikedir,
Paliperidon, ri,sperİdonun aktif bir metaboliti olduğu için XEPLION risperidona karşı bilinen aşırt duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları vc önlemleri
QT Aralığı
Diğer antipsikotiklerie olduğu gibi, bilinen kardiyovasküler hasuilıgı cian veya ailesinde QT uzama öyküsü olan hastalarda ve QT aralığını uzattiğı düşünülen diğer ilaçlar ile biriikte kullanılacağı durumlarda, XEPL10N reçetelenirken dikkatli olunmalıdır.
Nöroieptik malign sendrom
Hiperiermi, kas rijiditesi, otonomik instabilité, bilinç değişikliği ve serum krealinin fosfokinaz seviyelerinde yükselme ile karaklerize olan nöroieptik maJign sendrom'un (NMS), paliperidon da dahil; antipsikotik ilaçlar ile oluştuğu bildirilmiştir. Ek klinik belirtiler arasında miyoglobüHnüri (rabdomiyoliz) ve akut böbrek yetmezliği de bulunabilir. Eğer bir hastada NMS işaret eden bulgu ve semptomlar gelişirse, XEPL10N da dahil olmak üzere tüm iintipsikotik ilaçlar kesilmelidir.
Tardif Diskinezi
Dopamin reseptör antagonisti özelliğine sahip ilaçlar, özellikle dil ve/veya yüzde, ritmik, istem dışı hareketlerle karakterize olan tardif diskinezinin indüksiyonu ile ilişkili bulunmuştur. Eğer tardif diskinezinin bulgu ve semptomhırı ortaya çıkarsa, XEPLÍON da dahil olmak üzere tütn antipsikotik İlaçların kesilmesi değerlendirilmelidir.
Hiperglisemi
XH!*LIİ)N ık yandan klinik çnhşinalardıj seyrek olarak gkiko/;i bağh lrIvcts oiayiaı% orn.;k\\nglükoz diizeyiiKİe arlış bikfinlnıiştir, ^3iğer üiHipsikoiik jk^cíaíia aiduğy gibi, diy:ihcn olan ve ifşabe^es nıeHitus gelişmesi risk iakiörieri iiaHfahsrda, uygun klinik
bicine önerilir,
H ipe: s7 ; i-oía k t i ! ! e¡i¡ i
Doku küNürü çah^nıakLn n^ervic iÜRiöiierinde hücre i)uy(şnıe';inirı pnihiktiri iarafiodan siişnule edıfebıieceğini beiinnıektcdh'. Klinik vl' epidernryoiííjík ÇLilışnıaİarda aonnsikonk kiiHiinünsileilişkisi açik bir şekilde gösierile^ıenıış oisa da, ilgili nbbi öyküsü olan hastalarda dikkatli ohınoıas? önerünıek^edir. PalijıerFiloii pahniiai c-las! prolaktine bagh iünuirü olan iıastakirda dikkatli küHandnni^idır.
Kilo Alma
Adpik antipsikotik kullanımıyla birlikle kilo alımı gözlenmiştir. Kilonun klinik olarak İzlenmesi tavsiye edilmektedir.
Ortostaíik hipoiansiyon
Paitptíridon, aifa-biokör aktivitesinden dolayı hazi hastalarda oríostalik hipolansiyonii indükleyebilir. Oral paliperidon (INVEGA 3 mg, 6 mg, 9 mg ve 12 mg) ile yapılan plasebo kontrollü, 6 haftalık, sabit dozlu uç çalışmanın birleştirilmiş verilerine göre, plasebo ile tedavi edilen deneklerin %0,8'ine karşılık oral paliperidon ile tedavi edilen deneklerin '7i;2,5'inde ortostatik hipotansiyon bildirilmiştir. XEPLION, bilinen kardİyovasküİer hastalığı olan hastalarda (örn.; kalp yetmezliği, mıyokart infarktüsü veya iskemi, ileti anormallikleri), serebrovasküler hastalığı veya hipotansiyona neden olabilecek durumlarda {örn.; dehidratasyon, hipovoiemi ve antihipertansif ilaçlarla tedavi) dikkatli kullanılmalıdır.
Nöbetler
XEPLION, diğer antipsikotik ilaçlarda olduğu gibi nöbet öyküsü olan hastalarda veya nöbet eşiğini potansiyel olarak düşüren diğer koşullarm bulunduğu hastalarda dikkatli kullanılmalıdır.
B<)brek yetmezÜgi
Paliperidonun plazma konsantrasyonu, böbrek yetmezliği olan hastalarda artmıştır ve bu nedenle hafif böbrek yetmezliği olan hastalarda doz ayarlaması önerilmektedir. Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreatinin kleren.si <50 ml/dak.) XEPLÍON önerilmez (Bkz. Bölüm 4.2 ve Bölüm 5.2).
Karaciğer yetmezliği
Paliperidon, ağır karaciğer yetmezliği olan hastalarda (Child-Pugh Sınıf C) incelenmemiştir. Paliperidon, bu tür hastalarda kullanılıyorsa dikkatli olunması önerilir.
Demansı olatı ya^h hastalar
Konvıansiyonül ve atipik antipsikotik ilaçlar demansa bağlı psikozu olan yaşlı hastaların tedavisinde kullaniİdığıııda ölüm riskinde artışa neden olmaktadır.
Xi-;l*LION iienıtıns! olars v:işİ^ İKi'ıUihmia çiihşii*iiLiniEşnr. İnme için risk í'iSí'kloríií dcinans? olan yaşh lıaHUiiauia dikkaıJi kulïandmahdsr.
Genel uıorialite
17 kontrollü klinik çalışmanın meta-analizinde, ri.speridon, aripiprazol, olanzapin ve keliapin dahi! olmak üzere diğer atipik antipsikotik ilaçlarla tedavi edilen ve demansı olan yaşlı hastalarda, mortalité riski plaseboya kıyasla artmıştır. Risperidon ile tedavi edilen hastalarda, plasebo için %3.1 olan mortalité %4 olmuştur.
Serehrovüskiiler aJvers olayUtr
Ratıdomize pliisebo kontrollü klinik çıılışmalarda, risperidon, aripiprazol ve oianzapin gibi bazı atipik antipsikoiik ilaçlarla tedavi edilen demanslı yaşlı hastalarda serebrovaskUler advers olaylarda yaklaşık 3 kal artmış risk görülmüştür. Bu artmış riskin mekanizması bilinmemektedir, XEPLION, inme açısından risk faktörleri taşıyan demanslı yaşlı hastalarda dikkatli kullanılmalıdır.
Lcikopeni, Nöiropeni ve A^ramilositoz.
XEPLION dahil olmak üzere, antipsikotik ajanlarla lökopeni, notropeni ve agranülo.sitoz olayları bildirilmiştir Pazarlama sonrası denelim sırasında agranülositoz çok nadiren (<1/10.000 hasta) bildirilmiştir.
Klinik olarak anlamlı düzeyde düşük beyaz kan hücresi (WBC) sayımı veya ilaçla tetiklenmiş lökopeni/nötropeni öyküsüne sahip hastalar tedavinin ilk birkaç ayı boyunca izlenmeli ve ortada başka nedensel faktörler yokken WBC'de klinik olarak anlamlı bir düşüşe yönelik ilk belirtide XEPLİON kullanımına son verilmesi düşünülmelidir.
Klinik olarak anlamlı nötıopenisİ olan hastalar ateş veya diğer enfeksiyon semptomları veya belirEileri açısmdan dikkatle izlenmeli ve bu tür .semptomlar veya belirtilerin ortaya çıkması halinde derhal tedavi edilmelidir, Şiddedi nöEropenisi olan hastalar (mutlak nötrofil sayımı <1 X 10'VL) XEPLİON kullanımına .son vermeli ve iyileşene kadar WBC düzeylerini takip ettirmelidir.
Venöz iromboemboUk olay
Anlipsikotik ilaçlarla venöz tromboembolik olaylar (VTE) bildirilmiştir, Antipsikotik ilaç tedavisi gören hastalarda çoğunlukla kazanılmış VTE risk faktörleri bulunduğu için, VTE için tüm olası risk faktörleri, XEPLION ile tedaviden önce ve tedavi süresince tanımlanmalı ve koruyucu önlemler alınmalıdır,
Parkinson HasUthğtveLexvy Cisinıcikli Demanx
Parkin.son hastalığı veya Lewy cisimcikli demanslı hastalara XEPLION da dahil olmak üzere antipsikotik ilaçlar reçele edilirken doktorlar yarar risk değeriendirmesi yapmalıdır; çünkü her iki hasta grubunda da, antipsikotik ilaçlara karşı duyariilığm artmış olması ile birlikte Nöroleptİk Malign Sendrom riski artmış olabilir Bu artmış duyarlılığın belirtileri, ek.strapiramidal semptomlara ek olarak konfüzyon, obtundasyon, sık düşmeler ile biriikte postural instabilité olabilir.
Priüpizm
Aifa-adrenerjik blokiir etkileri olan unlipsikotik ilaçların (risperidon dahil), priapiznıi indüklediği bildirilmiştir. Pazarlama sonrası gözelim esnasmda paliperidon İle priapizm bildirilmiştir. Hastalar, priapizmin 3-4 saat içinde düzelmemesi durumunda acil tıbbi yardım almaları konusunda bilgilendirilmelidir (Bkz, Bt^lüm 4,8),
Vıicii! istsınm konimlü
Vücudun iç vücut ısısını düşürme yeteneğinin bozulması, antipsikotik ilaçlara bağlanmıştır. Aşırı egzersiz yapmak, aşın sıcağa maruziyet, antikolinerjik aktivitesi olan ilaçların eş zamanlı uygulanması veya dehidratasyon bulunması gibi iç vücut ısısında yükselmeye katkıda bulunabilecek koşulları olan hastalara XEPLION reçele edilirken dikkatli olunması önerilir.
AniienieUk e!ki
Paliperidon ile yapılan klinik öncesi çalışmalarda, antiemetik etki gözlenmiştir. Bu etki, eğer insanlarda oluşursa, bağırsak tıkanması. Reye sendromu ve beyin tümörü gibi durumları veya belli ilaçların aşın doz bulgu ve semptomlarını maskeleyebilir,
Uygtihmut
XEPLION'un kan damarı içine kaza ile enjekte edilmesinin önlenmesi için dikkatli olunmalıdır.
XEPLION her mİ'sinde 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında sodyum içermcr'. Sodyuma bağlı herhangi bir etki gözlenmez.
4,5. Diğer tıbbi ürünlür ile etkileşimler ve diğer etkileşim şekilleri
KEPLlON'un QT aralığını uzattığı bilinen ilaçlar, örn,; sınıf lA antiaritmikler (öm.; kinidin, di.sopramid) ve sınıf 111 antiaritmikler (örn.; amiodaron, solalol), bazı antihistaminikler, bazı diğer antipsikotik ilaçlar ve bazı antimalaryaller (örn.; meflokin) ile biriikte reçete ederken dikkatli olunması önerilir.
Paliperidon palmitat, paliperidona hidroliz olduğu için (Bkz. Bölüm 5,2), ilaç-ilaç etkileşim potansiyeli değerlendirilirken oral paliperidon ile yapılan çalışmaların bulgulan göz önünde bulundurulmalıdır,
XEPLİON'un diğer ilaçları etkileme potansiyeli
Paliperidonun, sitokrom P-450 izoenzimleri ile metabolizc olan ilaçlar ile klinik açıdan önemli farmakokinetik etkileşimlere neden olması beklenmemektedir, İnsan karaciğer mikrozomlarmdıı yapılanin viiroçalışmahır, paliperidonun, CYPIA2, CYP2A6, CYP2C8/9/I0, CYP2D6, CYP2EI, CYP3A4 ve CYP3A5 de duhiİ olmak üzere sitokrom P450 izoenzimleri lanıfından metaboiize edilen ilaçların metabolizmasını önemli derecede baskılamadigını göstermiştir. Bu nedenle, paliperidonun, bu meiabolik yolakhırla metabolize edilen ilaçların klerensini klinik açıdan belirgin bir biçimde baskılnması beklenmemektedir. Paliperidonun, ayrıca enzim indükleyici özelliklerinin olması beklenmemektedir,
Paliperidon, yüksek konsantrasyonlarda P-glikoproteinin (P-gp) zuyıf bir İnhibitörüdür.İn vivoveri mevcut değildir ve klinik açıdan İlişki bilinmemektedir.
Paliperidonun santral .sinir sistemi üzerindeki primcr etkileri ele almdığmda (Bkz, Bölüm 4,8), XEPLION diğer santral elkiii İlaçlar, örn,; anksiyolitikler, antipsikoiiklerin çoğu, hipnotikler, opiatlar, vb. veya alkol ile birlikte dikkatli kuilamlmalıdır,
Paliperidon, levodopa ve diğer dopamin agonistierinin etkilerini antagonize edebilir. Bu kombinasyonun gerekli olduğuna karar verilirse, özellikle son evre Parkinson ha.stahgında her bir tedaviye ilişkin en düşük etkili doz reçete edilmelidir,
Ortostatik hipotansiyonu İndükleme poiansiyeli nedeni ile (Bkz. Bölüm 4.4), XEPLION bu potansiyele sahip olan diğer terapötik ilaçlar, örn,; diğer antipsikotik ilaçlar, trisiklikler ile birlikte uygulandığı zaman aditif etki gözlenebilir.
Paliperidon nöbet eşiğini düşürdüğü bilinen diğer ilaçlar ile birlikte kombine edilirse dikkatli olunması önerilir (yani fenotiyazinler veya bulirofenonlar, trisiklikler veyaSSRriar,tramadol, meflokin, vb.).
Kararlı durumdaki oral uzatılmış salimli paliperidon tabletlerin (günde bir kez 12 mg) uzatılmış salimli dİvalproeks sodyum tabletlerle (günde bir kez 500 mg ila 2000 mg) eşzamanlı olarak uygulanması, valproalın kararlı durum farmakokİnetiğini etkilememiştir,
XEPLION ve lityum ara.smda farmakokinetik etkileşim olası değildir.
Diğer ilaçların XEPLION'u etkileme potansiyelleri
Paliperidon, CYPIA2, CYP2A6, CYP2C9, CYP2CI9 ve CYP3A5'in bir substratı değildir. Bu durum, bu izoenzimlerin inhibitörieri veya indükleyicileri ile bir etkileşimin olası olmadığım düşündürmektedir,In vitmçalışmalar, CYP2D6 ve CYP3A4'ün paliperidon metabolizma,smda minimal olarak görev aldığını gösterse de, bu izoenzimlerin, paliperidon metabolizmasında önemli bir rol oynadığına ilişkinin vitroveyain vivobulgular yoktur.In vitmçalışmalar, paliperidonun bir P-gp substratı olduğunu göstermiştir.
Paliperidon, CYP2D6 i!e kısıtlı derecede melabolize edilir (Bkz. Bölüm 5.2). Sağlıklı gönüllülerde yapılan bir etkileşme çalışmasında, oral paliperıdonun güçlü bir CYP2D6 inhibitorü olan parok.setinle birlikle uygulanması sonucu paliperidonun fannakokinetigi üzerinde klinik açıdan belirgin bir etki gözlenmemiştir.
Günde bir kere uygulanan uzatılmış salimli oral paliperidonun günde iki kere 200 mg karbamazepin ile birlikte uygulanması, paliperidonun ortalama kararlı dunım Cjax ve EAA değerlerinde yaklaşık olarak %37 oranında bİr düşüşe neden olmuştur. Bu düşüş, büyük ölçüde, karbamazepin tarafından rena! P-gp'nin indüklenmesinın bir sonucu olarak paliperidonun rena! klerensinde %35 oranında artışa bağlıdır, Karbama^epini^ eş zamanlı olarak uygulanması esnasında, idrarla değişmeden atılan ilaç miktarında minör bir azalma, paliperidonun CYP metabolizması veya biyoyararlanımı üzerinde düşük derecede etki olduğunu düşündürmektedir, Karbamazepin kullanımına başlandığında XEPLİON dozu yeniden değerlendirilmeli ve gerekirse arttırılmalıdır. Bu durumun tersine, karbamazepin kullanımı kesildiğinde XEPL10N dozu yeniden degeriendirilmeli ve gerekirse azaltılmalıdır.
Fizyolojik pH koşullarında bir katyon olan paliperidon, yaklaşık olarak yarısı fıltrasyon, yarısı aktif sekresyon yolu ile primer olarak değişmeden böbreklerden atılır. Böbrekte katyonik ilaçların aktif taşınmasını baskıladığı bilinen bir ilaç olan trimetroprimin eş zamanlı alarak uygulanması, paliperidonun farmakokinetiğİni etkilememiştir.
İ2 mg oral uzatılmış salimli paliperidon tabletin tekli bir dozunun, uzatılmış salimli divalproeks sodyum tabletlerle (günde bir kez iki 500 mg'lık tablet) eşzamanlı olarak uygulanması muhtemelen artmış oral absorpsiyonun bir sonucu olarak paliperidonun Cax ve EAA'sında yaklaşık %50'lik bir artışla sonuçlanmıştır. Sistemik klerenste herhangi bir etki gözlenmediğinden, uzatılmış salimli divalproeks sodyum tabletler ve XEPLION'un intramüsküler enjeksiyonu arasında klinik olarak anlamlı bir etkileşim beklenmemektedir. Bu etkileşim XEPLION ile çalışılmamıştır.
XEPLİON ve lityum arasında farmakokinetik etkileşim olası değildir.
XEPLION'un Risperidon ile birlikte kullanımı
XEPLION'un risperidon ile birlikle kullanımı incelenmemiştir. Paliperidon, risperidonun aktif bir metaboliti olduğu için risperidon XEPLION ile birlikte kullanılacaksa, aditif paliperidon maruziyeti göz önüne alınmalıdır.
4,6. Gebelik ve laktasyon Genel lavsiyc
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsİyon)
Hayv:ıniıır üzerinde yapılan araşiımuıhr üreme loksisile.sinin bulunduğunu göstermiştir.
(Bkz. Böiüm 5.3). İnsanlara yöneiik potansiyel risk bilinmemektedir.
Gebelik dönemi
XEPLİON'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. XEPL10N, kesin gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Yüksek doz oral paliperidon ile tedavi edilen laboratuar hayvanlannda f'etal ölümlerde hafif bir artış görülmüştür. İntramüsküler enjeksiyonla paliperidon palmitat uygulanan sıçanlarda, gebelik parametreleri etkilenmemiştir. Yüksek dozlar, anneler için toksik olmuştur. Maksimum insan mariiziyetinin 20-22 katı daha yüksek olan oral dozlar veya muksimtım insan maruziyetİnin 6 katı daha yüksek intramüsküler dozlar, feiüsü etkilememiştir. XEPL10N'un insanda doğum sancısı ve doğum üzerindeki etkisi bilinmemektedir.
Gebeliğin üçüncü trimesterinde antipsikotik ilaçlara (paliperidon da dahil) maruz kalan yeni doğanlar, doğumu takiben şiddeti değişebilen, anormal kas hareketleri (ekstrapiramidal işaretler/ekstrapiramidal semptomlar) ve/veya ilaç kesilme .semptomları açısından risk altındadırlar. Bu semptomlar, ajitasyon, hipertoni, hipotoni, tremor, soınnolans, respiratuar distres veya beslenme bozukluklarını içermektedir.
Laktasyon dönemi
Paliperidon anne sütü ile atılmaktadır (süte geçmektedir), XEPLION emzirme döneminde kuliamlmamalidır.
Üreme yeteneği/Fertiliic
Oral paliperidon tedavisi, prolaktin- ve santral sinir sistemi- aracılı etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların rertiiitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişİ sıçanların canlı embriyo sayısında çok az bir düşüş göstermiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
KEPLION, zihin açikhğf gerektiren aktivilelere engel olabilir vc sediisyon, sonıoo[;uıs, senkop ve bınanik gönııe gibi görsel etkilere neden olabilir (Bkz. Bölüm 4.8). Bu nedenle hastalan XEPLİON'a karşt bireysel duyarlılıkları bilinene kadar araç veya makine kullanmamaları konusunda uyarılmalıdır.
4.8. Lstenmeyen etkiler
Klinik çalışmalarda en sık bildirilen advers ilaç reaksiyonları (ADR'1er) insomnia, baş ağrısı, kilo alımı, enjeksiyon bölgesi reaksiyonları, ajitasyon, somnolans, akatizi, bulantı, konstipasyon, sersemlik, İremor, kusma, üst solum yolu enfeksiyonu, diyare ve taşikardidir. Bu advers ilaç reaksiyonian arasından akatizi dozla ilişkili olarak ortaya çıkmaktadır.
Aşağıda verilen tüm ADR'ler klinik çalışmalarda XEPL10N İle tedavi edilen hastalardan bildirilen reaksiyonlardır. Şu terimler ve sıklık dereceleri kullanılmıştır;
Çok yaygın (>I/1Ü); yaygın (>l/10ü ile <l/lü); yaygın olmayan (>1/1000 ile <1/100); seyrek (>l/i 0,000 ile <1/1000); çok seyrek {<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Sİsleoı Orgaii SiOiİi |
Advers İlaç Reoksivoohyı |
Siklik |
Çok v;iy|tiii |
|
Yayiisn Olmayan |
Sevrck |
Enjeksiyonlar
ve
enfesta-ıvonsar |
|
Üsi so]üiii.inı yolo
enfek'ıivoşHJ |
|
|
liağiŞikhk
hasıahkları |
|
|
¡■lipcrscnsinvik' |
|
Endokrin
iiiistalıklaii |
|
|
rlipi:'rprolaki.iiienıi |
|
MıHaboh/ma ve
besıenniL'
İKislalikiinı |
|
Kilo alınii, kan
gkıkoz
düzeyinde
yükselme, kan
Uigliseril
dlizcyinde
viikselnıe |
Hiperglisesni,. hij>erinsyİiiienH, iştah ariişı, iş(;iİi azahnas!, kan kok'sıeml düzeyinde yüksclnve |
|
PsikiyıHiik
lıasiahkhii |
hı soneni a |
Ajiu'ssyon |
Kabus |
|
Sinir sislcini hasiaiikiari |
Baş ağrısı |
park İD son İZ OK
akau/i.
diskİ?KZ!.
ek^ırapiranıidaİ
bo/iskhıkiar,
trcisior,
sersernİik,
soıınıolans |
Sesıkop, konvülsiyon. lardif diskirıczi, disariri, psjkoıiK>tor hiperaküviie, posiural sersendık, letarp |
Ns:iE-olei)tik
HKdign
sendrom.
serebrovLisküier
f.day |
Göz hasüihklan |
|
|
BüIiHiik !:öniK' |
Göz kayiHLisL gö/. harekel bozukUiöü |
Kuhik ve iç kiiiak ' hasialıkhy'! |
|
|
Venigo |
|
Kardiyak
İKisiaiiklar |
|
Taşikardi |
Sinüs taşikardisi, kondnksiyon bozukiügii, birinci derccc
atrioveniriküler bksk, hradikardi, poslund orios![ilik laşikardi sendronViL palpiıasyonian eleklrokardiyrigrLHüda QT iiZLirna'ii, iiornıal oh'nayari
eieklrokardivoiirarn |
|
Va^kiUer
liastahkhu' |
|
l'hperiinısiyori |
Onoslaük
İiipo^aiisivon |
|
GastRiinicslinai
kiasiahklar |
|
Kusma, abdonıirsai raiı:.usi/Jik/üs( itbilornsnaİ ağrL diyare, bıdaniL konstipasyon, diş ağnsi |
Ağrıkıuiilüğu |
|
Deri Vii deri allı dokü
hıs'slaiiklaii |
|
Döküsuü |
üruker, jciierali/e kaşiniL kaşHii! |
Haç eriipssyorsH |
Kas'iskeki bo/yklüklisr, bağ doku ve kemik hasüilikkiri |
|
Sın ağriSE,
eksirenıiiede
ligrı |
Mividji, eklem serdiği
1 |
|
İJrenic sisteiııi ve liienıe |
|
|
1iinekoinaHd, erekül difiionksiyon, i^cksikd |
Meme aküMiHi |
haHiaiikiari |
|
|
üisİDi'iksiyon.
giihıkk-re, ;.unenore.
düzensiz
inensn'uasyon,
nıensü'uel bo/ükluk,
gecikn^iş
iiies^snikisvoii |
|
Gene]
[K;2ükiiikiin' vc UVgüilHlia biilgesiiie ilişku? hiisiaiikİar |
|
As^_"ni,
enjeksiyon
bölgeselde
sertleşnıc,
yorgünNık,
enjeksiyon
bölgesinde üğn |
i:;iijek.siyi.)i'ı
bölgesinde kaşuılı |
Uygiilanıii
bölgesinde ügrL
enjeksiyon
b{jlgesE
reisksiyonlan,
enjeksiyon
bölgesinde
nodiiİ |
Aşüğıda şizofreni tedavisinde oral sıralanmıştır:
paliperidon ile bildirilen ek advers ilaç reaksiyonlar!
Enfeksiyonlar ve enies[asyonl;ir |
Yaygın: Ni=7ular:n\jit
Y'iiVgni o[nıay:nı: Idnu" yolu enfeksiyoniK rinil |
Ba^iŞikhk sisieın! liasiahkiaii |
Sevrek: AnLifilakiik rcLiksivon |
F'sikivısirik hnsüiiikfar |
Yaygin ohnayan: Uyku bozi^klüğü |
Sinir sisŞenu İKisUiiskiiiri |
Seyrek: Geçici Lskennk a^ık. grandnKil konvühivon |
Karüiyak husialfkiisr |
Viivgüi ohnavLin: Sinüs uritnıbi Sevrek; Sol da^ bloön |
Vasküler iıasial^kbu' |
Yaygın oinıayan: filjivsiansiyon Seyrek: İskeıni |
Scihnıunk göğiis hozükınklan ve |
Yaygsn; öksiirilk, l'aringolarnıgeal ağrn burun |
mcdiasiıiKd Ijasiaiikkir |
nkinnkiiğL
BiHnnnyor: Aspirasyon pniinıonisi |
Gasironıteslinin hiistabkksr |
Yaygin: Dispepsi Vaygin oinKivan: l"laznnsi/hk Seyrek: İnce bağirsak likanıkhği Bilinmiyor: Dilde şişnie |
Deri ve deri alü doku kiasUihkbın |
Seyrek: Anjioödern, papüier dokiknü |
Kos-iskeiei bo,r'ukhik[ar. haö doku |
Yaygin: Aru'ulji |
-ve kennk lıasKihki:nı |
Yaveri? obiKivan: Kasâskeki uönsi |
Böbrek ve idrar nasUslıkku'i |
Yaygnı 0İ!iKiy:in: Üriner retansiyon Sevrek: Üriner inkoıiiinans |
Gcbeisk, pııcpenyarn duRimhın ve BiHnsiiiyor: NeoiKilLÜ ilaç kesihnc* scinpiorniar! (Bkz.
perinatal hasta!ıkh.uı Böjürn4.6)
Üreıne sUieı^ıi ve menıe Seyrek: Mciiic ungonınar^L nıenıe ağrfsi, meine
hasıahkkuı hasi^asiyeli, retrograd ejakiilasyon
________BiisriP-iiyoi': PrKipsziTj_
Genel bo/ukhikia.r ve uygiHaina Vaygın ohi5;iy;in; PerH'eral ödem
bökesine ilişkin h;âsşiihkhşr s s
' hevrek: (.jdenı
Pazarlama Sonrası Veriler
Paliperidon üe ilk oluriik pazariamii sünrası deneyimde spontan bildirimlere dayanan bir sıktık kategorisi ile verilen advers ikıç reaksiyonları aşağıdaki tabloda yer almaktadır. Aşağıdaki terimler ve sıklık dereceleri kullanilmışSir;
Çok yaygın (>I/iO); yaygın (>l/IOO ile <1/10); yaygın olmayan (>1/1000 ile <1/100); seyrek (>t/10.000 ile <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Spontan bildirimlere dayanan bir sıklık kategorisi ile paliperidon pazarlama sonrası deneyiminde tanımlanmış olan advers olaylar
Çok seyrek: Neonatai ilaç yoksunlıık sendromu
Bu sınıfa özgü olaylar
Enjeksiyon bölgesi reaksiyonları: En sık bildirilen yan etki ağrıdtr. Bu reaksiyonların çoğu hafif ila orta şiddettedir. Bütün faz 2 ve faz 3 klinik çalışmalarında, enjeksiyon bölgesi ağrısının bireysel algısı zamanla sıklık ve yoğunluğu azaltmayı amaçlayan görsei analog skalada değeriendirmiştir. Deltoid enjeksiyonlar gluteal enjeksiyonlara oranla biraz daha fazla ağrılı olarak algılanmıştır. Diğer enjeksiyon bölgesi reaksiyonları çoğunlukla hafif yoğunlukladır ve enjeksiyon bölgesinde sertleşme (yaygın), kaşıntı (yaygın olmayan) ve nodüüer (seyrek) olarak tanımlanmıştır.
Kilo alma: 150 mg'hk başlangıç dozunun kullanıldığı İ3 hafialık çalışmada, vücut ağırlığının %7'si ve daha fazla kilo alma kriterini karşılayan bireylerin oranlan, XEPLION gruplarında plasebo grubuna göre daha yüksek orandadır. %7 ve daha fazla anormal kilo alımı olan denek oranı, dozla ilişkili bir eğilim göstermiştir ve insidans oranı plasebo grubunda %5 iken; XEPLİON 25 mg, 100 mg ve 150 mg gruplarında plasebo ile karşılaştırmalı olarak sırasıyla%6, 9r8ve %13 bulunmuştur.
Uzun dönemde nüksü önicme çiilışmasinm 33 hafiulık açık etikiitii geçiş/idiime dönemi esnasmda, XEPLION İle tedavi edilen deneklerin %t2'si bu kritere uymuştur {çift-kör fazmdan son noktaya kadar >%7 kilo artışı); açık etiketli başlangıca göre ortalama {SD) agıriık değişikliği +0.7 (4.79) kg olmuştur.
Laboratuar tesUeri
Serum proiaktin: XEPLION aSan deneklerde her iki cinsiyette de, serum prolaklin düzeyinde ortalama artışlar gözlenmiştir. 13 haftalık, çİft kör, plasebo kontrollü üç çalışmadan elde edilen verilere göre, proiaktin düzeylerinde artışı düşündürebilecek advers olaylar {Örn,; amenore, galaktore, jinckomasti) genelde deneklerin % Tinden azında bildirilmiştir.
Sınıf etkileri
Antipsikotik ilaçların kullanılması sonucunda QT uzaması, ventriküler aritmiler (ventriküler fibrilasyon, ventriküler taşikardi), ani beklenmedik ölüm, kardiyak arresl ve Torsades de pointes görülebilir.
Pulmoner embolizm ve üerin ven trombozu vakaları da dahil olmak üzere, antipsikotik ilaçlarla venöz tromboembolik olay bildirilmiştir (Sıklık bilinmemektedir).
4.9.Doz aşımı vc tedavisi
XEPL10N'un, sağlık personeli tarafından uygulanması gerektiğinden hastaların aşırı doz alma potansiyeli düşüktür.
Bel i fiile r
Genellikle, beklenen bulgu ve semptomlar paliperidonun bilinen farmakolojik etkilerinin artması şeklindedir. Bunlar, uyuşukluk ve sedasyon, taşikardi ve hipotansiyon, QT uzaması ve ekstrapiramidal semptomlardır. Torsade de pointes ve ventriküler fibrilasyon, oral paliperidon ile doz aşımı ayarında rapor edilmiştir. Akut doz aşımı durumunda, birden fazla ilaç ihtimali düşünülmelidir.
Tedavi
Tedavi gereksinimleri ve iyileşme değeriendtrilirken XEPLION'un uzatılmış salım özelliği ve
paliperidonun uzun yarılanma ömrü göz önünde iutıılmalıdır. Paliperidonun spesifik bir
antidotu yoktur. Genel destekleyici önlemler uygulanmalıdır. Hava yolu açık tutulmalı,
korunmalı ve yeterli oksijenasyon, ventiiasyon sağlanmalıdır, Kardİyovasküİer izlemeye
hemen başlanmalı ve olası aritmiler için sürekli elektrokardiyografik izleme yapılmalıdır.
Sayfa 18/34
Hipotansiyon ve dolaşım kolİapsı, intravenöz sıvı ve/veya sempatomimeük ilaçlar gibi uygun önlemierle tedavi ediimelidir. Ciddi ekstrapiramidal semptomların varlığında antikolinerjik ilaçlar uygulanmalıdır. Hasta iytleşene kadar yakın denetim ve gözlem sürdürülmelidir,
5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamİk öztllikler
Farmakoterapötik grup: Diğer antipsikotikler ATCkodu: N05AX13
XEPLION paliperidonun (+)* ve (')* rasemik karışımını içerir.
Etki mekanizması:
Paliperidon palmitat, paliperidona hidrolize olur (Bkz, Bolüm 5.3). Paliperidon, daha çok serotonerjik 5-HT:a antagonistik aktivitesi olan merkezi etkili dopamin Di antagonistidir. Paliperidon, aynı zamanda aifa-1 ve alfa-2 adrenerjik reseptörierin ve Mı histaminerjik reseptörlerin antagoni.sti olarak etki eder. Paliperidonun kolinerjik muskarinik veya Br ve (iı-adrenerjik reseptörlere afinitesi yoktur. {+)- ve (-)- paliperidon enantiyomerierinin farmakolojik aktivitesi, kaütatif ve kantİtatif olarak benzerdir.
Şizofrenide etkili olan diğer ilaçlarda olduğu gibi paliperidonun etki mekanizması bilinmemektedir. Ancak, ilacın şizofrenideki lerapötik aktivitesinin, dopamin Tip 2 (D;) ve seroionin Tip 2 (SHTja) reseptör antagonizmasmın kombinasyonu İle kontrol edildiği öne sürülmüştür. D: ve 5HT2a dışındaki diğer reseptörlerdeki antagonizma, paliperidonun diğer etkilerinin bazılarını açıklayabilir,
Elektrofizyoloji
Oral paliperidonun QT aralığı üzerindeki etkileri, şizofreni ve şizoafektif bozukluğu olan erişkinlerde yapılan iki randomize, çift-kör, çok merkezli, faz 1 çalışmasında ve şizofrenili erişkinlerde yapılan aktif kontrollü, 6 haftalık, sabit dozlu etkinlik çalışmalarında değerlendirilmiştir.
İlk faz I çalışmasında (n=141), denekler 7 gün süre ile günde bir kere hızlı salimli oral
paliperidon (4 mg'dan 8 mg'a litre edilerek) veya lek doz moksifloksasin (4Ü0 mg) almak
üzere randomİze olarak ayrılmışlardır. Günde tek doz 8 mg hızlı salimli oral paliperidon
(n=50, Cmas ss= ¡13 ng/ml) ile elde edilen ortalama kararii durum maksimum plazma
konsantrasyonu, deltoid kas içine uygulanan önerilen maksimum 150 mg'lık XEPLION dozu
Sayfa 19/34
ile gözlenen 2 kat daha yüksek maruziyete göre daha yüksek biilunmuştur (öngörülen ortaliima Cox ss = 50 ng/ml). Model-ayarh, giin-orialamalı lineer*derivelt QT düzeltmesinde (QTcLD), XEPL10N tedavi grubunda (n=50) 5.5 milisaniyehk (ms) ortalama artiş saptanmıştır (%90 Cl; 3,66; 7,25).
İkinci faz İ çahşmasmda (n=109) denekler; plasebo, maksimum önerilen oral uzatılmış sahmli paliperidon dozu (günde bir kere 12 mg) ve bunu takiben önerilen aralığın üzerinde bir doza titrasyon {günde bir kere i 8 mg) veya aynı farmakolojik ilaç sınıfından bir ilacı (günde iki kez 400 mg ketiapin) aktif kontrol olarak alacak şekilde rastgele ayrılmışlardır. Bu 10 günlük eşit etkinlik çalışmasında, birincil karşılaştırma 12 mg uzatılmış salimli paliperidon İle ketiapin arasında yapılmıştır. Her bireyin saptanan tmas değerinde QTcLD'de başlangıca göre en düşük kareler ortalamasının değişikliği, 12 mg uzatılmış salimli paliperidon için (ortalama Cnm 34 ng/ml), günde iki kez 400 mg keliapin ile karşılaştırıldığında (ortalama C. 1183 ng/ml) 5,1 ms daha düşük bulunmuştur (%90 CI; -9.2; -0.9). Bu değer Önceden betirienmiş 10 ms olan eşit etkinlik kriterine uygundur. Her bireyin saptanan E,nM değerinde QTcLD'de başlangıca göre ortalama değişiklik, 18 mg uzatılmış salimli paliperidon için (ortalama Cm^)! 53 ng/ml), günde iki kez 400 mg ketiapin ile karşılaştırıldığında (ortalama C,ax 1183 ng/mİ) 2.3 ms daha düşük bulunmuştur (%90 CI; -6.8; 2.3),
Her bireyin saptanan t^^ değerinde QTcLD'de ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca değerinde (karşılaştırılan aktif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaştırıldığında, 12 mg uzatılmış salimli paliperidon için 1.5 ms daha yüksek (%90 CI: -3,3; 6.2) ve günde iki kez 400 mg ketiapin için 8,0 ms daha yüksek (%90 Cl: 3.1; 12.9) bulunmuştur. Her bireyin saptanan değerinde QTcLD'de ortalama değişiklik, eşzamanlı plasebo grubunda saptanan orianca değerinde (karşılaştırılan aktif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaştırıldığında, 18 mg ıızatıitnış salimli paliperidon için 4,9 ms daha yüksek (%90 Cl: -0,5; 10.3) ve günde iki kez 400 mg ketiapin içİn 7.5 ms daha yüksek (%90 CI: 2,5; 12.5) bulunmuştur.
Bu çalışmaların hiçbirisinde herhangi bir zamanda deneklerde, başlangıca göre 60 milisaniyeyi geçen bir değişiklik veya 500 milisaniyeyi geçen bir QTcLD görülmemiştir.
Oral uzatılmış salimli paliperidonla ilgili sabit dozlu üç etkinlik çalışmasında, standardize edilmiş bir yöntem kullanılarak belirli günlerde (beklenen Cm^^ sürelerini içeren) 15 zaman noktasında, kapsamlı elektrokardiyografi (ECG) ölçümleri alınmıştır. Uzatılmış salimli paliperidon ile tedavi edilen 836 denek, olanzapin ile tedavi edilen 357 denek ve plasebo ile tedavi edilen 350 deneğin toplu verilerine göre herhangi bir zaman noktasında, herhangi bir
Sayfa 20/34
iedavi grubunda ortalama QTcLD artışs 5 milisaniyeyi geçmemiştir. Bu çalışmalar esnasnıda, uzaSilmış salsmlı 12 mg paliperidon ve oianzapin gruplarının her birisinde bir denekte bir zaman noktasmda 60 milisaniyeyi geçen değişiklik olmuştur (sırası üe 62 ve 110 milisaniye arEişları).
XEPL10N'un dört sabit dozlu etkinlik çalışmasında, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamış ve herhangi bir zaman noktasında 500 milisaniyeden fazla QTcLD değeri görülmemiştir. Uzun süreli nüksü Önleme çahşmasmda, deneklerin tamamında 60 iTiilisaniyeyi geçen QTcLD değişikliği olmamıştır ve bir denekte 507 milisaniyelik QTcLD değeri saptanmıştır (Bazett düzeltilmiş QT aralığı [QTcB] 483 milisaniye). Bu hastada ayrıca kaip hızı 45 atım/dakika bulunmuştur.
Klinik Etkinlik
XEPLION'un şizofreninin akut tedavisinde etkililiği, şizofreni için DSM-İV kriterlerini karşdayan akut nüks gelişmiş yatan erişkin hastalarda yapılan kısa süreli (biri9haftalık ve üçü 13 haftalık) çift-kör, randomize, plasebo kontrollü, sabİt dozlu dört çalışmada değerlendirilmiştir. Bu çalışmalarda i XEPL10N'un sabit dozları, 9 haftalık çalışmada 1., 8, ve 36. günlerde ve 13 haftalık çalışmalarda ek olarak 64. günde verilmiştir (ilk iki doz için bir haftalık aralıklarla ve daha sonra idame için 4 haftada bir).
Etkinlik, Pozitif ve Negatif Sendrom Ölçekleri (PANSS) kullanılarak değerlendirilmiştir. PANSS, pozitif semptomları, negatif semptomları, dağınık düşünceleri, kontrol edilemeyen saldırganlık/heyecanı ve anksiyete/depresyonu değerlendirmek için beş faktörden oluşan valide edilmiş çok maddeli bir ölçektir. Fonksiyon, Kişisel ve Sosyal Performans (PSP) ölçeği kullanılarak değerlendirilmiştir. PSP, sosyal olarak yararii aktivite alanlarında kişisel ve sosyal fonksiyonu ölçen ve klinisyenin derecelendirdiği valide edilmiş bir Ölçektir; iş ve çalışma, kişisel ve sosyal ilişkiler, kendi kendine bakım ve rahatsız edici ve agresif davranışlar. Sosyal, kişisel ve kendi kendine bakım alanlarında di,sfonksiyonun şiddeti, bu aktiviteleri başkalarının yardımı ile ve başkalarının yardımı olmaksızın uygulamada zoriuk derecesi (yok, hafif, aşikar, belirgin, şiddetli) ile ölçülür. Benzer şekilde, agre.sif davranışlarda disfonksiyonun şiddeti, agresif davranışların varlığı veya yokluğu (kabalık, başkalarına toplum içinde hakaret etmek, nesneleri kırmak, sözlü tehditler, fizik.sel saldırı) ve bu davranışların sıklığı ile ölçülür.
XEPLION'un üç sabit dozunu (başlangıçta 150 mg'lık deltoid enjeksiyon ve bunu takiben 25 mg/4 hafta, 100 mg/4 hafta veya 150 mg/4 hafta şeklinde 3 gluteal veya deltoid doz) plasebo ile karşılaştıran 13 haftalık çalışmada (n=636), XEPLION'un Üç dozu da, PANSS toplam puíinini düzeltmek ııçısından plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 100 nıg/4 hafta hem de 150 mg/4 haftalık tedavi grupları PSP puanı açısından plaseboya göre istatistiksel olarak anlamlı üstünlük göstermişken, 25 mg/4 haftalık tedavi grubu üstünlük göstermemiştir. Bu bulgular, tedavi süresi boyunca elkililiği ve PANSS'de düzelmeyi desteklemektedir ve dördüncü gün kadar erken dönemde gözlennniştir. Sekizinci günde ise 23 mg ve 150 mg'hk XEPLÍON gruplarında plaseboya göre anlamlı farklılık gözlenmiştir.
XEPLION'un üç sabit dozunu (50 mg/4 hafta, 100 mg/4 hafta vc 150 mg/4 hafta) plasebo ile karşılaştıran diğer bir 13 haftalık çalışmada (n=349), sadece 100 mg/4 haftalık XEPLION grubu, PANSS toplam puanında düzelme açısından plaseboya güre üstün bulunmuştur. Bu çalışmada, hem 50 mg/4 hafta, hem de 100 mg/4 hafta dozları, PSP puanını düzeltmek açısından pla.seboya üstün bulunmuştur. Bu çalışmaya 150 mg'hk bir doz dahil edilmesine rağmen, bu dozu alan gönüllü sayı.sı, bu dozun etkililiği ile ilgili kesin sonuçlara varmak için yeterli değildir.
XEPLÍON'un üç sabit dozunu (25 mg/4 hafta, 50 mg/4 hafta ve 100 mg/4 hafta) piasebo ile karşılaştıran üçüncü 13 haftalık çalışmada (n=513), XEPLlON'un üç dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, paliperidon doz grupların tamamında, PSP puanı açısından plaseboya göre istatistiksel olarak anlamlılık saptanmamıştır.
XEPLION'un iki sabit dozunu (50 mg/4 hafta ve 100 mg/4 hafta) piasebo ile karşılaştıran 9 haftalık çalışmada (n=197), XEPLION'un iki dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur.
XEPLION'un şizofrenide semptomatik kontrolü idame etmek ve şizofrenide relapsı geciktirme açısından etkililiği, şizofreni İçin DSM-IV kriterlerini karşılayan 849 yaşlı olmayan erişkin gönüllüleri içeren uzun süreli çift-kör, piasebo kontrollü, esnek dozlu bir çalışmada belirlenmiştir. Bu çalışma, 33 haftalık açık etiketli akut tedavi ve stabilizasyon fazı, randomize, piasebo kontrollü bir faz (nüks açısından gözlem yapmak üzere) ve 52 haftalık açık etiketli uzatma dönemini İçermiştir. Bu çalışmada, XEPLION dozları ayda bir defa uygulanan 25, 50, 75 ve 100 mg dozlarını içermiştir; 75 mg dozuna yalnızca 52 haftalık açık etiketli uzatmada izin verilmiştir. Hastalar, başlangıçta 9 haftalık bir geçiş dönemi sırasında esnek dozlarda (25-İOO mg) XEPLÍON almıştır. 24 haftalık koruma dönemine girmek için hastaların PANSS skorunun <75 olması gerekmiştir. Dozlama ayarlamalarına yalnızca koruma döneminin ilk 12 haftasında izin verilmiştir. Değişken uzunlukta çift-kör faz esnasında, hastalar stabilizasyon fazında aldıkları aynı XEPLlON'un doz grubuna (ortanca
Sayfa 22/34
süre İ71 gün [tıra!ıklar 1 gün-407 gün]) veya piusebo grubuna (ortalama süre 105 gün [aralıklar 8 gün-441 gün] ranüomİ7x olarak ayrılmıştır. Toplam 410 stabilize hasta, şizofreni semptomlarında nüks oluşana kadar, XEPLION veya plasebo gruplarına randomize alarak ayrılmıştır. Nüks, aşağıdakilerden birinin veya daha fazlasının ilk olarak ortaya çıkma zamanı olarak tanımlanmıştır. Bunlar; psikiyatrik hospitalizasyon, iki ardışık değerlendirmede toplam PANSS puanında >%25 artış (başlangıç puanı >40 ise) veya t O puanlık artış (başlangıç puanı <40 ise), kasıtlı olarak kentli kendini yaralamak, saldırgan davranış, intihar/öldürmeye eğilimli düşünceler veya PANSS maddelerinin P1 (Delüzyonlar), P2 (kavramsa! disorganizasyon), P3 (Halüsinasyonla ilgili davranış), P6 (Şüphecilik/perseküsyon), P7 (Düşmanlık) veya G8 (işbiriigi yapamama) ardışık ikİ değerlendirmesinde puanın >5 (maksimum başlangıç puanı <3 ise) veya >6 (maksimum başlangıç puanı 4 ise) olmasıdır, Primer etkinlik değişkeni, nükse kadar geçen süre olmuştur. Daha önceden planlanmış bir ara analiz (68 nüks olayı yaşandıktan sonra), nükse kadar geçen sürenin, XEPLION ile tedavi edilen ha.stalarda, plaseboya kıyasla anlamlı derecede daha uzun olduğunu göstermiştir (Şekil 1) ve etkililiğin devam etliği gösterildiğinden çalışma erken sonlandırılmıştır.
Şckij1. Zamaii:i karjı nüksü kıyasinyaıı KLiphn-Mcitır GruCiği - Ara AhüIİj.İ (TüiJaviyi amatlaya!) anaiii seli)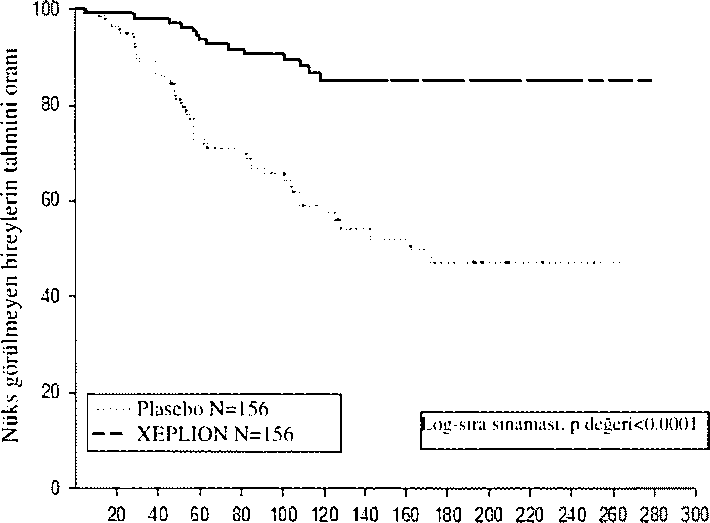
RanJnmi/.asyondan beri geçctı süre (gün)
Çalışmanın soniandınldığı tarihe kadar tüm verileri içeren nihai verilere dayanılarak yapılan analizin sonucu, ara verilere dayalı birincil etkililik analizinin .sonucu üe tutariidır.
Popülasyon alt grupltırının incelenmesi, cinsiyet, yaş veya ırk temei almarak tedaviye yanıt açısından klinik olarak anlamlı fark göstermemiştir.
5.2. Farmakokinetik özelliklur Genel Özellikler
Emilim:
Sudaki çözünürlüğünün aşırı düşük olmasına bağlı olarak paliperidon palmitat, intramüsküler enjeksiyondan sonra patiperidona hidroliz olmadan önce yavaşça çözünür ve sistemik dolaşıma absorbe olur. Tek bir intramüsküSer enjeksiyonu takiben paliperidonun plazma konsantrasyonları, 13 günlük ortalama tmas süresi içinde yavaş yavaş yükselerek maksimum plazma konsantrasyonlarına yükselir. İlacın salınması, birinci gün kadar erken bir zamanda başlar ve 126 gün kadar sürer,
Deltoid kas içine Eck doz inlramüsküier enjeksiyonunu takiben (25 mg-150 mg), gluteal kas içine enjeksiyonla karşılaştırıldığında ortalama olarak %28 daha yüksek bir gözlenmiştir. I, günde İ50 mg ve 8, günde i 00 mg'ın ikİ başlangıç deltoid intramüsküler enjeksiyonu, terapÖEik konsantrasyonlara hızla ulaşılmasına yardımcı olur. XEPLION'un salım profili ve doz rejimi, terapötik konsantrasyonların devam etme.sini sağlamaktadır. 100 mg'lsk XEPL10N dozu için ortalama kararlı durum doruk noktası; iki dalga arasındaki çukur oranı, gluteal uygulamayı takiben 1.8 ve deltoid uygulamayı takiben 2.2 olmuştur. 25 mg-150 mg'lık doz aralığında XEPLION uygulamasını takiben paliperidonun görünen ortalama yanlanma ömrü 25 ile49gün arasında değişmiştir,
Paliperidon palmitat uygulamasını takiben paliperidonun (+) ve (-) enaniiyomerleri birbirine dönüşür ve yaklaşık olarak 1.6-1,8'lik bir EAA (+)/(-) oranına ulaşır,
Daütlım:
Popülasyon analizine göre paliperidonun görünen dağılım hacmi 391 litredir. Ra,semik paliperidon plazma proteinine %74 oranında bağlanır.
Bivotransformasvon:
I mg hızlı salimli '^C-paliperidonun tek bir oral dozunun uygulanmasından i hafta sonra, dozun %59'u idrarla değişmeden atılmıştır. Bu durum, paliperidonun karaciğerde ileri derecede metabolize olmadığını göstermektedir. Hiçbirisi verilen dozun %6.5'inden fazlasını kapsamayanin vivodört metabolik yolak tanımlanmıştır: dealkilasyon, hidroksilasyon.
Sayfa 24 / 34
dehidrojcn:ısyon ve henzisoksazolün böiiinmesi.In viiraçalışmalar, paliperidon metabolizmasında CYP2D6 ve CYP3A4'Un rol oynadığını göstermesine rağmen, paliperidonun melaboliznnasındainv'/ro olarak bu izoenzimlerin önemli bir rol oynadığına dair bir kanıt yoktur. Popülasyon farmakokinetik analizleri, oral paliperidonun uygulanmasından sonra paliperidonun görünen kierensinde CYP2D6 substratlarının hızlı metabolize edicileri ile yavaş metabolize edicileri arasında ayırt edilebilir fark göstermemiştir. İnsan karaciğer mikrozomlarında yapılanin viiroçalışmalar, paliperidonun, CYPIA2, CYP2A6, CYP2C8/9/İ0, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5M içeren sitokrom P45Ü izoenzimleri tarafından metabolize edilen ilaçların metabolizmasını büyük ölçüde inhibe etmediğini göstermiştir,
In viiroçalışmalar, paliperidonun bir P-gp substratı olduğunu ve yüksek konsantra.syonlarda P-gp'nin zayıf bir inhibilörü olduğunu göstermiştir.Ini'(w veriler yoktur ve klinik ilişki bilinmemektedir.
Eliminasvon:
I mg hızlı salimli ''^C-paliperidonun tek bir oral doz uygulanması ile verilen radyoaktivitenin yaklaşık %80'i idrarda ve %1 l'i feçeste bulunmuştur.
DoğrusallıkyPoilrusal olmayan durum:
XEPLÍON uygulamasını takiben toplam paliperidon maruziyeti, 25 mg-150 mg'lık doz aralığının üzerinde dozla orantılı olmuştur ve 50 mg'ı aşan dozlardaCVMiÇİn dozia-orantıdan düşüktür.
Uzıın etkili paliperidon palınital enjeksiyonu ile oral uzitnlmış saltmlı paliperidomm kar.^da.^nrdmast
XEPLÍON, paliperidonu ayda bir uygulamak üzere lasarlanmışiır. Uzatılmış salimli oral paliperidon ise günde bir kere uygulanır. Şekil 2, önerilen başlangıç rejimi kullanılarak XEPLÍON uygulamasını takiben 5 hafta süre ile paliperidonun ortanca farmakokinetik profilini, ora! uzatılmış salimli tablet (6 mg veya 12 mg) uygulaması ile karşılaştırmalı olarak sunmaktadır. XEPLlON'un başlangıç rejimi {1. gün/8. günde deltoid kas içine 150 mg/IOO mg), tedaviyi oral destek kullanmaksızın başlatırken kararlı durum paliperidon konsantra.syonlarma hızla ulaşmak üzere tasarlanmıştır.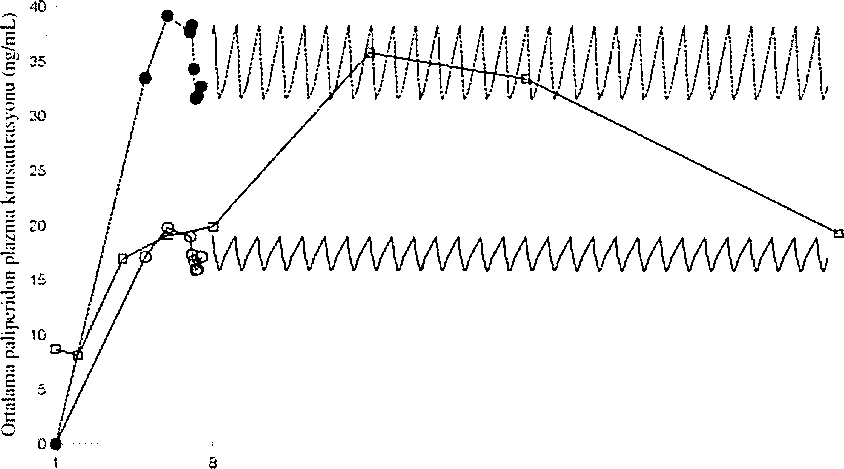
G'ö"O0ral6mg paüpcriiJon ♦--■-Oral12mı; paliperidonXEPLION
Hcsaplüiıarı oral 6 mg kararlı durum Hesaplanan oral 12mgknrdrlı durum
İ5 22
Zaman (gün)
23
32
Şekil1.Oraİ uzatılmış salimli lableiin (6mgveya 12mg)günlük uygulaması İle kurşılaşiırmalı olarak önerilen başiangıı; rejimi kuManıiarak {l.gün/8.günüe deltoiil kas içine 150 mg/U)0mgpaiiperidona eşdeğer paliperidon palmilat ile başlangıç) XEPLION'un uygulaıııasıni lakiben 5 iıaf'la süre ile paliperidon için ortalama larmakokinetik profillerini lakiben ortalama plazma konsantrasyonu-zaman profiİleri.
Genel okınık, XEPL10N ile gözlenen genel başlangıç plazma düzeyleri, 6 mg-12 mg uzatılmış salimli oral paliperidon ile gözlenen maruziyet sınırlan içinde bulunmuştur. XEPLION başlangıç rejiminin kullanılmasf, en düşük değerlerin görüldüğü doz öncesi günlerde bile (8, gün ve 36, gün) hastaların, 6 mg-12 mg uzatılmış salimli oral paliperidonun bu maruziyet penceresinde kalmalarını sağlamıştır. XEPLION uygulamasmı takiben paliperidon farmakokinetiği için gönüllüler arasında değişkenlik, uzatılmış salimli oral paliperidon tabletlerinde belirlenen değişkenliğe güre daha az bulunmuştur, İki ürün arasındaki ortanca farmakokinetik profillerindeki fark nedeni ile farmakokinetik özelliklerini direkt olarak karşılaştırılırken dikkatli olmak gerekir.
Hastalardaki karakteristik özellikler
KaraciSer vetmezllüi:
Paliperidon, karaciğerde yaygın şekilde metabolize edilmemektedir. XEPL10N, karaciğer yetmezliği olan hastalarda İncelenmemiş olmasına rağmen, hafif veya orta derece karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Orta derecede karaciğer yetmezliği
Sayfa 26 / 34
oliin (Ctıild-Pügh sınıf B) hastalarda oral pulipcıidon ile yapılan bir çalışmada, serbest paliperidonun plazma konsantrasyonu, sağlıklı deneklerle benzerdir. Paliperidon, agır karaciğer yetmezliği olan hastalarda incelenmemiştir.
Böbrek yetmezliği:
Hafif böbrek yetmezliği olan hastalarda XEPL10N dozu azaltılmalıdır. XEPLION'un, orta veya ağır böbrek yetmezliği olan hastalarda kullanılması önerilmez (Bkz, Bölüm 4.2), Değişik derecelerde böbrek yetmezliği olan deneklerde, tek bir oral 3 mg uzatılmış salimli tablet paliperidon dozunun dağılımı incelenmiştir. Paliperidon eiiminasyonu, azalan kreatinin klerensi ile birlikte azalmıştır. Paliperidonun toplam klerensi, bozulmuş böbrek fonksiyonu olan hastalar arasında hafif böbrek yetmezliğinde (CrCI =50 - <80 ml/dak) ortalama%32,orta böbrek yetmezliğinde (CrCl= 30 * <50 ml/dak) ortalama%64ve ağır böbrek yetmezliğinde (CrCI=10 - <30 ml/dak) ortalama %7I azalmıştır. Bu durum sağlıklı deneklerle karşılaştırıldığında, maruziyetle (EAAj,;f) sırası ile 1.5, 2.6 ve 4.8 kat ortalama artışa denk düşer. Hafif böbrek yetmezliği olan deneklerde XEPLION ile sınırlı sayıda gözleme ve farmakokinetik simiilasyonlara göre, hafif böbrek yetmezliği ohm hastalarda önerilen XEPLION başlangıç dozu tedavinin birinci gününde 100 mg'lık doz ve bir hafta sonra 75 mg'dır (her iki.si de deltoid kas içine uygulanır); daha sonra ayda bir (4 haftada bir) deltoid veya gluteal kas içine hastanm bireysel tolerabilitesine ve/veya etkililiğe göre 50 mg'ltk enjeksiyonlarla devam edilir {Bkz. Bölüm 4,2).
Yaslılarda:
Sadece yaşa bağlı dozaj ayarlaması önerilmez. Ancak, kreatinin klerensinde yaşla ügili azalma nedeni ile doz ayarlaması gerekli olabilir (Bkz, Bölüm 5,2 ve Bölüm 4.2),
ilki
Oral paliperidon İle yapılan çalışmaların popülasyon farmakokinetiği analiz verileri, XEPL10N uygulamasını takiben paliperidonun farmakokİnetiginde ırka bağlı farklılıkların kamımı göstermemiştir.
Cinsiyet:
Erkekler ve kadınlar arasında klinik olarak anlamlı fark gözlenmemiştir.
Sitrara kullanım durumu:
İnsan karaciğer enzimleri kullanılanin viiroçalışmalar temei alınarak, paliperidon CYP1A2 için bir substrat değildir; dolayısıyla sigara kullanımının paliperidon farmakokinetiğine bir etkisi olmamahdir. Buiıt viirobulgularla uyumlu oiarak popülasyon farmakokinetik değerlendirmesi, sigara kullananlar ile kulianmayaniar arasında herhangi bir fark ortaya koymamıştır.
5.3. Klinik öncesi güvcnlilik vcnlerİ
Toksikoloji
Oral uygulanan paliperidonun yanı sıra, dopamin D2 reseptörlerini antagonize eden diğer ilaçlarda olduğu gibi intramüsküler olarak uygulanan paliperidon palmitat tekrarlanan-doz ioksisitesi çalışmalarında serum prolaktin düzeylerini yükseltmiştir.
Adolesanlar için mg/m2 bazmda önerilen günde 12 mg'Iık maksimum insan oral dozunun
0,12, 0,5 ve 1,8 katı oian günde 0,16, 0,63 ve 2,5 mg/kg'hk oral paliperidon dozlarıyla sıçanlarda yapılan 7 haftalık juvenil toksisitesi çalışmasında gelişim, cinscl olgunlaşma ve üreme performansı üzerinde hiçbir elkİsi gözlenmemiştir Günde 2,5 mg/kg'a kadar olan oral dozlar, 2,5 mg/kg/gün ile tedavi edilen dişi sıçanlarda öğrenme ve hafıza üzerine etkiler dışında erkek ve dişilerde nörodavramşsal gelişimi olumsuz etkilememiştir. Bu etki tedavi bırakıldıktan sonra gözlemlenmemiştir.
Günde 0,31, !,25 ve 5 mg/kg dozlarında oral risperidonla (geniş ölçüde paliperidona dönüştürülmüştür) tedavi edilen juvenil köpeklerle yapılan 40 haftalık bir çalışmada cinsel olgunlaşma günde 0,31 ve 1,25 mg/kg dozlarında olumsuz olarak etkilenmemiştir. Uzun kemik gelişimi günde 0,31 mg/kg dozunda etkilenmemiştir; etkiler günde 1,25 ve 5 mg/kg dozlarında gözlenmiştir.
Kars i noj en i site
İntramüsküler olarak enjekte edilen paliperidon palmitiUm karsinojenik potansiyeli sıçanlarda değerlendirilmiştir, 10, 30 ve 60 mg/kg/ay'lık dozlarda dişi sıçanlarda meme bezİ adenokarsinomlarında istatistiksel olarak anlamlı bir artış olmuştur. Erkek sıçanlarda, XEPL10N'un mg/kg esas alınarak 150 mg'lık maksimum önerilen insan dozunun 1.2 ve 2,2 katı olan 30 ve 60 mg/kg/ay'hk dozlarda meme bezi adenomları ve karsinomlarında istatistiksel olarak anlamlı bir artış görülmüştür,
Ri.speridonun aktİf bir metaboliti olan oral paliperidonun karsinojenik potansiyeli, farelerde ve sıçanlarda yürütülen risperidon çalışmalarına göre değerlendirilmiştir. Risperidon, farelere
18 ay süre iie ve sıçanlara 25 ay süre ile 10 mg/kg/gün şeklinde uygulanmıştır. Hipoflz bezi adenomları, endokrin pimlireas adenomları ve menne bezi adenokarsinomlarında istatistiksel olarak aniamlı artışlar olmuştur. Diğer antipsikotik ilaçların kronik olarak uygulanmasından sonra, kemirgenlerde meme, hipofiz ve endokrin pankreas tümörlerinde bir artış saptanmış ve bu artışın uzatılmış dopamİn Dt anlagonizmasma bağh olduğu düşünülmüştür. Kemirgenlerde bu tümör bulgularmın insan riski ite ilişkisi bilinmemektedir.
Mutajenisite
Ames ters mutasyon te.stinde, fare lenfoma tayininde ve sıçan mikronükleus testinde paliperidonun mutajenik potansiyeli ile ilgili bulgu saptanmamıştır. Paliperidon palmitat, Ames ters mutasyon testinde veya fare lenfoma tayininde genotoksik özellikler göstermemiştir.
Fertilitede bozuktuk
Oral paliperidon tedavisi, prolaktin- ve santral sinir .sistemi- aracılı etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların fertiiitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi sıçanların canlı embriyo sayısında haiif bir düşüş göstermiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Polisorbat 20
Polietilen glikol 4000
Sitrik asit monohidrat
Anhidr disodyum hidrojen fosfat
Sodyum dihidrojen fosfat monohidrat
Sodyum hidroksit
Enjeksiyonluk su
6.2. GeçİnısizIikier
Geçimlilik İle İlgili çalışma yapılmadığından, bu tıbbi ürün başka tıbbi ürün veya seyreltici ile karıştırılmamalı, intramüsküler uygulama direk olarak kit içindeki enjektörden yapılmalıdır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25^C iiltındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve İçeriği
25mg (0,25 mİ) paliperidon (39 mg paliperidon palmitata eşdeğer) süspansiyonu ile
kullanıma hazır piston tıpalı ve uç başlıklı (bromobııtil lastik) bir enjektör (siklik-olerin-kopolimeri), merkezi mavi renkli bir güvenlik iğnesi ve merkezi gri renkli bir güvenlik iğnesi içeren kil
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürün i er ya da atık materyaller Tıbbi Atıkların Kontrolü Yönelmetiği ve
Ambalaj Atıklarının Kontrolü Yönetmeliklerİne uygun olarak imha edilmelidir.
Kit, intramüsküler enjeksiyon için kullanıma hazır enjektör ve 2 güvenlik iğnesi içerir.
L'n;ı.'kiiH-
2Hix!'.y |
|
|
(iri iiil'jU-/ |
|
Stjvi3]u;fİus':/ |
s
V
XEPLION sadece lek kullanım içindir.
1. Homojen hir süspansiyon sağlamak için enjektörü cn az K) saniye kuvvetli bİr şekilde çalkalayınız.
2, Uygun iğneyi seçiniz.
DELTOİD enjeksiyon için hasta 90 kg'dan hafif ise merkezi mavi renkli iğne; hasla 90 kg veya daha ağır ise merkezi gri renkh iğne seçilir.
GLUTEAL enjeksiyon için merkezi gri olan iğne kullaninız.
3. Enjektörü dik olarak tutarken lastik uç başhğmı saat yününde çevirerek çıkarınız.
4.Güvenlik iğnesinin kabını yarıya kadar sıyırınız. Plastik sıyırma kabını kullanarak iğne kılıfını kavrayınız. Güvenlik iğnesini enjektörün cam şırınga bağlantısına saat yönünde çevirerek takınız.
5. İğnenin kılıfını düz bir şekilde çekerek iğneden ayırınız, İğne gevşeyerek enjektörden çıkabileceği için kilıfı bükmeyiniz.
A-
/
6. Hiiviistni gidermek için, (akılmış olan iğne ile birlikle enjeklorü dik pozisyona getiriniz. Pision çubuğunu dikkatli bir şekilde ileri iterek enjektörün havasıni gideriniz.
7. Enjektör içeriğininSamanımıhastanm seçilen deltoid veya gluteal kası içine intramüskiiler olarak enjekte ediniz. İntravasküter veya subkutan olarak uygulamaymız,
8. Enjeksiyon tamamiandıktan sonra iğne koruma sistemini elkinleştirmek için baş parmağınızı veya bir parmağmızı (8a, 8b) veya düz bir yüzeyi kullanınız, 'Klik' sesİ duyulduğu zaman iğne koruma sistemi tam olarak etkinleşmiştir. İğne ile birlikte enjektörü uygun şekiide atınız.
8a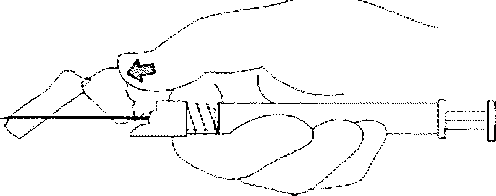
8b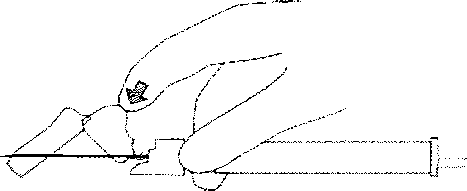 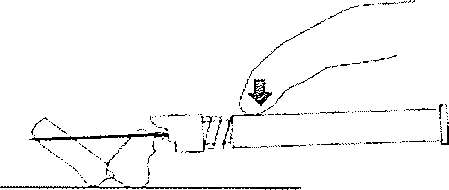
.......u
7. RUHSAT SAHİBİ
Johnson and Johnson Sıhhi Malzeme San. ve Tic. Ltd. Şti.,
Kavacıli Mahallesi Ertürk Sokak Keçeli Pbza No: 13 Kavacık, Beykoz-lstanbul Tel : O 216 538 20 00
Faks :0 2i6 538 23 69
8. RUHSAT NUMARASI
131/88
9.İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: İ 1.08.2011 Ruhsat yenileme tarihi:
10. KÜB'ÜN YENİLENME TARİHİ
|
|






